一种低温耐酸酿酒酵母菌及其筛选方法与应用与流程
1.本发明涉及餐厨垃圾处理技术领域,尤其是涉及一种低温耐酸酿酒酵母菌及其筛选方法与应用。
背景技术:
2.我国每年产生约13亿吨餐厨垃圾有机废弃物,且产量正在逐步增加。餐厨垃圾是城市生活垃圾的主要部分。其产生与堆积,严重污染环境,还造成食品安全问题。
3.目前,餐厨垃圾的处理方式主要包括填埋、焚烧、厌氧发酵、好氧堆肥等。填埋不仅占用大量土地,并且产生大量渗滤液污染土壤和地下水。餐厨垃圾含水率高达70%-90%,热值低,不适合焚烧;并且焚烧会产生大量有毒有害气体,污染空气。厌氧发酵运行成本高,分级处理多,产生的沼渣等需要进行二次处理,沼气产品纯度低等。而好氧堆肥不仅成本低,操作简单,污染小,并且能回收餐厨垃圾中的养分,成品可用作有机肥料、土壤改良剂、花卉基质等。
4.好氧堆肥过程中通过外源添加微生物菌剂可以提高堆肥效率。据报道,堆肥中的主要微生物一般为细菌。但一般细菌需要在ph大于6.0且温度在20℃以上才能正常生长,这对于北方地区以及严寒季节进行好氧堆肥都是不利的。堆肥过程中的微生物菌群在低温下几乎停止生长,难以分解餐厨垃圾中的有机物质,不能产生足够热量来启动堆肥过程,导致堆肥失败。此外,餐厨垃圾在堆放过程中容易酸化腐败,ph可以降低至5.0以下,影响细菌生长;加之,有些餐厨垃圾含油量很高,湿基含油率高达20%-30%,油脂易于包裹在物料表面,使微生物难以附着,并且形成厌氧区,导致进一步酸化等。nakasaki等(2013)的研究表明通过给添加不同种类有机酸的堆肥物料中接种毕赤酵母菌rb1,能够降解有机酸,将酸碱度提高到中性以上,从而刺激细菌生长与繁殖,实现有机物的剧烈降解,加速堆肥过程。choi和park(1998)的研究表明接种酵母菌可以作为堆肥失败的活化剂。所以,开发一种耐酸性强、能克服厌氧环境并使餐厨垃圾在低温条件下顺利启动好氧堆肥升温过程的菌种尤其重要;此外,餐厨垃圾异质性强,探究出菌种在不同条件的餐厨垃圾低温好氧堆肥过程中的应用效果更具现实指导性。
技术实现要素:
5.发明目的:为了克服背景技术的不足,本发明第一目的是公开一种低温耐酸酿酒酵母菌;第二目的是公开该酿酒酵母菌的筛选方法;第三目的是公开该酿酒酵母菌的在餐厨垃圾低温好氧堆肥上的应用。
6.技术方案:本发明公开了一种低温耐酸酿酒酵母菌,该酿酒酵母菌分类命名为saccharomyces cerevisiae,保藏于:中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为:cgmcc no.22786。
7.上述低温耐酸酿酒酵母菌的筛选方法,包括以下步骤:
8.s1、取冷藏发酵米酒酒糟,加去离子水,震荡混匀后离心取上层液体于酸性豆芽汁
培养基中,富集培养,每隔多天转接到新的酸性豆芽汁培养基中,连续转接多次得到富集菌液;
9.s2、吸取富集菌液进行10倍浓度梯度稀释,取稀释液涂布于ypd固体平板上,并连续将分离的单菌落转接于ypd固体平板上分离、纯化,培养,最后得到菌株dw。
10.其中,所述酸性豆芽汁培养基成分包括:黄豆芽200g/l,蔗糖30g/l,乳酸0.5%,去离子水定容,ph自然,115℃灭菌30min;
11.ypd固体培养基为:蛋白胨20g/l,葡萄糖20g/l,酵母提取物10g/l,琼脂20g/l,去离子水定容,ph自然,115℃灭菌30min。
12.上述低温耐酸酿酒酵母菌的应用,将酿酒酵母菌作为餐厨垃圾进行低温好氧堆肥的启动菌剂,在温度为6-13℃时效果尤为明显。
13.在6-8℃时,将酿酒酵母菌和枯草芽孢杆菌按照体积比1:1混合,应用于酸化餐厨垃圾低温好氧堆肥启动。
14.在10-13℃时,将酿酒酵母菌和枯草芽孢杆菌按照体积比1:2混合,应用于酸化-高油餐厨垃圾低温好氧堆肥启动。
15.所述餐厨垃圾为新鲜餐厨垃圾经过滤后自然放置1-3d形成的酸化物料以及外源添加2%大豆油形成的酸化-高油物料。
16.有益效果:与现有技术相比,本发明的优点为:
17.1、获得的酿酒酵母dw能在低温条件(4℃)下生长且耐酸性好;
18.2、将酿酒酵母菌dw与枯草芽孢杆菌在不同好氧堆肥条件下按比例添加时,相对于单一枯草芽孢杆菌的使用能使堆体迅速提高ph值,较早升温启动,较早进入高温期,并且延长高温期时间;
19.3、酿酒酵母菌dw及其复配菌剂能在低温条件下使餐厨垃圾好氧堆肥自发产热升温来带动其他土著微生物的活动,而不需要进行外源加热,从而节约成本;
20.4、该菌剂使用量少,只需要添加2%浓度为1
×
107cfu/ml的菌液就能达到明显效果;
21.5、该菌剂组成简单,酿酒酵母和枯草芽孢杆菌容易从环境获得,筛选成本低。
附图说明
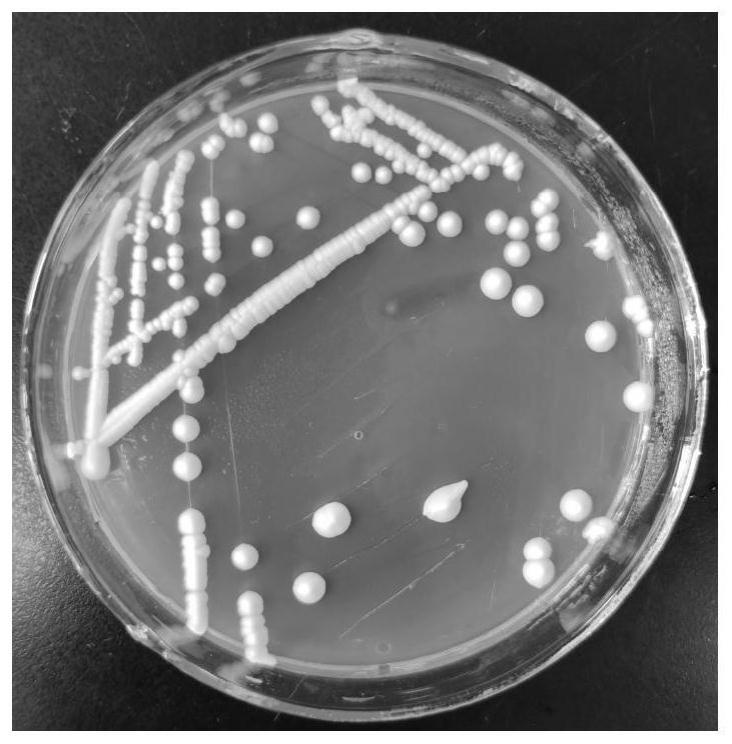
22.图1为本发明酿酒酵母菌dw菌落形态图;
23.图2为本发明酿酒酵母菌dw细胞形态图;
24.图3为本发明酿酒酵母菌dw系统发育树;
25.图4为本发明酿酒酵母菌dw低温测试;
26.图5为酸化餐厨垃圾低温好氧堆肥温度、ph、c/n比变化;
27.图6为酸化-高油餐厨垃圾低温好氧堆肥温度、ph、c/n比变化。
具体实施方式
28.下面结合附图和实施例对本发明的技术方案作进一步的说明。
29.培养基制备
30.酸性豆芽汁培养基:黄豆芽200g/l,蔗糖30g/l,乳酸0.5%,去离子水定容,ph自
然。115℃灭菌30min。
31.ypd固体培养基:蛋白胨20g/l,葡萄糖20g/l,酵母提取物10g/l,琼脂20g/l,去离子水定容,ph自然。115℃灭菌30min。
32.ypd液体培养基:蛋白胨20g/l,葡萄糖20g/l,酵母提取物10g/l,去离子水定容,ph自然。115℃灭菌30min。
33.lb液体培养基:蛋白胨10g/l,酵母粉5g/l,氯化钠10g/l,去离子水定容,ph自然。121℃灭菌20min。
34.lb固体培养基:蛋白胨10g/l,酵母粉5g/l,氯化钠10g/l,琼脂20g/l,去离子水定容,ph自然。121℃灭菌20min。
35.酿酒酵母菌的制备
36.该酿酒酵母菌分类命名为saccharomyces cerevisiae,保藏于:中国微生物菌种保藏管理委员会普通微生物中心,地址:北京市朝阳区北辰西路1号院3号中国科学院微生物研究所,保藏日期:2021年6月28日,保藏编号为:cgmcc no.22786。
37.采样与富集:样品采集于米酒酒糟,取回后立即冷藏备用。取冷藏发酵酒糟2g,加去离子水18ml,用涡旋振荡仪最高速震荡10min;于离心机上以6000rpm的速度离心10min。
38.吸取离心管中上清液1ml于50ml酸性豆芽汁培养基中,置于28℃摇床中培养,每三天后转接到另一新的酸性豆芽汁培养基中,连续转接三次后分离。
39.菌种分离:将最后转接的培养液采用稀释涂布平板法进行分离。按照10倍浓度梯度连续稀释成1
×
10-1
、1
×
10-2
、1
×
10-3
、1
×
10-4
、1
×
10-5
、1
×
10-6
、1
×
10-7
浓度液体。各取1
×
10-3
、1
×
10-5
、1
×
10-7
浓度液体100ul涂布于ypd平板上,于28℃生化培养箱培养2-3d。
40.菌种纯化:从培养好的ypd平板上挑选光滑、圆润、乳白色的单菌落,连续数次转接到新的ypd平板上进行划线分离,于28℃生化培养箱培养2-3d。其间紧密观察菌落形态以及用显微镜观察细胞形态是否一致,保证最后一次分离得到的是纯菌菌落。
41.菌种保藏:挑取纯化后的单菌落于ypd斜面培养基上,28℃培养2-3d,4℃冰箱保藏备用。
42.酿酒酵母菌的鉴定
43.菌落形态:用接种环挑取少量上述斜面保藏菌种,ypd平板上进行划线,于28℃生化培养箱培养2-3d。
44.如图1所示,其菌落呈圆形、表面及边缘光滑、乳白色、不透明,粘稠、易挑起。
45.如图2所示,菌体形态:显微镜下呈球形、卵圆形细胞等。
46.分子鉴定:
47.模板准备:用无菌枪头蘸取单菌落于10ul无菌ddh2o的1.5ml离心管中,吹吸混匀后作为dna模板。采用真菌鉴定试剂盒进行扩增。
48.扩增体系为(50ul):dna模板50~100ng,forward primer 0.5ul,reverse primer0.5ul,pcr premix 25ul,ddh2o补足至50ul。
49.反应程序为:预变性94℃5min,变性94℃1min,退火54℃1min,延伸72℃1min,30个循环,72℃5min,4℃保存。
50.将所得序列上传至ncbi后用blast进行检索比对,选出与该序列相似性较高的rdna序列,用mega7.0构建系统发育树,如图3所示,结果显示菌株dw与酿酒酵母
(saccharomyces cerevisiae)同源性最高,同属一支。
51.低温生长测试:将保藏的菌株dw菌挑一环接种至ypd液体培养基试管中,培养10h后测定od值,调整菌液初始浓度为107cfu/ml,依次稀释至1
×
107、1
×
106、1
×
105、1
×
104cfu/ml进行滴板实验,于4℃培养6d,记录2d、4d、6d时dw的生长情况。结果表明该菌株能在短时间内于4℃低温条件下进行生长(图4)。
52.酿酒酵母菌dw在酸化餐厨垃圾低温好氧堆肥中的应用
53.菌剂制备:
54.用接种环挑取少量斜面保藏的菌株dw于装有5ml ypd液体培养基的试管中,28℃、180rpm培养10-12h,获得种子液;将500ul种子液接种于500ml ypd液体培养基中,置于摇床中28℃、180rpm扩大培养10-12h,获得发酵液。对照组使用菌株为枯草芽孢杆菌,由浙江工业大学生物工程学院提供。同理,用接种环挑取少量斜面保藏的枯草芽孢杆菌于装有5ml lb液体培养基的试管中,37℃、180rpm培养14-16h,获得种子液;将500ul种子液接种于500ml lb液体培养基中,置于摇床中37℃、180rpm扩大培养14-16h,获得发酵液。分别培养后将发酵液8000
×
g离心10min收集菌体,将得到的菌体用无菌水进行洗涤、重悬。菌体重悬后分别吸取1ml进行10倍梯度稀释,用血球计数板进行计数,根据计数结果将菌液分别稀释至1
×
107cfu/ml。
55.餐厨垃圾预处理:
56.餐厨垃圾均来自中国农业大学有机循环研究院(苏州)员工食堂。将收集到的餐厨垃圾过滤除水,挑除蛋壳、骨头、纸巾等,并将餐厨垃圾存放1-3天,自然酸化至ph为5.0左右。最后用粉碎机进行破碎,使物料长度在1cm左右。
57.酸化餐厨垃圾进行好氧堆肥的室温为6-8℃。实验共设计5个处理(t1 v
酿酒酵母
:v
枯草芽孢杆菌
=1:0,t2 v
酿酒酵母
:v
枯草芽孢杆菌
=0:1,t3 v
酿酒酵母
:v
枯草芽孢杆菌
=1:1,t4 v
酿酒酵母
:v
枯草芽孢杆菌
=2:1,t5 v
酿酒酵母
:v
枯草芽孢杆菌
=1:2),每一处理三个重复,每一重复为2kg,其中餐厨垃圾与锯末的比例为4:1,初始水分在60%、c/n比在30左右,菌剂接种量为2%。
58.堆肥过程中,每天定时记录温度;翻堆频率设置为1天2次,每次2min;取样时间2天1次。鲜样用ph计测定ph值,风干样用元素分析仪测定c/n比。
59.分别将测定结果与对照组进行比较。
60.如图5所示,结果表明:
61.(1)在前96h内,加入酿酒酵母dw的处理(t1、t3、t4、t5)相比只加入枯草芽孢杆菌的处理(t2)首先进行升温启动,温度提高5-10℃。
62.(2)在120-216h内,最早进入50℃高温期的为t3、t4,相较于t2提前72h;其次为t5、t1,相较于t2提前42h。
63.(3)添加酿酒酵母的处理50℃以上高温期维持时间都大于1.0d,而t2只维持了0.95d。
64.(4)在120h内,添加酿酒酵母的处理ph值迅速升高至5.3-6.25,而t2的ph值变化最慢,为4.7。
65.(5)在120-192h内,添加酿酒酵母的处理ph值迅速升至8.5左右,而t2的ph值为7.1左右。
66.(6)温度变化和ph值变化表明添加酿酒酵母dw的处理均比只添加单一枯草芽孢杆
菌组成的菌剂在酸化餐厨垃圾低温好氧堆肥过程中启动效更好,并且酿酒酵母dw对酸化餐厨垃圾低温好氧堆肥具有明显促进作用。
67.(7)在酸化厨余垃圾低温好氧堆肥过程中菌剂组成按v
酿酒酵母
:v
枯草芽孢
=1:1时,效果最好。
68.酿酒酵母菌dw在酸化-高油餐厨垃圾低温好氧堆肥中的应用
69.菌剂制备:同上。
70.餐厨垃圾预处理:同上,并且每一重复外源添加2%的食用大豆油混合均匀。
71.酸化-高油餐厨垃圾进行好氧堆肥的室温为10-13℃,实验共设计5个处理(各处理同上),每一处理三个重复,每一重复为2kg,其中餐厨垃圾与锯末的比例为4:1,初始水分在63%、c/n比在28左右,菌剂接种量为2%。
72.堆肥过程中,每天定时记录温度;翻堆频率设置为1天2次,每次2min;取样时间2天1次。鲜样用ph计测定ph值,风干样用元素分析仪测定c/n比。
73.分别将测定结果与对照组进行比较。
74.如图6所示,结果表明:
75.(1)在前72h内,加入酿酒酵母dw的处理(t1、t3、t4、t5)相比只加入枯草芽孢杆菌的处理(t2)首先进行升温启动,温度提高4-14℃。
76.(2)在前72h内,添加酿酒酵母的的处理首先升温,达到30-41℃;而t2温度变化最慢,为27℃左右。
77.(3)在72-192h内,添加酿酒酵母的处理最早进入45℃高温期,相较于t2提前38-56h。
78.(4)在48h内,添加酿酒酵母的处理ph值迅速升高至5.5;而t2的ph值为4.7。
79.(5)在48-192h内,添加酿酒酵母的处理ph值较t2提前48h升至7.2左右。
80.(6)温度变化和ph值变表明添加酿酒酵母dw的处理比只添加单一枯草芽孢杆菌组成的菌剂在酸化-高油餐厨垃圾低温好氧堆肥过程中启动效果更好,并且酿酒酵母dw在酸化-高油餐厨垃圾低温好氧堆肥过程中具有显著促进作用。
81.(7)在酸化-高油厨余垃圾低温好氧堆肥过程中菌剂组成按v
酿酒酵母
:v
枯草芽孢
=1:2时,效果最好。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1