一种具有D-π-A结构的有机化合物及其合成方法、应用
一种具有d-π-a结构的有机化合物及其合成方法、应用
技术领域
1.本发明涉及一种具有d-π-a结构的有机化合物及其合成方法、应用,属于有机合成技术领域。
背景技术:
2.随着光学研究的快速发展,现阶段对通信信息材料的要求越来越高,非线性光学材料在光波频率转化和光信号处理方面有着巨大的应用前景,具有优异非线性光学性能的材料一直是研究的热点。无机非线性材料是现阶段非线性光学器件的主要应用材料,但其自身光电系数小、响应时间长等缺点限制了无机非线性光学材料的广泛应用。与无机非线性光学材料相比,有机非线性材料具有非线性光学系数高、响应快速、光学损伤阈值高等优点,逐渐成为研究的热点。有机非线性光学材料的非线性性能不仅与自身发色团的非线性光学特性有关,还与其发色团的结构有关。具有d-π-a结构的发色团电子高度离域,具有较大的非线性光学系数,共轭分子中的电荷转移性质大大加强了非线性光学性能。并且对发色团结构中的电子给体和受体的强度进行调控,可以有效优化发色团的非线性光学性能。但现有技术中的有机非线性化合物,具有高非线性光学性能的不多,并且大多数非线性有机化合物由于结构复杂,导致合成步骤繁琐,限制了有机光学材料在光学器件上的应用。
技术实现要素:
3.本发明的目的在于提供一种高非线性光学性能的具有d-π-a结构的有机化合物。
4.本发明的第二个目的在于提供一种步骤简单的上述化合物的合成方法。
5.本发明的第三个目的在于提供一种上述化合物作为光限幅材料的应用。
6.为了实现上述目的,本发明所采用的技术方案为:一种具有d-π-a结构的有机化合物,其结构通式如式a所示:
[0007][0008]
式a中,r1为取代或未取代的亚芳基、取代或未取代的亚芳杂基中的一种;取代的亚芳基为c1~c
10
烷基或c1~c
10
烷氧基取代的亚芳基;取代的亚芳杂基为c1~c
10
烷基或c1~c
10
烷氧基取代的亚芳杂基;r2和r3中的一个为氢原子,另一个为式b所示的取代基,或r2、r3均为式b所示的取代基;
[0009]
式b中,r4和r5独立选自c1~c
10
烷基、c1~c
10
烷氧基或c1~c6羟烷基;r6、r7、r8和r9独立选自氢原子、羟基或c1~c5烷基。
[0010]
本发明的具有d-π-a结构的有机化合物,所用的电子给体、共轭桥、电子受体组合
后,分子内电子的运输能力大大加强;与传统发色团相比,电子受体选用了芘基并在芘基上引入乙炔基,通过延展平面共轭结构可以有效地提高化合物的非线性光学系数;此外,具有d-π-a结构的有机化合物中含有多个苯环,以及炔键,因此该化合物整体的热稳定性较好,根据相似相溶原理,该化合物末端基为乙基,在大多数有机溶剂(二氯甲烷、乙酸乙酯)中具有良好的溶解性,因此本发明的具有d-π-a结构的有机化合物在大多数有机溶剂(二氯甲烷、乙酸乙酯)中具有良好的溶解性以及较高的热稳定性。
[0011]
当r2、r3均为式b所示的取代基时,r2、r3可以相同,也可以不相同。
[0012]
进一步地,所述亚芳基为亚苯基或亚联苯基。所述亚芳杂基的杂原子为氧原子或硫原子。
[0013]
式a中,r1为未取代的亚芳基或未取代的亚芳杂基,所述未取代的亚芳基为所述未取代的亚芳杂基为式b中,所述r4和r5为乙基;式b中,r8为羟基,r6、r7、r9为氢原子或r6、r7、r8、r9均为氢原子。
[0014]
本发明的具有d-π-a结构的有机化合物的合成方法所采用的技术方案为:
[0015]
一种上述的具有d-π-a结构的有机化合物的合成方法,包括以下步骤:将式c所示的含胺基的芘类衍生物和式d所示的化合物进行席夫碱反应,即得;
[0016][0017]
本发明的具有d-π-a结构的有机化合物的合成方法,步骤简单,产率较高。
[0018]
进一步地,式c中,r1为取代或未取代的亚芳基、取代或未取代的亚芳杂基中的一种;r2和r3独立选自氢原子或式b所示的取代基,且r2和r3中的一个或两个为式b所示的取代基,
[0019][0020]
式b中,r4和r5独立选自c1~c
10
烷基、c1~c
10
烷氧基或c1~c6羟烷基;r6、r7、r8和r9独立选自氢原子、羟基或c1~c5烷基。
[0021]
进一步地,所述亚芳基为亚苯基或亚联苯基。所述亚芳杂基中的杂原子为氧原子或硫原子。
[0022]
进一步地,所述式c中,r1为未取代的亚芳基或未取代的亚芳杂基,所述未取代的
亚芳基为所述未取代的亚芳杂基为式b中,所述r4和r5为乙基。
[0023]
进一步地,式c所示的含胺基的芘类衍生物、式d所示的化合物的摩尔比为1:(1.1~1.3)。
[0024]
为了提高反应产率,所述席夫碱反应的温度为80~90℃。席夫碱反应的时间为12~24h。席夫碱反应所采用的溶剂为该反应常用的溶剂。优选地,溶剂为四氢呋喃。席夫碱反应所采用的催化剂是该反应常用的催化剂。优选地,催化剂为乙酸。
[0025]
进一步地,式c所示的含胺基的芘类衍生物、式d所示的化合物、乙酸的摩尔比为1:(1.1~1.3):(4.5~4.7)。
[0026]
进一步地,具有d-π-a结构的有机化合物的制备方法,还包括以下步骤:所述席夫碱反应结束后,将席夫碱反应后的体系进行冷却、蒸馏、柱色谱分离。进一步地,具有d-π-a结构的有机化合物的制备方法中,所述萃取采用的有机溶剂为二氯甲烷。所述席夫碱反应蒸馏采用的容器是旋转蒸发器。所述柱色谱分离所用的流动相由体积比为10:1的石油醚与乙酸乙酯组成。
[0027]
进一步地,所述式c所示的含胺基的芘类衍生物的合成方法包括以下步骤:将1-卤芘与式e所示的化合物进行薗头偶联反应,即得;
[0028][0029]
式e中,r1为取代或未取代的亚芳基、取代或未取代的亚芳杂基中的一种;取代的亚芳基为c1~c
10
烷基或c1~c
10
烷氧基取代的亚芳基;取代的亚芳杂基为c1~c
10
烷基或c1~c
10
烷氧基取代的亚芳杂基。进一步地,所述1-卤芘为1-溴芘。
[0030]
进一步地,1-卤芘、式e所示的化合物的摩尔比为1:(1~1.2)。
[0031]
薗头偶联反应所采用的溶剂是该反应常用的溶剂。优选地,薗头偶联反应的溶剂由四氢呋喃和三乙胺组成。进一步地,四氢呋喃和三乙胺的体积比为1:1。
[0032]
薗头偶联反应所采用的催化剂是该反应常用的催化剂。优选地,薗头偶联反应的催化剂由四(三苯基膦)钯和碘化铜组成。进一步地,四(三苯基膦)钯、碘化铜的摩尔比为1:(1~1.2)。
[0033]
进一步地,1-卤芘、式e所示的化合物、四(三苯基膦)钯、碘化铜的摩尔比为20:(20~24):1:(1~1.2)。
[0034]
为了提高反应产率,所述薗头偶联反应(sonogashira反应)的温度为80~90℃。薗头偶联反应的时间为12~24h。
[0035]
进一步地,式c所示的化合物的制备方法,还包括以下步骤:薗头偶联反应结束后,将薗头偶联反应后的体系进行萃取,将萃取得到的有机相进行蒸馏、柱色谱分离。进一步地,式c所示的化合物的制备方法中,所述萃取包括以下步骤:向反应后的体系中加入二氯甲烷、水,萃取分层。所述薗头偶联反应的蒸馏为减压蒸馏。所述柱色谱分离所用的流动相
由体积比为10:1的石油醚与乙酸乙酯组成,柱色谱分离所用的固定相为硅胶。
[0036]
本发明的具有d-π-a结构的有机化合物的应用所采用的技术方案为:
[0037]
一种上述具有d-π-a结构的有机化合物作为光限幅材料的应用。
[0038]
本发明的具有d-π-a结构的有机化合物,具有较高的非线性吸收系数,在光限幅材料领域发挥着重要的作用。
附图说明
[0039]
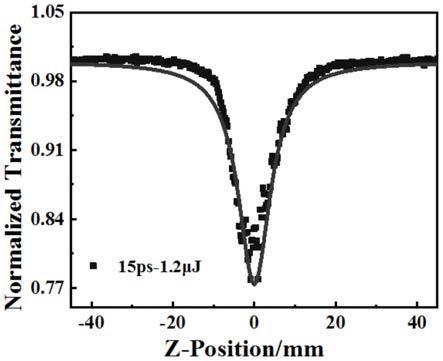
图1为用z-scan测试测得的实施例1中的化合物1的非线性吸收图;
[0040]
图2为本发明实施例1中的化合物1的输入能流与透光率的关系图;
[0041]
图3为本发明实施例1中的化合物1的前线分子轨道分布;
[0042]
图4为用z-scan测试测得的实施例2中的化合物2的非线性吸收图;
[0043]
图5为本发明实施例2中的化合物2的输入能流与透光率的关系图;
[0044]
图6为本发明实施例2中的化合物2的前线分子轨道分布;
[0045]
图7为用z-scan测试测得的实施例3中的化合物3的非线性吸收图;
[0046]
图8为本发明实施例3中的化合物3的输入能流与透光率的关系图;
[0047]
图9为本发明实施例3中的化合物3的前线分子轨道分布。
具体实施方式
[0048]
以下结合实施例对本发明做进一步地说明。以下实施例中,各原料均为市售商品。
[0049]
一、具有d-π-a结构的有机化合物的实施例
[0050]
实施例1
[0051]
本实施例的具有d-π-a结构的有机化合物(化合物1),具有如下结构:
[0052][0053]
实施例2
[0054]
本实施例的具有d-π-a结构的有机化合物(化合物2),具有如下结构:
[0055][0056]
实施例3
[0057]
本实施例的具有d-π-a结构的有机化合物(化合物3),具有如下结构:
[0058][0059]
二、具有d-π-a结构的有机化合物的合成方法的实施例
[0060]
实施例4
[0061]
本实施例的具有d-π-a结构的有机化合物的合成方法,为实施例1中的具有d-π-a结构的有机化合物的合成方法,包括以下步骤:
[0062]
1)在氮气保护条件下,将1-溴芘(2.24g,8mmol)和4-乙炔基苯胺(0.94g,8mmol)溶于除水除氧的四氢呋喃(thf,15ml)和三乙胺(et3n,15ml)的混合液中,加入催化剂四(三苯基膦)钯(462mg,0.4mmol)和碘化铜(76mg,0.4mmol),然后进行薗头偶联反应,控制反应温度为80℃,反应时间为24h;待反应完成后,用二氯甲烷稀释薗头偶联反应后体系,并用水萃取,得到有机相,再用无水硫酸镁对有机相进行干燥,减压蒸馏除去溶剂后将所得粗产品进行柱色谱分离,其中,柱色谱分离采用的流动相由体积比为10:1的石油醚与乙酸乙酯组成,固定相为硅胶粉,得到黄绿色固体中间体a-1(1.79g,70%)。
[0063]
2)将中间体a-1(600mg,1.89mmol)和4-二乙氨基苯甲醛(402mg,2.27mmol)分别溶解在干燥的thf(15ml)中,待完全溶解后,将二者混合,加入催化剂乙酸(hoac,0.5ml,8.75mmol),然后进行席夫碱反应,控制反应温度为90℃,反应时间为12h;待反应完成后,将溶液冷却至室温,用无水硫酸镁干燥,通过旋转蒸发器除去溶剂后将所得粗产品进行柱色谱分离,柱色谱分离采用的流动相由体积比为10:1的石油醚与乙酸乙酯组成,得到具有d-π-a结构的有机化合物1(0.66g,73%)。
[0064]
利用核磁共振氢谱、核磁共振碳谱分别对上述化合物1进行分析测定,测试结果如
下:
[0065]1h nmr(300mhz,氘代氯仿)δ(ppm)8.69(dd,j=9.2,4.3hz,1h),8.42(s,0h),8.29-8.17(m,2h),8.21-8.12(m,1h),8.12-7.96(m,2h),7.74(d,j=8.1hz,1h),7.69(s,0h),7.25(dd,j=36.1,8.5hz,1h),6.33-6.18(m,1h),3.42(p,j=6.9hz,2h),1.22(q,j=6.8hz,3h).
13
c nmr(75mhz,氘代氯仿)δ(ppm)190.03,152.24,132.62,132.32,131.30,131.13,131.01,129.55,128.27,128.06,127.30,124.57,121.32,111.05,110.55,77.50,77.08,76.65,44.65,44.55,29.71,12.59,12.46。
[0066]
本实施例涉及的路线如下:
[0067][0068]
实施例5
[0069]
本实施例的具有d-π-a结构的有机化合物的合成方法,为实施例2中的具有d-π-a结构的有机化合物的合成方法,包括以下步骤:
[0070]
1)在氮气保护条件下,将1-溴芘(2.24g,8mmol)和4-乙炔基苯胺(1.03g,8.8mmol)溶于除水除氧的四氢呋喃(thf,15ml)和三乙胺(et3n,15ml)的混合液中,加入催化剂四(三苯基膦)钯(462mg,0.4mmol)和碘化铜(84mg,0.44mmol),然后进行薗头偶联反应,控制反应温度为85℃,反应时间为18h;待反应完成后,用二氯甲烷稀释薗头偶联反应后体系,并用水萃取,得到有机相,再用无水硫酸镁对有机相进行干燥,减压蒸馏除去溶剂后将所得粗产品进行柱色谱分离,其中,柱色谱分离采用的流动相由体积比为10:1的石油醚与乙酸乙酯组成,固定相为硅胶粉,得到黄绿色固体中间体a-1(1.84g,72%)。
[0071]
2)将中间体a-1(600mg,1.89mmol)和4-(二乙氨基)水杨醛(437mg,2.27mmol)分别溶解在干燥的thf(15ml)中,待完全溶解后,将二者混合,加入催化剂乙酸(hoac,0.5ml,8.75mmol),然后进行席夫碱反应,控制反应温度为85℃,反应时间为18h;待反应完成后,将席夫碱反应后的体系冷却至室温,用无水硫酸镁干燥,通过旋转蒸发器除去溶剂后将所得粗产品进行柱色谱分离,柱色谱分离采用的流动相由体积比为10:1的石油醚与乙酸乙酯组成,得到具有d-π-a结构的有机化合物2(0.7g,75%)。
[0072]
利用核磁共振氢谱、核磁共振碳谱分别对上述化合物2进行分析测定,测试结果如下:
[0073]1h nmr(300mhz,氘代氯仿)δ(ppm)8.70(t,j=8.4hz,1h),8.37(s,1h),8.29-8.10
(m,4h),8.12-7.97(m,3h),7.76(dt,j=14.8,8.0hz,3h),7.57(dd,j=12.1,8.3hz,1h),7.28(d,j=5.5hz,2h),6.70(dd,j=14.5,8.4hz,2h),3.51-3.27(m,3h),1.30-1.11(m,6h).
13
c nmr(75mhz,氘代氯仿)δ(ppm)132.78,129.58,128.12,126.25,125.62,124.58,121.04,104.01,44.65,29.70,22.70,12.73。
[0074]
本实施例涉及的路线如下:
[0075][0076]
实施例6
[0077]
本实施例的具有d-π-a结构的有机化合物的合成方法,为实施例3中的具有d-π-a结构的有机化合物的合成方法,包括以下步骤:
[0078]
1)在氮气保护条件下,将1-溴芘(2.24g,8mmol)和4-乙炔基苯胺(1.12g,9.6mmol)溶于除水除氧的四氢呋喃(thf,15ml)和三乙胺(et3n,15ml)的混合液中,加入催化剂四(三苯基膦)钯(462mg,0.4mmol)和碘化铜(91mg,0.48mmol),然后进行薗头偶联反应,控制反应温度为90℃,反应时间为12h;待反应完成后,用二氯甲烷稀释薗头偶联反应后体系,并用水萃取,得到有机相,再用无水硫酸镁对有机相进行干燥,减压蒸馏除去溶剂后将所得粗产品进行柱色谱分离,其中,柱色谱分离采用的流动相由体积比为10:1的石油醚与乙酸乙酯组成,固定相为硅胶粉,得到黄绿色固体中间体a-1(1.89g,74%);
[0079]
2)将中间体a-1(600mg,1.89mmol)和四乙基米氏酮(735mg,2.27mmol)分别溶解在干燥的thf(15ml)中,待完全溶解后,将二者混合,加入催化剂乙酸(hoac,0.5ml,8.75mmol),然后进行席夫碱反应,控制反应温度为80℃,反应时间为24h;待反应完成后,将席夫碱反应后的体系冷却至室温,用无水硫酸镁干燥,通过旋转蒸发器除去溶剂后将所得粗产品进行柱色谱分离,柱色谱分离采用的流动相由体积比为10:1的石油醚与乙酸乙酯组成,得到具有d-π-a结构的有机化合物3(0.83g,70%)。
[0080]
利用核磁共振氢谱、核磁共振碳谱分别对上述化合物3进行分析测定,测试结果如下:
[0081]1h nmr(300mhz,氘代氯仿)δ(ppm)8.69(d,j=9.1hz,2h),8.26-7.97(m,20h),7.81(d,j=9.0hz,8h),7.60-7.51(m,5h),6.77-6.64(m,13h),3.42(q,j=7.1hz,16h),1.22(t,j=7.0hz,25h);
13
c nmr(75mhz,氘代氯仿)δ(ppm)193.63,150.31,147.00,133.10,132.56,131.59,131.34,131.18,130.80,129.36,128.06,127.81,127.31,126.18,125.76,
125.59,125.43,125.39,124.57,124.43,118.71,114.89,112.75,110.04,96.21,86.64,44.49,12.58。
[0082]
本实施例涉及的路线如下:
[0083][0084]
三、本发明的具有d-π-a结构的有机化合物作为光限幅材料的应用的实施例
[0085]
实施例7
[0086]
将实施例4制备的具有d-π-a结构的有机化合物作为光限幅材料的应用。
[0087]
四、实验例
[0088]
实验例1
[0089]
分别将实施例1~3的化合物(化合物1、化合物2和化合物3)溶于纯的n,n-二甲基甲酰胺溶剂中,浓度均为1mg/ml,对其做z-扫描测试,z-扫描的参数如下:激光入射波长为532nm,激光脉冲宽度为15ps,频率为10hz,焦距为0.4m,焦点光斑半径为15
×
10-6
m。测试结果如图1、图4、图7(图中的散点为测试数据,实线为拟合数据),由高斯软件拟合得到化合物1、化合物2和化合物3的非线性吸收系数分别为0.7
×
10-11
m/w,0.92
×
10-11
m/w,1.15
×
10-11
m/w。由图可知,芘基作为受体的d-π-a型非线性有机化合物在超短脉冲激光下,都具有不错的非线性吸收性能,因此该有机化合物在非线性光学领域将有良好的应用前景。本发明的具有d-π-a结构的有机化合物的合成方法以及在z-扫描的测试结果表明,通过简单的合成步骤来构建具有高非线性吸收系数的具有d-π-a结构的有机化合物是可行的。
[0090]
然后改变输入能流,分别测试化合物1、化合物2和化合物3的透光率与输入能流之间的关系,结果如图2、图5和图8所示,可以看到,在脉冲宽度为15ps的激光源下,随着输入能流的加大,化合物1、化合物2和化合物3的透过率呈非线性的下降,且当透过率下降20%时,化合物1对应的输入能流为0.062j/cm2,化合物2对应的输入能流为0.055j/cm2,化合物3对应的输入能流为0.040j/cm2。图2、图5和图8表明实施例1~3合成的具有d-π-a结构的有机化合物都具有一定的光限幅能力。
[0091]
实验例2
[0092]
分别对实施例1~3的化合物(化合物1、化合物2和化合物3)进行量子化学轨道计算,采用密度泛函数理论(dft),在b3lyp/6-31g(d)理论水平上对化合物1、化合物2和化合物3的量子化学轨道(homo和lumo)进行了模拟计算,得到该化合物的前线分子轨道分布(3d球棍模型、homo能级图和lumo能级图),测试结果如图3、图6、图9。由图3、图6、图9可知,化合物1、化合物2和化合物3的分子间存在明显的电荷转移,并且芘基部分存在明显的π-π*跃迁,从homo轨道跃迁到lumo轨道,整体分子间的电子是向芘基转移的。也就是说,π-π*跃迁和电荷转移共同赋予了化合物1、化合物2和化合物3的非线性光学性能。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1