一种工程化外泌体原位纳米疫苗及其制备方法和应用
1.本发明属于肿瘤免疫治疗药物技术领域,具体涉及一种工程化外泌体原位纳米疫苗及其制备方法和应用。
背景技术:
2.作为最有效的抗原呈递细胞,树突状细胞(dcs)是启动和调节肿瘤微环境中先天免疫和适应性免疫的核心。因此,已经开发出多种靶向dcs的疫苗以改善癌症免疫治疗,并进行了多项临床试验,但仍难以在临床上推广。目前研究较为广泛的一种dcs疫苗,是由抗原和佐剂组成的dcs纳米疫苗,该疫苗在体内多个位点直接激活和动员天然dcs亚群,是增强dcs抗肿瘤作用的重要方法。然而,由于佐剂缺乏靶向性,易诱导全身免疫系统的非特异性激活,引发局部或全身的炎症反应,存在难以避免的潜在免疫毒性副作用。此外,该策略的另一个主要挑战是识别最佳免疫优势肿瘤抗原,以引发有效的肿瘤特异性免疫反应。解决上述问题将有助于dcs疫苗在临床上的推广应用。
3.免疫原性细胞死亡(icd)可增强肿瘤抗原暴露,并促进肿瘤细胞内免疫刺激性容物的释放,已有研究将全肿瘤细胞icd裂解液用于自体dc疫苗的研发。在体内诱导肿瘤细胞icd将为dcs疫苗提供广泛的抗原库,而避免鉴定免疫优势抗原。cdc1s能有效处理和交叉呈递肿瘤相关性外源性抗原,进而激活cd8
+
t细胞并反应,然而,在肿瘤微环境中dcs通常不成熟,导致呈递肿瘤抗原的效率较低,因此,有必要将能有效激活体内cdc1s的免疫佐剂tlr3激动剂递送至肿瘤微环境中,以此改善肿瘤微环境中cd8
+
t细胞的募集、浸润和功能。因此,将icd诱导剂和tlr3激动剂靶向递送到肿瘤组织将是原位激活肿瘤浸润cdc1s的理想方式。
4.近年来,外泌体由于其低细胞毒性、最大限度地提高药物生物利用度的能力以及易于进行生物工程改造的特性,是一种天然的药物递送载体,利用外泌体开发的药物已有多项临床试验,进一步证明了其临床转化价值。因此,肿瘤来源的外泌体(texs)可以作为无细胞治疗载体,将icd诱导剂和tlr3激动剂共递送到肿瘤微环境中,以原位激活cdc1s。
5.三阴性乳腺癌(tnbc)是一种特定的乳腺癌亚型,其不表达雌激素受体(er)、孕激素受体(pr)和人表皮生长因子受体2(her2),约占所有乳腺癌的15%。由于其特殊的分子表型,tnbc对激素治疗或分子靶向治疗不敏感,且常规术后辅助放化疗疗效较差。tnbc转移后的中位生存时间13.3个月,术后复发率高达25%,迫切需要开发新的tnbc治疗策略。cdc1s浸润与tnbc良好预后之间存在很强的相关性,因此,上述原位激活cdc1s的治疗策略有望改善tnbc的治疗困境。为了提高上述肿瘤外泌体对tnbc的靶向性,有必要对外泌体进行工程化改造。α-乳清蛋白(α-la)是一种在大多数人类乳腺癌中表达的乳腺特异性免疫优势抗原,在外泌体表面富集α-la,有助于增强外泌体靶向能力和免疫原性。鉴于此,本发明设计了载有icd诱导剂elane和tlr3激动剂hiltonol的α-la工程化外泌体原位纳米疫苗,用于治疗改善乳腺癌的免疫治疗。
技术实现要素:
6.发明目的:基于此,本发明所要解决的技术问题是提供了一种工程化外泌体原位纳米疫苗及其制备方法和应用。
7.为实现上述目的,本发明采用如下技术方案包括如下几个方面:
8.作为本发明的第一个方面,本发明提供了过表达α-la的重组载体,所述重组载体是将α-la基因克隆到慢病毒表达载体中得到。
9.作为本发明的另一个方面,本发明提供了过表达α-la的细胞系,所述过表达α-la的细胞系是包括将所述的慢病毒表达载体转染乳腺癌细胞得到。
10.其中,所述乳腺癌细胞包括但不仅限于三阴性乳腺癌细胞mda-mb-231细胞,其他乳腺癌细胞也包含在内,只要该乳腺癌细胞能够表达上述α-乳清蛋白或者是能够分泌上述α-乳清蛋白外泌体的癌症细胞均在本发明的保护范围之内。
11.作为本发明的另一个方面,本发明提供了一种外泌体,所述外泌体是从权利要求2或3所述的细胞系中提取得到。
12.作为本发明的另一个方面,本发明提供了一种工程化外泌体原位纳米疫苗,所述工程化外泌体原位纳米疫苗包括所述的外泌体。
13.作为本发明的另一个方面,本发明提供了所述的工程化外泌体原位纳米疫苗的制备方法,包括以下步骤:
14.1)将所述的过表达α-la的重组载体转染乳腺癌细胞,制备得到表达α-乳清蛋白的稳定细胞系;
15.2)从细胞培养上清中提取得到富集α-乳清蛋白的外泌体;
16.3)通过电穿孔仪把免疫原性细胞死亡诱导剂elane和tlr3激动剂hiltonol电转到所获得外泌体中,得到工程化外泌体原位纳米疫苗。
17.需要说明的是,本发明通过基因工程手段改造外泌体精准递送elane和hiltonol到达肿瘤细胞,通过引发肿瘤细胞免疫原性细胞死亡,原位激活1型常规树突状细胞,诱发强烈的cd8
+
t细胞反应,有效抑制肿瘤生长。
18.作为本发明的另一个方面,本发明提供了所述的过表达α-la的重组载体、所述的过表达α-la的细胞系、所述的外泌体或所述工程化外泌体原位纳米疫苗在制备治疗乳腺癌或乳腺癌免疫治疗药物中的应用。
19.作为本发明的另一个方面,本发明提供了一种治疗乳腺癌的药物,所述药物含有如所述的外泌体或所述的疫苗。
20.其中,所述乳腺癌包括但不仅限于三阴性乳腺癌,应当说明的是,本发明的药物还可以治疗其他乳腺癌,只要该乳腺癌细胞能够表达上述α-乳清蛋白或者是能够分泌上述α-乳清蛋白外泌体的癌症。
21.本发明通过实验进一步说明,所述工程化外泌体原位纳米疫苗在免疫活性小鼠体内和肿瘤患者来源类器官中有效抑制肿瘤生长,所述工程化外泌体原位纳米疫苗在体内外的免疫激活效果强于游离免疫佐剂hiltonol,而且所述工程化外泌体原位纳米疫苗在体内未引起与游离免疫佐剂hiltonol类似的全身炎症反应,本发明的肿瘤抑制效应的机制包括但不限于工程化外泌体原位纳米疫苗靶向诱导肿瘤细胞发生免疫原性细胞死亡,进一步地,本发明的肿瘤抑制效应的机制包括但不限于工程化外泌体原位纳米疫苗原位激活1型
常规树突状细胞,进而活化肿瘤特异性cd8
+
t细胞,进一步诱导强烈的肿瘤杀伤。
22.有益效果:与现有技术相比,本发明具有以下优点:本发明成功通过基因工程手段在乳腺癌细胞来源的外泌体表面富集α-乳清蛋白,使得改造后的外泌体特异性靶向乳腺癌细胞。利用这种工程化的乳腺癌来源外泌体,我们有效的将elane和hiltonol递送至肿瘤细胞,通过引发肿瘤细胞免疫原性细胞死亡,原位激活1型常规树突状细胞,诱发强烈的cd8
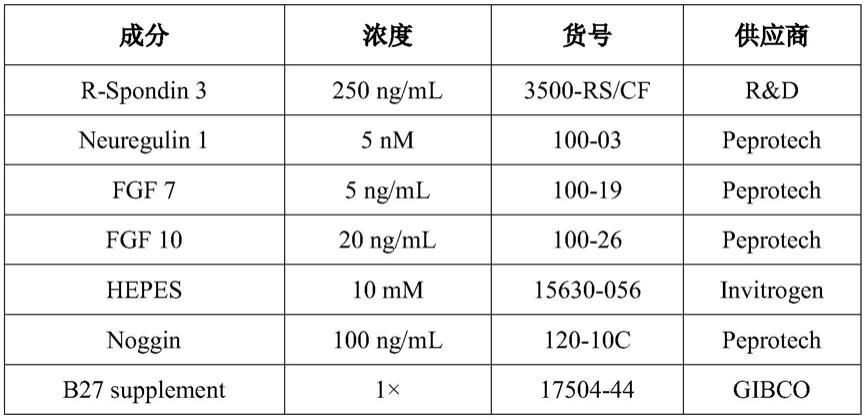
+
t细胞反应,从而有效抑制肿瘤生长。
附图说明
23.图1、稳定过表达α-la的mda-mb-231细胞系鉴定;
24.图2、纳米疫苗hela-exos的分析与鉴定;
25.图3、纳米疫苗hela-exos的靶向性分析与体外细胞杀伤特异性鉴定;
26.图4、纳米疫苗hela-exos体外免疫激活能力检测;
27.图5、纳米疫苗hela-exos的体内抗癌效应检评价;
28.图6、纳米疫苗hela-exos的体内安全性评价;
29.图7、纳米疫苗hela-exos的体内免疫激活能力评价;
30.图8、纳米疫苗hela-exos在患者来源类器官中免疫激活能力及抗癌效应评价。
具体实施方式
31.以下实施例是为了对本发明作进一步详细说明,并非对发明的限制。本发明的实验方法均参照《精编分子生物学实验指南》(f.m.奥斯伯等主编,科学出版社2005年出版)所建议的实验条件。
32.以下为实施例中所使用特殊培养基组分:
33.1、t细胞培养基:
34.成分浓度货号供应商ultraglutamine i2mmbe17-605e/u1lonzapenicillin/streptomycin100μg/ml15140-122invitrogenmale human ab serum10%1810-0001seracarerpmi 1640基础培养基1
×
sh30027.fshyclone
35.2、人乳腺癌类器官培养基
[0036][0037][0038]
实施例l:包裹elane和hiltonol的α-la工程化外泌体原位纳米疫苗的制备
[0039]
包裹elane和hiltonol的α-la工程化外泌体原位纳米疫苗的制备方法,该方法包括如下步骤:
[0040]
1、构建稳定过表达α-la的mda-mb-231细胞系
[0041]
从mda-mb-231细胞(本实验室保藏)的总rna中克隆人α-la全长编码序列(accession:cr542017),并将其克隆到慢病毒表达载体pcdh-cmv-puro(jhepatol.2017oct;67(4):739-748.)(本实验室保藏)中。将人293t细胞接种在6cm皿中培养24h,然后通过dna转染试剂以2:1:1的比例与pcdh-cmv-puro-α-la、pmd2.g(j gene med.2018jul;20(7-8):e3027.)(本实验室保藏)和pspax2(jgene med.2018jul;20(7-8):e3027.)(本实验室保藏)质粒共转染人293t细胞。48小时后收获病毒并滴定,用于随后的mda-mb-231细胞转染。mda-mb-231细胞接种在12孔板上并用表达α-la的慢病毒转染,每18小时重复转染1次,共转染3次,最后用嘌呤霉素(2μg/ml)筛选过表达α-la的mda-mb-231细胞。稳定过表达α-la的mda-mb-231细胞系(α-la/mda-mb-231)用蛋白免疫印迹法进行鉴定,
结果如图1所示,α-la/mda-mb-231相较于对照细胞高表达α-la。
[0042]
2、表面富集α-la的外泌体(la-exos)提取
[0043]
使用pbs清洗贴壁的稳定过表达α-la的mda-mb-231细胞,更换培养液为含有1%fbs的培养液,48小时后收集培养上清。收集的细胞上清于4℃下300g离心10分钟除去培养液中残存的细胞,3,000g离心30分钟除去培养液中残存的细胞碎片。选择超速转子,4℃,100,000g离心70min。去除上清,用预冷的pbs重悬后,再次4℃,100000g,超速离心70min。,沉淀即为表面富集α-la的外泌体(la-exos),所得外泌体可在-80℃条件下长期保存。
[0044]
3、纳米疫苗hela-exos的制备
[0045]
la-exos、人中性粒细胞弹性蛋白酶(elane)(abcam,ab280938)和hiltonol(oncovir inc.)在300μl电穿孔缓冲液中混合,以400v和150μf的电穿孔参数在4mm皿中进行电穿孔,电穿孔后,外泌体用pbs以4℃,100,000g离心70min洗涤2次,即得到纳米疫苗hela-exos,对所得的hela-exos进行表征。结果如图2所示,纳米疫苗hela-exos在透射电子显微镜下结构完整,纳米粒度仪检测其粒径分布,hela-exos平均粒径较于la-exos增大至约113nm,纳米流式结果显示hela-exos成功包裹elane和hiltonol,蛋白免疫印迹结果显示,hela-exos保留外泌体标志物成分,并相较于未转染mda-mb-231细胞来源的外泌体(texs)(从未转染的mda-mb-231细胞培养上清中,以上述超速离心法得到),大量富集α-la。
[0046]
实施例2:纳米疫苗hela-exos的体外生物功能评价
[0047]
纳米疫苗hela-exos的体外生物功能评价,包括以下三个部分:
[0048]
1、纳米疫苗hela-exos体外细胞靶向能力评价
[0049]
用dii标记hela-exos或texs,与mda-mb-231细胞和人外周血单核细胞(pbmc)的细胞混合物孵育2小时,或在mda-mb-231细胞和人肺癌细胞a549细胞铺板后分别加入dii标记的hela-exos或texs,用流式细胞术和荧光共聚焦实验评估细胞摄取效率,结果如图3a-b所示,hela-exos较于texs,显著提高了靶向能力,且mda-mb-231细胞相较于pbmc和a549细胞,摄取更多纳米疫苗hela-exos,表明hela-exos对乳腺癌细胞具有出色的靶向特异性。
[0050]
2、纳米疫苗hela-exos体外细胞靶向杀伤及icd诱导功能评价
[0051]
将texs与hela-exos分别与乳腺癌细胞mda-mb-231、mcf7、mda-mb-435、skbr-3和正常乳腺上皮细胞mcf10a孵育48小时,通过calcein-am活细胞荧光染色量化hela-exos的细胞杀伤效率,结果如图3c-d所示,hela-exos处理后,乳腺癌细胞仅剩余少量被染色的活细胞,使用酶标仪检测荧光定量杀伤效率,hela-exos对乳腺癌细胞的杀伤效率达到80%以上,而hela-exos几乎不杀伤正常乳腺上皮细胞。通过检测被杀伤mda-mb-231细胞钙网蛋白(calreticulin,crt)的胞膜转位,以及细胞培养上清中atp及hmgb1的释放来评估hela-exos诱导乳腺癌细胞icd的能力,结果如图3d-f所示,hela-exos显著增加mda-mb-231细胞的胞膜转位以及atp及hmgb1的释放,有效诱导mda-mb-231细胞发生icd。
[0052]
3、纳米疫苗hela-exos体外免疫激活能力评价
[0053]
将mda-mb-231细胞与pbmc来源的dcs共培养,并用dmem基础培养基、hiltonol或hela-exos预处理24小时,随后加入外周血pbmc分离的幼稚cd8
+
t细胞,并在补充有il-2的1640培养基中共培养48小时。48小时后收集细胞,使用流式细胞术分析细胞免疫激活情况,结果如图4所示,hela-exos处理组中,dcs中cd141(cdc1s的标志物)和hla-a2(mhc
‑ⅰ
类分子)的荧光强度升高,而cd1c(cdc2s的标志物)和hla-dr(mhc
‑ⅱ
类分子)显示无明显差异。
hela-exos处理组中,cd8
+
t细胞中颗粒酶b和穿孔素的产量升高,cd69(活化标记物)的表达增加,而cd8
+
t细胞中pd1的表达降低。上述结果表明hela-exos诱导乳腺癌细胞发生icd,从而促进cdc1s成熟,进而激活cd8
+
t细胞,导致其活化为杀伤表型。
[0054]
实施例3:纳米疫苗hela-exos的体内抗癌效应及免疫激活能力评价
[0055]
纳米疫苗hela-exos的体内抗癌效应及免疫激活能力评价,包括以下三个部分:
[0056]
1、纳米疫苗hela-exos在免疫活性原位瘤小鼠体内肿瘤生长抑制评价
[0057]
使用荧光素酶稳定表达的mda-mb-231细胞系原位接种免疫活性balb/c小鼠,肿瘤生长约21天,体积达到约100mm3时开始使用dmem基础培养基、hiltonol或hela-exos治疗,监测肿瘤体积,治疗30天后麻醉小鼠进行活体成像,随后处死小鼠。结果如图5所示,体内肿瘤成像以及肿瘤生长曲线结果图5a-c显示,hela-exos治疗显著抑制小鼠体内肿瘤生长。此外,hela-exos处理的小鼠肿瘤组织中,增殖标志物ki67表达降低,凋亡标志物caspase-3,icd标志物icd表达增高,显示出纳米疫苗hela-exos在免疫活性原位瘤小鼠体内有效抑制肿瘤生长。
[0058]
2、纳米疫苗hela-exos在小鼠体内安全性评价
[0059]
将治疗后小鼠的心、肝、脾、肺、肾切片后做h&e染色,结果如图6a所示,经过hela-exos治疗后小鼠重要器官未发生器质性病变,检测小鼠血清中肝肾毒性指标alt、ast、bun和crea水平,结果如图6b所示,经过hela-exos治疗后小鼠未造成小鼠肝肾功能损伤。检测小鼠血清中炎症指标il-6、il-12和tnf-α水平,结果如图6b所示,经过hela-exos治疗后小鼠减轻了hiltonol治疗引起的全身炎症反应。
[0060]
3、纳米疫苗hela-exos在小鼠体内的免疫激活能力评价
[0061]
利用组织免疫荧光染色、流式细胞术和免疫组织化学染色法分析治疗后小鼠肿瘤组织免疫微环境,结果如图7所示。组织免疫荧光染色及流式细胞术结果图7a-b显示,hela-exos治疗显着增加了小鼠组织微环境和引流淋巴结中cdc1亚群(cd11c
+
cd103
+
)的浸润。流式细胞术和免疫组织化学染色结果图7c-e显示,hela-exos治疗显着增加了小鼠组织微环境中cd8
+
t细胞浸润,且cd8
+
t细胞中颗粒酶b和穿孔素的产量升高,cd69的表达增加,而cd8
+
t细胞中pd1的表达降低。这些结果表明hela-exos可以有效地促进cdc1亚群的浸润和原位成熟,并增强微环境内的抗肿瘤cd8
+
t细胞免疫。
[0062]
实施例4:纳米疫苗hela-exos在患者来源类器官中的免疫激活能力及抗癌效应评价
[0063]
纳米疫苗hela-exos在患者来源类器官中的免疫激活能力及抗癌效应评价,包括以下四个部分:
[0064]
1、乳腺癌患者组织来源类器官培养
[0065]
将手术切除所得的乳腺癌组织切成小块,通过肿瘤分离试剂盒制备肿瘤组织单细胞悬液,并用红细胞裂解液裂解去除残留红细胞。将细胞沉淀重悬在10mg/ml基质胶中,此过程在冰上操作。随后,在培养板中打出40μl细胞悬液,液滴置于37℃培养箱中固化20分钟,最后加入400μl人乳腺癌类器官培养基,在37℃、5%co2的加湿培养箱中培养,每4天更换一次人乳腺癌类器官培养基。
[0066]
2、建立乳腺癌患者的pbmcs与自体肿瘤类器官共培养系统
[0067]
将上述乳腺癌患者组织来源类器官解离为单个细胞,并重新悬浮在t细胞培养基
中,加入自体pbmcs,在含有il-2的t细胞培养基中共培养,并加入dmem基础培养基、hiltonol或hela-exos进行共刺激,每周换液2到3次,包括添补il-2、hiltonol或hela-exo,每周pbmcs用新鲜的乳腺癌患者组织来源类器官重新刺激,共培养持续2周。
[0068]
3、纳米疫苗hela-exos在共培养系统中免疫激活能力评价
[0069]
共培养两周后,利用流式细胞术和免疫荧光染色技术评估纳米疫苗hela-exos在共培养系统中免疫激活能力,结果如图8a-d所示,在hela-exos处理组中,共培养系统内的类器官显示cd141
+
cdc1s和cd8
+
t细胞的浸润增加,且cd8
+
t细胞中颗粒酶b和穿孔素的产生显着增加,表明hela-exos可有效增强cdc1s激活并有效启动随后的肿瘤特异性cd8
+
t细胞反应。
[0070]
4、纳米疫苗hela-exos在共培养系统中肿瘤杀伤能力评价
[0071]
共培养两周后,通过mts细胞增殖与细胞毒性试剂盒(biovision,k300)定量检测类器官细胞活力,及对类器官进行活死细胞染色评估hela-exos的肿瘤生长抑制作用,结果如图8e-f所示,hela-exos处理组中,mts测定结果表明类器官的细胞活力显著降低,活死细胞染色结果显示hela-exos处理组中,类器官内部的死细胞显著增多。上述结果表明,纳米疫苗hela-exos显著抑制了自体肿瘤类器官的生长,并有效诱导细胞死亡,在乳腺癌中表现出有效的抗肿瘤活性。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1