双特异性T细胞衔接器、其重组溶瘤病毒及其用途的制作方法
双特异性t细胞衔接器、其重组溶瘤病毒及其用途
技术领域
1.本发明属于生物医药技术领域,涉及一种新的包含人cd47和人cd3 特异性结合片段的双特异性t细胞衔接器(bite)。本发明还涉及一种包含 所述双特异性t细胞衔接器(bite)的重组溶瘤病毒,本发明还提供了所属 双特异性t细胞衔接器和所述溶瘤病毒的制备方法及其在抗肿瘤方面的应 用。
背景技术:
2.癌症是全球第二大死亡原因,2018年估计有960万人死于癌症。在全球 范围内,大约六分之一的死亡是由癌症造成的。相关的癌症治疗方法,特别 是借助人体自身免疫系统的肿瘤免疫治疗日益成为人们关注的焦点。
3.人cd47即整合素相关蛋白,是一种细胞膜表面糖蛋白,属于免疫球蛋 白超家族。cd47广泛表达于多种癌细胞表面,通过与肿瘤吞噬细胞表面信 号调控蛋白α(signaling regulatory protein alpha,sirpα)连接释放“别吃我
”ꢀ
信号,阻止巨噬细胞吞噬作用。近年来,有多家公司投入大量人力物力研发 cd47抗体,但是进入临床后收效甚微,目前cd47抗体的最好水平是可以 进入组合药中。治疗效果不佳的主要原因是副作用难以控制,这归咎于cd47 的致命弱点,即在红细胞上表达。cd47抗体药物或者sirpα-fc融合蛋白与 红细胞结合后,可引起红细胞凝集,继而引发红细胞的破裂;带有igg1的 fc的cd47抗体药物还能激活巨噬细胞对红细胞的吞噬作用或者抗体依赖的 细胞介导的细胞毒性作用(antibody-dependent cell-mediated cytotoxicity, adcc),进一步引发红细胞的裂解,最终导致贫血的发生。
4.如何最大化利用cd47靶点在杀伤肿瘤细胞上优势,同时减少对红细胞 的损伤,一直是成功开发针对cd47药物的关键所在。双特异性t细胞衔接 器bite(bispecific t-cell engager)代表一类具有显著抗肿瘤效应的双特异 性抗体,能够靶向性激活自身t细胞杀伤肿瘤细胞。bite由两个单链可变 片段(scfv)组成,通过柔性接头串联连接。一个scfv识别t细胞表面蛋 白cd3εh,而另一个scfv识别特异性肿瘤细胞表面抗原。bite的这种结构 和特异性结合蛋白的能力允许它将t细胞物理性地桥接肿瘤细胞而形成t细 胞-bite-肿瘤细胞复合物,诱导免疫突触形成,刺激t细胞活化,产生杀伤 肿瘤的细胞因子。近年来,bite在抗肿瘤研究中取得了显著进展,在临床 上取得了理想的治疗效果。
5.由于标准肿瘤治疗方案在晚期肿瘤治疗中有限的治疗效果以及严重副 作用,靶向肿瘤的溶瘤病毒在近几十年里引起了极大的关注。溶瘤病毒得益 于其自身可选择性的在肿瘤局部感染并裂解肿瘤细胞的特性,正在越来越多 的成为抗肿瘤的首选。溶瘤病毒的肿瘤选择性可以是本身的肿瘤趋向性,也 可以是基因修饰的结果。溶瘤病毒可作用于多个细胞通路,以此减少肿瘤的 抗性,还可以诱导不同形式的细胞死亡。另外,溶瘤病毒可以打破肿瘤微环 境的免疫耐受,诱导长期的肿瘤特异性免疫应答。溶瘤病毒可特异性的转运 治疗性蛋白进入肿瘤组织,伴随病毒的进一步复制增加在恶性肿瘤细胞中表 达水平。另外,溶瘤病毒可以同化疗、放疗以及免疫治疗联合使用。
6.2006年,溶瘤腺病毒产品(oncorine)已在中国用于临床治疗鼻咽癌等。 该溶瘤病毒删除了人5型腺病毒的e1b-55kd基因,可在p53基因突变的癌 细胞中复制增殖并杀伤宿主细胞,产生溶瘤治疗作用;同时删除e3区,使 肿瘤抗原信息能通过树突细胞的传递而激活t细胞的免疫。但临床数据显 示,相较于放射治疗,溶瘤病毒oncorine联合化疗对鼻咽癌患者的治疗效果 较弱。
7.2015年,安进公司的溶瘤单纯疱疹病毒(talimogene laherparepvec, t-vec)获得美国fda批准用于治疗黑色素瘤,同年12月又获得欧盟批准 用于首次手术后复发的黑色素瘤患者不可切除的皮肤、皮下和淋巴结病灶的 局部治疗。t-vec临床研究结果极大地推动了溶瘤病毒在肿瘤治疗领域的研 发进程。但是通过瘤内给药方式限制了治疗类型,只能应用在离体表近的便 于手术的肿瘤类型中,对很多非浅表的实体瘤及转移瘤的治疗存在给药困难 和治疗不彻底的问题,若能证实通过静脉给药仍具有较好的肿瘤治疗效果, 将极大地提高其临床应用价值;由于疱疹病毒自身溶瘤作用的限制性,对体 积大和/或转移的肿瘤清除不完全,所以还需要联合其他治疗手段来增强抗肿 瘤作用。
8.痘苗病毒(vaccinia virus,vv)的生物学性状和致病机制相对明晰,在 消除天花的过程中起到了关键作用,它在人体的安全性也得到了充分证明。 根据致病性,宿主范围等特点,痘苗病毒可分为wr(western reserve)株、 wyeth株、copenhagen株、lister株、tian tan株等。因其具有宿主范围广, 保守性高,安全性好及外源基因容量大等特点,痘苗病毒被用于流感病毒、 人类免疫缺陷病毒等多个重组疫苗的载体。作为溶瘤病毒的研发,目前大多 数处于临床前研究阶段,只有少数进入临床研究阶段。
9.利用痘苗病毒作为溶瘤病毒治疗肿瘤的研究,目前进展最快的是美国 jennerex公司研发的pexa-vec(jx-594)。jx-594基于wyeth株病毒,在tk 区插入hgm-csf和lacz基因,由于缺失胸腺激酶基因,jx-594可在高水 平表达胸腺激酶的癌细胞中表达复制,但不会对正常细胞产生影响。同时 jx-594因插入了gm-csf基因,可在肿瘤细胞中表达gm-csf,激活机体 的抗肿瘤免疫反应。jx-594多种肿瘤类型的临床试验结果证明,经瘤内给药 或静脉滴注给药均具有良好的耐受性,pexa-vec联合sorafenib效果好于单独 用药组。中期分析结果表明其延长患者生存期的可能性不高。原本计划2020 上市的pexa-vec,临床iii期试验提前终止。
10.美国genelux公司研发的溶瘤病毒(gl-onc1,又称为glv-1h68),是 基于痘苗病毒(lister株),删除其基因f14.5l、tk(编码胸苷激酶)和ha (编码血凝素)以加强靶向肿瘤,并分别插入luciferase-gfp融合蛋白、β
‑ꢀ
半乳糖苷转移酶和β-葡萄糖醛酸酶进行痘病毒的筛选与生产制备。gl-onc1 已经完成的静脉注射给药i期临床试验显示出良好的安全性和疗效,未出现 剂量限制毒性,未到达最大耐受剂量,所有患者均出现针对gl-onc1的中 和反应;gl-onc1目前正在进行静脉注射给药的扩大性实验。
11.痘苗病毒的生活周期严格在宿主细胞的细胞质中进行,且需要痘苗病毒 的胸苷激酶基因作用,子代病毒的基因组才能顺利复制。而在正常的组织细 胞周期中,细胞胸苷激酶(thymidine kinase,tk)的合成发生在细胞分裂周 期的s期,细胞分裂完成后,胸苷激酶在细胞内部降解,因此细胞质中胸苷 激酶浓度较低。但肿瘤细胞分裂活跃,其胸苷激酶持续合成。利用该特征, 删除痘苗病毒的胸苷激酶基因,致使痘苗病毒在肿瘤细胞中特异性扩增,起 到溶瘤的作用。
cdr2、如seq id no:6所示的vl cdr3;
31.或所述vl
αcd47
包含:如seq id no:7所示的vl cdr1、如seq id no: 8所示的vl cdr2、如seq id no:9所示的vl cdr3;
32.或所述vl
αcd47
包含:如seq id no:10所示的vl cdr1、如seq id no: 11所示的vl cdr2、如seq id no:12所示的vl cdr3;
33.或所述vl
αcd47
包含:如seq id no:13所示的vl cdr1、如seq id no: 14所示的vl cdr2、如seq id no:15所示的vl cdr3;
34.或所述vl
αcd47
包含:如seq id no:16所示的vl cdr1、如seq id no: 17所示的vl cdr2、如seq id no:18所示的vl cdr3。
35.根据本发明所述的双特异性t细胞衔接器,其中,所述vh
αcd47
包含seq id no:19所示的重链可变区中含有的3个cdr;
36.优选地,所述vl
αcd47
包含seq id no:20-24中任一项所示的轻链可变 区中含有的3个cdr;
37.优选地,所述重链可变区中含有的3个cdr,和/或所述轻链可变区中 含有的3个cdr,由kabat、chothia或imgt编号系统定义。
38.根据本发明所述的双特异性t细胞衔接器,其中,所述vh
αcd47
包含选 自下列的氨基酸序列:
39.(i)seq id no:19所示的序列;
40.(ii)与seq id no:19所示的序列相比具有一个或几个氨基酸的置换、 缺失或添加的序列;或
41.(iii)与seq id no:19所示的序列具有至少80%、至少85%、至少90%、 至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少 97%、至少98%、至少99%、或100%的序列同一性的序列;
42.和/或,
43.所述vl
αcd47
包含选自下列的氨基酸序列:
44.(iv)seq id no:20-24中任一项所示的序列;
45.(v)与seq id no:20-24中任一项所示的序列相比具有一个或几个氨基 酸的置换、缺失或添加的序列;或
46.(vi)与seq id no:20-24中任一项所示的序列具有至少80%、至少 85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、 至少96%、至少97%、至少98%、至少99%、或100%的序列同一性的序列;
47.优选地,(ii)或(v)中所述的置换是保守置换。
48.根据本发明所述的双特异性t细胞衔接器,其中,所述vh
αcd3
包含选 自下列的氨基酸序列:
49.(i)seq id no:25或27所示的序列;
50.(ii)与seq id no:25或27所示的序列相比具有一个或几个氨基酸的置 换、缺失或添加的序列;或
51.(iii)与seq id no:25或27所示的序列具有至少80%、至少85%、至 少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、 至少97%、至少98%、至少
99%、或100%的序列同一性的序列;
52.和/或,
53.所述vl
αcd3
包含选自下列的氨基酸序列:
54.(iv)seq id no:26或28所示的序列;
55.(v)与seq id no:26或28所示的序列相比具有一个或几个氨基酸的置 换、缺失或添加的序列;或
56.(vi)与seq id no:26或28所示的序列具有至少80%、至少85%、至少 90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、 至少97%、至少98%、至少99%、或100%的序列同一性的序列;
57.优选地,(ii)或(v)中所述的置换是保守置换。
58.根据本发明所述的双特异性t细胞衔接器,其中,所述vh
αcd47
、vh
αcd3
、 vl
αcd47
和vl
αcd3
通过连接肽连接;
59.优选地,所述vh
αcd47
、vh
αcd3
、vl
αcd47
和vl
αcd3
之间任选地通过一条、 两条或三条连接肽连接;
60.优选地,双特异性t细胞衔接器包含如下式中任一项所示的融合蛋白:
61.vl
αcd47-l-vh
αcd3-l-vl
αcd3-l-vh
αcd47
;或
62.vh
αcd47-l-vh
αcd3-l-vl
αcd3-l-vl
αcd47
63.更优选地,所述l为kesgsvsseqlaqfrsld、egkssgsgseskst、 gggggg、gggggggg或(ggggs)n;进一步优选地,n为1-5的整数, 最优选地,n为3;
64.优选地,所述双特异性t细胞衔接器包含如下式所示的融合蛋白:
65.vh
αcd47-l-vh
αcd3-l-vl
αcd3-l-vl
αcd47
66.其中,所述vh
αcd47
如seq id no:19所示,所述vl
αcd47
如seq id no: 21或24所示,所述vh
αcd3
如seq id no:25所示,vl
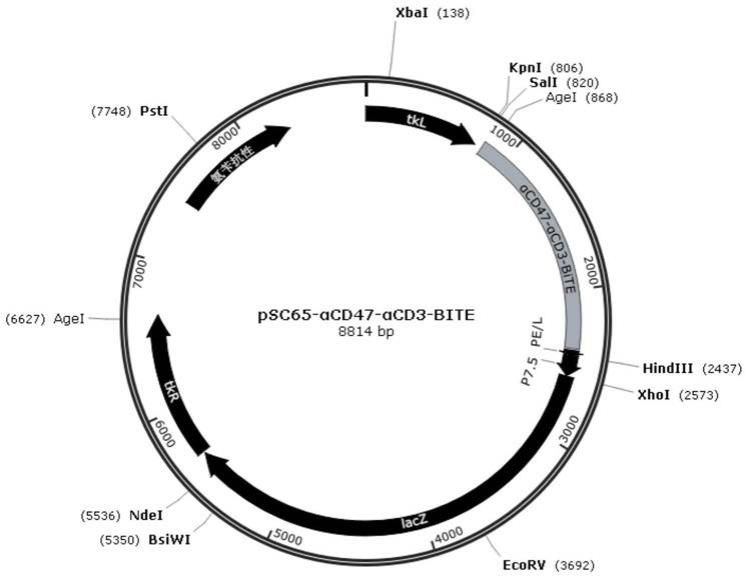
αcd3
如seq id no:26 所示,并且所述l为ggggsggggsggggs。
67.本发明还提供了一种分离的核酸分子,其编码所述的双特异性t细胞衔 接器;
68.优选地,所述核酸分子包含seq id no:31-35中任一项所示的核酸序 列,所述核酸序列为vl
αcd47
的编码序列;
69.优选地,所述核酸分子包含如seq id no:36所示的核酸序列,所述 核酸序列为vh
αcd47
的编码序列。
70.根据本发明所述的双特异性t细胞衔接器的表达框架:
[0071]5’‑
e1-e2-e3-e4-e5-e6-e7-3’[0072]
其中:
[0073]
e1是cmv增强子或/和其它顺式作用元件;优选包含seq id no:37 所示的核酸序列;
[0074]
e2是重组表达的启动子,优选cmv启动子,更优选包含seq id no: 38所示的核酸序列;
[0075]
e3是5’端非翻译区,任选地不包含或包含一个内含子序列,任选地包 含一个或多个限制酶位点;优选包含seq id no:39所示的核酸序列;
[0076]
e4是bite蛋白的信号肽的编码核苷酸序列;优选地,所述信号肽源于 人或小鼠的信号肽;优选包含seq id no:40所示的核酸序列;
[0077]
e5是所述的双特异性t细胞衔接器的编码核苷酸序列;
[0078]
e6是3’端非翻译区,任选地包含一个或多个限制酶位点;优选包含seq id no:41所示的核酸序列;
[0079]
e7是sv40转录中止信号区;优选包含seq id no:42所示的核酸序 列。
[0080]
再一方面,本发明提供了一种重组溶瘤病毒,所述溶瘤病毒可操作地插 入或包含所述双特异性t细胞衔接器bite的表达框架。
[0081]
优选地,所述表达框架位于所述重组溶瘤病毒的胸腺嘧啶核苷激酶(tk) 区。
[0082]
优选地,所述表达框架可单独表达、也可与其他基因或片段融合表达。
[0083]
优选地,所述重组溶瘤病毒还包含其他免疫调节因子的基因编码序列, 更优选地,所述其他免疫调节因子包括但不限于il-1、il-2、il-3、il-7、il-11、 il-12、il-15、il-17、il-18、il-21、il-33、il-35、il-37、gm-csf、ifn-α、 ifn-β、ifn-γ、抗pd-1/pd-l1抗体、抗ctla-4抗体、抗lag-3抗体、抗 tigit抗体或抗tim-3抗体;或
[0084]
所述重组溶瘤病毒还包含与细胞凋亡和细胞焦亡相关的蛋白的基因编 码序列,所述与细胞凋亡和细胞焦亡相关的蛋白包括但不限于凋亡相关因子 1(apaf-1)、白介素-1β转换酶(ice)、bcl-2蛋白、fas/apo-1、p53、myc、 共济失调毛细血管扩张突变基因(atm)、消皮素d(gasdermin d)、消皮素 e(gasdermin e)等;或
[0085]
所述重组溶瘤病毒还包含靶向免疫调节基因、凋亡与焦亡基因的小 rna。
[0086]
根据本发明所述的重组溶瘤病毒,其中,所述溶瘤病毒的病毒骨架来源 于经修饰或经改造的痘苗病毒天坛株、痘苗病毒纽约株、痘苗病毒哥本哈根 株、痘苗病毒金丝雀株、痘苗病毒安卡拉株、腺病毒、腺相关病毒、单纯疱 疹病毒、水痘-带状疱疹病毒(varicella-zoster virus,vzv)、呼吸道合胞病 毒(respiratory syncytial virus,rsv)、生里基森林病毒(semliki forest virus, sfv)、eb病毒、巨细胞病毒、人疱疹病毒6型、天花病毒、痘苗病毒、传 染性软疣病毒、羊口疮病毒、呼肠孤病毒、轮状病毒、肠道病毒、塞内卡病 毒、脊髓灰质炎病毒、柯萨奇病毒、鼻病毒、甲型肝炎病毒、口蹄疫病毒、 披膜病毒、甲病毒、塞姆利基森林病毒、东部马脑炎病毒、辛德毕斯病毒、 风疹病毒、冠状病毒、黄病毒、丙型肝炎病毒、日本脑炎病毒、圣路易斯脑 炎病毒、墨累谷热病毒、黄热病毒、西尼罗河病毒、寨卡病毒、登革病毒、 埃博拉病毒、马尔堡病毒、沙粒病毒、拉沙热病毒、淋巴细胞性脉络丛脑膜 炎病毒、皮钦德病毒、胡宁病毒、马丘波病毒、汉坦病毒、裂谷热病毒、副 粘病毒、人副流感病毒、腮腺炎病毒、猴病毒5、麻疹病毒、水疱性口炎病 毒、狂犬病病毒、正粘病毒、甲型流感病毒、乙型流感病毒、丙型流感病毒、 丁型肝炎病毒、猴免疫缺陷病毒、人免疫缺陷病毒1型和人免疫缺陷病毒2 型、劳氏肉瘤病毒、嗜人t细胞白血病病毒1型、猴泡沫病毒、乙型肝炎病 毒、戊型肝炎病毒、人乳头瘤病毒或多瘤病毒。
[0087]
优选地,所述溶瘤病毒骨架为细胞内成熟病毒、细胞内包装病毒、细胞 相关包装病毒或细胞外包装病毒。
[0088]
根据本发明所述的重组溶瘤病毒,其中,所述溶瘤病毒为包含双特异性 t细胞衔接器αcd47-αcd3-bite的编码基因的重组痘苗病毒天坛株,命名 为rtv-αcd47-αcd3-bite,其保藏编号为:cctcc no:v202081,保藏日 期为2021年1月2日,保藏地址为中国典型培养物保藏中心。
[0089]
再一方面,本发明提供了所述重组溶瘤病毒的制备方法,包括以下步骤:
[0090]
1)合成所述双特异性t细胞衔接器bite的表达框架;
[0091]
2)将步骤1)得到的表达框架亚克隆至溶瘤病毒的穿梭质粒中,构建重 组质粒载体;
[0092]
3)将步骤2)得到的重组质粒载体转染至溶瘤病毒中,经筛选获得重组 溶瘤病毒。
[0093]
任选地,培养获得的重组溶瘤病毒。
[0094]
在一个具体的实施方案中,本发明提供了一种重组痘苗病毒天坛株的制 备方法,包括以下步骤:
[0095]
1)合成双特异性t细胞衔接器αcd47-αcd3-bite的表达框架,其包 含如seq id no:31-42中任一项所示的核酸序列;
[0096]
2)将合成的表达框架亚克隆至痘苗病毒穿梭质粒(psc65)的tk区中, 构建重组质粒psc65-αcd47-αcd3-bite;
[0097]
3)采用基因同源重组的方式,将psc65-αcd47-αcd3-bite质粒转染到 已经被感染了野生型痘苗病毒的tk143-细胞中,使两者同源重组,产生重组 痘苗病毒rtv-αcd47-αcd3-bite;经筛选获得所述tk区包含 αcd47-αcd3-bite的编码序列的重组溶瘤痘苗病毒。
[0098]
其中,双特异性t细胞衔接器αcd47-αcd3-bite的表达框架由痘苗病 毒的早/晚期启动子p7.5控制。
[0099]
优选地,利用vero细胞扩增重组痘苗病毒的具体步骤包括:培养 vero细胞至密度接近100%时,更换低浓度胎牛血清维持培养基,加入溶 瘤痘苗病毒(接种量约为0.02moi每10cm培养板),放入孵箱培养,重组 痘病毒扩增完毕后,收集病毒液再反复冻融后,用蔗糖溶液进行密度梯度离 心纯化。
[0100]
再一方面,本发明还提供了所述双特异性t细胞衔接器或重组溶瘤病毒 用于制备抗肿瘤药物的用途;其中,所述肿瘤选自b细胞淋巴瘤、t细胞淋 巴瘤、黑色素瘤、前列腺癌、肾细胞癌、肉瘤、胶质瘤如高级别胶质瘤、母 细胞瘤如神经母细胞瘤、骨肉瘤、浆细胞瘤、组织细胞瘤、胰腺癌、乳腺癌、 肺癌诸如小细胞肺癌和非小细胞肺癌、胃癌、肝癌、结肠癌、直肠癌、食管 癌、大肠癌、造血系统癌、睾丸癌、宫颈癌、卵巢癌、膀胱癌、鳞状细胞癌、 腺癌、aids相关淋巴瘤、膀胱癌、脑癌、神经系统癌、头颈癌、头颈部鳞 状细胞癌、霍奇金氏淋巴瘤、非霍奇金氏淋巴瘤或血液致瘤疾病。
[0101]
另一方面,本发明提供了一种治疗肿瘤的方法,所述方法包括给予有需 要的受试者治疗有效量的双特异性t细胞衔接器或重组溶瘤病毒。根据本发 明所述的方法,其中所述方法还包括给予有需要的受试者另外的化疗药物、 放疗技术、手术治疗、免疫细胞药物(包括但不限于car-t、nk、nkt、 inkt、car-nk、car-nkt、car-inkt等)、其他溶瘤病毒;优选地, 所述方法为静脉注射或瘤内注射。
[0102]
本发明的发明构思如下:
[0103]
本发明提供一种新的αcd47-αcd3-bite双特异性t细胞衔接器,其在体 外有良好的抗肿瘤活性。进一步地,本发明人以痘苗病毒天坛株为研究模式, 提供了一种搭载本发明的双特异性t细胞衔接器的痘苗病毒天坛株。然后本 发明的发明人发现痘苗病毒天坛株自身具有强大的抗肿瘤作用;搭载 αcd47-αcd3-bite的双特异性t细胞衔接器,可避免cd47抗体与外周血的红 细胞结合,利用cd47广谱表达的特性识别肿瘤细胞,以及cd3抗体活化t细 胞,进而起到杀伤肿瘤细胞的作用,提升肿瘤免疫治疗效果的同时,增加安 全性。
[0104]
本发明的有益效果是:
[0105]
1.本发明提供的双特异性t细胞衔接器(bite)分子量小,能够穿透细 胞间隙到达实体瘤内部的肿瘤微环境(tme)发挥作用,其能够高效介导t 细胞对癌细胞的杀伤。
[0106]
2.本发明将双特异性t细胞衔接器与溶瘤病毒结合,提供了一种可高效 表达双特异性t细胞衔接器αcd47-αcd3-bite基因的痘苗病毒天坛株。在将 该溶瘤病毒投药至肿瘤病灶时,它在裂解肿瘤细胞发挥溶瘤效应的同时,还 搭载靶向肿瘤的基因抗人cd47的高杀伤性抗体,阻断cd47与sirpα结合, 提升体内巨噬细胞吞噬功能,来增强抗肿瘤效果。相对于单纯的基因疗法或 者病毒疗法,所述溶瘤病毒显著增强对恶性肿瘤的抑制能力。
[0107]
3.根据本发明的体外实验研究,证明本发明的痘苗病毒天坛株能够治疗 肝癌与恶性肺癌,并且实现了对肿瘤的良好靶向性及抗肿瘤效果,具有较为 完备的病毒扩增及质量控制体系,为进一步的产业化奠定基础,因此,本发 明具有良好的应用前景。
附图说明
[0108]
以下,结合附图来详细说明本发明的实施方案,其中:
[0109]
图1示出了本发明的穿梭质粒载体αcd47-αcd3 bite higg1 wt的构建 和5种相应bite蛋白的表达纯化;其中图1a为整合有αcd47-αcd3-bite 表达框架的穿梭质粒higg1 wt表达图谱;图1b为293t瞬时表达 αcd47-αcd3-bite的培养基上清,利用镍柱进行蛋白纯化后的结果。
[0110]
图2示出了αcd47-αcd3-bite介导t细胞的体外抗人卵巢腺癌细胞的 效果;其中,相对于t细胞对照组,68号克隆的cd47抗体与αcd3组成的 bite都能够很好地介导t细胞对sk-ov3的杀伤。说明αcd47-αcd3-bite 能够很好地识别cd47的肿瘤细胞且激活t细胞,从而介导t细胞对该肿瘤 细胞的特异杀伤;表明包含人cd47和人cd3特异性结合的双特异性t细 胞衔接器(bite)在体外能够很好地介导t细胞的抗肿瘤活性且具有广谱 性。
[0111]
图3示出了αcd47-αcd3-bite介导t细胞的体外抗人肺癌细胞的效果; 其中,相对于t细胞对照组,101号克隆的cd47抗体与αcd3组成的bite 能够介导t细胞对nci-h292肿瘤细胞的杀伤,与单独t细胞组比较,bite 组杀伤nci-h292细胞效果明显;表明包含人cd47和人cd3特异性结合的 双特异性t细胞衔接器(bite)在体外能够很好得介导t细胞的抗肿瘤活 性且具有广谱性。
[0112]
图4显示了痘苗病毒天坛株穿梭质粒载体(αcd47-αcd3-bite)的构建 和αcd47-αcd3-bite蛋白的表达。图4a为整合有αcd47-αcd3-bite基因 的痘苗病毒穿梭质粒psc65表达图谱;图4b为所述重组痘苗病毒 rtv-αcd47-αcd3-bite中插入片段αcd47-αcd3-bite的pcr鉴定结果; 图4c显示了重组痘苗病毒感染vero细胞的上清中有cd47-αcd3-bite蛋 白表达。从图4可知,重组痘苗病毒rtv-αcd47-αcd3-bite所搭载的 αcd47-αcd3-bite成功表达。
[0113]
图5显示了重组痘苗病毒rtv-αcd47-αcd3-bite搭载的 αcd47-αcd3-bite与cd47蛋白具有很高的亲和力;图5中为重组痘苗病 毒rtv-αcd47-αcd3-bite感染vero细胞收集的细胞上清与表达人源 cd47的肺癌细胞a549细胞进行亲和检测的流式结果;结果显示与野生型 痘苗病毒相比,重组痘苗病毒rtv-αcd47-αcd3-bite表达蛋白与cd47的 结合率在85%以上。
[0114]
图6显示了痘苗病毒天坛株rtv-αcd47-αcd3-bite的重组痘苗病毒的 体外杀伤a549细胞作用。实验分为四组,包括野生痘苗病毒感染的上清对 照组、野生痘苗病毒感染的上清+t细胞组、重组痘苗病毒感染的上清对照 组和重组痘苗病毒感染的上清+t细胞组。从图中可知重组痘苗病毒感染的 上清+t细胞组与空白对照组相比对肺癌细胞a549细胞具有显著的杀伤作 用。
[0115]
图7显示了不同结构的αcd47-αcd3-bite蛋白的抗癌效果。
[0116]
保藏信息
[0117]
痘苗病毒天坛株,命名为rtv-αcd47-αcd3-bite,其保藏编号为: cctcc no:v202081,保藏日期为2021年1月2日,保藏地址为中国典型 培养物保藏中心,地址:中国武汉武汉大学。
具体实施方式
[0118]
实施例1:αcd47-αcd3-bite的293t重组表达质粒的构建以及表达验证
[0119]
1.1带αcd47-αcd3-bite目的基因的higg1 wt载体构建
[0120]
首先,筛选高亲和力的5个抗人cd47抗体,选取其重链可变区和轻链 可变区,并按照下式构建融合蛋白:vh
αcd47-l-vh
αcd3-l-vl
αcd3-l-vl
αcd47
;
[0121]
其中,所述vh
αcd47
如seq id no:19所示,所述vl
αcd47
如seq id no: 20-24中任一项所示,所述vh
αcd3
如seq id no:25所示,vl
αcd3
如seq idno:26所示,并且所述l为ggggsggggsggggs。
[0122]
并且,根据vl
αcd47
不同,hu004-67表示包含seq id no:20所示的 vl
αcd47
的αcd47-αcd3 bite;hu004-68表示包含seq id no:21所示的 vl
αcd47
的αcd47-αcd3 bite;hu004-73表示包含seq id no:22所示的 vl
αcd47
的αcd47-αcd3 bite;hu004-100表示包含seq id no:23所示的 vl
αcd47
的αcd47-αcd3 bite;hu004-101表示包含seq id no:24所示的 vl
αcd47
的αcd47-αcd3 bite,其中wt cloning vector abvec-higg1 (genbank:fj475055.1)。
[0123]
按照结构式人工合成αcd47-αcd3-bite的dna序列,质粒构建图谱 如图1a所示,其中为vl
αcd47
的编码序列如seq id no:31-35中任一项所 示,vh
αcd47
的编码序列如seq id no:36所示。
[0124]
将人工合成的包含αcd47-αcd3-bite目的基因的higg1 wt载体转化 至大肠杆菌e.coli top10(唯地公司,货号dl1010s),在含氨苄霉素的培 养板上过夜生长。第2天,随机挑取单菌落进行37℃过夜培养,应用质粒抽 提试剂盒(qiagen公司,货号27106)提取质粒用于293t细胞转染。
[0125]
1.2带αcd47-αcd3-bite目的基因的293t细胞表达纯化
[0126]
1.293t细胞准备:将生长于t175培养瓶中汇合度超过90%的细胞移去 上清,加入2ml 2.5%trypsin-edta(gibco公司,货号25200072)消化细 胞至细胞完全脱壁,加入10ml完全培养基(dmem培养基+10%fbs+1% ps)中止消化,150g离心5分钟收集细胞,弃掉上清,用适量完全培养基 重选细胞使细胞浓度约为8
×
106~10
×
106个/ml。将细胞悬液计数,并取1.3
×
107个细胞铺于150mm细胞培养皿(thermo scientific公司,货号150468), 培养皿中培养基体积为25ml,培养至第二天用于后续质粒转染。
[0127]
2.αcd47-αcd3-bite的higg1 wt穿梭质粒转染293t细胞:取1mldmem培养基于ep
管中,加入20μgαcd47-αcd3-bite的higg1 wt穿梭 质粒cloning vector abvec-higg1(genbank:fj475055.1),混匀后加入30μl fectopro转染试剂(polyplus公司,货号116-001),之后立即置于漩涡振荡 器上剧烈震荡15s,置于室温静置20分钟。培养箱中取出待转染的293t细 胞,吸取并弃掉10ml培养基,边摇晃边加入静置后的转染试剂,置于37℃ 5%co2的培养箱中培养4-6小时。完全移除培养基,加入expi293表达培养 基(gibco公司,货号a1435102),置于37℃5%co2的培养箱中培养4 天。
[0128]
3.收集αcd47-αcd3-bite表达上清:收集表达培养皿中的培养基于50 ml离心管中,4000g离心5分钟,将表达上清转移到新的50ml离心管中。
[0129]
4.将表达上清进行his标签蛋白纯化:使用重力层析柱进行纯化,填充 的镍珠为ni-ntaagarose(qiagen公司,货号30210);装柱完成后,用 5mm、10mm的咪唑(溶解在50mm nah2po4·
2h2o,ph 8.0,300mm nacl 中)洗脱非特异吸附的蛋白,自然流速洗脱,收集滤液;然后用20mm、100 mm(分先后收集两管)、200mm(分先后收集两管)、500mm的咪唑(溶 解在50mm nah2po4·
2h2o,ph 8.0,300mm nacl中)进行目的蛋白的洗 脱,收集对应的滤液。
[0130]
5.取20μl滤液制样,进行10%sds-page检测。如图所示,由5mm 咪唑洗脱液到500mm咪唑洗脱液依次进行上样。由图1b所示100mm的 洗脱液和200mm中出现目的蛋白,条带大小为54kd左右。
[0131]
实施例2:αcd47-αcd3-bite介导t细胞的体外抗人卵巢腺癌细胞效果
[0132]
1.sk-ov3细胞铺板:sk-ov3(保存于上海鑫湾生物科技有限公司)为 luciferase表达细胞系。将细胞以1
×
104个/孔的密度铺于96孔板中,37℃培 养过夜待其贴壁。
[0133]
2.24小时后除去培养基,设7组,分别加入t细胞,b6h12-αcd3-bite (b6h12的重链可变区和轻链可变区分别如seq id no:29和30所示,其 余结构与本发明的实施例1的bite相同)和t细胞,hu004-67-αcd3-bite 和t细胞,hu004-68-αcd3-bite和t细胞,hu004-73-αcd3-bite和t细 胞,hu004-100-αcd3-bite和t细胞,hu004-101-αcd3-bite和t细胞。
[0134]
3.37℃培养过夜进行杀伤。24小时后除去上清,每孔加入50μl细胞裂 解液荧光素酶细胞裂解液(promega公司,货号e1531),室温震荡孵育30 分钟,每孔加入30μl荧光素酶底物(promega公司,货号e151a)。上机检 测(glomax navigator microplate luminometer,promega,steady-gloprotocol)。
[0135]
测得结果如图2。其中b6h12是已知的cd47抗体克隆(us 9017675b2), 作为阳性对照。hu004-68和hu004-101是筛选到的与cd47蛋白有高亲和力 的抗体克隆(委托泷搌生物科技公司进行抗体筛选获得)。由图2可知,针 对该种肿瘤细胞系,68号克隆的cd47抗体(scfv)-αcd3-bite相比t细胞 对照组,杀伤肿瘤活性有3.5倍的提升,相比较低杀伤能力的100号克隆有 2倍的提升,与阳性对照抗体相比有1.5倍的提升,能够很好地介导t细胞 的体外抗卵巢腺癌细胞效果。
[0136]
实施例3:αcd47-αcd3-bite介导t细胞的体外抗人肺癌细胞效果
[0137]
1.nci-h292细胞铺板:nci-h292(保存于上海鑫湾生物科技有限公司) 为luciferase表达细胞系。将细胞以1
×
104个/孔的密度铺于96孔板中,37℃ 培养过夜待其贴壁。
[0138]
2.24小时后除去培养基,设7组,分别加入t细胞,b6h12-αcd3-bite 和t细胞,hu004-67-αcd3-bite和t细胞,hu004-68-αcd3-bite和t细 胞,hu004-73-αcd3-bite和t细
胞,hu004-100-αcd3-bite和t细胞, hu004-101-αcd3-bite和t细胞。
[0139]
3.37℃培养过夜进行杀伤。24小时后除去上清,每孔加入50μl细胞裂 解液(promega公司,货号e1531),室温震荡孵育30分钟,每孔加入30μl 荧光素酶底物(promega公司,货号e151a)。上机检测(glomax navigatormicroplate luminometer,promega,steady-glo protocol)。
[0140]
测得结果如图3所示,101号克隆的cd47抗体-αcd3-bite能够很好的 介导t细胞的体外抗肺癌细胞效果,101号克隆的cd47抗体(scfv)-α cd3-bite相比t细胞对照组,杀伤肿瘤活性有4倍的提升,相比较低杀伤 能力的100号克隆有1.2倍的提升,与阳性对照抗体相比有1.2倍的提升, 能够很好的介导t细胞的体外抗卵巢腺癌细胞效果。图2和图3结果共同表 明包含人cd47和人cd3特异性结合的双特异性t细胞衔接器(bite)在 体外能够很好得介导t细胞的抗肿瘤活性且具有广谱性。
[0141]
实施例4:αcd47-αcd3-bite的重组痘苗病毒的构建以及表达验证
[0142]
4.1带αcd47-αcd3-bite目的基因的psc65载体构建
[0143]
人工合成αcd47-αcd3-bite的dna序列,以合成的dna序列为模版 采用如下引物进行pcr扩增。
[0144]
扩增的引物为:
[0145]
αcd47-αcd3-bite-f:seq id no:43
[0146]
gtaccaggcctagtactatggagaggacccttgtctg
[0147]
αcd47-αcd3-bite-r:seq id no:44
[0148]
aataagctcgaagtcgac ctaggagagatgctgatg
[0149]
pcr反应程序:94℃预变性5分钟;98℃变性10秒,58℃:退火30 秒,72℃延伸1分钟,反应30个循环;72℃再充分延伸10分钟,终止于 25℃。
[0150]
pcr产物的回收与克隆构建:扩增结束后,在2%的琼脂糖凝胶中分离 目的基因,同时将psc65载体用sal i酶切(thermo scientific公司,货号 er0642)线性化载体,并进行切胶回收,采用sanprep柱式dna胶回收试 剂盒(promega公司,货号a9282)回收pcr片断段与载体酶切片段。基因 回收产物与酶切线性化载体用同源重组的方法连接(诺唯赞公司,货号 c112-02)。将连接产物转化至大肠杆菌e.coli top10,在含氨苄霉素的培养 板上过夜生长。第2天,随机挑取单菌落进行测序,突变位点校正,验证全 部序列正确后,成功克隆出αcd47-αcd3-bite的psc65穿梭质粒,质粒构 建图谱如图4a所示。
[0151]
4.2构建重组痘苗病毒αcd47-αcd3-bite
[0152]
1.细胞准备:将143tk-细胞铺在6孔板中,每孔约1
×
106个。培养24 小时左右,当细胞贴壁并且铺满整个底面时,进行下一步操作。2.痘苗病 毒孵育:用0.0125/3pfu(pfu:空斑形成单位,病毒液滴度)/细胞的野生 型痘苗病毒天坛株感染细胞,37℃孵箱中孵育1小时后取出,吸掉上清,并 用1ml pbs冲洗一遍再加入1ml完全培养基。
[0153]
3.质粒转染:将上述穿梭质粒psc65-αcd47-αcd3-bite转染143tk-细胞。37℃孵箱中培养48小时左右,具体时间根据细胞病变情况而定。
[0154]
4.准备病毒铺斑用的2
×
dmem维持培养基(含2%ps和4%fbs),加 入2%预热的低熔点琼脂糖再加x-gal(终浓度为200μg/ml)。
[0155]
5.吸掉6孔板中的上清,将铺斑用的混合物加入6孔板中,每孔1ml。 然后小心放入
4℃冰箱,促进凝固,待低熔点琼脂糖凝固后再转入37℃孵箱 中倒置培养直至出现清晰的蓝斑。
[0156]
6.挑取蓝斑(重组的痘苗病毒rtv-αcd47-αcd3-bite)到500μl的完 全培养基。在-80℃反复冻融三次以上,使病毒尽量多的释放。
[0157]
7.将143tk-细胞铺在6孔板中,每孔约1
×
106个。培养24小时左右, 直至细胞贴壁并且铺满整个底面。
[0158]
8.反复吹打ep管中的蓝斑,使其完全散开。
[0159]
9.将完全培养基换成维持培养基然后将含有蓝斑的病毒液加入,37℃ 孵箱中孵育3-4小时。
[0160]
10.加入筛选压力:brdu工作浓度为50μg/ml,放入37℃孵箱中孵育 48小时左右,根据病毒斑形成情况进行铺斑。该纯化过程至少需要进行5 次。
[0161]
11.然后进行重组痘苗病毒的小样扩增,铺143tk-细胞于六孔板,每孔 1
×
106个细胞,使用时细胞约为孔板底面积的100%。
[0162]
12.种毒前将孔中的培养基换成2ml维持培养基。将纯化得到的含有 蓝斑的病毒液反复吹打至蓝斑散开。每孔加入100μl左右病毒液。37℃孵 箱中孵育48小时左右,根据病毒斑形成情况收样。
[0163]
13.收样:将孔里的培养基上清小心吸出1ml。用剩下的1ml培养基 将细胞充分吹下,收于ep管中,可以用于后续基因组的提取以及作为毒种 进行扩增。
[0164]
4.3αcd47-αcd3-bite的重组痘苗病毒的扩增与纯化
[0165]
1.vero细胞铺板:10cm皿,每个皿约5
×
106个细胞,保证第二天接 种痘苗病毒时使细胞密度达100%为宜;
[0166]
2.病毒接种前,需将完全培养基换成8ml维持培养基(dmem培养 基+2%fbs+1%ps),将病毒接种到维持培养基的细胞中,接种量约为0.02 moi(moi=病毒pfu/细胞数)。继续在37℃5%co2的孵箱中培养48小时 左右,根据病毒斑形成情况收样;
[0167]
3.收痘苗病毒:弃掉皿内8ml培养基,取用2ml维持培养基将剩余 的细胞吹下,收于15ml离心管中;
[0168]
4.冻存24小时后,将收得的病毒液再反复冻融2次,用36%的蔗糖 溶液进行密度梯度离心,16000g 4℃离心90min,小心倒掉上清,用pbs 缓冲液溶解离心管内的病毒沉淀,分装保存于-80℃,待测定病毒滴度。
[0169]
4.4αcd47-αcd3-bite的重组痘苗病毒的滴度测定
[0170]
1.143tk-细胞的准备:将143tk-细胞铺在24孔板中,每孔约为2
×
105个细胞,使用时细胞密度要达到24孔板底面积的100%;
[0171]
2.稀释病毒,用维持培养基稀释痘苗病毒病毒液,从1:100开始,做 10倍比稀释,终体积为1100μl;
[0172]
3.弃掉24孔板中的完全培养基,取稀释好的病毒液500μl加入孔中, 做两个复孔。37℃5%co2的孵箱中孵育48小时左右,根据病毒嗜斑形成 情况决定铺斑时间;
[0173]
4.铺斑方法:准备8ml含有2
×
dmem培养基+4%fbs+2%ps的铺斑 培养基和8ml沸水浴融化后也置于37℃水浴锅中的低熔点琼脂糖,将二者 混合,再将x-gal加入混合物中,终浓度为200μg/ml,待用;
[0174]
5.吸掉24孔板中的上清。步骤4中的铺斑混合物立刻加入24孔板中, 每孔500μl。然后小心放入4℃冰箱,促进凝固,待低熔点琼脂糖凝固后再 转入37℃孵箱中倒置培养直至出现清晰的蓝斑;
[0175]
6.病毒斑计数:首先观察病毒嗜斑的数目是否呈十倍比的趋势递减, 随后统计种毒的两个复孔中仅有个位数蓝斑的数量,得到的两个孔中蓝斑数 值之和,乘以该孔所对应稀释度的倒数值即为1ml中病毒的滴度。
[0176]
4.5重组痘苗病毒rtv-αcd47-αcd3-bite的表达验证
[0177]
1.收取病毒上清:取10cm培养皿,接种5
×
106个vero细胞/皿,保 证第二天接种痘苗病毒时使细胞密度达100%为宜。病毒接种前,需将完全 培养基换成8ml维持培养基(dmem培养基+2%fbs+1%ps);然后加入 病毒,接种量约为0.02moi(moi=病毒pfu/细胞数)。在37℃5%co2的 孵箱中培养48小时;根据病毒斑形成情况收取细胞上清,10000g离心5分 钟,取上清到新的离心管中。
[0178]
3.将病毒上清进行his标签蛋白纯化:使用注射器人工进行纯化,填充 的镍珠为ni-ntaagarose(qiagen公司,货号30210);装柱完成后用5nm、 10nm的咪唑(溶解在50mm nah2po4·
2h2o,ph 8.0,300mm nacl中) 洗脱非特异吸附的蛋白,自然流速洗脱,收集滤液;然后用20nm、100nm、 200nm、500nm的咪唑(溶解在50mm nah2po4·
2h2o,ph 8.0,300mm nacl 中)进行目的蛋白的洗脱,收集对应的滤液。
[0179]
4.取30μl滤液制样,进行10%sds-page检测,结果如图4b所示。 由5mm咪唑洗脱液到500mm咪唑洗脱液依次进行上样。由图4c所示200 nm的洗脱液中出现目的蛋白,条带大小为54kd左右。
[0180]
实施例5:重组痘苗病毒rtv-αcd47-αcd3-bite的亲和检测
[0181]
1.收取病毒上清:取10cm培养皿,接种5
×
106个vero细胞/皿,保 证第二天接种痘苗病毒时使细胞密度达100%为宜。病毒接种前,需将完全 培养基换成8ml维持培养基(dmem培养基+2%fbs+1%ps);然后加入 病毒,接种量约为0.02moi(moi=病毒pfu/细胞数),同时设置野生型病 毒对照;在37℃5%co2的孵箱中培养48小时;根据病毒斑形成情况收取 细胞上清,10000g离心5分钟,取上清到新的离心管中进行his标签蛋白 纯化。
[0182]
2.his标签蛋白纯化,方法同上。
[0183]
3.cd47-a549细胞的准备:取2
×
106个细胞分到两个ep管中,800g离 心3分钟,弃上清。
[0184]
4.用1ml的预冷清洗液(1
×
pbs+2%fbs)洗涤2遍,800g离心3分 钟,弃上清。
[0185]
5.取适量纯化蛋白与cd47-a549细胞共孵育,室温15分钟。
[0186]
6.用1ml的预冷清洗液洗涤2遍,800g离心3分钟,弃上清。
[0187]
7.每个样品加入0.1μl的pe标记的anti-his抗体,室温15分钟。
[0188]
8.用1ml的预冷清洗液洗涤2遍,800g离心3分钟,弃上清。
[0189]
9.每个样品加入200μl清洗液重悬,采用流式细胞术检测亲和力。
[0190]
图5结果显示,重组有αcd47-αcd3-bite的痘苗病毒表达的细胞上清 与cd47能够结合,与野生型痘苗病毒相比,阳性率为85.9%。挑取阳性克 隆进行传代稳定性测试,挑选出传代稳定性强,高表达目的蛋白的毒株进行 保藏,命名为rtv-αcd47-αcd3-bite,其保藏编号为:cctcc no:
[0191]
v202081,保藏日期为2021年1月2日,保藏地址为中国典型培养物保藏中 心,地址:中国武汉武汉大学。
[0192]
实施例6:αcd47-αcd3-bite的重组痘苗病毒体外抗肺癌效果
[0193]
1.143tk-细胞铺板:将143tk-细胞铺在6孔板中,每孔约为1
×
106个 细胞,使用时细胞密度要达到6孔板底面积的100%;
[0194]
2.病毒接种前将完全培养基换成每孔2ml维持培养基(dmem培养基 +2%fbs+1%ps),并接种病毒到该细胞中,接种量为0.02moi。37℃5%co2的孵箱中孵育48小时左右,根据病毒嗜斑形成情况决定收上清时间。同时 用野生痘苗病毒作为对照;
[0195]
3.分别取上清100μl用来进行后续的a549体外杀伤实验;
[0196]
4.a549细胞体外杀伤实验,按照试剂盒说明操作进行(dojindo公司, 货号ck17);吸取100μl重悬好的a549细胞至96孔板中,每孔细胞为1
×
104个,37℃,5%co2培养过夜。
[0197]
5.第二天,加入上清,37℃,5%co2培养1小时后,按照效靶比5:1 加入t细胞,继续37℃,5%co2培养4小时。
[0198]
6.在高对照孔中加入20μl裂解缓冲液后,在低对照孔和背景孔中加入 20μl培养基,37℃,5%co2培养30分钟。
[0199]
7.从每个孔中吸取100μl上清液至新的96孔板中。
[0200]
8.在每个孔中加入100μl显色液后,避光室温反应5分钟。
[0201]
9.最后在每个孔中加入50μl终止液终止,立即有酶标仪测定490nm 的吸光度。
[0202]
结果如图6所示,相比空白对照组,加载αcd47-αcd3-bite的重组痘 苗病毒在体外能够显著提高对于a549细胞的杀伤,有4倍之多的提升效果。
[0203]
综上所述,αcd47-αcd3-bite蛋白联合t细胞对肿瘤细胞有非常强的 杀伤活性,且制备的重组痘苗病毒rtv-αcd47-αcd3-bite作为溶瘤病毒, 同样能够显著控制人肺癌等多种实体肿瘤,对于肿瘤的治疗有非常高的应用 价值且制备简单,便于大量制备以及推广使用。
[0204]
实施例7:不同结构式的αcd47-αcd3-bite的介导t细胞的体外抗人卵巢腺癌细胞效果
[0205]
为了证明不同结构的αcd47-αcd3-bite蛋白的抗癌效果,申请人分别 设计了如下的bite
[0206]
bite1:vl
αcd47-l-vh
αcd3-l-vl
αcd3-l-vh
αcd47
[0207]
所述vh
αcd47
如seq id no:19所示,所述vl
αcd47
如seq id no:21 所示,所述vh
αcd3
如seq id no:25所示,vl
αcd3
如seq id no:26所示, 并且所述l为ggggsggggsggggs。
[0208]
bite2:vh
αcd47-l-vh
αcd3-l-vl
αcd3-l-vl
αcd47
[0209]
所述vh
αcd47
如seq id no:19所示,所述vl
αcd47
如seq id no:21 所示,所述vh
αcd3
如seq id no:25所示,vl
αcd3
如seq id no:26所示, 并且所述l为ggggsggggsggggs。
[0210]
bite3:vh
αcd47-l-vl
αcd47-l-vh
αcd3-l-vl
αcd3
[0211]
所述vh
αcd47
如seq id no:19所示,所述vl
αcd47
如seq id no:21 所示,所述vh
αcd3
如seq id no:25所示,vl
αcd3
如seq id no:26所示; 一条连接肽为ggggsggggsggggs。
[0212]
bite4:同bite1,仅连接肽更换为gggggg;
[0213]
bite5:同bite1,所述vh
αcd3
如seq id no:27所示,vl
αcd3
如seqid no:28所示。
[0214]
实施例同实施例2和3,结果如图7所示。vl
αcd47-l-vh
αcd3-l-vl
αcd3-l
ꢀ‑
vh
αcd47
其中l为(g4s)3,为αcd47-αcd3-bite的最优设计,能够介导强劲 的杀伤肿瘤细胞功能,变换cd47或者cd3(如克隆号sp34)的抗体克隆 种类,依然保有很强的杀伤功能;
[0215]
vhαcd47-l-vhαcd3-l-vlαcd3-l-vlαcd47其中l为(g4s)3,为 αcd47-αcd3-bite的次优设计,但是仍有跟对照抗体有类似的杀伤肿瘤活 性。
[0216]
上述实施例是示例性的,不能理解为对本发明的限制,本领域的普通技 术人员在本发明的范围内可以对上述实施例进行变化、修改、替换和变型。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1