一种TGFβ1抗原结合分子及其应用的制作方法
cdr3;或所述单可变结构域包含氨基酸序列分别如seq id no:11-13所示的cdr1-cdr3;或所述单可变结构域包含氨基酸序列分别如seq id no:14-16所示的cdr1-cdr3;或所述单可变结构域包含氨基酸序列分别如seq id no:17-19所示的cdr1-cdr3;或所述单可变结构域包含氨基酸序列分别如seq id no:28、9和30所示的cdr1-cdr3;或所述单可变结构域包含氨基酸序列分别如seq id no:29、9和31所示的cdr1-cdr3;或所述单可变结构域包含氨基酸序列分别如seq id no:32、18和34所示的cdr1-cdr3;或所述单可变结构域包含氨基酸序列分别如seq id no:33、18和35所示的cdr1-cdr3。
8.在本发明一较佳实施方案中,所述单可变结构域包含如seq id no:20-27和36-39中任一个所示的氨基酸序列或其变体;其中,所述变体与其所源自的序列相比具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性并至少保持所述tgfβ1抗原结合分子的功能。
9.在本发明一较佳实施方案中,所述tgfβ1抗原结合分子的构型为vhh或hcab。
10.在本发明一较佳实施方案中,所述hcab中的fc为higg1、higg2、higg3、higg4的fc或其突变。优选地,所述fc为higg1的fc。更优选地,所述fc的氨基酸序列如seq id no:1所示。
11.为解决上述技术问题,本发明提供的另一个技术方案为:一种多特异性抗原结合分子,其包含本发明所述的tgfβ1抗原结合分子。
12.为解决上述技术问题,本发明提供的另一个技术方案:一种分离的核酸,其编码如本发明所述的tgfβ1抗原结合分子。
13.为解决上述技术问题,本发明提供的另一个技术方案:一种重组表达载体,其包含如本发明所述的分离的核酸。
14.在本发明一较佳实施方案中,所述重组表达载体为质粒、粘粒、噬菌体、病毒载体或哺乳动物载体,所述病毒载体优选逆转录病毒载体、慢病毒载体、腺病毒载体或腺相关病毒载体,所述哺乳动物载体例如pcdna3.4。
15.为解决上述技术问题,本发明提供的另一个技术方案:一种转化体,其包含如本发明所述的重组表达载体。优选地,所述转化体的宿主细胞为原核细胞或真核细胞。更优选地,所述真核细胞为酵母细胞或哺乳动物细胞;其中,所述哺乳动物细胞例如为hek293细胞或cho细胞。
16.为解决上述技术问题,本发明提供的另一个技术方案:一种tgfβ1抗原结合分子或多特异性抗原结合分子的制备方法,其包含以下步骤:
17.培养如本发明所述的转化体,从培养物中获得所述tgfβ1抗原结合分子或所述多特异性抗原结合分子。
18.为解决上述技术问题,本发明提供的另一个技术方案:一种药物组合物,其包含如本发明所述的tgfβ1抗原结合分子和/或如本发明所述的多特异性抗原结合分子,以及药学上可接受的载体。
19.在本发明一较佳实施方案中,所述药物组合物还包含由激素制剂、靶向小分子制剂、蛋白酶体抑制剂、成像剂、诊断剂、化疗剂、溶瘤药物、细胞毒性剂、细胞因子、共刺激分子的激活剂、抑制性分子的抑制剂以及疫苗组成的群组中的一种或多种。
20.为解决上述技术问题,本发明提供的另一个技术方案:如本发明所述的tgfβ1抗原
结合分子、如本发明所述的多特异性抗原结合分子和/或如本发明所述的药物组合物在制备诊断、预防和/或治疗癌症的药物中的应用。优选地,所述癌症可选自下组中的一个:结直肠癌、乳腺癌、卵巢癌、胰腺癌、胃癌、前列腺癌、肾癌、宫颈癌、骨髓瘤、淋巴瘤、白血病、甲状腺癌、子宫癌(优选子宫内膜癌)、膀胱癌、神经内分泌肿瘤、头部颈部癌、肝癌、鼻咽癌、睾丸癌、小细胞肺癌、非小细胞肺癌、黑素瘤、基底细胞皮肤癌、鳞状细胞皮肤癌、隆突性皮肤纤维肉瘤、梅克尔细胞癌、成胶质细胞瘤、胶质瘤、肉瘤、间皮瘤和骨髓增生异常综合征。
21.为解决上述技术问题,本发明提供的另一个技术方案:一种试剂盒,其包括如本发明所述的tgfβ1抗原结合分子、如本发明所述的多特异性抗原结合分子和/或如本发明所述的药物组合物。
22.在本发明一较佳实施方案中,所述试剂盒还包括(i)施用所述tgfβ1抗原结合分子或药物组合物的装置;和/或(ii)使用说明。
23.为解决上述技术问题,本发明提供的另一个技术方案:一种套装药盒,其包含药盒a和药盒b,其中:
24.所述药盒a含有如本发明所述的tgfβ1抗原结合分子、如本发明所述的多特异性抗原结合分子和/或如本发明所述的药物组合物;
25.所述药盒b含有其他抗肿瘤抗体或者包含所述其他抗肿瘤抗体的药物组合物,和/或由激素制剂、靶向小分子制剂、蛋白酶体抑制剂、成像剂、诊断剂、化疗剂、溶瘤药物、细胞毒性剂、细胞因子、共刺激分子的激活剂、抑制性分子的抑制剂以及疫苗组成的群组中的一种或多种。
26.为解决上述技术问题,本发明提供的另一个技术方案:一种免疫检测或者测定tgfβ1的方法,其包括使用如本发明所述的tgfβ1抗原结合分子、如本发明所述的多特异性抗原结合分子和/或如本发明所述的药物组合物。优选地,所述检测为非诊断和/或治疗目的的检测。
27.定义
[0028]“互补决定区”或“cdr区”或“cdr”是抗体可变结构域中在序列上高变并且形成在结构上确定的环(“超变环”)和/或含有抗原接触残基(“抗原接触点”)的区域。cdr主要负责与抗原表位结合,从n-端开始顺序编号依次包括cdr1、cdr2和cdr3。在一个给定的可变区氨基酸序列中,各cdr的精确氨基酸序列边界可以使用许多公知的抗体cdr指派系统的任一种或其组合确定,所述指派系统包括例如:基于抗体的三维结构和cdr环的拓扑学的chothia(chothia等人.(1989)nature 342:877-883,al-lazikani等人,“standard conformations for the canonical structures of immunoglobulins”,journal of molecular biology,273,927-948(1997)),基于抗体序列可变性的kabat(kabat等人,sequences of proteins of immunological interest,第4版,u.s.department of health and human services,national institutes of health(1987)),abm(university of bath),contact(university college london),国际immunogenetics database(imgt)(http://imgt.cines.fr/),以及基于利用大量晶体结构的近邻传播聚类(affinity propagation clustering)的north cdr定义。除非另有说明,否则在本发明中,术语“cdr”或“cdr序列”涵盖以上述任一种方式确定的cdr序列。cdr也可以基于与参考cdr序列(例如本发明示例的cdr之任一序列)具有相同的abm编号位置而确定。在一个实施方案中,本发明的单可变结构
域的cdr根据abm编号方案确定位置。除非另有说明,否则在本发明中,当提及抗体可变区和cdr中的残基位置(包括单可变结构域残基)时,是指根据abm编号系统的编号位置。
[0029]
具有不同特异性(即,针对不同抗原的不同结合位点)的抗体具有不同的cdr。然而,尽管cdr在抗体与抗体之间是不同的,但是cdr内只有有限数量的氨基酸位置直接参与抗原结合。使用kabat、chothia、imgt、abm和contact方法中的至少两种,可以确定最小重叠区域,从而提供用于抗原结合的“最小结合单位”。最小结合单位可以是cdr的一个子部分。正如本领域技术人员明了,通过抗体的结构和蛋白折叠,可以确定cdr序列其余部分的残基。因此,本发明也考虑本文所给出的任何cdr的变体。例如,在一个cdr的变体中,最小结合单位的氨基酸残基可以保持不变,而根据kabat或chothia或abm定义的其余cdr残基可以被保守氨基酸残基替代。
[0030]
如本文所用,“免疫球蛋白单可变结构域”或者“单可变结构域”或者“单结构域抗体”是指具有抗原结合活性的单个可变区(可变结构域)。不同于常规抗体中由一对vh和vl组成功能性抗原结合单位,单可变结构域可以独自形成功能性抗原结合单位。单可变结构域可以衍生自天然存在的无轻链抗体,例如骆驼科动物(如骆驼和羊驼)的重链抗体的可变结构域(variable domain of heavy chain of heavy-chain antibody,vhh)和鲨鱼的新抗原受体的单可变结构域(ignar variable single-domain,vnar),也可以从全长抗体中筛选得到,例如人抗体中具有抗原结合活性的轻链可变结构域和重链可变结构域。vhh通常包含三个高度可变的“互补决定区(cdr)”和四个相对保守的“框架区(fr)”,并且从n端至c端以fr1-cdr1-fr2-cdr2-fr3-cdr3-fr4的次序连接,也称为“纳米抗体(nanobody)”。
[0031]“重链抗体(heavy-chain antibody,hcab)”是指不具有轻链的抗体,从n端到c端可以包含vh-ch2-ch3,或包含vh-ch1-ch2-ch3,或包含vhh-ch2-ch3等;可以构成同型二聚体,例如不具有轻链的重链二聚体抗体。重链抗体中可以包含来自标准抗体的vh或者来自单结构域抗体的vhh。在一个实施方案中,本发明的重链抗体包含单结构域抗体的vhh。
[0032]
如本文所用,“嵌合抗体”指这样的抗体,其中的一部分(例如cdr、fr、可变区、恒定区或其组合)与衍生自特定物种的抗体中相应序列相同或同源,剩余的部分与衍生自另一物种的抗体中相应序列相同或同源。在本发明的一些实施方案中,嵌合抗体包含衍生自非人物种(例如骆驼科动物,例如骆驼和羊驼)的可变区以及衍生自不同物种(例如人)的恒定区。嵌合抗体还可指对至少两种不同抗原具有特异性的多特异性抗体。嵌合抗体可以通过抗体工程化产生。抗体工程化的方法是本领域技术人员公知的。特别地,可以通过dna重组技术生成嵌合抗体(例如参见sambrook,j.,et al.(1989).molecular cloning:a laboratory manual,2nd ed.cold spring harbor laboratory,cold spring harbor,n.y)。
[0033]
如本文所用,术语“人源化抗体”是指非人抗体经修饰以增加与人抗体的序列同源性的抗体。人源化抗体通常保留其所源自的非人抗体的抗原结合能力并且对于人体具有较低的免疫原性。人源化抗体可以通过抗体工程化改造任何非人物种抗体或其中包含非人物种来源序列的抗体(例如嵌合抗体)来获得。由非人抗体获得人源化抗体的技术是本领域技术人员熟知的,例如,可以将非人抗体(例如驼源抗体)的cdr序列移植到人抗体框架区中。在某些情况下,为了保持人源化抗体的抗原结合能力和/或稳定性,可以在人抗体框架区中保留非人抗体(例如驼源抗体)框架序列的关键氨基酸残基,即进行“回复突变”(参见,例如
morrison et al.(1984)proc.natl.acad.sci.81(21):6851-6855;neuberger et al.(1984)nature 312:604-608)。
[0034]
如本文所用,氨基酸序列的“百分比(%)序列同一性”、“序列同一性”具有本领域公认的定义,其指通过序列比对(例如通过人工检视或可公知的算法)确定的两个多肽序列之间相同的百分比。可以使用本领域技术人员已知的方法确定,例如使用可公开获得的计算机软件如blast、blast-2、clustal omega和fasta软件。
[0035]
可以修饰多肽中的非关键区域(例如抗体cdr区和框架区的非关键氨基酸以及恒定区的氨基酸),例如进行一个或多个氨基酸的取代、添加和/或缺失,而不改变多肽的功能。这类相对于参考氨基酸序列(例如单可变结构域)修饰的多肽,可以称作参考氨基酸序列的“变体”。参考氨基酸序列的变体可以与其所源自的序列(即参考氨基酸序列)具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性,或者与其所源自的序列相比具有一个或多个(例如,1、2、3、4、5、6、7、8、9或10个)氨基酸的取代、添加和/或缺失。优选地,所述取代为保守取代。本领域技术人员应当理解多肽中非关键区域中的氨基酸可以用合适的保守氨基酸取代,并且一般不改变其生物活性(参见,例如watson et al.,molecular biology of the gene,4th edition,1987,the benjamin/cummings pub.co.,p.224)。合适的保守取代是本领域技术人员熟知的。在下表中列出一些常见的氨基酸残基保守取代的非限制性实例。在某些情况下,氨基酸取代是非保守取代。本领域技术人员应当理解,可以对多肽进行氨基酸突变或修饰来改变其性能,例如改变抗体糖基化修饰的类型,改变形成链间二硫键的能力,或者为抗体缀合物的制备提供活性基团。包含这类氨基酸突变或修饰的抗体或其抗原结合片段也涵盖在本发明的抗体或其抗原结合片段的范围之内。
[0036]
如本文所用,术语“多特异性抗原结合分子”是指能够特异性结合两种或更多种(例如2、3、4、5或6种)不同抗原表位的抗原结合分子。例如是双特异性、三特异性或四特异性抗原结合分子,其分别能够特异性结合2、3或4种抗原表位。如本文所用,术语“抗原表位”或“抗原决定簇”表示抗原中与抗体的抗原结合位点特异性结合的区域。
[0037]
如本领域已知,在本发明中可交换使用的“多核苷酸”或“核酸”是指任何长度的核苷酸链,并且包括dna和rna。核苷酸可以是脱氧核糖核苷酸、核糖核苷酸、修饰的核苷酸或碱基、和/或它们的类似物、或者能够通过dna或rna聚合酶掺入链的任何底物。
[0038]
如本发明所用,“载体”表示构建体,其能够将一种或多种所关注的基因或序列递送入宿主细胞并且优选在宿主细胞中表达所述基因或序列。载体的实例包括但不限于病毒载体、裸dna或rna表达载体、质粒、粘粒或噬菌体载体、与阳离子凝聚剂相关的dna或rna表达载体、包囊化于脂质体中的dna或rna表达载体以及某些真核细胞,例如生产细胞。
[0039]
在本发明中术语“宿主细胞”可包括已经引入外源性核酸的细胞,包括这些细胞的子代。宿主细胞包括“转化子”和“转化的细胞”,其包括原代转化细胞以及由此来源的子代,而不考虑传代次数。子代在核酸含量上与亲代细胞可能不完全相同,但可能含有突变。本发明包括与在初始转化的细胞中筛选或选择的细胞具有相同功能或生物学活性的突变子代。
[0040]
术语“药物组合物”表示含有一种或多种本公开的tgfβ1抗原结合分子作为活性组分与其他化学组分的混合物,所述其他组分例如生理学/可药用的载体或赋形剂。药物组合物的目的是促进对生物体的给药,利于活性成分的吸收进而发挥生物活性。
[0041]
术语“药学可接受的载体”指药用组合物中除了活性组分以外,对受试者无毒的组分。药学可接受赋形剂包括但不限于缓冲剂,稳定剂和/或防腐剂。
[0042]
本发明的“套装药盒”以本领域技术人员已知的方式使用,并且被定义为第一活性成分(药盒a)和第二活性成分(药盒b)存在于多于一个单位中的组合。套装药盒的一个实例是其中第一活性成分和第二活性成分单独地存在的组合。套装药盒的组分可以分开、依序、同时(simultaneously)、同时(concurrently)或按时间顺序交错给药。可以将本发明的tgfβ1抗原结合分子作为单一药剂给药或者与一种或多种其它药剂组合给药,其中所述组合不会引起不可接受的不良反应。
[0043]
在符合本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。
[0044]
本发明所用试剂和原料均市售可得。
[0045]
本发明的积极进步效果在于:
[0046]
本发明提供的tgfβ1抗原结合分子对人tgfβ1以外的tgfβ亚型几乎没有结合能力,对tgfβ1的结合能力高,具有阻断tgfβr2和tgfβ1结合的活性,以及中和tgfβ1-smad3信号通路的活性,与现有抗体(如gc1008和m7824)相比具有相当或更好的效果。
附图说明
[0047]
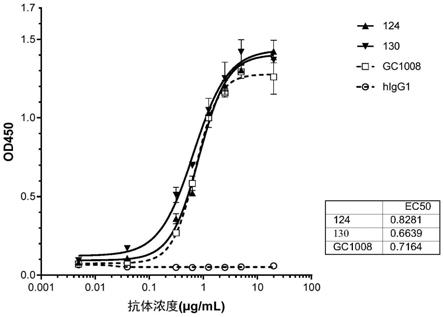
图1a-1c显示候选嵌合抗体在elisa水平与重组人tgfβ1的亲和活性。
[0048]
图2a-2b显示候选嵌合抗体在elisa水平与重组人前体tgfβ1(latent tgfβ1)的亲和活性。
[0049]
图3a-3b显示候选嵌合抗体在elisa水平与重组小鼠tgfβ1的亲和活性。
[0050]
图4显示候选嵌合抗体对在elisa水平与重组人tgfβ2的亲和活性。
[0051]
图5显示候选嵌合抗体在elisa水平对重组人tgfβ3的亲和活性。
[0052]
图6显示候选嵌合抗体在elisa水平阻断tgfβ1和hutgfβr2-fc结合的活性。
[0053]
图7a-7b显示候选嵌合抗体在facs水平阻断tgfβ1和hutgfβr2-cho细胞结合的活性。
[0054]
图8a-8b显示候选嵌合抗体的中和tgfβ1信号通路并抑制细胞因子il11的活性。
[0055]
图9显示候选嵌合抗体中和tgfβ2-smad3信号通路的活性。
[0056]
图10显示候选嵌合抗体中和tgfβ3-smad3信号通路的活性。
[0057]
图11a-11b显示改造后分子在facs水平上阻断人tgfβ1结合hutgfβr2-cho的活性。
[0058]
图12a-12d显示改造后分子中和tgfβ1-smad3信号通路的活性。
具体实施方式
[0059]
下面通过实施例的方式进一步说明本发明,但并不因此将本发明限制在所述的实施例范围之中。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。
[0060]
实施例1原材料的制备
[0061]
1.1融合蛋白hutgfβr2-fc制备
[0062]
根据uniprot数据库提供的序列合成人tgfβr2胞外区(uniprot编号p37173第23
–
166位),将编码所示的人tgfβr2胞外区的基因序列的c端连接至人igg1 fc段(如seq id no:1所示),然后构建至真核表达载体pcdna3.4(invitrogen)中。将获得的表达载体采用expicho瞬转表达系统(gibco,a29133)进行表达,所得上清经0.22μm过滤后采用protein a/g亲和纯化方法进行纯化,然后用100mm甘氨酸盐(ph3.0)洗脱获得质检合格的hutgfβr2-fc融合蛋白。
[0063]
1.2阳性抗体制备
[0064]
本实施例中制备的阳性对照抗体gc1008(抗体序列参见us20170342144 a1)和m7824(merck,由针对pd-l1的人igg1单克隆抗体融合至tgf-βrii(充当tgfβ“陷阱”)的胞外域组成的双功能融合蛋白,抗体序列参见cn106103488b)。通过分子克隆方法构建出包含完整抗体轻链和重链基因的质粒。然后采用瞬转系统(expicho)进行表达,其中,用到的主要材料包括:gibco培养基(货号:a29100-01),gibco转染试剂盒(货号:a29129)。然后采用protein a/g亲和层析柱亲和法进行纯化获得阳性对照抗体gc1008和m7824。
[0065]
1.3过表达细胞株制备
[0066]
1.3.1 hutgfβr2-cho细胞株的构建
[0067]
通过基因合成技术合成编码hutgfβr2蛋白(uniprot id p37173)的dna片段(通用生物系统(安徽)有限公司),并将其克隆至表达载体plvx-puro(clontech,632164)。通过转化的方法导入大肠杆菌ss320,挑取大肠杆菌单克隆后测序得到正确的质粒克隆,进行质粒抽提并再次测序确认。电转前一天,将cho-s细胞传代至5
×
105个/ml,次日使用电转试剂盒(invitrogen,mpk10096)和电转仪(invitrogen,neon
tm transfection system,mp922947)将构建好的质粒导入细胞中。将电转后的细胞移至含10%fbs的dmem培养基中,放置于37℃细胞培养箱中培养48h。然后按1500-4000个细胞/孔铺到96孔板中,加入终浓度2μg/ml嘌呤霉素(gibco,a1113803)加压筛选。挑取96孔板中长出的细胞克隆,转移至24孔培养板中继续扩大培养,之后通过facs方法,利用实施例1.2制得的阳性对照抗体gc1008鉴定人tgfβr2稳定转化成功的细胞株。
[0068]
1.3.2 hutgfr2/sbe/hek293细胞株的构建
[0069]
smad3反应原件报告系统质粒为pgl4.48[luc2p/sbe/hygro](promega,e3671),通过基因合成技术合成含有hutgfβr2蛋白(uniprot id p37173)的dna片段,并将其克隆至表达载体。通过化转的方法导入大肠杆菌,挑取大肠杆菌单克隆后测序得到正确的质粒克隆,进行质粒抽提并再次测序确认。电转前一天,将hutgfβr2-hek293传代使得细胞汇合度达到50%,与实施例1.3.1一样的方式电转,加入终浓度250μg/ml潮霉素(gibco,10687010),放置于37℃二氧化碳培养箱中培养,14d后补充加入含2μg/ml嘌呤霉素和250μg/ml潮霉素的dmem培养基。挑取96孔板中长出的单细胞克隆,转移至24孔培养板中继续扩大培养,之后通过重组人tgfβ1(sino biological,10804-h08h1)鉴定人hutgfr2/sbe/hek293稳转成功的细胞株。
[0070]
实施例2动物免疫和血清免疫效价检测
[0071]
采用重组人tgfβ1(购自sino biological,货号为10804-h08h1)作为抗原免疫1只羊驼(南昌大佳科技),每2周免疫一次,共免疫4次,每只羊驼每次免疫500μg抗原,辅以cfa(完全弗氏佐剂)。待羊驼免疫结束后取羊驼血清进行免疫效价检测。免疫效价测定是通过elisa方法测定免疫血清针对重组人tgfβ1的结合能力,并根据结合抗原的抗体效价进行免
疫效果的判定。
[0072]
具体方法如下:在免疫效价测定的前一天,将重组人tgfβ1用pbs稀释至终浓度2μg/ml,获得稀释液。取30μl稀释液加入到elisa板中,4℃包被过夜。在免疫效价测定当日,包被板用pbst润洗三遍,然后用含有5%脱脂奶粉的pbst室温封闭2h,再用pbst润洗三遍。在另外一块96孔稀释板上将未经免疫接种的阴性血清和免疫后血清用pbs进行稀释,首孔100倍稀释,然后后续7个孔采用2倍梯度稀释。将稀释好的血清加到包被了重组人tgfβ1的第一块elisa板中,室温孵育2h。pbst洗板三次后,以1:10000加入anti-vhh-hrp(genescript,a01861-200),室温孵育1h。孵育完成后,pbst洗板六次,加tmb(surmodics,tmbs-1000-01)显色,根据显色结果,加入2m hcl终止反应,通过酶标仪(molecular devices,spectermax 190)在od450波长处读取od值。结果显示免疫4次的血清效价达到了12800,可用于下一步的羊驼外周血免疫抗体库构建。
[0073]
实施例3羊驼免疫文库构建及初步筛选
[0074]
3.1文库构建
[0075]
动物免疫结束后,取羊驼新鲜血液50ml,通过ficoll-paque密度梯度分离液(ge,17144003s)分离外周血单个核细胞(peripheral blood mononuclear cell,pbmc),将分离的pbmc细胞提取rna,通过反转录试剂盒(takara,6210a)将提取的rna反转录成cdna。基于vhh抗体胚系基因(germline)的情况,设计简并引物通过pcr扩增并用琼脂糖凝胶电泳回收pcr产物后获得编码vhh-ch2的dna片段。然后以回收的dna片段产物为模板扩增所有的vhh基因,最后通过双酶切和连接将目的抗体基因片段插入至噬菌体展示用载体上。连接产物通过回收试剂盒(omega,d6492-02)回收,最后通过电转仪(bio-rad,micropulser)转化至感受态大肠杆菌ss320(lucigen,mc1061f)中,并涂布于含有氨苄抗性的2-yt固体平板,构建抗人tgfβ1单域抗体文库。
[0076]
通过梯度稀释铺板,测定此文库库容量为1.8
×
109cfu。采用辅助噬菌体m13ko7(neb)对抗人tgfβ1单域抗体文库进行包装,得到抗人tgfβ1单域抗体文库对应的噬菌体文库。
[0077]
3.2噬菌体文库磁珠法筛选
[0078]
将生物素标记的重组人tgfβ1和卵白素偶联的磁珠(thermo fisher,11205d)一起孵育,使得重组人tgfβ1结合于磁珠上。将结合有抗原tgfβ1的磁珠和上文3.1制备的具有单域抗体展示的噬菌体文库室温孵育2h,经pbst洗涤6-8次后,去除非特异性吸附的噬菌体,加入胰蛋白酶(gibco)轻轻混匀20min,以洗脱特异性结合重组人tgfβ1的单域抗体展示噬菌体。接着将洗脱的噬菌体侵染对数期的ss320菌体(lucigen,mc1061 f),并将噬菌体侵染的ss320菌体涂布于50μg/ml羧苄青霉素抗性平板,37℃过夜培养,第二天收集菌体。采用ss320菌体制备噬菌体,用于下一轮的筛选。如此反复,并对每轮随机挑选的10个克隆进行序列分析。
[0079]
3.3单克隆筛选
[0080]
挑取磁珠法筛选获得的第一轮和第二轮产物中的阳性噬菌体库分别进行单克隆筛选。具体方法如下:单克隆筛选前一天将重组人tgfβ1(sinobiological,10804-h08h1)包被到96孔elisa板上,第二天于96孔板中制备噬菌体上清。通过噬菌体elisa筛选针对重组人tgfβ1的阳性克隆,然后挑取所有阳性克隆测序分析,将序列唯一的克隆制备裂解液,制
备方法如下:将序列唯一的克隆的菌液以1:100接种至50ml 2-yt培养基中,37℃恒温摇床振荡培养14h,10000g常温离心5min,使用1ml ph 9.0含有benzonase核酸酶的tris-hcl缓冲液重悬细菌,冰上裂解30min,4℃10000g离心10min,收集上清即得到阳性克隆裂解液。
[0081]
将制备好的阳性克隆裂解液进行elisa亲和检测。具体方法如下:在96孔elisa板上,包被2μg/ml重组人tgfβ1,4℃孵育过夜。次日,将孔板用pbst清洗3次,加入5%脱脂牛奶封闭2h。随后,将孔板用pbst清洗3次后,加入梯度稀释的阳性克隆裂解液,孵育1h。随后,将孔板用pbst清洗3次,加入1:8000稀释的rabbit anti-camelid-vhh-hrp(genescript,a01861-200),孵育1h。随后,将孔板用pbst清洗6次,加tmb(surmodics,tmbs-1000-01)并避光显色5-10min,根据显色情况,加入2m的hcl终止反应。通过酶标仪(molecular devices,spectermax 190)读取od450下的数值并采用四参数拟合。
[0082]
最终选取的阳性克隆裂解液与重组人tgfβ1的结合展现出剂量依赖的结合效应。以克隆号分别对这6个候选嵌合抗体进行命名,采用abm定义cdr的方式,确定了重链可变区单域抗体(vhh)的互补决定区序列,具体氨基酸序列如表1所示。
[0083]
表1候选嵌合抗体的cdr序列
[0084][0085]
实施例4候选嵌合抗体的产生和表达
[0086]
将实施例3筛选获得的vhh与人igg1 fc段(如seq id no:1所示)融合,其中将所述vhh基因序列的c端连接到人igg1 fc段基因序列的n端来构建vhh-fc嵌合抗体的表达载体pcdna3.4(invitrogen)。通过expicho瞬转表达系统(gibco,a29133)表达,将表达有目的蛋白的细胞培养上清于15000g高速离心10min,所得上清用mabselect sure lx(ge,17547403)进行亲和纯化,然后用100mm乙酸钠(ph3.0)洗脱目的蛋白,接着用1m tris-hcl中和,最后通过超滤浓缩管(millipore,ufc901096)将所得蛋白置换至pbs缓冲液中得到候选嵌合抗体。纯化后,用100mm甘氨酸盐(ph3.0)洗脱目的蛋白,浓缩,置换,分装入库冻存。
[0087]
实施例5候选嵌合抗体的理化性质
[0088]
5.1候选嵌合抗体亲和力检测
[0089]
在本实施例中,采用fortebio octet red96仪器,检测了候选嵌合抗体与人tgfβ1的亲和力。称取1g的bsa,量取500μl的tween 20,加入到1000ml的1
×
pbs,混匀。过滤后分装保存。吸取0.1ml 0.1m ph=2.0的甘氨酸溶液加入0.9ml的超纯水,混匀。抗体以kb buffer稀释成10μg/ml,抗原(重组人tgfβ1)以kb buffer稀释成系列浓度梯度,依次为200、50、12.5、0nm。避光预湿传感器(protein a sensor,gator,20-5006)至少10min后开始测试样
品板(greinierbio,pn655209),测试无误后按预设程序进行。首先将抗体和传感器进行结合120s,结合完毕在10
×
kb缓冲液中继续平衡30s后,将结合有抗体的传感器转移至不同浓度抗原稀释液中结合120s,待信号稳定后,再转移到10
×
kb缓冲液中,解离时间为120s,最后通过不同浓度抗抗原的结合解离数据拟合得到kd(亲和力动力学常数)、kon(结合常数)和koff(解离常数),kon可写成ka,koff可写成kd。
[0090]
检测结果见表2,结果显示嵌合抗体124具有与阳性对照gc1008相当的kd和kd。
[0091]
5.2候选嵌合抗体的sec-hplc单体纯度鉴定
[0092]
材料准备:1、流动相:150mmol/l磷酸缓冲液,ph 7.4;2、样品制备:候选嵌合抗体均用流动相溶液稀释到0.5mg/ml。agilent hplc 1100色谱柱(xbridge beh sec 3.5μm,7.8mm i.d.
×
30cm,waters)流速设为0.8ml/min,进样体积20μl,vwd检测器波长为280nm和214nm。
[0093]
本实施例的嵌合抗体的尺寸排阻高效液相色谱法(sec-hplc)结果如下:按照面积归一法计算样品中高分子聚合物、候选嵌合抗体单体和低分子物质百分比,结果显示在表2中。
[0094]
5.3候选嵌合抗体的sds-page单体纯度鉴定
[0095]
非还原(非变性)sds-page样品准备:将1μg的候选嵌合抗体或质控品ipi(即伊匹木单抗(ipilimumab),通过实施例4的方法制备获得)加入5
×
sds上样缓冲液(含有终浓度为40mm的碘代乙酰胺)中,75℃干浴加热10min,冷却到室温后,12000rpm离心5min,取上清。还原(变性)sds-page样品准备:将2μg的候选嵌合抗体或质控品ipi加入5
×
sds上样缓冲液(含有终浓度为5mm的dtt)中,100℃干浴加热10min,冷却到室温后,12000rpm离心5min,取上清。将上清加入bis-tris 4-15%梯度胶(金斯瑞)进行凝胶电泳并通过考马斯亮蓝染色使蛋白条带显色。使用epson v550彩色扫描仪扫描带有显色蛋白条带的蛋白凝胶(脱色液脱色至凝胶背景透明),通过image j按照峰面积归一法计算还原条带纯度,结果显示在表2中。
[0096]
表2候选嵌合抗体的理化性质
[0097][0098][0099]
实施例6候选嵌合抗体的亲和活性验证
[0100]
6.1基于elisa检测候选嵌合抗体对tgfβ1的亲和活性
[0101]
对获得的候选嵌合抗体进行了elisa水平的亲和活性的验证。具体方法如下:在96孔elisa板上,分别包被2μg/ml重组人tgfβ1(sinobiological,10804-h08h1)、重组小鼠tgf
β1(近岸蛋白,ck33)或重组人前体tgfβ1(acro,tg1-h82qb),4℃孵育过夜;次日,将孔板用pbst清洗3次,加入5%脱脂牛奶封闭2h;随后,将孔板用pbst洗涤3次后,加入梯度稀释的候选嵌合抗体和阳性对照抗体gc1008或m7824孵育1h;孵育结束后将孔板用pbst洗涤3次,加入1:4000稀释的山羊抗人goat-anti-human-igg-fc-hrp(abcam,ab97225)孵育1h;随后,将孔板用pbst洗涤6次,加tmb(surmodics,tmbs-1000-01)并避光显色5-10min,根据显色情况,加入2m的hcl终止反应。通过酶标仪(molecular devices,spectermax 190)读取od450下的数值并采用四参数拟合。
[0102]
结果如下:在elisa水平上的与重组人tgfβ1的亲和活性结果见图1a-1c,可见候选嵌合抗体具有接近甚至优于阳性对照抗体gc1008的亲和人tgfβ1的活性;在elisa水平上的与重组人前体tgfβ1的亲和活性结果见图2a-2b,可见候选嵌合抗体具有接近甚至优于阳性对照抗体gc1008的亲和重组人前体tgfβ1的活性;在elisa水平上的与重组小鼠tgfβ1的亲和活性结果见图3a-3b,可见嵌合抗体124、130和107具有接近甚至优于阳性对照抗体m7824的亲和重组小鼠tgfβ1的活性。
[0103]
6.2基于elisa检测候选嵌合抗体对重组人tgfβ2和tgfβ3的亲和活性
[0104]
对获得的候选嵌合抗体进行了elisa水平的亲和人tgfβ2和人tgfβ3活性的验证。具体方法如下:在96孔elisa板上,分别包被2μg/ml的anti-fd抗体(southern,2046-01),4℃孵育过夜;次日,将孔板用pbst清洗3次,加入5%脱脂牛奶封闭2h;随后,将孔板用pbst洗涤3次后,加入梯度稀释的候选嵌合抗体和阳性对照抗体gc1008、m7824孵育1h;孵育结束后将孔板用pbst洗涤3次,加入2μg/ml生物素化重组人tgfβ2(近岸蛋白,cj79)或重组人tgfβ3(近岸蛋白,cj44)室温孵育1h;孵育结束后将孔板用pbst洗涤3次,加入1:5000稀释的neutr avindin-hrp,室温孵育50min,随后,将孔板用pbst洗涤6次,加tmb(surmodics,tmbs-1000-01)并避光显色5-10min,根据显色情况,加入2m的hcl终止反应。通过酶标仪(molecular devices,spectermax 190)读取od450下的数值并采用四参数拟合。
[0105]
候选嵌合抗体在elisa水平亲和人tgfβ2结果见图4所示,候选嵌合抗体亲和人tgfβ3结果见图5所示。可见,候选嵌合抗体在elisa水平上没有结合人tgfβ2和人tgfβ3的活性。
[0106]
实施例7候选嵌合抗体阻断tgfβr2和tgfβ1结合的活性
[0107]
7.1 elisa方法检测候选嵌合抗体阻断hutgfβr2-fc和tgfβ1结合的活性
[0108]
采用elisa方法检测候选嵌合抗体是否阻断tgfβ1与hutgfβr2-fc的结合,具体方法如下:30μl/孔包板0.5μg/ml重组人tgfβ1,4℃过夜。次日,将孔板用pbst洗3次后用5%脱脂牛奶封闭2h。然后分别将候选嵌合抗体或阳性对照抗体gc1008梯度稀释,稀释好的抗体与1μg/ml生物素标记的hutgfβr2-fc提前预混30min,30μl/孔加至96孔elisa板中,孵育1h。之后,用pbst清洗3次后加入二抗neutr avidin-hrp(therofisher,31001)并孵育1h。孵育完成后,pbst洗板六次,加tmb(surmodics,tmbs-1000-01)显色,根据显色结果,加入2m hcl终止反应,通过酶标仪(molecular devices,spectermax 190)在od450下读板。
[0109]
结果显示在图6,结果表明,候选嵌合抗体拥有接近甚至优于gc1008的阻断tgfβ1和hutgfβr2-fc结合的活性。
[0110]
7.2 facs方法检测候选嵌合抗体阻断hutgfβr2-cho和tgfβ1结合的活性
[0111]
采用facs方法检测候选嵌合抗体是否阻断tgfβ1与hutgfβr2-cho的结合,具体方法如下:将hutgfβr2-cho细胞密度调整为2
×
106个/ml,以每孔100μl加入96孔圆底板中,
300g离心去上清,将候选嵌合抗体、阳性对照抗体gc1008稀释液分别和0.5μg/ml生物素标记的重组人tgfβ1室温孵育1h,并加至铺满hutgfβr2-cho的96圆底板中,4℃孵育30min。用facs缓冲液清洗2次后加入二抗streptavidin pe(ebioscience,12-4317-87),并孵育1h。将孵育后的细胞混合液洗涤3次后加入200μl的facs缓冲液重悬细胞,最后通过流式细胞仪(beckman,cytoflex aoo-1-1102)上机检测。
[0112]
通过数据分析结果显示在图7a-7b中,结果表明,嵌合抗体130阻断tgfβ1和hutgfβr2-cho细胞结合的活性显著优于gc1008。
[0113]
实施例8候选嵌合抗体抑制tgfβ1诱导分泌il-11活性的方法检测
[0114]
在本实施例中,tgfβ1可与a549细胞结合刺激a549分泌il-11,抗体中和tgfβ1蛋白,使得与a549结合的tgfβ1量减少,从而降低il-11分泌,因此,可以通过il-11试剂盒(r&d,dy218)检测il-11的释放量来反应抗体的中和活性。
[0115]
具体方法如下:将a549细胞(ccl-185
tm
)密度调整为2
×
105个/ml,每孔中加入100μl细胞,轻轻拍打混匀,将96孔细胞培养板放入37℃细胞培养箱中孵育16-20h。然后用培养基(dmem+10%fbs)配制重组人tgfβ1(8ng/ml)溶液和抗体,将两者等体积混合后37℃孵育1h,使得孵育的终浓度为13.5nm。从稀释板中取100μl混合液加入到细胞板中,轻轻拍打混匀,放入细胞培养箱培养24h。之后取30μl的细胞上清做il-11分泌检测。
[0116]
本实施例结果显示在图8a-8b中,结果表明,嵌合抗体124和130的中和效果与gc1008高度相似。
[0117]
实施例9荧光素酶报告基因法检测候选嵌合抗体对tgfβ2/tgfβ3的中和活性
[0118]
在本实施例中,基于hutgfr2/sbe/hek293细胞报告系统检测抗体对tgfβ2/tgfβ3的中和活性,基本原理为tgfβ2/tgfβ3与tgfβr2结合会招募并磷酸化tgfβr2,接着导致包括smad3在内的smad蛋白磷酸化,磷酸化smad3与其反应原件结合导致下游荧光素酶基因表达,bright-lite(vazyme,货号:dd1204-03)可以检测荧光素酶表达量,抗体中和tgfβ2/tgfβ3会降低磷酸化smad3介导的荧光素酶表达,因此,该检测方法可以用来反映抗体对tgfβ2/tgfβ3的中和活性。
[0119]
将hutgfr2/sbe/hek293细胞密度调整为2
×
105个/ml,每孔中加入50μl细胞,轻轻拍打混匀。然后用培养基(dmem+10%fbs)配制重组人tgfβ2或tgfβ3(1ng/ml)和待测抗体,将两者等体积混合后37℃孵育1h,从稀释板中取50μl混合液加入到细胞板中,轻轻拍打混匀,放入细胞培养箱培养18h。之后,每孔加入50μl bright-lite(vazyme,货号:dd1204-03),避光孵育10min,检测荧光信号。
[0120]
图9显示了对tgfβ2的中和活性结果,表明嵌合抗体124和130对tgfβ2的中和活性显著弱于阳性对照抗体gc1008和m7824,且接近阴性对照。图10显示了对tgfβ3的中和活性结果,表明嵌合抗体124对tgfβ3的中和活性显著弱于阳性对照抗体m7824和gc1008。
[0121]
实施例10抗体工程改造
[0122]
10.1人源化改造
[0123]
为了降低抗体分子在体内的免疫原性,对候选嵌合抗体124和130进行了人源化设计。将抗体序列和人源抗体胚系基因数据库进行比对,找到和各vhh序列同源性比较高的1-3条胚系基因,同时兼顾胚系基因的成药性,选择合适的胚系基因模板进行比对,分析vhh框架区中非人源序列位点的数量。对vhh进行同源建模,同源建模参考pdb数据库(http://
www.rcsb.org/)的纳米抗体模型。结合vhh的模拟结构模型和非人源位点情况,进行组合回复突变设计(同时避免引入潜在翻译后修饰位点),设计了不同程度人源化的序列。抗tgfβ1的vhh-fc嵌合抗体改造后的人源化分子124-hvh10和130-hvh23的vhh氨基酸序列如seq id no:26和seq id no:27所示,人源化程度分别为94.35%和98.37%。
[0124]
10.2亲和力成熟改造
[0125]
对124-hvh10和130-hvh23进行亲和力成熟改造,用于提高亲和力和生物学活性。亲和力成熟改造是基于m13噬菌体展示技术,采用codon-based引物(引物合成过程中,单个密码子由nnk组成)引入cdr区突变,共构建4个噬菌体展示文库:文库1为cdr1+cdr2+cdr3单点组合突变;文库2为cdr1+cdr2双点组合突变;文库3为cdr1+cdr3双点组合突变,文库4为cdr2+cdr3双点组合突变。
[0126]
以124-hvh10和130-hvh23为模板,通过pcr方式获得单个cdr区突变片段,再通过overlapping pcr方式获得vhh全长片段,双酶切(hindⅲ和notⅰ)和双粘端连接将点突变抗体连接到噬菌体展示载体中,最后通过电转将带有突变位点的vhh序列转入大肠杆菌ss320中。构建好的4个文库包装成噬菌体后,进行淘筛。方法与实施例3一致,最终各选择了2个较优分子,候选亲和力成熟分子的cdr氨基酸序列如表3所示,全长分别如seq id no:36-39所示。
[0127]
表3亲和力成熟分子的cdr序列
[0128][0129]
10.3改造后分子的制备
[0130]
选择了2个人源化分子124-hvh10和130-hvh23与4个候选亲和力成熟分子124-hvh10-11、124-hvh10-20、130-hvh23-20和130-hvh23-51进行样品制备,制备方法详见实施例4。
[0131]
实施例11 facs方法检测人源化分子阻断tgfβr2和tgfβ1结合的活性
[0132]
检测方法参见实施例7.2。结果如图11a-11b所示,图11a显示人源化分子124-hvh10在细胞水平上阻断tgfβr2和tgfβ1结合的活性与母本分子相当;图11b显示人源化分子130-hvh23在细胞水平上阻断tgfβr2和tgfβ1结合的活性与母本分子相当。
[0133]
实施例12荧光素酶报告基因法检测改造后分子阻断tgfβ1信号通路的中和效果
[0134]
在本实施例中,基于hutgfr2/sbe/hek293细胞报告系统检测抗体对tgfβ1的中和活性,基本原理与实施例9一致。
[0135]
将hutgfr2/sbe/hek293细胞密度调整为2
×
105个/ml,每孔中加入50μl细胞,轻轻拍打混匀。然后用培养基(dmem+10%fbs)配制重组人tgfβ1(1ng/ml)和待测抗体,将两者等体积混合后37℃孵育1h,从稀释板中取50μl混合液加入到细胞板中,轻轻拍打混匀,放入细胞培养箱培养18h。之后,每孔加入50μl bright-lite(vazyme,货号:dd1204-03),避光孵育
10min,检测荧光信号。
[0136]
结果如图12a-12d所示,图12a显示亲和力成熟分子124-hvh10-11在细胞水平上阻断人tgfβ1信号通路的中和效果略优于人源化分子124-hvh10,且与阳性对照抗体m7824相当(m7824与gc1008的活性相当甚至更优,可参考cn106103488b的比较结果);图12b显示亲和力成熟分子124-hvh10-20在细胞水平上阻断人tgfβ1信号通路的中和效果略优于人源化分子124-hvh10,且与阳性对照抗体m7824相当;图12c显示亲和力成熟分子130-hvh23-20在细胞水平上阻断人tgfβ1信号通路的中和效果显著优于人源化分子130-hvh23,且与阳性对照抗体m7824相当;图12d显示亲和力成熟分子130-hvh23-51在细胞水平上阻断人tgfβ1信号通路的中和效果显著优于人源化分子130-hvh23,且与阳性对照抗体m7824相当。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1