一种高效率检测细胞被原核生物污染情况的方法与流程
1.本发明技术领域的分类号为c12q1/68(2006.01)i,具体涉及一种高效率检测细胞被原核生物污染情况的方法。
背景技术:
2.原核生物是指一类细胞核无核膜包裹,只存在称作核区的裸露dna的原始单细胞生物,常见的原核生物包括支原体、衣原体和细菌等,其中在细胞培养的过程中极其容易被支原体感染。支原体是一类没有细胞壁、高度多形性、能通过滤菌器、可用人工培养基培养增殖的最小原核细胞型微生物,大小为0.1~0.3微米。由于能形成丝状与分枝形状,故称为支原体。支原体广泛存在于人和动物体内,对人致病的支原体主要有肺炎支原体、溶脲脲原体、人型支原体、生殖器支原体等。支原体可通过黏附作用与宿主细胞结合,从细胞膜获取脂质和胆固醇,使细胞膜损伤。
3.专利申请号为cn200910253189.4的发明专利中公开了一种检测支原体的方法,该方法为支原体培养检测法,支原体培养检测法的操作过程比较复杂,且检测周期较长、效率较低,且该专利中检测的为人体泌尿生殖系统的支原体感染情况。随着人脐带间充质干细胞的广泛培养与使用,现在还未见报道人脐带间充质干细胞支原体污染的检测方法。本发明通过提取培养的人脐带间充质干细胞中支原体的dna直接通过荧光定量检测方法进行分析,提供了一种能够快速、高效的检测人脐带间充质干细胞中被支原体污染的情况。
技术实现要素:
4.为解决上述技术问题,本发明的第一个方面提供了一种高效率检测细胞被原核生物污染情况的方法,至少包括以下步骤:
5.(1)对待测样品中的支原体dna进行裂解;
6.(2)对裂解出的支原体的dna进行析出;
7.(3)制备含支原体dna的洗脱液;
8.(4)分别配制待测样品组、阳性对照组和阴性对照组的pcr待测品;
9.(5)对待测样品组、阳性对照组和阴性对照组进行stepone上机检测,并根据判断标准判断各组样品的支原体污染情况。
10.作为一种优选的技术方案,所述步骤(1)对待测样品中的支原体dna进行裂解的步骤为:取待测样品液100-300μl至第一ep管中,并向第一ep管中加入dna裂解液。
11.作为一种优选的技术方案,所述步骤(1)对待测样品中的支原体dna进行裂解的步骤为:取待测样品液100-300μl至第一ep管中,并向第一ep管中加入dna裂解液,所述dna裂解液为赛多利斯试剂盒microsart amp extraction试剂中的buffer a1。
12.作为一种优选的技术方案,所述步骤(2)对裂解出的支原体的dna进行析出的步骤为:在步骤(1)的所得物中加入dna析出液,之后转移至吸附柱内10000-20000r/min并离心0.5-3min,弃去废液。
13.本技术方案中发明人通过对待测样品的dna进行裂解和析出,得到支原体的dna分子作为复制模板。
14.作为一种优选的技术方案,所述检测结果灵敏的支原体污染的快速检测方法还包括多次对支原体dna进行洗涤和纯化的步骤,所述对支原体dna进行洗涤和纯化的步骤在步骤(2)之后进行。
15.作为一种优选的技术方案,所述在步骤(2)之后进行对支原体dna进行洗涤和纯化三次。
16.作为一种优选的技术方案,所述在步骤(2)之后进行对支原体dna进行洗涤和纯化时,至少使用两种不同的洗涤液。
17.发明人使用至少两种洗涤液对析出的支原体的dna进行洗涤和纯化,由于在进行裂解支原体的dna以及析出支原体dna的过程中引入了外部杂质,外部杂质的存在可能会对dna的扩增以及荧光检测过程中造成较大的影响,导致测试结果的稳定性以及灵敏度下降,故发明人为了较大限度的除去外部杂质的影响至少使用两种不同的洗涤液对析出支原体的dna进行洗涤和纯化。洗涤和纯化的次数保持在三次,洗涤次数过多可能会使析出的支原体dna部分流失,降低测试过程的灵敏度,洗涤次数过少可能有外部物质未洗涤干净,同样影响测试过程中的稳定性。
18.作为一种优选的技术方案,所述步骤(3)中制备含支原体dna的洗脱液的具体步骤为:将吸附柱换至第二ep管中,并加入洗脱液静置2-5min,8000-10000r/min离心0.5-3min,弃去吸附柱,即得到。
19.作为一种优选的技术方案,所述步骤(5)中的stepone上机检测的具体步骤为打开仪器及电脑软件,新建实验,“支原体”选择fam通道、“内参”选择rox通道,设置pcr程序中的扩增循环数在40-48cycles,变性温度在80-95℃,退火温度在40-55℃,延伸温度在70-95℃。
20.作为一种优选的技术方案,所述步骤(5)中的stepone上机检测的具体步骤为打开仪器及电脑软件,新建实验,“支原体”选择fam通道、“内参”选择rox通道,设置pcr程序中的扩增循环数在44-46cycles,变性温度在90-95℃,退火温度在50-55℃,延伸温度在90-95℃。
21.作为一种优选的技术方案,所述步骤(5)中的pcr程序中的扩增循环数为45cycles。
22.本技术方案中通过对在支原体中提取的dna作为模板分子,在一定的变性温度下使模板分子双链间的氢键断裂,而形成两条单链,之后突然降温进入退火阶段后,加入的引物和荧光探针分别与模板进行相互作用,模板分子与引物按照碱基配对原则互补结合,在dna聚合酶的作用下,按照半保留复制的机制沿着模板链延伸至完成新的dna合成,在扩增循环的过程中,重复这一过程使支原体的dna得到扩增,从而使模板dna的含量得到较大的扩大。荧光探针为一寡核苷酸,两端分别标记一个报告荧光基团和一个淬灭荧光基团,探针完整时,报告基团发射的荧光信号被淬灭基团吸收,pcr扩展时活性酶会将探针酶切降解,使报告荧光基团和淬灭荧光基团分离,从而荧光检测系统可接收到荧光信号,即每扩增一条dna链,就有一个荧光分子形成,从而实现了荧光信号的积累与pcr产物形成完全同步,通过荧光检测可以反映出支原体的dna的扩增的数量。扩增循环次数越高,支原体的dna扩增
grade water得到internal control、阳性对照管中加入300μl pcr grade water得到positive control,然后分别在6个pcr管中加入15μl混合好的mycoplasma mix和1μl的internal control,将6个pcr管每两个分成一组,分别是样本组、阳性对照组和阴性对照组,设置平行的两组,在样本组中加入10μl制备的含支原体dna的洗脱液,在阳性对照组中加入10μlpositive control,在阴性对照组中加入10μl pcr grade water,即得到;
37.(7)stepone上机检测:打开仪器及电脑软件,新建实验,“支原体”选择fam通道、“内参”选择rox通道,添加相对应的样本个数,
38.设置pcr程序如下:
[0039][0040]
设置好程序后,运行程序,运行结束,适当调整分析线、基线,得到ct值,根据以下标准进行判断分析:
[0041][0042]
本实施例中的人脐带间充质干细胞注射液为阴性,测试结果也为阴性,其中一平行组的fam测试图如图1所示,rox测试图如图2所示。
[0043]
实施例2
[0044]
该实施例中提供了一种高效率检测细胞被原核生物污染情况的方法,包括以下步骤:
[0045]
(1)进行裂解支原体的dna:取人脐带间充质干细胞注射液200μl至1.5ml的第一ep管中,并向第一ep管中加入200μl赛多利斯试剂盒microsart amp extraction试剂中的buffer a1,振荡10s,使之混匀,之后置于70℃加热设备中,加热10min,期间颠倒混匀4次,所述人脐带间充质干细胞注射液购自华夏源细胞工程基团股份有限公司,批号20201104;
[0046]
(2)析出支原体dna:在步骤(1)的所得物中加入赛多利斯试剂盒microsart amp extraction试剂中的buffer a2 400μl并振荡10s,使之混匀,之后转移至吸附柱内10000r/min并离心1min,弃去废液;
[0047]
(3)洗涤纯化支原体dna:在赛多利斯试剂盒microsart amp extraction试剂中的
buffer b中加入无水乙醇至瓶身的刻度线,在步骤(2)中的所得物中加入buffer b与无水乙醇的混合物500μl,10000r/min并离心1min,弃去废液;
[0048]
(4)洗涤纯化支原体dna:在赛多利斯试剂盒microsart amp extraction试剂中的buffer c中加入无水乙醇至瓶身的刻度线,在步骤(3)中的所得物中加入buffer c与无水乙醇的混合物500μl,10000r/min离心1min,弃去废液,之后再加入buffer c与无水乙醇的混合物500μl,12000r/min离心3min,弃废液;
[0049]
(5)制备含支原体dna的洗脱液:将吸附柱换至1.5ml的第二ep管中,并加入60μl在70℃下预热过的赛多利斯试剂盒microsart amp extraction试剂中的buffer d,静置2min,8000r/min离心2min,弃去吸附柱,即得到;
[0050]
(6)制备pcr待测品:在赛多利斯试剂盒microsart amp extraction中的支原体mix管中加入390μl rehydration buffer得到mycoplasma mix、内参管中加入80μl pcr grade water得到internal control、阳性对照管中加入300μl pcr grade water得到positive control,然后分别在6个pcr管中加入15μl混合好的mycoplasma mix和1μl的internal control,将6个pcr管每两个分成一组,分别是样本组、阳性对照组和阴性对照组,设置平行的两组,在样本组中加入10μl制备的含支原体dna的洗脱液,在阳性对照组中加入10μlpositive control,在阴性对照组中加入10μl pcr grade water,即得到;
[0051]
(7)stepone上机检测:打开仪器及电脑软件,新建实验,“支原体”选择fam通道、“内参”选择rox通道,添加相对应的样本个数,
[0052]
设置pcr程序如下:
[0053][0054]
设置好程序后,运行程序,运行结束,适当调整分析线、基线,得到ct值,根据以下标准进行判断分析:
[0055][0056]
本实施例中的人脐带间充质干细胞注射液为阴性,测试结果也为阴性,其中1平行组的fam测试图如图3所示,rox测试图如图4所示。
[0057]
实施例3
[0058]
该实施例中提供了一种高效率检测细胞被原核生物污染情况的方法,包括以下步骤:
[0059]
(1)进行裂解支原体的dna:取人脐带间充质干细胞注射液200μl至1.5ml的第一ep管中,并向第一ep管中加入200μl赛多利斯试剂盒microsart amp extraction试剂中的buffer a1,振荡10s,使之混匀,之后置于70℃加热设备中,加热10min,期间颠倒混匀4次,所述人脐带间充质干细胞注射液购自华夏源细胞工程基团股份有限公司,批号20201103;
[0060]
(2)析出支原体dna:在步骤(1)的所得物中加入赛多利斯试剂盒microsart amp extraction试剂中的buffer a2 400μl并振荡10s,使之混匀,之后转移至吸附柱内10000r/min并离心1min,弃去废液;
[0061]
(3)洗涤纯化支原体dna:在赛多利斯试剂盒microsart amp extraction试剂中的buffer b中加入无水乙醇至瓶身的刻度线,在步骤(2)中的所得物中加入buffer b与无水乙醇的混合物500μl,10000r/min并离心1min,弃去废液;
[0062]
(4)洗涤纯化支原体dna:在赛多利斯试剂盒microsart amp extraction试剂中的buffer c中加入无水乙醇至瓶身的刻度线,在步骤(3)中的所得物中加入buffer c与无水乙醇的混合物500μl,10000r/min离心1min,弃去废液,之后再加入buffer c与无水乙醇的混合物500μl,12000r/min离心3min,弃废液;
[0063]
(5)制备含支原体dna的洗脱液:将吸附柱换至1.5ml的第二ep管中,并加入60μl在70℃下预热过的赛多利斯试剂盒microsart amp extraction试剂中的buffer d,静置2min,8000r/min离心2min,弃去吸附柱,即得到;
[0064]
(6)制备pcr待测品:在赛多利斯试剂盒microsart amp extraction中的支原体mix管中加入390μl rehydration buffer得到mycoplasma mix、内参管中加入80μl pcr grade water得到internal control、阳性对照管中加入300μl pcr grade water得到
extraction试剂中的buffer a2 400μl并振荡10s,使之混匀,之后转移至吸附柱内10000r/min并离心1min,弃去废液;
[0076]
(3)洗涤纯化支原体dna:在赛多利斯试剂盒microsart amp extraction试剂中的buffer b中加入无水乙醇至瓶身的刻度线,在步骤(2)中的所得物中加入buffer b与无水乙醇的混合物500μl,10000r/min并离心1min,弃去废液;
[0077]
(4)洗涤纯化支原体dna:在赛多利斯试剂盒microsart amp extraction试剂中的buffer c中加入无水乙醇至瓶身的刻度线,在步骤(3)中的所得物中加入buffer c与无水乙醇的混合物500μl,10000r/min离心1min,弃去废液,之后再加入buffer c与无水乙醇的混合物500μl,12000r/min离心3min,弃废液;
[0078]
(5)制备含支原体dna的洗脱液:将吸附柱换至1.5ml的第二ep管中,并加入60μl在70℃下预热过的赛多利斯试剂盒microsart amp extraction试剂中的buffer d,静置2min,8000r/min离心2min,弃去吸附柱,即得到;
[0079]
(6)制备pcr待测品:在赛多利斯试剂盒microsart amp extraction中的支原体mix管中加入390μl rehydration buffer得到mycoplasma mix、内参管中加入80μl pcr grade water得到internal control、阳性对照管中加入300μl pcr grade water得到positive control,然后分别在6个pcr管中加入15μl混合好的mycoplasma mix和1μl的internal control,将6个pcr管每两个分成一组,分别是样本组、阳性对照组和阴性对照组,设置平行的两组,在样本组中加入10μl制备的含支原体dna的洗脱液,在阳性对照组中加入10μlpositive control,在阴性对照组中加入10μl pcr grade water,即得到;
[0080]
(7)stepone上机检测:打开仪器及电脑软件,新建实验,“支原体”选择fam通道、“内参”选择rox通道,添加相对应的样本个数,
[0081]
设置pcr程序如下:
[0082][0083]
设置好程序后,运行程序,运行结束,适当调整分析线、基线,得到ct值,根据以下标准进行判断分析:
[0084][0085][0086]
本实施例中的人脐带间充质干细胞注射液为阴性,测试结果也为阴性。
[0087]
实施例5
[0088]
该实施例中提供了一种高效率检测细胞被原核生物污染情况的方法,包括以下步骤:
[0089]
(1)进行裂解支原体的dna:取人脐带间充质干细胞注射液200μl至1.5ml的第一ep管中,并向第一ep管中加入200μl赛多利斯试剂盒microsart amp extraction试剂中的buffer a1,振荡10s,使之混匀,之后置于70℃加热设备中,加热10min,期间颠倒混匀4次,所述人脐带间充质干细胞注射液购自华夏源细胞工程基团股份有限公司,批号20201103;
[0090]
(2)析出支原体dna:在步骤(1)的所得物中加入赛多利斯试剂盒microsart amp extraction试剂中的buffer a2 400μl并振荡10s,使之混匀,之后转移至吸附柱内10000r/min并离心1min,弃去废液;
[0091]
(3)洗涤纯化支原体dna:在赛多利斯试剂盒microsart amp extraction试剂中的buffer b中加入无水乙醇至瓶身的刻度线,在步骤(2)中的所得物中加入buffer b与无水乙醇的混合物500μl,10000r/min并离心1min,弃去废液;
[0092]
(4)洗涤纯化支原体dna:在赛多利斯试剂盒microsart amp extraction试剂中的buffer c中加入无水乙醇至瓶身的刻度线,在步骤(3)中的所得物中加入buffer c与无水乙醇的混合物500μl,10000r/min离心1min,弃去废液,之后再加入buffer c与无水乙醇的混合物500μl,12000r/min离心3min,弃废液;
[0093]
(5)制备含支原体dna的洗脱液:将吸附柱换至1.5ml的第二ep管中,并加入60μl在70℃下预热过的赛多利斯试剂盒microsart amp extraction试剂中的buffer d,静置2min,8000r/min离心2min,弃去吸附柱,即得到;
[0094]
(6)制备pcr待测品:在赛多利斯试剂盒microsart amp extraction中的支原体mix管中加入390μl rehydration buffer得到mycoplasma mix、内参管中加入80μl pcr grade water得到internal control、阳性对照管中加入300μl pcr grade water得到
positive control,然后分别在6个pcr管中加入15μl混合好的mycoplasma mix和1μl的internal control,将6个pcr管每两个分成一组,分别是样本组、阳性对照组和阴性对照组,设置平行的两组,在样本组中加入10μl制备的含支原体dna的洗脱液,在阳性对照组中加入10μlpositive control,在阴性对照组中加入10μl pcr grade water,即得到;
[0095]
(7)stepone上机检测:打开仪器及电脑软件,新建实验,“支原体”选择fam通道、“内参”选择rox通道,添加相对应的样本个数,
[0096]
设置pcr程序如下:
[0097][0098]
设置好程序后,运行程序,运行结束,适当调整分析线、基线,得到ct值,根据以下标准进行判断分析:
[0099][0100]
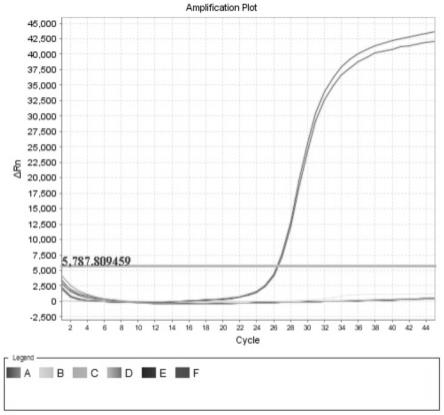
本实施例中的人脐带间充质干细胞注射液为阴性,测试结果也为阴性,测试图如图1所示。
[0101]
性能测试
[0102]
性能测试一
[0103]
对实施例1-实施例6中的两组pcr测试中的支原体检测通道(fam)和内参检测通道(rox)的检测结果平均值进行分析,比较实施例1-实施例6中的测试结果,当样本组、阳性对照组和阴性对照组中的内参检测通道差值越大时,灵敏度越高,检测结果如下表中所示。
[0104][0105]
从上述数据中可以看出,当测试过程中的扩增循环数为45时,测试具有较高的稳定性和灵敏度,并且能够较好的抵御外部物质的干燥,具有较好的可操作性。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1