一种用于在对虾中递送和表达外源基因的对虾病毒表达系统
1.本发明属于基因工程技术领域,具体涉及一种用于在对虾细胞中递送和表达外源基因的对虾病毒表达系统。
背景技术:
2.对虾是一种重要的海水养殖经济品种,但随着养殖规模的不断扩大,养殖环境的水质不断恶化,导致对虾养殖中的病害问题愈发严重。尤其是频繁爆发的病毒性疾病,因缺乏有效的防治措施,而给对虾养殖业造成了巨大损失。为了满足对虾病毒的分离和纯化、研制诊断试剂与核酸疫苗以及对虾病毒病的致病机制研究的需要,亟需建立对虾永生性细胞系。
3.但是,由于缺乏有效的对虾细胞基因转移技术,导致人们无法将永生性转化相关基因高效导入体外培养的对虾细胞中,以诱导对虾细胞的永生性转化,从而大大阻碍了对虾永生性细胞系的成功建立。另外,由于针刺易导致对虾受精卵破裂和显微注射后的受精卵孵化率低等原因,导致对虾活体的基因转移与基因编辑的研究进展远滞后于鱼类。因此,对虾高效基因转移与表达系统的建立,也将大大推动转基因对虾的研制以及基因编辑技术在对虾活体中的应用。
4.目前,基于哺乳动物病毒的逆转录病毒和慢病毒基因转移和表达系统已经成功构建,并广泛应用于哺乳动物细胞的高效基因转移与表达,大大推动了相关研究领域的发展。但是,由于病毒具有严格的宿主专一性,上述哺乳动物病毒介导的基因转移与表达系统在对虾组织和细胞中的亲嗜性极低。
技术实现要素:
5.本发明的目的是提供一种用于在对虾细胞中递送和表达外源基因的对虾病毒表达系统,从而弥补现有技术的不足。
6.本发明首先提供一种用于将外源基因在对虾细胞中进行表达的重组质粒,所述的重组质粒包含有对虾ihhnv病毒的基因组dna、昆虫多角体蛋白基因的启动子ph、用于插入外源基因的多克隆酶切位点(mcs)和sv40多聚腺苷酸信号(pa);
7.作为本发明实施例的一种具体记载,所述的对虾ihhnv病毒的基因组dna序列为seq id no:1;
8.作为实施例的具体记载,所述的ph启动子的核酸序列为seq id no:2,mcs的核酸序列为seq id no:3;sv40的pa的核酸序列为seq id no:4。
9.更进一步,所述启动子ph和多克隆酶切位点之间还插入有gus报告基因;
10.所述的gus报告基因的编码核酸和氨基酸序列分别为seq id no:5和seq id no:6;
11.所提供的重组质粒用于制备将外源基因在对虾细胞中进行表达的系统;
12.一种将外源基因在对虾细胞中进行表达的系统,包含有上述的重组质粒,以及插
入有对虾wssv病毒囊膜蛋白vp28基因的昆虫杆状病毒重组表达质粒bacmid-vp28;
13.其中,vp28基因的编码核酸和氨基酸序列分别为seq id no:7和seq id no:8;
14.所述的表达系统还包含有昆虫sf9包装细胞。
15.本发明还提供了一种使外源基因在对虾成体组织和体外培养细胞中稳定、高效表达的方法:将外源基因克隆到上述对虾病毒表达质粒中,然后通过上述述对虾病毒表达系统,制备混合包装病毒,然后通过肌肉注射和孵育的方式分别感染对虾成体组织及其细胞,检测外源基因的表达。
16.本发明所提供的对虾病毒表达系统能够高效的在对虾细胞中表达外源基因,且表达系统中的所有质粒dna遗传信息是游离于对虾细胞染色体之外,不会整合到对虾细胞的基因组中,提高了该系统的生物安全性。
附图说明
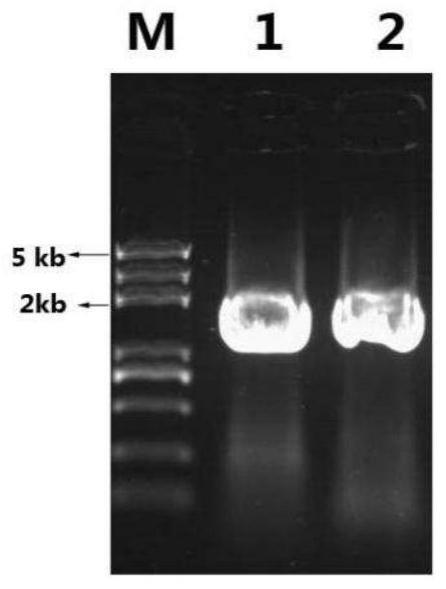
17.图1:pcr扩增对虾ihhnv病毒全基因组前后两个片段的凝胶电泳结果图,其中,泳道1为ihhnv基因组前半部分的pcr扩增片段(1-1910bp),泳道2为ihhnv基因组后半部分的pcr扩增片段(1870-3833bp),m为dna marker。
18.图2:puc19-ihhnv环化质粒的图谱;
19.图3:puc19-ihhnv环化质粒的凝胶电泳结果图,其中泳道1为puc19-ihhnv质粒(6.5kb),m为dna marker。
20.图4:puc19-ihhnv环化质粒测序分析结果图,其中下划线代表酶切位点。
21.图5:pfastbactm 1-gus质粒的图谱;
22.图6:pcr扩增带有puc19-ihhnv质粒线性化位点附近30bp同源臂的ph-gus-mcs片段的凝胶电泳结果;其中泳道1为扩增产物pph-gus-mcs,m为dna marker。
23.图7:对虾ihhnv病毒表达质粒puc19-ihhnv-ph-gus的图谱。
24.图8:puc19-ihhnv-ph-gus表达质粒的测序分析结果;其中,下划线代表酶切位点,灰色阴影代表ph启动子,大框内代表gus基因,小方框内为起始密码子和终止密码子。
25.图9:puc19-ihhnv-ph-gus与bacmid分别单独转染昆虫sf9细胞的gus染色光镜结果图;其中,a为未转染质粒的昆虫sf9细胞,b为puc19-ihhnv-ph-gus质粒在昆虫sf9细胞单独转染120h的染色结果图,c为bacmid质粒在昆虫sf9细胞单独转染120h的染色结果图。比例尺为100μm。
26.图10:对虾病毒表达质粒puc19-ihhnv-ph-gus在昆虫sf9细胞中的包装效果(透射电镜检测);其中,a为未感染病毒的昆虫sf9细胞,b为puc19-ihhnv-ph-gus转染昆虫sf9细胞后的上清液所感染的sf9细胞,c为bacmid转染昆虫sf9细胞后的上清液所感染的sf9细胞,d为puc19-ihhnv-ph-gus和bacmid共转染昆虫sf9细胞后的上清液所感染的sf9细胞。比例尺为2μm。放大倍数为4
×
。
27.图11:病毒表达质粒puc19-ihhnv-ph-gus转染sf9细胞后的上清二次侵染sf9细胞后所收集的培养基上清液的负染电镜结果;其中比例尺为100nm。
28.图12:bacmid与puc19-ihhnv-ph-gus的共转染实验中转染试剂cellfectin ii的最佳转染剂量的优化结果图;其中,a为未转染昆虫sf9细胞光镜图,b为质粒与转染试剂比例为1:4(μg:μl),c为质粒与转染试剂比例为1:5(μg:μl),d为质粒与转染试剂比1:6(μg:μ
l)。比例尺为100μm。
29.图13:bacmid与puc19-ihhnv-ph-gus的最佳共转染比例的优化结果;a:未转染昆虫sf9细胞光镜图;b、c、d、e和f分别为puc19-ihhnv-ph-gus与bacmid以1:1/3、1:1/2、1:1、1:2和1:3的比例共转染到昆虫sf9细胞。比例尺为100μm。
30.图14:对虾病毒质粒puc19-ihhnv-ph-gus在昆虫sf9细胞中的包装效果检测;其中,a为未感染病毒的昆虫sf9细胞光镜图,b为bacmid转染sf9细胞后的培养基上清液所感染的昆虫sf9细胞,c为bacmid-gus转染昆虫sf9细胞后的培养基上清液所感染的sf9细胞,d为puc19-ihhnv-ph-gus和bacmid共转染sf9细胞后的上清液所感染的sf9细胞。比例尺为100μm。
31.图15:在1.5
×
l-15完全培养基中培养的对虾血淋巴细胞感染puc19-ihhnv-ph-gus/bacmid-vp28混合病毒5天后的结果图;其中,a为未感染病毒,b为puc19-ihhnv-ph-gus/bacmid-vp-28混合病毒感染。比例尺为100μm。
32.图16:puc19-ihhnv-ph-gus/bacmid-vp28混合病毒感染刀额新对虾活体后不同组织中的gus基因表达结果图,其中,i图为体视显微镜下结果,ii图为1.5ml ep管内观察结果。i图中,a0-e0为对虾成体肌肉注射pbs后的心脏、鳃、oka、肌肉与肠gus染色结果。a1-e1为对虾成体肌肉注射7
×
104tu病毒后的心脏、鳃、oka、肌肉与肠gus染色结果。a2-e2为对虾成体肌肉注射7
×
105tu病毒后的心脏、鳃、oka、肌肉与肠gus染色结果。a3-e3为对虾成体肌肉注射7
×
106tu病毒后的心脏、鳃、oka、肌肉与肠gus染色结果。ii图与i图结果对应。
具体实施方式
33.本发明所使用的对虾传染性皮下及造血组织坏死病毒(ihhnv)与哺乳动物腺相关病毒(aav2)同属于细小病毒科,是一种单链dna病毒,其基因组只有4kb左右,易于开展分子生物学操作。
34.在之前的研究中申请人发现bac-to-bac昆虫杆状病毒基因转移与表达系统不能有效侵染对虾活体及其体外培养细胞。在将对虾病毒wssv的囊膜蛋白(vp28)引入上述昆虫杆状病毒的囊膜中,其在对虾体外培养细胞中的侵染效率也很低,不能应用于对虾细胞的永生性转化研究。
35.本发明首先构建了一种基于对虾ihhnv病毒全基因组的对虾高效基因转移与表达系统,首先扩增了对虾ihhnv病毒的基因组dna全长,并构建其环化质粒puc19-ihhnv,从而实现了在大肠杆菌中扩增对虾病毒基因组dna的目的。然后将昆虫多角体蛋白基因的启动子ph、用于插入外源基因的多克隆酶切位点(mcs)和sv40多聚腺苷酸信号(pa)插入到对虾ihhnv病毒的基因组dna之后,构建重组表达质粒puc19-ihhnv-ph-gus。
36.通过检测gus报告基因的表达以及透射电镜和电镜负染分析,探究对虾病毒表达质粒puc19-ihhnv-ph-gus在昆虫sf9细胞中的表达与包装能力;但结果表明重组表达质粒puc19-ihhnv-ph-gus单独转染到昆虫sf9细胞中,检测不到报告基因gus的表达。
37.而通过将对虾wssv病毒囊膜蛋白vp28基因插入到昆虫杆状病毒表达质粒bacmid中,构建成重组表达质粒bacmid-vp28,然后将重组表达质粒bacmid-vp28和puc19-ihhnv-ph-gus共转染昆虫sf9包装细胞后,收集和制备puc19-ihhnv-ph-gus和bacmid-vp28的混合病毒上清;将一代混合病毒感染sf9细胞,4天后收集细胞培养上清,离心,获得第二代混合
病毒上清;超速离心,纯化和浓缩得到混合病毒,并根据gus基因的表达,测定包装病毒(puc19-ihhnv-ph-gus)的滴度;最后,将混合病毒感染对虾活体及其细胞,检测gus基因的表达。结果混合病毒bacmid-vp28和puc19-ihhnv-ph-gus共感染对虾细胞后,gus基因的表达量明显提高。
38.实现上述技术方案的方法,其一种具体的步骤如下:
39.扩增对虾ihhnv病毒的基因组dna全长,将其与puc19质粒连接环化,构建其环化质粒puc19-ihhnv;然后将昆虫多角体蛋白基因启动子(ph)、报告基因gus(β-葡萄糖苷酸酶)、多克隆酶切位点(mcs)和sv40多聚腺苷酸信号(pa)引入上述环化质粒中ihhnv序列之后。
40.上述环化质粒puc19-ihhnv的构建方法为:分段扩增对虾ihhnv病毒的第1-1910bp和1870-3833bp的两个片段,然后采用大片段同源重组技术,将上述2个克隆片段与线性化的puc19质粒连接。
41.病毒表达质粒bacmid-vp28的构建方法为:将vp28基因克隆到供体质粒pfastbac1的多克隆酶切位点,构建重组质粒pfastbac1-vp28,然后将其转化到感受态细胞dh10bac中,蓝白斑筛选阳性克隆,然后提取重组病毒表达质粒bacmid-vp28。
42.本发明另一个方面提供了一种基于对虾ihhnv病毒全基因组的高效基因转移与表达系统。该系统的组成为:对虾病毒表达质粒(puc19-ihhnv-ph-gus)、昆虫杆状病毒表达质粒(bacmid-vp28)和昆虫sf9包装细胞。
43.其中,上述对虾病毒介导的基因转移与表达系统的技术流程为:将对虾病毒表达质粒(puc19-ihhnv-ph-gus)和昆虫杆状病毒表达质粒(bacmid-vp28)共转染昆虫sf9包装细胞;4天后收集细胞培养上清,离心,获得第一代puc19-ihhnv-ph-gus和bacmid-vp28的混合病毒上清;将一代混合病毒感染sf9细胞,4天后收集细胞培养上清,离心,获得第二代混合病毒上清;超速离心,纯化和浓缩得到混合病毒,并根据gus基因的表达测定包装病毒(puc19-ihhnv-ph-gus)的滴度;将混合病毒感染对虾活体及其细胞,检测gus基因的表达。
44.本发明还提供了一种使外源基因在对虾成体组织和体外培养细胞中稳定、高效表达的方法:将外源基因克隆到上述对虾病毒表达质粒中,然后通过上述述对虾病毒表达系统,制备混合包装病毒,然后通过肌肉注射和孵育的方式分别感染对虾成体组织及其细胞,检测外源基因的表达。
45.下面结合实施例和附图对本发明进行详细的描述。
46.实施例1:对虾ihhnv病毒基因组dna全长的克隆及其环化质粒puc19-ihhnv的构建。
47.设计特异性引物,pcr技术分段扩增对虾ihhnv病毒的第1-1910bp和1870-3833bp的两个片段(图1),测序后可拼接获得了对虾ihhnv病毒的基因组dna全长,为3833bp。然后采用大片段同源重组技术(gibsonultra kit),将上述2个克隆片段与线性化的puc19质粒连接,构建了对虾ihhnv基因组dna的puc19环化质粒:puc19-ihhnv(图2-图4),从而实现了对虾病毒ihhnv基因组dna在细菌中的扩增与纯化。
48.实施例2:基于对虾ihhnv病毒全基因组的对虾病毒表达质粒puc19-ihhnv-ph-gus的构建。
49.以质粒pfastbac
tm
1-gus为模板(图5),pcr扩增其中的ph-gus-mcs-sv40 pa片段(2383bp)。pcr扩增得到的ph-gus-mcs片段的左右两端分别带有15bp的同源臂(2413bp)(图
gus病毒可以感染对虾细胞(图15)。
62.如图16所示,将puc19-ihhnv-ph-gus和bacmid-vp28混合病毒按照7
×
106tu/只、7
×
105tu/只和7
×
104tu/只的剂量注射到对虾体内,5天后,取注射后对虾的心脏、鳃、oka器官、肌肉和肠组织检测gus基因的表达。发现在心脏、鳃和oka器官中均有gus基因的表达,且gus基因的表达随病毒注射剂量的增加而升高。这表明,puc19-ihhnv-ph-gus和bacmid-vp28混合病毒可以感染对虾活体,并且具有组织特异性。
63.对虾成体组织的gus染色方法:避光条件下,现用现配gus组织染色液:每1ml组织染色液中添加830μl无核酸酶灭菌水、100μl 1m磷酸钠溶液、20μl 0.5m edta-2na、10μl 10%tritonx-100,、20μl 50mm铁氰化钾溶液和20μl 0.1m x-gluc溶液(50mg/ml);向离心管中加入gus组织染液,使其没过组织块,于28℃培养箱中孵育过夜;从培养箱中取出离心管,小心弃除染色液,用小镊子取出组织,置于盛有pbs缓冲液的小皿中,于体视显微镜下观察并拍照记录。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1