肝癌模型细胞、体外培养方法、应用及肝癌动物模型建立方法
1.本技术涉及肝癌模型技术领域,尤其涉及肝癌模型细胞、体外培养方法、应用及肝癌动物模型建立方法
背景技术:
2.在大量的肝癌肿瘤药物研究中,建立大鼠肝癌模型显得尤为重要。常用的大鼠肝癌模型建立分为移植型和原发性两种。
3.原发性肝癌模型是利用化学致癌物质诱发大鼠肝癌缓慢发生,这种模型虽然时间较长,但可以观察到肝癌发生发展的主要阶段,有利于肝癌早期瘤前病变的检测。目前国内外有很多用den诱发原发性大鼠肝癌的模型,。该模型主要存在的问题是染毒剂量不准确,时间较长。另外,以二乙基亚硝胺为启动剂,藻毒素为促进剂,构建大鼠肿瘤促进模型,观察肝脏病理形态改变,分别运用免疫组化法、原位杂交法检测肝细胞中gst-pi蛋白和gst-pi mrna表达情况,然而其得到的动物模型肿瘤体积有限,肿瘤增强、黏附和侵袭能力一般,不利于对肿瘤细胞耐药性进行全面研究。
4.移植型肝癌模型通常是将肝癌细胞注射到小鼠腹腔,抽取腹水后分离成细胞悬液,再打开小鼠腹腔并将细胞悬液注射到小鼠肝脏建立模型。然而,现有的移植型模型成瘤时间较短,但无法观察到肝癌发生的过程,也得到模型动物肿瘤增强、黏附和侵袭能力一般,也不利于对肿瘤细胞耐药性进行全面研究。
技术实现要素:
5.有鉴于此,本技术的目的在于提取一种肝癌模型细胞、体外培养方法、模型建立方法及应用,以一定程度上解决上述技术问题之一。
6.第一方面,本技术实施例公开了一种大鼠肝癌模型细胞的体外培养方法,包括以下步骤:
7.获得大鼠肝癌细胞系rh-35细胞;
8.制备明胶/聚乳酸/透明质酸的混合液,所述混合液是以20~100mg/ml的明胶溶液、2~15mg/ml透明质酸溶液和10~50mg/ml聚乳酸溶液按照1:(1~4):1的比例混合而成;
9.三维培养,将所述rh-35细胞接种至明胶/聚乳酸/透明质酸组成三维介质和3d培养混合液中培养7~15天,即得。
10.在本技术实施例中,所述三维培养方法具体包括:
11.第一培养,将所述rh-35细胞接种至未成凝胶的明胶/聚乳酸/透明质酸混合液和3d培养混合液的培养体系中,浸润后观察细胞在培养皿中生长至70%~80%;及
12.第二培养,收获所述第一培养中得到的细胞,清洗,消化,浓缩后,转移至铺设有明胶/聚乳酸/透明质酸成型的三维培养水凝胶支架和3d培养混合液的环境中培养,培养7~15天,即得。
13.在本技术实施例中,所述3d培养混合液为包含全氟辛酸或全氟辛烷磺酸钾的高糖
dmem培养液。
14.在本技术实施例中,所述3d培养混合液包含0.3~10mg/l全氟辛酸或0.3~10mg/l全氟辛烷磺酸钾。
15.在本技术实施例中,所述高糖dmem培养液包含116.6mg/l无水氯化钙、59.05mg/l l-亮氨酸亚油酸、0.042mg/l亚油酸、0.0013mg/l五水硫酸铜、91.25mg/l l-赖氨酸盐酸盐、0.105mg/l硫辛酸、0.05mg/l九水硝酸铁、17.24mg/l l-蛋氨酸、8.1mg/l酚红、0.417mg/l七水硫酸亚铁、35.48mg/l l-苯丙氨酸、0.081mg/l 1,4-丁二胺二盐酸盐、311.8mg/l氯化钾、26.25mg/l l-丝氨酸、55mg/l丙酮酸钠、28.64mg/l氯化镁、53.45mg/l l-苏氨酸、0.0035mg/l维生素h、48.84mg/l无水硫酸镁、4.45mg/l l-丙氨酸、2.24mg/ld-泛酸钙、6999.5mg/l氯化钠、7.5mg/l l-天门冬酰胺、氯化胆碱8.98mg/l、54.35mg/l无水磷酸二氢钠、6.65mg/l l-天门冬氨酸、2.65mg/l叶酸、71.02mg/l磷酸氢二钠、17.56mg/l l-半胱氨酸盐酸盐、12.6mg/l i-肌醇、0.432mg/l七水硫酸锌、7.35mg/l l-谷氨酸、2.02mg/l烟酰胺、147.5mg/l l-精氨酸盐酸盐、17.25mg/l l-脯氨酸、2mg/l盐酸吡哆醛、31.29mg/l l-胱氨酸盐酸盐、9.02mg/l l-色氨酸、0.031mg/l盐酸吡哆醇、365mg/l l-谷氨酰胺、38.4mg/l l-酪氨酸、0.219mg/l核黄素、18.75mg/l甘氨酸、52.85mg/l l-缬氨酸、2.17mg/l盐酸硫胺、31.48mg/l l-组氨酸盐酸盐、3151mg/l d-葡萄糖、0.365mg/l胸苷、54.47mg/l l-异亮氨酸、2mg/l次黄嘌呤和0.68mg/l维生素b12。
16.第二方面,本技术实施例公开了第一方面所述的体外培养方法得到肝癌模型细胞,所述细胞按照wb表达检测计,以β-actin为参照,hab18g/cd147的相对表达量为3.6~6.07,paxillin的相对表达量为4.39~6.97,fak的相对表达量为1.85~3.17。
17.第三方面,本技术实施例公开了用于建立肝癌模型的的细胞制剂,所述细胞制剂为细胞冻存管、冻存液或冻干粉,所述细胞制剂包含权利要求6所述的肝癌模型细胞。
18.第四方面,本技术实施例公开了一种建立肝癌动物模型的方法,将第二方面所述的肝癌模型细胞或第三方面所述的细胞制剂注射待建立模型的动物,观察动物体内肿瘤体积的变化情况。
19.第五方面,本技术实施例公开了第一方面所述的体外培养方法得到的肝癌模型细胞在建立肝癌动物模型中的应用。
20.与现有技术相比,本技术至少具有以下有益效果:
21.本技术利用大鼠肝癌细胞系rh-35作为基础,将其与体外进行传代培养,并将其在配制的明胶/聚乳酸/透明质酸三维介质和高糖培养液中培养,使得培养的细胞具有丝状伪足,并在三维水凝胶接种中形成缠绕的三维细胞团,接近于体外的三维细胞及微环境。经过间接免疫荧光检测发现其关键黏附因子(paxillin,fak和p-fak)的表达均明显上调。
22.另外,本技术还通过体内试验,将各组实施例和对比例培养的rh-35移植至km小鼠体内,经过对小鼠体内肝脏肿瘤的生长情况,组织切片分析,肿瘤细胞侵袭、黏附和抗凋亡相关基因mrna表达量分析发现,经过本技术的移植方法建立肝脏肿瘤模型鼠,肿瘤增值、黏附和侵袭能力强,而且抗凋亡能力增强。由此说明,采用本技术实施例提供的rh-35细胞、体外培养方法及模型建立方法,十分适合建立典型的肿瘤药物筛选的动物模型,在靶向肿瘤药物开发中具有十分重要的实际意义。
附图说明
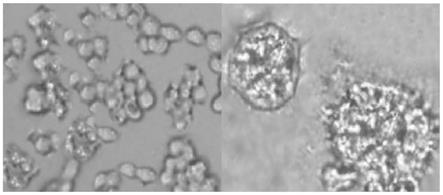
23.图1为本技术提供的rh-35细胞在3d(左图)和2d(右图)条件培养后的显微图。
24.图2为本技术提供的rh-35细胞在3d(左图)和2d(右图)条件培养后的f-actin荧光染色表达图。
25.图3为本技术提供的rh-35细胞在3d(左图)和2d(右图)条件培养后的hab18g/cd147荧光染色表达图。
26.图4为本技术提供的rh-35细胞在3d(左图)和2d(右图)条件培养后的e-cadherin荧光染色表达图。
27.图5为本技术提供的rh-35细胞在3d(左图)和2d(右图)条件培养后的paxillin荧光染色表达图。
28.图6为本技术提供的rh-35细胞在3d(左图)和2d(右图)条件培养后的fak荧光染色表达图。
29.图7为本技术提供的rh-35细胞在3d(左图)和2d(右图)条件培养后的p-fak荧光染色表达图。
具体实施方式
30.为了使本技术的目的、技术方案及优点更加清楚明白,以下结合实施例对本技术进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本技术,并不用于限定本技术。本技术中未详细单独说明的试剂均为常规试剂,均可从商业获得;未详细特别说明的方法均为常规实验方法,可从现有技术中获知。
31.体外肝癌细胞培养
32.一、材料与方法
33.大鼠肝癌细胞(rh-35,普诺赛)。pfoa(95%,pfoa)、pfos(》98.0%,pfos)。
34.1、细胞培养
35.1)大鼠肝癌细胞系rh-35细胞自液氮罐中取出冻存管,立即放入370c水浴锅中,期间要不断晃动使冻存管中的细胞解冻。
36.2)在细胞悬液中加入1.0ml预热的高糖培养基,1000rpm离心_5分钟,倒掉上清液。
37.3)加入4.0ml新鲜培养基,移液枪轻轻吹打形成悬液,移入培养瓶中(培养瓶上记录复苏日期)。
38.4)酒精棉擦拭后即可将培养瓶放入细胞培养孵箱中培养。
39.②
细胞传代
40.1)当培养瓶中的肿瘤细胞融合度在80%以上时,就能进行传代培养。
41.2)用移液枪将培养瓶中的旧培养基吸出,添加适量的pbs没过瓶底,晃动润洗细胞。吸出pbs,向培养瓶中添加适量的消化液,使得瓶底细胞都浸泡在胰酶溶液之中。
42.3)在显微镜下观察被消化的细胞,1~2分钟消化处理(细胞变圆),用无菌滴管吸去消化液,加入2.0ml高糖dmem完全培养基,吹打,制成细胞悬液,将悬液转入离心管中离心(1000rpm,5分钟),弃去上清。
43.4)向离心管中加入适量新鲜培养基,反复吹打均匀后用计数板统计细胞数量。取适量细胞悬液移入培养瓶或培养皿中,间隔一天更换一次培养基。
44.5)向离心管中加入适量新型培养基,反复吹打用并进行细胞计数。2、明胶/聚乳酸/透明质酸水凝胶的制备
45.(1)配制20~100mg/ml的明胶(10wt%,北京百灵威科技有限公司),2~15mg/ml透明质酸(杭州杰恒化工有限公司)溶液和10~50mg/ml聚乳酸(sigma-aldrich)溶液,于37℃条件下将透明质酸溶液和聚乳酸溶液用蠕动泵以1ml/min的速度缓慢滴加到明胶溶液中形成得到明胶、聚乳酸和透明质酸溶于的混合物。
46.(2)水凝胶成型:使用磁力搅拌器使其混合均匀,滴加含10mg/ml edc和5mg/ml nhs溶液至上述混合物中,滴加量占混合物质量的1%,磁力搅拌均匀后,静置交联30min,再于-80℃冷冻过夜,即可得到水凝胶。
47.3、rh-35细胞的三维水凝胶接种
48.本技术提供的rh-35细胞三维水凝胶过程大致如下:
49.(1)将未成凝胶的明胶/聚乳酸/透明质酸混合液吹打混匀后接种在24孔板中,每孔中添加200μl的3d培养混合液,浸润24孔板后将其放置在超净台工作中,静置20~30min;
50.(2)观察细胞在培养皿中生长至70%~80%,吸出旧培养液;
51.(3)用灭菌的pbs洗液清洗两次;
52.(4)加入1ml灭菌的胰蛋白酶消化液,当细胞形态趋于椭圆并从培养皿底浮起时,吸出胰酶;
53.(5)加入1ml完全培养基混匀终止消化,置于1.5ml离心管中;
54.(6)设置800rpm/min,离心4min;
55.(7)去上清,加1ml培养基,使细胞重悬,备用;
56.(8)静置30min后,取50μl(105cells/ml)细胞悬液和250μl稀释的培养基进行混合然后接种在铺上三维培养水凝胶支架的24孔板中,在培养箱中静置30min;
57.(9)待其凝固后补加培养基1ml;
58.(10)每隔一天进行细胞换液。
59.具体的实施例和对比例在配制明胶/聚乳酸/透明质酸混合液以及接种rh-35细胞中的相关参数如表1所示。表1中的3d培养液以高糖dmem培养液为基础,添加全氟辛酸(pfoa)、全氟辛烷磺酸钾(pfos)或二乙基亚硝胺(den)。
60.其中,高糖dmem培养液包含:
61.116.6mg/l无水氯化钙、59.05mg/l l-亮氨酸亚油酸、0.042mg/l亚油酸、0.0013mg/l五水硫酸铜、91.25mg/l l-赖氨酸盐酸盐、0.105mg/l硫辛酸、0.05mg/l九水硝酸铁、17.24mg/l l-蛋氨酸、8.1mg/l酚红、0.417mg/l七水硫酸亚铁、35.48mg/l l-苯丙氨酸、0.081mg/l 1,4-丁二胺二盐酸盐、311.8mg/l氯化钾、26.25mg/l l-丝氨酸、55mg/l丙酮酸钠、28.64mg/l氯化镁、53.45mg/l l-苏氨酸、0.0035mg/l维生素h、48.84mg/l无水硫酸镁、4.45mg/l l-丙氨酸、2.24mg/ld-泛酸钙、6999.5mg/l氯化钠、7.5mg/l l-天门冬酰胺、氯化胆碱8.98mg/l、54.35mg/l无水磷酸二氢钠、6.65mg/l l-天门冬氨酸、2.65mg/l叶酸、71.02mg/l磷酸氢二钠、17.56mg/l l-半胱氨酸盐酸盐、12.6mg/l i-肌醇、0.432mg/l七水硫酸锌、7.35mg/l l-谷氨酸、2.02mg/l烟酰胺、147.5mg/l l-精氨酸盐酸盐、17.25mg/l l-脯氨酸、2mg/l盐酸吡哆醛、31.29mg/l l-胱氨酸盐酸盐、9.02mg/l l-色氨酸、0.031mg/l盐酸吡哆醇、365mg/l l-谷氨酰胺、38.4mg/l l-酪氨酸、0.219mg/l核黄素、18.75mg/l甘氨
酸、52.85mg/l l-缬氨酸、2.17mg/l盐酸硫胺、31.48mg/l l-组氨酸盐酸盐、3151mg/l d-葡萄糖、0.365mg/l胸苷、54.47mg/l l-异亮氨酸、2mg/l次黄嘌呤和0.68mg/l维生素b12。
62.配制过程大致为:取三蒸水溶解后,ph调节至7.13~7.14,容量瓶定容至1.0l,最后各加入10万单位的青霉素和链霉素。配好的溶液用0.22μm无菌滤器抽滤除菌,放入4℃储存备用。
63.表1
64.[0065][0066]
表1中,对比例1的rh-35细胞直接使用含有5mg/lpfoa的上述高糖dmem培养液进行培养。
[0067]
4、细胞爬片实验
[0068]
将上述实施例1~6和对比例2~6在3d细胞培养条件下培养6天、对比例1悬浮培养6天后的细胞,在显微镜下观察细胞克隆生长状态良好时可以制作冰冻组织切片。具体过程如下:
[0069]
1)4%pfa于室温固定20分钟,pbs(ph7.4)震洗三次;
[0070]
2)用tissue-tek oct冰冻组织包埋剂(翊圣生物)于低温包埋rh-35细胞克隆10~15分钟。
[0071]
3)在-20℃条件下用低温切片机制作冰冻切片(10μm/片),并将冰冻组织切片固定
于apes处理过的载玻片上,于-70℃冰箱储存,备用。
[0072]
5、丝状肌动蛋白(f-actin)直接免疫荧光染色
[0073]
1)将2d或3d两种条件下培养的rh-35用0.1%tritonx-100溶液处理5min;
[0074]
2)5%正常山羊血清于37℃封闭30min;
[0075]
3)滴加tritc直标鬼笔环肤抗体(1:40)室温避光孵育20min;
[0076]
4)dapi复染细胞核1分钟,抗荧光抗体淬灭封片剂封片。
[0077]
6、hab 18g/cd 147和e-cadher i n jet接免疫荧光染色
[0078]
1)将固定好的2d或3d两种条件下培养的rh-35细胞直接用5%正常山羊血清于37℃封闭30min;
[0079]
2)分别滴加抗鼠habl 8g/cd147一抗(5μg/ml,货号ck002-01,太平洋美诺克)和鼠抗人e-cadherin一抗(1:50,艾美捷,货号abp51221),37℃孵育1小时。
[0080]
3)滴加羊抗鼠fitc标记荧光二抗,37℃孵育40min;
[0081]
4)用dapi复染细胞核1分钟,抗荧光抗体淬灭封片剂封片。
[0082]
7、fak、p-fak和paxillin间接免疫荧光染色
[0083]
1)固定好的2d或3d两种条件下培养的rh-35细胞用0.1%triton x-100处理5min;
[0084]
2)5%正常山羊血清于37℃封闭30min;
[0085]
3)分别滴加鼠抗人fak一抗((1:100)、鼠抗人p-fak一抗((1:100)和鼠抗人paxillin一抗(1:1000),37℃孵育1h;
[0086]
4)分别滴加羊抗鼠fitc标记荧光二抗,37℃孵育40min;
[0087]
5)用dapi复染细胞核1min,抗荧光抗体淬灭封片剂封片。
[0088]
8、western blotting
[0089]
(1)rh-35细胞在3d或2d培养条件下培养8天后,回收细胞,滴加ripa细胞裂解液提取细胞总蛋白;用bca法对细胞总蛋白定量,-200c储存,备用。
[0090]
(2)100v恒压对提取的蛋白样品电转1h至pvdf膜上,5%脱脂奶粉室温封闭3h。
[0091]
(3)分别滴加鼠抗鼠habl 8g/cd147一抗(0.5μg/ml)、鼠抗人fak一抗(1:1000)和鼠抗人paxillin一抗(1:10000)于已封闭pvdf膜上,4℃卵孚育过夜后,pbst洗膜后滴加羊抗鼠hrp二抗,室温孵育1h,于暗室中发光。以β-actin作为内参。
[0092]
9、明胶酶谱实验
[0093]
(1)rh-35细胞在两种不同培养条件下培养6小时(细胞贴壁后),将含10%nbcs、1%氨节青霉素/链霉素和2%谷氨酰胺的完全rpmi1640细胞培养基更换为无血清rpmi 1640细胞培养基。
[0094]
(2)在条件培养基培养条件下,将不同培养条件下培养的细胞置于37℃、5%co2和饱和湿度的细胞培养箱继续培养8小时。
[0095]
(3)收集上述培养上清,4℃低温离心。培养上清和非还原上样缓冲液混匀,55℃孵育5分钟,备用。
[0096]
(4)用含0.1%明胶的12%的聚丙烯酰胺凝胶对上述样品进行聚丙烯酞胺凝胶电泳,用考马斯亮兰染色,用脱色液脱色至目的条带清晰。
[0097]
二、结果
[0098]
如图1所示,在8天的培养过程中,rh-35细胞在2d细胞培养模型中只能形成单层、
贴壁的多角形的细胞克隆,而在3d细胞培养模型中逐渐形成巨大的、无极性的球状细胞克隆。此外,在3d细胞培养条件下,rh-35细胞在培养4天后于球状细胞克隆表面开始形成丝状伪足,并且伪足形成的数量随培养时间的延长而逐渐增多,而且随培养时间的延长细胞克隆表面逐渐长出丝状伪足缠绕至水凝胶介质中,以形成三维细胞团。而在对比例1提供的普通二维生长环境中,并未出现明显的细胞成团现象。
[0099]
间接免疫荧光结果如图2~7所示。如图2所示,rh-35细胞在3d细胞培养的f-acitin表达水平高于2d培养(图中亮度更高),且而在3d细胞培养模型中,f-actin的张力丝环绕于球状细胞克隆中每一个细胞表面。如图3所示,rh-35细胞在3d细胞培养模型中hab18g/cd147的表达的荧光强度也高于明显高于在2d细胞培养条件下的荧光强度。如图4所示,rh-35细胞在3d细胞培养模型中黏着小带e-cadherin的表达明显高于在2d培养条件的表达。如图5~7所示,rh-35细胞在3d细胞培养模型中关键黏附因子(paxillin,fak和p-fak)的表达均明显上调。由此,经过间接免疫荧光检测发现,本技术对rh-35细胞进行3d培养,由于三维基质对细胞维持三维微环境起到增强作用,促使其rh-35细胞的张力丝、关键黏附因子等等表达增强,为其实现黏附、侵袭等功能提供了帮助。
[0100]
本实验进一步利用wb检测了各实施例和对比例提供的rh-35细胞培养模式下,hab18g/cd147、paxillin和fak的相对表达量,结果列入表2,并对表2的每列数据进行多重比较和显著性差异标记,表2为wb电泳条带的计算相对灰度值,用于表征各蛋白的相对表达量。
[0101]
表2
[0102][0103][0104]
由表2可知,实施例1~6提供的三维培养模式下,rh-35细胞中hab18g/cd147、paxillin和fak的相对表达量均显著高于对比例1~6,说明本技术实施例提供的三维培养模式更利于相关蛋白的表达,与上述的免疫荧光染色结果一致。
[0105]
动物实验
[0106]
一、材料与方法
[0107]
1、实验动物饲养
[0108]
km小鼠,6~8周龄spf级雄性体重18~22g,湖南斯莱克景达实验动物有限公司。实验前适应性喂养1周,并按实验动物使用的3r原则给予人道的关怀。
[0109]
2、小鼠肝癌模型构建
[0110]
将雄性km小鼠预饲养适应环境一周后分别为正常组、实验组、对照组。正常组10只,正常喂养。实验组按照实施例1~6和对比例1~6分为12组,每组10只,各组小鼠经右下胁部皮下经过上述各实施例或对比例体外培养得到的rh-35细胞,注射剂量为5mg/kg体重,每日1次,共注射7次。对照组分为3组,分别按照实验组的相同剂量注射pfoa、pfos或den。观察至第20周结束,每天观察并记录小鼠毛发、饮食、运动等。小鼠每周称重一次,整个实验过程中所有小鼠均为自由进食饮水,垫料隔天更换一次。电子游标卡尺测量小鼠体内肿瘤体积的变化情况。
[0111]
3、动物组织样本回收
[0112]
于实验第20周后,人道处死小鼠,摘眼球取血,血液静置1~2小时后,1000r/min离心10min,用移液枪吸取上层血清至新的ep管,-80℃冷冻保存,用于测定血清肝功能相关指标。
[0113]
于手术台上剥离小鼠肝脏及肾脏,并称重,拍照记录肝脏的形态、颜色、质地。将取出的肝脏及肾脏生理盐水中洗去表面血液后,一分为二,一部分放入10%中性福尔马林中固定24小时后,用于组织病理学检测,另一部分保存于-80℃冰箱用于后续检测。
[0114]
4、肝脏和肾脏组织切片制作
[0115]
取小鼠肝脏(肾脏),生理盐水冲洗表面血液;切取肝脏(肾脏),10%中性福尔马林室温固定24h后;依次用蒸馏水浸泡2h、75%乙醇浸泡2h、85%乙醇浸泡2h、95%乙醇浸泡1.5h、95%乙醇浸泡1h、100%乙醇浸泡2h、100%乙醇浸泡1h脱水;最后再用二甲苯洗涤1h,洗涤2次,洗涤至透明状后浸入石蜡溶液后,冷却,切片,切出每片石蜡组织厚度为3μm;切片放入摊片机,待石蜡组织切片完全展开后,贴于多聚赖氨酸处理过的玻片上,60℃烘片;37℃烘箱过夜烘干,室温保存。
[0116]
5、血液中生化指标检测
[0117]
本实验采用thermo scientific
tm indiko&indiko plus全自动生化分析仪检测血清肝损伤标志物谷丙转氨酶(alt)、谷草转氨酶(ast)的表达水平。
[0118]
6、组织切片h&e染色及评分
[0119]
将上述制得的小鼠肝脏组织切片放入二甲苯脱溶液中脱蜡处理3次,每次5min;然后依次采用100%乙醇、95%乙醇、90%乙醇、80%乙醇、70%乙醇和蒸馏水分别冲洗洗5min后,再于切片上滴加苏木精染色10min,温水中返蓝10min,伊红染色3min后;再依次用75%乙醇、85%乙醇、95%乙醇和100%乙醇分别浸提处理10min;用二甲苯冲洗3次,每次5min,直至切片透明,最后用中性树脂封片。将h&e染色后的肝组织切片置于显微镜下观察,对其脂肪化和炎症进行双盲评分。
[0120]
脂肪化的标准为脂肪化的肝细胞占总细胞的比例为1~25%时记为1分;25~50%记为2分;50~75%时记为3分;》75%时记为4分。
[0121]
炎症的评分标准为,于低倍镜下观察到1个病灶记为1分;观察到2个或两个以上病灶,记为2分。
[0122]
7、肝脏组织切片masson染色及评分
[0123]
将肝脏组织切片放入二甲苯脱蜡处理2次,每次10min;然后依次浸入100%乙醇、95%乙醇、90%乙醇、80%乙醇、70%乙醇和蒸馏水分别处理5min;再用苏木精溶液滴加至切片上,染色处理2~3min;蒸馏水洗冲洗5min;用ph=4.5的盐酸酒精溶液浸提3次,再次蒸馏水洗5min后;滴加丽春红酸性品红溶液染色5min;蒸馏水冲洗1min,1%磷铝酸溶液固定5min;用醋酸溶液浸提2次,每次5min;再依次用95%乙醇、100%乙醇和二甲苯分别处理切片5min至透明,最后用中性树脂封片。
[0124]
将masson染色后的肝组织切片置于显微镜下观察,对其纤维化进行双盲评分。纤维化评分标准与炎症相同。
[0125]
8、rt-pcr检测相关基因mrna表达水平并定量
[0126]
收集各组小鼠肝脏组,切碎,匀浆后,用胰蛋白酶充分消化,1500r/min离心5min后收集细胞;trizol试剂盒提取细胞中总rna,按照primescript rt reagent kit试剂盒说明书反转录成cdna,再将cdna进行实时定量rt-pcr实验,引物由上海生工公司提供,各引物序列见表3所示。
[0127]
pcr反应体系为:双蒸水8.5μl、dna模板2μl、上下游引物各1μl,cdna 3μl、taq酶12.5μl,总反应体系28μl;反应条件:95℃预变性5min,95℃变性15s;60℃退火30s,72℃延伸45s,40个循环后,72℃5min;每个基因设多个,取平均值;记录目的基因ct值,以gapdh为内参照,计算snail、e-cadherin mrna相对表达量(2-δδct);其中
△
ct=ct(样品)-ct(gapdh)。
[0128]
表3
[0129]
引物名序列snail-ftcgcgagcttgcttggcga,如seq id no.1所示snail-rgctgtcaggcgcgctgcgata,如seq id no.2所示e-cadherin-fgtgacataagttcggactgcg,如seq id no.3所示e-cadherin-rgctggttaggatcatggcaagt,如seq id no.4所示hesl-fcgaagagcaagaataaat,如seq id no.5所示hesl-rgaatgaggaaagcaaact,如seq id no.6所示bcl-2-fatggcgcacgctgggagaac,如seq id no.7所示bcl-2-rgcggtagcggcgggagaagt,如seq id no.8所示gapdh-fcagagctagaacacggcagcg,如seq id no.9所示gapdh-rtgcggcgatggctaggcgtga,如seq id no.10所示
[0130]
9、细胞周期检测
[0131]
收集各组小鼠肝脏组织,切碎,匀浆后,用胰蛋白酶充分消化,1500r/min离心5min后收集细胞;pbs冲洗细胞3次后,取200μl 105个/ml细胞悬液,加入2.5μl annexin v/fitc和5μl pi孵育15min,流式细胞仪分析细胞周期的分布情况。
[0132]
10、数据处理
[0133]
所有测试数据均以平均值和标准偏差表示,应用spss13.0软件处理数据,并对数据进行多重比较和显著性差异标记。
[0134]
二、结果
[0135]
表4
[0136][0137]
表4可知,相对正常组,对照组和实验组小鼠血清中alt和ast含量均显著升高,说明对照组和实验组中小鼠的肝脏功能受到损伤。相对于正常组,实验组和对照组小鼠体内肝脏在第20周后均出现了肿瘤,并且实验组中实施例1~6小鼠肝脏肿瘤体积均显著高于对照组和对比例1~6,说明采用实施例1~6提供的rh-35细胞进行移植造模,能够获得肿瘤体积更大的荷瘤小鼠。
[0138]
表5
[0139]
[0140][0141]
表5可知,对照组和实验组小鼠血清中的脂肪化评分、炎症评分、纤维化评分和肝损评分均显著高于正常组,说明对照组和实验组中小鼠造模过程中,小鼠肝脏功能、炎症和纤维化等等功能受到了全方位损伤,造模更为成功,实施例1~6提供的rh-35细胞致癌能力更强。
[0142]
表6
[0143][0144]
由表6可知,正常组小鼠肝脏细胞仅有19.23%比例的细胞处于g2/m时期,而对照组和对比例1~6提供的rh-35细胞移植小鼠后,小鼠肝脏肿瘤细胞中g2/m时期比例与正常组相比无显著差异。而实验组中,实施例1~6提供的rh-35细胞移植小鼠后,小鼠肝脏肿瘤细胞中g2/m时期比例显著高于正常组。而肝脏肿瘤细胞中处于g2/m时期,细胞增值和生长
35细胞移植小鼠后,小鼠肝脏肿瘤细胞抗凋亡能力增强。而对比例1~6和对照组的snail表达量和e-cadherin表达量与正常组相比不明显,说明对比例1~6提供的rh-35细胞移植小鼠后,其形成的肝脏肿瘤抗凋亡能力一般,不利于对形成的模型小鼠进行研究。
[0150]
综上所述,本技术利用大鼠肝癌细胞系rh-35作为基础,将其与体外进行传代培养,并将其在配制的明胶/聚乳酸/透明质酸三维介质和高糖培养液中培养,使得培养的细胞具有丝状伪足,并在三维水凝胶接种中形成缠绕的三维细胞团,接近于体外的三维细胞及微环境。经过间接免疫荧光检测发现其关键黏附因子(paxillin,fak和p-fak)的表达均明显上调。
[0151]
另外,本技术还通过体内试验,将各组实施例和对比例培养的rh-35移植至km小鼠体内,经过对小鼠体内肝脏肿瘤的生长情况,组织切片分析,肿瘤细胞侵袭、黏附和抗凋亡相关基因mrna表达量分析发现,经过本技术的移植方法建立肝脏肿瘤模型鼠,肿瘤增值、黏附和侵袭能力强,而且抗凋亡能力增强。由此说明,采用本技术实施例提供的rh-35细胞、体外培养方法及模型建立方法,十分适合建立典型的肿瘤药物筛选的动物模型,在靶向肿瘤药物开发中具有十分重要的实际意义。
[0152]
以上所述,仅为本技术较佳的具体实施方式,但本技术的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本技术揭露的技术范围内,可轻易想到的变化或替换,都应涵盖在本技术的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1