一种融合蛋白及其制备司美格鲁肽中间体多肽的方法与流程
1.本发明涉及一种融合蛋白及其制备司美格鲁肽中间体多肽的方法,具体涉及一种可高效制备司美格鲁肽中间体多肽arg34glp-1(9-37)的融合蛋白序列,属于基因工程及多肽制备技术领域。
背景技术:
2.2型糖尿病(t2dm)是由多种病因造成人体胰岛β细胞功能受损、胰岛素分泌不足或者靶组织的胰岛素抵抗力增强引起的慢性代谢性紊乱综合症,临床上主要表现为多饮、多食、多尿及体重减轻等症状,并具有突发糖尿酮症酸中毒、高渗性昏迷等并发症的风险。t2dm是一种慢性代谢疾病,多在35~40岁之后发病,占糖尿病患者90%以上。目前,临床上治疗糖尿病的药物主要集中在各类胰岛素和四大类口服降糖药。为了让糖尿病患者在治疗时有更多的选择,一些新型的治疗糖尿病药物在21世纪初应运而生,如胰高糖素样肽-1(glp-1)类似物,这类药物是在内源glp-1的基础上经过结构改变而成的。内源性的glp-1是由肠道l细胞分泌的一种肠促降糖激素,含有30多个氨基酸,能通过广泛分布人体心脏、肝脏、肾脏、胰腺、胃肠道等多器官组织的细胞膜表面的glp-1受体结合,引发细胞内部相关信号传导路径发生改变,从而发挥相应的调节机体的功能,所以glp-1具有多功能、多靶点的作用特点,尤其对胰岛细胞的调节功能尤为显著,能根据体内葡萄糖水平按需促进胰岛素分泌。但唯一的不足是glp-1在人体内很容易被二肽基肽酶iv降解,半衰期大约2min,这就限制了其临床运用。结构改造后的glp-1制剂既保留了glp-1的药理作用,又大大提高了药物的作用时间。
3.司美格鲁肽(semaglutide)是由nove nordisk公司研发的长效glp-1类似物,通过基因重组技术,利用酵母生产获得,该药物只需要进行每周一次的皮下注射给药。司美格鲁肽作为glp-1类似物的代表药物之一,在多个临床试验研究已经证明联合不同的口服降糖药可以有效控制血糖,并能够使患者减轻体重、减少收缩压及改善胰岛β细胞功能。
4.司美格鲁肽的主链结构为一个含有29个氨基酸的中间体多肽arg34glp-1(9-37)或含有27个氨基酸的中间体多肽arg34glp-1(11-37),其氨基酸序列分别为egtftsdvssylegqaakefiawlvrgrg(seq id no:1)和tftsdvssylegqaakefiawlvrgrg(seq id no:2)。目前现有技术中该中间体多肽主要通过化学合成的方法制备(公开号为cn105753964a的专利文献,公开于2016年),但是化学法工艺步骤多,合成过程中需要使用多种的有机溶剂且使用量较大,不利于工业化放大且对环境不友好,且化学合成多肽中潜在的氨基酸消旋体杂质给该药的长期使用带来一定风险。而其他生物法制备该中间体多肽的方法包括胞内可溶性表达、包涵体表达以及包涵体形式的串联表达。其中,胞内可溶性表达(公开号为cn104745597a的专利文献,公开于2015年)的表达量较低,不具备工业化放大价值;涉及包涵体表达的专利cn110498849a(公开于2019年)公开了一种高纯度和高收率的制备司美格鲁肽主肽链的方法,但是其中公开的优选前导肽序列kpstyi属于短肽序列,无法有效提高融合蛋白的表达量;另外,在专利公开号为cn111378027a(公开于2020年)的专
利文献中针对司美格鲁肽的中间体多肽进行了串联表达,利用kexii蛋白酶酶切位点kr作为linker,需要经过kexii酶以及羧肽酶b两步酶切得到司美格鲁肽的中间体多肽,步骤繁琐且kexii酶价格昂贵,不具备工业化放大意义。
5.基于现有技术存在上述技术问题,因此迫切需要寻找一种融合蛋白表达量更高、工艺步骤更简单、更适合工业化生产的方法。
技术实现要素:
6.针对目前在司美格鲁肽制备中存在的问题,本发明公开了一种可高效制备司美格鲁肽中间体多肽arg34glp-1(9-37)或arg34glp-1(11-37)的融合蛋白序列。该融合蛋白包括一段融合肽,蛋白酶酶切位点和目的主分子序列,并以遗传背景清晰、易于培养、发酵周期短的大肠杆菌表达系统为基础,构建重组菌株。通过优化融合肽序列,改变蛋白等电点及亲水性等性质,有效提高了融合蛋白的表达量。随后对融合蛋白序列进行酶切,得到司美格鲁肽中间体多肽arg34glp-1(9-37)或arg34glp-1(11-37)。
7.为了实现上述发明目的,本发明所公开的技术方案如下:
8.本发明的第一个目的是提供一种融合肽,所述融合肽序列如下所示:
9.matkavsvlkgdgpvqgiinfeqkesngpvkvwgsikgltx1glhgfhvhkx2fvnqhlcgshlvalylvx3;
10.所述x1为谷氨酸和组氨酸中的任意一个氨基酸;
11.所述x2为色氨酸、亮氨酸、缬氨酸中的任意0个、1个、2个或3个的排列组合;
12.所述x3为组氨酸、丙氨酸中的任意0个、1个或2个的排列组合。
13.在一种实施方式中,所述的融合肽序列如seq id no:3、seq id no:4、seq id no:5、seq id no:6、seq id no:7、seq id no:8、seq id no:9、seq id no:10或seq id no:11所示任一,具体如下:
14.matkavsvlkgdgpvqgiinfeqkesngpvkvwgsikglteglhgfhvhkfvnqhlcgshlvalylv(seq id no:3);
15.matkavsvlkgdgpvqgiinfeqkesngpvkvwgsikglteglhgfhvhkfvnqhlcgshlvalylvha(seq id no:4);
16.matkavsvlkgdgpvqgiinfeqkesngpvkvwgsikglthglhgfhvhkfvnqhlcgshlvalylv(seq id no:5);
17.matkavsvlkgdgpvqgiinfeqkesngpvkvwgsikglteglhgfhvhkfvnqhlcgshlvalylvh(seq id no:6);
18.matkavsvlkgdgpvqgiinfeqkesngpvkvwgsikglteglhgfhvhkwlvfvnqhlcgshlvalylvh(seq id no:7);
19.matkavsvlkgdgpvqgiinfeqkesngpvkvwgsikglthglhgfhvhkwlvfvnqhlcgshlvalylv(seq id no:8);
20.matkavsvlkgdgpvqgiinfeqkesngpvkvwgsikglthglhgfhvhkwlfvnqhlcgshlvalylv(seq id no:9);
21.matkavsvlkgdgpvqgiinfeqkesngpvkvwgsikglthglhgfhvhkwvfvnqhlcgshlvalylv(seq id no:10);
22.matkavsvlkgdgpvqgiinfeqkesngpvkvwgsikglthglhgfhvhkwfvnqhlcgshlvalylv(seq id no:11)。
23.本发明的第二个目的是提供一种融合蛋白,所述融合蛋白包含权利要求1所述的融合肽,所述融合蛋白包括融合肽-ddddk-arg34glp-1(9-37)或融合肽-ddddk-arg34glp-1(11-37);
24.所述arg34glp-1(9-37)的氨基酸序列如seq id no:1所示;
25.所述arg34glp-1(11-37)的氨基酸序列如seq id no:2所示。
26.本发明的第三个目的是提供了编码所述融合蛋白的基因。
27.本发明的第四个目的是提供了一种重组表达载体,所述重组表达载体含有编码所述融合蛋白的基因。
28.在一种实施方式中,所述重组表达载体包括但不限于pet系列、duet系列、pgex系列、phy300、phy300plk、ppic3k、ppic9k或ptrc系列载体。
29.在一种实施方式中,所述pet系列载体包括pet-24a(+)、pet-28a(+)、pet-29a(+)、pet-30a(+);所述duet系列载体包括prsfduet-1、pcdfduet-1;所述ptrc系列系列载体包括ptrc99a。
30.本发明的第四个目的是提供了表达所述融合蛋白,或含有编码所述融合蛋白的基因的重组微生物细胞。
31.在一种实施方式中,所述微生物细胞的宿主包括但不限于大肠杆菌、枯草芽孢杆菌或毕赤酵母。
32.在一种实施方式中,所述大肠杆菌包括大肠杆菌jm109(de3)、大肠杆菌hms174(de3)、大肠杆菌bl21(de3)、大肠杆菌rostta2(de3)、大肠杆菌rosttagami(de3)、大肠杆菌rostta2(de3)、大肠杆菌dh5α、大肠杆菌w3110和/或大肠杆菌k12。
33.本发明的第五个目的是提供了制备司美格鲁肽中间体多肽arg34glp-1(9-37)或arg34glp-1(11-37)的方法,利用所述重组微生物细胞发酵生产司美格鲁肽中间体多肽arg34glp-1(9-37)或arg34glp-1(11-37)。
34.在一种实施方式中,将所述重组微生物细胞在35~40℃下培养10~12h,得到种子液,然后按照0.1%~2%(v/v)的接种量接入tb培养基中培养至发酵液od
600
值达到6~8时,加入终浓度为0.05~1mm的iptg进行诱导,在25~40℃下诱导14~18h后结束发酵,将发酵后的菌体破碎并提取、酶切得到司美格鲁肽中间体多肽arg34glp-1(9-37)或arg34glp-1(11-37)。
35.优选地,将所述重组微生物细胞在37℃下培养12h,得到种子液,然后按照0.2%(v/v)的接种量接入tb培养基中培养至发酵液od
600
值达到6~8时,加入终浓度为0.1mm的iptg进行诱导,在37℃下诱导16h后结束发酵。
36.在一种实施方式中,将所述重组微生物细胞在lb培养基中35~40℃下培养8~12h,得到细胞种子液,将细胞种子液接入基础发酵培养基进一步培养8~12h得到二级种子液,然后接入含有基础发酵培养基中进行培养;当发酵液od
600
的值达到100~200时,加入终浓度为0.05~1mm的iptg进行诱导,在25~40℃下诱导8~18h后结束发酵,收集菌体,将菌体破碎并提取、酶切得到司美格鲁肽中间体多肽arg34glp-1(9-37)或arg34glp-1(11-37)。
37.优选地,将所述重组微生物细胞在lb培养基中37℃下培养8h,得到细胞种子液,将
细胞种子液接入基础发酵培养基进一步培养8h得到二级种子液,然后接入含有6l的基础发酵培养基(bfm培养基)中进行培养;当发酵液od
600
的值达到150时,加入终浓度为0.1mm的iptg进行诱导,在37℃下诱导12h后结束发酵,收集菌体,将菌体破碎并提取、酶切得到司美格鲁肽中间体多肽arg34glp-1(9-37)或arg34glp-1(11-37)。
38.在一种实施方式中,将菌体破碎后离心收集得到包涵体沉淀,将包涵体利用洗涤缓冲液进行洗涤,将洗涤后的包涵体在ph为6.0~10.0的条件下,按照蛋白浓度为5~55g/l加入包涵体溶解缓冲液,进一步优选为按照蛋白浓度为20~30g/l加入包涵体溶解缓冲液,进行溶解,将溶解后的融合蛋白经肠激酶在30~35℃下酶解20~24h后即可得到中间体多肽、标签和连接肽的混合液,混合液使用离子交换分离即可获得纯度符合要求的中间体多肽样品,纯化后的司美格鲁肽中间体多肽hplc纯度最高可以达到92.5%以上。
39.在一种实施方式中,所述溶解缓冲液成分为25mm tris,0.1mm edta-2na,调节ph至7.5~8.0对包涵体进行溶解。
40.在一种实施方式中,将菌体与破碎缓冲液按照体积比1:2的量混合,通过高压均质机破碎菌体,离心收集包涵体沉淀;将包涵体沉淀按体积比1:2加入洗涤缓冲液进行洗涤,将洗涤后的包涵体按照蛋白浓度为25g/l加入包涵体溶解缓冲液,进行溶解,将溶解后的融合蛋白经肠激酶在35℃下酶解24h后即可得到中间体多肽、标签和连接肽的混合液。
41.在一种实施方式中,所述破碎缓冲液的成分为25mm tris,10mm edta-2na,ph7.5~8.0。
42.在一种实施方式中,所述洗涤缓冲液的成分为25mm tris,0.25m尿素,1%吐温20,ph7.5。
43.本发明提供了所述融合肽,或所述融合蛋白,或编码所述融合蛋白的基因,或所述重组表达载体,或所述微生物细胞在制备司美格鲁肽中间体多肽arg34glp-1(9-37)中的应用。
44.本发明中包涵体表达量较佳的是seq id no:4、seq id no:5和seq id no:11这三条序列。推测可能原因是大肠杆菌bl21体系更易表达中性蛋白,提高融合蛋白的等电点,可以有效提高外源融合蛋白在大肠杆菌里的表达效率,但当等电点过高时,也会影响融合蛋白的表达效率。同时,在提取过程中,平均亲水性较高的蛋白容易溶解在上清里,导致包涵体提取过程中的损失。虽然通过降低融合蛋白的平均亲水性可以降低包涵体提取过程中的损失,但是平均亲水性过低,及疏水性较强会导致融合蛋白在大肠杆菌的胞内体系中无法有效地翻译及表达,因此,当融合蛋白的平均亲水性控制在一个合适的范围内时,可以得到较高的包涵体表达量。
45.本发明相对现有技术,具有以下优势:
46.(1)通过改变融合肽序列,提高融合蛋白(融合肽-ddddk-arg34glp-1(9-37))的等电点,表达量显著增加;且后处理仅需单步酶切,减少工艺步骤;中间体多肽的收率和纯度均比现有技术有所提高;
47.(2)平衡融合蛋白疏水性,减少包涵体提取过程中因亲水性引起的溶解损失,显著提高提取及酶切收率,降低成本,有利于工业化放大;
48.(3)本发明制备的融合蛋白的表达量最高可达13.1g/l,酶切后司美格鲁肽中间体多肽的粗品含量可以达到3.62g/l,纯化后纯度达到92.5%,收率大于86.2%。
附图说明
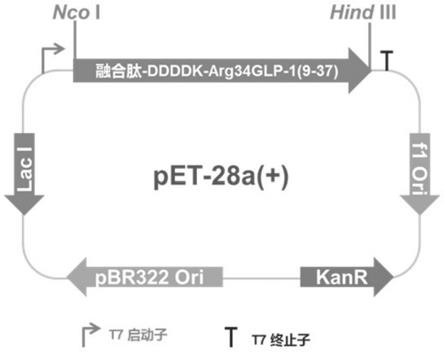
49.图1是实施例1中重组质粒的构建图。
50.图2是实施例19离子交换目的峰的hplc图谱。
具体实施方式
51.为便于本领域技术人员理解本发明内容,下面将结合具体实施例进一步描述本发明的技术方案,但以下内容不应以任何方式限制本发明权利要求书请求保护的范围。
52.下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
53.bfm-培养基:磷酸氢二铵6g/l,氯化铵4g/l,磷酸二氢钾13.5g/l,7水合硫酸镁1.39g/l,1水柠檬酸2.8g/l,酵母粉(安琪802)3g/l,微量元素(大肠)10ml/l,用10m naoh调节ph至7.0。
54.实施例1:构建表达司美格鲁肽中间体多肽融合蛋白的重组工程菌
55.设计一个用于在大肠杆菌中表达的融合蛋白序列:融合肽-ddddk-arg34glp-1(9-37)。
56.融合肽的氨基酸序列首先可以增强表达,其次可以保护中间体多肽arg34glp-1(9-37),防止其被大肠杆菌自身的蛋白酶降解。融合肽的氨基酸序列是matkavsvlkgdgpvqgiinfeqkesngpvkvwgsikglteglhgfhvhkfvnqhlcgshlvalylv(seq id no:3)。所述融合肽序列的c末端通过ddddk残基连接司美格鲁肽的中间体多肽arg34glp-1(9-37),因此完整的融合蛋白氨基酸序列为matkavsvlkgdgpvqgiinfeqkesngpvkvwgsikglteglhgfhvhkfvnqhlcgshlvalylvddddkegtftsdvssylegqaakefiawlvrgrg(seq id no:12),该序列等电点为6.2,平均亲水性为0。
57.利用融合pcr技术合成编码上述融合蛋白的核苷酸序列,将获得的核酸序列通过nco i/hind iii酶切位点插入到质粒pet-28a(+)的相应的酶切位点中,重组质粒图谱如图1所示。将该重组质粒转入到宿主大肠杆菌bl21(de3)中,获得表达司美格鲁肽中间体多肽融合蛋白的重组工程菌s1。
58.实施例2:摇瓶体系司美格鲁肽中间体多肽融合蛋白的表达
59.将实施例1得到的重组工程菌s1在lb培养基中37℃下培养12h,得到种子液,然后按照0.2%(v/v)的接种量接入tb培养基中进行培养。当发酵液od
600
的值达到6~8时,加入终浓度为0.1mm的iptg进行诱导,37℃下诱导16h后结束发酵,离心收集菌体。
60.实施例3:摇瓶体系中司美格鲁肽中间体多肽融合蛋白的表达及表达量检测
61.将实施例2中得到的发酵菌体洗涤,利用超声破碎仪破碎菌体,将破碎混悬液离心,收集包涵体。对全菌体和包涵体进行sds-page检测,并利用光密度仪检测目的蛋白的电泳纯度。同时利用bca试剂盒检测全菌体和包涵体的总蛋白量。将总蛋白量和电泳纯度相乘得到中间体多肽融合蛋白的表达量。经检测,重组工程菌s1经发酵诱导表达后,得到1.56g/l的融合蛋白,破碎洗涤后得到0.95g/l包涵体。
62.实施例4:重组菌株的构建及在摇瓶体系中表达司美格鲁肽中间体多肽融合蛋白
63.采用融合肽的氨基酸序列如seq id no:4所示,在c末端通过ddddk残基连接司美格鲁肽的中间体多肽arg34glp-1(9-37),得到含有seq id no:4融合肽序列的融合蛋白,其等电点为6.4,平均亲水性为0。按照实施例1的操作构建重组工程菌s2,并按照实施例2和实
施例3的操作进行表达,测得重组工程菌s2经发酵诱导表达后,得到1.44g/l的融合蛋白,破碎洗涤后得到1.32g/l包涵体。
64.实施例5:重组菌株的构建及在摇瓶体系中表达司美格鲁肽中间体多肽融合蛋白
65.采用融合肽的氨基酸序列为seq id no:5所示,在c末端通过ddddk残基连接司美格鲁肽的中间体多肽arg34glp-1(9-37),得到含有seq id no:5融合肽序列的融合蛋白,其等电点为6.7,平均亲水性为0。按照实施例1的操作构建重组工程菌s3,并按照实施例2~3的操作进行表达,测得重组工程菌s3经发酵诱导表达后,得到1.73g/l的融合蛋白,破碎洗涤后得到1.43g/l包涵体。
66.实施例6:重组菌株的构建及在摇瓶体系中表达司美格鲁肽中间体多肽融合蛋白
67.采用融合肽的氨基酸序列为seq id no:6,在c末端通过ddddk残基连接司美格鲁肽的中间体多肽arg34glp-1(9-37),得到含有seq id no:6融合肽序列的融合蛋白,其等电点为6.4,平均亲水性为0。按照实施例1的操作构建重组工程菌s4,并按照实施例2~3的操作进行表达,测得重组工程菌s4经发酵诱导表达后,得到1.36g/l的融合蛋白,破碎洗涤后得到1.17g/l包涵体。
68.实施例7:重组菌株的构建及在摇瓶体系中表达司美格鲁肽中间体多肽融合蛋白
69.采用融合肽的氨基酸序列为seq id no:7,在c末端通过ddddk残基连接司美格鲁肽的中间体多肽arg34glp-1(9-37),得到含有seq id no:7融合肽序列的融合蛋白,其等电点为6.4,平均亲水性为-0.1。按照实施例1的操作构建重组工程菌s5,并按照实施例2~3的操作进行表达,测得重组工程菌s5经发酵诱导表达后,得到0.93g/l的融合蛋白,破碎洗涤后得到0.87g/l包涵体。
70.实施例8:重组菌株的构建及在摇瓶体系中表达司美格鲁肽中间体多肽融合蛋白
71.采用融合肽的氨基酸序列为seq id no:8,在c末端通过ddddk残基连接司美格鲁肽的中间体多肽arg34glp-1(9-37),得到含有seq id no:8融合肽序列的融合蛋白,其等电点为6.7,平均亲水性为-0.1。按照实施例1的操作构建重组工程菌s6,并按照实施例2~3的操作进行表达,测得重组工程菌s6经发酵诱导表达后,得到1.16g/l的融合蛋白,破碎洗涤后得到1.08g/l包涵体。
72.实施例9:重组菌株的构建及在摇瓶体系中表达司美格鲁肽中间体多肽融合蛋白
73.采用融合肽的氨基酸序列为seq id no:9,在c末端通过ddddk残基连接司美格鲁肽的中间体多肽arg34glp-1(9-37),得到含有seq id no:9融合肽序列的融合蛋白,其等电点为其等电点为6.7,平均亲水性为-0.1。按照实施例1的操作构建重组工程菌s7,并按照实施例2~3的操作进行表达,测得重组工程菌s7经发酵诱导表达后,得到1.24g/l的融合蛋白,破碎洗涤后得到1.14g/l包涵体。
74.实施例10:重组菌株的构建及在摇瓶体系中表达司美格鲁肽中间体多肽融合蛋白
75.采用融合肽的氨基酸序列为seq id no:10,在c末端通过ddddk残基连接司美格鲁肽的中间体多肽arg34glp-1(9-37),得到含有seq id no:10融合肽序列的融合蛋白,其等电点为其等电点为6.7,平均亲水性为-0.1。按照实施例1的操作构建重组工程菌s8,并按照实施例2~3的操作进行表达,测得重组工程菌s8经发酵诱导表达后,得到1.15g/l的融合蛋白,破碎洗涤后得到1.04g/l包涵体。
76.实施例11:重组菌株的构建及在摇瓶体系中表达司美格鲁肽中间体多肽融合蛋白
77.采用融合肽的氨基酸序列为seq id no:11,在c末端通过ddddk残基连接司美格鲁肽的中间体多肽arg34glp-1(9-37),得到含有seq id no:11融合肽序列的融合蛋白,其等电点为其等电点为6.7,平均亲水性为0。按照实施例1的操作构建重组工程菌s9,并按照实施例2~3的操作进行表达,测得重组工程菌s9经发酵诱导表达后,得到1.45g/l的融合蛋白,破碎洗涤后得到1.25g/l包涵体。
78.实施例12:构建表达司美格鲁肽中间体多肽融合蛋白的重组工程菌
79.设计一个用于在大肠杆菌中表达的融合蛋白序列:融合肽-ddddk-arg34glp-1(11-37)。
80.融合肽的氨基酸序列首先可以增强表达,其次可以保护中间体多肽arg34glp-1(11-37),防止其被大肠杆菌自身的蛋白酶降解。融合肽的氨基酸序列是matkavsvlkgdgpvqgiinfeqkesngpvkvwgsikglteglhgfhvhkfvnqhlcgshlvalylvha(seq id no:4)。所述融合肽序列的c末端通过ddddk残基连接司美格鲁肽的中间体多肽arg34glp-1(11-37),因此完整的融合蛋白氨基酸序列为matkavsvlkgdgpvqgiinfeqkesngpvkvwgsikglteglhgfhvhkfvnqhlcgshlvalylvhaddddktftsdvssylegqaakefiawlvrgrg(seq id no:13),该序列等电点为6.7,平均亲水性为0。
81.按照实施例1的操作构建重组工程菌s10,并按照实施例2~3的操作进行表达,测得重组工程菌s10经发酵诱导表达后,得到1.69g/l的融合蛋白,破碎洗涤后得到1.40g/l包涵体。
82.实施例13:重组菌株的构建及在摇瓶体系中表达司美格鲁肽中间体多肽融合蛋白
83.采用融合肽的氨基酸序列为seq id no:5,在c末端通过ddddk残基连接司美格鲁肽的中间体多肽arg34glp-1(11-37),得到含有seq id no:5融合肽序列的融合蛋白,其等电点为其等电点为7.6,平均亲水性为-0.1。按照实施例1的操作构建重组工程菌s11,并按照实施例2~3的操作进行表达,测得重组工程菌s11经发酵诱导表达后,得到1.17g/l的融合蛋白,破碎洗涤后得到1.11g/l包涵体。
84.实施例14:重组菌株的构建及在摇瓶体系中表达司美格鲁肽中间体多肽融合蛋白
85.采用融合肽的氨基酸序列为seq id no:11,在c末端通过ddddk残基连接司美格鲁肽的中间体多肽arg34glp-1(11-37),得到含有seq id no:11融合肽序列的融合蛋白,其等电点为其等电点为7.6,平均亲水性为-0.1。按照实施例1的操作构建重组工程菌s12,并按照实施例2~3的操作进行表达,测得重组工程菌s12经发酵诱导表达后,得到1.21g/l的融合蛋白,破碎洗涤后得到1.13g/l包涵体。以上实施例结果汇总如下表1所示。
86.表1
87.重组工程菌融合肽序列等电点平均亲水性融合蛋白量(g/l)包涵体量(g/l)s1seq id no:36.201.560.95s2seq id no:46.401.441.32s3seq id no:56.701.731.43s4seq id no:66.401.361.17s5seq id no:76.4-0.10.930.87s6seq id no:86.7-0.11.161.08s7seq id no:96.7-0.11.241.14
s8seq id no:106.7-0.11.151.04s9seq id no:116.701.451.25s10seq id no:46.701.691.4s11seq id no:57.6-0.11.171.11s12seq id no:117.6-0.11.211.13
88.实施例15:重组工程菌发酵罐发酵培养
89.将实施例5得到的重组工程菌s3在lb培养基中37℃下培养8h,得到细胞种子液,接入基础发酵培养基(bfm培养基)进一步培养8h得到二级种子液,然后接入6l的基础发酵培养基(bfm培养基)中进行培养。当发酵液od
600
的值达到150时,加入终浓度为0.1mm的iptg进行诱导,37℃下诱导12h后放罐。离心收集菌体。
90.实施例16:司美格鲁肽中间体多肽融合蛋白的提取及酶切
91.将实施例15中得到的菌体,按照体积比1:2加入破碎缓冲液(即1l发酵液获得的菌体中添加2l的破碎缓冲液),其中,破碎缓冲液的成分为25mm tris,10mm edta-2na,ph7.5~8.0。通过高压均质机破碎菌体,离心收集包涵体沉淀。将沉淀按体积比1:2加入洗涤缓冲液(即1l发酵液获得的沉淀中添加2l的洗涤缓冲液),其中,洗涤缓冲液的成分为25mm tris,0.25m尿素,1%吐温20,ph7.5。洗涤后离心收集的包涵体沉淀用洗涤液洗涤1次。将洗涤后的包涵体按照蛋白浓度为25g/l加入包涵体溶解缓冲液,其中溶解缓冲液的成分为25mm tris,0.1mm edta-2na,调节ph至7.5~8.0进行溶解0.5h。溶解后的包涵体溶液加入肠激酶,在35℃下酶解24h后即可得到中间体多肽、标签和连接肽的混合液。经hplc检测,溶解后的包涵体含量为13.1g/l,酶切后的中间体多肽含量为3.62g/l。
92.实施例17:重组菌株在发酵罐体系中表达司美格鲁肽中间体多肽
93.将实施例4中得到的重组工程菌s2按照实施例15~16进行发酵、诱导、提取及酶切。经hplc检测,溶解后的包涵体含量为11.4g/l,酶切后的中间体多肽含量为3.08g/l。
94.实施例18:重组菌株在发酵罐体系中表达司美格鲁肽中间体多肽
95.将实施例11中得到的重组工程菌s9按照实施例15~16进行发酵、诱导、提取及酶切。经hplc检测,溶解后的包涵体含量为10.3g/l,酶切后的中间体多肽含量为2.77g/l。
96.实施例19:司美格鲁肽中间体多肽的纯化
97.取实施例16得到的含20.3g目的蛋白的混合液,使用离子交换纯化,依次得到洗杂峰1,目的峰和再生峰,取目的峰样品进行hplc,hplc检测洗脱时间为15.833min,目的蛋白的纯度为92.5%,hplc图谱如图2所示。收集到的司美格鲁肽中间体多肽样品为17.5g,收率为86.2%。
98.对比例1
99.采用目前已经公开的融合肽序列,此融合肽的序列与本技术融合肽序列类似,序列具体为:mathavsvlkgdgpvqgiinfeqhesngpvkvwgsihglteglhgfhvhkfvnqhlcgshlvalylv(seq id no:14)作为前导肽,其它步骤均同实施例1~3,重组工程菌s13经发酵诱导表达后,得到0.85g/l的融合蛋白,破碎洗涤后得到0.61g/l包涵体。然后参考实施例15~16进行发酵、诱导、提取及酶切。经hplc检测,溶解后的包涵体含量为6.5g/l,酶切后的中间体多肽含量为1.75g/l。采用本发明中的融合肽序列,酶切后的中间体多肽的含量为2.77~3.62g/l,均高于对比例中的数据。
100.本技术中在制备利拉鲁肽中间体多肽中使用的前导肽序列并不适用于所有的glp-1类多肽产品的前肽表达,比如司美格鲁肽项目。
101.虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1