一种脐带间充质干细胞神经向分化工艺的制作方法
1.本发明涉及生物技术领域,具体涉及种将脐带间充质干细胞分化为神经细胞的方法。
背景技术:
2.神经系统变性疾病属于临床中一类进行性中枢神经系统疾病,主要是由于系统性特殊神经细胞亚群发生变性后导致的一类疾病,常见的疾病类型包括帕金森病、遗传性舞蹈病、阿尔茨海默病等,其共同的特征为神经细胞功能缺失或者功能不良,干细胞在这些疾病的治疗方面具有很大的潜力。移植神经干细胞通过分泌多种神经营养因子和促进受损神经元的神经保护和神经修复等机制,成为一种新的治疗神经系统疾病的候选方法。
3.神经干细胞(nscs)具有自我更新、免疫原性低、组织相容性好、多向分化潜能等优点,可以分化成神经元、星形胶质细胞和少突胶质细胞,来维持和修复受损的脑组织。内源性nscs能被激活的细胞数目非常有限,且大部分分化为胶质细胞形成神经胶质瘢痕参与组织修复,不足以弥补功能神经元的缺失。外源性nscs来源有限,间充质干细胞(mscs)是一种重要的nscs来源。mscs在连续传代培养和冷冻保存后仍具有多向分化潜能,因此间充质干细胞可作为理想的种子细胞,在一定的诱导条件下,分化成神经细胞。
4.mscs首先从骨髓中的非造血细胞群中被鉴定出来。随后,哺乳动物的几乎所有组织中都分离出了mscs,包括血液、脐带、心脏、脂肪组织、骨骼肌、胰腺和牙髓等。其中,脐带间充质干细胞(hucmscs)具有较高的分化潜能,可向多个方向进行分化。有报道从人脐带中分离出mscs,且细胞含量、增殖能力优于骨髓mscs,免疫原性比骨髓mscs低,并且具有取材方便,无伦理学争议等优点,因此越来越受到研究工作者们的关注。然而,目前由hucmscs诱导形成nscs存在耗时长、成本高、过程繁琐、产率低下等问题。
技术实现要素:
5.本发明的目的,是为了解决背景技术中的问题,提供一种脐带间充质干细胞神经向分化工艺。
6.本发明的上述技术目的是通过以下技术方案得以实现的:
7.一种利用冻存脐带间充质干细胞分化为神经干细胞的方法,包括以下步骤:
8.1)脐带间充质干细胞获取制备;
9.2)脐带间充质干细胞冻存:将获取的脐带间充质干细胞置入无损取样冻存管后,放入冻存复苏盒内进行冻存,冻存顺序为,冰水中冻存1-3h,干冰12-24h,最后转移到液氮中冻存存放;
10.3)脐带间充质干细胞复苏、取样检测:使用冻存复苏盒将脐带间充质干细胞复苏后,取出无损取样冻存管,检测细胞活性;
11.4)取细胞活性大于80%的复苏脐带间充质干细胞进行培养,将脐带间充质干细胞用msc培养基培养至铺满培养皿;
12.5)将培养皿上的脐带间充质干细胞进行消化处理后,离心,清洗,得到间充质干细胞;
13.6)使用第一种培养基(诱导培养基)将间充质干细胞诱导诱导培养3天,得到神经干细胞样细胞;
14.7)将神经干细胞样细胞转移到第二种培养基(分化培养基)置于37℃,5% co2继续培养7-14天,得到分化的神经细胞。
15.作为优选,所述步骤1)中脐带间充质干细胞的制备步骤为:
①
将人脐带组织去除血管和表皮,用0.9%生理盐水清洗干净后,剪成5mm
×
5mm大小的组织块接种于100mm培养皿,37℃,5%co2培养,7天换液一次;
②
待细胞融合度达到80%-90%传代,用0.05%胰酶edta溶液消化后,调整细胞数,按1
×
105个细胞/ml浓度接种于100mm培养皿,37℃,5%co2继续培养,3天传代一次。
16.作为优选,所述步骤5)中使用0.05%的胰酶edta溶液消化处理, 1200rpm/min,5min离心,去上清,用0.9%生理盐水清洗1遍。
17.作为优选,所述步骤6)中所得细胞,在进行步骤7)操作之前,用0.05%的胰酶edta溶液消化,吹打混匀,1200rpm/min,5min离心,去上清,用0.9%生理盐水清洗1遍。
18.作为优选,步骤7)中所用培养皿需用25μg/ml纤连蛋白于37℃培养箱中预处理1-2小时。
19.作为优选,所述msc培养基制备方法为:在dmem/f12基础培养基(1:1, gibco)中添加胎10%牛血清,1%青霉素和1%链霉素。
20.作为优选,所述第一种培养基即诱导培养基的制备方法为:在dmem/f12 基础培养基(1:1,gibco)中添加10%胎牛血清、2%b27、7.5μl/ml神经组织提取物(0.58ml/g)、1%青霉素和1%链霉素。
21.作为优选,所述述第二种培养基即分化培养基的制备方法为:在dmem/f12 基础培养基(1:1,gibco)中添加1%n2、2%b27、脑源性神经营养因子(bdnf, 10ng/ml)、神经胶质细胞神经营养因子(gdnf,10ng/ml)、神经生长因子(10 ng/ml)、神经营养因子-3(nt-3,10ng/ml)、抗坏血酸(200μm)、环腺苷酸(camp,0.5mm)、1%青霉素和1%链霉素,3天换一次液。
22.作为优选,
①
步骤4)所述复苏间充质干细胞的接种密度为2
×
105个细胞/ ml;
②
步骤6)所述间充质干细胞的诱导培养密度为(6.25-25)
×
104个细胞/ ml;
③
步骤7)所述神经干细胞样细胞的分化培养密度为(1-2.5)
×
104个细胞 /cm2。
23.综上所述,本发明的有益效果:
24.1、本发明所述的一种脐带间充质干细胞神经向分化工艺,通过第一种培养基,缩短、简化了神经干细胞的诱导过程,为间充质干细胞来源的神经干细胞的临床应用提供了基础。
25.2、本发明所述的一种脐带间充质干细胞神经向分化工艺,通过第二种培养基使神经干细胞样细胞能够分化形成神经元和胶质细胞,为其临床应用提供了基础。
附图说明
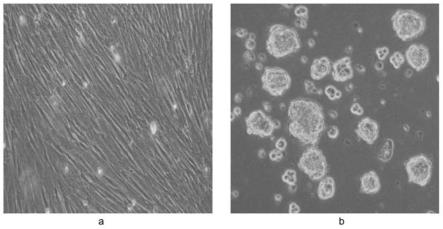
26.图1是脐带间充质干细胞诱导成神经干细胞样细胞的光学显微镜照片 (
×
100);
27.图2是诱导神经干细胞的活率测定及神经细胞相关基因的表达情况;
28.图3是神经元和神经胶质细胞标记分子在分化细胞中的阳性表达(
×
100)。
具体实施方式
29.以下具体实施例仅仅是对本发明的解释,其并不是对本发明的限制,本领域技术人员在阅读完本说明书后可以根据需要对本实施例做出没有创造性贡献的修改,但只要在本发明的权利要求范围内都受到专利法的保护。
30.下面结合附图以实施例对本发明进行详细说明。
31.实施例1:
32.一种利用冻存脐带间充质干细胞分化为神经干细胞的方法,包括以下步骤:
33.1)脐带间充质干细胞的制备:
①
将人脐带组织去除血管和表皮,用0.9%生理盐水清洗干净后,剪成5mm
×
5mm大小的组织块接种于100mm培养皿,37℃, 5%co2培养,7天换液一次;
②
待细胞融合度达到80%-90%传代,用0.05%胰酶edta溶液消化后,调整细胞数,按1
×
105个细胞/ml浓度接种于100mm培养皿,37℃,5%co2继续培养,3天传代一次;msc培养基制备方法为:在 dmem/f12基础培养基(1:1,gibco)中添加10%胎牛血清,1%青霉素和1%链霉素;
34.2)脐带间充质干细胞冻存:将获取的脐带间充质干细胞置入无损取样冻存管后,放入冻存复苏盒内进行冻存,冻存顺序为,冰水中冻存1-3h,干冰12-24h,最后转移到液氮中冻存存放;
35.3)脐带间充质干细胞复苏、取样检测:使用冻存复苏盒将脐带间充质干细胞复苏后,取出无损取样冻存管,检测细胞活性;
36.4)脐带间充质干细胞复苏培养:
①
取细胞活性大于80%的复苏脐带间充质干细胞按照2
×
105个细胞/ml进行接种,培养至细胞铺满整个培养皿。
②
使用 0.05%的胰酶edta溶液消化处理,1200rpm/min,5min离心,去上清,用0.9%生理盐水冲洗1遍,得到间充质干细胞;
37.5)神经干细胞样细胞诱导培养及神经标记分子基因表达:
38.①
神经干细胞样细胞诱导:
39.使用第一种培养基(诱导培养基)将步骤4)得到的间充质干细胞按照密度为12.5
×
104个细胞/cm2进行接种,诱导培养3天,得到神经干细胞样细胞;诱导培养基的制备方法为:在dmem/f12基础培养基(1:1,gibco)中添加10%胎牛血清、2%b27、7.5μl/ml神经组织提取物(0.58ml/g)、1%青霉素和1%链霉素。
40.②
神经标记分子基因表达:
41.a.细胞rna提取:每天收集间充质干细胞诱导培养样品标记为d0、d1、 d3,加入0.7ml trizol,反复吹打数次,裂解细胞,室温静置5min。加入0.2ml氯仿,剧烈震荡15s,室温静置3min。12000
×
g,4℃,离心 15min。取上层无色液相(400-450μl),加入0.5ml异丙醇室温静置10min, 12000
×
g,4℃,离心10min。弃上清液,加入1ml75%的乙醇洗涤一次,7500
×
g,4℃,离心5min,弃上清液,室温干燥3-5min。根据沉淀的量加入20-50ul rnase-free水溶解,测浓度。
42.b.rt-qpcr:
5min,之后1
×
pbs洗4次,每次5min;滴加含抗荧光淬灭剂的封片剂封片,进行荧光观察。
55.根据图3所示,染色结果显示神经元标记蛋白tuj1与神经胶质标记蛋白gfap 均呈阳性表达,说明在第二种诱导培养基培养条件下神经干细胞样细胞向神经细胞分化效果明显。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1