一种新利司他半抗原、人工抗原、抗体及其制备方法和应用
1.本发明涉及食品检测领域,更具体地,涉及一种新利司他半抗原、人工抗原、抗体及其制备方法和应用。
背景技术:
2.新利司他(cetilistat),又名西替利斯他、赛利司他、西替利斯塔,是一种人体脂肪酶抑制剂,最初由英国alizyme公司开发,用于治疗肥胖以及由肥胖引起的糖尿病,2003年alizyme公司将新利司他授权给日本的武田制药公司,并于2013年9月在日本国内上市。该药最大优点是不作用于神经系统,不影响胃肠道的其他酶活性,不被吸收即不进入血液,不抑制食欲,无需限制饮食。用药后24h即可出现排便带油的现象(水面漂浮多量油滴),即排除未被消化的脂肪。其作用机理是通过与胃和小肠腔内胃脂肪酶和胰脂肪酶的活性丝氨酸部位形成共价键使酶失活而发挥治疗作用,失活的酶不能将食物中的脂肪主要是甘油三酯水解为可吸收的游离脂肪酸和单酰基甘油。未消化的甘油三酯不能被身体吸收,从而减少热量摄入,控制体重。长期服用新利司他会导致肠道作用,脂肪泻、肛门排便增加等不良反应。其他消化道不良反应还包括油性斑点、带便的胃肠排气、脂(油)性便,甚至大便失禁等。
3.目前新利司他还没有通过国内上市批准,所以国内对新利司他检测方法尚无过多的报道与研究。yu zhou用hplc-pda的方法检测新利司他(yu z,wan c.a simple and convenient method for simultaneous determination of four major species of illegal additives in slimming health food[j].journal of liquid chromatography&related technologies,2010,33(4):452-461.);秦军等对于新利司他的测定也是利用高效液相色谱法hplc(秦军,王显芹,傅世玲,et al.hplc determination method for cetilistat and related impurities:,2015.)。然而,高效液相色谱法虽然具有检测效率高、准确度高、抗干扰能力强等特点;但是,检测所需的仪器设备昂贵、成本高、样品前处理繁杂、需专业人士操作,不符合大批量样品现场检测要求。
[0004]
与现有的检测方法相比,基于抗原-抗体特异性分子识别的免疫检测方法,在现场检测方面具有更大优势,表现出快速、灵敏、简便等特点,并且成本低廉,对操作人员技能要求较低。然而,免疫分析方法研发的关键在于设计出合适的新利司他半抗原,制备出灵敏度高、特异性强的抗体,但是现有技术中未见有关于新利司他半抗原、人工抗原、抗体的相关报道。
技术实现要素:
[0005]
本发明要解决的技术问题是克服现有技术中新利司他检测方法的缺陷和不足,提供一种新利司他半抗原、人工抗原、抗体及其制备方法和应用。
[0006]
本发明的目的在于提供新利司他半抗原。
[0007]
本发明的目的还在于提供新利司他半抗原在制备新利司他人工抗原中的应用。
[0008]
本发明的目的还在于提供新利司他人工抗原。
[0009]
本发明的目的还在于提供所述新利司他人工抗原在制备新利司他人工抗体中的应用。
[0010]
本发明的目的还在于提供一种新利司他抗体。
[0011]
本发明的目的还在于提供一种检测新利司他的免疫分析方法。
[0012]
本发明的目的还在于提供一种检测新利司他的试剂盒。
[0013]
本发明上述目的通过以下技术方案实现:
[0014]
本发明提供了一种新利司他半抗原,为半抗原cet1或半抗原cet2,所述半抗原cet1的结构式如式(i)所示,
[0015][0016]
所述半抗原cet1采用系统命名法命名为:11-((3-((6-甲基-4-氧代-4h-苯并[d][1,3]恶嗪-2-基)氧基)丙基)氨基)十一烷酸;
[0017]
所述半抗原cet2的结构式如式(ii)所示,
[0018][0019]
所述半抗原cet2采用系统命名法命名为:4-(((十六烷氧基)羰基)氨基)苯甲酸。
[0020]
本发明所述半抗原cet1的制备方法,包括如下步骤:
[0021]
s1.控制反应体系温度不超过20℃下,将2-氨基-5-甲基苯甲酸和吡啶的二氯甲烷的混合溶液与氯甲酸-3-氯丙酯混合,充分反应,然后除去溶剂二氯甲烷及未反应的吡啶,以二氯甲烷和水溶解反应物,控制温度为4~6℃,调节ph至1~2,过滤析出的固体,固体水洗、烘干的到中间产物1;
[0022]
s2.控制反应体系温度不超过20℃,将中间产物1的二氯甲烷溶液与三氯氧磷混合,然后加热回流充分反应。控制反应体系温度不超过5℃,加水将反应物分层,将二氯甲烷层纯化,过滤,除去二氯甲烷,结晶纯化,干燥得中间产物2;
[0023]
s3.将中间产物2、11-氨基十一酸、氢氧化钾、和碘化钠溶于无水n,n-二甲基甲酰
胺(dmf),充分反应,加水并调节ph至中性,再用乙酸乙酯萃取,除去水相,将有机相浓缩,然后分离、纯化,即得到新利司他半抗原cet1。
[0024]
优选地,步骤s1所述2-氨基-5-甲基苯甲酸、吡啶和氯甲酸-3-氯丙酯的摩尔比为1:2~3:1~2。
[0025]
进一步优选地,步骤s1所述2-氨基-5-甲基苯甲酸、吡啶和氯甲酸-3-氯丙酯的摩尔比为1:3:1.2。
[0026]
优选地,步骤s1所述2-氨基-5-甲基苯甲酸和吡啶的二氯甲烷混合溶液与氯甲酸-3-氯丙酯混合是将2-氨基-5-甲基苯甲酸和吡啶的二氯甲烷混合溶液的温度降为15℃再与氯甲酸-3-氯丙酯混合;所述混合的方式是将氯甲酸-3-氯丙酯滴加至混合溶液。
[0027]
优选地,步骤s1所述除去溶剂二氯甲烷及未反应的吡啶是采用旋蒸的方式。
[0028]
优选地,步骤s1所述控制温度为5℃。
[0029]
优选地,步骤s1所述调节ph是利用体积分数为10%的盐酸调节。
[0030]
优选地,步骤s2所述中间产物1和三氯氧磷的摩尔比为1:2~4。
[0031]
进一步优选地,步骤s2所述中间产物1和三氯氧磷的摩尔比为1:3。
[0032]
优选地,步骤s2所述中间产物1的二氯甲烷溶液与三氯氧磷混合时添加氢化钠除水,并以二苯甲酮做指示剂,指示除水效果。
[0033]
优选地,步骤s2所述中间产物1的二氯甲烷溶液与三氯氧磷混合是将中间产物1的二氯甲烷溶液控制温度为15℃然后缓慢滴加三氯氧磷。
[0034]
优选地,步骤s2所述加水将反应物分层是添加一级水;所述二氯甲烷层纯化是将二氯甲烷层先水洗,然后用饱和碳酸氢钠溶液洗涤,接着用饱和食盐水洗涤,然后加入无水硫酸钠和活性炭除去多余水分和杂质。
[0035]
优选地,步骤s2采用减压蒸馏除去所述纯化后的二氯甲烷层中的二氯甲烷。
[0036]
优选地,步骤s2所述结晶纯化是将除去二氯甲烷的反应物溶于甲苯,分级降温结晶,过滤并洗涤。
[0037]
进一步优选地,所述分级降温结晶的条件是先降温至14~16℃,搅拌析晶2.5~3h,然后持续降温至0℃,搅拌析晶2.5~3h。
[0038]
进一步优选地,所述分级降温结晶的条件是先降温至15℃,搅拌析晶3h,然后持续降温至0℃,搅拌析晶3h。
[0039]
优选地,步骤s2所述干燥是在45℃减压干燥至恒重。
[0040]
优选地,步骤s3所述中间产物2、11-氨基十一酸、氢氧化钾、和碘化钠的摩尔比为1:1~2:1~3:0.1~0.5。
[0041]
进一步优选地,步骤s3所述中间产物2、11-氨基十一酸、氢氧化钾、和碘化钠的摩尔比为1:1.2:2:0.2。
[0042]
优选地,步骤s3所述充分反应的条件是加热90~95℃反应10~12h。
[0043]
进一步优选地,步骤s3所述充分反应的条件是加热90℃反应12h。
[0044]
优选地,步骤s3所述分离、纯化是将浓缩的有机相,上硅胶柱,用乙酸乙酯和石油醚体积比为4~6:1混合溶剂洗脱,从而分离、纯化。
[0045]
进一步优选地,所述乙酸乙酯和石油醚体积比为5:1。
[0046]
所述中间产物1的结构式为:
[0047][0048]
所述中间产物2的结构式为:
[0049][0050]
本发明所述半抗原cet2的制备方法,包括如下步骤:
[0051]
控制反应体系温度小于20℃,将对氨基苯甲酸和吡啶的二氯甲烷混合溶液,与氯甲酸十六烷基酯混合,充分反应,然后除去溶剂二氯甲烷及未反应的吡啶,以二氯甲烷和水溶解反应物,控制温度为4~6℃,调节ph至1~2,过滤析出的固体,固体水洗、烘干即得新利司他半抗原cet2。
[0052]
优选地,所述对氨基苯甲酸、吡啶和氯甲酸十六烷基酯的摩尔比为1:2~4:1~1.5。
[0053]
进一步优选地,所述对氨基苯甲酸、吡啶和氯甲酸十六烷基酯的摩尔比为1:3:1.2。
[0054]
优选地,所述对氨基苯甲酸和吡啶的二氯甲烷混合溶液降温至15℃,然后与氯甲酸十六烷基酯混合。
[0055]
优选地,利用旋蒸的方式除去所述溶剂二氯甲烷及未反应的吡啶。
[0056]
优选地,所述调节ph是利用体积分数为10%的盐酸调节。
[0057]
所述半抗原cet1和/或半抗原cet2在制备新利司他人工抗原中的应用也在本发明的保护范围之内。
[0058]
一种新利司他人工抗原,由所述半抗原cet1或半抗原cet2偶联载体蛋白得到,由所述半抗原cet1偶联载体蛋白得到的人工抗原cet1的结构式如式(iii)所示,其中,p为载体蛋白,
[0059][0060]
由所述半抗原cet2偶联载体蛋白得到的人工抗原cet2的结构式如式(iv)所示,其中,p为载体蛋白,
[0061][0062]
优选地,所述载体蛋白(p)为牛血清白蛋白(bovine serum albumin,bsa)、钥孔血蓝蛋白(keyhole limpet hemocyanin,klh)、乳铁蛋白(lactoferrin,lf)或者鸡卵清白蛋白(ovalbumin,ova)任意一种或几种。
[0063]
本发明所述人工抗原cet1或人工抗原cet2的制备方法,利用半抗原cet1或半抗原cet2,通过活泼酯法偶联载体蛋白。
[0064]
作为上述方法的一个具体实施方式,人工抗原cet1的制备方法,包括如下步骤:
[0065]
(1)将半抗原cet1与n-羟基丁二酰亚胺(nhs)、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edc)溶解于n,n-二甲基甲酰胺(dmf)中,室温下避光搅拌2~4h,得到半抗原cet1活化液;
[0066]
(2)将载体蛋白加入到pbs缓冲液中;
[0067]
(3)将步骤(1)的半抗原cet1活化液缓慢逐滴加入步骤(2)的载体蛋白溶液中,4℃反应12h;
[0068]
(4)用pbs缓冲液透析步骤(3)所得反应液,即得人工抗原cet1。
[0069]
优选地,步骤(1)中所述半抗原cet1、nhs与edc的摩尔比为1:1~2:1.5~2.5。
[0070]
更优选地,步骤(1)中所述半抗原cet1、nhs与edc的摩尔比为1:1.75:2.25。
[0071]
优选地,步骤(2)中所述载体蛋白与pbs缓冲液的质量体积比为8~11mg:0.5~1.5ml。
[0072]
更优选地,步骤(2)中所述载体蛋白与pbs缓冲液的质量体积比为10mg:1ml。
[0073]
优选地,步骤(1)中所述半抗原cet1与步骤(2)中所述载体蛋白的质量比为1~2:1
~4。
[0074]
更优选地,步骤(1)中所述半抗原cet1与步骤(2)中所述载体蛋白的质量比为1:3。
[0075]
所述人工抗原cet2的制备方法同人工抗原cet1。
[0076]
所述新利司他人工抗原在制备新利司他抗体中的应用也在本发明的保护范围之内。
[0077]
一种新利司他人工抗原组合,包括免疫原和包被原,免疫原是由所述半抗原cet1偶联载体蛋白得到的,即人工抗原cet1;包被原为所述新利司他人工抗原。
[0078]
优选地,所述包被原是由所述半抗原cet2偶联载体蛋白得到的,即人工抗原cet2。
[0079]
进一步优选地,所述免疫原是由所述半抗原cet1偶联载体蛋白乳铁蛋白(lf)得到的,即人工抗原cet1-lf;所述包被原是由所述cet2偶联载体蛋白鸡卵清蛋白(ova)得到的,即人工抗原cet2-ova。
[0080]
所述人工抗原组合在制备新利司他抗体和/或检测新利司他中的应用也在本发明的保护范围之内。
[0081]
一种新利司他抗体,利用所述半抗原cet1偶联载体蛋白得到的人工抗原cet1免疫动物制备得到。
[0082]
优选地,所述新利司他抗体是利用所述半抗原cet1偶联载体蛋白乳铁蛋白(lf)得到的人工抗原cet1-lf免疫动物制备得到。
[0083]
优选地,所述新利司他抗体为单克隆抗体或多克隆抗体。
[0084]
一种新利司他多克隆抗体的制备方法,利用所述半抗原cet1偶联载体蛋白得到的人工抗原cet1免疫实验动物。
[0085]
优选地,利用所述半抗原cet1偶联载体蛋白乳铁蛋白(lf)得到的人工抗原cet1-lf免疫实验动物。
[0086]
作为上述方法的一个具体实施方式,新利司他多克隆抗体的制备方法包括如下步骤:
[0087]
(1)利用所述人工抗原cet1配合免疫佐剂免疫实验动物;
[0088]
(2)首次免疫时,人工抗原cet1与等体积的完全弗氏佐剂乳化后免疫新西兰大白兔;
[0089]
(3)4周后第二次免疫,以后每间隔3周加强免疫一次。
[0090]
(4)加强免疫四次后,心脏取血分离获得血清即得多克隆抗体。
[0091]
优选地,所述人工抗原cet1是所述半抗原cet1偶联载体蛋白乳铁蛋白(lf)得到的人工抗原cet1-lf。
[0092]
所述新利司他抗体在检测新利司他和/或制备检测新利司他试剂盒中的应用也在本发明的保护范围之内。
[0093]
一种检测新利司他的免疫分析方法,以所述新利司他人工抗原为抗原,以所述半抗原cet1偶联载体蛋白得到的人工抗原cet1免疫动物制备得到的抗体为检测抗体进行检测;所述免疫分析方法为非诊断治疗目的方法。
[0094]
优选地,所述免疫分析方法以半抗原cet2偶联载体蛋白得到的人工抗原cet2为抗原。
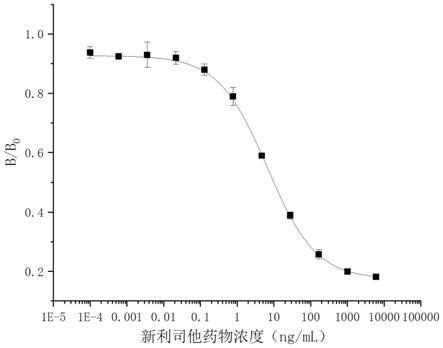
[0095]
进一步优选地,所述免疫分析方法以载体蛋白为鸡卵清蛋白(ova)的人工抗原
cet2-ova为抗原,以载体蛋白为乳铁蛋白(lf)的人工抗原cet1-lf为免疫原免疫动物制备得到的抗体为检测抗体进行检测。
[0096]
所述免疫分析方法包括但不局限于酶免疫分析、免疫层析、免疫传感、免疫胶体金等。
[0097]
一种检测新利司他的试剂盒,包括所述新利司他人工抗原和所述新利司他抗体。
[0098]
优选地,所述试剂盒包括所述半抗原cet2偶联载体蛋白得到的人工抗原cet2和所述半抗原cet1偶联载体蛋白的人工抗原cet1免疫动物制备得到的抗体。
[0099]
进一步优选地,所述试剂盒包括所述半抗原cet2偶联载体蛋白鸡卵清蛋白(ova)得到的人工抗原cet2-ova和所述半抗原cet1偶联载体蛋白乳铁蛋白(lf)的人工抗原cet1-lf免疫动物制备得到的抗体。
[0100]
优选地,所述试剂盒还包括酶标板、新利司他标准品、酶结合物、显色液、终止液或洗涤液中一种或多种。
[0101]
优选地,所述试剂盒包括所述新利司他人工抗原包被的酶标板、新利司他标准品、酶结合物、显色液、终止液和浓缩洗涤液。
[0102]
与现有技术相比,本发明具有以下有益效果:
[0103]
(1)本发明提供了两种新利司他半抗原,半抗原cet1和半抗原cet2,应用半抗原cet1偶联乳铁蛋白(lf)制备得到的人工抗原cet1-lf作为免疫原,进而制备得到新利司他抗体,应用半抗原cet2偶联鸡卵清蛋白(ova)制备得到的人工抗原cet2-ova作为包被原;本发明半抗原cet1与待测物新利司他的骨架结构重叠度高,有效的提高了新利司他人工抗原cet1-lf的免疫原性,且人工抗原cet1-lf与半抗原cet1结构差异较大,形成了较大空间位阻,进一步提高抗体亲和力;
[0104]
(2)同时,本发明所得到的抗体效价高、特异性强、亲和力高,对新利司他的最低检测限lod为0.22ng/ml,半抑制浓度ic
50
为6.57ng/ml,定量检测范围为0.78~55.26ng/ml,检测灵敏度高,线性范围广;对新利司他的交叉反应率为100%,对新利司他类似物奥利司他无交叉反应;本发明的抗体具有简便快速、特异性强、线性范围广,灵敏度高的特点;利用本发明的新利司他人工抗原、抗体可实现快速准确的检测新利司他的目的。
附图说明
[0105]
图1为本发明半抗原cet1的合成路线图。
[0106]
图2为本发明半抗原cet2的合成路线图。
[0107]
图3为本发明半抗原cet1、lf、cet1-lf紫外扫描图。
[0108]
图4为本发明半抗原cet2、ova、cet2-ova紫外扫描图。
[0109]
图5为本发明新利司他多克隆抗体间接竞争elisa标准曲线。
具体实施方式
[0110]
以下结合说明书附图和具体实施例来进一步说明本发明,但实施例并不对本发明做任何形式的限定。除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。
[0111]
除非特别说明,以下实施例所用试剂和材料均为市购。
[0112]
实施例1新利司他半抗原的合成与鉴定
[0113]
1.新利司他半抗原cet1的合成与鉴定
[0114]
1.1新利司他半抗原cet1的合成
[0115]
取2-氨基-5-甲基苯甲酸(1mmol)、吡啶(3mmol),溶于二氯甲烷,搅拌至澄清,降温至15℃,滴加氯甲酸-3-氯丙酯(1.2mmol),控制温度小于20℃,滴加完毕之后室温下反应2h。反应结束后,旋蒸除去二氯甲烷及未反应的吡啶,加入750g二氯甲烷,250g水,冰水冷却,控制温度为5℃,滴加体积分数为10%盐酸,调节ph至1~2,析出大量固体,过滤,固体水洗、烘干的到中间产物1。
[0116]
反应瓶中加入中间产物1(1mmol),二氯甲烷溶解(氢化钠除水,二苯甲酮做指示剂,指示除水效果),冰水降温,控制反应体系温度15℃,缓慢滴加三氯氧磷(3mmol),控制体系温度不超过20℃,滴加完毕,加热回流充分反应。反应完毕,冰水降温,控制体系温度不超过5℃,缓慢滴加一级水,继续搅拌半小时,分层,将二氯甲烷层水洗,再用饱和碳酸氢钠溶液洗涤,最后用饱和食盐水洗涤,加入无水硫酸钠10g,活性炭5g室温搅拌一小时,过滤,减压蒸馏除去二氯甲烷,加入200ml甲苯,搅拌,降温至15℃,搅拌析晶3h,持续降温至0℃,搅拌析晶3h,过滤,固体用适量甲苯洗涤,减压干燥(45℃)至恒重,得中间产物2。
[0117]
取中间产物2(1mmol)、11-氨基十一酸(1.2mmol),加入氢氧化钾(2mmol)和碘化钠(0.2mmol)并用无水n,n-二甲基甲酰胺(dmf)溶解,加热90℃反应12h,反应结束后加水,加1mol/l盐酸调节ph至中性,再用乙酸乙酯萃取,震荡、静置,除去水相,将有机相浓缩,上硅胶柱,用乙酸乙酯和石油醚体积比为5:1混合溶剂洗脱分离、纯化,即得到新利司他半抗原cet1。半抗原cet1的合成路线图如图1所示。
[0118]
1.2新利司他半抗原cet1的鉴定
[0119]
半抗原cet1的核磁鉴定结果:1h nmr(600mhz,chloroform-d)δ7.91(d,j=2.0hz,1h),7.53(dd,j=8.4,2.0hz,1h),7.31(d,j=8.3hz,1h),4.42(t,j=6.7hz,2h),2.42(s,3h),1.80(h,j=8.0,7.4hz,2h),1.49
–
1.21(m,21h),0.88(t,j=7.0hz,3h).
[0120]
半抗原cet1的质谱结果为:ms:c
23h34
n2o5:418.25,esi-[m-h]-:417.3。
[0121]
半抗原cet1的结构式如式(i)所示:
[0122][0123]
半抗原cet1采用系统命名法命名为:11-((3-((6-甲基-4-氧代-4h-苯并[d][1,3]恶嗪-2-基)氧基)丙基)氨基)十一烷酸。
[0124]
2.新利司他半抗原cet2的合成与鉴定
[0125]
2.1新利司他半抗原cet2的合成
[0126]
称取对氨基苯甲酸(1mmol)、吡啶(3mmol),溶于二氯甲烷,搅拌至澄清,降温至15
℃,滴加氯甲酸十六烷基酯(1.2mmol),控制温度小于20℃,滴加完毕之后室温下反应2h。反应结束后,旋蒸除去二氯甲烷及未反应的吡啶,加入二氯甲烷,水,冰水冷却,控制温度为5℃,滴加体积分数10%的盐酸,调节ph至1~2,析出大量固体,过滤,将固体水洗、烘干得到新利司他半抗原cet2。半抗原cet2的合成路线图如图2所示。
[0127]
2.2新利司他半抗原cet2的鉴定
[0128]
半抗原cet2的核磁鉴定结果:1h nmr(600mhz,dmso-d6)δ9.98(s,1h),8.12
–
8.07(m,2h),7.86(d,j=8.6hz,2h),1.62(p,j=6.8hz,2h),1.47
–
1.08(m,29h),0.85(t,j=6.9hz,3h).
[0129]
半抗原cet2的质谱结果为:ms:c
24h39
no4:405.29,esi-[m-h]-:404.3。
[0130]
半抗原cet2的结构式如式(ii)所示:
[0131][0132]
半抗原cet2采用系统命名法命名为:4-(((十六烷氧基)羰基)氨基)苯甲酸。
[0133]
实施例2新利司他人工抗原的合成和鉴定
[0134]
1.新利司他人工抗原的合成
[0135]
将实施例1制备的半抗原cet1或半抗原cet2,通过活泼酯法偶联乳铁蛋白(lf)或鸡卵清蛋白(ova)。
[0136]
称取3.3mg(0.008mmol)实施例1制备的半抗原cet1,与0.014mmol nhs和0.018mmol edc溶解于50~200μl dmf中,室温下避光搅拌2~4h,得到半抗原活化液;将10mg lf加入到1ml的pbs缓冲液(0.01mol/l,ph=7.4)中;将半抗原活化液缓慢逐滴加入lf的pbs缓冲溶液中,4℃反应12h;然后用pbs缓冲液透析3天,每天3次,透析结束后即得人工抗原cet1,分装于离心管中,于-20℃保存,以供使用。
[0137]
其中,pbs缓冲液的配方:na2hpo4·
12h2o 2.90g,nacl 8.50g,kcl 0.20g,kh2po
4 0.20g,加蒸馏水定容至1000ml。
[0138]
人工抗原cet2的制备同人工抗原cet1,区别仅在于载体蛋白为鸡卵清蛋白。
[0139]
2.新利司他人工抗原的鉴定
[0140]
对lf、半抗原cet1和上述合成的人工抗原cet1-lf,进行紫外扫描。紫外扫描结果如图3。
[0141]
lf、半抗原cet1、cet1-lf分别进行紫外(200~350nm)扫描鉴定,并通过比较偶联前后的各物质的最高吸光值,发现cet1-lf的吸收曲线与载体蛋白lf明显不同,半抗原cet1在240nm和300nm处各有一个特征峰,而偶联lf后,cet1-lf的吸收峰在240nm和300nm处明显比lf高,且相对半抗原cet1的曲线发生显著位移。由于在偶联反应的透析过程已经将未反
应的药物等小分子成分全部透析去除,因此偶联产物出现的药物特征峰是由蛋白结合的药物分子贡献的,故说明反应产物是载体蛋白lf与半抗原cet1的复合物,说明cet1-lf偶联成功。
[0142]
对ova、半抗原cet2和上述合成的cet2-ova,进行紫外扫描。紫外扫描结果如图4。
[0143]
ova、半抗原cet2和cet2-ova分别进行紫外(200~350nm)扫描鉴定,并通过比较偶联前后的各物质的最高吸光值,发现cet2-ova的吸收曲线与载体蛋白ova明显不同,半抗原cet2在240nm和260nm处各有一个特征峰,而偶联ova后,cet2-ova的吸收峰在240nm和260nm处明显比ova高,且相对半抗原cet2的曲线发生显著位移。由于在偶联反应的透析过程已经将未反应的药物等小分子成分全部透析去除,因此偶联产物出现的药物特征峰是由蛋白结合的药物分子贡献的,故说明反应产物是载体蛋白ova与半抗原cet2的复合物,说明cet2-ova偶联成功。
[0144]
实施例3抗体的制备
[0145]
1.多克隆抗体的制备
[0146]
将实施例2制备的cet1-lf作为免疫原与免疫佐剂(第一次免疫用不完全弗氏佐剂,以后加强免疫均用弗氏不完全佐剂)按体积比1:1乳化均匀,免疫体重为2.5~3kg新西兰大白兔。采用颈部和背部皮下多点注射,4周后第二次免疫,以后每间隔3周加强免疫一次。第三次加强免疫后1周耳缘静脉取血,并利用间接竞争elisa测定血清效价。当效价不再上升时,采用耳缘静脉加强免疫。一周后心脏采血,收集到的血获得血清的方式为:在37℃下温浴0.5~1h,然后在4℃下静置过夜,再用吸管吸取析出来的血清,接着在4℃下,3000~5000rpm离心10min,取上清。抗血清采用硫酸铵沉淀法纯化的到多克隆抗体,于-20℃冻存备用。
[0147]
实施例4新利司他免疫原和包被原组合优化
[0148]
本发明还按照实施例2的cet1-lf的制备方法制备了牛血清白蛋白(bsa)为载体蛋白的人工抗原cet1-bsa和以鸡卵清蛋白(ova)作为载体蛋白的人工抗原cet1-ova,且均偶联成功。
[0149]
将制备的cet1-bsa和实施例2制备的cet1-lf作为免疫原,按照实施例3的方法免疫新西兰大白兔制得的新利司他多克隆抗体进行包被原筛选,以制备cet1-ova的和实施例2制备的cet2-ova作为包被原,经elisa检测免疫新西兰大白兔所获得抗血清的效价和抑制率。
[0150]
具体操作步骤如下:
[0151]
(1)将包被原cet1-ova和cet2-ova分别用包被液(0.05m碳酸盐缓冲溶液,ph 9.6)稀释至250ng/ml的浓度,包被96孔酶标板,每孔加入100μl,37℃恒温水浴箱温育过夜,弃包被液,用pbst(0.01m pbs,0.06%tween-20(v/v))洗涤2次;
[0152]
(2)每孔加入120μl封闭液(1wt%的鱼胶蛋白),37℃封闭3h,弃去封闭液,拍板,在干燥箱37℃烘干备用;
[0153]
(3)将制得的新利司他多克隆抗体用pbst稀释为1:8000、1:16000、1:32000、1:64000、1:128000、1:256000、1:512000,同时设置空白对照孔(用pbst代替);用pbst将1mg/ml新利司他药物稀释1000倍,为1μg/ml;
[0154]
效价列:先每孔加50μl的pbst,然后将倍比稀释得到新利司他多克隆抗体按每孔
50μl依次加入孔内,最后一个孔不加抗体,用50μl pbst代替;
[0155]
抑制列:先每孔加50μl的新利司他药物,然后将倍比稀释得到新利司他多克隆抗体按每孔50μl依次加入孔内,最后一个孔不加抗体,用50μl pbst代替;在37℃下温育40min,洗涤5次,拍板;
[0156]
(4)加入羊抗兔二抗ig-hrp(5000倍稀释),37℃温育30min,洗涤5次,拍板;
[0157]
(5)加入显色液,在37℃下温育显色10min;
[0158]
(6)加入10%h2so4终止反应,并在450nm处读取od值;
[0159]
效价是od
450
为1.0左右所对应的抗血清稀释倍数。
[0160]
抑制率=(效价的od值-抑制的od值)/抑制的od值*100%
[0161]
4组免疫原和包被原组合的抗血清的效价和抑制率如表1所示。
[0162]
表1 4组免疫原和包被原组合的抗血清的效价和抑制率
[0163][0164]
从表1中可以看出,不同的新利司他人工抗原作为免疫的新西兰大白兔产生的抗血清均有一定的效价,所得抗血清对目标分析物新利司他均有不同程度的抑制效果。其中,编号4的免疫原和包被原结构组合所示的抗血清效价1:512000和抑制率90.31%为最佳组合;在该组合下,新利司他抗体不仅能特异性识别目标分析物新利司他,而且抗体灵敏度好;抗血清效价和抑制率均高于编号1、2、3的免疫原和包被原组合,故编号4的免疫原和包被原结构组合为最佳组合。即将cet1-lf作为免疫原、cet2-ova作为包被原。
[0165]
实施例5新利司他的间接竞争elisa检测方法的建立
[0166]
1、实验方法
[0167]
一种检测新利司他的间接竞争elisa方法,包括以下步骤:
[0168]
(1)将实施例2制备的人工抗原cet2-ova作为包被原,用包被液稀释至62.5ng/ml,包被96孔酶标板,每孔加入100μl,37℃孵育过夜(12h);
[0169]
(2)弃去包被液,洗涤两次,拍干;
[0170]
(3)每孔加入120μl封闭液(即1wt%鱼皮胶原蛋白),37℃封闭3h;
[0171]
(4)弃去封闭液,拍板,37℃烘干30min后取出,用自封袋装好备用;
[0172]
(5)用实施例4的pbst以1:4000倍稀释实施例3制备的新利司他多克隆抗体,并将新利司他药物稀释至6000ng/ml、1000ng/ml、166.67ng/ml、27.78ng/ml、4.63ng/ml、0.77ng/ml、0.13ng/ml、0.02ng/ml、0.004ng/ml;
[0173]
(6)每行加入50μl待检测新利司他药物稀释液(三组平行),再加入50μl/孔实施例3制备的新利司他多克隆抗体稀释液,37℃孵育40min,洗涤五次,拍干;
[0174]
(7)加入羊抗兔二抗-hrp(5000倍稀释)100μl/孔,37℃孵育30min,洗涤五次,拍干;
[0175]
(8)加入显色液,每孔100μl,显色10min;
[0176]
(9)加入50μl 10%的h2so4溶液终止反应,并在450nm处读取od值。
[0177]
2、实验结果
[0178]
用于检测新利司他药物的抗体间接竞争elisa标准曲线如图5所示,从图5可知,检测新利司他药物的抗体间接竞争elisa标准曲线具备典型的s型曲线,检测灵敏度好,用于检测新利司他的抗体半抑制浓度(ic
50
)为6.57ng/ml,定量检测范围为0.78~55.26ng/ml,最低检测限(lod)为0.22ng/ml;说明本发明制备得到的用于检测新利司他的抗体可以满足检测要求。
[0179]
实施例6用于检测新利司他的抗体的特异性评价
[0180]
1、实验方法
[0181]
通过新利司他抗体与新利司他药物及其类似物进行交叉反应实验来确定用于检测新利司他的抗体的特异性,抗体的特异性用交叉反应率(cr)表示,交叉反应率越小,特异性越强。将新利司他及其类似物奥利司他分别作倍比稀释,采用间接竞争elisa法进行测定,步骤同实施例5,得到类似物的ic
50
值,按照以下公式计算新利司他交叉反应率(cr),
[0182]
cr(%)=ic
50
(新利司他)/ic
50
(类似物)
×
100%
[0183]
2、实验结果
[0184]
实施例3制备的新利司他多克隆抗体与新利司他药物及其类似物的交叉反应结果如表2所示,
[0185]
表2新利司他多克隆抗体与新利司他及其类似物的交叉反应结果
[0186][0187]
注:nr表示无反应
[0188]
从表2可知,用于检测新利司他的多克隆抗体对新利司他的交叉反应率为100%,ic
50
为6.57ng/ml,对新利司他类似物奥利司他无交叉;说明用于检测新利司他的抗体对新利司他的识别能力高、特异性强,可以有效地排除新利司他类似物奥利司他对新利司他检测的干扰,能够专门用于对新利司他的检测。
[0189]
实施例7检测新利司他的试剂盒的开发
[0190]
1.试剂盒的组成
[0191]
检测新利司他的试剂盒,包含下述各部分:
[0192]
(1)包被有包被原的酶标板的制备:将实施例2制备的新利司他人工抗原cet2-ova作为包被原,用包被缓冲液将包被原稀释成31.25μg/l,每孔加入100μl,37℃避光孵育过夜,倾去孔中液体,用洗涤液洗涤2次,每次30s,拍干,然后在每孔中加入200μl封闭液,25℃避光孵育2h,倾去孔内液体拍干,干燥后用铝膜真空密封保存;包被缓冲液为ph值为9.6,0.05mol/l的碳酸盐缓冲液,封闭液为ph值为7.1~7.5,含有质量比1wt%~3wt%酪蛋白、0.1~0.3mol/l的磷酸盐缓冲液;
[0193]
(2)新利司他标准品溶液:8个浓度梯度,分别为1000μg/l,200μg/l,40μg/l,8μg/l,1.6μg/l,0.32μg/l,0.064μg/l,0.0128μg/l;
[0194]
(3)实施例3制备的新利司他多克隆抗体;
[0195]
(4)酶结合物:辣根过氧化物酶标记的实施例3制备的新利司他多克隆抗体;
[0196]
(5)底物显色液:由a液和b液组成,a液为过氧化脲,b液为四甲基联苯胺;
[0197]
(6)终止液为2mol/l h2so4;
[0198]
(7)洗涤液为ph值为7.4,含有0.5%~1.0%吐温-20、0.01
‰
~0.03
‰
叠氮化钠防腐剂、0.1~0.3mol/l的磷酸盐缓冲液,所述百分比为重量体积百分比。
[0199]
2.样品检测
[0200]
将样品和标准品对应微孔按序编号,每个样品和标准品做2孔平行,并记录标准孔和样品孔所在的位置。根据需要量将酶结合物浓缩液用酶结合物稀释液按1:10体积比进行稀释(即一份酶结合物浓缩液加入10份酶结合物稀释液,现配现用)。加入标准品/样品50μl到对应的微孔中,然后加入酶结合物工作液50μl,轻轻震荡混匀,用盖板膜盖板后置25℃避光环境中反应30min。将孔内液体甩干,加入洗涤工作液250μl/孔;充分洗涤4~5次,每次间隔10s,泼掉板孔内洗涤液,用吸水纸拍干(拍干后未被清楚的气泡可食用未使用过的枪头戳破)。加入底物显色液a液50μl/孔,再加入底物显色液b液50μl/孔,轻轻振荡混匀,用盖板膜盖板后置25℃避光环境中反应10min;加入终止液50μl/孔,轻轻振荡混匀,设定酶标仪与450nm处,测定每孔od值。
[0201]
3.检测结果分析
[0202]
标准品或样本的百分吸光率等于标准品或样本的吸光度值的平均值(双孔)除以第一个标准品(0μg/l)的吸光度值的平均值,再乘以100%。以标准品百分吸光率为纵坐标,以新利司他标准品浓度(μg/l)的对数为横坐标,绘制标准曲线图。将样本的百分吸光率代入标准曲线中,从标准曲线上读出样本所对应的浓度,乘以其对应的稀释倍数即为样本中新利司他的实际浓度。
[0203]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1