一种畜禽粪污除臭微生物菌剂及其制备方法和应用与流程
1.本发明属于涉及环境保护的微生物菌剂技术领域,具体涉及一种畜禽粪污除臭微生物菌剂及其制备方法和应用。
背景技术:
2.恶臭作为环境公害之一,不仅能带给人嗅觉的不适,而且还会使长期生活于恶臭污染环境中的人们,产生厌食、失眠、记忆力下降、心情烦躁等功能性疾病。人对异臭的感觉,是因为异臭的固体、液体、气体的各式各样的异味分子在空中散发、流动,使人的嗅觉细胞受到刺激,传达到人脑,而使人感觉到异味。
3.恶臭污染源众多,污染面广,涉及行业多,主要包括畜禽养殖场、屠宰场、垃圾处理厂、污水处理、垃圾转运站、垃圾填埋场、制药厂、发酵厂、食品厂、酒厂、垃圾堆肥站、垃圾焚烧厂、市政污水处理、食品与渔业加工和工业废水处理等场所。
4.恶臭气体成分较复杂,往往是含多种恶臭物质的混合物,大多数臭味物质,能够挥发到环境中,但通常一般可分为以下五大类:
①
含氮的化合物,如氨、胺类、酰胺、吲哚类等;
②
含硫化合物,如硫化氢、硫醇类、硫醚类等;
③
含氧的有机物,如酚、醇、醛、酮、有机酸等;
④
卤素及其衍生物,如氯气、卤代烃等;
⑤
烃类,如烷烃、烯烃、炔烃、芳香烃等。
5.对于恶臭气体的去除,最有效的手段是微生物除臭。目前,微生物除臭策略主要从两条途径出发,第一条是从吸收和利用臭味物质的角度,将微生物添加到待处理的样本中,微生物会吸收这些臭味分子,转化成细胞体内的物质,从而固定环境中的臭味物质;该方法直接治理,市场上常用,比较成熟。第二条是添加抑制产臭微生物生长的抑菌试剂,但该方法存在选择性低,抑制产臭菌的同时也会抑制有益菌,且此方法成本比较高,适用性不高。上述两条除臭策略都具有一定的除臭效果,但是对环境恶臭去除需要长期不间断施用,治标不治本,且成本很高。
6.因此,如何获得一种能够从源头治疗恶臭的微生物菌剂以及处理方法,以期解决微生物之间存在的拮抗作用,并且具备去除恶臭的效果显著,能够长时间高效处理恶臭,成为亟待解决的技术问题。
技术实现要素:
7.本发明的目的就是为了解决上述技术问题,从而提供一种畜禽粪污除臭微生物菌剂及其制备方法和应用。本发明的技术目的在于,不仅要解决如何从源头上治疗恶臭的问题;其次还要解决如何利用微生物菌剂长时间高效除恶臭的问题;再次还要解决各菌株之间容易发生拮抗作用的问题。
8.本发明的目的之一是提供一种畜禽粪污除臭微生物菌剂,所述微生物菌剂按各菌株的细菌数占复合菌总细菌数的份数计,包括以下菌株:
9.ochrobactrum sp.dsm717,15-20份;
10.rummeliibacillus pycnus dsm 15030,10-20份;
11.brevibacillus reuszeri dsm9887,10-20份;
12.enterococcus faecalis dsm2981,10-15份;
13.methylobacterium aminovorans jcm8240,5-10份;
14.acinetobacter indicus dsm 100979,10-15份;
15.bacillus velezensis cgmcc no.23309,15-20份;
16.lactococcus lactis cgmcc no.22594,10-20份。
17.一方面,本发明提供的上述微生物菌剂,能够从源头上治理恶臭,从根本上减少环境中的恶臭气体,其能够高效分解及利用碳源(糖类和油脂)、氮源(蛋白质及氨基酸)和硫源(含硫氨基酸),但不会代谢产生臭味物质(氨气、胺、硫化氢、硫醇以及异味有机酸),使得环境中臭味物质的前体降低,从源头有效抑制臭味的再次发生。
18.另一方面,本发明提供的上述微生物菌剂,能够高效实现恶臭的治理和氨气的长时间高效去除。如本发明实验例表1所示,本发明的微生物菌剂对氨气的去除率可高达95%,且21天后的去除率仍然达到86.5%,除臭效果极其显著;而不在本发明配方范围内的微生物菌剂无法实现本发明的效果。另外,该微生物菌剂能够高效利用环境中的氮源且不产生氨气,可调控含氮有机废弃物的降解途径,同时还能降解臭味素(如吲哚和3-甲基吲哚)和甲胺(三甲胺)等多种胺类化合物,全面降低环境中臭气物质的产生量。另外,本发明的微生物菌剂还能够抑制产臭微生物活性,抑制产臭微生物的生长与代谢,高效实现从源头治理和减少恶臭气体的排放。
19.更进一步,本发明提供的上述微生物菌剂,很好解决了各微生物菌株之间的拮抗性,并起到了协同增效的作用。如本发明摸索例所示,通过对500个菌株进行了大量筛选,发现大部分菌株之间都存在拮抗作用,仅有18株菌株之间无明显的抑制效应;然后进一步对这18株菌株进行二轮拮抗实验时,发现其中10株菌株之间仍然存在一定的拮抗性,仅得到8株菌株之间完全没有拮抗作用。因此本发明提供的上述微生物菌剂,很好解决了微生物菌株之间容易存在的拮抗性,各菌株之间完全没有拮抗作用,并且起到了很好的协同增效作用,实现了从源头上高效除恶臭的效果。
20.本发明提供的上述微生物菌剂中,能够高效利用氮源且不产氨气的微生物有苍白杆菌ochrobactrum sp.dsm717、鲁梅尔芽孢杆菌rummeliibacillus pycnus dsm 15030和罗伊氏芽孢杆菌brevibacillus reuszeri dsm9887;能够降解甲胺和三甲胺的微生物有嗜胺甲基杆菌methylobacterium aminovorans jcm8240;利用丁酸的微生物有粪肠球菌enterococcus faecalis dsm2981;可降解吲哚和3-甲基吲哚(粪臭素)的微生物有印度不动杆菌acinetobacter indicus dsm 100979;能够抑制产臭微生物的有贝莱斯芽孢杆菌bacillus velezensis cgmcc no.23309和乳酸乳球菌lactococcus lactis cgmcc no.22594。
21.其中,前面6种微生物均是已知菌株,均可以从市售获得,保藏编号中的dsm表示德国微生物菌种保藏中心,jcm表示日本微生物菌种保藏中心。后面两种菌株是申请人筛选获得并已提供了菌株保藏,保藏信息如下:
22.一株分类命名为贝莱斯芽孢杆菌bacillus velezensis的菌株w2,于2021年8月27日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏地址为北京市朝阳区北辰西路1号院3号,保藏编号为cgmcc no.23309;
23.一株分类命名为乳酸乳球菌lactococcus lactis的菌株hj7,于2021年5月24日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏地址为北京市朝阳区北辰西路1号院3号,保藏编号为cgmcc no.22594。
24.进一步对本发明微生物菌剂中各菌株的具体功能说明如下:
25.1、ochrobactrum sp.,苍白杆菌,去除含氮化合物类恶臭物质,将含氮化合物固定为硝态氮,菌株保藏编号dsm 717(已有菌株)。
26.2、rummeliibacillus pycnus,鲁梅尔芽孢杆菌,可去除含氮化合物类恶臭物质,将含氮化合物固定为硝态氮,菌株保藏编号dsm15030(已有菌株)。
27.3、brevibacillus reuszeri,罗伊氏芽孢杆菌,去除含氮化合物类恶臭物质,将含氮化合物固定为硝态氮,菌株保藏编号dsm 9887(已有菌株)。
28.4、enterococcus faecalis,粪肠球菌,可利用并降解丁酸,菌株保藏编号dsm2981(已有菌株)。
29.5、methylobacterium aminovorans,嗜胺甲基杆菌,可降解甲胺和三甲胺,菌株保藏编号jcm8240(已有菌株)。
30.6、acinetobacter indicus,印度不动杆菌,可降解吲哚和3-甲基吲哚粪臭素,菌株保藏编号dsm 100979(已有菌株)。
31.7、bacillus velezensis,贝莱斯芽孢杆菌,对多种动物病原细菌具有拮抗作用,菌株保藏编号cgmcc no.23309(申请人保藏)。
32.8、lactococcus lactis,乳酸乳球菌,产乳酸和乙酸,能分泌对有害菌起作用的抗生物素类物质,酸耐受性较高,菌株保藏编号cgmcc no.22594(申请人保藏)。
33.本发明的上述微生物菌剂的优点在于:
34.本发明的复合菌剂由8株功能菌株组成,其生理特性清楚,按功能进行分类,分别属于高效利用氮源且不产氨气的微生物、降解甲胺和三甲胺的微生物、利用丁酸的微生物、降解吲哚和3-甲基吲哚(粪臭素)的微生物、抑制产臭微生物和产酸微生物;多株功能明确的菌种混合培养,可调控含氮有机废弃物的降解途径,降解臭味素和甲胺等多种胺类化合物,抑制产臭微生物活性,降低环境的氨气等臭气产生量。将其用于畜禽粪污养殖场地、储粪池等不同的恶臭产生环境时,可以降低氨气、硫化氢、臭味素和甲胺等气体的排放率,有效达到源头治理和减排的效果,同时具有稳定和保留有机碳和有机氮的作用,有利于养殖粪污肥料化利用的。
35.需要说明的是,本发明中用作接种物的8种功能微生物在菌剂中的比例可根据不同的畜禽粪污发酵原料不同在所述范围内调整,使之达到更好的使用效果。
36.特别指出的是,在本发明上述微生物菌剂的基础上,进一步添加任何其它菌株,以达到降低粪污臭味的目的,并取得可预期的效果,均不背离本发明的精神,仍属于本发明的保护范围。
37.本发明的目的之二是提供上述畜禽粪污除臭微生物菌剂的制备方法,包括以下步骤:
38.(1)按菌液中各菌株的细菌数占复合菌总细菌数的份数计,分别取以下菌株的菌液:15-20份ochrobactrum sp.dsm717、10-20份rummeliibacillus pycnus dsm 15030、10-20份brevibacillus reuszeri dsm9887、10-15份enterococcus faecalis dsm2981、5-10
份methylobacterium aminovorans jcm8240、10-15份acinetobacter indicus dsm 100979、15-20份bacillus velezensis cgmcc no.23309和10-20份lactococcus lactis cgmcc no.22594;
39.(2)将步骤(1)各菌液混合后接种于培养基中,培养温度为30~40℃,ph为4-8,密封静置培养5-7天,即得所述微生物菌剂。
40.进一步的是,所述培养基配方为:豆粕10.0g/l、酵母膏2.0g/l、糖蜜20.0g/l、乙酸钠5.0g/l、柠檬酸氢二铵2.0g/l、磷酸氢二钾2.0g/l、硫酸镁0.58g/l、硫酸锰0.25g/l、吐温80 1.0ml,余量为水。
41.本发明的目的之三是提供上述畜禽粪污除臭微生物菌剂的应用,包括所述微生物菌剂在去除畜禽养殖粪污上的应用。
42.具体的,是将所述微生物菌剂制备成菌液进行应用,所述菌液包括细菌发酵液或细菌重悬液。所述细菌重悬液可以为利用任何可用于重悬细菌的液体,包括生理盐水、pbs等。
43.进一步的是,所述微生物菌剂中各菌株的菌液浓度为1~4
×
109个/ml。
44.具体的,将所述微生物菌剂在去除畜禽养殖粪污上应用时,所述应用方法包括以下步骤:
45.取所述微生物菌剂组成的发酵菌液,按照体积占比5~10%接种于培养液中,30℃放置2~7天,按照每吨粪污施用10~20公斤发酵菌液,喷施或撒施于养殖粪污储粪池中。
46.在上述应用中,当养殖粪污储粪池的温度为10~40℃范围内时,本发明的微生物菌剂均能够发挥很好的效果。
47.本发明的有益效果如下:
48.(1)本发明可针对养殖场所显著降低畜禽粪污的臭气排放,改善养殖环境,有利于畜禽养殖动物的生长繁育;
49.(2)本发明适合于不同规模的养殖场粪污堆放场所,具有良好的市场价值;
50.(3)本发明菌剂的制备方法简单,易于实施;
51.(4)本发明在降低粪污氨气等臭味的同时,可以保留有机氮和有机碳,利于畜禽粪污堆肥处理和还田。
附图说明
52.图1为菌株a~e的生长曲线;
53.图2为菌株f~j的生长曲线;
54.图3为菌株l~p(不包含n)的生长曲线;
55.图4为菌株q~t的生长曲线;
56.图5为三种配方条件下液体菌剂的活菌数;
57.图6为液体菌剂和市售除臭剂的除臭效果对比。
具体实施方式
58.为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例对本发明进行具体描述,有必要指出的是,以下实施例仅仅用于对本发明进行解释和说明,并不用于
限定本发明。本领域技术人员根据上述发明内容所做出的一些非本质的改进和调整,仍属于本发明的保护范围。
59.实施例1
60.按菌液体积份数(各菌株的细菌数)计,复合菌剂中含有如下菌种:
61.15份ochrobactrum sp.dsm717、10份rummeliibacillus pycnus dsm 15030、10份brevibacillus reuszeri dsm9887、10份enterococcus faecalis dsm2981、10份methylobacterium aminovorans jcm8240、15份acinetobacter indicus dsm 100979、20份bacillus velezensis cgmcc no.23309和10份lactococcus lactis cgmcc no.22594,
62.每份各菌种的菌浓为4
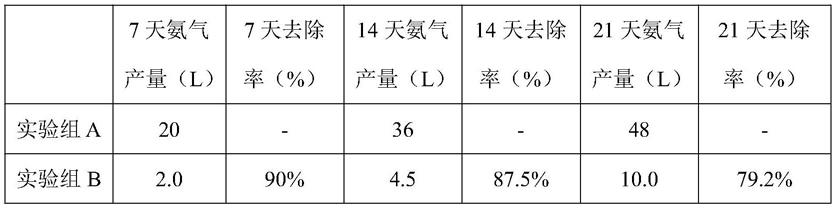
×
109个/ml。
63.实施例2
64.按菌液体积份数(各菌株的细菌数)计,复合菌剂中含有如下菌种:
65.20份ochrobactrum sp.dsm717、20份rummeliibacillus pycnus dsm 15030、10份brevibacillus reuszeri dsm9887、10份enterococcus faecalis dsm2981、5份methylobacterium aminovorans jcm8240、10份acinetobacter indicus dsm 100979、15份bacillus velezensis cgmcc no.23309和15份lactococcus lactis cgmcc no.22594,
66.每份各菌种的菌浓为1
×
109个/ml。
67.实施例3
68.按菌液体积份数(各菌株的细菌数)计,复合菌剂中含有如下菌种:
69.15份ochrobactrum sp.dsm717、10份rummeliibacillus pycnus dsm 15030、15份brevibacillus reuszeri dsm9887、10份enterococcus faecalis dsm2981、5份methylobacterium aminovorans jcm8240、10份acinetobacter indicus dsm 100979、15份bacillus velezensis cgmcc no.23309和20份lactococcus lactis cgmcc no.22594,
70.每份各菌种的菌浓为2
×
109个/ml。
71.实施例4
72.取实施例1所得复合菌剂按照体积占比10%接种于培养液中,静置培养,培养温度为30℃,培养时间为3天,ph为6;
73.所述培养液,按1l配置:豆粕5.0g、酵母膏2.0g、糖蜜20.0g、乙酸钠5.0g、柠檬酸氢二铵2.0g、磷酸氢二钾2.0g、硫酸镁0.58g、硫酸锰0.25g、吐温80 1.0ml,其余为水。
74.实施例5
75.取实施例2所得菌剂按照体积占比8%接种于培养液中,静置培养,培养温度为30℃,培养时间为5天,ph为6;
76.所述培养液,按1l配置:豆粕6.0g、酵母膏1.0g、糖蜜10.0g、乙酸钠5.0g、柠檬酸氢二铵2.0g、磷酸氢二钾2.0g、硫酸镁0.58g、硫酸锰0.25g、吐温80 1.0ml,其余为水。
77.实施例6
78.取实施例3所得菌剂按照体积占比5%接种于培养液中,静置培养,培养温度为35℃,培养时间为7天,ph为6;
79.所述培养液,按1l配置:豆粕8.0g、酵母膏2.0g、糖蜜18.0g、乙酸钠5.0g、柠檬酸氢二铵2.0g、磷酸氢二钾2.0g、硫酸镁0.58g、硫酸锰0.25g、吐温80 1.0ml,其余为水。
80.实验例
81.将实施例4、5、6所得复合菌液,施用于新鲜取得的猪粪(来自于四川某大型养猪场),模拟储粪池的环境,进行适量通气,设置a、b、c、d四组粪污除臭模拟实验。其中实验组a在启动时使用等量自来水作为空白;实验组b在启动时使用实施例1为菌剂;实验组c在启动时使用实施例2为菌剂;实验组d在沼气发酵启动时使用实施例3为菌剂;菌剂施用量按照每吨粪污施用10公斤发酵菌液。整个实验过程为21天,每7天检测一下产氨气量,测出氨气去除率如表1。从表1可以看出,本发明实施例所得复合菌剂的对氨气的去除率效果极其优异。
82.表1各实验组不同时间的氨气去除率
[0083][0084][0085]
注:表中
“‑”
表示实验组a作为空白对照,不统计氨气去除率。
[0086]
摸索例
[0087]
为了获得本发明实施例中的8个菌株组合,发明人进行了大量实验摸索和菌株筛选,具体方法如下:
[0088]
(一)实验方法与步骤
[0089]
从四川某大型养猪场采集猪粪和堆肥样品进行富集培养,设计了以下五步方法进行菌株的筛选和优化实验,最终获得具有优异的粪污除臭功能的复合菌株组合:
[0090]
第一步,从产臭不明显富集样本中培养出约500个单菌落,获得粪污原位可生长单菌落500个,为筛选具有除臭的菌株做充分准备。根据培养条件主要是细菌和真菌,大致包含酵母菌、乳酸菌、芽孢杆菌等。
[0091]
第二步,对500个单菌落进行一轮拮抗效果实验筛选,发现只有20个菌落无明显的拮抗作用,其余480个菌落均表现出明显的拮抗作用。将筛选出的20个菌落依次命名为a、b、c、d、e、f、g、h、i、j、k、l、m、n、o、p、q、r、s、t,经菌落形态描述及分子生物学鉴定,上述20个菌株名称见表2,其中n和k为条件致病菌,其余18株菌株主要包含乳酸菌和芽孢杆菌、酵母菌等,将其作为具有除臭效果的供试菌株,并对这18株菌的生长和培养条件进行检测和优化。
[0092]
表2各菌株的名称
[0093][0094]
第三步,对上述18株菌进行二轮拮抗实验,进一步筛选这18株菌之间是否存在拮抗作用,结果发现其中仍然有10株菌存在拮抗作用,仅有8株菌之间完全不发生拮抗作用,分别为a、b、c、d、e、f、g、h,对应的菌株名称依次为:ochrobactrum sp.,rummeliibacillus pycnus,brevibacillus reuszeri,enterococcus faecalis,methylobacterium aminovorans,acinetobacter indicus,bacillus velezensis,lactococcus lactis。
[0095]
第四步,设计了以这8株菌为基础的三种菌株配方组合,进行了菌株发酵混合培养优化实验;并与市售除臭生物试剂进行除臭效果评估实验,最终确定具有优异粪污除臭功能的8个菌株的组合。
[0096]
第五步,对8个菌株组合的比例进行初步设置,在设置范围内随机改变获得3个比例配方,以氨气去除率为指标优化不同菌株组分比例,通过实验可知,在设定的比例组合范围内均可取得较好的除臭效果。
[0097]
具体实验方法步骤如下:
[0098]
1、实验材料
[0099]
(1)供试载体
[0100]
非金属矿物载体:沸石粉、植物源载体:稻壳粉、玉米秸秆粉。
[0101]
上述载体过60目筛,在121℃灭菌30min,烘干备用。
[0102]
(2)供试培养基
[0103]
mrs培养基(g/l):蛋白胨10g、葡萄糖20g、乙酸钠5g、硫酸镁0.2g、硫酸锰0.05g、牛肉粉5g、酵母粉4g、磷酸氢二钾2g、柠檬酸三铵2g、吐温80 1mg/l、琼脂粉15g。
[0104]
ypd培养基(g/l):酵母粉10、蛋白胨20g、葡萄糖20g、琼脂20g。
[0105]
cc培养基(g/l):酵母粉10g、蛋白胨3g、葡萄糖10g、琼脂20g。
[0106]
2、试验方法
[0107]
(1)菌株的生长曲线和产氨气性能分析
[0108]
从臭味不明显的猪粪或堆肥样品中分离具有除臭潜力的功能微生物,使用m9u产氨检测培养基,经群落分析及分子生物学鉴定菌株。
[0109]
(2)菌株生长曲线测定
[0110]
按照体积比1%将菌株a~t接种在mrs液体培养基,30℃、200rpm摇床单独培养。前
14h每隔2h各取200μl菌液,14~46h每隔8h各取200μl菌液,使用酶标仪进检测od
600
,每组重复检测2次。以时间(h)为横坐标,od
600
值为纵坐标,建立各菌株生长曲线。
[0111]
(3)拮抗作用分析
[0112]
将菌株通过划线交叉法,在mrs平板上两两之间交叉划线,观察交叉点是否有菌生长。两菌均能生长,则无拮抗作用;只有一株或者两株均不能生长则存在拮抗作用。运用牛津杯抑菌圈法测定菌株之间的拮抗性,观察透明圈的大小,透明圈越大代表拮抗性越强烈,反之,则拮抗性越低。
[0113]
(4)菌剂对猪粪臭气及氨气的去除效果评估
[0114]
除臭效果评估反应体系见表3。
[0115]
表3复合菌剂除臭效果评估
[0116][0117]
注:a、b、c组中的液体菌剂配方1、配方2、配方3参见下文中具体记载的配方1、配方2、配方3;市售除臭剂1主要成分是植物提取液,商品名为百芬百;市售除臭菌剂2主要包含芽孢杆菌、酵母菌、光合细菌、乳酸菌,商品名为倍净师。
[0118]
嗅觉影响分析评估标准见表4。
[0119]
表4恶臭评判标准
[0120][0121][0122]
产氨气检测:将湿润的红色石蕊试纸贴于盛有样品的一次性塑料盒盖,盖上盖子3min后读取颜色,红色石蕊试纸遇氨气变紫。
[0123]
产硫化氢检测:将湿润的醋酸铅试纸贴于盛有样品的一次性塑料盒盖,盖上盖子3min后读取颜色,醋酸铅试纸遇硫化氢变黑。
[0124]
(5)氨气去除率计算
[0125]
称取24份猪粪样品置于一次性塑料盒中,每份250g,将其分为5个试验组和1个对照组,每组设置3个重复。5个试验组分别加液体菌剂1、液体菌剂2、液体菌剂3、市售除臭剂1、市售除臭菌剂2,对照组加无菌水。与猪粪充分混匀,然后将盛有20ml稀硫酸的小烧杯平稳放入一次性饭盒中,加盖密封,吸收氨气。每2天吸取1ml稀硫酸样品,10天后取样结束,利用凯式定氮法测氨,氨气去除率计算公式如下:
[0126][0127]
(二)实验结果
[0128]
1、菌株生长曲线测定
[0129]
通过检测各菌株不同生长时间的od
600
值,绘制出菌株生长曲线,如图1~图4。图1显示,在30℃、200rpm摇床单独培养相同条件下,菌株a~e在8~20小时达到对数生长期,菌株a、b、c、e在20~28小时进入平稳生长期,菌d在28~36小时进入衰退期,之后生长平稳。图2、3、4显示,菌株f在20~28小时进入衰退期,之后生长平稳。菌株g在4~12小时达到对数生长期,12~48小时生长平稳;菌株h、i、j、l、m在8~28小时进入对数生长期,第28小时以后开始衰退。菌株o在8~28小时达到对数生长期,28小时以后生长开始衰退;菌株s在12~28小时内达到对数生长期,之后生长较为平稳;菌株p、q、r、t在4~8小时内进入对数生长期,在8~48小时内,菌株p、r、t增长缓慢,生长较为平稳,菌株q在8~12小时内生长衰退,12~20小时内菌数开始增长,20小时以后生长平稳。
[0130]
从上述结果可以看出,菌株a~f、h~o均在8小时后进入对数生长期,对数生长期均在12小时以上,部分菌株对数生长期后进入平稳生长期,48小时以内不会有衰退期,平稳生长期均时长超过12小时,如菌株a、b、c、e、f等,但是h、i、j、l、m、n等菌株在28小时以后进入生长衰退期。菌株g、p、q、r、t等在4小时后进入对数生长期,对数生长期持续时长约4小时,均在4小时以后的不同时间进入平稳生长期,平稳生长时间超过对数生长期。因此,按照对数生长期收集菌体作为与载体复配的时间节点,菌株g、r分别在培养10.4小时和7.2小时收集,其他菌株均在培养17.6小时以后收集菌体。
[0131]
2、菌株间拮抗作用分析
[0132]
通过平板交叉划线法探究各菌株间的拮抗作用,观察交叉点处的菌株生长情况。如下表5所示:18株微生物之间无相互抑制效应。微生物之间的拮抗作用是指一种微生物的生长和代谢活动,对其他微生物产生抑制、干扰或毒害作用。拮抗作用一般具有专一性或特异性,本实验中所筛选菌株有乳酸菌、酵母菌和芽孢杆菌等,广泛共存于环境中。经过拮抗实验可得有8株菌株之间完全没有拮抗作用,而其余10株菌存在一定的拮抗性。
[0133]
表5菌株的拮抗性
[0134][0135]
表中
“‑”
表示无拮抗作用,“+”表示有拮抗作用。
[0136]
3、菌株配方对液体菌剂活菌数的影响
[0137]
经过初步筛选a~h菌株为备选菌株,通过分子鉴定得到8个菌株:ochrobactrum sp.(dsm717),rummeliibacillus pycnus(dsm 15030),brevibacillus reuszeri(dsm9887),enterococcus faecalis(dsm2981),methylobacterium aminovorans(jcm8240),acinetobacter indicus(dsm 100979),bacillus velezensis(cgmcc no.23309),lactococcus lactis(cgmcc no.22594)。
[0138]
选择8种菌株作为复合菌剂备选菌株,按照分别含有6株菌、7株菌和8株菌,形成三种不同的组合配方:组合配方一含6株菌,共28个组合;组合配方二含7株菌,共8个组合;组合配方三含8株菌,1个组合。筛选出不同组合配方下氨气的累积量和氨气去除率效率最好的配方,分别记为配方1(含6株菌),配方2(含7株菌)和配方3(含8株菌),具体配方如下:
[0139]
配方1(6种菌)为:ochrobactrum sp.,15份;rummeliibacillus pycnus,10份;brevibacillus reuszeri,15份;enterococcus faecalis,10份;methylobacterium aminovorans,5份;acinetobacter indicus,10份。
[0140]
配方2(7种菌)为:ochrobactrum sp.,15份;rummeliibacillus pycnus,10份;brevibacillus reuszeri,15份;enterococcus faecalis,10份;methylobacterium aminovorans,5份;acinetobacter indicus,10份;bacillus velezensis,15份。
[0141]
配方3(8种菌)为:ochrobactrum sp.,15份;rummeliibacillus pycnus,10份;brevibacillus reuszeri,15份;enterococcus faecalis,10份;methylobacterium aminovorans,5份;acinetobacter indicus,10份;bacillus velezensis,15份;lactococcus lactis,15份。
[0142]
考察了在不同配方(配方1~配方3)下,培养5天,对菌剂总活菌数的影响,结果如图5。从图5可以看出,三种配方培养下,总菌数都可达到10
10
个/ml以上,表明混合培养的效果比较好,可以达到复合菌剂共培养的要求。测定不同配方的氨气累积量和氨气去除率,结果如表6,从表6可以看出,配方1~3的组合菌剂氨气产量与对照组(加无菌水)相比均大大降低,其中以配方3的氨气产量最低,氨气去除率最高。
[0143]
表6不同组合配方氨气累积量和氨气去除率
[0144][0145]
4、菌剂对猪粪臭气及氨气的去除效果评估
[0146]
考查不同菌剂配方对猪粪臭氧的去除效果,如表7和图6的结果显示,配方3除臭效果最好,几乎闻不到气味;配方2次之,气味很弱;配方1和市售除臭剂1除臭效果不明显,很容易能感觉到气味,市售除臭菌剂2除臭效果最差,可以闻到强烈的气味。因此配方3具有更好的实际粪污除臭效果。
[0147]
表7菌剂除臭效果分析评估
[0148][0149]
5、以氨气去除率为指标优化不同菌株组分比例
[0150]
以上述配方3的菌株组合,分别设计三种不同的比例进行除臭效果实验。
[0151]
比例一,按菌液体积份数计,复合菌剂中含有如下菌种:ochrobactrum sp.,15份、rummeliibacillus pycnus,10份、brevibacillus reuszeri,10份、enterococcus faecalis,10份、methylobacterium aminovorans,10份、acinetobacter indicus,15份、bacillus velezensis,20份、lactococcus lactis,10份;每份各菌种的菌浓为4
×
109个/ml。
[0152]
比例二,按菌液体积份数计,复合菌剂中含有如下菌种:ochrobactrum sp.,20份、rummeliibacillus pycnus,20份、brevibacillus reuszeri,10份、enterococcus faecalis,10份、methylobacterium aminovorans,5份、acinetobacter indicus,10份、bacillus velezensis,15份、lactococcus lactis,15份;每份各菌种的菌浓为1
×
109个/ml。
[0153]
比例三,按菌液体积份数计,复合菌剂中含有如下菌种:ochrobactrum sp.,15份、rummeliibacillus pycnus,10份、brevibacillus reuszeri,15份、enterococcus faecalis,10份、methylobacterium aminovorans,5份、acinetobacter indicus,10份、bacillus velezensis,15份、lactococcus lactis,20份;每份各菌种的菌浓为2
×
109个/ml。
[0154]
实验室条件下,在猪粪存储盒中使用上述菌剂,测定其氨气的积累量。氨气去除率结果表明(表8):在第7天,三种比例的菌剂氨气去除率均达90%以上;在第14天,三种比例的菌剂氨气去除率均达87.5%以上;在第21天,三种比例的菌剂氨气去除率均达79.2%以上。结果表明在设置范围内随机改变获得3个比例配方,以氨气去除率为指标优化不同菌株组分比例,通过实验可知,在设定的比例组合范围内均可取得较好的除臭效果。
[0155]
表8不同菌株比例组合氨气累积量和氨气去除率
[0156]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1