一种急性T淋巴细胞白血病药物靶点及其应用
一种急性t淋巴细胞白血病药物靶点及其应用
技术领域
1.本发明涉及生物医药技术领域,尤其涉及一种急性t淋巴细胞白血病药物靶点及其应用。
背景技术:
2.急性t淋巴细胞白血病(t-all)是一组在正常造血系统分化过程中造血干/祖细胞恶性克隆增殖性疾病,以骨髓t系幼稚淋巴细胞异常增殖和聚集为主。近年来,t-all患者经过化疗和异基因造血干细胞移植在生存上都取得了较明显的延长,同时也开发了多种靶向药物,但t-all的5年生存率仍然不高。t-all患者在经过长期巩固化疗或者异基因移植后,仍有可能出现复发,随之而来的病情极度恶化,最后很快导致死亡。因此,治愈率低、预后差是t-all面临的关键问题。随着对白血病分子发病机制的理解日益加深,与预后相关的分子标志可作为临床治疗指导。因此,寻找与t-all 发病相关的分子标志物及治疗靶点,对于t-all的治疗具有重要的指导意义。
3.egfl7属于egf域超家族成员,相对分子量为30kda,是在进化中高度保守的基因。人类egfl7基因定位于9号染色体长臂末端,并且为分泌型蛋白。egfl7蛋白从氨基端到羧基端依次可分为三部分:一个信号肽、一个富含半胱氨酸的emi结构域、两个表皮生长因子样结构域。egfl7基因与蛋白在物种间高度保守,提示其有可能参与重要的生命调节。目前的研究表明,egfl7特异性表达于内皮细胞,是调节内皮细胞迁徙的关键因子,在血管生成过程中发挥重要作用,且在多种肿瘤如肝癌、胶质瘤、黑色素瘤、胰腺癌、卵巢癌、宫颈癌、胃癌、乳腺癌、喉癌等实体瘤细胞也相对高表达egfl7,并且其表达程度与这些实体瘤的分期和不良预后密切相关,egfl7也是与肿瘤侵袭转移密切相关的癌基因。如zhou b等(epidermalgrowth factor-like domain 7regulates breast cancer cell proliferation andvascular endothelial growth factor expression via the p38mapk signalingpathway)通过构建egfl7稳定过表达载体和egfl7敲除载体发现egfl7 可促进乳腺癌细胞增殖和血管生成;如liu q等(novel expression of egfl7 in osteosarcoma and sensitivity to cisplatin.front oncol)通过对比骨肉瘤(os) 中egfl7的分泌及其化疗后分泌的变化,发现egfl7响应化疗的过度表达表明它可以用作os的治疗靶点。但关于egfl7在t-all中发挥的作用尚未见相关报道。
技术实现要素:
4.为解决上述技术问题,本发明提供了egfl7作为急性t淋巴细胞白血病药物靶点的新用途,敲低egfl7可显著抑制急性t淋巴细胞白血病的增殖,可作为t-all相关的生物标志物,为t-all的临床辅助诊断技术提供了新的方向。
5.本发明的第一个目的是提供一种急性t淋巴细胞白血病药物靶点,该药物靶点为表皮生长因子域7(egfl7),其核苷酸序列如seq id no.1所示。
6.本发明通过对egfl7在t-all患者及t-all细胞系中表达情况的研究,发现egfl7在
正常供体及t-all患者骨髓单个核细胞中的表达具有明显的差异:egfl7在t-all患者骨髓单个核细胞中的表达量相对于健康对照组极其显著上调。并进一步检测egfl7在t-all各细胞系中的表达,通过在 t-all细胞中沉默egfl7,分析egfl7对t-all细胞表型等方面影响及相关调控作用,发现egfl7促进t-all细胞的增殖。通过体内动物实验进一步验证了egfl7对t-all的促增殖作用,因此,egfl7具有作为t-all 相关的生物标志物的潜能。
7.本发明的第二个目的是提供一种预防或治疗急性t淋巴细胞白血病的药物,该药物以egfl7为靶点进行设计,降低egfl7的表达。
8.进一步地,药物中含有egfl7的拮抗剂。
9.进一步地,含有egfl7的拮抗剂为sirna、抗体、shrna、慢病毒包裹的序列等。
10.进一步地,上述shrna的序列为:
11.ccggtgcaagaaagactcgtgactgctcgagcagtcacgagtct ttcttgcattttt。
12.进一步地,抗体为megf0444a。
13.进一步地,egfl7为急性t淋巴细胞白血病药物研制也提供了新的可能性,如作为药物筛选靶点。
14.本发明的第三个目的是提供一种抑制急性t淋巴细胞白血病细胞株 jurkat或ccrf-cem增殖或转移的试剂,该试剂中包括抑制egfl7表达的物质。本发明通过沉默egfl7,发现t-all细胞增殖速度减慢,克隆能力被抑制,尤其是jurkat和ccrf-cem。
15.本发明的第四个目的是提供一种试剂盒,该试剂盒包含用于检测egfl7 表达量或分泌量的试剂。该试剂盒可用于诊断待测个体是否患有急性t淋巴细胞白血病,或诊断待测个体的急性t淋巴细胞白血病的恶性程度,或预测待测个体的急性t淋巴细胞白血病的发病风险程度。
16.进一步地,该试剂盒中还包含扩增egfl7的引物对,该引物对的核苷酸序列如seq id no.3和seq id no.4所示,具体为:
17.f:tgaatgcagtgctaggaggg;
18.r:gcacagagtgtaccgtct。
19.借由上述方案,本发明至少具有以下优点:
20.本发明发现egfl7高表达于t-all患者中,是独立的不利因素,提供了一种新的针对t-all的治疗靶点,在t-all的治疗、药物筛选等方面具有巨大的潜力。
21.上述说明仅是本发明技术方案的概述,为了能够更清楚了解本发明的技术手段,并可依照说明书的内容予以实施,以下以本发明的较佳实施例并配合详细附图说明如后。
附图说明
22.为了使本发明的内容更容易被清楚的理解,下面根据本发明的具体实施例并结合附图,对本发明作进一步详细的说明。
23.图1为正常供体和t-all患者骨髓单个核细胞中egfl7的表达情况;
24.图2为t-all患者的kaplan-meier生存分析结果;
25.图3为t-all患者和正常供体血浆中egfl7蛋白表达情况;
26.图4为egfl7在t-all细胞中基因水平的表达情况;
27.图5为egfl7在t-all细胞中蛋白水平的表达情况;
28.图6为jurkat/shegfl7组和jurkat/shctrl组egfl7的mrna表达情况;
29.图7为jurkat/shegfl7组和jurkat/shctrl组egfl7的蛋白表达情况;
30.图8为jurkat/shegfl7组和jurkat/shctrl组细胞增殖速度;
31.图9为jurkat/shegfl7组和jurkat/shctrl组细胞克隆情况;
32.图10为jurkat/shegfl7组和jurkat/shctrl组的nsg小鼠发病时间情况;
33.图11为jurkat/shegfl7组和jurkat/shctrl组小鼠肝脏脾脏肿大情况;
34.图12为jurkat/shegfl7组和jurkat/shctrl组在肝脏、骨髓和脾脏中的侵袭情况;
35.图13为parsatuzumab与igg抗体对t-all细胞增殖的抑制情况;
36.图14为parsatuzumab与igg抗体对t-all细胞克隆数量及大小的抑制情况;
37.图15为parsatuzumab与igg抗体对小鼠生存情况的影响。
具体实施方式
38.下面结合附图和具体实施例对本发明作进一步说明,以使本领域的技术人员可以更好地理解本发明并能予以实施,但所举实施例不作为对本发明的限定。
39.一、材料和方法
40.(一)、动物
41.6-8周spf级c57bl/6j(wt)小鼠从苏州大学实验动物中心购买,并在大学标准化动物中心维持spf级环境饲养。所有是实验小鼠都保持在恒定的环境中,饲养环境要求温度为18~29℃,日温差≤3℃,相对湿度达40 %~70%,新鲜空气换气次数l0次/h,气流速度≤0.18m/s,压差25pa,洁净度一万级,氨浓度l5mg/m3,噪音≤60db,照度150~300lux,光照周期(12 小时光照:12小时黑暗),小鼠均饲养于spf(specific pathogen-free facility) 级别的隔离笼中,无病原菌,并且保证充足的水和食物。所有的程序是根据动物护理委员会和美国国立卫生研究院的关怀和使用动物的指南进行。
42.(二)、细胞
43.t-all细胞系:jurkat,t-all-sil,lousy,hpb-t-all,ccrf-cem, molt-4培养于含10%fbs的rpmi1640完全培养基中,37℃,5%co2细胞培养箱中培养。
44.(三)、主要试剂及耗材
45.trizol:invitrogen
46.all-in-one rt master mix:abcam
47.sybr green real-time pcr master mix:bimake
48.rpmi1640培养基:hyclone
49.胎牛血清:bi公司
50.青霉素链霉素:索莱宝
51.ripa裂解液(强):碧云天生物科技
52.western封闭液:5%脱脂牛奶
53.质粒抽提试剂盒:碧云天生物技术
54.pagerμler prestained protein ladder:thermo fisher
55.phosphatase/protease inhibitor cocktail:cell signaling technology
56.ecl化学发光底物:thermofisher
57.human egfl7 elisa试剂盒:康为
58.异丙醇、乙醇:阿拉丁生化
59.硝酸纤维素膜:merck
60.甲基纤维素半固体培养基:stem cell
61.鼠抗人gapdh一抗:santa cruz
62.鼠抗人egfl7一抗:santa cruz
63.cck8:bimake
64.人cd45抗体:santa cruz
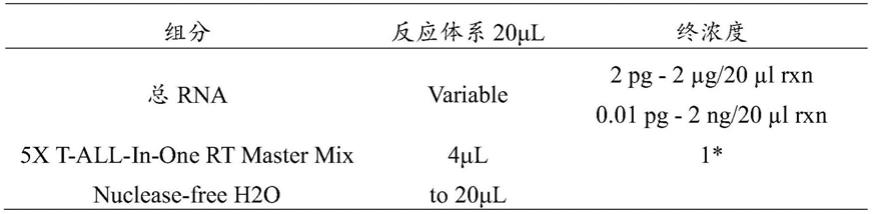
65.parsatuzumab:睿捷
66.igg:sigma
67.实施例1
68.一、操作过程:
69.1.t-all患者及供体骨髓单个核细胞提取
70.将5ml左右t-all患者或供体的骨髓标本缓慢加入预含5ml ficoll淋巴细胞分离液的离心管中,2000转/分钟,上机离心20分钟。轻轻吸取中间白膜层,加入等体积pbs混匀后,离心2000转/分钟,离心5分钟。倒掉上清后,收集底部沉淀细胞即为骨髓单个核细胞。
71.2.rna提取(trizol方法):在收集的骨髓单个核细胞中加入1mltrizol,充分吹打混匀,置于冰盒5分钟后;离心10分钟,10,000转/分钟,加入200μl氯仿后充分颠倒混匀,置于冰盒5分钟后10,000转/分钟,离心15分钟。吸净上层液体,移至不含rna酶的ep管,同时加入相同体积的异丙醇溶液,轻柔混合均匀,置于冰盒15分钟,10,000转/分钟离心15分钟后弃上清。加入600μl 70%乙醇,轻柔地颠倒混匀,10,000转/分钟离心 15分钟,弃上清。加入800μl无水乙醇,上下颠倒混匀,10,000转/分钟离心5分钟;弃上清,通风橱内干燥。加入20-50μldepc水,ep管中包含总 rna;将得到的rna使用nano drop仪器测定浓度及纯度,实验室-80℃冰箱储存备用。
72.3.逆转录:rna逆转录为cdna,以下为反应体系
[0073][0074]
反应过程:25℃分钟,42℃15分钟,85℃5分钟。
[0075]
4.实时荧光定量pcr(real-time pcr)反应:该反应在96孔板中进行,总反应体系为20μl,每个样本重复两次。
[0076][0077]
pcr引物
[0078][0079]
反应过程:95℃10分钟,95℃15秒,60℃1分钟,共40个循环。
[0080]
5.elisa法测定t-all患者及健康人外周血egfl7的表达:按照 elisa试剂盒的说明操作,在吸光度为450nm长度下检测,通过对比标准品,采用多功能光谱酶标仪,计算样品的浓度,以纳克/毫升(ng/ml)表示结果。
[0081]
6.免疫印迹实验
[0082]
6.1细胞系总蛋白提取:收集t-all患者或供体的骨髓标本细胞,用预冷的1*pbs洗涤两遍,按1*107细胞/ml的比例加入细胞裂解液ripa,同时按1:100的比例分别加入蛋白酶抑制剂和磷酸酶抑制剂;冰盒静置30分钟,期间可以每隔10分钟涡旋震荡30秒,以促进细胞的充分裂解;在4℃条件下,离心5分钟,120000g,吸上清至新的ep管中,置于冰上。
[0083]
6.2蛋白浓度测定:按不同浓度取5μl蛋白标准品加至96孔板中;取5μl sample到96孔板中。如果样品量较少,需加标准品稀释液补足到5μl。注意记录样品体积;各孔加入250μl染色液;在酶标仪上设定吸光度为a595 的波长的测定;根据标准曲线计算出样品中的蛋白浓度。
[0084]
6.3蛋白质变性:根据上样量,计算所需要的蛋白样品的体积,按总体积比例相应的加入loading buffer,混合后于沸水中煮大约10分钟,促使蛋白质变性。
[0085]
6.4sds-聚丙烯酰胺凝胶电泳:取出10%预制胶,在电泳槽内测缓慢加入已经配制好的1*电泳缓冲液;将之蛋白样品取出,并再次在沸水中煮10 分钟,进一步保证蛋白质变性,然后冷却至室温逐个加样,并在电泳槽外侧加至一定体积的1*电泳缓冲液;将电泳槽与电泳仪按照正确的电极连接,电压调至恒压80v,90min,待跑出分离胶后,可将电压上调至120v,待溴酚蓝跑至浓缩胶块底部时,关闭电源,取出预制胶。
[0086]
6.5转膜:可提前将预先准备硝酸纤维素膜(nc膜)浸泡在预冷的1* 转膜液中;取出胶后缓慢浸泡在转膜液中,按照滤纸-nc膜-分离胶-滤纸的顺序放置,每放置一层需要去除每层之间的气泡;将电转仪与电泳仪按照正确的电极连接,倒入预冷的1*转膜液,并置于冰盒中,可在槽中放入冰块,将电流调至恒流200ma,设置转膜时间约为1.5小时。
[0087]
6.6目的蛋白及内参蛋白的检测:转膜结束后,轻柔取出nc膜,加入 5ml快速封闭
液后置于摇床上,室温下进行封闭30分钟,弃去封闭液,按不同的蛋白样品的分子量,根据蛋白marker,剪裁nc膜,再转入相应大小的容器中,分别加入目的蛋白的一抗鼠抗人egfl7抗体,以及作为内参的鼠抗人gapdh蛋白一抗,于4℃冰箱,摇床上孵育过夜,第二天加入1*tbst 约5ml于摇床上快速摇晃洗涤3次,每次持续5分钟,根据不同的一抗,加入辣根过氧化物酶(hrp)标记的二抗稀释液,摇床上室温孵育30分钟后加入1*tbst约5ml于摇床上快速摇晃洗涤3次;最后将ecl底物按1:1 的比例混合后滴加在nc膜上,平铺均匀,使用成像仪显影后拍照保存。
[0088]
7.悬浮细胞培养:将细胞及培养液转移至离心管中,离心5分钟,1000 转/分;弃上清,加入适量rpmi完全培养基(rpmi 1640培养基+10%fbs+1%青霉素/链霉素)重悬细胞,根据细胞数将细胞培养在培养瓶中,放置于37℃,含5%co2培养箱中每2~3天换液传代。
[0089]
8.病毒包装与细胞感染
[0090]
8.1质粒准备:敲低egfl7表达的shrna质粒shegfl7(ccgg tgcaagaaagactcgtgactgctcgagcagtcacgagtctttcttgca ttttt)及相应对照质粒shctrl均购自于上海吉凯公司。
[0091]
8.2包装慢病毒:复苏hek 293t包装细胞系,复苏后调至最佳细胞状态,于包装病毒前18小时传代细胞,并按细胞计数1.0
×
106/皿接种至直径为10cm的培养皿,培养箱培养过夜。保证hek 293t细胞在包装前约有60-80%左右的融合度。按慢病毒包装体系:目的载体质粒和空载体质粒 10μg,δr 6.5μg,vsv-g 3.5μg,rev 2.5μg计算所需质粒的体积进行包装。收集48小时病毒上清,倒置光学显微镜下观察荧光,吸取病毒上清,使用 0.45μm滤膜过滤除菌,将其分装后保存于-80℃冰箱冻存待用。
[0092]
8.3细胞感染:将jurkat细胞分为两组,每组1*105/ml数量的悬浮细胞,加入1ml新鲜完全培养基重悬于6孔板中,按1:1的比例分别加入收集的病毒上清,细胞培养48~72小时后流式检测gfp+百分比以判断病毒的感染效率。
[0093]
8.4流式分选筛选感染细胞:按照细胞传代步骤准备细胞;使用1*pbs 洗涤细胞;1000rpm,离心5分钟;
[0094]
弃上清,用800μl~1ml含edta的1*pbs重悬细胞;并使用分选滤膜滤过细胞去除细胞团块;接收管中准备200μl完全培养基;因转化质粒带有gfp,病毒感染的aml细胞系无需额外染色,流式细胞仪上机,选择通道,设门,分选gfp阳性的细胞,继续培养扩增,最终得到敲低 egfl7表达的jurkat/shegfl7细胞和对照细胞jurkat/shctrl。通过real-timepcr和western blot实验检测细胞系中的egfl7的表达情况。
[0095]
9.cck8细胞增殖实验:jurkat/shegfl7和jurkat/shctrl按5*103个/孔接种于96孔细胞培养板上,置于37℃5%co2培养箱培养过夜培养,每孔加入10μl cck8试剂继续培养2小时,酶标仪下检测450nm波长的各孔吸光度的od值。
[0096]
10.集落形成实验:
[0097]
将甲基纤维素培养基从冰箱中取出后复温,待甲基纤维素培养基充分融化后,向离心管中加入所需要的甲基纤维素培养基,同时细胞计数,调整细胞密度为10,000细胞/ml;吸取50μl细胞(500个细胞)悬液加入甲基纤维素半固体培养基中(已加入抗生素),涡旋30秒,并以300rpm速度离心,充分混匀细胞和培养基;取含500个细胞的体积(含培养基)及甲基纤维素培养基混合物1ml,加入35mm的小培养皿中置于培养箱培养7天。在4* 显微镜下计数克隆数目;倒置荧光显微镜下拍照并保存。
[0098]
11.t-all小鼠模型的建立
[0099]
将8周龄,体重18~22g的nsg小鼠随机分成两组,每组5只抽取100μl 含1*105个的jurkat/shegfl7和jurkat/shctrl细胞分别以尾静脉注射接种于已辐照的小鼠。观察实验组jurkat/shegfl7及对照组jurkat/shctrl小鼠是否有毛色暗淡,炸毛,四肢乏力,行动迟缓,脾脏肿大等白血病等发病情况,记录生存时间,解剖小鼠,流式细胞术观察肝脾及骨髓中cd45阳性细胞百分率。
[0100]
12.parsatuzumab(megf0444a)对t-all细胞增殖能力的影响
[0101]
jurkat细胞按5*103个/孔接种于96孔细胞培养板上,加入igg或 parsatuzumab后,置于37℃5%co2培养箱培养过夜培养,每孔加入10μl cck8试剂继续培养2小时,酶标仪下检测450nm波长的各孔吸光度的od 值。
[0102]
将含500个细胞的体积(含培养基)及甲基纤维素培养基混合物1ml 中,加入igg或parsatuzumab后,转移到35mm的小培养皿中置于培养箱培养7天。在4*显微镜下计数克隆数目;倒置荧光显微镜下拍照并保存。
[0103]
将8周龄,体重18~22g的nsg小鼠随机分成三组,每组5只,抽取 100μl含5*106个的jurkat细胞以尾静脉注射接种于已辐照的小鼠。从接种后第二周开始,每隔一天注射50mg/kg igg或parsatuzumab抗体,观察小鼠生存时间。
[0104]
13.统计学分析
[0105]
本实验数据采用spss statistics 20.0统计软件分析。非参数秩和检验计量资料,卡方检验或fisher检验分类变量,mann-whitney连续变量采用, kaplan-meier方法log-rank检验os和dfs比率,并对数秩和检验进行比较。cox比例回归用于单因素及多因素分析。统计学显著性差异定义为 p《0.05。
[0106]
二、实验结果
[0107]
1.egfl7在t-all患者骨髓中相对高表达
[0108]
通过qrt-pcr和western blot分析发现,与正常供体骨髓单个核细胞相比,t-all患者骨髓单个核细胞检测到相对较高的egfl7的表达(图1)。对于所有纳入本实验的t-all患者进行kaplan-meier生存分析(图2)。发现,egfl7高表达组t-all患者的os明显低于egfl7低表达组t-all患者(p=0.045)。
[0109]
2.elisa法测定t-all患者及健康人外周血egfl7的表达
[0110]
收集t-all患者及正常供体的外周血血浆及骨髓标本,通过elisa分析发现t-all患者血浆中egfl7蛋白表达水平高于正常人(图3)。
[0111]
3.egfl7在t-all细胞中表达情况
[0112]
qpcr结果显示egfl7相对高表达在jurkat细胞和ccrf-cem细胞,而相对低表达于molt-4、t-all-sil、lousy和hpb-all中,但在cd34
+
正常供体单个核细胞中几乎没有表达(图4)。western blot结果显示,egfl7 在蛋白水平相对高表达于jurkat和ccrf-cem中,而在molt-4和 t-all-sil中也有一定表达,在hpb-t-all和lousy中有微弱表达(图5)。
[0113]
4.在t-all细胞系中制备egfl7基因沉默细胞
[0114]
我们采用real-time pcr及western blot检测jurkat细胞经过egfl7 (jurkat/shegfl7)或ctrl(jurkat/shctrl)慢病毒感染后细胞中egfl7的 mrna及蛋白表达水平,gapdh作为内参,结果证实与对照细胞 jurkat/shctrl相比,jurkat/shegfl7组在基因(图
6)及蛋白水平(图7)都降低了egfl7的表达。以上实验证明egfl7基因沉默的jurkat细胞构建成功。
[0115]
5.体外实验证明egfl7基因沉默对t-all细胞增殖的影响
[0116]
应用cck8法检测沉默egfl7后对jurkat细胞增殖活性的影响。结果显示,与对照组jurkat/shctrl相比,沉默egfl7的实验组jurkat/shegfl7 细胞增殖速度减慢(图8),表明沉默egfl7可以抑制t-all细胞增殖活性。进一步采用集落形成实验检测沉默egfl7对t-all细胞系克隆形成能力的影响。结果显示,与对照组jurkat/shctrl相比,沉默egfl7可以抑制 jurkat细胞克隆能力(图9)。
[0117]
6.体内实验证明egfl7基因沉默对t-all细胞增殖的影响
[0118]
本实验采用nsg小鼠构建t-all移植小鼠模型,观察实验组及对照组小鼠的发病情况,记录生存时间。与对照组相比,沉默egfl7的t-all细胞延缓nsg小鼠发病时间(图10)。通过小鼠生存曲线分析,发现egfl7 在维持t-all进展中发挥重要功能。为了在体内更直接验证egfl7缺失对 t-all细胞的作用,我们在25天左右统一处死小鼠,与对照组jurkat/shctrl 相比,实验组明显改善小鼠肝脏脾脏肿大的症状(图11,左图为脾脏,右图为肝脏)。同时,通过分析小鼠肝、骨髓及脾脏的人cd45阳性细胞群体的表达,发现egfl7缺失显著降低白血病细胞在外周血中的比例及免疫、造血器官中的负荷(图12)。
[0119]
7.体内外实验证明靶向egfl7的抗体parsatuzumab能够抑制t-all细胞的增殖
[0120]
为了验证靶向egfl7的抗体parsatuzumab对t-all细胞增殖能力的影响,利用cck-8法检测在加入对照抗体igg或parsatuzumab后细胞增殖情况。结果发现,与对照抗体igg组相比,parsatuzumab具有显著抑制t-all 细胞增殖能力(图13)。集落形成实验同样证明parsatuzumab显著抑制 t-all细胞的克隆数量及大小,而igg抗体并无明显抑制效果(图14)。进一步通过尾静脉接种jurkat细胞构建的小鼠模型观察parsatuzumab对小鼠生存情况的影响。通过小鼠生存曲线分析,与对照组相比,我们发现 parsatuzumab组能够显著延长t-all小鼠的生存时间,igg抗体组对t-all 小鼠的生存时间没有明显改善(图15)。
[0121]
显然,上述实施例仅仅是为清楚地说明所作的举例,并非对实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式变化或变动。这里无需也无法对所有的实施方式予以穷举。而由此所引申出的显而易见的变化或变动仍处于本发明创造的保护范围之中。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1