副猪嗜血杆菌培养基及其制备方法与流程
1.本发明涉及生物制品微生物技术领域,特别涉及一种副猪嗜血杆菌培养基及其制备方法。
背景技术:
2.副猪嗜血杆菌病是由副猪嗜血杆菌引起的猪的多发性浆膜炎和关节炎,本病无明显季节性,在其它流毒感染、不适饲养环境及粗劣饲管方式时,呈高发病率(20%左右)及高致死率(高达50%);病猪和隐性感染猪是本病的主要传染源,主要经呼吸和消化两大途径传播;易感对象为4月龄以内的小猪,日龄越小的猪危害性越大,断奶期仔猪常呈急性发作、突然死亡,青年猪、大猪则多转为慢性病程,治愈的成带毒僵猪,部分经10~20d衰竭、死亡。特别在有繁殖与呼吸综合征和圆环病毒ⅱ型感染这两种免疫抑性疾病存在的猪场,本病更容易趁机暴发,且发病很快,确诊和治疗都有困难,死亡率大幅度上升,损失惨重。如果再与肺炎支原体,胸膜肺炎放线杆菌、多杀性巴氏杆菌、猪链球菌等混合感染,便会发生呼吸道病综合征。1910年,德国科学家首次报道副猪嗜血杆菌。1922年,sehermer和ehrlich首次分离到副猪嗜血杆菌。1931年,lewis和shope在研究猪流感时发现了这一细菌,并将其命名为h.influenzae suis。本病世界各地都有发生,已成为影响养猪业的典型的细菌性传染病,在养猪业发达国家均有此病的流行和发生。近年来我国不少地区都有本病发生和流行的报道,成为一些病毒病的继发病,给我国养猪业造成了严重的经济损失。
3.因副猪嗜血杆菌的生物学特性原因,导致在临床上十分难以分离和培养:以常见的几种微生物培养基为例,副猪嗜血杆菌在营养价值较高的血琼脂培养基上无法生长,在巧克力琼脂培养基上生长也不稳定,有时无法生长,有时需培养72h后才长出针尖大小的菌落,并且活菌在巧克力培养基上保存时间较短,超过72h就会死亡,使后期的纯化、生化鉴定、药敏试验、菌种保存等研究工作无法正常进行。分离、鉴定该菌在实验室诊断上造成了很大的困难,所以,研发一种能稳定培养副猪嗜血杆菌生长的固体培养基显得刻不容缓。
技术实现要素:
4.本发明的主要目的是提出一种副猪嗜血杆菌培养基及其制备方法,旨在提供一种适合培养副猪嗜血杆菌的固体培养基。
5.为实现上述目的,本发明提出一种副猪嗜血杆菌培养基,所述副猪嗜血杆菌培养基包括以下组分:基础培养基、辅酶ⅰ、马血清以及脱纤绵羊血。
6.可选地,所述副猪嗜血杆菌培养基包括以下组分:
7.基础培养基1000份、辅酶ⅰ溶液40~60份、马血清80~100份以及脱纤绵羊血50~70份;
8.其中,所述辅酶ⅰ溶液的浓度为1.8~2.2g/ml。
9.可选地,所述基础培养基包括以下浓度的组分:胰蛋白胨13~18g/l、大豆蛋白胨3~7g/l、氯化钠3~7g/l、琼脂粉13~18g/l以及葡萄糖23~28g/l。
10.可选地,所述副猪嗜血杆菌培养基包括以下组分:
11.基础培养基1000份、辅酶ⅰ溶液50份、马血清100份以及脱纤绵羊血50份;
12.其中,所述辅酶ⅰ溶液的浓度为2g/ml,所述基础培养基包含以下浓度的组分:胰蛋白胨15g/l、大豆蛋白胨5g/l、氯化钠5g/l、琼脂粉18g/l以及葡萄糖25g/l。
13.可选地,所述副猪嗜血杆菌培养基的ph为7.1~7.5。
14.此外,本发明还提出一种如上文所述的副猪嗜血杆菌培养基的制备方法,所述副猪嗜血杆菌培养基的制备方法包括以下步骤:
15.将辅酶ⅰ溶于蒸馏水,制得辅酶ⅰ溶液;
16.在无菌环境下,将所述辅酶ⅰ溶液、脱纤绵羊血和马血清加入到基础培养基中,混合均匀,得到副猪嗜血杆菌培养基。
17.可选地,在无菌环境下,将所述辅酶ⅰ溶液、脱纤绵羊血和马血清加入到基础培养基中,混合均匀,得到副猪嗜血杆菌培养基的步骤之前还包括:
18.取胰蛋白胨、大豆蛋白胨、氯化钠、琼脂粉以及葡萄糖,加蒸馏水至1000ml,搅拌加热至完全溶解,调节ph至7.1~7.5后,高压高温灭菌12~17min,得到基础培养基。
19.可选地,在无菌环境下,将所述辅酶ⅰ溶液、脱纤绵羊血和马血清加入到基础培养基中,混合均匀,得到副猪嗜血杆菌培养基的步骤包括:
20.灭菌后的基础培养基冷却至50~55℃后,在无菌环境下,将所述辅酶ⅰ溶液、脱纤绵羊血和马血清加入到基础培养基中,混合均匀,然后置于36~38℃下静置过夜,得到副猪嗜血杆菌培养基。
21.本发明的技术方案中,通过在基础培养基中添加辅酶ⅰ、脱纤绵羊血和马血清,解决了副猪嗜血杆菌在血琼脂培养基上生长必须接种金黄色葡萄球菌的问题,使菌落更纯粹,有效地减少了细菌纯化中杂菌污染的机率;而且,本发明培养基营养更充足,更适合副猪嗜血杆菌的生长特性,比巧克力培养基上生长更稳定、菌落更大、保存时间更长,培养的活菌在2~8℃可保30日。本发明提出的副猪嗜血杆菌培养基可以用于培养、鉴别和分离副猪嗜血杆菌,并有效地提高了对该菌的分离成功率。
具体实施方式
22.为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。另外,全文中出现的“和/或”的含义,包括三个并列的方案,以“a和/或b”为例,包括a方案、或b方案、或a和b同时满足的方案。此外,各个实施例之间的技术方案可以相互结合,但是必须是以本领域普通技术人员能够实现为基础,当技术方案的结合出现相互矛盾或无法实现时应当认为这种技术方案的结合不存在,也不在本发明要求的保护范围之内。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
23.因副猪嗜血杆菌的生物学特性原因,导致在临床上十分难以分离和培养:以常见的几种微生物培养基为例,副猪嗜血杆菌在营养价值较高的血琼脂培养基上无法生长,在巧克力琼脂培养基上生长也不稳定,有时无法生长,有时需培养72h后才长出针尖大小的菌
落,并且活菌在巧克力培养基上保存时间较短,超过72h就会死亡,使后期的纯化、生化鉴定、药敏试验、菌种保存等研究工作无法正常进行。分离、鉴定该菌在实验室诊断上造成了很大的困难,所以,研发一种能稳定培养副猪嗜血杆菌生长的固体培养基显得刻不容缓。
24.鉴于此,本发明提供一种副猪嗜血杆菌培养基,所述副猪嗜血杆菌培养基包括以下组分:基础培养基、辅酶ⅰ、马血清以及脱纤绵羊血。
25.其中,辅酶ⅰ能够提供一种副猪嗜血杆菌生长必需的因子,马血清以及脱纤绵羊血能够提供副猪嗜血杆菌生长需要的营养物质,本发明的技术方案中,通过在基础培养基中添加辅酶ⅰ、脱纤绵羊血和马血清,三种物质组合发挥协同作用,能够有效解决副猪嗜血杆菌在血琼脂培养基上生长必须接种金黄色葡萄球菌的问题,使菌落更纯粹,有效地减少了细菌纯化中杂菌污染的机率;而且,本发明培养基营养更充足,更适合副猪嗜血杆菌的生长特性,比巧克力培养基上生长更稳定、菌落更大、保存时间更长,培养的活菌在2~8℃可保30日。本发明提出的副猪嗜血杆菌培养基可以用于培养、鉴别和分离副猪嗜血杆菌,并有效地提高了对该菌的分离成功率。
26.进一步地,本副猪嗜血杆菌培养基各组分的添加量如下:每1000ml基础培养基,对应添加辅酶ⅰ80~120g、马血清80~100ml以及脱纤绵羊血50~70ml,当各组分按照上述比例添加时,获得的培养基具有最佳的培养效果,且显著优于巧克力培养基。具体来说,本培养基为固体培养基,鉴于此,辅酶ⅰ优选以溶液的形式加入,以提高分散性。基于此,所述副猪嗜血杆菌培养基包括以下组分:基础培养基1000份、辅酶ⅰ溶液40~60份、马血清80~100份以及脱纤绵羊血50~70份;其中,所述辅酶ⅰ溶液的浓度为1.8~2.2g/ml。
27.具体来说,本培养基用到的基础培养基包括以下浓度的组分:胰蛋白胨13~18g/l、大豆蛋白胨3~7g/l、氯化钠3~7g/l、琼脂粉13~18g/l以及葡萄糖23~28g/l。
28.基于上述实施例,进一步提出本发明副猪嗜血杆菌培养基的优选配方,本实施例中,所述副猪嗜血杆菌培养基包括以下组分:基础培养基1000份、辅酶ⅰ溶液50份、马血清100份以及脱纤绵羊血50份;其中,所述辅酶ⅰ溶液的浓度为2g/ml,所述基础培养基包含以下浓度的组分:胰蛋白胨15g/l、大豆蛋白胨5g/l、氯化钠5g/l、琼脂粉18g/l以及葡萄糖25g/l。在该培养基中,相较于本发明提出的副猪嗜血杆菌培养基的其他配方,菌落生长更稳定、菌落更大、更纯粹、保存时间更长,培养的活菌在2~8℃可保34日。
29.此外,所述副猪嗜血杆菌培养基的ph为7.1~7.5。
30.基于上述实施例,本发明还提出一种副猪嗜血杆菌培养基的制备方法,所述副猪嗜血杆菌培养基的制备方法包括以下步骤:
31.步骤s10,将辅酶ⅰ溶于蒸馏水,制得辅酶ⅰ溶液;
32.步骤s20,在无菌环境下,将所述辅酶ⅰ溶液、脱纤绵羊血和马血清加入到基础培养基中,混合均匀,得到副猪嗜血杆菌培养基。
33.可以理解的是,上述步骤中,各组分的添加量如下:基础培养基1000份、辅酶ⅰ溶液40~60份、马血清80~100份以及脱纤绵羊血50~70份;其中,所述辅酶ⅰ溶液的浓度为1.8~2.2g/ml,优选为2g/ml。
34.本发明提出的培养基制备简单,价格低廉。
35.具体实施时,在步骤s20之前还可以包括基础培养基的制备步骤,例如,本实施例中,步骤s20之前还包括:
36.步骤s30,取胰蛋白胨、大豆蛋白胨、氯化钠、琼脂粉以及葡萄糖,加蒸馏水至1000ml,搅拌加热至完全溶解,调节ph至7.1~7.5后,高压高温灭菌12~17min,得到基础培养基。
37.其中,高压高温灭菌方式可以参考本领域常规的灭菌方法,例如,在120~122℃、103.4kpa高压灭菌。
38.可以理解的是,步骤s30只需要在步骤s20之前完成即可,其具体顺序不做限定,可以在步骤s10之前、之后或者同时进行,对此,本发明不做限定。
39.进一步地,基于上述实施例,步骤s20可以按照如下步骤实施:
40.步骤s21,灭菌后的基础培养基冷却至50~55℃后,在无菌环境下,将所述辅酶ⅰ溶液、脱纤绵羊血和马血清加入到基础培养基中,混合均匀,然后置于36~38℃下静置过夜,得到副猪嗜血杆菌培养基。
41.以下结合具体实施例对本发明的技术方案作进一步详细说明,应当理解,以下实施例仅仅用以解释本发明,并不用于限定本发明。
42.实施例1
43.取胰蛋白胨15g,大豆蛋白胨5g,氯化钠5g,琼脂粉18g,葡萄糖25g,加蒸馏水至1000ml,搅拌加热煮沸至完全溶解,用氢氧化钠调节ph值为7.1,分装三角瓶,121℃高压灭菌15min。取1g辅酶ⅰ(烟酰胺腺嘌呤二核苷酸,nad)充分溶解于50ml蒸馏水中,过滤除菌处理;当基础培养基冷却至50~55℃时,无菌环境下依次加入无菌辅酶ⅰ溶液50ml,脱纤绵羊血50ml,马血清100ml,充分混匀后在无菌环境分装到无菌玻璃平皿中(分装时需不断摇匀),每个平皿15ml,分装完成后,将平皿至37℃温室静置过夜后即得副猪嗜血杆菌培养基。
44.实施例2
45.取胰蛋白胨16g,大豆蛋白胨6g,氯化钠5g,琼脂粉16g,葡萄糖24g,加蒸馏水至1000ml,搅拌加热煮沸至完全溶解,用氢氧化钠调节ph值为7.3,分装三角瓶,121℃高压灭菌15min。取1.1g辅酶ⅰ(烟酰胺腺嘌呤二核苷酸,nad)充分溶解于50ml蒸馏水中,过滤除菌处理;当基础培养基冷却至50~55℃时,无菌环境下依次加入无菌辅酶ⅰ溶液50ml,脱纤绵羊血50ml,马血清100ml,充分混匀后在无菌环境分装到无菌玻璃平皿中(分装时需不断摇匀),每个平皿15ml,分装完成后,将平皿至37℃温室静置过夜后即得副猪嗜血杆菌培养基。
46.实施例3
47.取胰蛋白胨14g,大豆蛋白胨6g,氯化钠6g,琼脂粉18g,葡萄糖23g,加蒸馏水至1000ml,搅拌加热煮沸至完全溶解,用氢氧化钠调节ph值为7.5,分装三角瓶,121℃高压灭菌15min。取0.9g辅酶ⅰ(烟酰胺腺嘌呤二核苷酸,nad)充分溶解于50ml蒸馏水中,过滤除菌处理;当基础培养基冷却至50~55℃时,无菌环境下依次加入无菌辅酶ⅰ溶液50ml,脱纤绵羊血50ml,马血清100ml,充分混匀后在无菌环境分装到无菌玻璃平皿中(分装时需不断摇匀),每个平皿15ml,分装完成后,将平皿至37℃温室静置过夜后即得副猪嗜血杆菌培养基。
48.实施例4
49.取胰蛋白胨17g,大豆蛋白胨5g,氯化钠6g,琼脂粉13g,葡萄糖25g,加蒸馏水至1000ml,搅拌加热煮沸至完全溶解,用氢氧化钠调节ph值为7.2,分装三角瓶,121℃高压灭菌15min。取1.2g辅酶ⅰ(烟酰胺腺嘌呤二核苷酸,nad)充分溶解于50ml蒸馏水中,过滤除菌处理;当基础培养基冷却至50~55℃时,无菌环境下依次加入无菌辅酶ⅰ溶液50ml,脱纤绵
羊血50ml,马血清100ml,充分混匀后在无菌环境分装到无菌玻璃平皿中(分装时需不断摇匀),每个平皿15ml,分装完成后,将平皿至37℃温室静置过夜后即得副猪嗜血杆菌培养基。
50.实施例5
51.取胰蛋白胨18g,大豆蛋白胨7g,氯化钠6g,琼脂粉17g,葡萄糖24g,加蒸馏水至1000ml,搅拌加热煮沸至完全溶解,用氢氧化钠调节ph值为7.4,分装三角瓶,121℃高压灭菌15min。取0.8g辅酶ⅰ(烟酰胺腺嘌呤二核苷酸,nad)充分溶解于50ml蒸馏水中,过滤除菌处理;当基础培养基冷却至50~55℃时,无菌环境下依次加入无菌辅酶ⅰ溶液50ml,脱纤绵羊血50ml,马血清100ml,充分混匀后在无菌环境分装到无菌玻璃平皿中(分装时需不断摇匀),每个平皿15ml,分装完成后,将平皿至37℃温室静置过夜后即得副猪嗜血杆菌培养基。
52.实施例6
53.取胰蛋白胨16g,大豆蛋白胨7g,氯化钠7g,琼脂粉18g,葡萄糖23g,加蒸馏水至1000ml,搅拌加热煮沸至完全溶解,用氢氧化钠调节ph值为7.2,分装三角瓶,121℃高压灭菌15min。取1.0g辅酶ⅰ(烟酰胺腺嘌呤二核苷酸,nad)充分溶解于50ml蒸馏水中,过滤除菌处理;当基础培养基冷却至50~55℃时,无菌环境下依次加入无菌辅酶ⅰ溶液50ml,脱纤绵羊血50ml,马血清100ml,充分混匀后在无菌环境分装到无菌玻璃平皿中(分装时需不断摇匀),每个平皿15ml,分装完成后,将平皿至37℃温室静置过夜后即得副猪嗜血杆菌培养基。
54.实施例7
55.取胰蛋白胨14g,大豆蛋白胨6g,氯化钠7g,琼脂粉18g,葡萄糖24g,加蒸馏水至1000ml,搅拌加热煮沸至完全溶解,用氢氧化钠调节ph值为7.3,分装三角瓶,121℃高压灭菌15min。取1.1g辅酶ⅰ(烟酰胺腺嘌呤二核苷酸,nad)充分溶解于50ml蒸馏水中,过滤除菌处理;当基础培养基冷却至50~55℃时,无菌环境下依次加入无菌辅酶ⅰ溶液50ml,脱纤绵羊血50ml,马血清100ml,充分混匀后在无菌环境分装到无菌玻璃平皿中(分装时需不断摇匀),每个平皿15ml,分装完成后,将平皿至37℃温室静置过夜后即得副猪嗜血杆菌培养基。
56.实施例8
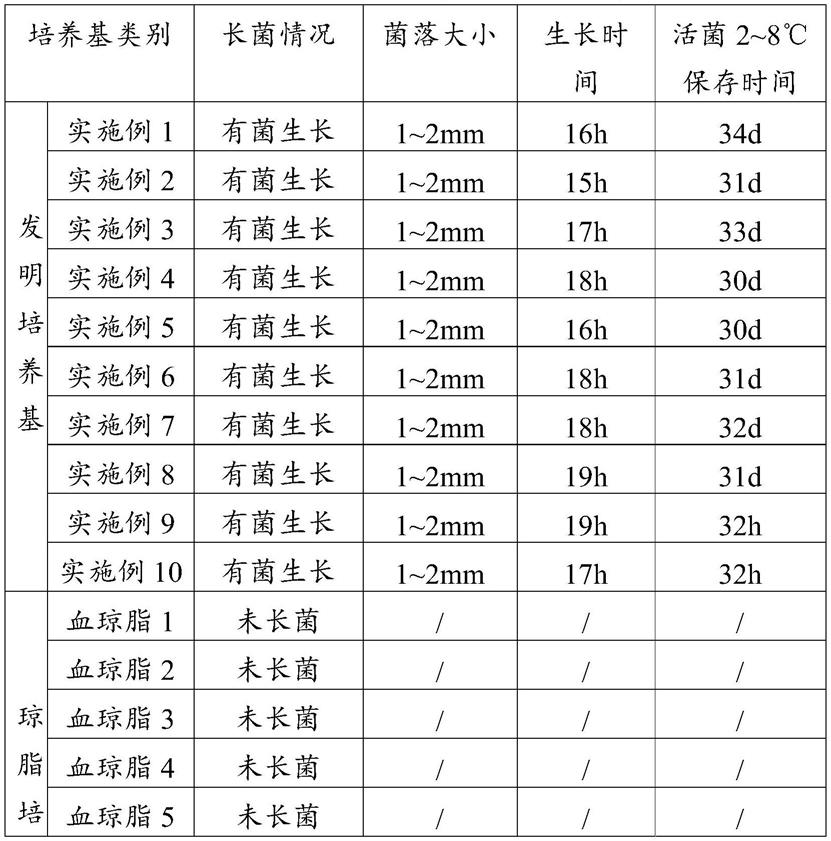
57.取胰蛋白胨15g,大豆蛋白胨7g,氯化钠5.5g,琼脂粉17g,葡萄糖25g,加蒸馏水至1000ml,搅拌加热煮沸至完全溶解,用氢氧化钠调节ph值为7.1,分装三角瓶,121℃高压灭菌15min。取1.0g辅酶ⅰ(烟酰胺腺嘌呤二核苷酸,nad)充分溶解于50ml蒸馏水中,过滤除菌处理;当基础培养基冷却至50~55℃时,无菌环境下依次加入无菌辅酶ⅰ溶液50ml,脱纤绵羊血50ml,马血清100ml,充分混匀后在无菌环境分装到无菌玻璃平皿中(分装时需不断摇匀),每个平皿15ml,分装完成后,将平皿至37℃温室静置过夜后即得副猪嗜血杆菌培养基。
58.实施例9
59.取胰蛋白胨13g,大豆蛋白胨5g,氯化钠3g,琼脂粉18g,葡萄糖25g,加蒸馏水至1000ml,搅拌加热煮沸至完全溶解,用氢氧化钠调节ph值为7.1,分装三角瓶,121℃高压灭菌17min。取1.1g辅酶ⅰ(烟酰胺腺嘌呤二核苷酸,nad)充分溶解于50ml蒸馏水中,过滤除菌处理;当基础培养基冷却至50~55℃时,无菌环境下依次加入无菌辅酶ⅰ溶液40ml,脱纤绵羊血60ml,马血清80ml,充分混匀后在无菌环境分装到无菌玻璃平皿中(分装时需不断摇匀),每个平皿15ml,分装完成后,将平皿至37℃温室静置过夜后即得副猪嗜血杆菌培养基。
60.实施例10
61.取胰蛋白胨15g,大豆蛋白胨3g,氯化钠5g,琼脂粉18g,葡萄糖25g,加蒸馏水至
1000ml,搅拌加热煮沸至完全溶解,用氢氧化钠调节ph值为7.1,分装三角瓶,121℃高压灭菌15min。取1.8g辅酶ⅰ(烟酰胺腺嘌呤二核苷酸,nad)充分溶解于100ml蒸馏水中,过滤除菌处理;当基础培养基冷却至50~55℃时,无菌环境下依次加入无菌辅酶ⅰ溶液60ml,脱纤绵羊血70ml,马血清90ml,充分混匀后在无菌环境分装到无菌玻璃平皿中(分装时需不断摇匀),每个平皿15ml,分装完成后,将平皿至37℃温室静置过夜后即得副猪嗜血杆菌培养基。
62.将副猪嗜血杆菌分别接种按实施例1~8得到的本发明培养基、血琼脂培养基和巧克力培养基,置37℃培养箱培养后生长状况比较,结果见表1。
63.表1各实施例及对比例制得的电线电缆料的性能测试
64.[0065][0066]
由表1可以看出,血琼脂培养基中并未生长副猪嗜血杆菌,说明未接种金黄色葡萄球菌的血琼脂培养基无法实现对副猪嗜血杆菌的培养;巧克力培养基中只有部分培养基上能够生长副猪嗜血杆菌,说明其培养成功率不高,此外,其能够生长出的菌落不仅小,而且生长时间极长,培养效率不高,且长出的菌落可保存时间均较短;相较而言,各实施例不仅均能长出菌落,且长出的菌落在1~2mm大小,菌落生长时间在19h以下,且可保存时间至少为30日,说明本发明提出的培养基适于副猪嗜血杆菌生长,长出的菌落更纯粹、更大,生长更稳定且速度快,且保存时间更长。
[0067]
以上所述仅为本发明的优选实施例,并非因此限制本发明的专利范围,凡是在本发明的发明构思下,利用本发明说明书内容所作的等效结构变换,或直接/间接运用在其他相关的技术领域均包括在本发明的专利保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1