植物胚性小孢子快速分离纯化装置
1.本实用新型涉及一种植物胚性小孢子快速分离纯化装置。
背景技术:
2.小孢子培养、未受精胚培养和假受精胚培养等双单倍体育种技术是现代育种的核心技术之一。
3.双单倍体技术的实质是诱导大小孢子在无融合条件下转向胚性发育,可分为活体诱导与离体培养两种。活体诱导法在玉米等少数作物获得非常成功的应用,但广泛适用于各种作物的方法则是诱导大小孢子胚发育的离体培养。得益于雄性生殖细胞数量庞大,利用雄配子(小孢子)如花药培养或小孢子细胞培养是获得单倍体的主要形式,其最佳途径为雄配子直接诱导形成胚状体而非愈伤组织。小孢子培养是效率最高的培养方式,但至今仅在以十字花科植物为主的约20个物种上获得成功应用。花药培养虽然简单易行,但却严重受到花丝、花药壁等体细胞诱导增殖能力更强的影响,往往难以获高效的双单倍体培养体系。
4.深入的研究表明小孢子胚诱导培养受基因型和培养环境双重影响。小孢子培养打断了小孢子正常配子体发育途径,而转向不可逆的孢子体发育途径,最终由单细胞发育成胚和植株。这种转向相当于从高速行驶的列车上掉出少量乘客,没有受伤而且还能实现孢子生殖。这种转变可能很短时间就会错过,因此整个培养前处理环节都显得非常重要,不仅要从大量小孢子中快速筛选出有望从配子体发育转向孢子体发育的少量“胚性小孢子”,而且要确保胚性小孢子受伤很小,能够继续分裂和发育。小孢子具有“二型性”,绝多数植物胚性小孢比普通小孢子更圆更大,体积相关可以接近一倍。少数植物胚性小孢子比普通小孢子瘦瘪。
5.通常小孢子提取分离要经历花蕾或花药化学消毒灭菌,在培养液中研磨破碎,混和液过筛分离花萼、花瓣、子房壁、花药壁等组织和纤维,再用800rpm低速离心3次,分离弃去上层破碎的体细胞和各类浆液,留下底层的小孢子。
6.再调到适合密度悬浮培养。在这一个过程中,存在以下问题:
7.1.高温灭菌后筛网壁上焊点生锈,筛网壁的缝隙残留植物组织难以清理,致使铁锈等杂质混入培养液中。
8.2.研钵粗重,转移培养液不方便,容易在操作中造成菌类污染。虽然小孢子有较为坚硬的孢粉层,但研磨过程中依然可能造成大量小孢子挤压损伤,萌发孔膨胀“出芽”的现象,失去培养价值。
9.3.小孢子在分离纯化过程中,多次经历溶液在不同容器之间转移,用吸管将细胞反复沉淀和悬浮,在无菌的超净工作台和有菌的离心机之间反复转移,大大增加了污染风险,并可能对小孢子造成机械损伤和应激反应。
10.4.分离纯化之后,大量瘦弱、畸形、破裂、没有培养价值的小孢子依然占据主导,与少量的孢满、浑圆,体积较大的胚性小孢子混在一起培养,部分密度较高的细胞器或碎屑依
然存在培养液中,没有达到理想的分离效果。
技术实现要素:
11.本实用新型要解决的技术问题是为了解决小孢子分离纯化过程中容易受污染,程序繁琐,机械损伤较大和分离纯化程度低的问题,提出一种植物小孢子一次性快速分离纯化装置。
12.为了解决上述技术问题,本实用新型提供了如下的技术方案:
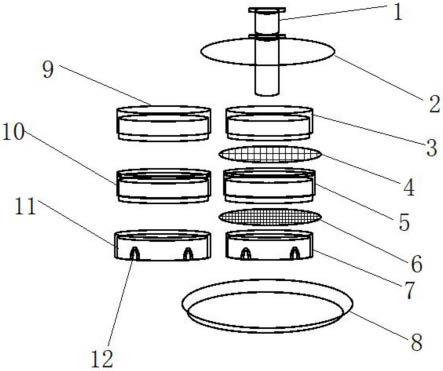
13.本实用新型公开了一种植物胚性小孢子快速分离纯化装置,研磨棒为平头磨砂空心玻璃管,研磨棒上套设有透明防尘板;研钵包括接水盘,优选为金属接水盘,在接水盘内设置有至少三层嵌套式金属内套,金属内套外设置有等高的嵌套式金属外套,最下层的金属内套和金属外套上均设置有拱形孔洞,用于排水。在上层金属内套与中层金属内套之间设置有不锈钢粗网,不锈钢粗网的折边压入上层金属外套与中层金属外套之间,不锈钢粗网孔径在250-400目;在中层金属内套与下层金属内套之间设置有不锈钢细网,不锈钢细网的折边压入中层金属外套与下层金属外套之间;不锈钢细网的孔径在400-1000目;根据不同植物种类,小孢子直径的大小,设置不同的筛网孔径;金属外套的高度≥金属上套与金属下套之和。
14.研磨后将不锈钢细网单独取出,倒置于新的无菌培养皿上,便可获得主要含胚性小孢子的培养液,直接进行培养,不再进行离心等步骤;通过显微镜观察所得胚性小孢子的数量和比例。可以再次调整滤网孔隙度,设置更为精细的过滤网,进行二次提纯分离。
15.本实用新型可以实现不锈钢粗网和不锈钢细网与金属内套可自由分离,拆洗组装方便,不易生锈,研磨过程中植物小孢子及时落入网眼中,大幅度减少了反复摩擦造成的机械损伤,减免了反复离心转移环节,大幅度简化了操作程序,减少了污染风险和细胞生理生化上的应激反应,该装置也可以用于其它球状,方形等规则细胞的分离提纯置。
16.本实用新型所达到的有益效果是:
17.1)不锈钢粗网和不锈钢细网与金属内套与金属外套之间可自由分离,拆洗组装方便,容易清洗干净,不易生锈,解决了普通研钵滤网和研磨体是一体式,滤网网壁缝隙残留植物组织难以清理,容易生锈的问题;
18.2)平头研磨棒与不锈钢网和金属套之间均有大的接触面积,研磨过程中植物小孢及时落入网眼,大幅度减少了反复摩擦造成的机械损伤。
19.3)小孢子在分离纯化过程中,一次性地完成与大于自身和小于自身的杂质颗粒分离,避免了多次经历在不同容器和有菌环境之间转移,大大减少了污染风险,机械损伤和生理生化上的应激反应。
20.4)离心分离依据物质的密度进行分离,密度接近和大于小孢子的物质也混入其中,而筛网依据细胞形状和大小进行分离。胚性小孢子比普通小孢子大,而比花粉颗粒小,通过两层滤网,可以达到理想的分离效果,减少非胚性小孢子对胚性小孢子分裂生长的影响。
21.5),不锈钢粗网的折边压入上层金属外套与中层金属外套之间,不锈钢细网的折边压入中层金属外套与下层金属外套之间,增加不锈钢粗网和不锈钢细网与金属内套的接合力,防止加不锈钢粗网和不锈钢细网在研磨过程中脱落,研磨过程中需要用手压紧不锈
钢外套,防止不锈钢粗网和不锈钢细网松动。
附图说明
22.附图用来提供对本实用新型的进一步理解,并且构成说明书的一部分,与本实用新型的实施例一起用于解释本实用新型,并不构成对本实用新型的限制。在附图中:
23.图1是本实用新型各部件的结构示意图;
24.图2是本实用新型的结构示意图。
具体实施方式
25.以下结合附图对本实用新型的优选实施例进行说明,应当理解,此处所描述的优选实施例仅用于说明和解释本实用新型,并不用于限定本实用新型。
26.实施例
27.如图1-2所示,一种植物胚性小孢子快速分离纯化装置,包括研磨棒1和研钵,研钵包括金属接水盘8,在金属接水盘8内设置有至少三层嵌套式金属内套,金属内套外设置有等高的嵌套式金属外套;
28.在上层金属内套3与中层金属内套5之间设置有不锈钢粗网4,不锈钢粗网4的折边压入上层金属外套9与中层金属外套10之间,不锈钢粗网4的孔径在250-400目;
29.在中层金属内套5与下层金属内套7之间设置有不锈钢细网6,不锈钢细网6的折边压入中层金属外套10与下层金属外套11之间;不锈钢细网6的孔径在400-1000目。
30.研磨棒1为平头磨砂空心玻璃管,研磨棒上套设有透明防尘板2,防止研磨时手上灰尘掉落进入研钵内,下层的金属内套7和下层金属外套11上均设置有拱形孔洞12,用于排水。
31.采用本实施例的分离纯化装置对洋桔梗小孢子的分离纯化过程如下:
32.在经过体内诱导小孢子胚性发育的洋桔梗植株上,取1.5-2.8cm长的花蕾,具体长度因不同品种有所差异,尽量选取大部分小孢子发育处于单核靠边期的花蕾,切去花柄,用洗衣粉水清净花蕾备用,在超净工作台上用75%酒精消毒30秒,3%次氯酸钠+吐温1滴消毒10-20分钟,无菌水漂洗三遍,移入盘子中,切开花蕾,取出花药,弃去花朵其余部分。
33.不锈钢粗网孔径在250-320目之间;不锈钢细网的孔径在600-800目之间,将花药移入不锈钢粗网上,边研磨边加入nln16液体培养基,清洗不锈钢粗网上附着的细胞组织,以使小孢子尽量流到不锈钢细网上。先将上层金属内套和外套一起拿起,中层金属内外套暴露出来,然后将中层金属内外套再和下层金属内外套分离,分离的时候,按住不锈钢细网,然后用移液管加入提取液对不锈钢细网进行冲洗,然后吸出移入培养皿。也可以拆下不锈钢细网,转移,翻转放入注有10-15ml nln16培养基的溶液中,晃动洗脱附在筛网上的小孢子。再将小孢子溶液分盘至适合密度即可。
34.2.粗糙龙胆小孢子的分离纯化
35.在经过体内诱导小孢子胚性发育的粗糙龙胆植株上,取2.5-4cm长的花蕾,具体长度因不同品种有所差异,尽量选取大部分小孢子发育处于单核靠边期的花蕾,切去花柄,用洗衣粉水洗净花蕾备用,在超净工作台上用75%酒精消毒30秒,用0.1%氯化汞+吐温1滴消毒15-25分钟,无菌水漂洗四遍,移入盘子中,切开花蕾,取出花药,弃去花朵其余部分。
36.不锈钢粗网孔径在280-400目之间;不锈钢细网的孔径在600-1000目之间,边研磨边加入nln16液体培养基,清洗不锈钢粗网上附着的细胞组织,以使小孢子尽量流到不锈钢细网上,拆开套件,取出不锈钢细网后,转移,翻转放入注有10-15ml nln16培养基的溶液中,晃动洗脱附在不锈钢细网上的小孢子。再将小孢子溶液分盘至适合密度即可。
37.最后应说明的是:以上所述仅为本实用新型的优选实施例而已,并不用于限制本实用新型,尽管参照前述实施例对本实用新型进行了详细的说明,对于本领域的技术人员来说,其依然可以对前述各实施实例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换。凡在本实用新型的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本实用新型的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1