针对GPC3的抗体及其用途的制作方法
针对gpc3的抗体及其用途
技术领域
1.本发明涉及针对gpc3的抗体,以及这种抗体的用途,特别是它们在癌症治疗中的用途。
2.发明背景
3.磷脂酰肌醇蛋白聚糖(gpc)代表高度保守的硫酸乙酰肝素蛋白聚糖家族,其通过c末端糖基-磷脂酰肌醇(gpi)锚连接到质膜上。迄今为止,哺乳动物中已鉴定出gpc家族的六名成员:gpc1到gpc6。磷脂酰肌醇蛋白聚糖具有相似的结构,包含60-70kda核心蛋白,其通过gpi和c-末端硫酸乙酰肝素侧链连接到细胞膜。所有gpc蛋白质在胚胎发育期间都高度表达,并且在成人中剧烈变化。在成人中,gpc2不再表达;gpc3仅在卵巢中表达;gpc5特异性地在大脑中表达;而gpc1、gpc4和gpc6在各种组织中广泛表达。
4.已经表明gpc与肿瘤发育高度相关。gpc1与胰腺癌生长、迁移和血管生成有关。gpc1还在乳腺癌、食管鳞状细胞癌和胶质瘤中上调,表明较差的预后。gpc2主要与神经系统肿瘤相关,例如神经母细胞瘤。一些研究表明,gpc4在胰腺癌中高度表达,gpc6在卵巢癌中上调并与预后呈正相关。在所有gpc家族成员中,gpc3是最令人感兴趣的并且已得到充分研究,已被证明是肿瘤诊断的潜在标志物以及靶向治疗的肿瘤抗原。
5.人gpc3是由580个氨基酸残基组成的70kda蛋白质。它包含位于arg358和cys359之间的弗林蛋白酶限制位点。gpc3蛋白在该位点被分为两个片段:40kda的n-末端结构域和30kda的c-末端结构域,它们随后通过一个或多个二硫键连接。c-末端残基cys495和cys508由硫酸乙酰肝素修饰,残基ser560与gpi连接。
6.先前的研究表明,gpc3与包含肝细胞癌(hcc)在内的癌症高度相关。gpc3在超过70%的肝细胞癌患者中高度表达,而未在非癌症患者如肝炎、肝硬化和脂肪肝的肝细胞中检测到其表达。目前,使用索拉非尼、乐伐替尼和瑞戈非尼的标准疗法在晚期肝细胞癌中仍不令人满意。由于gpc3与包含肝细胞癌在内的肿瘤的发生和发展的高相关性,其已成为包含肝癌在内的各种癌症的有希望的治疗靶标。
7.发明概述
8.本公开提供了结合gpc3的新型抗体或其抗原结合片段,其可以是单克隆抗体或双特异性抗体的形式,例如双特异性t细胞衔接器(bite)。本发明公开的抗体能够结合gpc3并介导效应细胞对表达gpc3的靶细胞(例如各种癌细胞)的杀伤。
9.在一个方面,本公开提供了特异性结合gpc3的抗体或其抗原结合片段,其包含轻链可变区(vl)和重链可变区(vh),其中(i)vl包含分别具有如seq id no:1-3所示的氨基酸序列的lcdr 1-3,并且vh包含分别具有如seq id no:6-8所示的氨基酸序列的hcdr 1-3;或(ii)vl包含分别具有如seq id no:23-25所示的氨基酸序列的lcdr 1-3,并且vh包含分别具有如seq id no:60-62所示的氨基酸序列的hcdr 1-3。
10.在本发明公开的抗体或其抗原结合片段的一些实施方案中,(i)vl包含与seq id no:4具有至少80%、至少85%、至少90%、至少95%、至少98%、至少99%或100%序列同一性的氨基酸序列,并且vh包含与seq id no:9具有至少80%、至少85%、至少90%、至少
95%、至少98%、至少99%、或100%序列同一性的氨基酸序列;或(ii)vl包含与seq id no:26具有至少80%、至少85%、至少90%、至少95%、至少98%、至少99%或100%序列同一性的氨基酸序列,并且vh包含与seq id no:28具有至少80%、至少85%、至少90%、至少95%、至少98%、至少99%或100%序列同一性的氨基酸序列。在一些实施方案中,(i)vl包含如seq id no:4所示的氨基酸序列,并且vh包含如seq id no:9所示的氨基酸序列;或者(ii)vl包含如seq id no:26所示的氨基酸序列,并且vh包含如seq id no:28所示的氨基酸序列。
11.在一些实施方案中,抗体可以是选自igg、iga、igm、ige和igd的同种型。在一些实施方案中,抗体可以是选自igg1、igg2、igg3和igg4的亚型。
12.在一些实施方案中,抗原结合片段可选自fab、fab’、f(ab')2、fv、scfv和ds-scfv。
13.在一些实施方案中,抗体可以是单克隆抗体。在一些实施方案中,抗体包含(i)轻链,其包含与seq id no:5具有至少80%、至少85%、至少90%、至少95%、至少98%、至少99%或100%序列同一性的氨基酸序列,以及重链,其包含与seq id no:10具有至少80%、至少85%、至少90%、至少95%、至少98%、至少99%或100%序列同一性的氨基酸序列;或者(ii)轻链,其包含与seq id no:27具有至少80%、至少85%、至少90%、至少95%、至少98%、至少99%或100%序列同一性的氨基酸序列,以及重链,其包含与seq id no:29具有至少80%、至少85%、至少90%、至少95%、至少98%、至少99%或100%序列同一性的氨基酸序列。
14.在其他实施方案中,抗体可以是双特异性或多特异性抗体。在一些实施方案中,抗体是双特异性抗体,其进一步包含与第二抗原结合的第二抗原结合区。在一些实施方案中,第二抗原可以是肿瘤相关抗原或免疫细胞抗原。在一些实施方案中,第二抗原是t细胞抗原。在一些实施方案中,t细胞抗原可以选自t细胞受体(tcr)、cd3、cd4、cd8、cd16、cd25、cd28、cd44、cd62l、cd69、icos、41-bb(cd137)和nkg2d。
15.在一些实施方案中,第二抗原是cd3,并且第二抗原结合区包含vl和vh,其中vl包含分别具有如seq id no:11-13所示的氨基酸序列的lcdr1-3,并且vh包含分别具有如seq id no:16-18所示的氨基酸序列的hcdr1-3。
16.在一些实施方案中,第二抗原结合区包含vl和vh,所述vl包含与seq id no:14具有至少80%、至少85%、至少90%、至少95%、至少98%、至少99%或100%序列同一性的氨基酸序列,并且所述vh包含与seq id no:19具有至少80%、至少85%、至少90%、至少95%、至少98%、至少99%或100%序列同一性的氨基酸序列。在一些实施方案中,第二抗原结合区包含vl和vh,所述vl包含如seq id no:14所示的氨基酸序列,并且所述vh包含如seq id no:19所示的氨基酸序列。
17.在一些实施方案中,第二抗原结合区的vl任选地通过第一接头与特异性结合gpc3的抗体的vl的c端连接,并且第二抗原结合区的vh任选地通过第二接头与特异性结合gpc3的抗体的vh的c端连接,其中第一接头和第二接头相同或不同。在一些实施方案中,第一接头包含如seq id no:21(ggggsggggsggggs)或seq id no:32(gsggggsggggs)所示的氨基酸序列,第二接头包含如seq id no:22所示的氨基酸序列(gggssggggsggggs)。
18.在一些实施方案中,双特异性抗体包含(i)轻链,其包含与seq id no:15具有至少80%、至少85%、至少90%、至少95%、至少98%、至少99%或100%序列同一性的氨基酸序
列,以及重链,其包含与seq id no:20具有至少80%、至少85%、至少90%、至少95%、至少98%、至少99%或100%序列同一性的氨基酸序列;或者(ii)轻链,其包含与seq id no:30具有至少80%、至少85%、至少90%、至少95%、至少98%、至少99%或100%序列同一性的氨基酸序列,以及重链,其包含与seq id no:31具有至少80%、至少85%、至少90%、至少95%、至少98%、至少99%或100%序列同一性的氨基酸序列。
19.在一些实施方案中,双特异性抗体可以是双特异性t细胞衔接器(bite)。
20.在另一方面,本公开提供了双特异性抗体或其抗原结合片段,其包含含有vl和vh的结合gpc3的第一抗原结合区,和含有vl和vh的结合cd3的第二抗原结合区,其中(i)第一抗原结合区的vl包含分别具有如seq id no:1-3所示的氨基酸序列的lcdr 1-3,并且第一抗原结合区的vh包含分别具有如seq id no:6-8所示的氨基酸序列的hcdr 1-3;或者(ii)第一抗原结合区的vl包含分别具有如seq id no:23-25所示的氨基酸序列的lcdr 1-3,并且第一抗原结合区的vh包含分别具有如seq id no:60-62所示的氨基酸序列的hcdr 1-3;并且第二抗原结合区的vl包含分别具有如seq id no:11-13所示的氨基酸序列的lcdr 1-3,并且第二抗原结合区的vh包含分别具有如seq id no:16-18所示的氨基酸序列的hcdr 1-3。
21.在本发明公开的双特异性抗体或其抗原结合片段的一些实施方案中,(i)第一抗原结合区的vl包含与seq id no:4具有至少80%、至少85%、至少90%、至少95%、至少98%、至少99%或100%序列同一性的氨基酸序列,并且第一抗原结合区的vh包含与seq id no:9具有至少80%、至少85%、至少90%、至少95%、至少98%、至少99%或100%序列同一性的氨基酸序列;或者(ii)第一抗原结合区的vl包含与seq id no:26具有至少80%、至少85%、至少90%、至少95%、至少98%、至少99%或100%序列同一性的氨基酸序列,并且第一抗原结合区的vh包含与seq id no:28具有至少80%、至少85%、至少90%、至少95%、至少98%、至少99%或100%序列同一性的氨基酸序列;并且第二抗原结合区的vl包含与seq id no:14具有至少80%、至少85%、至少90%、至少95%、至少98%、至少99%或100%序列同一性的氨基酸序列,并且第二抗原结合区的vh包含与seq id no:19具有至少80%、至少85%、至少90%、至少95%、至少98%、至少99%或100%序列同一性的氨基酸序列。
22.在一些实施方案中,(i)第一抗原结合区的vl包含如seq id no:4所示的氨基酸序列,且第一抗原结合区的vh包含如seq id no:9所示的氨基酸序列;或者(ii)第一抗原结合区的vl包含如seq id no:26所示的氨基酸序列,且第一抗原结合区的vh包含seq id no:28所示的氨基酸序列;并且第二抗原结合区域的vl包含如seq id no:14所示的氨基酸序列,且第二抗原结合区的vh包含如seq id no:19所示的氨基酸序列。
23.在一些实施方案中,第二抗原结合区的vl任选地通过第一接头与第一抗原结合区vl的c端连接,并且第二抗原结合区的vh任选地通过第二接头与第一抗原结合区vh的c端连接,其中第一接头和第二接头相同或不同。在一些实施方案中,第一接头包含如seq id no:21(ggggsggggsggggs)或seq id no:32(gsggggsggggs)所示的氨基酸序列,第二接头包含如seq id no:22(gggssggggsggggs)所示的氨基酸序列。
24.在一些实施方案中,双特异性抗体包含(i)轻链,其包含与seq id no:15具有至少80%、至少85%、至少90%、至少95%、至少98%、至少99%或100%序列同一性的氨基酸序列,以及重链,其包含与seq id no:20具有至少80%、至少85%、至少90%、至少95%、至少
98%、至少99%或100%序列同一性的氨基酸序列;或者(ii)轻链,其包含与seq id no:30具有至少80%、至少85%、至少90%、至少95%、至少98%、至少99%或100%序列同一性的氨基酸序列,以及重链,其包含与seq id no:31具有至少80%、至少85%、至少90%、至少95%、至少98%、至少99%或100%序列同一性的氨基酸序列。
25.在一些实施方案中,双特异性抗体可以是双特异性t细胞衔接器(bite)。
26.在又一方面,本公开提供了核酸,其包含编码本发明公开的抗体或其抗原结合片段或本发明公开的双特异性抗体或其抗原结合片段的核苷酸序列。
27.在另一方面,本公开提供了包含本发明公开的核酸的载体。
28.在另一方面,本公开提供了包含本发明公开的核酸或本发明公开的载体的宿主细胞。
29.在又一方面,本公开提供了药物组合物,其包含(i)本发明公开的抗体或其抗原结合片段,或本发明公开的双特异性抗体或其抗原结合片段;和(ii)药学上可接受的载体或赋形剂。
30.在本发明公开的药物组合物的一些实施方案中,药物组合物进一步包含第二治疗剂。在一些实施方案中,第二治疗剂可以选自抗体、化学治疗剂和小分子药物。在一些实施方案中,第二治疗剂可以选自布鲁顿酪氨酸激酶(btk)抑制剂、pi3k抑制剂、hdac抑制剂、pd-1/pd-l1抑制剂、lag3抑制剂和糖皮质激素。
31.在又一方面,本公开提供了缀合物,其包含本发明公开的抗体或其抗原结合片段或者本发明公开的双特异性抗体或其抗原结合片段,以及与其缀合的化学部分。
32.在本发明公开的缀合物的一些实施方案中,化学部分选自治疗剂、可检测部分和免疫刺激分子。
33.在另一方面,本公开提供了治疗受试者中的癌症的方法,包括向受试者施用有效量的本发明公开的抗体或其抗原结合片段、本发明公开的双特异性抗体或其抗原结合片段、本发明公开的药物组合物或本发明公开的缀合物。
34.在本发明公开的方法的一些实施方案中,癌症是gpc3阳性癌症。在一些实施方案中,癌症选自肝癌、结肠癌、胰腺癌、肺癌、膀胱癌、黑素瘤和骨髓瘤,优选肝癌或骨髓瘤。
35.在一些实施方案中,该方法还包括向受试者施用第二治疗剂。在一些实施方案中,第二治疗剂选自抗体、化学治疗剂和小分子药物。在一些实施方案中,第二治疗剂可以选自布鲁顿酪氨酸激酶(btk)抑制剂、pi3k抑制剂、hdac抑制剂、pd-1/pd-l1抑制剂、lag3抑制剂和糖皮质激素。
36.在另一方面,本公开提供了检测受试者中的gpc3阳性癌症的方法,包括(i)使从受试者获得的样品与本发明公开的抗体或其抗原结合片段、本发明公开的双特异性抗体或其抗原结合片段、或本发明公开的缀合物接触;和(ii)检测抗体或其抗原结合片段与样品中的gpc3的结合。
37.在一些实施方案中,抗体或其抗原结合片段与可检测部分连接。在一些实施方案中,癌症选自肝癌、结肠癌、胰腺癌、肺癌、膀胱癌、黑素瘤和骨髓瘤,优选肝癌或骨髓瘤。
38.在又一方面,本公开提供用于检测样品中gpc3抗原的存在的试剂盒,其包含本发明公开的抗体或其抗原结合片段、本发明公开的双特异性抗体或其抗原结合片段、或本发明公开的缀合物。优选地,抗体或其抗原结合片段与可检测部分连接。
39.在另一方面,本公开提供了本发明公开的抗体或其抗原结合片段、本发明公开的双特异性抗体或其抗原结合片段、本发明公开的药物组合物或本发明公开的缀合物在制备用于治疗受试者中的癌症的药物中的用途。在一些实施方案中,癌症是gpc3阳性癌症。在一些实施方案中,癌症选自肝癌、结肠癌、胰腺癌、肺癌、膀胱癌、黑素瘤和骨髓瘤,优选肝癌或骨髓瘤。
40.在另一方面,本公开提供了本发明公开的抗体或其抗原结合片段、本发明公开的双特异性抗体或其抗原结合片段、本发明公开的药物组合物或本发明公开的缀合物,其用于治疗受试者中的癌症。在一些实施方案中,癌症是gpc3阳性癌症。在一些实施方案中,癌症选自肝癌、结肠癌、胰腺癌、肺癌、膀胱癌、黑素瘤和骨髓瘤,优选肝癌或骨髓瘤。
41.在又一方面,本公开提供了本发明公开的抗体或其抗原结合片段、本发明公开的双特异性抗体或其抗原结合片段、本发明公开的药物组合物或本发明公开的缀合物在制备用于检测受试者中gpc3阳性癌症的试剂盒中的用途。在一些实施方案中,癌症选自肝癌、结肠癌、胰腺癌、肺癌、膀胱癌、黑素瘤和骨髓瘤,优选肝癌或骨髓瘤。
42.在另一方面,本公开提供了本发明公开的抗体或其抗原结合片段、本发明公开的双特异性抗体或其抗原结合片段、本发明公开的药物组合物或本发明公开的缀合物,其用于检测受试者中的gpc3阳性癌症。在一些实施方案中,癌症选自肝癌、结肠癌、胰腺癌、肺癌、膀胱癌、黑素瘤和骨髓瘤,优选肝癌或骨髓瘤。
附图说明
43.可通过参考描述了利用本发明原理的示例性实施方案的以下详细描述和附图来获得对本发明的特征和优点的理解,在附图中:
44.图1a显示了通过elisa测量的1a1 fab对重组人gpc3的结合。bsa用作阴性对照。
45.图1b显示了通过elisa测量的6a4 fab对重组人gpc3的结合。bsa用作阴性对照。
46.图2a显示了通过流式细胞术测量的1a1 fab对肿瘤细胞系huh7、hepg2和sk-hep-1的结合。商业抗gpc3抗体(gpc3-pe)用作阳性对照。颜色代码,紫色:阴性对照;绿色:1a1 fab或gpc3-pe抗体。
47.图2b显示了通过流式细胞术测量的6a4 fab对肿瘤细胞系huh7和a549的结合。商业抗gpc3抗体(gpc3-pe)用作阳性对照。颜色代码,紫色:阴性对照;绿色:6a4 fab。
48.图3a显示了通过elisa测量的1a1 mab对重组人、食蟹猴和小鼠gpc3的结合。bsa用作阴性对照。
49.图3b显示了通过elisa测量的6a4 mab对重组人gpc3的结合。
50.图4a显示了通过流式细胞术测量的1a1 mab对肿瘤细胞系hepg2、huh7、rpmi8226、h226和sk-hep-1的结合。颜色代码,紫色:阴性对照;绿色:1a1 mab。
51.图4b显示了通过流式细胞术测量的6a4 mab对肿瘤细胞系hepg2的结合。igg同种型抗体用作阴性对照。
52.图5a显示了通过elisa测量的基于1a1的gpc3
×
cd3 hbite对重组人、食蟹猴和小鼠gpc3的结合。bsa用作阴性对照。
53.图5b显示了通过elisa测量的基于1a1的gpc3
×
cd3 hbite对重组人cd3的结合。
54.图5c显示了通过elisa测量的基于6a4的gpc3
×
cd3 hbite对重组人gpc3的结合。
cloning:a laboratory manual”(第2版),卷1-3,冷泉港实验室出版社(1989);f.ausubel等人编辑,“current protocols in molecular biology”,green publishing and wiley interscience,纽约(1987年);roitt等人,“immunology”(第6版),mosby/elsevier,爱丁堡(2001年);和janeway等人,“immunobiology”(第6版),garland science publishing/churchill livingstone,纽约(2005年),以及上面引用的通常
背景技术:
。
74.如本发明所用,单数形式“一个”、“一种”和“该”包含复数对象,除非上下文另有明确说明。因此,例如,提及“一种抗体”包含多种抗体,并且在一些实施方案中提及“一种抗体”包含多种抗体,等等。
75.除非另有说明或定义,否则术语“包含”及其变体诸如“包括”和“含有”应理解为意味着包括所述元素或步骤或者元素或步骤的组,但不排除任何其他元素或步骤或着元素或步骤的组。
76.如本发明所用,术语“抗体”是指免疫球蛋白分子,其具有特异性结合特定抗原的能力。抗体通常在每条重链和轻链中包含可变区和恒定区。抗体重链和轻链的可变区包含与抗原相互作用的结合域。抗体的恒定区可介导免疫球蛋白与宿主组织或因子的结合,所述宿主组织或因子包括免疫系统的各种细胞(如效应细胞)和补体系统的组分,如补体激活经典途径中的第一组分c1q。因此,大多数抗体具有重链可变区(vh)和轻链可变区(vl),它们共同形成与抗原结合的抗体部分。
[0077]“轻链可变区”(vl)或“重链可变区”(vh)由间插三个“互补决定区”或“cdr”的“框架”区组成。框架区用于调整cdr,以用于特异性结合抗原表位。cdr包含抗体中主要负责抗原结合的氨基酸残基。从氨基末端到羧基末端,vl和vh结构域都包含以下框架(fr)区和cdr区:fr1,cdr1,fr2,cdr2,fr3,cdr3和fr4。vl结构域的cdr 1、2和3在本文中也分别称为lcdr1、lcdr2和lcdr3;vh结构域的cdr 1、2和3在本文中也分别称为hcdr1、hcdr2和hcdr3。
[0078]
每个vl和vh结构域的氨基酸分配按照cdr的任何常规定义。常规定义包括kabat定义(kabat,sequences of proteins of immunological interest(national institutes of health,bethesda,md,1987和1991));chothia定义(chothia&lesk,j.mol.biol.196:901-917,1987;chothia等人,nature 342:878-883,1989);chothia kabat cdr的复合,其中cdr-h1是chothia和kabat cdr的复合;oxford molecular的抗体建模软件所使用的abm定义;以及martin等人的contact定义(万维网bioinfo.org.uk/abs)。kabat提供了广泛使用的编号惯例(kabat编号系统),其中不同重链之间或不同轻链之间的对应残基被赋予相同的编号。本公开可以使用根据这些编号系统中的任一种定义的cdr,但是优选的实施方案使用kabat定义的cdr。
[0079]
本发明所用的术语“抗体”应以其最广泛的意义来理解,并且包括单克隆抗体(包含全长单克隆抗体)、多克隆抗体、抗体片段和包含至少两个抗原结合区的多特异性抗体(例如,双特异性抗体)。抗体可含有另外的修饰,例如非天然存在的氨基酸、fc区中的突变、以及糖基化位点的突变。抗体还包括翻译后修饰的抗体、含有抗体的抗原决定簇的融合蛋白以及含有对抗原识别位点的任何其他修饰的免疫球蛋白分子,只要这些抗体表现出预期的生物活性即可。
[0080]
如本发明所用,术语抗体的“抗原结合片段”是指保持特异性结合抗原(例如gpc3蛋白)能力的一种或多种抗体片段。已经表明,抗体的抗原结合功能可以由全长抗体的片段
id no:y的同一性百分比,并被阐述为该氨基酸序列中x%的残基与seq id no:y中公开的序列残基相同。
[0087]
通常使用计算机程序进行此类计算。比较和对齐序列对的示例性程序包括align(myers和miller,1988)、fasta(pearson和lipman,1988;pearson,1990)以及gapped blast(altschul等人,1997)、blastp、blastn或者gcg(devereux等人,1984)。
[0088]
此外,在确定两条氨基酸序列之间的序列同一性的程度时,技术人员可以考虑所谓的“保守性”氨基酸取代,其通常可以描述为氨基酸残基被替换为具有类似化学结构的另一种氨基酸残基的氨基酸取代,其对多肽的功能、活性或其他生物学性质几乎没有影响或基本上没有影响。这种保守性氨基酸取代在本领域中是众所周知的,例如wo 04/037999,gb-a-2 357 768,wo 98/49185,wo 00/46383和wo 01/09300;并且(优选地)这些取代的类型和/或组合可以根据来自wo 04/037999以及wo 98/49185以及其中引用的另外的参考文献的相关教导来选择。
[0089]
这种保守性取代优选地是以下组(a)到(e)中的一个氨基酸被同组中的另一个氨基酸残基取代的取代:(a)小的脂肪族、非极性或弱极性残基:ala、ser、thr、pro和gly;(b)极性、带负电的残基及其(不带电的)酰胺:asp、asn、glu和gln;(c)极性、带正电的残基:his、arg和lys;(d)大的脂肪族、非极性残基:met、leu、he、val和cys;以及(e)芳香族残基:phe、tyr和trp。
[0090]
特别优选的保守性取代如下:ala到gly或到ser;arg到lys;asn到gln或到his;asp到glu;cys到ser;gln到asn;glu到asp;gly到ala或到pro;his到asn或到gln;ile到leu或到val;leu到ile或到val;lys到arg、到gln或到glu;met到leu、到tyr或到ile;phe到met、到leu或到tyr;ser到thr;thr到ser;trp到tyr;tyr到trp;和/或phe到val、到ile或到leu。
[0091]
本发明描述的应用于多肽的任何氨基酸取代也可以基于由schulz等人,principles of protein structure,springer-verlag,1978开发的不同物种的同源蛋白质之间的氨基酸变异频率的分析,基于chou和fasman,biochemistry 13:211,1974和adv.enzymol.,47:45-149,1978开发的结构形成潜能分析,以及基于eisenberg等人,proc.nat.acad sci.usa 81:140-144,1984;kyte&doolittle,j mol.biol.157:105-132,1981,以及goldman等人,ann.rev.biophys.chem.15:321-353,1986开发的蛋白质疏水性模式分析,这些文献通过全文引用并入本文。
[0092]
如本发明所用,术语"单克隆抗体"是指从基本同质的抗体群体中获得的抗体。也就是说,除了可能天然发生的少量突变之外,构成群体的每个抗体是相同的。单克隆抗体具有高度特异性,并且针对单一抗原。本文中的术语“单克隆抗体”并不限于通过杂交瘤技术产生的抗体,也不应被解释为要求通过任何特定的方法产生的抗体。
[0093]
术语“双特异性抗体”在本发明的语境中应理解为具有由不同的抗体序列限定的两个不同抗原结合区的抗体。这可以理解为与不同的靶标结合,但也包括与一个靶标的不同表位结合。
[0094]
如本发明所用,术语“肿瘤相关抗原”是指与正常细胞相比,在癌细胞中差异表达的抗原,因此可用于靶向癌细胞。
[0095]
如本发明所用,术语“cd3”是指人cd3蛋白复合物,其具有五个肽链,γ链、δ链、ε链、ζ链和η链,并且与t细胞受体α和β链结合以形成tcr-cd3复合物。该术语包括任何cd3变
体、亚型和物种同源物,它们可以由包含t细胞在内的细胞天然表达,或者由转染了编码上述链的基因或cdna的细胞表达。
[0096]
如本发明所用,术语“双特异性t细胞衔接器”或“bite”是指具有两个抗原结合域的单多肽链分子,其中一个抗原结合域与t细胞抗原结合,第二个抗原结合域与靶标表面存在的抗原结合(参见pct公开文本wo 05/061547;baeuerle等人,2008,drugs of the future 33:137-147;bargou等人,2008,science 321:974-977,其通过引用整体并入本文)。因此,本公开的bite具有与gpc3结合的抗原结合区和靶向t细胞抗原的第二抗原结合区。
[0097]
如本文所用的术语“载体”是指能够运送其所连接的另一种核酸的核酸分子。
[0098]
如本发明所用,术语“宿主细胞”是指已引入表达载体的细胞。
[0099]
术语“药学上可接受”是指载体或佐剂与组合物的其他成分相容并且对其接受者没有大量毒害,和/或这些载体或佐剂被批准或可用于包含在对人类肠胃外给药的药物组合物中。
[0100]
如本发明所用,术语“治疗”、“处理”等,指施用药剂或进行程序,以便获得效果。这些效果可以就完全或部分地预防疾病或其症状而言是预防性的,和/或可以就影响疾病和/或疾病症状的部分或完全治愈而言是治疗性的。如本发明所用,“治疗”可包括治疗哺乳动物,特别是人类的疾病或病症(例如癌症),并且包括:(a)在对疾病易感而尚未被诊断为患病的受试者中预防该疾病或疾病症状的发生(例如,包括可能与原代疾病相关或由其引起的疾病);(b)抑制疾病,即阻止其发展;(c)缓解疾病,即导致疾病的消退。治疗可指在治疗或改善或预防癌症方面取得成功的任何指代,包括任何客观或主观参数,例如消除;缓解;减少症状或使疾病病症对患者而言更容易忍受;减慢恶化或衰退速度;或使恶化的终点衰弱减少。症状的治疗或改善基于一个或多个客观或主观参数;包括医生检查的结果。因此,术语“治疗”包括施用本发明公开的抗体或组合物或缀合物,以预防或延迟、缓解或阻止或抑制与疾病(例如癌症)相关的症状或病症的发展。术语“治疗效果”是指受试者中疾病、疾病症状或疾病副作用的减少、消除或预防。
[0101]
本发明所用的术语“有效量”是指当施用至至受试者以治疗疾病时足以实现这种疾病的治疗的量。
[0102]
如本文所用,术语“受试者”是指期望诊断、医治或治疗的任何哺乳动物受试者。用于治疗目的的“哺乳动物”是指任何归类为哺乳动物的动物,包括人、家畜、以及实验室动物、动物园动物、运动动物或宠物动物,如狗、马、猫、牛、绵羊、山羊、猪、小鼠、大鼠、兔、豚鼠、猴子等。
[0103]
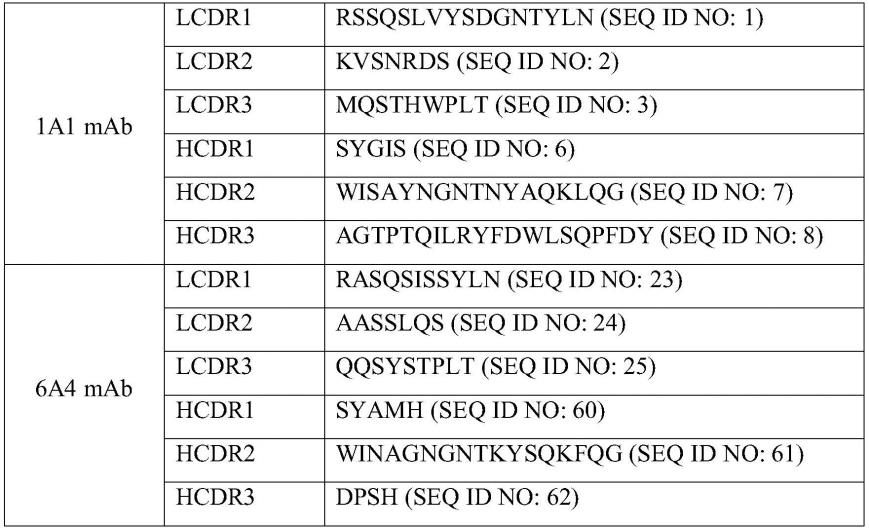
在一个方面,本公开提供了特异性结合gpc3的抗体或其抗原结合片段,其包含轻链可变区(vl)和重链可变区(vh),其中(i)vl包含分别具有如seq id no:1-3所示的氨基酸序列的lcdr 1-3,并且vh包含分别具有如seq id no:6-8所示的氨基酸序列的hcdr 1-3;或者(ii)vl包含分别具有如seq id no:23-25所示的氨基酸序列的lcdr 1-3,并且vh包含分别具有如seq id no:60-62所示的氨基酸序列的hcdr 1-3。
[0104]
在一些实施方案中,cdr序列根据kabat编号系统定义。
[0105]
当根据kabat编号系统定义cdr序列时,本发明公开的抗体的vl包含分别具有如seq id no:1(rssqslvysdgntyln)、seq id no:2(kvsnrd)和seq id no:3(mqsthwplt)所示
的氨基酸序列的lcdr1、lcdr2和lcdr3,本发明公开的抗体的vh包含分别具有如seq id no:6(sygis)、seq id no:7(wisayngntnyaqklqg)和seq id no:8(agtptqilryfdwlsqpfdy)所示的氨基酸序列的hcdr1、hcdr2和hcdr3;或本文公开的抗体的vl包含分别具有如seq id no:23(rasqsissyln)、seq id no:24(aasslqs)和seq id no:25(qqsystplt)所示的氨基酸序列的lcdr1、lcdr2和lcdr3,本发明公开的抗体的vh包含分别具有如seq id no:60(syamh)、seq id no:61(winagngntkysqkfqg)和seq id no:62(dpsh)所示的氨基酸序列的hcdr1、hcdr2和hcdr3。
[0106]
在本发明公开的抗体或其抗原结合片段的一些实施方案中,(i)vl包含与seq id no:4具有至少80%、至少85%、至少90%、至少95%、至少98%、至少99%或100%序列同一性的氨基酸序列,并且vh包含与seq id no:9具有至少80%、至少85%、至少90%、至少95%、至少98%、至少99%或100%序列同一性的氨基酸序列;或者(ii)vl包含与seq id no:26具有至少80%、至少85%、至少90%、至少95%、至少98%、至少99%或100%序列同一性的氨基酸序列,并且vh包含与seq id no:28具有至少80%、至少85%、至少90%、至少95%、至少98%、至少99%或100%序列同一性的氨基酸序列。
[0107]
在一些实施方案中,vl包含通过插入、缺失和/或取代一个或多个氨基酸而形成的如seq id no:4或seq id no:26所示的氨基酸序列的功能变体,前提是该功能变体保留与gpc3结合的能力。在一些实施方案中,vh包含通过插入、缺失和/或取代一个或多个氨基酸而形成的如seq id no:9或seq id no:28所示的氨基酸序列的功能变体,前提是该功能变体保留与gpc3结合的能力。
[0108]
功能变体包含或组成为与亲本多肽具有至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%、至少99.1%、至少99.2%、至少99.3%、至少99.4%、至少99.5%、至少99.6%、至少99.7%、至少99.8%或至少99.9%序列同一性的氨基酸序列。例如,seq id no:4或seq id no:26的功能变体包含或组成为与seq id no:4或seq id no:26具有至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%、至少99.1%、至少99.2%、至少99.3%、至少99.4%、至少99.5%、至少99.6%、至少99.7%、至少99.8%或至少99.9%序列同一性的氨基酸序列。例如,seq id no:9或seq id no:28的功能变体包含或组成为与seq id no:9或seq id no:28具有至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%、至少99.1%、至少99.2%、至少99.3%、至少99.4%、至少99.5%、至少99.6%、至少99.7%、至少99.8%或至少99.9%序列同一性的氨基酸序列。
[0109]
在一些实施方案中,seq id no:4或seq id no:26的功能变体包含或组成为与seq id no:4或seq id no:26具有至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%、至少99.1%、至少99.2%、至少99.3%、至少99.4%、至少99.5%、至少99.6%、至少99.7%、至少99.8%或至少99.9%序列同一性并且通过插入、缺失和/或取代seq id no:4或seq id no:26中的一个或多个氨基酸而形成的氨基酸序列。在一些实施方案中,seq id no:9或seq id no:28的功能变体包含或组成为与seq id no:9或seq id no:28具有至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%、至少99.1%、至少99.2%、至少99.3%、至少99.4%、至少99.5%、至少99.6%、至少99.7%、至少99.8%或至少99.9%序列同一性并且通过插入、缺失和/或取代
seq id no:9或seq id no:28中的一个或多个氨基酸而形成的氨基酸序列。
[0110]
在功能变体的上下文中,插入、缺失和/或取代的氨基酸的数量优选不超过亲本氨基酸序列中氨基酸总数的40%,更优选不超过35%,更优选是1%到33%,更优选是5%到30%,更优选是10%到25%,更优选是15%到20%。例如,插入、缺失和/或取代的氨基酸的数量可以是1到20,优选是1到10,更优选是1到7,还更优选是1到5,最优选是1到2。在优选的实施方案中,插入、缺失和/或取代的氨基酸的数量为1、2、3、4、5、6或7。
[0111]
在一些实施方案中,插入、缺失和/或取代可以在框架(fr)区,例如fr1、fr2、fr3和/或fr4处进行。
[0112]
在一些实施方案中,一个或多个氨基酸的取代可以是一个或多个氨基酸的保守性取代。这种保守性取代优选地是以下组(a)到(e)中的一个氨基酸被同组中的另一个氨基酸残基取代的取代:(a)小的脂肪族、非极性或弱极性残基:ala、ser、thr、pro和gly;(b)极性、带负电的残基及其(不带电的)酰胺:asp、asn、glu和gln;(c)极性、带正电的残基:his、arg和lys;(d)大的脂肪族、非极性残基:met、leu、he、val和cys;以及(e)芳香族残基:phe、tyr和trp。
[0113]
特别优选的保守性取代如下:ala到gly或到ser;arg到lys;asn到gln或到his;asp到glu;cys到ser;gln到asn;glu到asp;gly到ala或到pro;his到asn或到gln;ile到leu或到val;leu到ile或到val;lys到arg、到gln或到glu;met到leu、到tyr或到ile;phe到met、到leu或到tyr;ser到thr;thr到ser;trp到tyr;tyr到trp;和/或phe到val、到ile或到leu。
[0114]
在优选的实施方案中,vl包含如seq id no:4所示的氨基酸序列,vh包含如seq id no:9所示的氨基酸序列;或者vl包含如seq id no:26所示的氨基酸序列,vh包含如seq id no:28所示的氨基酸序列。
[0115]
根据抗体重链恒定区的氨基酸序列,免疫球蛋白分子可以分为五类(同种型):iga、igd、ige、igg和igm,并可进一步分为不同的亚型,如igg1、igg2、igg3、igg4、iga1、iga2等。根据轻链的氨基酸序列,抗体的轻链可以分为lambda(λ)链和kappa(κ)链。本发明公开的抗体可以是上述任何类别或亚型。
[0116]
在一些实施方案中,抗体可以是选自igg、iga、igm、ige和igd的同种型。在一些实施方案中,抗体可以是选自igg1、igg2、igg3和igg4的亚型。在优选的实施方案中,抗体是igg1抗体。
[0117]
本发明公开的抗体可以是完整抗体或其抗原结合片段。抗原结合片段可以是保留与gpc3特异性结合能力的抗体的任何片段。抗原结合片段的实例包含但不限于:fab片段;f(ab')2片段;fab'片段;fd片段;fd'片段;fv片段;scfv片段;dab片段;单独的互补决定区(cdr);纳米抗体;包含一对串联的fd片段(vh-ch1-vh-ch1)的线性抗体,以及保留抗原结合活性的上述任何片段的修饰形式。
[0118]
在一些实施方案中,抗原结合片段可选自fab、fab’、f(ab')2、fv、scfv和ds-scfv。在优选的实施方案中,抗原结合片段是fab或scfv。
[0119]
在一些实施方案中,抗体可以是单克隆抗体。在一些实施方案中,抗体包含(i)轻链,其包含与seq id no:5具有至少80%、至少85%、至少90%、至少95%、至少98%、至少99%或100%序列同一性的氨基酸序列,和重链,其包含与seq id no:10具有至少80%、至少85%、至少90%、至少95%、至少98%、至少99%或100%序列同一性的氨基酸序列;或者
(ii)轻链,其包含与seq id no:27具有至少80%、至少85%、至少90%、至少95%、至少98%、至少99%或100%序列同一性的氨基酸序列,和重链,其包含与seq id no:29具有至少80%、至少85%、至少90%、至少95%、至少98%、至少99%或100%序列同一性的氨基酸序列。
[0120]
在一些实施方案中,轻链包含通过插入、缺失和/或取代一个或多个氨基酸而形成的如seq id no:5或seq id no:27所示的氨基酸序列的功能变体,前提是该功能变体保留与gpc3结合的能力。在一些实施方案中,重链包含通过插入、缺失和/或取代一个或多个氨基酸而形成的如seq id no:10或seq id no:29所示的氨基酸序列的功能变体,前提是该功能变体保留与gpc3结合的能力。
[0121]
例如,seq id no:5或seq id no:27的功能变体包含或组成为与seq id no:5或seq id no:27具有至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%、至少99.1%、至少99.2%、至少99.3%、至少99.4%、至少99.5%、至少99.6%、至少99.7%、至少99.8%或至少99.9%序列同一性的氨基酸序列。例如,seq id no:10或seq id no:29的功能变体包含或组成为与seq id no:10或seq id no:29具有至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%、至少99.1%、至少99.2%、至少99.3%、至少99.4%、至少99.5%、至少99.6%、至少99.7%、至少99.8%或至少99.9%序列同一性的氨基酸序列。
[0122]
在一些实施方案中,插入、缺失和/或取代的氨基酸的数量优选不超过亲本氨基酸序列中氨基酸总数的40%,更优选不超过35%,更优选是1%到33%,更优选是5%到30%,更优选是10%到25%,更优选是15%到20%。例如,插入、缺失和/或取代的氨基酸的数量可以是1到50,优选是1到20,更优选是1到10,还更优选是1到5。在优选的实施方案中,插入、缺失和/或取代的氨基酸的数量为1、2、3、4、5、6或7。
[0123]
在一些实施方案中,插入、缺失和/或取代可以在框架(fr)区,例如fr1、fr2、fr3和/或fr4;和/或恒定区,例如cl、ch1、ch2和/或ch3处进行。
[0124]
在一些实施方案中,一个或多个氨基酸的取代可以是一个或多个氨基酸的保守性取代。保守性取代的实例如上所述。
[0125]
在优选的实施方案中,轻链包含如seq id no:5所示的氨基酸序列,重链包含如seq id no:10所示的氨基酸序列;或轻链包含如seq id no:27所示的氨基酸序列,重链包含如seq id no:29所示的氨基酸序列。
[0126]
在其他实施方案中,抗体可以是双特异性或多特异性抗体。在一些实施方案中,抗体是双特异性抗体,其进一步包含与第二抗原结合的第二抗原结合区。在一些实施方案中,第二抗原可以是肿瘤相关抗原或免疫细胞抗原。
[0127]
本领域已经鉴定了许多与特定癌症相关的肿瘤相关抗原。在一些实施方案中,肿瘤相关抗原是可潜在地激发明显的肿瘤特异性免疫应答的抗原。这些抗原中的一些由正常细胞编码,但不一定由正常细胞表达。这些抗原可以表征为通常在正常细胞中沉默(即,不表达)的抗原,仅在某些分化阶段表达的抗原,以及随时间表达的抗原,例如胚胎和胎儿抗原。其他癌症抗原由突变的细胞基因例如癌基因(例如活化的ras癌基因)、抑制基因(例如突变的p53),以及由内部缺失或染色体易位产生的融合蛋白编码。其他癌症抗原可以由病毒基因编码,例如rna和dna肿瘤病毒携带的基因。许多其他肿瘤相关抗原和针对其的抗体
是已知的和/或可商购获得的,也可以由本领域技术人员制造。
[0128]
肿瘤相关抗原的实例包括但不限于5t4、甲胎蛋白、ca-125、癌胚抗原、cd19、cd20、cd22、cd23、cd30、cd33、cd40、cd56、cd79、cd78、cd123、cd138、c-met、cspg4、igm、c型凝集素样分子1(cll-1)、egfr、egfrviii、上皮肿瘤抗原、erbb2、flt3、叶酸结合蛋白、gd2、gd3、hiv-1包膜糖蛋白gp41、hiv-1包膜糖蛋白gpl20、黑色素瘤相关抗原、间皮素、muc-1、突变的p53、突变的ras、ror1、vegfr2及其组合。
[0129]
在一些实施方案中,第二抗原是t细胞抗原。在一些实施方案中,t细胞抗原可以选自t细胞受体(tcr)、cd3、cd4、cd8、cd16、cd25、cd28、cd44、cd62l、cd69、icos、41-bb(cd137)和nkg2d或其任何组合。8,cd44,cd62l,cd69,icos,41-bb(cd137)和nkg2d或其任何组合。在一些实施方案中,t细胞抗原是cd3,第二抗原结合区与cd3的γ链、δ链、ε链、ζ链和η链中的任何结合。
[0130]
在一些实施方案中,第二抗原是cd3,第二抗原结合区包含vl和vh,其中vl包含分别具有如seq id no:11-13所示的氨基酸序列的lcdr 1-3,并且vh包含分别具有如seq id no:16-18所示的氨基酸序列的hcdr1-3。
[0131]
在一些实施方案中,cdr序列根据kabat编号系统定义。当使用kabat定义的cdr序列时,本发明公开的第二抗原结合区的vl包含分别具有如seq id no:11(rsstgavttsnyan)、seq id no:12(gankrap)和seq id no:13(alwysnlwv)所示的氨基酸序列的lcdr1、lcdr2和lcdr3,本发明公开的第二抗原结合区的vh包含分别具有如seq id no:16(gftfnty)、seq id no:17(rskynnya)和seq id no:18(hgnfgssyvsyfay)所示的氨基酸序列的hcdr1、hcdr2和hcdr3。
[0132]
在一些实施方案中,第二抗原结合区包含vl和vh,该vl包含与seq id no:14具有至少80%、至少85%、至少90%、至少95%、至少98%、至少99%或100%序列同一性的氨基酸序列,并且该vh包含与seq id no:19具有至少80%、至少85%、至少90%、至少95%、至少98%、至少99%、或100%序列同一性的氨基酸序列。
[0133]
在一些实施方案中,vl包含通过插入、缺失和/或取代一个或多个氨基酸而形成的如seq id no:14所示的氨基酸序列的功能变体,前提是该功能变体保留与cd3结合的能力。在一些实施方案中,vh包含通过插入、缺失和/或取代一个或多个氨基酸而形成的如seq id no:19所示的氨基酸序列的功能变体,前提是该功能变体保留与cd3结合的能力。
[0134]
例如,seq id no:14的功能变体包含或组成为与seq id no:14具有至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%、至少99.1%、至少99.2%、至少99.3%、至少99.4%、至少99.5%、至少99.6%、至少99.7%、至少99.8%或至少99.9%序列同一性的氨基酸序列。例如,seq id no:19的功能变体包含或组成为与seq id no:19具有至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%、至少99.1%、至少99.2%、至少99.3%、至少99.4%、至少99.5%、至少99.6%、至少99.7%、至少99.8%或至少99.9%序列同一性的氨基酸序列。
[0135]
在一些实施方案中,插入、缺失和/或取代的氨基酸的数量优选不超过亲本氨基酸序列中氨基酸总数的40%,更优选不超过35%,更优选是1%到33%,更优选是5%到30%,更优选是10%到25%,更优选是15%到20%。例如,插入、缺失和/或取代的氨基酸的数量可以是1到20,优选是1到10,更优选是1到7,还更优选是1到5,最优选是1到2。在优选的实施方
案中,插入、缺失和/或取代的氨基酸的数量为1、2、3、4、5、6或7。
[0136]
在一些实施方案中,插入、缺失和/或取代可以在框架(fr)区,例如fr1、fr2、fr3和/或fr4处进行。
[0137]
在一些实施方案中,一个或多个氨基酸的取代可以是一个或多个氨基酸的保守性取代。保守性取代的实例如上所述。
[0138]
在优选的实施方案中,第二抗原结合区包含vl和vh,该vl包含如seq id no:14所示的氨基酸序列,该vh包含如seq id no:19所示的氨基酸序列。
[0139]
在一些实施方案中,第二抗原结合区的vl任选地通过第一接头与特异性结合gpc3的抗体的vl的c端连接,第二抗原结合区的vh任选地通过第二接头与特异性结合gpc3的抗体的vh的c端连接,其中第一接头和第二接头相同或不同。在一些实施方案中,第一接头包含如seq id no:21(ggggsggggsggggs)或seq id no:32(gsggggsggggs)所示的氨基酸序列,第二接头包含如seq id no:22(gggssggggsggggs)所示的氨基酸序列。
[0140]
在一些实施方案中,双特异性抗体包含(i)轻链,其包含与seq id no:15具有至少80%、至少85%、至少90%、至少95%、至少98%、至少99%或100%序列同一性的氨基酸序列,以及重链,其包含与seq id no:20具有至少80%、至少85%、至少90%、至少95%、至少98%、至少99%或100%序列同一性的氨基酸序列;或者(ii)轻链,其包含与seq id no:30具有至少80%、至少85%、至少90%、至少95%、至少98%、至少99%或100%序列同一性的氨基酸序列,以及重链,其包含与seq id no:31具有至少80%、至少85%、至少90%、至少95%、至少98%、至少99%或100%序列同一性的氨基酸序列。
[0141]
在一些实施方案中,轻链包含通过插入、缺失和/或取代一个或多个氨基酸而形成的如seq id no:15或seq id no:30所示的氨基酸序列的功能变体,前提是该功能变体保留与gpc3和cd3结合的能力。在一些实施方案中,重链包含通过插入、缺失和/或取代一种或多种氨基酸而形成的如seq id no:20或seq id no:31所示的氨基酸序列的功能变体,前提是该功能变体保留与gpc3和cd3结合的能力。
[0142]
例如,seq id no:15或seq id no:30的功能变体包含或组成为与seq id no:15或seq id no:30具有至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%、至少99.1%、至少99.2%、至少99.3%、至少99.4%、至少99.5%、至少99.6%、至少99.7%、至少99.8%或至少99.9%序列同一性的氨基酸序列。例如,seq id no:20或seq id no:31的功能变体包含或组成为与seq id no:20或seq id no:31具有至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%、至少99.1%、至少99.2%、至少99.3%、至少99.4%、至少99.5%、至少99.6%、至少99.7%、至少99.8%或至少99.9%序列同一性的氨基酸序列。
[0143]
在一些实施方案中,插入、缺失和/或取代的氨基酸的数量优选不超过亲本氨基酸序列中氨基酸总数的40%,更优选不超过35%,更优选是1%到33%,更优选是5%到30%,更优选是10%到25%,更优选是15%到20%。例如,插入、缺失和/或取代的氨基酸的数量可以是1到50,优选是1到20,更优选是1到10,还更优选是1到5。在优选的实施方案中,插入、缺失和/或取代的氨基酸的数量为1、2、3、4、5、6或7。
[0144]
在一些实施方案中,插入、缺失和/或取代可以在框架(fr)区,例如fr1、fr2、fr3和/或fr4;和/或恒定区,例如cl、ch1、ch2和/或ch3处进行。
id no:19所示的氨基酸序列的功能变体,前提是该功能变体保留与cd3结合的能力。
[0151]
seq id no:4,9,14,19,26和28的功能变体可以是如上所述的那些。
[0152]
在优选的实施方案中,第一抗原结合区的vl包含如seq id no:4所示的氨基酸序列,并且第一抗原结合区的vh包含如seq id no:9所示的氨基酸序列;或第一抗原结合区的vl包含如seq id no:26所示的氨基酸序列,并且第一抗原结合区的vh包含如seq id no:28所示的氨基酸序列;并且第二抗原结合区的vl包含如seq id no:14所示的氨基酸序列,并且第二抗原结合区的vh包含如seq id no:19所示的氨基酸序列。
[0153]
在一些实施方案中,第二抗原结合区的vl任选地通过第一接头与第一抗原结合区的vl的c端连接,第二抗原结合区的vh任选地通过第二接头与第一抗原结合区的vh的c端连接,其中第一接头和第二接头相同或不同。在一些实施方案中,第一接头包含如seq id no:21(ggggsggggsggggs)或seq id no:32(gsggggsggggs)所示的氨基酸序列,第二接头包含如seq id no:22(gggssggggsggggs)所示的的氨基酸序列。
[0154]
在一些实施方案中,双特异性抗体包含单个多肽链,所述单个多肽链包含第一抗原结合区和第二抗原结合区,以及任选地fc区。
[0155]
fc区可以是任何同种型,包括但不限于igg1、igg2、igg3和igg4,并且可包含一种或多种突变或修饰。在一个实施方案中,fc区是igg1同种型或由其衍生的,任选地具有一个或多个突变或修饰。在一个实施方案中,fc区是人igg1 fc。
[0156]
在一个实施方案中,fc区是效应功能缺陷的。例如,fc区可以是igg1同种型,或非igg1型,例如igg2、igg3或igg4,其已发生突变,使得其介导例如adcc的效应功能的能力降低甚至消除。这样的突变在dall'acqua wf等人,j immunol.177(2):1129-1138(2006)和hezareh m,j virol.;75(24):12161-12168(2001)中已有描述。
[0157]
在一个实施方案中,fc区包含去除用于asn连接的糖基化的受体位点的突变或以其他方式被操纵以改变糖基化特性。例如,在igg1 fc区中,可以使用n297q突变以去除asn连接的糖基化位点。因此,在一个具体实施方案中,fc区包含具有n297q突变的igg1野生型序列。
[0158]
在进一步的实施方案中,fc区被糖工程化以减少岩藻糖并因此增强adcc,例如通过在抗体产生过程中向培养基中添加化合物,如us2009317869中所述或者如van berkel等人(2010)biotechnol.bioeng.105:350中所述,或者通过使用fut8敲除细胞,例如yamane-ohnuki等人(2004)biotechnol.bioeng 87:614中所述。或者,可以使用等人(1999)nature biotech 17:176描述的方法来优化adcc。在另一个实施方案中,fc区被改造以增强补体激活,例如在natsume等人(2009)cancer sci.100:2411中所述。
[0159]
在一些实施方案中,fc区包含可抑制fc同源二聚体化的修饰或突变。在一些实施方案中,fc区包含人igg1 fc野生型序列的变体。该变体可包含在人igg1t366和y407(kabat编号)位点处的氨基酸取代。优选地,t366被l(亮氨酸)取代。优选地,y407被i(异亮氨酸)、f(苯丙氨酸)、l(亮氨酸)、m(甲硫氨酸)、h(组氨酸)、k(赖氨酸)、s(丝氨酸)、q(谷氨酰胺)、t(苏氨酸)、w(色氨酸)、a(丙氨酸)、g(甘氨酸)或n(天冬酰胺)取代。更优选地,y407被组氨酸取代。在一个实施方案中,t366被亮氨酸取代,并且y407被组氨酸取代。
[0160]
在一些实施方案中,fc区可以是单体人igg1 fc(例如,mfc7.2),如pct申请号pct/us2018/016524中所述,其通过引用整体并入本文。
[0161]
在一些实施方案中,双特异性抗体包含第一多肽链,所述第一多肽链包含第一抗原结合区的vl和第二抗原结合区的vl,和任选地fc区;以及第二多肽链,所述第二多肽链包含第一抗原结合区的vh和第二抗原结合区域的vh,和任选地fc区。fc区可以是如上所述的那些。
[0162]
在一些实施方案中,第一多肽链还包含轻链恒定区(cl)。在一些实施方案中,第一多肽链包含如上所述的单体人igg1 fc(例如,mfc7.2)。在一些实施方案中,第一多肽链从n端到c端包含:第一抗原结合区的vl、第二抗原结合区的vl、cl和mfc7.2。
[0163]
在一些实施方案中,第二多肽链还包含重链恒定区(ch),例如ch1。在一些实施方案中,第二多肽链包含如上所述的单体人igg1 fc(例如,mfc7.2)。在一些实施方案中,第二多肽链从n端到c端包含:第一抗原结合区的vh、第二抗原结合区的vh、ch1和mfc7.2。
[0164]
在一些实施方案中,双特异性抗体包含(i)轻链,其包含与seq id no:15具有至少80%、至少85%、至少90%、至少95%、至少98%、至少99%或100%序列同一性的氨基酸序列,以及重链,其包含与seq id no:20具有至少80%、至少85%、至少90%、至少95%、至少98%、至少99%或100%序列同一性的氨基酸序列;或者(ii)轻链,其包含与seq id no:30具有至少80%、至少85%、至少90%、至少95%、至少98%、至少99%或100%序列同一性的氨基酸序列,以及重链,其包含与seq id no:31具有至少80%、至少85%、至少90%、至少95%、至少98%、至少99%或100%序列同一性的氨基酸序列。
[0165]
在一些实施方案中,轻链包含通过插入、缺失和/或取代一个或多个氨基酸而形成的如seq id no:15或seq id no:30所示的氨基酸序列的功能变体,前提是该功能变体保留与gpc3和cd3结合的能力。在一些实施方案中,重链包含通过插入、缺失和/或取代一个或多个氨基酸而形成的如seq id no:20或seq id no:31所示的氨基酸序列的功能变体,前提是该功能变体保留与gpc3和cd3结合的能力。
[0166]
seq id no:15,20,30和31的功能变体可以是如上所述的那些。
[0167]
在优选的实施方案中,轻链包含如seq id no:15所示的氨基酸序列,重链包含如seq id no:20所示的氨基酸序列;或轻链包含如seq id no:30所示的氨基酸序列,重链包含如seq id no:31所示的氨基酸序列。
[0168]
在一些实施方案中,双特异性抗体可以是双特异性t细胞衔接器(bite),优选地是如上所述的hbite。
[0169]
在又一方面,本公开提供了核酸,其包含编码本发明公开的抗体或其抗原结合片段或本发明公开的双特异性抗体或其抗原结合片段的核苷酸序列。
[0170]
在另一方面,本公开提供了包含本发明公开的核酸的载体。
[0171]
任何载体都可以适用于本公开。在一些实施方案中,载体是病毒载体。在一些实施方案中,载体是逆转录病毒载体、dna载体、鼠白血病病毒载体、sfg载体、质粒、rna载体、腺病毒载体、杆状病毒载体、epstein barr病毒载体、乳多空病毒载体、痘苗病毒载体、单纯疱疹病毒载体、腺相关病毒载体(aav)、慢病毒载体或其任意组合。合适的示例性载体包括例如pgar、pbabe-puro、pbabe-neo largetcdna、pbabe-hygro-htert、pmko.1gfp、mscv-ires-gfp、pmscv pig(puro ires gfp空质粒)、pmscv-loxp-dsred-loxp-egfp-puro-wpre、mscv ires萤光素酶、pmig、mdh1-pgk-gfp_2.0、ttrmpvir、pmscv-ires-mcherry fp、pretrox gfp t2a cre、prxtn、plncexp和plxin-luc。
[0172]
重组表达载体可以是任何合适的重组表达载体。合适的载体包括被设计用于繁殖和扩增或用于表达或两者的载体,例如质粒和病毒。例如,载体可以选自puc系列(fermentas life sciences,glen burnie,md.)、pbluescript系列(stratagene,lajolla,ca)、pet系列(novagen,madison,wis.)、pgex系列(pharmacia biotech,uppsala,瑞典)和pex系列(clontech,palo alto,calif.)。也可以使用噬菌体载体,例如λgt10、λgt11、λzapii(stratagene)、λembl4和λnm1149。可用于本公开的植物表达载体的实例包括pbi01、pbi101.2、pbi101.3、pbi121和pbin19(clontech)。可用于本公开的动物表达载体的实例包括pcdna、peuk-cl、pmam和pmamneo(clontech)。
[0173]
重组表达载体可以使用标准重组dna技术制备,例如sambrook等人,molecular cloning:a laboratory manual,第三版,cold spring harbor press,cold spring harbor,n.y.2001;以及ausubel等人,current protocols in molecular biology,greene publishing associates and john wiley&sons,ny,1994中所述。可以制备环形或线性的表达载体构建体以包含在原核或真核宿主细胞中具有功能的复制系统。复制系统可以衍生自例如colel、2μ质粒、λ、sv40、牛乳头瘤病毒等。
[0174]
在另一方面,本公开提供了包含本发明公开的核酸或本发明公开的载体的宿主细胞。
[0175]
任何细胞都可以用作本公开的核酸或载体的宿主细胞。在一些实施方案中,细胞可以是原核细胞、真菌细胞、酵母细胞或高等真核细胞如哺乳动物细胞。合适的原核细胞包括但不限于真细菌,例如革兰氏阴性或革兰氏阳性生物体,例如肠杆菌科(enterobactehaceae),例如埃希氏杆菌属(escherichia),例如大肠杆菌(e.coli);肠杆菌属(enterobacter);欧文氏菌属(erwinia);克雷伯氏菌属(klebsiella);变形杆菌(proteus);沙门氏菌属(salmonella),例如鼠伤寒沙门氏菌(salmonellatyphimurium);沙雷氏菌属(serratia),例如粘质沙雷氏菌(serratiamarcescans);和志贺氏菌属(shigella);芽孢杆菌属(bacilli),例如枯草芽孢杆菌(b.subtilis)和地衣芽孢杆菌(b.licheniformis);假单胞菌(pseudomonas),如铜绿假单胞菌(p.aeruginosa);和链霉菌(streptomyces)。在一些实施方案中,细胞是人细胞。在一些实施方案中,细胞是免疫细胞。在一些实施方案中,宿主细胞包括例如cho细胞,例如chos细胞和cho-k1细胞,或hek293细胞,例如hek293a、hek293t和hek293fs。
[0176]
在又一方面,本公开提供了药物组合物,其包含(i)本发明公开的抗体或其抗原结合片段,或本发明公开的双特异性抗体或其抗原结合片段;和(ii)药学上可接受的载体或赋形剂。
[0177]
在一些实施方案中,与本发明公开的组合物一起使用的载体或赋形剂包括但不限于马来酸、酒石酸、乳酸、柠檬酸、乙酸、碳酸氢钠、磷酸钠、组氨酸、甘氨酸、氯化钠、氯化钾、氯化钙、氯化锌、水、右旋糖、n-甲基吡咯烷酮、二甲亚砜、n,n-二甲基乙酰胺、乙醇、丙二醇、聚乙二醇、二甘醇单乙醚和表面活性剂聚氧乙烯-脱水山梨糖醇单油酸酯。
[0178]
在本发明公开的药物组合物的一些实施方案中,药物组合物进一步包含第二治疗剂。在一些实施方案中,第二治疗剂可以选自抗体、化学治疗剂和小分子药物。在一些实施方案中,第二治疗剂可以选自布鲁顿酪氨酸激酶(btk)抑制剂、pi3k抑制剂、hdac抑制剂、pd-1/pd-l1抑制剂、lag3抑制剂和糖皮质激素,或其任意组合。
[0179]
在一些实施方案中,治疗剂是化学治疗剂。化学治疗剂可以包括例如细胞毒剂、抗代谢剂(例如叶酸拮抗剂、嘌呤类似物、嘧啶类似物等)、拓扑异构酶抑制剂(例如喜树碱衍生物、蒽二酮、蒽环类、表鬼臼毒素、喹啉生物碱等)、抗微管剂(例如紫杉烷、长春花生物碱)、蛋白质合成抑制剂(例如头孢菌素、喜树碱衍生物、喹啉生物碱)、烷化剂(例如烷基磺酸盐、亚乙基亚胺、氮芥、亚硝基脲、铂衍生物、三氮烯等)、生物碱、萜类化合物和激酶抑制剂。
[0180]
在又一方面,本公开提供了缀合物,其包含本发明公开的抗体或其抗原结合片段或本发明公开的双特异性抗体或其抗原结合片段,以及与其缀合的化学部分。
[0181]
在本发明公开的缀合物的一些实施方案中,化学部分选自治疗剂、可检测部分和免疫刺激分子。
[0182]
在一些实施方案中,治疗剂包括但不限于免疫调节剂、放射性化合物、酶(例如穿孔素)、化学治疗剂(例如顺铂)或毒素。在一些实施方案中,治疗剂可以是例如美登素、格尔德霉素、微管蛋白抑制剂例如微管蛋白结合剂(例如奥瑞他汀类)或小沟结合剂例如加利车霉素(calicheamicin)。
[0183]
其他合适的治疗剂包括例如小分子细胞毒剂,即具有杀死哺乳动物细胞能力的分子量小于700道尔顿的化合物。这样的化合物还可包含能够具有细胞毒性作用的有毒金属。此外,应当理解,这些小分子细胞毒剂还包括药物前体,即在生理条件下分解或转化以释放细胞毒剂的化合物。此类药剂的实例包括顺铂、美登素衍生物、雷切霉素、加利车霉素、多西他赛、依托泊苷、吉西他滨、异环磷酰胺、伊立替康、美法仑、米托蒽醌、sorfimer卟啉钠ii、替莫唑胺、托泊替康、三甲双胍、奥瑞他汀e、长春生物碱和多柔比星;肽细胞毒素,即具有杀死哺乳动物细胞能力的蛋白质或其片段,例如蓖麻毒素、白喉毒素、假单胞菌细菌外毒素a、dna酶和rna酶;放射性核素,即随着α或β粒子或γ射线的一种或多种的同时发射而衰变的元素的不稳定同位素,例如碘-131、铼-186、铟-111、钇-90、铋-210、铋-213、锕-225和砹-213;螯合剂,其可用于促进这些放射性核素与分子或其多聚体的结合。
[0184]
在一些实施方案中,可检测部分可以选自生物素、链霉抗生物素蛋白、酶或其催化活性片段、放射性核素、纳米颗粒、顺磁性金属离子或荧光、磷光,或化学发光分子。用于诊断目的的可检测部分包括例如荧光标记、放射性标记、酶、核酸探针和造影剂。
[0185]
在一些实施方案中,免疫刺激分子是激发免疫应答的免疫效应分子。例如,免疫刺激分子可以是细胞因子如il-2和ifn-γ、趋化因子如il-8、血小板因子4、黑色素瘤生长刺激蛋白、补体激活剂;病毒/细菌蛋白结构域,或病毒/细菌肽。
[0186]
在另一方面,本公开提供了治疗受试者中癌症的方法,包括向受试者施用有效量的本发明公开的抗体或其抗原结合片段、本发明公开的双特异性抗体或其抗原结合片段、本发明公开的药物组合物或本发明公开的缀合物。
[0187]
在本发明公开的方法的一些实施方案中,癌症是gpc3阳性癌症。在一些实施方案中,癌症选自肝癌、结肠癌、胰腺癌、乳腺癌、肺癌、卵巢癌、食道癌、膀胱癌、前列腺癌、结肠直肠癌、子宫癌、宫颈癌、脑癌、宫颈癌、胃癌、胆管癌、软骨肉瘤、肾癌、甲状腺癌、皮肤癌、黑色素瘤、神经胶质瘤、神经母细胞瘤、淋巴瘤和骨髓瘤。优选地,该癌症选自肝癌、结肠癌(如结肠腺癌和结肠直肠癌)、胰腺癌、肺癌(如肺间皮瘤、非小细胞肺癌(nsclc)和肺鳞状细胞癌)、膀胱癌、黑色素瘤和骨髓瘤(如多发性骨髓瘤)。
[0188]
在一些实施方案中,施用于受试者的剂量可随实施方案、所用药物、给药方法以及被治疗的部位和受试者而变化。然而,剂量应足以提供治疗反应。临床医生可以确定给予人或其他受试者以治疗医学病症的有效量。治疗有效所需的精确量可取决于许多因素,例如抗体的活性和给药途径。
[0189]
本文所述的抗体、组合物或缀合物的剂量可以在合适的时间段内一次性或以一系列亚剂量的形式施用给哺乳动物,例如根据需要,每天、每半周、每周、每两周、每半月、每两月、每半年或每年施用一次。包含有效量的抗体、组合物或缀合物的剂量单位可以以单日剂量给药,或者总日剂量可以根据需要以每日给药的两个、三个、四个或更多个分剂量给药。
[0190]
合适的给药方式可由医生选择。给药途径可以是肠胃外给药,例如通过注射给药、经鼻给药、经肺给药或经皮给药。可以通过静脉内注射、肌内注射、腹膜内注射、皮下注射进行全身或局部给药。在一些实施方案中,选择抗体、组合物或缀合物用于肠胃外递送、吸入或通过消化道递送,例如口服。给药剂量和方法可以根据受试者的重量、年龄、条件等而变化,并且可以适当地选择。
[0191]
在一些实施方案中,该方法还包括向受试者施用第二治疗剂。在某些实施方案中,在施用第二治疗剂之前、基本上同时或之后施用结合剂。
[0192]
在一些实施方案中,第二治疗剂选自抗体、化学治疗剂和小分子药物。在一些优选的实施方案中,第二治疗剂可以选自布鲁顿酪氨酸激酶(btk)抑制剂、pi3k抑制剂、hdac抑制剂、pd-1/pd-l1抑制剂、lag3抑制剂和糖皮质激素,或其任意组合。
[0193]
在一些实施方案中,第二治疗剂是化学治疗剂。化学治疗剂可以包括例如细胞毒剂、抗代谢剂(例如叶酸拮抗剂、嘌呤类似物、嘧啶类似物等)、拓扑异构酶抑制剂(例如喜树碱衍生物、蒽二酮、蒽环类、表鬼臼毒素、喹啉生物碱等)、抗微管剂(例如紫杉烷、长春花生物碱)、蛋白质合成抑制剂(例如头孢菌素、喜树碱衍生物、喹啉生物碱)、烷化剂(例如烷基磺酸盐、亚乙基亚胺、氮芥、亚硝基脲、铂衍生物、三氮烯等)、生物碱、萜类化合物和激酶抑制剂。
[0194]
在另一方面,本公开提供了检测受试者中的gpc3阳性癌的方法,其包括(i)使从受试者获得的样品与本发明公开的抗体或其抗原结合片段、或本发明公开的双特异性抗体或其抗原结合片段、或本发明公开的缀合物接触;和(ii)检测抗体或其抗原结合片段与样品中的gpc3的结合。
[0195]
在一些实施方案中,抗体或其抗原结合片段与可检测部分连接。可检测部分可以选自生物素、链霉抗生物素蛋白、酶或其催化活性片段、放射性核素、纳米颗粒、顺磁性金属离子,或荧光、磷光或化学发光分子。用于诊断目的的可检测部分包括例如荧光标记、放射性标记、酶、核酸探针和造影剂。
[0196]
在一些实施方案中,癌症选自肝癌、结肠癌、胰腺癌、乳腺癌、肺癌、卵巢癌、食道癌、膀胱癌、前列腺癌、结肠直肠癌、子宫癌、宫颈癌、脑癌、宫颈癌、胃癌、胆管癌、软骨肉瘤、肾癌、甲状腺癌、皮肤癌、黑色素瘤、神经胶质瘤、神经母细胞瘤、淋巴瘤和骨髓瘤。优选地,该癌症选自肝癌、结肠癌(如结肠腺癌和结肠直肠癌)、胰腺癌、肺癌(如肺间皮瘤、非小细胞肺癌(nsclc)和肺鳞状细胞癌)、膀胱癌、黑色素瘤和骨髓瘤(如多发性骨髓瘤)。
[0197]
在又一方面,本公开提供了用于检测样品中gpc3抗原的存在的试剂盒,其包含本发明公开的抗体或其抗原结合片段、本发明公开的双特异性抗体或其抗原结合片段、或本
发明公开的缀合物。优选地,抗体或其抗原结合片段与可检测部分连接。可检测部分可以选自生物素、链霉抗生物素蛋白、酶或其催化活性片段、放射性核素、纳米颗粒、顺磁性金属离子,或荧光、磷光或化学发光分子。用于诊断目的的可检测部分包括例如荧光标记、放射性标记、酶、核酸探针和造影剂。
[0198]
在另一方面,本公开提供了本发明公开的抗体或其抗原结合片段、本发明公开的双特异性抗体或其抗原结合片段、本发明公开的药物组合物或本发明公开的缀合物在制备用于治疗受试者的癌症的药物中的用途。在一些实施方案中,癌症是gpc3阳性癌症。
[0199]
在另一方面,本公开提供了本发明公开的抗体或其抗原结合片段、本发明公开的双特异性抗体或其抗原结合片段、本发明公开的药物组合物或本发明公开的缀合物,其用于治疗受试者的癌症。在一些实施方案中,癌症是gpc3阳性癌症。
[0200]
在又一方面,本公开提供了本发明公开的抗体或其抗原结合片段、本发明公开的双特异性抗体或其抗原结合片段、本发明公开的药物组合物或本发明公开的缀合物在制备用于检测受试者中的gpc3阳性癌症的试剂盒中的用途。
[0201]
在另一方面,本公开提供了本发明公开的抗体或其抗原结合片段、本发明公开的双特异性抗体或其抗原结合片段、本发明公开的药物组合物或本发明公开的缀合物,其用于检测受试者中的gpc3阳性癌症。
[0202]
在本文公开的用途的一些实施方案中,gpc3阳性癌症选自肝癌、结肠癌、胰腺癌、乳腺癌、肺癌、卵巢癌、食道癌、膀胱癌、前列腺癌、结肠直肠癌、子宫癌、宫颈癌、脑癌、宫颈癌、胃癌、胆管癌、软骨肉瘤、肾癌、甲状腺癌、皮肤癌、黑色素瘤、神经胶质瘤、神经母细胞瘤、淋巴瘤和骨髓瘤。优选地,该癌症选自肝癌、结肠癌(如结肠腺癌和结肠直肠癌)、胰腺癌、肺癌(如肺间皮瘤、非小细胞肺癌(nsclc)和肺鳞状细胞癌)、膀胱癌、黑色素瘤和骨髓瘤(如多发性骨髓瘤)。
实施例
[0203]
列出以下实施例以阐述本发明的各种实施方案,并非旨在以任何形式限制本发明。本实施例以及本发明描述的方法目前代表优选实施方案,是示例性的,并非旨在作为对本发明范围的限制。本领域技术人员将想到包含在由权利要求的范围限定的本发明的精神内的变化和其他用途。
[0204]
包括hep-g2(人肝癌细胞系)、a375(人黑色素瘤细胞系)、huh7(肝细胞衍生的细胞癌细胞系)、sk-hep-1(人肝腺癌细胞系)、a549(人非小细胞肺癌细胞系)、ls174t(人结肠腺癌细胞系)、rpmi8226(人骨髓瘤细胞系)、h226(人肺间皮瘤细胞系)和5637(人膀胱癌细胞系)在内的细胞系购自国家认证细胞培养物收藏中心。
[0205]
通过使用lipofectamine
tm ltx试剂和plus
tm
试剂(thermo)将商业化gpc3重组质粒pcmv-gpc3(sino biological)转染到ls174t细胞中产生稳定表达gpc3的肿瘤细胞系ls174t-gpc3,并且ls174t-gpc3稳定细胞系是通过潮霉素b筛选获得的。
[0206]
生物素化的人gpc3蛋白、人gpc3蛋白、食蟹猴gpc3蛋白和小鼠gpc3蛋白购自acrobiosystems。抗人igg(γ链特异性)-r-pe抗体、抗人igg(fc特异性)-过氧化物酶抗体和单克隆抗m2-过氧化物酶购自sigma。
[0207]
m13ko7辅助噬菌体购自new england biolabs。dynabeads
tm myone
tm
链霉亲和素
t1购自thermofisher scientific。pe抗-his标签抗体购自biolegend。m13噬菌体抗体(hrp)购自sino biological。
[0208]
实施例1.淘选和筛选噬菌体展示的天然人fab文库以鉴定gpc3抗体
[0209]
如前所述(zhu等人,j virol 2006,80:891-899)(对其稍加修改,分别在第一轮、第二轮和第三轮淘选中使用5、1和0.2mg的抗原),使用具有来自约30个健康个体的外周血b细胞的大型(规模,10
11
)噬菌体展示的天然人fab文库来选择针对与磁珠(dynabeads
tm myone
tm
链霉亲和素t1;thermofisher scientific)缀合的重组人gpc3的抗体。通过使用多克隆噬菌体elisa从第3轮生物淘选观察到强阳性信号。随后测试第3轮噬菌体的特异性结合。通过基于可溶性表达的单克隆酶联免疫吸附测定(semelisa)和测序分析,鉴定出命名为1a1和6a4的两种特定fab克隆。1a1和6a4 fab都具有κ轻链。
[0210]
将六组氨酸标记的1a1 fab和6a4 fab在大肠杆菌菌株hb2151中表达,并使用ni-nta树脂从周质的可溶性部分中纯化。然后使用标准方案进行elisa以测量对重组人gpc3(全长胞外域)的结合亲和力。简而言之,将重组人gpc3(acrobiosystems)以50ng每孔在corning eia/ria高结合的96孔板(corning公司)上,在4℃下包被过夜,并用在pbs(ph7.4)中的3%的脱脂牛奶封闭。加入五倍连续稀释的抗体并在室温下孵育2小时。使用含有0.05%吐温20的pbs洗涤板。通过hrp缀合的抗flag标签抗体(sino biological)检测结合的抗体。该测定在室温下用tmb底物(solarbio)进行显色,并用酶标仪在450nm处测量od值。结果显示fab克隆1a1具有ec
50
为约190nm的亲和力(图1a),而fab克隆6a4具有ec
50
为约234nm的亲和力(图1b)。
[0211]
为了测量1a1 fab或6a4 fab对细胞表面结合的gpc3的结合,使用癌细胞系hepg、huh7、sk-hep-1和a549进行流式细胞术。将每种细胞系的5
×
105个细胞与fab抗体(10μg/ml)或作为阳性对照的gpc3-pe抗体(sino biological,10μg/ml)在冰上共同孵育60分钟。细胞用含有0.1%牛血清白蛋白的pbs(pbsa)洗涤一次,并重悬于200ml pbsa中。然后加入2μl抗his-pe缀合物(biolegend)并孵育60分钟。用pbsa洗涤细胞一次,然后用于流式细胞术分析。结果如图2a和2b所示。
[0212]
从图2a可以看出,1a1 fab显示出与hepg2和huh7的中等结合,以及与sk-hep-1的相对较弱的结合。这可能是由于gpc3在sk-hep-1细胞上的表达相对较低,正如gpc3-pe抗体与这些细胞几乎没有结合所证明的。从图2b可以看出,6a4 fab显示出与huh7和a549的中等结合。结果表明,1a1 fab和6a4 fab可以与表达gpc3的癌细胞系很好地结合。
[0213]
实施例2.抗gpc3单克隆抗体的构建和初步表征
[0214]
使用fab克隆1a1和6a4来构建完整的单克隆抗体(1a1 mab和6a4 mab)。简而言之,将fab克隆1a1和6a4的重链fd片段分别与人igg1 fc片段的n-末端融合。将轻链和重链构建至载体pdin1中,该载体由本发明人从pdr12修饰而来,以包含两个分子克隆位点(mcs),用于表达单克隆抗体。抗gpc3 1a1 mab和6a4 mab的构建和初步表征如下进行。
[0215]
抗gpc3单克隆抗体的克隆
[0216]
为了产生抗gpc3 1a1 mab的构建体,使用以下引物:
[0217]
gpc3-1a1-igg1-vh-fp-hindⅲ,5’gaataagcttgccgccaccatggaatggagctgggtctttctcttcttcct
’3’
(正义)(seq id no:33);
[0218]
gpc3-igg1-fc-rp-xbaⅰ,5’gtactctagattatttacccggagacagggagaggctcttctgcg
tgtagtggttg 3’(反义)(seq id no:34);
[0219]
gpc3-1a1-igg1-vl-fp-noti,5’agtccgcggccgcgccaccatgggtgtgcccactcaggtcctggggt 3’(正义)(seq id no:35);
[0220]
gpc3-1a1-igg1-lc-rp-xhoi,5’gcatctcgagttaacactctcccctgttgaagctcttt 3’(反义)(seq id no:36);
[0221]
gpc3-1a1-igg1-vh-rp-ol,5’tgtgtgagttttgtcacaagatttgggctcaactttctt 3’(正义)(seq id no:37);
[0222]
gpc3-igg1-fc-fp-ol,5’tgtgacaaaactcacacatgtccaccgtgcccagca 3’(反义)(seq id no:38)。
[0223]
为产生抗gpc3 1a1 mab,分别使用引物对gpc3-1a1-igg1-vl-fp-noti/gpc3-1a1-igg1-lc-rp-xhoi和gpc3-1a1-igg1-vh-fp-hindiii/gpc3-1a1-igg1-vh-rp-ol从抗gpc3 1a1 fab扩增抗gpc3抗体的vl+cl和vh+ch1基因片段。使用引物对gpc3-igg1-fc-fp-ol/gpc3-igg1-fc-rp-xbaⅰ从含有igg1的单体fc片段的pdin1载体扩增fc结构域。对于全长重链,使用引物对gpc3-1a1-igg1-vh-fp-hindⅲ/gpc3-igg1-fc-rp-xbaⅰ,通过重叠pcr将pcr产物与fc结构域融合。用hindiii和xbai消化重链基因片段并克隆到pbudce4.1载体中。轻链基因片段通过noti和xhoi限制位点克隆到pbudce4.1载体中。这两个载体一起用于表达抗gpc3 1a1 mab。
[0224]
为了产生抗gpc3 6a4 mab的构建体,使用以下引物:
[0225]
gpc3-6a4-mab-vh-fp-ol,5’cagcactgctctgttgcctggtcctcctgactggggtgagggccgaagtgcagctggtg 3’(正义)(seq id no:39);
[0226]
gpc3-6a4-mab-vh-rp-ol,5’ggcatgtgtgagttttgtcacaagatttgggctcaactttcttgt 3’(反义)(seq id no:40);
[0227]
gpc3-6a4-mab-fc-fp-ol,5’gtgacaaaactcacacatgcc 3’(正义)(seq id no:41);
[0228]
gpc3-6a4-mab-fc-rp-xba1,5’cgattctagaatcatttacccggggacagggagaggct 3’(反义)(seq id no:42);
[0229]
gpc3-6a4-mab-vl-fp-ol,5’gcactgctctgttgcctggtcctcctgactggggtgagggccgatgttgtgatgact 3’(正义)(seq id no:43);
[0230]
gpc3-6a4-mab-vl-rp-xba1,5’cgattctagaatcaacactctcccctgttgaagctctt 3’(反义)(seq id no:44);
[0231]
pby-sp-fp-not1,5’gaatgcggccgcaaactacaagacagacttgcaaaagaaggcatgcacagctcagcactgctctgttg 3’(正义)(seq id no:45)。
[0232]
为产生抗gpc3 6a4 mab,使用与1a1 mab类似的方案获得抗gpc3 6a4 mab的轻链和重链基因片段。基因片段通过noti和xbai限制性位点克隆到pby载体中。
[0233]
蛋白质表达、纯化和初步表征
[0234]
在293fs或cho-s细胞中表达抗gpc3 1a1 mab和6a4 mab。质粒和转染剂pei按1:3的比例混合,然后滴加到293fs或cho-s细胞培养物中。转染后细胞继续生长5到7天。通过在8000rpm下离心20分钟,收获细胞培养物。将含有目标蛋白的培养上清液加载到protein a sepharose 4 fast flow色谱柱(ge healthcare),并根据制造商的说明进行纯化。
[0235]
对纯化的蛋白质进行sds-page。在非还原性sds-page上,1a1 mab显示出约150kda
的表观分子量(amw)。在还原性sds-page上,重链和轻链分别具有约55kda和30kda的表观分子量(数据未显示)。根据kabat编号系统的1a1 mab和6a4 mab的cdr序列如表1所示。轻链可变区(vl)和重链可变区(vh)的氨基酸序列如表2所示。1a1 mab和6a4 mab的完整轻链和重链序列如表3所示。
[0236]
表1. 1a1 mab和6a4 mab的cdr序列
[0237][0238]
表2. 1a1 mab和6a4 mab的vl和vh序列
[0239][0240]
[0241]
表3. 1a1 mab和6a4 mab的轻链和重链序列
[0242]
[0243][0244]
实施例3.抗gpc3双特异性抗体的构建和初步表征
[0245]
双特异性t细胞衔接器(bite)是一类新型的双特异性抗体,其通过同时结合肿瘤抗原和t细胞抗原如t细胞表面的cd3分子,引导细胞毒性t细胞杀死癌细胞。pct申请号pct/us2018/16524(其通过引用整体并入本文)中描述的hbite是bite的特定形式。hbite具有形成异二聚体的轻链和重链。轻链从n端到c端包含抗靶标(例如肿瘤抗原)vl结构域、抗cd3vl-cl和单体人igg1 fc(例如,mfc7.2)。重链从n端到c端包含抗靶标(例如肿瘤抗原)vh结构域、抗cd3vh-ch1和单体人igg1 fc(例如,mfc7.2)。单体fc7.2包含两个能够抑制fc同源二聚化的氨基酸突变(t366l和y407h)。为产生gpc3
×
cd3 hbite,将上述抗gpc3抗体的vl和vh结构域分别通过接头ggggsggggsggggs(seq id no:21)或gsggggsggggs(seq id no:32)和gggssggggsggggs(seq id no:22)与抗cd3 fab的vl和vh结构域的n端融合。抗cd3 fab进一步与mfc7.2的n端融合。将轻链和重链构建至载体pdin1中,以在哺乳动物细胞中表达。靶向gpc3和cd3的双特异性抗体(基于1a1的gpc3
×
cd3 hbite和基于6a4的gpc3
×
cd3 hbite)的构建和初步表征如下进行。
[0246]
靶向gpc3和cd3的双特异性抗体的克隆
[0247]
为产生基于1a1的gpc3
×
cd3 hbite双特异性抗体的构建体,使用以下引物:
和xbai消化并克隆到pby载体中。
[0265]
使用引物对bi-011-6a4-vh-fp和bi-011-6a4-vh-rp扩增质粒pwci-gpc3-6a4,以获得vh基因片段。然后使用引物对pby-sp-fp-notⅰ和bi-011-6a4-vh-rp扩增vh基因片段,以获得sp+vh的基因片段。使用引物对cd3-vh-fp和fc-rp-xbaⅰ扩增质粒pdin1-gpc3-1a1,以获得fc基因片段。使用引物对pby-sp-fp-notⅰ和fc-rp-xbaⅰ扩增sp+vh和fc基因片段,以获得完整的重链基因片段。将重链基因片段用notⅰ和xbaⅰ消化并克隆到pby载体中。
[0266]
蛋白质表达、纯化和初步表征
[0267]
基于1a1的gpc3
×
cd3 hbite和基于6a4的gpc3
×
cd3 hbite在293fs或cho-s细胞中表达。将质粒和转染剂pei以1:3的比例混合,然后加入293fs或cho-s细胞培养物中。转染后细胞继续生长5到7天。通过在8000rpm下离心20分钟,收获细胞培养物。将含有目标蛋白的培养上清液加载到protein a sepharose 4 fast flow色谱柱(ge healthcare),并根据制造商的说明进行纯化。
[0268]
对纯化的蛋白质进行sds-page。在非还原性sds-page上,基于1a1的gpc3
×
cd3 hbite显示出约120kda的表观分子量(amw)。在还原性sds-page上,重链和轻链彼此接近,具有约62kda的表观分子量(未显示数据)。根据kabat编号系统,基于1a1的gpc3
×
cd3 hbite和基于6a4的gpc3
×
cd3 hbite的cdr序列如表4所示。轻链可变区(vl)和重链可变区(vh)的氨基酸序列如表5所示。基于1a1的gpc3
×
cd3 hbite和基于6a4的gpc3
×
cd3 hbite的轻链和重链序列如表6所示。
[0269]
表4.基于1a1的gpc3
×
cd3 hbite和基于6a4的gpc3
×
cd3 hbite的cdr序列
[0270]
[0271][0272]
表5.基于1a1的gpc3
×
cd3 hbite和基于6a4的gpc3
×
cd3 hbite的vl和vh序列
[0273]
[0274][0275]
表6.基于1a1的gpc3
×
cd3 hbite和基于6a4的gpc3
×
cd3 hbite的轻链和重链序列
[0276]
[0277][0278]
实施例4.抗gpc3单克隆抗体与gpc3的结合亲和力
[0279]
按照标准方案进行elisa检测,以确定抗gpc3 1a1 mab与来自人、食蟹猴和小鼠的重组gpc3的结合亲和力,以及抗gpc3 6a4 mab与重组人gpc3的结合亲和力。简而言之,将重组gpc3(acrobiosystems)以50ng每孔在corning eia/ria高结合的96孔板(corning公司)
上,在4℃下包被过夜,并用在pbs(ph7.4)中的3%脱脂牛奶封闭。加入五倍连续稀释的生物素化抗体并在室温下孵育2小时。使用含有0.05%吐温20的pbs洗涤板。通过hrp缀合的链霉亲和素(sino biological)检测结合的抗体。该测定在室温下用tmb底物(solarbio)进行显色,并用酶标仪在450nm处检测。通过将数据拟合到langmuir吸附等温线来计算半数最大结合(ec
50
)。结果如图3a到3b所示。
[0280]
从图3a可以看出,1a1 mab可以以相似的亲和力结合来自所有三种物种的重组gpc3。1a1 mab与人、食蟹猴和小鼠gpc3结合的ec
50
分别为0.6nm、0.58nm和1.12nm,这表明1a1 mab对来自不同物种的gpc3蛋白具有高结合亲和力。从图3b可以看出,6a4 mab以4.5nm的ec
50
结合重组gpc3。
[0281]
实施例5.抗gpc3单克隆抗体在各种癌细胞系中与细胞表面结合的gpc3的结合
[0282]
为了测量抗gpc3 1a1 mab和6a4 mab对细胞表面结合的gpc3的结合能力,使用包括hepg2、huh7、rpmi8226、h226和sk-hep-1的癌细胞系进行流式细胞术。对于1a1 mab,将每个细胞系的5
×
105个细胞与抗体(10μg/ml)在冰上共同孵育1h。细胞用含有0.1%牛血清白蛋白的pbs(pbsa)洗涤一次,并重悬于100μl pbsa中。然后加入1μl抗人igg(fc特异性)-fitc缀合物(sigma)并孵育30分钟。用pbsa洗涤细胞一次,然后用于流式细胞术分析。结果如图4a所示。
[0283]
对于6a4 mab,将hepg2细胞用胰蛋白酶消化,离心,并重悬于0.5%pbsa中以达到5
×
106个细胞/ml的密度。在每个ep管中加入90μl的细胞悬浮液。将抗gpc3 6a4 mab制备成2mg/ml的浓度,然后连续稀释2倍以获得工作溶液。igg同种型抗体用作阴性对照。在每个ep管中加入10μl如上各种工作溶液,混合后在4℃下孵育60分钟。孵育结束后,所有ep管以400g离心5分钟,用0.5%pbsa洗两次。然后,将细胞重悬于100μl0.5%pbsa中,加入2μl抗人igg(γ-链特异性)-r-藻红素抗体,并在4℃下在黑暗中孵育30分钟。用二抗孵育后,将细胞离心并清洗两次,重悬于400μl的0.5%pbsa中以进行流式细胞术。结果如图4b所示。
[0284]
从图4a可以看出,1a1 mab与hep-g2、huh7和rpmi8226结合良好,同时显示与h226和sk-hep1中等结合。从图4b可以看出,6a4 mab可以与gpc3阳性肿瘤细胞系hepg2结合。这表明1a1 mab和6a4 mab具有与gpc3阳性肿瘤细胞系结合的能力。
[0285]
实施例6.靶向gpc3和cd3的双特异性抗体与gpc3和cd3的结合亲和力
[0286]
为确定基于1a1的gpc3 x cd3 hbite和基于6a4的gpc3 x cd3hbite双特异性抗体对gpc3和cd3的结合亲和力,如实施例4中所述进行elisa,其中使用人、食蟹猴或小鼠gpc3或人cd3蛋白进行包被。结果如图5a到5d所示。
[0287]
结果表明,基于1a1的gpc3
×
cd3 hbite分别以48.56nm、41.21nm和69.84nm的ec
50
结合人、食蟹猴和小鼠gpc3(图5a),以10.8nm的ec
50
结合人cd3(图5b)。基于6a4的gpc3
×
cd3 hbite以75.2nm的ec
50
结合人gpc3(图5c),并以4.2nm的ec
50
结合人cd3(图5d)。
[0288]
这些结果表明,双特异性抗体可以结合gpc3和cd3蛋白,其亲和力适合用作bite以触发t细胞对肿瘤细胞的杀伤。
[0289]
实施例7.靶向gpc3和cd3的双特异性抗体与癌细胞系的结合
[0290]
为确定基于1a1的gpc3
×
cd3 hbite和基于6a4的gpc3
×
cd3 hbite双特异性抗体对癌细胞系的结合亲和力,使用多种表达gpc3的癌细胞系(包括hep-g2、huh7、rpmi8226、a375、5637)以及cd3阳性jurkat细胞系进行流式细胞术。程序与实施例5中描述的程序类
似。结果如图6a到6b所示。
[0291]
结果表明,基于1a1的gpc3
×
cd3 hbite与hepg2、huh7、rpmi8226和表达cd3的jurkat细胞结合良好,与a375和5637具有中等结合(图6a);而基于6a4的gpc3
×
cd3 hbite与hepg2和huh7结合良好,并与rpmi8226具有中等结合(图6b)。这表明基于1a1的gpc3
×
cd3 hbite和基于6a4的gpc3
×
cd3 hbite可以与表达gpc3的癌细胞和表达cd3的细胞结合。
[0292]
实施例8.双特异性抗体介导的体外人癌细胞系的杀伤
[0293]
双特异性t细胞衔接器可以同时与肿瘤抗原和t细胞抗原(例如t细胞表面的cd3分子)结合,导致t细胞聚集和活化,从而最终导致肿瘤细胞被的杀伤。为了评估基于1a1的gpc3
×
cd3 hbite双特异性抗体的杀伤效率,使用四种表达gpc3的细胞系hepg-2、huh7、rpmi-8226和ls174t-gpc3作为靶细胞。
[0294]
对于人肝癌细胞系hepg2和huh-7,通过使用maestro zht平台(axion biosystems)监测细胞的电阻抗来进行杀伤测定。将100μl细胞悬液(2000个细胞/孔,悬浮在rpmi 1640完全培养基中)一式三份接种到384孔板中。将板在maestro zht平台预孵育24小时。同时,复苏冷冻储存的pbmc并重悬在rpmi 1640完全培养基中。将靶细胞在培养箱中在37℃和5%co2下孵育24小时。第二天,弃去50μl培养上清液,将在25μl rpmi 1640完全培养基中的104个pbmc(靶细胞:效应细胞比=1:5)加入到每个孔中。然后,相应地将25μl抗体(从20μg/ml连续稀释5倍)加入每个孔中(最高终浓度为5μg/ml)。处理48小时后,设置终点并输出细胞电阻抗(z)数据。通过以下等式计算细胞生长的抑制:
[0295]
细胞生长抑制率(%)=(z
对照
–z实验
)/z
对照
×
100%;
[0296]
其中,z
对照
代表对照组的细胞电阻抗,z
实验
代表实验组的细胞电阻抗。
[0297]
对于人骨髓瘤细胞系rpmi8226,根据制造商的说明进行ldh和cck8测定以测试杀伤效率。将100μl细胞悬液(3
×
104个细胞/孔,悬浮在rpmi 1640完全培养基中)一式两份接种到96孔板中。同时,加入在50μl rpmi 1640完全培养基中的1.5
×
105个pbmc(靶细胞:效应细胞比=1:5)。然后,相应地向每个孔中加入50μl的5倍系列稀释的抗体溶液(从0.8μg/ml开始稀释)(最高终浓度为0.2μg/ml)。处理48小时后,将96孔板离心,收集100μl培养上清液,按照细胞毒性ldh测定试剂盒-wst的说明书检测490nm处的光密度(od)值(od490)。通过以下等式计算细胞生长的抑制:
[0298]
细胞生长抑制率(%)=(od
实验-od
低对照
)/(od
高对照-od
低对照
)
×
100%;
[0299]
其中,od
实验
代表实验组的od490值,od
低对照
代表活细胞的对照组的od490值,od
高对照
代表活细胞全部被裂解缓冲液杀死的对照组的od490值。
[0300]
同时,向每孔中剩余的细胞培养物补充100μl含有20%cck-8(终浓度为10%cck-8)的rpmi 1640完全培养基,并在co2培养箱中孵育60分钟。用酶标仪读取490nm处的光密度(od)值。通过以下等式计算细胞生长的抑制:
[0301]
细胞生长抑制率(%)=(od
对照
–
od
实验
)/od
对照
×
100%;
[0302]
其中,od
对照
代表对照组的od490值,od
实验
代表实验组的od490值。
[0303]
对于人结肠腺癌细胞系ls174t-gpc3,将100μl细胞悬液(3
×
104个细胞/孔,悬浮在rpmi 1640完全培养基中)一式两份接种到96孔板中。同时,加入在50μl rpmi 1640完全培养基中的1.5
×
105个pbmc(靶细胞:效应细胞比=1:5)。然后,相应地向每个孔中加入50μl的5倍系列稀释的抗体溶液(从0.8μg/ml开始稀释)(最高终浓度为0.2μg/ml)。48h后,每孔
hbite(对于ls174t-gpc3为25μg/kg;对于huh-7为50μg/kg)或载体对照。处理后,持续测量肿瘤大小,持续2到3周。结果如图12到13所示。
[0314]
为了评估基于6a4的gpc3
×
cd3 hbite的杀伤功效,在人源化pbmc/b-ndg模型中进行了体内抗肿瘤实验。简而言之,将1
×
106个ls174t-gpc3肿瘤细胞与1
×
106个人pbmc和corning基质胶混合,然后皮下注射到hu-pbl小鼠的右腹。从第2天(处理第1天)开始,每周3次向小鼠腹膜内注射基于6a4的gpc3
×
cd3 hbite(75μg/kg)或载体对照。处理后,持续测量肿瘤大小,持续2周。结果如图14所示。
[0315]
从图12到13可以看出,与对照组相比,施用基于1a1的gpc3
×
cd3 hbite导致ls174t-gpc3和huh-7细胞的肿瘤体积显著减小。从图14可以看出,与对照组相比,施用基于6a4的gpc3
×
cd3 hbite导致ls174t-gpc3细胞的肿瘤体积显著减小。这些结果表明,基于1a1的gpc3
×
cd3 hbite和基于6a4的gpc3
×
cd3 hbite对表达gpc3的多种癌细胞系具有强效的杀伤能力,可用于治疗多种表达gpc3的癌症。
[0316]
实施例10.抗gpc3单克隆抗体介导的对人癌细胞系的adcc杀伤
[0317]
复苏冷冻的nk细胞,并在含有20%fbs、1%青霉素/链霉素和50iu il-2的rpmi 1640完全培养基中,在37℃和5%co2下培养过夜。以hepg2细胞为靶细胞,用完全培养基稀释至2.5
×
105个细胞/ml,以100μl/孔加入96孔板,并在37℃下培养过夜。用rpmi 1640培养基将抗gpc3单克隆抗体1a1 mab和6a4 mab制备成浓度分别为400μg/ml、40μg/ml和4μg/ml,以igg同种型抗体作为阴性对照。将制备的抗体溶液以50μl/孔加入含有靶细胞的96孔板中。通过离心收集nk细胞并用完全培养基稀释至1
×
106个细胞/ml。将50μl nk细胞加入到96孔板中。抗体的最终浓度分别为100μg/ml,10μg/ml和1μg/ml。将所有培养板在37℃下孵育72小时。然后,移除原始培养基并以100μl/孔替换成含有10%cck-8的新鲜培养基。将板在37℃下孵育约30分钟,并在450nm(参考波长为630nm)处使用酶标仪测量od值。
[0318]
杀伤效率使用如下公式计算:
[0319]
细胞毒性%=(od
肿瘤+nk+0μg/ml mab
–
od
肿瘤+nk+xμg/ml mab
)/od
肿瘤+nk+0μg/ml mab
×
100%,
[0320]
其中x表示1,10或100。
[0321]
1a1 mab和6a4 mab对hepg2细胞的adcc杀伤如图15a到15b所示。结果表明,与对照组相比,1a1 mab和6a4 mab介导显著增加的对hepg2细胞的adcc杀伤,并且杀伤效率呈剂量依赖性。这表明1a1 mab和6a4 mab对表达gpc3的癌细胞系具有强效的杀伤效率。
[0322]
虽然已经示出和描述了本发明的优选实施方案,但对于本领域技术人员来说显而易见的是,这些实施方案仅作为示例提供。在不脱离本发明的情况下,本领域技术人员将想到许多变体、变化和替换。应当理解,可以采用本文描述的实施方案的各种替代方案。旨在使以下权利要求限定本发明的范围,并且覆盖这些权利要求及其等同物范围内的方法和结构。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1