包含共表达MHC和肿瘤抗原的抗原呈递细胞的组合物和使用所述组合物的癌症疗法的制作方法
包含共表达mhc和肿瘤抗原的抗原呈递细胞的组合物和使用所述组合物的癌症疗法
技术领域
1.与相关申请的交叉引用
2.本技术是基于分别于2020年1月10日和2020年10月14日提交的韩国专利申请号10-2020-0003910和10-2020-0133005并要求它们的优先权,其公开内容整体通过参考并入本文。
3.本发明涉及一种用于预防或治疗癌症的疫苗组合物,所述疫苗组合物包含在细胞表面上过表达主要组织相容性复合物(mhc)和肿瘤抗原的复合体的抗原呈递细胞,还涉及使用所述疫苗组合物的癌症疗法。
背景技术:
4.通过将肿瘤抗原装载到特化的抗原呈递细胞例如树突状细胞上,预期抗肿瘤治疗性细胞疫苗在给药到癌症患者时发挥其作为抗癌疫苗的作用。
5.然而,根据基于抗原呈递细胞的特定mhc等位基因和抗原表位的表位-mhc限制的机制,通常用于抗原装载的表位肽温育方法不可避免地在抗原呈递表位序列的范围和已在细胞中表达的特定mhc等位基因的整体抗原呈递效能及其表达水平方面受到限制。
技术实现要素:
6.技术问题
7.为了将肿瘤抗原、特别是源自于具有不同细胞特异性mhc的个体癌症患者的各种不同患者特异性新抗原应用于被标准化用于治疗目的的抗癌细胞疫苗,最终需要开发出一种用于生产克服了个体抗原呈递细胞的mhc限制的细胞疫苗的新技术,因此,本发明旨在解决这个问题。
8.一方面,提供了一种用于预防或治疗癌症的疫苗组合物,所述疫苗组合物包含在细胞表面上过表达主要组织相容性复合物(mhc)和肿瘤抗原的复合体的抗原呈递细胞。
9.另一方面,提供了一种治疗癌症的方法,所述方法包括向患者给药所述在细胞表面上过表达mhc和肿瘤抗原的复合体的抗原呈递细胞的步骤。
10.又一方面,提供了用于癌症治疗的抗原呈递细胞,所述抗原呈递细胞在其细胞表面上过表达mhc和肿瘤抗原的复合体。
11.又一方面,提供了所述抗原呈递细胞在制备用于癌症的治疗剂中的用途,所述抗原呈递细胞在其细胞表面上过表达mhc和肿瘤抗原的复合体。
12.又一方面,提供了一种制备用于预防或治疗癌症的疫苗组合物的方法,所述方法包括在抗原呈递细胞中引入共表达mhc等位基因和肿瘤抗原基因的基因构建物、包含所述基因构建物的表达载体、从所述基因构建物转录的rna转录本或从所述基因构建物、表达载体或rna转录本产生的多肽的步骤。
13.技术解决方案
14.本发明是基于下述想法,即通过使用双顺反子基因构建物或mrna转录本以最大量共表达患者的肿瘤衍生的细胞特异性mhc等位基因和肿瘤抗原,即使在标准化的特定抗原呈递细胞中也能解决“特定mhc等位基因和参比细胞表达水平对抗原呈递能力的限制”。
15.具体来说,在本发明中,将从患者肿瘤分析获得的肿瘤衍生新抗原序列和每位患者的肿瘤衍生的mhc等位基因同时在抗原呈递细胞中过表达,并在所述细胞表面上表达最大量的“表位-mhc免疫刺激复合体”,以使所述抗原呈递细胞的肿瘤抗原呈递效能最大化,并将所述复合体给药到所述患者,最终导致促进患者特异性抗癌t细胞的增殖和活化并使新抗原特异性抗癌免疫效果最大化。
16.根据本发明的一个方面,提供了一种用于预防或治疗癌症的疫苗组合物,所述疫苗组合物包含在细胞表面上过表达主要组织相容性复合物(mhc)和肿瘤抗原的复合体的抗原呈递细胞。
17.还提供了一种治疗癌症的方法,所述方法包括向患者给药所述在细胞表面上过表达mhc和肿瘤抗原的复合体的抗原呈递细胞的步骤。
18.还提供了用于癌症治疗的抗原呈递细胞,所述抗原呈递细胞在其细胞表面上过表达mhc和肿瘤抗原的复合体。
19.还提供了所述抗原呈递细胞在制备用于癌症的治疗剂中的用途,所述抗原呈递细胞在其细胞表面上过表达mhc和肿瘤抗原的复合体。
20.在一个实施方式中,所述抗原呈递细胞可以是树突状细胞。
21.在一个实施方式中,所述抗原呈递细胞可以包含:共表达mhc等位基因和肿瘤抗原基因的基因构建物;包含所述基因构建物的表达载体;或从所述基因构建物转录的rna转录本,所述rna转录本共表达所述mhc等位基因和肿瘤抗原基因;或从所述基因构建物、表达载体或rna转录本产生的多肽,由此在所述细胞表面上过表达mhc和肿瘤抗原的复合体。
22.在一个实施方式中,所述mhc可以是i类mhc或ii类mhc。
23.在一个实施方式中,所述基因构建物可以包含所述mhc等位基因的核酸序列和编码所述肿瘤抗原的核酸序列。
24.在一个实施方式中,所述mhc等位基因的核酸序列可以在其n-端处与编码β-2-微球蛋白(b2m)的序列融合。
25.在一个实施方式中,所述mhc等位基因和肿瘤抗原可以源自于待治疗的癌症患者的肿瘤细胞。
26.在一个实施方式中,所述肿瘤抗原可以包括肿瘤相关抗原(taa)、肿瘤特异性抗原(tsa)或肿瘤衍生新抗原。
27.在一个实施方式中,所述肿瘤衍生新抗原可以包含在癌细胞中特异性表达的突变。
28.在一个实施方式中,所述肿瘤相关抗原(taa)可以是gp100、melan-a/mart、mage-a、黑素瘤抗原e(mage)、mage-3、mage-4、mage-a3、酪氨酸酶、trp2、ny-eso-1、癌胚抗原(cea)、psa、p53、乳腺珠蛋白-a、生存素、muc1(黏蛋白1)/df3、金属泛激蛋白-1(mps-1)、细胞色素p450亚型1b1、90k/mac-2结合蛋白、ep-cam(mk-1)、hsp-70、htert(trt)、lea、lage-1/camel、tage-1、gage、5t4、gp70、scp-1、c-myc、周期蛋白b1、mdm2、p62、koc、imp1、rcas1、ta90、oa1、ct-7、hom-mel-40/ssx-2、ssx-1、ssx-4、hom-tes-14/scp-1、hom-tes-85、hdac5、
mbd2、trip4、ny-co-45、knsl6、hip1r、seb4d、kiaa1416、imp1、90k/mac-2结合蛋白、mdm2、ny-eso-1或lmna。
29.在一个实施方式中,所述基因构建物可以(a)以5’至3’方向包含启动子、5
’‑
utr、所述mhc等位基因的核酸序列、内部核糖体进入位点(ires)的核酸序列、编码所述肿瘤抗原的核酸序列和3
’‑
utr,或(b)以5’至3’方向包含启动子、5
’‑
utr、编码所述肿瘤抗原的核酸序列、内部核糖体进入位点(ires)的核酸序列、所述mhc等位基因的核酸序列和3
’‑
utr。在优选实施方式中,所述mhc等位基因的核酸序列可以在其n-端处与编码β-2-微球蛋白(b2m)的序列融合。
30.在一个实施方式中,所述rna转录本可以是mrna转录本。
31.在一个实施方式中,所述表达载体可以是双顺反子表达载体。
32.在一个实施方式中,所述基因构建物、表达载体、rna转录本或多肽可以通过电穿孔引入到抗原呈递细胞中。
33.在一个实施方式中,所述抗原呈递细胞可以是癌症患者的自体或同种异体抗原呈递细胞。
34.在一个实施方式中,所述疫苗可以是个性化抗癌疫苗。
35.根据本发明的另一方面,提供了一种制备用于预防或治疗癌症的疫苗组合物的方法,所述方法包括在抗原呈递细胞中引入共表达所述mhc等位基因和肿瘤抗原基因的基因构建物、包含所述基因构建物的表达载体、从所述基因构建物转录的rna转录本或从所述基因构建物、表达载体或rna转录本产生的多肽的步骤。
附图说明
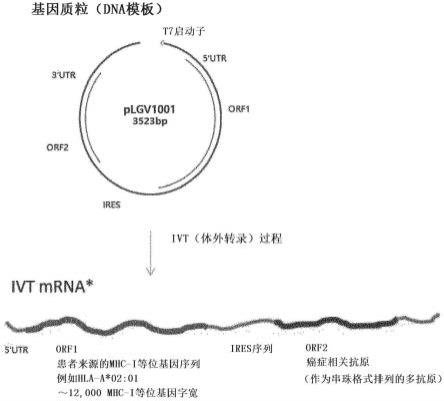
36.图1示出了根据本公开的一个实施方式,共表达i类mhc等位基因(orf1)和肿瘤抗原(orf2)的基因构建物和从其体外转录的mrna转录本的构造;
37.图2a和图2b示出了根据本公开的一个实施方式,参考模板“lgv1007”的完整序列结构;
38.图3示出了根据本公开的一个实施方式,确认从参考模板“lgv1007”的体外转录得到的mrna转录本产生的电泳结果;
39.图4a、4b和4c示出了根据本公开的一个实施方式,在用lgv1007mrna转录本以每1x106个细胞0μg、3μg、5μg或10μg的量电穿孔k562细胞后的9天中,检查hla-a*0201分子的表达水平的结果,以便推导在用lgv1007 mrna转录本电穿孔k562细胞后所述表达水平达到最高水平的条件;
40.图5示出了根据本公开的一个实施方式,在lgv1007 mrna转录本的体外翻译后确认来自于肿瘤抗原的蛋白质表达的western印迹分析的结果;
41.图6(a)示出了根据本公开的一个实施方式,在用lgv1007 mrna转录本电穿孔k562细胞后用于确认来自于i类mhc等位基因(orf1)的蛋白质表达的western印迹分析的结果,并且图6(b)示出了用于确认来自于肿瘤抗原(orf2)的完整蛋白质表达的western印迹分析的结果;
42.图7示出了在用lgv1007 mrna转录本电穿孔k562细胞后24小时,用于确认k562细胞表面上lgv1007 mrna转录本的表达水平的流式细胞术的结果;
43.图8示出了通过用lgv1007 mrna转录本电穿孔的k562抗原呈递细胞测量pbmc t细胞的免疫活性的elispot ifnγ释放测定法的结果;
44.图9示出了lgv1032 mrna转录本的构造图和在个性化单核细胞衍生的树突状细胞(modc)中的细胞表达的结果,其中lgv1032具有与lgv1007同源的双顺反子转录本构造,维持orf2(肿瘤抗原部分),并具有gfp报告蛋白作为位于orf1中的细胞表达标志物,并且lgv1032像lgv1007一样,在电穿孔到细胞中之后即使在个体衍生的自体树突状细胞中也有效表达;和
45.图10示出了elispot ifnγ释放测定法的结果,所述结果显示电穿孔到个体衍生的自体树突状细胞中的lgv1032通过有效抗原呈递促进抗原特异性t细胞免疫活性。
具体实施方式
46.在后文中会更详细地描述本发明。
47.本公开的一个实施方式涉及一种共表达mhc和肿瘤抗原的核酸分子。
48.此外,本公开的一个实施方式涉及一种共表达所述mhc和肿瘤抗原的核酸组合物。
49.此外,本公开的一个实施方式涉及一种共表达所述mhc和肿瘤抗原的基因构建物。
50.此外,本公开的一个实施方式涉及一种从所述共表达mhc和肿瘤抗原的基因构建物转录的rna转录本。
51.此外,本公开的一个实施方式涉及在细胞表面上过表达所述mhc和肿瘤抗原的复合体的抗原呈递细胞,以及用于预防或治疗癌症的疫苗组合物,所述疫苗组合物包含所述抗原呈递细胞。
52.术语“核酸”、“核酸分子”或“核酸序列”是指dna或rna分子或序列,并且“核酸组合物”是指包含所述核酸、核酸分子或核酸序列的组合物。
53.术语“基因构建物”是指可操作连接以表达编码靶蛋白的基因插入片段的核酸构建物。在一个实施方式中,所述基因构建物可以是线性或环状的单链或双链dna、cdna或rna,其作为双顺反子转录本编码两个或更多个靶蛋白。所述基因构建物可以形成可用于转化或转染宿主的载体的一部分,但不限于此,并且所述基因构建物本身可以在体外转录和/或翻译。
54.术语“可操作连接”是指核酸序列之间的功能连接。例如,编码序列(例如编码靶蛋白的序列)可以被可操作连接到适合的控制元件,以允许其复制、转录和/或翻译。例如,当启动子指导编码序列的转录时,所述编码序列被可操作连接到所述启动子。所述控制元件不必与所述编码序列毗邻,只要它们正确起作用即可。例如,在启动子序列与编码序列之间可能存在居间的非翻译但仍转录的序列,并且所述启动子仍可被认为是“可操作连接”到所述编码序列。
55.所述基因构建物中的相应组分必须彼此可操作连接,并且这些组分序列的连接可以通过在方便的限制性酶位点处连接来进行,并且当这种位点不存在时,所述连接可以根据常用方法使用合成寡核苷酸接头或连接物来进行。
56.可互换的术语“双顺反子”或术语“多顺反子”是指一种系统,在所述系统中即使在真核细胞中的mrna内,核糖体也能合成多肽,因此能够从单一mrna合成多种蛋白质。在本公开的一个实施方式中,所述基因构建物被设计成从单一mrna同时表达编码所述mhc等位基
因的核酸序列和编码所述肿瘤抗原的核酸序列。
57.一般来说,原核细胞具有能够通过在单一mrna的多个位点处结合核糖体而一次合成几种蛋白质的多顺反子系统,而真核细胞原则上具有通过从一个启动子产生一个mrna并且仅翻译所述基因来合成单一多肽的单顺反子系统。然而,本公开的基因构建物能够在真核细胞中从单一mrna表达几种多肽,例如,它能够通过将基因放置在每个启动子之后来表达每个基因,或者通过在两个基因之间放置内部核糖体进入位点(ires)而在一个启动子下同时表达所述两个基因。
58.当在本文中使用时,“包含(指定的组分)”可以意味着其可以包含除所列组分之外的其他组分(“包含”)或者其可以基本上包含所列组分(“基本上由
……
组成”)。
59.术语“主要组织相容性复合物(mhc)”是将抗原片段呈递到免疫细胞以区分自体和非自体分子的一种蛋白质。存在i类mhc和ii类mhc两种类型。i类mhc存在于所有有核细胞中,而ii类mhc存在于抗原呈递细胞中。本文提供的技术精神适用于i类mhc和ii类mhc两者。
60.一般来说,在适应性免疫应答中,当病原体或抗原进入身体时,抗原呈递细胞摄取它们并将它们分解成短肽片段。所述肽与细胞内的i类mhc或ii类mhc分子结合,以转运到细胞表面。正如所述,当所述病原体或抗原的肽与i类mhc或ii类mhc结合以在抗原呈递细胞的细胞表面上呈递时,t细胞通过t细胞受体(tcr)识别它们并被激活,以启动免疫应答。就此而言,所述病原体或抗原的肽对应于t细胞的“表位”。
61.人类mhc被称为人类白细胞抗原(hla),并且i类mhc(或i类hla)分子包括hla-a、hla-b和hla-c。i类mhc分子由α多肽链和β-2-微球蛋白组成。i类mhc分子与cd8+细胞毒性t细胞相互作用,并在器官移植排斥或被感染细胞的破坏中发挥重要作用。
62.ii类mhc(或ii类hla)分子包括hla-dr、hla-dq和hla-dp。ii类mhc分子由α多肽链和β多肽链组成。ii类mhc分子在通过与cd4+辅助性t细胞的相互作用识别非自身抗原以诱导细胞免疫中发挥重要作用。
63.编码mhc的基因是具有高度多态性的基因,并存在许多不同的等位基因以诱导针对各种不同病原体或抗原的免疫应答。例如,截至2020年1月,在人类中已报道的i类hla等位基因的数目为18,000或更多,已报道的ii类hla等位基因的数目为7,000或更多。根据个体基因位点,报告了5,735个hla-a、7,053个hla-b、5,653个hla-c、2,676个hla-drb1、771个hla-dqb1 1、1,519个hla-dpb1等(www.ebi.ac.uk/imgt/hla/)。相对常见的等位基因的实例是hla-a*2402、hla-a*3303、hla-a*0201、hla-a*1101、hla-a*0206、hla-a*3101、hla-a*0207、hla-a*2601、hla-a*2602、hla-a*3001、hla-a*0101、hla-a*3004、hla-a*0203、hla-a*0301、hla-a*0205、hla-a*0215n、hla-a*2408、hla-a*2420、hla-a*2610、hla-a*2901、hla-a*2603、hla-a*3201、hla-b*5101、hla-b*1501、hla-b*4403、hla-b*3501、hla-b*5801、hla-b*4601、hla-b*5401、hla-b*1302、hla-b*2705、hla-b*0702、hla-b*4006、hla-b*4801、hla-b*4001、hla-b*5502、hla-b*1301、hla-b*4002、hla-b*5201、hla-b*5901、hla-b*1401、hla-b*3901、hla-b*6701、hla-b*0801、hla-b*1507、hla-b*1518、hla-b*3701、hla-b*3802、hla-b*0705、hla-b*1538、hla-b*3511、hla-b*4003、hla-b*4402、hla-b*5001、hla-b*5102、hla-b*5601、hla-b*1502、hla-b*1511、hla-b*1527、hla-b*3503、hla-b*4701、hla-b*5605、hla-b*570、hla-cw*0102、hla-cw*0304、hla-cw*1402、hla-cw*0702、hla-cw*0801、hla-cw*0401、hla-cw*0302、hla-cw*0303、hla-cw*1403、hla-cw*0602、hla-cw*0701、hla-cw*1202、
hla-cw*0802、hla-cw*0202、hla-cw*0704、hla-cw*1203、hla-cw*0501、hla-cw*1505、hla-cw*0103、hla-cw*1502、hla-cw*1507等,但本公开不限于此。此外,由于hla基因在6号染色体的短臂上的位置彼此靠近,仅跨越4兆碱基,因此它们具有孩子从父母各继承一个单倍型的特征。
64.在一个优选实施方式中,所述mhc等位基因可以是i类mhc等位基因或ii类mhc等位基因。
65.在一个优选实施方式中,所述mhc等位基因可以源自于靶患者的肿瘤。
66.在一个优选实施方式中,所述基因构建物包含所述mhc等位基因的核酸序列和编码所述肿瘤抗原的核酸序列。
67.此外,所述编码mhc等位基因的核酸序列可以在其n-端处与编码β-2-微球蛋白(b2m)的序列融合,这可能在所述mhc等位基因在抗原呈递细胞中表达时有助于细胞表面上的结构稳定性。b2m是一种约12kda的非糖基化蛋白质,其作用是使mhc、特别是i类mhc的α多肽链稳定。人类b2m基因编码一种119个氨基酸的蛋白质,其中20个n-端氨基酸编码前导序列。成熟蛋白含有99个氨基酸。所述基因包含4个外显子和3个内含子,其中外显子1包含5’非翻译区、整个前导序列和成熟肽的前两个氨基酸,外显子2编码大部分成熟蛋白,外显子3编码成熟蛋白的最后四个氨基酸和终止密码子,外显子4含有3’非翻译区。在此,通过与b2m融合可以提高所述肽在mhc分子上的稳定性,并且可以提高当在抗原呈递细胞中表达时在所述细胞表面上的结构稳定性。
68.所述编码b2m的序列可以包含对应于整个人类β-2-微球蛋白基因的核酸残基的全部或一部分。
69.作为在肿瘤(癌症)中表达的抗原的术语“肿瘤抗原”或“癌抗原”是指引发免疫应答的分子。所述免疫应答可以涉及抗体产生或具有免疫能力的特定细胞的活化或它们两者。
70.所述肿瘤抗原可以源自于带有肿瘤的生物体、灭活或失活的完整肿瘤细胞或裂解物,并包括源自于肿瘤的任何抗原。所述裂解物是指从施加引起细胞正常结构的破坏的过程而产生的物质。此外,所述肿瘤抗原包括肿瘤细胞中含有的并与正常细胞差异表达的具有抗原性质的任何蛋白质或其他物质。
71.例如,所述肿瘤抗原包括肿瘤相关抗原(taa)和肿瘤特异性抗原(tsa)。
72.作为在癌细胞中以比在正常细胞中更高的水平表达或在与正常细胞不同的分化阶段中表达的抗原的肿瘤相关抗原(taa),是也以低水平存在于正常细胞中的肿瘤共有抗原。因此,使用taa的免疫应答极有可能受到自身耐受的阻碍,所述自身耐受是一种防止对自身细胞的破坏或相反由于自身免疫而攻击不需要的器官的免疫抑制机制。
73.所述肿瘤相关抗原(taa)的实例可以包括gp100、melan-a/mart、mage-a、黑素瘤抗原e(mage)、mage-3、mage-4、mage-a3、酪氨酸酶、trp2、ny-eso-1、癌胚抗原(cea)、psa、p53、乳腺珠蛋白-a、生存素、muc1(黏蛋白1)/df3、金属泛激蛋白-1(mps-1)、细胞色素p450亚型1b1、90k/mac-2结合蛋白、ep-cam(mk-1)、hsp-70、htert(trt)、lea、lage-1/camel、tage-1、gage、5t4、gp70、scp-1、c-myc、周期蛋白b1、mdm2、p62、koc、imp1、rcas1、ta90、oa1、ct-7、hom-mel-40/ssx-2、ssx-1、ssx-4、hom-tes-14/scp-1、hom-tes-85、hdac5、mbd2、trip4、ny-co-45、knsl6、hip1r、seb4d、kiaa1416、imp1、90k/mac-2结合蛋白、mdm2、ny-eso-1或lmna,
但不限于此。
74.肿瘤特异性抗原(tsa)是指仅特异性存在于癌细胞中的抗原。具体来说,当肿瘤在癌症患者中生长时,发生癌细胞特异性基因突变并产生刺激t细胞的新的抗原表位,其被称为新抗原。换句话说,新抗原含有癌细胞特异性基因突变,并且仅在癌细胞中选择性表达,其不同于甚至在正常细胞中也以低水平表达的肿瘤共有抗原。因此,所述新抗原被自身免疫系统识别为非自身的外来表位,并诱导强烈的抗癌免疫活性。
75.当从突变的dna产生的肽被展示在细胞表面上的mhc i上时,t-细胞受体(tcr)识别所述肽。由于在正常细胞或组织中不发生突变,因此新抗原特异性t细胞没有自身耐受或自身免疫问题。由于这些优点,新抗原被认为是基于t-细胞的癌症免疫疗法的理想靶点。
76.所述新抗原由移码缺失或插入(其中组成dna的一个或多个核苷酸被添加或缺失,导致密码子阅读框移位)、由一个核苷酸被另一个核苷酸替换引起的点突变、其他剪接位点突变、通读突变或基因融合突变等引起,但不限于此。
77.新抗原通过个体癌症患者的特定癌细胞基因组分析来预测。例如,从患者的肿瘤获得癌细胞,从其提取dna,然后进行测序分析。将所述序列与正常细胞的核酸序列进行比较,以选择已发生突变的部分。然后可以在几个突变的核酸序列中鉴定出刺激t细胞的新抗原。就此而言,可以使用大数据处理例如下一代基因测序(ngs)、全外显子组测序(wes)或rna测序、mhc结合预测计算机程序或用于新抗原预测的人工智能(ai),但不限于此。由于在患者之间不共享突变,因此可以产生用于个性化抗癌疫苗(个性化癌症疫苗)的新抗原。
78.术语“装载或脉冲”意味着抗原呈递细胞(apc)例如树突状细胞捕获并降解抗原,通过将所述抗原装载到mhc分子上而在表面上展示它们。正如所述,装载有抗原的细胞可以诱导强烈的抗原特异性t淋巴细胞活性。
79.所述基因构建物可以包含允许所述基因在所选宿主中表达的转录和翻译表达控制序列。所述表达控制序列可以包括用于执行转录的启动子、用于控制此类转录的随机操纵基因序列和/或用于控制转录和翻译的终止的序列。起始密码子和终止密码子通常被认为是编码靶蛋白的核酸序列的一部分。它们必需在所述基因构建物被给药到的个体中有功能。起始密码子和终止密码子必须与编码序列同框。
80.例如,所述基因构建物可以(a)以5’至3’方向包含启动子、5
’‑
utr、编码所述mhc等位基因的核酸序列、内部核糖体进入位点(ires)的核酸序列、编码所述肿瘤抗原的核酸序列和3
’‑
utr,或(b)以5’至3’方向包含启动子、5
’‑
utr、编码所述肿瘤抗原的核酸序列、内部核糖体进入位点(ires)的核酸序列、编码所述mhc等位基因的核酸序列和3
’‑
utr。
81.术语“启动子”是指与转录调控物结合的dna序列位点。对于本发明的目的而言,可以使用能够诱导强且稳定的基因表达的启动子来提高基因表达率。
82.所述启动子可以是组成型或诱导型的。所述启动子的实例可以包括但不限于腺病毒早期和晚期启动子、猿猴病毒40(sv40)、小鼠乳腺肿瘤病毒(mmtv)启动子、hiv长末端重复序列(ltr)启动子、莫洛尼病毒、巨细胞病毒(cmv)启动子、epstein barr病毒(ebv)启动子、劳斯肉瘤病毒(rsv)启动子、rna聚合酶
±
启动子、t3和t7启动子、λ噬菌体的主要操纵基因和启动子区等。
83.术语“5
’‑
utr”或“5
’‑
非翻译区”是指存在于mrna转录本的5
’‑
端处但不翻译成氨基酸的区域。在基因组序列中,5
’‑
utr通常被定义为转录起始位点与起始密码子之间的区
域。脊椎动物mrna的5
’‑
utr的长度可以从几十个碱基直至几百个碱基不等。mrna翻译成蛋白质始于30s核糖体亚基与所述5
’‑
utr的结合。具体来说,当30s核糖体亚基中的16s核糖体rna(16s rrna)结合到5
’‑
utr的核糖体结合位点(rbs),并且trna识别并结合到mrna的起始密码子(aug)时,开始向蛋白质的翻译。所述5
’‑
utr的核糖体结合位点和起始密码子的位置相隔大约6至8个核苷酸,并且在所述核糖体结合位点中存在与16s rrna的3
’‑
末端互补的序列,其被称为shine-dalgarno序列。
84.术语“ires”或“内部核糖体进入位点”是指在转录本翻译过程中被核糖体识别为翻译过程的起点的核酸序列。换句话说,ires是mrna内与核糖体直接结合的特定区域,使得能够在真核细胞中从单一mrna合成多个多肽,并用于使本公开的基因构建物成为双顺反子。也就是说,在翻译期间,位于所述ires的5’部分上的多肽编码序列从5
’‑
末端处的帽结构开始翻译,而位于所述ires的另一侧上的多肽编码序列通过核糖体亚基结合到所述ires来翻译。因此,可以分别获得几种多肽。
85.所述ires可以天然或合成得到,并且可以源自于病毒例如脊髓灰质炎病毒、emc病毒等,或者可以源自于细胞例如免疫球蛋白重链结合蛋白(bip)或果蝇的触角足基因(antp)等,但不限于此。
86.术语“3
’‑
utr”或“3
’‑
非翻译区”是指存在于mrna转录本的3
’‑
端处但不翻译成氨基酸的区域。
87.此外,所述基因构建物可以适合地包含接头或连接物、增强子、可选择标记(例如抗生素抗性标记)、复制单元、polya序列、纯化用标签(例如gst、poly-arg、flag、组氨酸标签(his标签)或c-my等)或已知调控原核或真核细胞或病毒的基因表达的其他结构和诱导序列及其各种不同组合等。
88.此外,本公开涉及一种从上述基因构建物转录的rna转录本,所述rna转录本共表达所述mhc等位基因和肿瘤抗原。所述rna转录本同时翻译并合成所述mhc等位基因和肿瘤抗原,因而所述rna转录本是双顺反子。
89.所述rna转录本可以是mrna转录本,并且可以在细胞中在从上述基因构建物转录之后分离和纯化,并且优选地,它可以通过体外转录方法体外转录。
90.此外,本公开涉及一种包含所述基因构建物的双顺反子表达载体。术语“载体”是指包含可操作连接的必需调控因子以在个体的细胞中表达编码靶蛋白的基因插入片段的基因构建物,并且可以使用各种不同类型的载体例如质粒、病毒载体、噬菌体载体、粘粒载体等。
91.所述表达载体和rna转录本的每个组分的描述用上述基因构建物的每个组分的描述代替。
92.另一个实施方式涉及一种从所述基因构建物、包含所述基因构建物的表达载体或从所述基因构建物转录的rna转录本产生的多肽。
93.又一个实施方式涉及一种用于共表达所述mhc等位基因和肿瘤抗原基因的组合物,所述组合物包含上述基因构建物、包含所述基因构建物的表达载体、从所述基因构建物转录的rna转录本或从所述基因构建物、表达载体或rna转录本产生的多肽。
94.此外,又一个实施方式涉及抗原呈递细胞,其包含所述基因构建物、包含所述基因构建物的表达载体、从所述基因构建物转录的rna转录本或从所述基因构建物、表达载体或
rna转录本产生的多肽。
95.此外,又一个实施方式涉及一种制备用于预防或治疗癌症的疫苗组合物的方法,所述方法包括在抗原呈递细胞中引入所述基因构建物、包含所述基因构建物的表达载体、从所述基因构建物转录的rna转录本或从所述基因构建物、表达载体或rna转录本产生的多肽的步骤。
96.术语“抗原呈递细胞”是指通过促进针对抗原(例如肿瘤抗原)的免疫应答的增强来实现本公开的目的的任何细胞。所述抗原呈递细胞包括树突状细胞(dc)、巨噬细胞或b细胞。所述抗原呈递细胞可以是自体(来自于癌症患者)或同种异体的。术语“自体”是指从个体获得并用于治疗同一个体的细胞,术语“同种异体”是指从同一物种的另一个体获得的细胞。
97.树突状细胞(dc)是身体中最强类型的抗原呈递细胞,能够吞噬外来抗原并将它们呈递到幼稚(cd4+或cd8+t)和记忆t细胞。树突状细胞通常通过微胞饮作用和/或胞吞作用摄取抗原,然后对这些抗原进行细胞内加工,并将所述抗原呈递给免疫系统的t细胞。这种加工通常在体内发生。或者,在从身体分离树突状细胞、在体外培养所述树突状细胞并向体外培养的树突状细胞提供抗原后,允许所述细胞与t细胞相互作用。可以将所述细胞返回到体内,这可以唤起对感兴趣的抗原的提高的免疫应答。将所述抗原提供给树突状细胞的过程通常被称为装载或脉冲或共培养。
98.在特定实施方式中,从靶患者或相同或不同物种的个体获得树突状细胞的前体细胞,将其分化成树突状细胞,然后可以向其引入上述基因构建物、rna转录本、表达载体或多肽。例如,可以通过从将要用疫苗给药的患者的血液分离的单核细胞的分化来获得树突状细胞。用于从单核细胞分化树突状细胞的技术在本领域中已被确立。作为非限制性实例,在经典方案中,可以通过密度梯度离心从全血分离外周血单核细胞(pbmc),并且可以利用单核细胞的贴壁性或免疫磁珠来进行单核细胞从pbmc的分离。可以将分离的单核细胞在gm-csf和il-4存在下培养,以分化成不成熟的树突状细胞。可以将不成熟的树突状细胞在成熟因子、通常为tlr-4激动剂例如lps存在下进行培养,或使用含有tnfα、il-6、il-1β和pge2的单核细胞成熟混合物进行培养和成熟。树突状细胞的成熟和载体的引入可以同时进行。
99.所述基因构建物、rna转录本或表达载体在细胞中的引入可以使用本领域中已知的适合的标准技术来进行,例如电穿孔、电注射、显微注射、磷酸钙共沉淀、氯化钙/氯化铷法、反转录病毒感染、deae-葡聚糖、阳离子脂质体法、聚乙二醇介导的摄取、基因枪等,但不限于此。此时,载体可以通过用适合的限制酶消化环状构建物而以线性化形式引入。
100.在优选实施方式中,所述基因构建物、rna转录本、表达载体或多肽可以通过电穿孔引入。电穿孔是指对细胞施加电流或电场以促进不可渗透的材料进入所述细胞。例如,当将细胞悬浮在含有待引入的不可渗透的物质(例如核酸、载体等)的溶液中并使dc高压脉冲通过它时,通过电在所述细胞膜中产生孔,并且同时,所述不可渗透的物质可以通过电泳作用引入到所述细胞中。电穿孔装置可以是静态型电穿孔装置或流动型电穿孔装置。静态型电穿孔装置包含专用电转杯,其中含有与固定体积的靶细胞流体接触的模制电极。将感兴趣的分子放置在两个电极之间并用高压脉冲。
101.又一个实施方式涉及一种用于预防或治疗癌症的疫苗组合物,所述疫苗组合物包含上述基因构建物、rna转录本、表达载体或多肽,还涉及所述疫苗组合物的制备方法。
102.又一个实施方式涉及一种用于预防或治疗癌症的疫苗组合物,所述疫苗组合物包含其中引入有上述基因构建物、rna转录本、表达载体或多肽的抗原呈递细胞,还涉及所述疫苗组合物的制备方法。
103.又一个实施方式涉及一种用于预防或治疗癌症的疫苗组合物,所述疫苗组合物包含在细胞表面上过表达所述mhc等位基因和肿瘤抗原的复合体的抗原呈递细胞,还涉及所述疫苗组合物的制备方法。
104.术语“疫苗”是指包含根据本公开的抗原呈递细胞的制剂,其可以给药到受试者。因此,本发明的疫苗组合物可以方便地用于预防、改善或治疗疾病。在引入到受试者或宿主中后,所述疫苗能够引发免疫应答,包括但不限于产生抗体、细胞因子和/或其他细胞应答。
105.在优选实施方式中,所述mhc等位基因和肿瘤抗原可以源自于将要用所述组合物给药的靶癌症患者的肿瘤细胞。
106.本公开的癌症疫苗组合物可以在抗原呈递细胞(apc)中同时过表达从患者肿瘤分析获得的肿瘤抗原序列、特别是新抗原序列和源自于每位患者的肿瘤的mhc等位基因,从而在所述细胞表面上表达最大量的抗原(或表位)-mhc免疫刺激复合体,以使apc的肿瘤抗原呈递效能最大化。最终,所述癌症疫苗组合物可以尽可能多地刺激患者特异性抗癌t细胞的增殖和激活,从而增强抗癌免疫效果。
107.具体来说,包含在本公开的癌症疫苗组合物中的抗原呈递细胞(例如树突状细胞)可以同时过表达所述mhc等位基因和肿瘤抗原,由此所述mhc等位基因和肿瘤抗原彼此组合,在所述抗原呈递细胞的表面上表达,并且所述抗原可以被呈递给t淋巴细胞。结果,当t淋巴细胞被激活时,强烈的癌症特异性细胞毒性t淋巴细胞(ctl)被诱导,破坏癌细胞,从而免疫治疗癌症。此外,在抗原呈递细胞(例如树突状细胞)上丰富表达的共刺激物质在t淋巴细胞受体与抗原-mhc复合体之间的反应中发挥重要作用,并分泌几种参与t淋巴细胞分化、生长或流入的细胞因子,以调控免疫应答的活性。因此,所述疫苗组合物可以被有用地应用于抗癌免疫疗法。
108.本公开的疫苗组合物可以包含另外的佐剂以增强所述疫苗的有效性。适合的佐剂包括(1)铝盐(明矾),例如氢氧化铝、磷酸铝、硫酸铝等;(2)水包油乳液制剂(含有或不含其他特异性免疫刺激剂如胞壁酰肽或细菌细胞壁组分),例如(a)mf5(wo90/14837),其含有5%角鲨烯、0.5%tween 80和0.5%span 85(任选地含有不同量的n-乙酰胞壁酰基-l-丙氨酰基-d-异谷氨酰胺基-l-丙氨酸-2-(1'-2'-二棕榈酰基-sn-甘油-3-羟基磷酰氧基)-乙胺(mtp-fe)),被配制成亚微米粒子,(b)saf,其含有10%角鲨烯、0.4%tween 80、5%普朗尼克嵌段聚合物和n-乙酰胞壁酰基-l-苏氨酰基-d-异谷氨酰胺(thr-mdp),被微流化成亚微米粒子或涡旋振荡以产生更大粒径的乳液,和(c)ribi
tm
佐剂系统(ras),其含有选自单磷脂a(mpl)、海藻糖二霉菌酸酯(tdm)和细胞壁骨架(cws)的一种或多种细菌细胞壁组分、2%角鲨烯和0.2%tween 80;(3)皂苷佐剂;(4)完全弗氏佐剂(cfa)和不完全弗氏佐剂(ifa);(5)细胞因子,例如白细胞介素(例如il-1、il-2、il-4、il-5、il-6、il-7、il-12等)、干扰素(例如γ干扰素)、巨噬细胞集落刺激因子(m-csf)、肿瘤坏死因子(tnf)等;(6)细菌adp-核糖基转移酶毒素,例如霍乱毒素(ct)、百日咳毒素(pt)或大肠埃希氏杆菌热不稳定毒素(lt),特别是lt-r72、ct-s109、pt-k9/g129的脱毒突变体(wo93/13302和wo92/19265);和(7)其他充当佐剂以增强疫苗有效性的材料,但不限于此。
109.所述疫苗组合物可以包含常用盐水、或者悬浮或溶解的缓冲水性溶液介质。例如,它通常可以包含稀释剂,例如水、盐水、甘油、乙醇等。辅助物质例如润湿剂、乳化剂、ph缓冲剂等可以存在于所述组合物中。
110.适合于注射的制剂包括无菌水性溶液(水溶性)或分散系和用于临时制备无菌注射溶液或分散系的无菌粉剂。它们必须在制造条件下稳定,并且必须被防腐以对抗微生物例如细菌和真菌的污染作用。微生物污染可以通过各种不同的抗细菌或抗真菌剂例如对羟基苯甲酸酯、氯丁醇、苯酚、抗坏血酸、硫柳汞等来防止。在许多情况下,优选地包含等渗剂例如糖或氯化钠。通过在可注射组合物中使用延迟吸收的试剂例如单硬脂酸铝或明胶来引起所述组合物的延长吸收。
111.无菌可注射溶液可通过下述方法制备:在上述溶剂中并入所需量的抗原呈递细胞和在需要时上面列出的各种不同其他组分,然后对除了抗原呈递细胞和/或热敏感的佐剂细胞因子等之外的其余组分例如缓冲溶液如pbs进行过滤除菌。通常,分散系通过将各种不同的已除菌活性组分并入到无菌媒介物中来制备,所述媒介物含有基础分散介质和来自于上文所述的那些成分的所需其他成分。在用于制备无菌可注射溶液的无菌粉剂的情况下,优选的制备方法是真空干燥和冷冻干燥,其从先前的无菌过滤溶液产生活性成分和任何其他所需成分的粉末。
112.不以任何方式限制本发明的作用,根据本发明的树突状细胞的递送对于诱导免疫应答,特别是诱导细胞毒性t-淋巴细胞对抗原的应答来说特别有用。所述免疫应答可以是特异性(t细胞和/或b细胞)和/或非特异性免疫应答。
113.因此,本发明的又一方面涉及一种在人类、特别是癌症患者中建立、诱导或促进对抗原的免疫应答的方法,所述方法包括向癌症患者给药有效量的上述疫苗组合物或抗原呈递细胞。
114.所述免疫应答优选地包括细胞毒性t-淋巴细胞应答,并且本发明的细胞毒性淋巴细胞应答可以独立地或与辅助性t-细胞应答、体液应答或其他特异性或非特异性免疫应答一起发生。
115.本发明的又一方面涉及本发明的树突状细胞与疾病状态的治疗和/或预防相关的用途。可以按照本发明的方法治疗的疾病的实例包括各种不同的癌症疾病和难治性癌症疾病。
116.所述疾病可以是例如实体癌或血液癌。其非限制性实例可以包括乳腺癌、肺癌、前列腺癌、卵巢癌、脑癌、肝癌、宫颈癌、子宫内膜癌、子宫癌、结肠癌、结肠直肠癌、结肠直肠癌、直肠癌、肾癌、肾母细胞瘤、皮肤癌、口腔鳞状细胞癌、表皮癌、鼻咽癌、头颈癌、骨癌、食道癌、膀胱癌、淋巴癌(例如霍奇金淋巴瘤或非霍奇金淋巴瘤)、胃癌、胰腺癌、睾丸癌、甲状腺癌、滤泡癌、黑素瘤、骨髓瘤、多发性骨髓瘤、间皮瘤、骨肉瘤、骨髓增生异常综合征、间质起源的肿瘤、软组织肉瘤、脂肪肉瘤、胃肠道间质瘤、恶性周围神经鞘瘤(mpnst)、尤文氏肉瘤,平滑肌肉瘤、间充质软骨肉瘤、淋巴肉瘤、纤维肉瘤、横纹肌肉瘤、畸胎瘤、成神经细胞瘤、成髓细胞瘤、神经胶质瘤、良性皮肤肿瘤或白血病。所述肺癌可以是例如小细胞肺癌(sclc)或非小细胞肺癌(nsclc)。所述白血病可以是例如急性髓系白血病(aml)、慢性髓系白血病(cml)、急性淋巴细胞性白血病(all)或慢性淋巴细胞性白血病(cll)。待治疗的受试者可以是接受二线抗过度增殖疗法的受试者。例如,所述二线抗过度增殖疗法可以是化学
疗法、放射疗法、免疫疗法、光疗法、冷冻疗法、毒素疗法、激素疗法或手术。
117.因此,本发明的又一方面提供了一种通过使用所述癌症疫苗组合物增强肿瘤特异性免疫应答来治疗癌症的方法。在这里,所述组合物的给药引起、诱导或以其他方式促进抑制、停止、延迟或阻止疾病状态的发作或进展的免疫应答。
118.所述组合物的直接递送通常可以是全身、皮下、真皮内、腹膜内、血管内(静脉内)、肌肉内或局部递送,或通过间质组织递送。所述组合物也可以给药到病变部位。给药方案可以是单剂或多剂方案。
119.术语“有效量”是指当给药到个体、包括人类时足以实现所需结果的量,例如有效治疗或预防癌症的量。所述有效量可以随着多种因素例如个体的疾病状态、年龄、性别、体重等而变。正如本领域技术人员会理解的,可以对剂量或治疗方案进行调整以提供最佳治疗反应。
120.使用治疗有效量的个体治疗方案可以由单次给药组成,或者在其他情况下可以包括一系列施用。治疗时长取决于各种不同因素,例如疾病的严重程度、个体的年龄、癌症疫苗的浓度、患者对癌症疫苗的响应性或其组合。还应该认识到,在个体的治疗方案过程中用于治疗的癌症疫苗的有效剂量可以提高或降低。通过本领域中已知的标准诊断测定法,剂量的变化可以发生并且将是显而易见的。在某些情况下,本发明的癌症疫苗可以在使用常见抗癌剂、放疗、激素疗法、生物疗法和/或肿瘤手术切除的治疗之前、期间或之后给药。
121.实施方式的详细描述
122.在后文中,将参考下述示例性实施方式更详细地描述本发明。然而,这些实施方式仅仅是为了说明本发明,本发明的范围不受这些示例性实施方式限制。
123.实施例1.双顺反子表达载体的制备
124.用于共表达i类mhc等位基因和肿瘤抗原的双顺反子载体的构造如图1中所示,具体来说,所述双顺反子载体包含基因构建物,其以5’至3’方向包含5’utr-orf1(包含重组b2m和i类mhc等位基因的融合体的开放阅读框;详细来说是在n-端处包含b2m并在c-端处包含肿瘤衍生的i类mhc等位基因的融合蛋白的编码序列)-ires-orf2(由多抗原表位以串珠格式组成的重组蛋白的编码序列)-3’utr。具体来说,参考模板被命名为“lgv1007”,并具有以n-端至c-端方向包含信号序列、b2m和hla-a*0201的融合蛋白(seq id no:1)的编码序列作为orf1,和包含ny-eso1、mage-a3、生存素、multi-mage-a和melan-a的共有抗原重组蛋白(seq id no:2)的编码序列作为orf2。lgv1007的整个序列结构如图2中所示,并且lgv1007的包含从5’末端处的bamhi到3’末端处的xbai限制性酶位点的整个dna序列(3,523bp)示出在seq id no:3中,并且要求并提供其基因合成(geneart,thermo fisher)。然而,lgv1007仅仅是根据本公开的一个实施方式的代表性实例,并且可以改变orf1和orf2的核酸序列,以包含如上所述为个体癌症患者定制的自体序列,并且除了orf1和orf2之外的核酸序列可以使用本领域中广泛已知的序列针对抗原呈递进行优化和标准化。
125.实施例2.使用体外转录(ivt)产生mrna转录本
126.为了产生双顺反子mrna转录本,通过使用限制性酶xbal消化,将在实施例1中得到的双顺反子载体(dna质粒载体)线性化,并使用expin
tm combo gp试剂盒(geneall,112-102)纯化所述线性化的dna。使用mmessage mmachine
tm t7 ultra转录试剂盒(thermofisher),按照制造商的说明书通过体外转录(ivt)将所述纯化的线性化质粒模板
用于mrna生产。最后使用licl沉淀法纯化得到的mrna转录本。详细来说,将mrna产物与licl沉淀溶液(每20μl ivt反应50μl)轻轻混合,并在-20℃温育30min或更长时间。接下来,通过在4℃以20,000
×
g离心14分钟,将样品沉积下来。然后将沉积物用70%乙醇洗涤。将最终的mrna产物重悬浮在无核酸酶的去离子水中。使用nanodrop2000测量mrna产物的量。
127.图3示出了检查从参考模板lgv1007的体外转录得到的mrna转录本生产的page电泳结果。确认了产物的预计正确尺寸(~3.5kb,第1道)。
128.实施例3.用于细胞内mrna转染的细胞电穿孔
129.使用细胞电穿孔将在上述2中得到的mrna转录本转染到人类细胞。使用amaxa
tm 4d-nucleofector
tm x unit装置和sf细胞系nucleofector
tm
溶液(lonza),按照制造商的方案将k562人类骨髓瘤来源的成淋巴细胞性白血病细胞(atcc ccl-243
tm
)电穿孔。在电穿孔之前两天以3x105个细胞/ml的密度新鲜分离k562细胞。在电穿孔当天,对细胞进行计数,并在室温下制备所需数目的细胞(1~2x106个细胞)。在电穿孔之前,将细胞用无血清rpmi或opti-mem(gibco)洗涤两次,最后重悬浮在100μl sf细胞系4d nucleofector
tm x溶液(82μl核转染溶液,18μl增补剂)中。然后,使用程序ff-120将0.1ml所述细胞悬液与0μg至20μg体外转录(ivt)的lgv1007 mrna混合。在电穿孔后,向细胞悬液添加新鲜培养基,并将所述电穿孔的细胞直接在37℃下在co2细胞培养箱中温育。
130.图4示出了在将k562细胞用lgv1007 mrna转录本以每1x106个细胞0μg、3μg、5μg或10μg的量电穿孔后的9天中,检查hla-a*0201分子的表达水平的结果,以便推导在用lgv1007 mrna转录本电穿孔k562细胞后表达水平达到最高水平的条件。在10μg转录本电穿孔后24小时,观察到最高表达水平(高达参比表达水平的~65倍),并且在48小时后,它急剧降低并连续维持在参比值的5倍至2倍的表达水平。非抗原呈递细胞的mhc-i等位基因的最大过表达(即为个体患者的肿瘤个性化)具有为所述患者肿瘤定制特定抗原呈递细胞的mhc-i表型的作用,因此预计将使个体患者的抗癌免疫t细胞的激活最大化。
131.实施例4.mrna产物的体外翻译
132.为了体外翻译带有flag标签的多抗原重组蛋白,使用tnt quick偶联转录/翻译试剂盒(promega)或一步法人类高得率mini ivt试剂盒(thermo scientific),按照制造商的说明书将lgv1007模板dna质粒用于单管体外转录/体外翻译中。将反应体积从100μl按比例缩小到25μl。在tnt quick偶联转录/翻译试剂盒(promega)的情况下,将反应混合物在30℃温育60分钟至90分钟,并且在一步法人类高得率mini ivt试剂盒(thermo scientific)的情况下,反应时间为6小时至16小时。
133.图5示出了在lgv1007 mrna转录本的体外翻译后用于确认带有flag标签的多抗原重组蛋白的产生的western印迹分析的结果。
134.实施例5.蛋白质表达分析
135.在将mrna电穿孔到k562细胞中后,对其中融合有b2m和hla-a*0201的重组mhc-i蛋白的细胞表达进行western印迹分析。此外,对体外翻译的带有flag标签的多抗原重组蛋白进行western印迹分析,以确认所述多抗原重组蛋白的蛋白质表达。详细来说,收集用lgv1007 mrna电穿孔的k562细胞,用pbs洗涤两次,并在4℃下在含有蛋白酶抑制剂混合物(atto)的ripa裂解缓冲液(atto)中裂解。根据标准的western印迹方案,将20μg~30μg蛋白质与sds样品缓冲液混合,并通过在tris-甘氨酸预制12%或4%-20%凝胶(komabiotech)
上运行sds-page进行分析。免疫印迹抗体从下述来源获得:β-2微球蛋白(cell signaling)和flag(sigma-aldrich)。施加抗β-2微球蛋白抗体或抗flag m2抗体,在4℃过夜。施加辣根过氧化物酶(hrp)偶联的第二抗体(santa cruz biotechnology),在室温下1小时。使用增强化学发光检测试剂盒(ecl,amersham或pierce)鉴定免疫反应性蛋白质。使用amersham成像仪680检测来自于western印迹分析的信号。
136.图6示出了在将k562细胞用lgv1007 mrna转录本电穿孔后,确认i类mhc等位基因(orf1)和肿瘤抗原(orf2)两者的蛋白质表达的western印迹分析的结果,确认了orf1(b2m-hla-a*0201)蛋白具有~51kda的尺寸(图6a),并且orf2(肿瘤抗原融合蛋白)以~30kda的预期尺寸表达(图6b)。然而,由于所述肿瘤抗原融合蛋白在细胞表达后被蛋白酶体快速降解,因此它显然只能通过体外翻译法表达。
137.实施例6.流式细胞术
138.使用intellicyt ique
tm screener plus(sartorius)流式细胞仪进行流式细胞术。详细来说,在核转染后24小时至72小时或直至2周,收集用lgv系列mrna电穿孔的k562细胞并以300xg离心5分钟。将细胞沉积物重悬浮在流式细胞术缓冲液(含有1%fbs和2mm edta的dpbs)中。对于细胞染色来说,以建议的浓度添加apc偶联的小鼠抗人hla-a2抗体(bd pharmigen),然后通过在暗处在室温温育30分钟至1小时,将细胞染色。在染色温育后,将细胞沉积并重悬浮在pbs中。使用intellicyt forecyt软件(sartorius)来分析流式细胞术结果。
139.图7示出了在用lgv1007 mrna转录本以每1x106个细胞1ug的量电穿孔k562细胞后24小时,用于确认k562细胞表面上的表达水平的流式细胞术的结果。观察到与参比值相比~10倍或更高的过量表达。
140.实施例7.使用elispot ifnγ细胞因子释放测定法分析的免疫细胞激活
141.在k562apc抗原呈递细胞中,比较了传统抗原装载方法(肽脉冲)和rna抗原装载之间的免疫效能的优势。详细来说,在第1天,通过elispot ifnγ测定法对用实施例3中制备的lgv1007 mrna转录本(包含的5个抗原序列:生存素,mart1,nyeso1,magea3,multimage)电穿孔的k562apc细胞、装载有参比抗原(生存素,9个氨基酸的肽)的k562apc细胞或未用肽处理的k562apc对照细胞进行免疫活性比较。将纯化的pbmc(外周血单核细胞)cd8+t细胞在2.5x10e5个细胞/ml的apc细胞悬液中进行刺激。添加100μl t细胞/孔和100μl apc/孔(t细胞相比于apc以2:1至10:1的比例混合),并将细胞混合物在37℃温育24小时。在第2天,将细胞培养基用10u/ml的il-2和5ng/ml的il-15代替,并在7天后,重新增补il-2。在apc刺激11天后,通过elispot ifnγ流程(bd bioscience),按照制造商的说明书分析释放ifnγ的t细胞。仔细地监测阳性斑点的显色,并将测定板在室温下空气干燥2小时至过夜,直至完全干燥。通过用解剖显微镜观察对阳性斑点直接计数或通过使用elispot读板器对阳性斑点自动计数,来进行pbmc t细胞激活测定。
142.图8示出了使用用lgv1007 mrna转录本电穿孔的k562apc细胞、装载有参比抗原(生存素,9个氨基酸的肽)的k562apc细胞和未用肽处理的k562apc对照细胞,用于测量pbmc t细胞的免疫活性的elispot ifnγ释放测定法的结果。通过用参考rna lgv1007电穿孔而被激活的k562抗原呈递细胞引发并激活带有同源的i类mhc等位基因(hla-a*0201)的pbmc cd8+t细胞,并因此观察到释放ifnγ的阳性斑点。相反,源自于用作mhc基因型限制性对照
的异源i类mhc等位基因(无hla-a*0201)的cd8 t细胞不被apc引发。通过这个实验,确认了与传统的肽抗原装载相比,用lgv1007 mrna转录本电穿孔的k562apc细胞引发离体人类pbmc免疫细胞的卓越的激活。
143.实施例8.引入有lgv1032的自体树突状细胞的制备和使用所述细胞的免疫细胞激活
144.进行了实验以验证,在从每位患者提取和培养的具有各种不同的i类和ii类mhc的个性化自体树突状细胞中,所述lgv rna抗原装载方法是否如同在实验室中技术优化的k562apc中,通过有效的抗原装载和抗原呈递有效地促进抗原特异性免疫细胞活化。结果示出在图9和10中。
145.图9示出了lgv1032 mrna转录本的构造图和用于确认在个体衍生的自体树突状细胞中的细胞表达的facs分析的结果。lgv1032具有与lgv1007(实施例1)同源的双顺反子转录本构造,维持orf2(肿瘤抗原部分),并具有gfp报告蛋白作为位于orf1中的细胞表达标志物。因此,lgv1032的制备方法与lgv1007相同。作为如上所述的流式细胞术的结果,确认了lgv1032与lgv1007一样,在通过电穿孔方法引入到个体衍生的自体树突状细胞中后也在所述细胞中有效表达。所述个体衍生的或个性化自体树突状细胞通过收集血液,将单核细胞分化成不成熟树突状细胞,然后通过成熟过程获得成熟树突状细胞来获得。已知尽管这种体外细胞分化和成熟过程花费约一周,但最终的成熟树突状细胞具有最大的抗原呈递能力。正如在图9中gfp报告蛋白的facs分析的结果中所示,确认了lgv1032被有效地电穿孔到所有阶段的细胞(单核细胞、不成熟dc、成熟dc)中,并且它们在被引入到所述细胞中后表达。
146.图10示出了在elispot ifnγ释放测定法中确认斑点增加的结果,证实了被电穿孔到个体衍生的自体树突状细胞(modc)中的lgv1032有效地促进抗原特异性t细胞免疫活性。elispot ifnγ释放测定法中斑点的增加清楚地证实了用lgv1032电穿孔的自体树突状细胞(图10,第3和4列)与作为传统方法的用肽抗原脉冲的自体树突状细胞(图10,第2列)相比,相当有效地促进mart1抗原特异性tcre t细胞活化。
147.在上述描述的基础上,本领域技术人员会理解,本公开可以以不同的具体形式实施而不改变其技术精神或本质特征。就此而言应该理解,上述示例性实施方式不是限制性的,而是在所有方面均为说明性的。本发明的范围由权利要求书而不是由前面的描述来定义,因此落于权利要求书的边界和范围或此类边界和范围的等同性之内的所有改变和修改,旨在被权利要求书涵盖。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1