新苹果酸脱氢酶变体及使用其生产L-赖氨酸的方法与流程
acids research 12:387(1984))的needleman程序中所执行的needleman-wunsch算法(needleman和wunsch,1970,j.mol.biol.48:443-453)、blastp、blastn、fasta(atschul,s.f.等人,j molec biol 215:403(1990);guide to huge computers,martin j.bishop编,academic press,san diego,1994;以及carillo等人(1988)siam j applied math 48:1073)来确定。例如,可使用美国国家生物技术信息中心的blast或clustalw确定同源性、类似性或同一性。
21.多核苷酸或多肽的同源性、类似性或同一性可如例如smith和waterman,adv.appl.math(1981)2:482中所发表的通过使用例如gap计算机程序诸如needleman等人(1970),j mol biol.48:443比较序列信息来确定。概括地说,gap程序可定义为通过两个序列中的较短序列中符号(即,核苷酸或氨基酸)的总数除以类似比对符号的数目所获得的值。gap程序的默认参数可包括(1)二元比较矩阵(包括相同值为1且非同值为0)和gribsko等人,(1986)nucl.acids res.14:6745(或ednafull(ncbi nuc4.4的emboss版)取代矩阵)的加权比较矩阵,如schwartz和dayhoff编,atlas of protein sequence and structure,national biomedical research foundation,第353-358页(1979)中所公开;(2)每个空位的罚分为3.0并且每个空位的每个符号额外罚分0.10(或空位开放罚分为10,空位延伸罚分为0.5);以及(3)末端空位没有罚分。
22.作为本公开的实例,本公开的变体可以表现出苹果酸脱氢酶活性。
23.在本公开中,术语“苹果酸脱氢酶(malate dehydrogenase)”是一种酶,其通过将nad+还原为nadh可逆地催化苹果酸(malate)氧化成草酰乙酸(oxaloacetate)。具体地说,本公开的苹果酸脱氢酶(malate dehydrogenase)可与mdh或苹果酸的脱氢酶(malic acid dehydrogenase)互换使用。在本公开中,苹果酸脱氢酶的序列可获自已知数据库ncbi的genbank(例如,genbank登录号wp_011015079.1、yp_226625.1)。具体地说,苹果酸脱氢酶可以是由ncgl2297基因(或mdh基因)编码的表现出苹果酸脱氢酶活性的多肽,但不限于此。
24.在本公开中,术语“对应于”是指多肽中所列出的位置处的氨基酸残基,或者与多肽中所列出的残基类似、相同或同源的氨基酸残基。鉴别对应位置处的氨基酸可为确定参考特定序列的序列中的特定氨基酸。如本文所用,“对应区域”通常是指相关蛋白或参考(reference)蛋白中类似或对应的位置。
25.例如,将任意氨基酸序列与seq id no:3比对(align),并且基于此,可以参考seq id no:3的氨基酸残基和对应氨基酸残基的数值位置对上述氨基酸序列的每个氨基酸残基进行编号。例如,如本公开中所述的序列比对算法可通过与查询序列(也称为“参考序列”)比较来确定氨基酸位置或修饰诸如取代、插入或缺失发生的位置。
26.针对此类比对,例如,可使用needleman-wunsch算法(needleman和wunsch,1970,j.mol.biol.48:443-453)、emboss包的needleman程序(emboss:the european molecular biology open software suite,rice等人,2000,trends genet.16:276-277)等,但程序和算法不限于此,并且可适当使用本领域中已知的序列比对程序、成对序列比较算法等。
27.本公开的另一个方面为提供一种编码本公开的变体的多核苷酸。
28.在本公开中,术语“多核苷酸”为以核苷酸单体通过共价键连接成长链的核苷酸聚合物的形式的一定长度以上的dna或rna链,并且更具体地指编码变体的多核苷酸片段。
29.编码本技术的变体的多核苷酸可包括编码由seq id no:1表示的氨基酸序列的碱
edition,cold spring harbor laboratory press,cold spring harbor,new york,1989)。
35.本公开的另一个方面为提供一种载体,其包含本公开的多核苷酸。载体可为用于在宿主细胞中表达多核苷酸的表达载体,但不限于此。
36.本公开的载体可包括dna构建体,其包含编码目标多肽的多核苷酸的碱基序列,所述多核苷酸的碱基序列可操作性地连接至合适的表达调控区(或表达调控序列),以使得目标多肽可在合适的宿主中表达。表达调控区可含有能够起始转录的启动子、用于调控转录的任何操纵子序列、编码合适的mrna核糖体结合位点的序列以及调控转录和翻译终止的序列。可将载体转化到合适的宿主细胞中,然后独立于宿主基因组复制和起作用,或者可以将载体整合到基因组本身中。
37.本公开中所用的载体没有特别限制,可使用本领域中已知的任何载体。通常使用的载体的实例包括天然或重组质粒、粘粒、病毒和噬菌体。例如,可以将pwe15、m13、mbl3、mbl4、ixii、ashii、apii、t10、t11、charon4a、charon21a等用作噬菌体载体或粘粒载体,并且可以将pdz系统、pbr系统、puc系统、pbluescript ii系统、pgem系统、ptz系统、pcl系统、pet系统等用作质粒载体。具体地说,可以使用pdz、pdc、pdcm2、pacyc177、pacyc184、pcl、peccg117、puc19、pbr322、pmw118和pcc1bac载体等。
38.例如,可以将编码目标多肽的多核苷酸通过载体插入到染色体中,以用于细胞内染色体插入。将多核苷酸插入到染色体中可以通过本领域中已知的任何方法(例如,同源重组(homologous recombination))进行,但不限于此。载体可以进一步含有选择标记物(selection marker),以用于确认染色体插入与否。选择标记物用于选择载体转化的细胞,即,用于确认目标核酸分子的插入与否,可以使用赋予可选择表型诸如抗药性、营养缺陷型、细胞毒剂抗性或表面多肽的表达的标记物。在用选择剂(selective agent)处理的环境中,只有表达选择标记物的细胞存活或表现出其他表型性状,因此可以选择转化细胞。
39.在本公开中,术语“转化”意指将包含编码靶多肽的多核苷酸的载体引入到宿主细胞或微生物中,以使得由多核苷酸编码的多肽可以在宿主细胞中表达。转化的多核苷酸可以通过插入到宿主细胞的染色体中来定位,或定位于染色体外,只要其可以在宿主细胞中表达即可。多核苷酸包含编码目标多肽的dna和/或rna。多核苷酸可以以任何形式引入,只要其可以被引入到宿主细胞并表达即可。例如,可以将多核苷酸以表达盒的形式引入到宿主细胞,表达盒为包含自我表达所需的所有元件的基因构建体。表达盒通常可以包含与多核苷酸可操作地连接的启动子、转录终止信号、核糖体结合位点和翻译终止信号。表达盒可为能够自我复制的表达载体的形式。多核苷酸可以以其自身的形式被引入到宿主细胞中并且可操作地连接至在宿主细胞中表达所需的序列,但不限于此。
40.在上文中,术语“可操作地连接”意指多核苷酸序列与启动子序列功能性地连接,所述启动子序列起始并介导编码本公开的目标变体的多核苷酸的转录。
41.本公开的另一个方面为提供一种谷氨酸棒状杆菌菌株,其包含本公开的变体或本公开的多核苷酸。
42.本公开的菌株可以包含本公开的修饰多肽、编码所述多肽的多核苷酸或包含本公开的多核苷酸的载体。
43.在本公开中,“菌株(或微生物)”包括所有野生型微生物或天然或人工遗传修饰的
微生物,并且菌株(或微生物)可为特定机制由于外部基因的插入或内源性基因的活性增强或失活而削弱或加强的微生物,并且菌株(或微生物)可为包含针对目标多肽、蛋白或产物的生产的遗传修饰的微生物。
44.本公开的菌株可为:包含本公开的变体、本公开的多核苷酸或含有本公开的多核苷酸的载体中的任何一种或多种的菌株;经修饰以表达本公开的变体或本公开的多核苷酸的菌株;表达本公开的变体或本公开的多核苷酸的菌株(例如,重组菌株);或表现出本公开的变体的活性的菌株(例如,重组菌株),但不限于此。
45.本公开的菌株可以是具有l-赖氨酸生产能力的菌株。
46.本公开的菌株可为天然具有苹果酸脱氢酶活性和/或l-赖氨酸生产能力的微生物,或者将本公开的变体或编码变体的多核苷酸(或包含上述多核苷酸的载体)引入到不具有苹果酸脱氢酶活性和/或l-赖氨酸生产能力的亲本菌株中和/或对亲本菌株赋予l-赖氨酸生产能力的微生物,但不限于此。
47.例如,本公开的菌株为用包含本公开的多核苷酸或编码本公开的变体的多核苷酸的载体转化并表达本公开的变体的细胞或微生物。出于本公开的目的,本公开的菌株可包括包含本公开的变体并且可生产l-赖氨酸的所有微生物。例如,本公开的菌株可为重组菌株,其是通过将编码本公开的变体的多核苷酸引入到天然野生型微生物或生产l-赖氨酸的微生物中来表达苹果酸脱氢酶变体而具有增加的l-赖氨酸生产能力的重组菌株。具有增加的l-赖氨酸生产能力的重组菌株可为与天然野生型微生物或苹果酸脱氢酶未修饰微生物(即,表达野生型苹果酸脱氢酶的微生物)相比具有增加的l-赖氨酸生产能力的微生物,但不限于此。例如,作为用于比较l-赖氨酸生产能力的增加的靶菌株的苹果酸脱氢酶未修饰微生物可为atcc13032菌株和/或谷氨酸棒状杆菌cj3p(us 9556463 b2;其全部公开内容通过引用而并入本文),但不限于此。
48.例如,与变异之前的亲本菌株或未修饰微生物的l-赖氨酸生产能力相比,具有增加的生产能力的重组菌株的l-赖氨酸生产能力可增加约1%或更多、约2.5%或更多、约5%或更多、约6%或更多、约7%或更多、约8%或更多、约9%或更多、约10%或更多、约10.5%或更多、约11%或更多、约11.5%或更多、约12%或更多、约12.5%或更多、约13%或更多、约13.5%或更多、约14%或更多、约14.5%或更多、约15%或更多、约15.5%或更多、约16%或更多、约16.5%或更多、约17%或更多、约17.5%或更多、约18%或更多、约18.5%或更多、约19%或更多、约19.5%或更多、约20%或更多、约20.5%或更多、约21%或更多、约21.5%或更多、约22%或更多、约22.5%或更多、约23%或更多、约23.5%或更多、约24%或更多、约24.5%或更多、约25%或更多、约25.5%或更多、约26%或更多、约26.5%或更多、约27%或更多、约27.5%或更多、约28%或更多、约28.5%或更多、约29%或更多、约29.5%或更多、约30%或更多、约31%或更多、约32%或更多、约33%或更多、约34%或更多、或约35%或更多(上限不进行具体限制并且可为例如约200%或更少、约150%或更少、约100%或更少、约50%或更少、约45%或更少、约40%或更少、或约35%或更少)。在另一个实例中,与变异之前的亲本菌株或未修饰微生物的l-赖氨酸生产能力相比,具有增加的生产能力的重组菌株的l-赖氨酸生产能力可增加约1.1倍或更多、约1.12倍或更多、约1.13倍或更多、约1.15倍或更多、约1.16倍或更多、约1.17倍或更多、约1.18倍或更多、约1.19倍或更多、约1.2倍或更多、约1.25倍或更多、或约1.3倍或更多(上限不进行具体限制并且可为例如约10
倍或更少、约5倍或更少、约3倍或更少或约2倍或更少)。更具体地,与变异之前的亲本菌株或未修饰微生物的l-赖氨酸生产能力相比,具有增加的生产能力的重组菌株的l-赖氨酸生产能力可增加约16.25%(或约1.16倍),但增加率不限于此。术语“约”为包括
±
0.5、
±
0.4、
±
0.3、
±
0.2、
±
0.1等所有的范围,包括等于或类似于在术语“约”之后的值的范围中的所有值,但不限于此。
49.在本公开中,“未修饰微生物”不排除包含可在微生物中天然存在的突变的菌株,并且可为野生型菌株或天然菌株本身,或者可为通过因天然或人工因素所致的遗传变异而性状改变之前的菌株。例如,未修饰微生物可为未引入或尚未引入本说明书中所述的苹果酸脱氢酶变体的菌株。术语“未修饰微生物”可与“修饰之前的菌株”、“修饰之前的微生物”、“未变异菌株”、“未修饰菌株”、“未变异微生物”或“参考微生物”互换使用。
50.在本公开的另一个实例中,本公开的微生物可为谷氨酸棒状杆菌、生乳棒状杆菌(corynebacterium crudilactis)、沙漠棒状杆菌(corynebacterium deserti)、有效棒状杆菌(corynebacterium efficiens)、帚石南棒状杆菌(corynebacteriumcallunae)、停滞棒状杆菌(corynebacterium stationis)、单一棒状杆菌(corynebacterium singulare)、耐盐棒状杆菌(corynebacterium halotolerans)、纹带棒状杆菌(corynebacterium striatum)、产氨棒状杆菌(corynebacterium ammoniagenes)、污染棒状杆菌(corynebacterium pollutisoli)、亚胺棒状杆菌(corynebacterium imitans)、龟口腔棒状杆菌(corynebacterium testudinoris)或微黄棒状杆菌(corynebacterium flavescens)。
51.在本公开中,多肽的“弱化”包括与内源性活性相比活性降低或活性缺失的两种情况。弱化可与诸如失活、缺陷、下调、降低、减小和衰减的术语互换使用。
52.弱化还可以包括:与微生物最初拥有的多肽的活性相比,由于编码多肽的多核苷酸的变异等而多肽本身的活性降低或消除的情况;与天然菌株相比,由于编码多肽的多核苷酸的基因的表达的抑制或翻译成多肽的抑制而细胞中总体多肽活性水平和/或浓度(表达水平)较低的情况;多核苷酸根本不表达的情况;和/或即使多核苷酸表达,也不表现出多肽活性的情况。“内源性活性”意指在通过因天然或人工因素所致的遗传变异而性状改变的情况下,性状改变之前的亲本菌株或者野生型或未修饰微生物最初拥有的特定多肽的活性。内源性活性可与“修饰之前的活性”互换使用。与内源性活性相比,多肽的活性“失活、缺陷、降低、下调、减少或衰弱”的事实意指与性状改变之前的亲本菌株或野生型或未修饰微生物最初拥有的特定多肽的活性相比,多肽的活性降低。
53.此类多肽活性弱化可通过本领域中已知的任何方法进行,但是方法不限于此,并且弱化可以通过应用本领域中熟知的各种方法来实现(例如,nakashima n.等人,bacterial cellular engineering by genome editing and gene silencing.int jmol sci.2014;15(2):2773-2793;sambrook等人,molecular cloning 2012等)。
54.特别地,本公开中多肽活性的弱化可为:
55.1)缺失编码多肽的基因的全部或部分;
56.2)修饰表达调控区(或表达调控序列)以降低编码多肽的基因的表达;
57.3)修饰构成多肽的氨基酸序列以消除或弱化多肽活性(例如,氨基酸序列中一个或多个氨基酸的缺失/取代/添加);
58.4)修饰编码多肽的基因序列以消除或弱化多肽活性(例如,编码经过修饰以消除或弱化多肽活性的多肽的多肽基因的核酸碱基序列中一个或多个核酸碱基的缺失/取代/添加);
59.5)修饰编码多肽的基因转录物的起始密码子或编码5'-utr区的碱基序列;
60.6)引入与编码多肽的基因的转录物互补结合的反义寡核苷酸(例如,反义rna);
61.7)在编码多肽的基因的sd序列(shine-dalgarno sequence)之前添加与sd序列互补的序列以形成不可连接核糖体的二级结构;
62.8)添加在编码多肽的基因序列的开放阅读框(orf)的3'末端的相反方向上转录的启动子(逆转录工程化,rte);或
63.9)选自上述1)至8)的两种或更多种的组合,但不特别限于此。
64.例如:
65.上述1)缺失编码多肽的基因的一部分或全部可除去染色体中编码目标内源性多肽的整个多核苷酸,或用缺失一些核苷酸的多核苷酸置换、或用标记物基因置换。
66.上述2)表达调控区(或表达调控序列)的修饰可为缺失、插入、非保守或保守取代,或由于其组合而发生表达调控区(或表达调控序列)的变异,或用表现出较弱活性的序列置换。表达调控区含有启动子、操纵子序列、编码核糖体结合位点的序列和调控转录和翻译终止的序列,但不限于此。
67.上述3)修饰编码多肽的基因转录物的起始密码子或编码5'-utr区的碱基序列可为例如用编码与内源性起始密码子相比具有较低多肽表达速率的另一种起始密码子的碱基序列取代,但不限于此。
68.上述4)和5)氨基酸序列或多核苷酸序列的修饰可为缺失、插入或非保守或保守取代多肽的氨基酸序列或编码多肽的核苷酸序列,或者序列中因其组合所致而发生变异,或者用经修饰以表现出较弱活性的氨基酸序列或多核苷酸序列或经修饰以失活的氨基酸序列或多核苷酸序列置换,以使得多肽的活性弱化,但不限于此。例如,基因表达可以通过将变异引入到多核苷酸序列中并形成终止密码子来抑制或弱化,但修饰不限于此。
69.上述6)对于与编码多肽的基因的转录物互补结合的反义寡核苷酸(例如,反义rna)的引入,可参考文件,例如weintraub,h.等人,antisense-rna as amolecular tool for genetic analysis,reviews-trends in genetics,第1卷(1)1986。
70.上述7)在编码多肽的基因的sd序列之前添加与sd序列互补的序列以形成不可连接核糖体的二级结构可为使mrna不能翻译或减慢mrna翻译速率。
71.上述8)添加在编码多肽的基因序列的开放阅读框(orf)的3'末端的相反方向上转录的启动子(逆转录工程化,rte)可为通过制备与编码多肽的基因的转录物互补的反义核苷酸来弱化活性。
72.在本公开中,术语多肽活性的“增强”意指与内源性活性相比,多肽的活性增加。增强可与术语诸如活化、上调、过表达和增加等互换使用。在此,活化、增强、上调、过表达和增加可包括表现出最初没有的活性和表现出与内源性活性或修饰之前的活性相比改善的活性。“内源性活性”意指在通过因天然或人工因素所致的遗传变异而性状改变的情况下,性状改变之前的亲本菌株或未修饰微生物最初拥有的特定多肽的活性。这可与“修饰之前的活性”互换使用。与内源性活性相比,多肽的活性“增强”、“上调”、“过表达”或“增加”的事实
意指与性状改变之前的亲本菌株或未修饰微生物最初拥有的特定多肽的活性和/或浓度(表达水平)相比,多肽的活性改善。
73.增强可以通过引入外来多肽或增强内源性多肽的活性和/或浓度(表达水平)来实现。多肽活性的增强与否可以通过多肽的活性程度、表达水平或者由多肽产生的产物的量的增加来确认。
74.对于多肽活性的增强,可应用本领域中熟知的各种方法,并且方法不受限制,只要目标多肽的活性与修饰之前微生物的活性相比增强即可。具体地说,可使用本领域的技术人员熟知的基因工程和/或蛋白质工程,其为分子生物学的例行方法,但方法不限于此(例如,sitnicka等人,functional analysis of genes.advances in cell biology.2010,第2卷.1-16;sambrook等人,molecular cloning2012等)。
75.特别地,本公开的多肽的活性的增强可为:
76.1)编码多肽的多核苷酸的细胞内拷贝数增加;
77.2)用表现出强活性的序列置换染色体上的编码多肽的基因表达调控区;
78.3)修饰编码多肽的基因转录物的起始密码子或编码5'-utr区的碱基序列;
79.4)修饰多肽的氨基酸序列以增强多肽的活性;
80.5)修饰编码多肽的多核苷酸序列以增强多肽的活性(例如,修饰多肽基因的多核苷酸序列以编码经修饰来增强多肽的活性的多肽);
81.6)引入表现出多肽的活性的外来多肽或编码多肽的外来多核苷酸;
82.7)优化编码多肽的多核苷酸的密码子;
83.8)分析多肽的三级结构以进行选择并修饰或化学修饰暴露位点;或
84.9)选自上述1)至8)的两种或更多种的组合,但不特别限于此。
85.更特别地:
86.上述1)编码多肽的多核苷酸的细胞内拷贝数的增加可以通过引入到载体的宿主细胞中来实现,所述载体可独立于宿主被复制并起作用并且可操作地连接编码多肽的多核苷酸。或者,增加可通过将编码多肽的多核苷酸的一个拷贝或两个或更多个拷贝引入到宿主细胞的染色体中来实现。向染色体中的引入可以通过将能够将多核苷酸插入到宿主细胞的染色体中的载体引入宿主细胞中来进行,但不限于此。载体如上文所述。
87.上述2)用表现出强活性的序列置换染色体上的编码多肽的基因表达调控区(或表达调控序列)可为例如缺失、插入、非保守或保守取代,或由于其组合而发生序列的变异,或用表现出较强活性的序列置换,以使得表达调控区的活性进一步增强。表达调控区没有特别限制,但可含有启动子、操纵子序列、编码核糖体结合位点的序列和调控转录和翻译终止的序列等。例如,置换可为用强启动子置换初始启动子,但不限于此。
88.已知强启动子的实例包括cj1至cj7启动子(us 7662943 b2)、lac启动子、trp启动子、trc启动子、tac启动子、λ噬菌体pr启动子、pl启动子、tet启动子、gapa启动子、spl7启动子、spl13(sm3)启动子(us 10584338 b2)、o2启动子(us 10273491 b2)、tkt启动子和ycca启动子,但不限于此。
89.上述3)修饰编码多肽的基因转录物的起始密码子或编码5'-utr区的碱基序列可为例如用编码与内源性起始密码子相比具有较高多肽表达率的另一种起始密码子的碱基序列取代,但不限于此。
90.上述4)和5)氨基酸序列或多核苷酸序列的修饰可为缺失、插入、非保守或保守取代多肽的氨基酸序列或编码多肽的核苷酸序列,或者序列中因其组合所致而发生变异,或者用经修饰以表现出较强活性的氨基酸序列或多核苷酸序列或经修饰以更具活性的氨基酸序列或多核苷酸序列置换,以使得多肽的活性增强,但不限于此。置换可具体地通过将多核苷酸通过同源重组插入到染色体中来进行,但不限于此。此处所用的载体可以进一步含有选择标记物,以用于确认染色体插入。选择标记物如上文所述。
91.上述6)引入表现出多肽的活性的外来多肽可为将编码表现出与多肽的活性相同或类似的活性的多肽的外来多核苷酸引入到宿主细胞中。外来多核苷酸的来源或序列不受限制,只要其表现出与多肽的活性相同或类似的活性即可。引入可以通过适当地选择本领域的技术人员已知的转化方法来进行。当引入的多核苷酸在宿主细胞中表达时,可以产生多肽,并且其活性可以增加。
92.上述7)优化编码多肽的多核苷酸的密码子可为密码子优化内源性多核苷酸以便增加宿主细胞中的转录或翻译或者密码子优化外来多核苷酸以便在宿主细胞中进行优化的转录和翻译。
93.上述8)分析多肽的三级结构以选择并修饰或化学修饰暴露位点可为例如通过将待分析的多肽的序列信息与储存已知蛋白的序列信息的数据库比较来根据序列的类似性程度确定模板蛋白候选物,基于此确认结构并选择和修饰或化学修饰待进行修饰或化学修饰的暴露部分。
94.此类多肽活性的增强可为基于野生型微生物菌株或修饰之前的微生物菌株中表达的多肽的活性或浓度的对应多肽的活性或浓度表达水平的增加或者由多肽产生的产物的量的增加,但不限于此。
95.在本公开的微生物中,多核苷酸的部分或整个修饰(例如,用于编码上述蛋白变体的修饰)可以通过以下来诱导:(a)使用在微生物中插入染色体的载体进行同源重组或使用工程化核酸酶(例如,crispr-cas9)进行基因组编辑;和/或(b)用光诸如紫外线和辐射和/或化学品进行处理,但不限于此。用于修饰基因的一部分或全部的方法可以包括使用dna重组技术的方法。例如,通过将含有与目标基因具有同源性的核苷酸序列的核苷酸序列或载体引入微生物中以引起同源重组,可以缺失基因的一部分或全部。引入的核苷酸序列或载体可包含显性选择标记物,但不限于此。
96.在本公开的微生物中,变体、多核苷酸和l-赖氨酸等如上述其他方面所述。
97.本公开的另一个方面提供一种用于生产l-氨基酸的方法,其包括在培养基中培养包含本公开的变体或本公开的多核苷酸的谷氨酸棒状杆菌菌株的步骤。
98.用于生产本公开的l-氨基酸的方法可以包括在培养基中培养包含本公开的变体、或本公开的多核苷酸、或本公开的载体的谷氨酸棒状杆菌菌株的步骤。
99.此外,本公开的l-氨基酸可以是l-赖氨酸。
100.在本公开中,术语“培养”意指使本公开的谷氨酸棒状杆菌菌株在适当控制的环境条件下生长。本公开的培养过程可以根据本领域已知的合适的培养基和培养条件进行。本领域技术人员可以根据选择的菌株容易地调整和使用这种培养过程。具体地说,培养可以是分批型、连续型和/或分批补料型,但不限于此。
101.在本公开中,术语“培养基”意指含有培养本公开的谷氨酸棒状杆菌菌株所需的营
养物质作为主要组分的混合物质,并且培养基供应存活和发展不可缺少的营养物质、生长因子等,包括水。具体地说,作为用于培养本公开的谷氨酸棒状杆菌菌株的培养基和其他培养条件,可以没有特别限制地使用任何一种,只要其为用于微生物的普通培养的培养基即可。本公开的谷氨酸棒状杆菌菌株可以在有氧条件下控制温度、ph等的同时在含有适当碳源、氮源、磷源、无机化合物、氨基酸和/或维生素等的普通培养基中培养。
102.特别地,棒状杆菌属菌株的培养基可见于美国微生物学会的文件“manual of methods for general bacteriology”(washington,d.c.,usa,1981)中。
103.在本公开中,碳源包括:碳水化合物,诸如葡萄糖、蔗糖(saccharose)、乳糖、果糖、蔗糖(sucrose)和麦芽糖;糖醇,诸如甘露醇和山梨糖醇;有机酸,诸如丙酮酸、乳酸和柠檬酸;氨基酸,诸如谷氨酸、蛋氨酸和赖氨酸;等。可以使用天然有机营养物质,诸如淀粉水解物、糖蜜、赤糖糊、米糠、木薯、甘蔗渣和玉米浆。具体地说,可以使用碳水化合物,诸如葡萄糖和经过灭菌的预处理糖蜜(即,转化为还原糖的糖蜜),并且可以以各种方式使用适当量的其他碳源而没有限制。这些碳源可以单独使用或以两种或更多种的组合使用,但不限于此。
104.作为氮源,可以使用:无机氮源,诸如氨、硫酸铵、氯化铵、乙酸铵、磷酸铵、碳酸铵和硝酸铵;和有机氮源,诸如氨基酸(诸如谷氨酸、蛋氨酸和谷氨酰胺)、蛋白胨、nz-胺、肉提取物、酵母提取物、麦芽提取物、玉米浆、酪蛋白水解物、鱼或其分解产物以及脱脂豆饼或其分解产物。这些氮源可以单独使用或以两种或更多种的组合使用,但不限于此。
105.磷源可包括磷酸二氢钾、磷酸氢二钾或与其对应的含钠盐。作为无机化合物,可以使用氯化钠、氯化钙、氯化铁、硫酸镁、硫酸铁、硫酸锰、碳酸钙等。除这些之外,还可以含有氨基酸、维生素和/或合适的前体等。这些组分或前体可以分批或连续地添加到培养基中,但添加方式不限于此。
106.在培养本公开的谷氨酸棒状杆菌菌株期间,可以通过以适当方式向培养基中添加化合物诸如氢氧化铵、氢氧化钾、氨、磷酸和硫酸来调节培养基的ph。在培养期间,可以通过使用消泡剂诸如脂肪酸聚乙二醇酯来抑制起泡。可向培养基中注入氧气或含氧气体以维持培养基的好氧状态,或可不注入气体或可以注入氮气、氢气或二氧化碳气体以维持厌氧和微氧状态,但用于维持状态的方法不限于此。
107.在本公开的培养中,培养温度可维持在20℃至45℃,具体地25℃至40℃,并且菌株可培养约10至160小时,但培养条件不限于此。
108.通过本公开的培养物生产的l-氨基酸可以被分泌到培养基中或可以保留在细胞中。
109.本公开的用于生产l-氨基酸的方法可以在例如培养步骤之前进一步包括准备本公开的谷氨酸棒状杆菌菌株的步骤、准备用于菌株培养的培养基的步骤或这些的组合(以任何顺序)。
110.本公开的用于生产l-氨基酸的方法还可包括从根据培养物的培养基(进行培养的培养基)或从谷氨酸棒状杆菌菌株中回收l-氨基酸的步骤。在培养步骤之后还可包括回收步骤。
111.回收可为根据用于培养本公开的微生物的方法例如分批、连续或分批补料培养方法,通过本领域已知的合适方法来收集目标l-氨基酸。例如,可以使用离心分离、过滤、用结
晶蛋白质沉淀剂处理(盐析法)、提取、超声分解、超滤、渗析、各种形式的色谱法诸如分子筛色谱法(凝胶过滤)、吸附色谱法、离子交换色谱法和亲和色谱法、hplc或其组合。可以通过本领域已知的合适方法从培养基或微生物中回收目标l-氨基酸。
112.本公开的用于生产l-氨基酸的方法还可包括纯化步骤。纯化可以通过本领域已知的合适方法进行。在一个实例中,当本公开的用于生产l-氨基酸的方法包括回收步骤和纯化步骤时,回收步骤和纯化步骤可以不分顺序地连续或不连续地进行,或者可以同时或通过合并成一个步骤来进行,但进行步骤的方式不限于此。
113.在本发明的方法中,变体、多核苷酸、载体、菌株等如上述其他方面所述。
114.本公开的另一个方面为提供一种用于l-氨基酸生产的组合物,其包含有包含本公开变体的谷氨酸棒状杆菌菌株、编码所述变体的多核苷酸、包含所述多核苷酸的载体或本公开的多核苷酸;一种培养基,在其中培养了该谷氨酸棒状杆菌菌株;或其中两个或更多个的组合。
115.本公开的组合物还可包含常用于氨基酸生产的组合物中的任意合适的赋形剂。此类赋形剂可为例如防腐剂、润湿剂、分散剂、悬浮剂、缓冲剂、稳定剂或等渗剂,但不限于此。
116.在本公开的组合物中,变体、多核苷酸、载体、菌株、培养基、l-氨基酸等如上述其他方面所述。
117.有益效果
118.与具有未修饰多肽的现有微生物的情况相比,在培养包含本公开的苹果酸脱氢酶变体的谷氨酸棒状杆菌菌株的情况下,可以以更高的产量生产l-赖氨酸。
附图说明
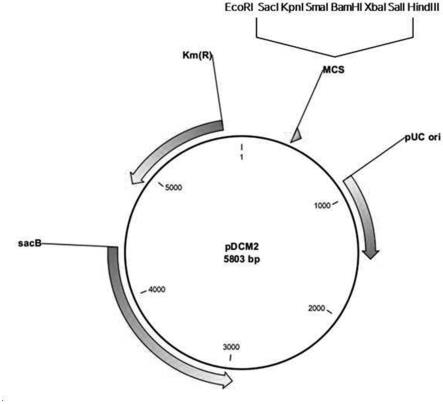
119.图1是pdcm2质粒的示意图。
具体实施方式
120.在下文中,将通过实施例的方式更详细地描述本发明。然而,以下实施例仅为用于说明本发明的优选实施方式,并不用于限制本发明的范围。同时,本说明书中未描述的技术事项可以被本发明的技术领域或类似技术领域的技术人员充分理解并容易地实施。
121.实施例1:质粒的构建
122.设计用于插入和替换棒状杆菌属(corynebacterium)染色体中的基因的质粒(pdcm2,图1,seq id no:11),并利用仿生学股份有限公司(bionics co.,ltd.)的基因合成(gene-synthesis)服务来合成了质粒。通过参考关于sacb系统的众所周知的论文(gene,145(1994)69-73),以包含轻松用于克隆的限制性酶切位点方式设计质粒。如此合成的pdcm2质粒具有以下特性:
123.1)pdcm2质粒具有只在大肠杆菌中起作用的复制起点(replication origin),因此在大肠杆菌中可以自我复制(self-replication),但在棒状杆菌属中则不能自我复制。
124.2)pdcm2质粒具有卡那霉素抗性基因作为选择标记。
125.3)pdcm2质粒具有levan蔗糖基因(sacb)作为二级正选择(positive-selection)标记。
126.4)最终构建的菌株中没有来自pdcm2质粒的基因信息。
127.实施例2:用于在微生物中表达苹果酸脱氢酶变体的载体的构建
128.为了确认变体(t272i;seq id no:1)对l-赖氨酸生产的影响,构建用于构建表达变体的菌株的载体,如下所述。在变体(t272i;seq id no:1)中,由苹果酸脱氢酶氨基酸序列(seq id no:3)的第272位的苏氨酸(thr)被异亮氨酸(ile)取代。
129.使用野生型谷氨酸棒状杆菌(corynebacterium glutamicum)atcc13032的gdna(基因组dna)作为模板,使用具有seq id no:5和6的序列的引物对以及具有seq id no:7和8的序列的引物对分别进行pcr。使用以上获得的两个片段的混合物作为模板和具有seq id no:5和seq id no:8的序列的引物对再次进行重叠pcr以获得片段。如下进行pcr:在94℃变性5分钟后,94℃30秒、55℃30秒和72℃1分30秒,共30个循环,然后在72℃下进行5分钟。pdcm2质粒用smai处理,将以上获得的pcr产物融合克隆到pdcm2质粒中。使用hd克隆试剂盒(clontech)进行融合克隆。获得的载体命名为pdcm2-ncgl2297(t272i)。本实施例中使用的引物的序列描述于下表1中:
130.[表1]
[0131]
名称序列(5
’‑
》3’)seq id noncgl2297_1ftcgagctcggtaccctttgctggctaacaacggcaseq id no:5ncgl2297_2rcaggaatgccgtatgcaccgatggaaggaattgccgcagagseq id no:6ncgl2297_3fctctgcggcaattccttccatcggtgcatacggcattcctgseq id no:7ncgl2297_4rctctagaggatccccaagttctgccatgcgacgctseq id no:8
[0132]
实施例3:表达苹果酸脱氢酶变体的微生物的l-赖氨酸生产能力的评价
[0133]
3-1.表达苹果酸脱氢酶变体的菌株的构建
[0134]
将实施例2中构建的载体转化到谷氨酸棒状杆菌cj3p(us 9556463 b2)中。
[0135]
使用seq id no:9和10从发生同源重组的菌株中选择引入变体的菌株。所选择的菌株被命名为cj3p_ncgl2297_t272i(或ca01-7537),该菌株在2020年12月22日保藏于《布达佩斯条约》下的保藏单位韩国微生物保藏中心(korean culture of microorganisms,kccm),其保藏号为kccm12907p。本实施例中使用的引物的序列描述于下表2中:
[0136]
[表2]
[0137]
名称序列(5
’‑
》3’)seq id noncgl2297_5ftttgctggctaacaacggcaseq id no:9ncgl2297_6raagttctgccatgcgacgctseq id no:10
[0138]
3-2.表达苹果酸脱氢酶变体的菌株的l-赖氨酸生产能力的比较
[0139]
l-赖氨酸生产能力通过实施例3-1中构建的每种菌株和对照亲本菌株的烧瓶发酵效价评估来分析。
[0140]
首先,将每种菌株接种到含有25ml种子培养基的250ml角挡板烧瓶中,并在30℃下以200rpm振荡培养20小时。将1ml的种子培养基接种到含有24ml生产培养基的250ml角挡板烧瓶中,并在30℃下以200rpm振荡培养72小时。培养完成后,通过hplc测量l-赖氨酸的生产率。培养基中每种实验菌株的l-赖氨酸浓度和浓度增加率如下表3所示。
[0141]
《种子培养基(ph 7.0)》
[0142]
葡萄糖20克、蛋白胨10克、酵母提取物5克、尿素1.5克、kh2po
4 4克、k2hpo
4 8克、
mgso4·
7h2o 0.5克、生物素0.1毫克、盐酸硫胺素1毫克、泛酸钙2毫克、烟酰胺2毫克(基于1升蒸馏水)。
[0143]
《生产培养基(ph 7.0)》
[0144]
葡萄糖100克、(nh4)2so
4 40克、大豆蛋白2.5克、玉米浆固体5克、尿素3克、kh2po
4 1克、mgso4·
7h2o 0.5克、生物素100微克、氯化硫胺素1000微克、泛酸钙2000微克、烟酰胺3000微克、caco
3 30克(基于1升蒸馏水)。
[0145]
实验进行3个重复,其分析结果的平均值示于下表3中。
[0146]
[表3]
[0147]
菌株l-赖氨酸浓度(g/l)l-赖氨酸浓度增加率(%)cj3p8 cj3p_ncgl2297_t272i9.316.3
[0148]
如表3所示,与对照组相比,cj3p_ncgl2297_t272i菌株表现出增加的l-赖氨酸生产能力。
[0149]
根据以上描述,本发明所属技术领域的技术人员将理解,在不改变本发明的技术精神或本质特征的情况下,可以以其他具体形式实施本发明。在这点上,应当理解,上述实施方式在所有方面都是示例性的,而不是限制性的。本发明的范围应被解释为包括源自下述的权利要求书的含义和范围的所有变化或修改形式,而不是上述详细描述及其等效概念。
[0150]
[保藏号]
[0151]
保藏单位:韩国微生物保藏中心
[0152]
保藏号:kccm12907p
[0153]
保藏日期:2020年12月22日
[0154]
(中文译文)
[0155]
国际承认用于专利程序的微生物保藏的布达佩斯条约
[0156]
国际表格
[0157]
至:cj第一制糖株式会社
[0158]
韩国首尔市中区东湖路330号
[0159]
cj第一制糖中心
[0160]
(邮编)100-400
[0161][0162]
上述翻译文本与原文没有相违之处。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1