HMO生产的制作方法
hmo生产
技术领域
1.本发明涉及在宿主细胞中重组生产生物分子的领域。更具体地,它涉及一种使用表达主要易化子超家族(major facilitator superfamily,mfs)的蛋白质的基因修饰细胞重组生产人乳寡糖(hmo)的方法。
背景技术:
2.人乳寡糖(hmos)构成人乳中的第三大固体成分,并且高度耐受酶水解。因此,很大一部分hmo基本上没有被消化和吸收,这使得它们能够进入结肠。在结肠中,hmo可以作为底物,通过选择性地刺激特定糖分解细菌的生长来塑造肠道生态系统。这种选择性被认为对婴儿和成人都有益,因为双歧杆菌(bifidobacterium)物种被认为对肠道健康有积极影响(chichlowski m.et al,(2012)j.pediatr.gastroenterol.nutr.5:251-258;elison e.et al.,(2016)brit j.nutr,116:1356-1368)。
3.除了其益生元特性外,hmo还与其他积极的作用相关,从而扩大了它们的应用领域(kunz c.et al.,(2014)food oligosaccharides:production,analysis and bioactivity,1st edition,p5-20,eds.moreno j.和luz sanz m.,john wiley&sons,ltd)。
4.hmo对健康的明显益处使其能够被批准用于食品,例如婴儿配方粉和食品,以及用于消费者健康产品。hmo的生物生产是一种有价值的高成本效益大规模hmo制造方式。它依赖于构建成表达合成所需寡糖需要的糖基转移酶、并利用细菌固有的核苷酸糖库作为hmo前体的基因工程细菌。hmo生物生产技术的最新发展使得克服细菌表达系统的某些固有限制成为可能。例如,可以对生产hmo的细菌细胞进行基因改造,以增加细菌中有限的细胞内核苷酸糖库(wo2012112777),从而提高参与hmo生产的酶的活性(wo2016040531),或者促进合成的hmo分泌到细胞外介质中(wo2010142305、wo2017042382)。此外,重组细胞中所关注基因的表达可以通过使用特定的启动子或其他基因表达调控子来调节,例如,如最近在wo2019123324中所描述。
5.wo2010142305和wo2017042382中描述的方法具有以下优点:它可以通过高水平的重组基因表达,例如使用wo2012112777、wo2016040531或wo2019123324的方法,从而减少生产细胞所遭受的代谢负担。这种方法在重组hmo生产细胞工程中引起了越来越多的关注,例如,近期描述了几种新的糖转运蛋白基因编码蛋白质和发酵方法,其可以促进重组产生的2
’‑
岩藻糖基乳糖(2
’‑
fl)的流出,而2
’‑
fl是人乳中最丰富的hmo(wo2018077892、us201900323053、us201900323052)。然而,目前,尚没有一种算法能够在多个蛋白质数据库(例如:uniprot)中在众多具有预测转运蛋白功能的细菌蛋白质当中准确找出能够外流出不同的重组生产的hmo结构的适配的转运蛋白,因为确定糖转运蛋白底物特异性的结构/因素仍未得到充分研究,仍是高度不可预测的。
技术实现要素:
6.识别对不同的重组生产的hmo具有特异性的新的高效糖外流转运蛋白以及开发表达所述蛋白的重组细胞对于大规模工业hmo生产是有利的。
7.本发明提供了能够生产人乳寡糖(hmo)的重组细胞,其中上述细胞表达编码推定的mfs(major facilitate superfamily,主要易化子超家族)转运蛋白的异源基因,该基因源自于细菌粘质沙雷氏菌(serratia marcescens)。更具体地,本发明涉及一种优化用于生产寡糖、特别是hmo的基因修饰细胞,其包括编码与氨基酸序列seq id no:1具有至少80%序列相似性的蛋白质的重组核酸(图3)。在本文中称为seq id no:1的氨基酸序列是指与genbank登记号为wp_060448169.1的氨基酸序列具有100%同一性的氨基酸序列。具有氨基酸序列seq id no:1的mfs转运蛋白在本发明中可互换地称为“marc蛋白”或“marc转运蛋白”或“marc”;编码marc蛋白的核酸序列在本发明中称为“marc编码核酸/dna”或“marc基因”或“marc”。
8.本发明表明,使用表达marc蛋白的hmo生产重组细胞对于与hmo发酵和纯化二者相关的hmo制造过程均产生非常明显的改进。本发明公开的重组细胞和hmo生产方法提供了较高的总hmo生产的产率、较低的副产物形成或副产物与产物比、较低的每次发酵的生物质形成,并促进了发酵肉汤的下游处理过程中的回收。令人惊讶的是,研究发现,在不同的hmo生产细胞中编码marc的dna序列的表达,与细胞外介质中的一些特定hmo以及生产细胞内部的其他hmo的积聚相关,并且与hmo总产量的增加有关。令人惊讶的是,研究发现,产生的hmo的流出增加是由三或四单元单糖组成的hmo(即,其为三糖和四糖的hmo)所特有的,例如,2
’‑
岩藻糖基乳糖(2
’‑
fl)、3-岩藻糖基乳糖(3-fl)、3
’‑
唾液酸乳糖(3
’‑
sl)、6
’‑
唾液酸乳糖(6
’‑
sl)、乳-n-三糖-2(lnt-2)、乳-n-新四糖(lnnt)和乳-n-四糖(lnt),但不适用于更大的寡糖结构,例如在生产细胞内部积聚的五糖和六糖。令人惊讶的是,研究还发现,在表达marc基因的相应hmo生产细胞中,主要hmo例如2
’‑
岩藻糖基乳糖(2
’‑
fl)、3
’‑
岩藻糖基乳糖(3-fl)、乳-n-三糖(lnt ii)和乳-n-四糖(lnt)的总产量也得以增加,而在这些细胞中,相应地,副产物例如二岩藻糖基乳糖(dfl)、乳-n-岩藻五糖v(lnfp v)或对-乳-新-六糖-i(plnh-i)的产生常常会减少,所述副产物寡糖通常积聚在生产细胞内部。此外,非常出人意料的是,hmo生产细胞中marc蛋白的表达导致发酵过程中生物质的形成减少,并且导致细胞培养更加健康,如发酵结束时死亡细胞的数量减少所反映,这使得制造过程更加高效,因为每生物质单位生产出更多的产品。
9.因此,本发明的第一方面涉及一种能够生产一种或多种hmo的基因修饰细胞,其中所述细胞包括编码seq id no:1的蛋白质或其功能性同源物的重组核酸,该功能性同源物的氨基酸序列与seq id no:1序列具有至少80%同一性,优选至少85%同一性,更优选至少90%同一性。
10.本发明的第二方面涉及一种包括编码mfs转运蛋白的核酸序列的核酸构建体,其中编码蛋白质的核酸序列与seq id no:2具有至少70%的序列同一性,例如至少80%,例如至少85%,例如至少95%,例如至少99%,以及包括上述核酸构建体的基因修饰细胞,该基因修饰细胞为大肠杆菌(escherichia coli)。
11.在一方面,核酸构建体包括编码mfs转运蛋白的核酸序列,其中核酸序列与seq id no:2具有至少70%同一性。
12.本发明的第三方面涉及一种生产一种或多种寡糖的方法,该方法包括以下步骤:
13.(i)提供能够生产hmo的基因修饰细胞,其中所述细胞包括编码seq id no:1的蛋白质或其功能性同源物的重组核酸,所述功能性同源物的氨基酸序列与seq id no:1至少具有80%同一性,优选至少85%同一性,更优选至少90%同一性;
14.(ii)在合适的细胞培养基中培养根据(i)的细胞,以表达所述重组核酸;
15.(iii)收获在步骤(ii)中产生的一种或多种hmo。
16.本发明还涉及包括编码主要易化子超家族(mfs)蛋白质的异源核酸序列的基因修饰细胞或核酸构建体用于生产一种或多种人乳寡糖(hmo)的用途,所述核酸序列与seq id no:2具有至少70%的序列同一性。
17.如上所述,在培养能够生产一种或多种hmo的基因修饰细胞的过程中,上述细胞包括编码marc转运蛋白的核酸,令人惊讶地发现,相应的一种或多种hmo以很高的产率产生,同时副产物和生物质的形成减少。这有利于下游处理过程中hmo的回收,例如,总的回收和纯化过程可以包括更少的步骤,并且总的纯化时间得以缩短。
18.这些提高产物产率和有利于产物回收的效果使得本发明优越于现有技术的公开内容。
19.本发明的其他方面和有利特征通过以下非限制性实施例进行详细描述和说明。
附图说明
20.图1示出具有和不具有seq id no:1的mfs转运蛋白过表达的工程化大肠杆菌细胞内部和外部(图1)的3-fl相对分布。
21.图2示出具有和不具有seq id no:1的mfs转运蛋白过表达的工程化大肠杆菌中细胞内部和外部的2
’‑
fl相对分布(图2a),和600nm下测量的相对细胞光密度(图2b)。
22.图3示出seq id no:1。
具体实施方式
23.在下文中,将更详细地描述本发明的实施方式。除非另有明确说明,否则每个具体的特征变化都可以应用于本发明的其他实施方式。
24.一般而言,除非另有明确定义或说明,本发明使用的所有术语均应根据其在技术领域中的普通含义进行解释,并且适用于本发明的所有方面和实施方式。除非另有明确说明,所有提及“一个/一种/该[细胞、序列、基因、转运蛋白、步骤等]”应开放地解释为指的是所述细胞、序列、基因、转运蛋白、步骤等中的至少一种情形。除非明确说明,本文公开的任何方法的步骤不必按照公开的确切顺序执行。
[0025]
本发明总体上涉及一种用于高效生产寡糖的基因修饰细胞,以及所述基因修饰细胞在寡糖生产方法中的用途。具体而言,本发明涉及一种能够合成寡糖,优选为异源寡糖,特别是人乳寡糖(hmo)的基因修饰细胞。因此,本发明的细胞修饰成表达一组细胞合成一种或多种hmo所必需的重组核酸(其使细胞能够合成一种或多种hmo),例如编码一种或多种具有下文所述的糖基转移酶活性的酶的基因。本发明的寡生产重组细胞进一步修饰成包括异源重组核酸序列,优选地,编码源自细菌粘质沙雷氏菌的推定的mfs(主要易化子超家族)转运蛋白的dna序列。更具体地,本发明涉及一种优化用于生产一种或多种特定寡糖,特别是
一种或多种特定hmo的基因修饰细胞,其包括编码与氨基酸序列seq id no:1(图3)具有至少80%序列相似性、优选至少85%、更优选至少90%、再更优选至少95%序列相似性的蛋白质的重组核酸。在本文中称为seq id no:1的氨基酸序列是与genbank登记号为wp_060448169.1的氨基酸具有100%同一性的氨基酸序列。
[0026]
因此,本发明的第一方面涉及一种能够生产一种或多种hmo的基因修饰细胞,其中所述细胞包括编码seq id no:1的蛋白质或其功能性同源物的重组核酸,所述功能性同源物的氨基酸序列与seq id no:1具有至少80%同一性,优选至少85%同一性,更优选至少90%同一性。在本发明中,术语“功能性同源物”是指氨基酸序列与seq id no:1的同一性为80%-99.9%、并且具有有益于实现本发明的至少一个有益效果的功能的蛋白质,上述有益效果例如,增加宿主细胞的hmo总产量,有利于产生的hmo的回收,提高hmo生产效率和/或hmo生产细胞的活力。
[0027]
具有氨基酸序列seq id no:1的mfs转运蛋白在本发明中可互换地称为“marc蛋白”或“marc转运蛋白”或“marc”;出于本发明的目的,编码marc蛋白的核酸序列在本文中称为“marc编码核酸/dna”或“marc基因”或“marc”。
[0028]
术语“主要易化子超家族(mfs)”是指继发性主动转运蛋白类别的一个庞大且异常多样化的家族,它负责转运一系列不同的底物,包括糖、药物、疏水分子、肽、有机离子等等。糖转运蛋白的特异性是高度不可预测的,并且针对例如寡糖具有特异性的新型转运蛋白的识别需要无负担实验室进行实验(更多细节参见综述reddy v.s.et al.(2012),febs j.279(11):2022-2035)。在本发明中术语“mfs转运蛋白”是指促进寡糖、优选为hmo通过细胞膜转运的蛋白质,优选为促进由宿主细胞合成的hmo/寡糖从细胞溶质转运至细胞培养基的蛋白质,上述hmo/寡糖优选为包括三个或四个糖单元的hmo/寡糖,特别是2
’‑
fl、3-fl、lnt-2、lnt、lnnt、3
’‑
sl或6
’‑
sl。额外地,或者另外可选地,mfs转运蛋白还可以促进根据本发明不视作hmo或寡糖的分子的流出,上述分子例如乳糖、葡萄糖、细胞代谢物或毒素。
[0029]
在两个或多个核酸或氨基酸序列的上下文中,术语“[某值]%序列同一性”是指,在比较窗口或指定的核酸或氨基酸序列上,在比较和比对成对应关系最大化时,两个或多个序列具有所给出百分比的共同的核苷酸或氨基酸残基(即序列具有至少90%同一性)。核酸或氨基酸序列的百分比同一性可以默认参数使用blast 2.0序列比较算法来测量,或通过手动比对和目测来测量(参见如http://www.ncbi.nlm.nih.gov/blast/)。该定义也适用于测试序列的补体和有删除和/或添加的序列,以及有置换的序列。适用于确定百分比同一性、序列相似性并用于比对的算法的一实例为blast 2.2.20+算法,该算法披露于altschul et al.nucl.acids res.25,3389(1997)。blast 2.2.20+用于确定本发明的核酸和蛋白质的百分比序列同一性。执行blast分析的软件通过美国国立生物技术信息中心(the national center for biotechnology information)(http://www.ncbi.nlm.nih.gov/)可公开获得。常用的序列比对算法的实例为
[0030]
clustal omega(http://www.ebi.ac.uk/tools/msa/clustalo/),
[0031]
emboss needle(http://www.ebi.ac.uk/tools/psa/emboss_needle/),
[0032]
mafft(http://mafft.cbrc.jp/alignment/server/),或
[0033]
muscle(http://www.ebi.ac.uk/tools/msa/muscle/)。
[0034]
在本发明的上下文中,术语“寡糖”是指含有若干个单糖单元的糖聚合物。在一些
1,4-半乳糖基转移酶。例如,生产2
’‑
fl需要修饰细胞表达活性α-1,2-岩藻糖基转移酶;为了生产3-fl,修饰细胞需要表达活性α-1,3-岩藻糖基转移酶;为了生产lnt,修饰细胞需要表达至少两种糖基转移酶,β-1,3-n-乙酰基葡糖胺基转移酶和β-1,3-半乳糖基转移酶;为了生产6
’‑
sl,修饰细胞需要表达活性α-2,6-唾液酸基转移酶。一些具有糖基转移酶活性的蛋白质的非限制性实施方式,其可以由生产细胞所包括的重组基因编码,可以选自表1的非限制性实施例。
[0038]
表1
[0039]
[0040]
[0041][0042]
本发明一方面提供一种核酸构建体,其包括编码能够进行糖转运的蛋白质的异源核酸序列,上述蛋白质是如seq id no:1所示的主要易化子超家族(mfs)蛋白质,或其氨基酸序列与seq id no:1具有至少80%同一性的功能性同源物,其中编码mfs蛋白质的核酸序列与seq id no:2序列具有至少70%序列同一性。
[0043]
术语“异源核酸序列”、“重组基因/核酸/dna编码”或“编码核酸序列”是指人工核酸序列(即,使用产生核酸序列的标准实验室方法在体外产生),它包含一组连续的、非重叠的三联体(密码子),当其在适当的控制序列(即启动子)的控制下时,被转录到mrna中并翻译成多肽。编码序列的边界通常由正好位于mrna 5’端开放读框上游的核糖体结合位点、转录起始密码子(aug、gug或uug)和翻译终止密码子(uaa、uga或uag)决定。编码序列可以包
括,但不限于,基因组dna、cdna、合成的和重组的核酸序列。术语“核酸”包括rna、dna和cdna分子。可以理解的是,由于遗传密码的简并性,可以产生许多种编码给定蛋白质的核苷酸序列。术语核酸与术语“多核苷酸”可互换使用。“寡核苷酸”是短链的核酸分子。“引物”是能够在置于诱导与核酸链互补的引物延伸产物的合成的条件下(即,在核苷酸和诱导剂如dna聚合酶的存在下,并在合适的温度和ph值下)充当合成起始点的寡核苷酸,而无论其是天然存在的,如在纯化的限制酶切消化中,还是合成产生的。引物优选为单链的,以在扩增中获得最大的效率,但也另外可选是双链的。如果是双链的,在用于制备延伸产物之前,首先要对引物进行处理以分离其链。优选地,引物是脱氧核糖核苷酸。引物必须足够长,以便在诱导剂存在的情况下引发延伸产物的合成。引物的确切长度取决于许多因素,包括温度、引物来源和方法的用途。
[0044]
本发明的重组核酸序列可以是编码dna序列,例如基因,或非编码dna序列,例如调节dna,如启动子序列。本发明一方面涉及提供一种重组细胞,其包括编码生产一种或多种hmo所必需的酶的重组dna序列和编码marc蛋白的dna序列。因此,在一实施方式中,本发明涉及一种核酸构建体,其包括编码核酸序列,即,所关注基因的重组dna序列,例如糖基转移酶基因或marc基因,以及非编码dna序列,例如启动子dna序列,例如衍生自lac操纵子或glp操纵子的启动子的重组启动子序列,或衍生自另一基因组启动子dna序列的启动子序列,或合成启动子序列,其中编码序列和启动子序列可操作地连接。术语“可操作地连接”是指两个以上核酸(例如dna)片段之间的功能关系。通常,它是指转录调控序列与所转录的序列的功能关系。例如,如果一启动子序列在合适的宿主细胞或其他表达系统中刺激或调节编码序列的转录,则它与编码序列可操作地连接。一般来说,与所转录的序列可操作地连接的启动子转录调控序列与所转录的序列在物理上是邻接的,即,它们是顺式作用的。
[0045]
在一实施方式中,本发明的核酸构建体可以是载体dna的一部分,在另一实施方式中,构建体是整合到宿主细胞基因组中的表达组件/盒。因此,术语“核酸构建体”是指人工构建的核酸片段,特别是dna片段,其旨在要“移植”到靶细胞例如细菌细胞中,以修饰基因组的基因表达,或者表达可以包括在构建体中的基因/编码dna序列。在本发明的上下文中,核酸构建体包含重组dna序列,其包括两个以上重组dna序列:基本上,包括启动子dna序列的非编码dna序列,和编码所关注基因例如marc蛋白、用于在宿主细胞中生产hmo的另一基因的糖基转移酶的编码dna序列。优选地,构建体进一步包括调节构建体的编码dna的转录或翻译的非编码dna序列,例如促进核糖体与转录产物结合的dna序列,稳定转录产物的前导dna序列。
[0046]
将包括在构建体(表达组件)中的所关注的重组基因整合到细菌基因组中可以通过常规方法实现,例如,通过使用含有与染色体上的特定位点同源的侧翼序列的线性盒,如对于atttn7-位点所述(waddell c.s.和craig n.l.,genes dev.(1988)feb;2(2):137-49.);用于核酸序列的基因组整合方法,其中重组由噬菌体λ的red重组酶功能或rac原噬菌体的rece/rect重组酶功能介导(murphy,j bacteriol._(1998);180(8):2063-7;zhang et al.,nature genetics(1998)20:123-128;muyrers et al.,embo rep.(2000)1(3):239-243);基于red/et重组的方法(wenzel et al.,chem biol.(2005),12(3):349-56.;vetcher et al.,appl environ microbiol.(2005);71(4):1829-35);或阳性克隆,即携带表达组件的克隆,可以通过例如标记基因,或丧失或获得基因功能来选择。
[0047]
单一拷贝的包括所关注基因的表达组件可以足以确保所需hmo的生产并实现根据本发明的所需效果。因此,在一些优选实施方式中,本发明涉及包括一、二或三拷贝整合在细胞的基因组dna中的所关注基因的重组hmo生产细胞。在一些实施方式中,优选单一拷贝的基因。
[0048]
在一优选的实施方式中,本发明的核酸构建体的重组编码核酸序列相对于启动子是异源的,这意味着所来源物种的基因组中的等效原生编码序列在另一启动子序列(即并非是构建体的启动子序列)的控制下转录。此外,对于宿主细胞来说,编码dna可以是异源的(即来源于另一个生物物种或属),例如,如在大肠杆菌宿主细胞中表达的编码marc蛋白的dna序列,或者是同源的(即来源于宿主细胞),例如结肠酸操纵子的基因,wca基因。
[0049]
术语“调控元件”或“启动子”或“启动子区域”或“启动子元件”是在转录启动过程被dna依赖性rna聚合酶识别和结合的核酸序列。启动子连同其他转录和翻译调控核酸序列(也称为“控制序列”)是表达给定的基因或一组基因(操纵子)所必需的。一般来说,转录和翻译调控序列包括,但不限于,启动子序列、核糖体结合位点、转录起始和终止序列、翻译起始和终止序列以及增强子或激活序列。“转录起始位点”是指要转录的第一个核苷酸,将其指定为+1。起始位点下游的核苷酸编号为+2、+3、+4等,5’相反(上游)方向的核苷酸编号为-1、-2、-3等。构建体的启动子dna序列可以来源于所选物种的基因组的任何基因的启动子区域,优选地,大肠杆菌基因组dna的启动子区域。因此,任何能够与rna聚合酶结合并启动转录的启动子dna序列都适用于实施本发明。原则上,任何启动子dna序列均可用于控制构建体的所关注重组基因的转录,可以使用不同或相同的启动子序列来驱动整合到宿主细胞基因组中或表达载体dna中的不同的所关注基因的转录。为了使构建体中包括的重组基因得到最佳表达,构建体可以包括进一步的调控序列,例如:前导dna序列,例如源自大肠杆菌的glp基因的5
’‑
非翻译区(5’utr)的dna序列,核糖体结合序列。后面的序列的实例在wo2019123324(并入本文作为参考)中进行了描述,并且在本发明的非限制性工作实施例中进行了说明。
[0050]
在一些优选实施方式中,本发明的构建体中包括的用于调节重组基因表达的调节元件是glpfkx操纵子启动子pglpf,在其他优选实施方式中,启动子是lac操纵子启动子p lac。
[0051]
在另一方面,本发明的构建体中包括的用于调节重组基因表达的调节元件是mgibac;半乳糖/甲基-半乳糖苷转运蛋白启动子pmgib或其变体,例如但不限于seq id no:12的pmglb_70utr,或seq id no:13的pmglb_70utr_sd4。
[0052]
在另一方面,本发明的构建体中包括的用于调节重组基因表达的调节元件是gatyzabcd;塔格糖-1,6-双p醛缩酶启动子pgaty或其变体,例如但不限于seq id no:14的pgaty_u70utr。
[0053]
本发明的基因修饰细胞中或核酸构建体中存在的优选的调控元件选自pgaty_70utr、pglpf、pglpf_sd1、pglpf_sd10、pglpf_sd2、pglpf_sd3、pglpf_sd4、pglpf_sd5、pglpf_sd6、pglpf_sd7、pglpf_sd8、pglpf_sd9、plac_16utr、plac、pmglb_70utr和pmglb_70utr_sd4。
[0054]
本发明的基因修饰细胞中或核酸构建体中存在的特别优选的调控元件选自pglpf和plac。
[0055]
然而,任何启动子均适用于实施本发明,只要其能够转录和/或调节编码一种或多种蛋白质的一种或多种重组核酸(或一种或多种调控核酸)的转录水平,并允许实现根据本发明的所需效果即可,上述一种或多种蛋白质是实现在宿主细胞中生物合成生产一种或多种hmo的最优水平所必需的或对其有益的,例如,参与hmo或hmo前体的跨膜转运、hmo生产副产物降解的蛋白质,基因表达调节蛋白质等。
[0056]
优选地,宿主细胞中表达的包括hmo生物合成生产相关基因、启动子dna序列和其他调控序列例如核糖体结合位点序列(例如,shine-dalgarno序列)的本发明的构建体,能够使hmo的生产达到在1升包括宿主细胞悬液的发酵介质中至少0.03g/od(光学密度)的水平,例如,大约0.05g/l/od至大约0.1g/l/od。出于本发明的目的,后一水平的hmo生产被认为是“足够的”,能够生产该水平所需hmo的宿主细胞被认为是“合适的宿主细胞”,即细胞可以进一步修饰成表达hmo转运蛋白,例如marc,以实现本发明所述的至少一种有益于hmo生产的效果。
[0057]
本发明的基因修饰细胞或核酸构建体包括核酸序列,例如编码推定的mfs(主要易化子超家族)转运蛋白的异源基因。
[0058]
本发明中特别关注的mfs转运蛋白是marc蛋白。因此,本发明的核酸构建体含有与基因marc seq id no:2具有至少70%序列同一性的核酸序列。
[0059]
基因修饰细胞中或核酸构建体中含有的核酸序列编码seq id no:1的蛋白质,或氨基酸序列与seq id no:1具有至少80%同一性的功能性同源物。
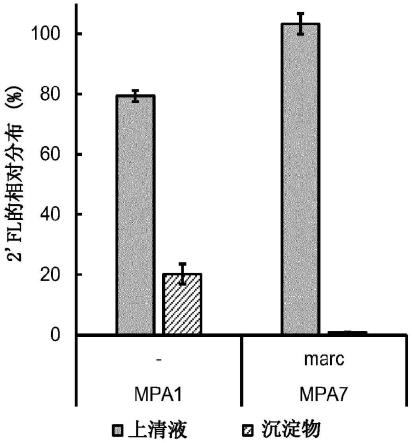
[0060]
seq id no:1的蛋白质的功能性同源物可以通过诱变获得。与氨基酸序列seq id no:1的功能性相比,功能性同源物应具有至少50%的保留的功能性,例如60%、70%、80%、90%或100%。与氨基酸序列seq id no:1的功能性相比,功能性同源物可以具有更高的功能性。seq id no:1的功能性同源物应当能够提高根据本发明的基因修饰细胞的hmo产量。
[0061]
基因修饰细胞(宿主细胞或重组细胞)可以是,例如,细菌或酵母细胞。在一优选的实施方式中,可以是基因修饰的细菌细胞。对于细菌宿主细胞,原则上没有限制;它们可以是真细菌(革兰氏阳性或革兰氏阴性)或古细菌,只要它们允许插入所关注基因的基因修饰,并且可以在生产规模上进行培养即可。优选地,宿主细胞具有允许培养至高细胞密度的特性。根据本发明的适用于重组工业生产hmo的细菌宿主细胞的非限制性实例可以是草生欧文氏菌(erwinia herbicola)(成团泛菌(pantoea agglomerans))、弗氏柠檬酸杆菌(citrobacter freundii)、柠檬泛菌(pantoea citrea)、胡萝卜软腐病果胶杆菌(pectobacterium carotovorum)或野油菜黄单胞菌(xanthomonas campestris)。也可以使用芽孢杆菌属(bacillus)的细菌,包括枯草芽孢杆菌(bacillus subtilis)、地衣芽孢杆菌(bacillus licheniformis)、凝结芽孢杆菌(bacillus coagulans)、嗜热芽孢杆菌(bacillus thermophilus)、侧孢芽孢杆菌(bacillus laterosporus)、巨大芽孢杆菌(bacillus megaterium)、蕈状芽孢杆菌(bacillus mycoides)、短小芽孢杆菌(bacillus pumilus)、迟缓芽孢杆菌(bacillus lentus)、蜡样芽孢杆菌(bacillus cereus)和环状芽孢杆菌(bacillus circulans)。类似地,可以使用本发明的方法修饰乳杆菌属(lactobacillus)和乳球菌属(lactococcus)的细菌,其包括但不限于嗜酸乳杆菌(lactobacillus acidophilus)、唾液乳杆菌(lactobacillus salivarius)、植物乳杆菌(lactobacillus plantarum)、瑞士乳杆菌(lactobacillus helveticus)、德氏乳杆菌
(lactobacillus delbrueckii)、鼠李糖乳杆菌(lactobacillus rhamnosus)、保加利亚乳杆菌(lactobacillus bulgaricus)、卷曲乳杆菌(lactobacillus crispatus)、加氏乳杆菌(lactobacillus gasseri)、干酪乳杆菌(lactobacillus casei)、罗伊氏乳杆菌(lactobacillus reuteri)、詹氏乳杆菌(lactobacillus jensenii)和乳酸乳球菌(lactococcus lactis)。嗜热链球菌(streptococcus thermophiles)和费氏丙酸杆菌(proprionibacterium freudenreichii)也是适用于本发明的细菌物种。作为本发明的一部分,还包括来自以下属的如本发明所述修饰的菌株:肠球菌属(enterococcus)(例如,屎肠球菌(enterococcus faecium)和嗜热肠球菌(enterococcus thermophiles))、双歧杆菌(bifidobacterium)(例如,长双歧杆菌(bifidobacterium longum)、婴儿双歧杆菌(bifidobacterium infantis)和两歧双歧杆菌(bifidobacterium bifidum))、芽孢乳杆菌属(sporolactobacillus spp.)、小单孢菌属(micromomospora spp.)、微球菌属(micrococcus spp.)、红球菌属(rhodococcus spp.)和假单胞菌属(pseudomonas)(例如,荧光假单胞菌(pseudomonas fluorescens)和铜绿假单胞菌(pseudomonas aeruginosa))。在乳糖的存在下培养包括本发明所述特征的细菌,并且从细菌本身或者从细菌培养的上清液中回收由细胞产生的寡糖,例如hmo。在一优选的实施方式中,本发明的基因修饰细胞是大肠杆菌细胞。
[0062]
在另一优选的实施方式中,宿主细胞是酵母细胞,例如酿酒酵母(saccharomyces cerevisiae)、粟酒裂殖酵母(schizosaccharomyces pombe)、毕赤酵母(pichia pastoris)、乳酸克鲁维酵母(kluveromyces lactis)、马克斯克鲁维酵母(kluveromyces marxianus)等。
[0063]
本发明的重组细胞生产的hmo可以使用本领域现有的适当方法(例如在wo2015188834、wo2017182965或wo2017152918中所描述)进行纯化。
[0064]
本发明的基因修饰细胞可以使用本领域的标准方法提供,例如sambrook et al.wilson&walker、maniatise et al.和ausubel et al.等手册中描述的那些方法。
[0065]
适用于hmo生产的宿主细胞,例如大肠杆菌可以包括内源性β-半乳糖苷酶基因或外源性β-半乳糖苷酶基因,例如,大肠杆菌包括内源性lacz基因(例如,genbank登录号v00296(gi:41901))。为了本发明的目的,将hmo生产细胞基因操纵成包括任何β-半乳糖苷酶基因或包括失活的基因。基因可以通过将相应的核酸序列从细菌基因组中完全或部分删除而失活,或者基因序列在转录过程中发生突变,或者,如果被转录则转录物不被翻译,或如果被翻译成蛋白质(即β-半乳糖苷酶),则该蛋白质不具有相应的酶活性。通过这种方式,hmo生产细菌积聚了增加的细胞内乳糖库,这有利于hmo的生产。
[0066]
在一些实施方式中,工程化细胞,例如细菌,含有缺陷的唾液酸分解代谢途径。“唾液酸分解代谢途径”是指一系列反应,通常由酶控制和催化,从而导致唾液酸降解。本发明所述的示例性唾液酸分解代谢途径是大肠杆菌途径。在该途径中,唾液酸(neu5ac;n-乙酰基神经氨酸)被酶nana(n-乙酰基神经氨酸裂解酶)和nank(n-乙酰基甘露糖胺激酶)和nane(n-乙酰基甘露糖胺-6-磷酸差向异构酶)降解,这些酶均由nanatek-yhch操纵子编码,并受nanr阻遏(http://ecocyc.org/ecoli)。通过在内源性nana(n-乙酰基神经氨酸裂解酶)(例如,genbank登录号d00067.1(gl216588))和/或nank(n-乙酰基甘露糖胺激酶)基因(例如,genbank登录号(氨基酸)bae77265.1(gl85676015))和/或nane(n-乙酰基甘露糖胺-6-磷酸
差向异构酶,gi:947745,将其并入本文作为参考)中引入突变,在大肠杆菌宿主中呈现缺陷型唾液酸分解代谢途径。任选地,nant(n-乙酰基神经氨酸转运蛋白)基因也被失活或突变。唾液酸代谢的其他中间体包括:(mannac-6-p)n-乙酰基甘露糖胺-6-磷酸;(glcnac-6-p)n-乙酰基葡糖胺-6-磷酸;(glcn-6-p)葡糖胺-6-磷酸和(fruc-6-p)果糖-6-磷酸。在一些优选的实施方式中,nana是突变的。在其他优选实施方式中,nana和nank是突变的,而nane保持功能。在另一优选的实施方式中,nana和nane是突变的,而nank没有突变、失活或缺失。突变是编码nana、nank、nane和/或nant的基因产物的核酸序列中的一个或多个变化。例如,突变可以是核酸序列中的1个、2个、最多5个、最多10个、最多25个、最多50个或最多100个变化。例如,nana、nank、nane和/或nant基因通过无效突变而突变。在此所述的无效突变包括氨基酸置换、添加、删除或插入,这些突变导致酶功能丧失(即活性降低或没有活性)或酶丧失(即没有基因产物)。“删除”是指编码区被完全或部分去除,从而不产生(功能性)基因产物。失活是指编码序列已被改变,使得产生的基因产物在功能上无活性或编码的基因产物活性低于天然的、天然产生的、内源性基因产物活性的100%,例如90%、80%、70%、60%、50%、40%、30%或20%。“未突变的”基因或蛋白质与天然的、天然产生的或内源性编码序列不存在1个、2个、最多5个、最多10个、最多20个、最多50个、最多100个、最多200个或最多500个或更多密码子的差异,或与相应的编码的氨基酸序列没有差异。
[0067]
此外,宿主细胞(例如大肠杆菌)还包括唾液酸合成能力。例如,通过提供外源udp-glcnac 2-差向异构酶(例如空肠弯曲杆菌(campylobacter jejuni)的neuc(genbank aak91727.1;gl15193223))或等同物(例如大肠杆菌s88的neuc(genbank yp_002392936.1;gi:218560023))、neu5ac合成酶(例如空肠弯曲杆菌的neub(genbank aak91726.1;gi:15193222))或等同物(例如林氏黄杆菌(flavobacterium limnosediminis)唾液酸合成酶,genbank gl559220424))和/或cmp-neu5ac合成酶(例如,空肠弯曲杆菌的neua(genbank aak91728.1;gl:15193224))或等同物(例如,巴西弧菌(vibrio brasiliensis)cmp-唾液酸合成酶,genbank gi:493937153)),细菌包括唾液酸合成能力。
[0068]
在工程酵母中生产岩藻糖基化hmo也是本领域已知的(参见例如yu et al.,(2018)microb cell fact 17:101;hollands et al.,(2019)methabolic eng 52:232-242))。
[0069]
为了生产含n-乙酰基葡糖胺的hmo,例如乳-n-三糖2(lnt-2)、乳-n-四糖(lnt)、乳-n-新四糖(lnnt)、乳-n-岩藻五糖i(lnfp-i)、乳-n-岩藻五糖ii(lnfp-ii)、乳-n-岩藻五糖iii(lnfp-iii)、乳-n-岩藻五糖v(lnfp-v)、乳-n-二岩藻六糖i(ldfh-i)、乳-n-二岩藻六糖ii(ldfh-ii)和乳-n-新二岩藻六糖ii(lndfh-iii),细菌包括功能性lacy基因和功能异常lacz基因,如上文所述,并且其改造成包括外源性udp-glcnac:galα/β-r-n-乙酰基葡糖胺基转移酶基因(glcnact)或其功能性变体或片段。该外源性udp-glcnac:galα/β-r-3-n-乙酰基葡糖胺基转移酶基因可以获自若干种来源中的任一种(参见表1),例如,来自脑膜炎奈瑟菌(n.meningitidis)(genbank蛋白质登记号aaf42258.1)或淋病奈瑟菌(n.gonorrhoeae)(genbank蛋白质登记号acf31229.1)的igta基因。任选地,在包括外源性udp-glcnac:galα/β-r-3-n-乙酰基葡糖胺基转移酶的细菌中共表达额外的外源性糖基转移酶基因。例如,β-1,4-半乳糖基转移酶基因(gal4t)与udp-glcnac:galα/β-r-3-n-乙酰基葡糖胺基转移酶基因共表达。该外源性β-1,4-半乳糖基转移酶基因可以获自若干种来源中
的任一种,例如,来自脑膜炎奈瑟菌的igtb基因(genbank蛋白质登记号aaf42257.1),或来自幽门螺杆菌(h.pylori)的hp0826/galt基因(genbank蛋白质登记号np_207619.1)。任选地,在包括外源性udp-glcnac:galα/β-r-3-n-乙酰基葡糖胺基转移酶基因的细菌中共表达的额外的外源性糖基转移酶基因是β-1,3-半乳糖基转移酶基因(gal3t),例如,来自大肠杆菌055:h7的wbgo基因(genbank蛋白质登记号wp_000582563),或来自幽门螺杆菌的jhp0563基因(genbank蛋白质登记号aez55696.1)或来自无乳链球菌ib oi2型(streptococcus agalactiae type ib oi2)的cpsibj基因(genbank蛋白质登记号ab050723)。上述任一种酶的功能变体和片段也包括在发明中。
[0070]
n-乙酰基葡糖胺基转移酶的基因和/或半乳糖基转移酶的基因也可以与pglp可操作地连接,并从相应的基因组整合组件中表达。在一实施方式中,基因组整合的基因是编码半乳糖基转移酶的基因,例如编码来自幽门螺杆菌的galt酶的hp0826基因(genbank蛋白质登记号np_207619.1);在另一实施方式中,基因组整合的基因是编码β-1,3-n-乙酰基葡糖胺基转移酶的基因,例如来自脑膜炎奈瑟菌的igta基因(genbank蛋白质登记号aaf42258.1)。在这些实施方式中,第二基因,即编码β-1,3-n-乙酰基葡糖胺基转移酶或半乳糖基转移酶的基因,相应地,可以从基因组整合的或质粒携带的组件中表达。第二基因可以任选地在glp启动子的控制下或在适用于表达系统的任何其他启动子例如plac的控制下表达。
[0071]
除非另有说明,否则本发明中使用的所有技术和科学术语与本发明所属领域的普通技术人员通常理解的含义相同。singleton et al.(1994)dictionary of microbiology and molecular biology,second edition,john wiley and sons(new york)为技术人员提供了本发明中所用的大量术语的通用词典。尽管在本发明的实施或测试中可以使用与本文描述的那些相似或等同的任何方法和材料,但对优选的方法和材料进行了描述。本技术所需的大多数命名法和一般实验室方法可见于sambrook et al.,molecular cloning:a laboratory manual,vol.1-3,cold spring harbor laboratory,cold spring harbor,new york(2012);wilson k.和walker j.,principles and techniques of biochemistry and molecular biology(2010),cambridge university press;或见于maniatise et al.,molecular cloning a laboratory manual,cold spring harbor laboratory(2012);或见于ausubel et al.,current protocols in molecular biology,john wiley and sohns(2010)。这些手册在下文中相应地称为“sambrook et al.”、“wilson&walker”、“maniatise et al.”、“ausubel et al.”。
[0072]
本发明的第二方面涉及一种用于生产一种或多种hmo的方法,该方法包括以下步骤:
[0073]
(i)提供能够生产hmo的基因修饰细胞,其中所述细胞包括编码seq id no:1的蛋白质或其功能性同源物的重组核酸,所述功能性同源物的氨基酸序列与seq id no:1具有至少80%同一性,优选至少85%同一性,更优选至少90%同一性;
[0074]
(ii)在合适的细胞培养基中培养(i)中的细胞,以允许hmo产生和dna序列的表达,从而产生具有氨基酸序列seq id no:1的蛋白质;或氨基酸序列与seq id no:1具有至少80%同一性、优选至少85%同一性、更优选至少90%同一性的功能同源物;
[0075]
(iii)收获在步骤(ii)中产生的hmo。
[0076]
根据本发明,术语“培养”(或“培养”或“培养”,也称为“发酵”)涉及根据行业中已知的方法在受控的生物反应器中的细菌表达细胞的繁殖。
[0077]
为了生产一种或多种hmo,如本发明所述的产生hmo的细菌根据本领域已知的方法,在合适的碳源存在下培养,碳源例如葡萄糖、甘油、乳糖等,产生的hmo从培养基和培养过程中生成的微生物生物质中收获。此后,根据本领域已知的方法来纯化hmo,例如wo2015188834、wo2017182965或wo2017152918中所述的方法,经过纯化的hmo可以用作营养品(nutraceutical)、药物或用于任何其他目的,例如用于研究。hmo的制造通常是通过以较大的量进行培养来完成。本发明中的术语“制造”和“制造规模”的定义是用最小体积为5l的培养液进行发酵。通常,“制造规模”过程定义为能够处理大量的含有所关注hmo或多种hmo的制剂,并且,例如在治疗性化合物或组合物的情形中,能够生产满足临床试验以及市场供应需求的所关注的蛋白质的产量。除量大以外,与摇瓶培养等简单的实验室规模方法相比,制造规模方法的特征还在于使用了生物反应器(发酵罐)技术系统,该系统配备有用于搅拌、曝气、营养物质供应、监测和控制工艺参数(ph、温度、溶解氧张力、背压等)的装置。在很大程度上,实验室规模方法中的表达系统的行为,例如摇瓶、台式生物反应器或公开的实施例中描述的深孔模式,确实允许预测该系统在生物反应器的复杂环境中的表现。
[0078]
关于发酵过程中使用的合适的细胞培养基,没有任何限制。培养基可以是半合成的(semi-defined),即含有复杂的培养基化合物(例如酵母提取物、大豆蛋白胨、酪蛋白水解物等),或者它可以是化学上明确的,不含任何复杂化合物。
[0079]
术语“一种或多种hmo”是指hmo生产细胞可以能够生产单一hmo结构(第一hmo)或多种hmo结构(第二hmo、第三hmo等)。在一些实施方式中,可以优选产生单一hmo的宿主细胞,在其他优选实施方式中,可以优选产生多种hmo结构的宿主细胞。产生单一hmo结构的宿主细胞的非限制性实例是产生2
’‑
fl、3-fl、3
’‑
sl、6
’‑
sl或lnt-2的细胞。能够产生多种hmo结构的宿主细胞的非限制性实例可以是产生dfl、fsl、lnt、lnnt、lnfp i、lnfp ii、lnfp iii、lnfp iv、lnfp v、plnnh的细胞。
[0080]
本发明上下文中的术语“收获”是指在发酵终止后收集所产生的hmo。在不同的实施方式中,它可以包括收集生物质(即宿主细胞)和培养基中包括的hmo,即在发酵液与生物质分离之前/未分离的情况下。在其他实施方式中,产生的hmo可以分别地从生物质和发酵液中,即在生物质与培养基(即发酵液)分离之后/以后。将细胞从培养基中分离可以使用本领域技术人员公知的任何方法,例如任何合适类型的离心或过滤。从培养基中分离细胞可以在收获发酵液之后立即进行,或者在将发酵液储存在适当条件下之后在后续阶段进行。从剩余的生物质(或总发酵)中回收生成的hmo包括将其从生物质(即生产细胞)中提取。它可以通过本领域任何合适的方法来完成,例如通过超声处理、煮沸、均化、使用溶菌酶的酶促裂解,或冷冻和研磨。
[0081]
从发酵中回收之后,hmo可用于进一步的处理和纯化。
[0082]
通过发酵产生的hmo的纯化可以使用wo2016095924、wo2015188834、wo2017152918、wo2017182965、us20190119314(均并入作为参考)中描述的合适方法进行。
[0083]
在本发明的一些实施方式中,宿主细胞可以产生若干种hmo,其中一种hmo是“产物”hmo,而一些/所有其他hmo是“副产物”hmo。通常情况下,副产物hmo是主要hmo的前体,或者主要hmo进一步修饰的产物。在一些实施方式中,可能需要产生大量的产物hmo和少量的
副产物hmo。本发明所述的用于hmo生产的细胞和方法允许具有明确的hmo分布(profile)的hmo产物的受控产生,例如,在一实施方式中,在产生的hmo混合物中,产物hmo与混合物的其他hmo(即副产物hmo)相比,是占优势的hmo,即,比起其他的副产物hmo,产物hmo以更高的量产生;在其他实施方式中,可以调整产生相同hmo混合物的细胞,以便比起产物hmo,以更高的量产生一种或多种副产物hmo。例如,在3-fl(产物hmo)的生产过程中,通常会产生大量的dfl(副产物hmo)。使用本发明的基因修饰细胞,3-fl产物中的dfl含量水平可以显着降低。
[0084]
有利的是,本发明既降低了副产物与产物的比率,同时又增加了产物(和/或总hmo)的总产率。这样,副产物的形成相对于产物的形成较少,有利于提高产物的形成,并且增加生产和产物回收过程的效率,从而提供优越的hmo制造方法。
[0085]
在不同的优选实施方式中,可以选择不同的宿主细胞,以产生2
’‑
fl、3-fl、3
’‑
sl、6
’‑
sl、lnt-2、dfl、fsl、lnt、lnnt、dfl、fsl、lnt、lnnt、lnfp i、lnfp ii、lnfp iii、lnfp iv、lnfp v、plnnh中的一种/两种作为产物或副产物hmo。在一优选的实施方式中,产物是3-fl,副产物是dfl。在另一优选的实施方式中,产物是2
’‑
fl,副产物是dfl。在另一优选的实施方式中,产物是lnt-2,副产物是lnt和lnfp i。
[0086]
本发明还涉及根据本发明的基因修饰细胞和/或核酸构建体用于生产一种或多种寡糖、优选一种或多种人乳寡糖的用途。在一实施方式中,根据本发明的基因修饰细胞或核酸构建体用于生产选自2
’‑
fl、3-fl、dlf、lnt、lnt-ii、lnnt、plnnh和plnh-ii的特定hmo。
[0087]
在特别优选的实施方式中,根据本发明的基因修饰细胞和/或核酸构建体用于生产选自2
’‑
fl和3-fl的特定hmo。
[0088]
本发明通过以下非限制性实施例和实施方式进一步说明。
[0089]
实施例
[0090]
材料和方法
[0091]
除非另有说明,否则使用分子生物学领域中已知的标准技术、载体、控制序列元件和其他表达系统元件用于核酸操纵、转化和表达。此类标准技术、载体和元素可参见,例如:ausubel et al.(eds.),current protocols in molecular biology(1995)(john wiley&sons);sambrook,fritsch,&maniatis(eds.),molecular cloning(1989)(cold spring harbor laboratory press,ny);berger&kimmel,methods in enzymology 152:guide to molecular cloning techniques(1987)(academic press);bukhari et al.(eds.),dna insertion elements,plasmids and episomes(1977)(cold spring harbor laboratory press,ny);miller,j.h.experiments in molecular genetics(1972)(cold spring harbor laboratory press,ny)。
[0092]
以下描述的实施方式是为了说明本发明,而不是以任何方式限制本发明。
[0093]
菌株
[0094]
使用的菌株为mdo,由大肠杆菌k12 dh1构建,大肠杆菌k12 dh1基因型是:f
ˉ
,gyra96,reca1,rela1,enda1,thi-1,hsdr17,supe44。本实施例中使用的菌株描述于表2中。
[0095]
表2
start pcr master mix(thermofisher)、user enzym(new england biolab)均按照供应商的推荐使用。引物由德国eurofins genomics提供。pcr片段和质粒通过eurofins genomics测序。在t100
tm
热循环仪(bio-rad)中使用dreamtaq pcr master mix进行菌落pcr。
[0109]
表3:用于扩增质粒骨架、启动子元件和marc的寡聚物
[0110][0111]
表4:在hmo生产细胞中表达的异源性蛋白质
[0112]
基因基因来源genbank蛋白质登记号蛋白质功能futc幽门螺杆菌26695abo61751.1α-1,2-岩藻糖基转移酶futa幽门螺杆菌26695np_207177.1α-1,3-岩藻糖基转移酶marc粘质沙雷氏菌wp_060448169.1mfs转运蛋白
[0113]
表5:用于marc表达的合成dna
[0114][0115]
[0116]
质粒的构建
[0117]
合成质粒骨架,其含有两个i-scei核酸内切酶位点,上述两个位点被两个适合于同源重组到大肠杆菌基因组的dna片段和t1转录终止子序列隔开。例如,在一质粒骨架中合成gal操纵子(在galk中进行同源重组所需)和t1转录终止子序列(puc57::gal)(genescript)。gal操纵子中用于同源重组的dna序列覆盖了大肠杆菌k-12mg155全基因组genbank:id:cp014225.1序列的碱基对3.628.621-3.628.720和3.627.572-3.627.671。通过同源重组插入会导致galk的949个碱基对和galk-表型缺失。以类似的方式,可以合成基于puc57(genescript)或任何其他合适的载体的骨架,该骨架含有两个i-scei核酸内切酶位点,上述两个位点被两个适合于同源重组到大肠杆菌基因组的dna片段和t1转录终止子序列隔开。使用在分子生物学领域公知的标准技术来设计引物和大肠杆菌k-12dh1染色体dna的特定dna序列的扩增。此类标准技术、载体和元件可参见例如:ausubel et al.(eds.),current protocols in molecular biology(1995)(john wiley&sons);sambrook,fritsch,&maniatis(eds.),molecular cloning(1989)(cold spring harbor laboratory press,ny);berger&kimmel,methods in enzymology 152:guide to molecular cloning techniques(1987)(academic press);bukhari et al.(eds.)。
[0118]
使用寡聚物o261和o262,使用获自大肠杆菌dh1的染色体dna来扩增含有启动子pglpf的300bp dna片段(表3)。
[0119]
含有源自粘质沙雷氏菌的密码子优化版本的marc基因的1.197bp的dna片段由genescript合成(表5)。使用寡核苷酸o737和o738通过pcr对marc基因进行扩增(表3)。
[0120]
纯化所有pcr片段(质粒骨架、含有启动子的元件和marc基因),并组装质粒骨架、启动子元件()和含有marc的dna片段。质粒通过标准user克隆进行克隆。可以使用任何标准的dna克隆技术在任何适当的质粒中进行克隆。将质粒转化到top10细胞中,并在含有100μg/ml氨苄青霉素(或任何合适的抗生素)和0.2%葡萄糖的lb板上进行选择。对构建的质粒进行纯化,并通过dna测序(mwg eurofins genomics)验证启动子序列和marc基因的5’端。通过这种方式,构建含有与marc基因连接的任意所关注启动子的基因组件。
[0121]
菌株的构建
[0122]
使用由大肠杆菌k-12dh1构建的细菌菌株mdo。大肠杆菌k-12dh1基因型为:f
ˉ
,gyra96,reca1,rela1,enda1,thi-1,hsdr17,supe44。除大肠杆菌k-12dh1基因型以外,mdo还具有以下修饰:lacz:删除1.5kbp,laca:删除0.5kbp,nanketa:删除3.3kbp,mela:删除0.9kbp,wcaj:删除0.5kbp,mdoh:删除0.5kbp,在gmd基因上游插入plac启动子。
[0123]
基本按照herring等人的描述,通过gene gorging进行含有与marc基因连接并与t1转录终止子序列连接的启动子的表达组件的插入(herring,c.d.,glasner,j.d.和blattner,f.r.(2003).gene(311).153-163)。简而言之,将供体质粒和辅助质粒共转化到mdo中,并在含有0.2%葡萄糖、氨苄青霉素(100μg/ml)或卡那霉素(50mg/ml)和氯霉素(20μg/ml)的lb板上进行选择。将单个菌落接种在含有氯霉素(20μg/ml)和10μl 20%l-阿拉伯糖的1ml lb中,并在37℃下振摇孵育7-8小时。为了整合到大肠杆菌的galk基因座中,将细胞铺在m9-dog板上,并在37℃下孵育48小时。将mm-dog板上形成的单个菌落在含有0.2%葡萄糖的lb板上重新划线培养,并在37℃下孵育24小时。在macconkey-半乳糖琼脂板上呈现白色、并且对氨苄青霉素和氯霉素均敏感的菌落,预计已丧失供体和辅助质粒,并在galk基
因座中含有插入物。使用引物o48和o49(表3)通过菌落pcr识别galk位点中的插入物,并通过测序验证插入的dna(eurofins genomics,germany)。
[0124]
以类似的方式,使用不同的选择标记基因在大肠杆菌染色体dna中的其他基因座处进行基因组件的插入。
[0125]
深孔检验(dwa)
[0126]
dwa如lv等人(bioprocess biosyst eng(2016)39:1737-1747)最初所述进行,并针对本发明的目的加以优化。更具体地,实施例中公开的菌株使用4天方案在24深孔板中进行筛选。在最初的24小时内,细胞生长至高密度,而在接下来的72小时内,将细胞转移至允许诱导基因表达和产物形成的培养基。具体地,在第1天,使用补充有硫酸镁、硫胺素和葡萄糖的基础基本培养基来制备新鲜接种物。将制备的培养物在34℃下以700rpm摇动孵育24小时后,将细胞转移至新的补充有硫酸镁和硫胺素的基础基本培养基(2ml)中,向其中添加最初一次的20%葡萄糖溶液(1μl)和10%乳糖溶液(0.1ml),然后将50%蔗糖溶液作为碳源提供给细胞。接种新培养基后,将细胞在28℃下以700rpm振摇72小时。经变性和随后的离心之后,通过hplc对上清液进行分析。
[0127]
为对总样品进行分析,通过以4700rpm离心10分钟,使通过煮沸制备的细胞裂解物沉淀。上清液中的hmo浓度通过hplc或hpac方法测定。
[0128]
结果
[0129]
实施例1.表达marc基因的用于3-fl生产的大肠杆菌的工程化
[0130]
可以操纵大肠杆菌k-12(dh1)mdo菌株,以表达所关注的异源基因。例如,菌株mpa5是α-1,3-岩藻糖基转移酶基因、futa和结肠酸基因(gmd-fcl-gmm-wcal-cpsb-cpsg)过表达的3-fl生产菌株。将含有与marc基因连接的启动子元件(pglpf)的表达组件以单一拷贝插入到mpa5背景菌株中,产生菌株mpa6,并导致i)培养基部分中相对较高的3-fl的量和ii)细胞内部相对较低的3-fl的量(图1)。
[0131]
实施例2.表达marc基因的用于2
’‑
fl生产的大肠杆菌的工程化
[0132]
可以操纵大肠杆菌k-12(dh1)mdo菌株,以表达所关注的异源基因。例如,菌株mpa1是α-1,2-岩藻糖基转移酶基因、futc和结肠酸基因(gmd-fcl-gmm-wcal-cpsb-cpsg)过表达的2
’‑
fl生产菌株。将含有与marc基因连接的启动子元件(pglpf)的表达组件插入到mpa1染色体dna中,产生菌株mpa7,并导致i)培养基部分中相对较高的2
’‑
fl的量,和ii)细胞内部相对较低的2
’‑
fl的含量(图2a),和iii)600nm处相对较低的光学密度(图2b)。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1