羧酸盐化合物的制备方法以及酰胺化物化合物的制备方法与流程
1.本发明涉及羧酸盐化合物的制备方法以及酰胺化物(日文原文:
アミデート
)化合物的制备方法。
背景技术:
2.在咪唑鎓骨架上加成二氧化碳的羧酸盐化合物作为稳定的n-杂环碳烯(以下称为nhc碳烯)前体而为人所知,作为氨基甲酸酯树脂制备用的催化剂而被利用。作为以往的羧酸盐化合物的制备方法,已知有使nhc碳烯与二氧化碳反应的方法(非专利文献1)。已知在咪唑鎓骨架的2位加成异氰酸酯的酰胺化物化合物也能够用作氨基甲酸酯树脂制备用的催化剂。作为酰胺化物化合物的制备方法,已知有使作为nhc碳烯的1,3-二烷基咪唑-2-叉基与异氰酸酯化合物反应的方法(非专利文献2)。现有技术文献非专利文献
3.非专利文献1:journal of organic chemistry 2009年74卷7935-7942页非专利文献2:struct.chem.2013年24卷2059-2068页
技术实现要素:
发明要解决的课题
4.在非专利文献1、2所记载的使nhc碳烯与二氧化碳或异氰酸酯反应的方法中,由于nhc碳烯通常对氧或水不稳定,所以必须使用如手套箱的特殊的设备在无水无氧条件下制备,因此并不是能满足实用面的方法。
5.本发明是有鉴于上述背景技术而完成的,其课题在于提供一种羧酸盐化合物或酰胺化物化合物的制备方法,其不需要使用如手套箱的特殊设备的在无水无氧条件下的制备。用于解决问题的技术方案
6.本发明人为了解决上述课题而进行精心研究,结果发现能够通过使咪唑鎓羧酸盐与碳酸二烷酯、碳酸亚烷酯等碳酸酯反应来制备羧酸盐化合物。另外,发现通过使咪唑鎓羧酸盐与碳酸二烷酯、碳酸亚烷酯等碳酸酯反应,进一步使其与苯基异氰酸酯等含氮化合物反应,从而能够制得酰胺化物化合物,进而完成本发明。
7.即,本发明包括以下[1]~[9]。
[0008]
[1]一种下述式(3a)所示的羧酸盐化合物的制备方法,其包含使下述式(1)所示的咪唑鎓羧酸盐与下述式(2)所示的碳酸酯反应的工序,式(1):
[0009]
[化学式1]
(式中,r1以及r4相同或不同,表示被杂原子取代或未被杂原子取代的碳原子数1~20的烃基,r2以及r3相同或不同,表示氢原子或被杂原子取代或未被杂原子取代的碳原子数1~20的烃基,r2以及r3也可以与它们所键合的碳原子共同形成环结构,r5表示氢原子或被杂原子取代或未被杂原子取代的碳原子数1~20的烃基),式(2):
[0010]
[化学式2](式中,r6以及r7相同或不同,表示碳原子数1~6的烃基,r6以及r7与它们所键合的氧原子共同形成环结构或未形成环结构),式(3a):
[0011]
[化学式3](式中,r1、r2、r3以及r4如上述所定义)。[2]根据[1]所述的羧酸盐化合物的制备方法,其中,式(2)所示的碳酸酯为碳酸二甲酯。[3]根据[1]或[2]所述的羧酸盐化合物的制备方法,其中,r2以及r3为氢原子。[4]一种下述式(5)所示的酰胺化物化合物的制备方法,其包含以下的工序1以及工序2,(工序1)是使式(1)所示的咪唑鎓羧酸盐与式(2)所示的碳酸酯反应而获得反应物(a)的工序,式(1):[化学式4](式中,r1以及r4相同或不同,表示被杂原子取代或未被杂原子取代的碳原子数1~20的烃基,r2以及r3相同或不同,表示氢原子或被杂原子取代或未被杂原子取代的碳原子数1~20的烃基,r2以及r3也可以与它们所键合的碳原子共同形成环结构,r5表示氢原子或被杂原子取代或未被杂原子取代的碳原子数1~20的烃基),式(2):
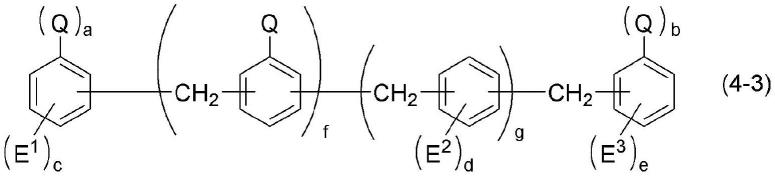
[化学式5](式中,r6以及r7相同或不同,表示碳原子数1~6的烃基,r6以及r7与它们所键合的氧原子共同形成环结构或未形成环结构),(工序2)是将工序1所获得的反应物(a)根据需要进行加热,并使其与式(4)所示的含氮化合物根据需要在加热下反应而获得式(5)所示的酰胺化物化合物的工序,式(4):[化学式6](式中,a表示经取代或未取代的烃基,q表示-nco基或-nhco2r8,r8表示被杂原子取代或未被杂原子取代的烃基,n为1以上的整数),式(5):[化学式7](式中,a、r1、r2、r3、r4、n各自如上述所定义)。[5]根据[4]所述的酰胺化物化合物的制备方法,其中,反应物(a)包含式(3a)所示的羧酸盐化合物,式(3a):[化学式8](式中,r1、r2、r3以及r4如上述所定义)。[6]根据[4]或[5]所述的酰胺化物化合物的制备方法,其中,式(4)所示的含氮化合物为下述式(4-1)~(4-3)中任一项所示的含氮化合物,式(4-1):[化学式9]r
9-q
ꢀꢀꢀ
(4-1)(式中,q如上述所定义,r9为被卤素原子取代或未被卤素原子取代的烃基或被杂原子取代或未被杂原子取代的烃基),式(4-2):
[化学式10]q-r
10-q
ꢀꢀꢀ
(4-2)(式中,q为相同或相异,并如上述所定义,r
10
为被卤素原子取代或未被卤素原子取代的二价烃基或被杂原子取代或未被杂原子取代的二价烃基),式(4-3):[化学式11](式中,q为相同或相异,并如上述所定义,e1、e2以及e3各自独立表示被卤素原子取代或未被卤素原子取代的烃基、被杂原子取代或未被杂原子取代的烃基、卤素原子、二烷基氨基、烷氧基、芳氧基、硝基、氰基、磺酰基、(烷基氨基)羰基氨基、(二烷基氨基)羰基氨基或异氰酸酯基,f以及g各自独立表示0~4的整数,a以及b各为0或1,c、d以及e各自独立表示0~4的整数,其中,f为0时,a或b中至少一者为1)。[7]根据[4]至[6]中任一项所述的酰胺化物化合物的制备方法,其中,式(2)所示的碳酸酯为碳酸二甲酯。[8]根据[4]至[7]中任一项所述的酰胺化物化合物的制备方法,其中,r2以及r3为氢原子。[9]根据[6]至[8]中任一项所述的酰胺化物化合物的制备方法,其中,r9为被卤素原子取代或未被卤素原子取代的芳香族烃基或被杂原子取代或未被杂原子取代的芳香族烃基,r
10
为被卤素原子取代或未被卤素原子取代的二价的芳香族烃基或被杂原子取代或未被杂原子取代的二价的芳香族烃基。发明效果
[0012]
根据本发明,能够提供不需要如手套箱的特殊设备的羧酸盐化合物的制备方法以及酰胺化物化合物的制备方法。
具体实施方式
[0013]
以下,对用于实施本发明的方式进行详细说明。
[0014]
在本发明中,式(3a)所示羧酸盐化合物(以下,称为羧酸盐化合物(3a)。)是通过使式(1)所示的咪唑鎓羧酸盐(以下,称为咪唑鎓羧酸盐(1)。)与式(2)所示碳酸酯(以下,称为碳酸酯(2)。)反应而制备。另外,式(5)所示的酰胺化物化合物的制备方法能够通过经由下述工序1以及工序2来制备。(工序1)是使式(1)所示的咪唑鎓羧酸盐与式(2)所示的碳酸酯反应而获得反应物
(以下,称为反应物(a)。)的工序。式(1):
[0015]
[化学式12](式中,r1以及r4相同或不同,表示被杂原子取代或未被杂原子取代的碳原子数1~20的烃基,r2以及r3相同或不同,表示氢原子或被杂原子取代或未被杂原子取代的碳原子数1~20的烃基,r2以及r3也可以与它们所键合的碳原子共同形成环结构,r5表示氢原子或被杂原子取代或未被杂原子取代的碳原子数1~20的烃基)。式(2):
[0016]
[化学式13](式中,r6以及r7表示相同或相异并表示碳原子数1~6的烃基,r6以及r7也可以与它们所键合的氧原子共同形成环结构)。
[0017]
(工序2)是将工序1所获得的反应物(a)根据需要进行加热,并使其与式(4)所示的含氮化合物(以下,称为含氮化合物(4)。)根据需要在加热下反应而获得式(5)所示的酰胺化物化合物(以下,称为酰胺化物化合物(5)。)的工序。
[0018]
[化学式14](式中,a表示经取代或未取代的烃基,q表示-nco基或-nhco2r8,r8表示被杂原子取代或未被杂原子取代的烃基,n为1以上的整数)。式(5):
[0019]
[化学式15](式中,a、r1、r2、r3、r4、n各自如上述所定义)。
[0020]
在本发明的一个优选实施方式中,反应物(a)包含式(3a)所示羧酸盐化合物。式(3a):[化学式16]
(式中,r1、r2、r3以及r4如上述所定义)。
[0021]
式(1)中,r1以及r4表示被杂原子取代或未被杂原子取代的碳原子数1~20的烃基,优选为被杂原子取代或未被杂原子取代的碳原子数1~12的烃基,优选为被杂原子取代或未被杂原子取代的碳原子数1~8的烃基。作为另一方式,被杂原子取代或未被杂原子取代的碳原子数1~20的烃基优选为被杂原子取代或未被杂原子取代的碳原子数1~20的伯或仲烷基,更优选为被杂原子取代或未被杂原子取代的碳原子数1~12的伯或仲烷基,更优选为被杂原子取代或未被杂原子取代的碳原子数1~8的伯或仲烷基。作为被杂原子取代或未被杂原子取代的碳原子数1~20的烃基,为甲基、乙基、丙基、异丙基、丁基、仲丁基、叔丁基、戊基、己基、辛基、1,1,3,3-四甲基丁基、2-乙基己基、癸基、十二烷基、十四烷基、十六烷基、十八烷基、烯丙基、苄基、环己基、金刚烷基、苯基、2,6-二异丙基苯基、2,4,6-三甲基苯基、2-甲氧基乙基、2-乙氧基乙基、2-(二甲基氨基)乙基等。优选为甲基、乙基、丙基、异丙基、丁基、辛基、1,1,3,3-四甲基丁基、十二烷基、环戊基、环己基、2-乙基己基、苄基、苯基、2,4,6-三甲基苯基,特别优选为甲基、乙基、丁基、辛基、2-乙基己基、1,1,3,3-四甲基丁基、苄基。在r1以及r4中,作为杂原子,可举出:氮原子、氧原子、硫原子等。在烃基被氧原子、氮原子、硫原子等杂原子取代时,烃基为例如具有-o-、-n<、-s-、-so
2-等基团,而烃链被这些基团中断。在烃基被氧原子、氮原子、硫原子等杂原子取代时,优选为烃基被氧原子取代而烃链被-o-基中断。
[0022]
r2以及r3表示氢原子或被杂原子取代或未被杂原子取代的碳原子数1~20的烃基,优选为氢原子。另外,被杂原子取代或未被杂原子取代的碳原子数1~20的烃基优选为被杂原子取代或未被杂原子取代的碳原子数1~6的烃基,特别优选为被杂原子取代或未被杂原子取代的碳原子数1~4的烃基。作为被杂原子取代或未被杂原子取代的碳原子数1~20的烃基,可举出:甲基、乙基、丙基、异丙基、丁基、仲丁基、叔丁基、戊基、己基、辛基、2-乙基己基、癸基、十二烷基、十四烷基、十六烷基、十八烷基、烯丙基、苄基、环己基、金刚烷基、苯基、2,6-二异丙基苯基、2,4,6-三甲基苯基、2-甲氧基乙基、2-乙氧基乙基、2-(二甲基氨基)乙基等。优选为甲基、乙基、丙基、异丙基、丁基、环戊基、环己基、苯基、2-甲氧基乙基、2-乙氧基乙基、2-(二甲基氨基)乙基,特别优选为甲基、乙基、丁基、2-甲氧基乙基、2-乙氧基乙基、2-(二甲基氨基)乙基。在r2以及r3中,作为杂原子,可举出:氮原子、氧原子、硫原子等。在烃基被氧原子、氮原子、硫原子等杂原子取代时,烃基为例如具有-o-、-n<、-s-、-so
2-等基团,而烃链被这些基团中断。在烃基被氧原子、氮原子、硫原子等杂原子取代时,优选为烃基被氧原子取代而烃链被-o-基中断。r2以及r3也可以与它们所键合的碳原子共同形成环结构。r2以及r3与它们所键合的碳原子共同形成环结构时,例如能够采用如下所示的苯并咪唑鎓环结构。
[0023]
[化学式17]
(式中,r1、r4以及r5如上述所定义。rw、r
x
、ry以及rz分别表示氢原子或碳原子数1~20的烃基。
[0024]
r5表示氢原子或被杂原子取代或未被杂原子取代的碳原子数1~20的烃基,优选为被杂原子取代或未被杂原子取代的碳原子数1~20的烃基。作为被杂原子取代或未被杂原子取代的碳原子数1~20的烃基,优选为被杂原子取代或未被杂原子取代的碳原子数1~8的烃基,特别优选为被杂原子取代或未被杂原子取代的1或2的烃基。作为被杂原子取代或未被杂原子取代的碳原子数1~20的烃基,可举出:甲基、乙基、丙基、异丙基、丁基、仲丁基、叔丁基、戊基、己基、辛基、2-乙基己基、癸基、十二烷基、十四烷基、十六烷基、十八烷基、烯丙基、苄基、环己基、金刚烷基、苯基、2,6-二异丙基苯基、2,4,6-三甲基苯基、2-甲氧基乙基、2-乙氧基乙基以及2-(二甲基氨基)乙基等。特别优选为甲基、乙基、丙基、异丙基、丁基、环戊基、环己基、2-乙基己基、苯基,优选为甲基、乙基。
[0025]
在r5中,作为杂原子,可举出:氮原子、氧原子、硫原子等。在烃基被氧原子、氮原子、硫原子等杂原子取代时,烃基为例如具有-o-、-n<、-nh-、-s-、-so
2-等基团,而烃链被这些基团中断。在烃基被氧原子、氮原子、硫原子等杂原子取代时,优选为烃基被氧原子取代而烃链被-o-基中断。另外,作为另一方式,当烃基被氧原子、氮原子、硫原子等杂原子取代时,也能够形成具有-oh、-nh2等基团的烃基。
[0026]
作为咪唑鎓羧酸盐(1),例如,可举出:1,3-二甲基咪唑鎓甲酸盐、1-乙基-3-甲基咪唑鎓甲酸盐、1-丁基-3-甲基咪唑鎓甲酸盐、1-甲基-3-辛基咪唑鎓甲酸盐、1-甲基-3-(1,1,3,3-四甲基丁基)咪唑鎓甲酸盐、1-甲基-3-(2-乙基己基)咪唑鎓甲酸盐、1-十二烷基-3-甲基咪唑鎓甲酸盐、1-甲基-3-十八烷基咪唑鎓甲酸盐、1-苄基-3-甲基咪唑鎓甲酸盐、1,3-二丁基咪唑鎓甲酸盐、1-丁基-3-乙基咪唑鎓甲酸盐、1-丁基-3-辛基咪唑鎓甲酸盐、1-丁基-3-(1,1,3,3-四甲基丁基)咪唑鎓甲酸盐、1-丁基-3-(2-乙基己基)咪唑鎓甲酸盐、1-丁基-3-十二烷基咪唑鎓甲酸盐、1-丁基-3-十八烷基咪唑鎓甲酸盐、1-苄基-3-丁基咪唑鎓甲酸盐、1,3-二辛基咪唑鎓甲酸盐、1,3-双(1,1,3,3-四甲基丁基)咪唑鎓盐、1-乙基-3-辛基咪唑鎓甲酸盐、1-乙基-3-(1,1,3,3-四甲基丁基)咪唑鎓甲酸盐、1-辛基-3-(2-乙基己基)咪唑鎓甲酸盐、1-(1,1,3,3-四甲基丁基)-3-(2-乙基己基)咪唑鎓甲酸盐、1-十二烷基-3-辛基咪唑鎓甲酸盐、1-十二烷基-3-(1,1,3,3-四甲基丁基)咪唑鎓甲酸盐、1-辛基-3-十八烷基咪唑鎓甲酸盐、1-(1,1,3,3-四甲基丁基)-3-十八烷基咪唑鎓盐、1-苄基-3-辛基咪唑鎓甲酸盐、1-苄基-3-(1,1,3,3-四甲基丁基)咪唑鎓甲酸盐、1,3-双(2-乙基己基)咪唑鎓甲酸盐、1-乙基-3-(2-乙基己基)咪唑鎓甲酸盐、1-(2-乙基己基)-3-十二烷基咪唑鎓盐、1-(2-乙基己基)-3-十八烷基咪唑鎓盐、1-苄基-3-(2-乙基己基)咪唑鎓甲酸盐、1,3-二(十二烷基)咪唑鎓甲酸盐、1-十二烷基-3-十八烷基咪唑鎓甲酸盐、1-苄基-3-十二烷基咪唑鎓甲酸盐、1,3-二(十八烷基)咪唑鎓甲酸盐、1-苄基-3-十八烷基咪唑鎓甲酸盐、1,3-二苄基咪唑鎓甲酸盐;
[0027]
1,3-二甲基咪唑鎓乙酸盐、1-乙基-3-甲基咪唑鎓乙酸盐、1-丁基-3-甲基咪唑鎓
乙酸盐、1-甲基-3-辛基咪唑鎓乙酸盐、1-甲基-3-(1,1,3,3-四甲基丁基)咪唑鎓乙酸盐、1-甲基-3-(2-乙基己基)咪唑鎓乙酸盐、1-十二烷基-3-甲基咪唑鎓乙酸盐、1-甲基-3-十八烷基咪唑鎓乙酸盐、1-苄基-3-甲基咪唑鎓乙酸盐、1,3-二丁基咪唑鎓乙酸盐、1-丁基-3-乙基咪唑鎓乙酸盐、1-丁基-3-辛基咪唑鎓乙酸盐、1-丁基-3-(1,1,3,3-四甲基丁基)咪唑鎓乙酸盐、1-丁基-3-(2-乙基己基)咪唑鎓乙酸盐、1-丁基-3-十二烷基咪唑鎓乙酸盐、1-丁基-3-十八烷基咪唑鎓乙酸盐、1-苄基-3-丁基咪唑鎓乙酸盐、1,3-二辛基咪唑鎓乙酸盐、1,3-双(1,1,3,3-四甲基丁基)咪唑鎓咪唑鎓乙酸盐、1-乙基-3-辛基咪唑鎓乙酸盐、1-乙基-3-(1,1,3,3-四甲基丁基)咪唑鎓乙酸盐、1-辛基-3-(2-乙基己基)咪唑鎓乙酸盐、1-(1,1,3,3-四甲基丁基)-3-(2-乙基己基)咪唑鎓乙酸盐、1-十二烷基-3-辛基咪唑鎓乙酸盐、1-十二烷基-3-(1,1,3,3-四甲基丁基)咪唑鎓乙酸盐、1-辛基-3-十八烷基咪唑鎓乙酸盐、1-(1,1,3,3-四甲基丁基)-3-十八烷基咪唑鎓乙酸盐、1-苄基-3-辛基咪唑鎓乙酸盐、1-苄基-3-(1,1,3,3-四甲基丁基)咪唑鎓乙酸盐、1,3-双(2-乙基己基)咪唑鎓乙酸盐、1-乙基-3-(2-乙基己基)咪唑鎓乙酸盐、1-(2-乙基己基)-3-十二烷基咪唑鎓乙酸盐、1-(2-乙基己基)-3-十八烷基咪唑鎓乙酸盐、1-苄基-3-(2-乙基己基)咪唑鎓乙酸盐、1,3-二(十二烷基)咪唑鎓乙酸盐、1-十二烷基-3-十八烷基咪唑鎓乙酸盐、1-苄基-3-十二烷基咪唑鎓乙酸盐、1,3-二(十八烷基)咪唑鎓乙酸盐、1-苄基-3-十八烷基咪唑鎓乙酸盐、1,3-二苄基咪唑鎓乙酸盐;
[0028]
1,3-二甲基咪唑鎓2-乙基己酸盐、1-乙基-3-甲基咪唑鎓2-乙基己酸盐、1-丁基-3-甲基咪唑鎓2-乙基己酸盐、1-甲基-3-辛基咪唑鎓2-乙基己酸盐、1-甲基-3-(1,1,3,3-四甲基丁基)咪唑鎓2-乙基己酸盐、1-甲基-3-(2-乙基己基)咪唑鎓2-乙基己酸盐、1-十二烷基-3-甲基咪唑鎓2-乙基己酸盐、1-甲基-3-十八烷基咪唑鎓2-乙基己酸盐、1-苄基-3-甲基咪唑鎓2-乙基己酸盐、1,3-二丁基咪唑鎓2-乙基己酸盐、1-丁基-3-乙基咪唑鎓2-乙基己酸盐、1-丁基-3-辛基咪唑鎓2-乙基己酸盐、1-丁基-3-(1,1,3,3-四甲基丁基)咪唑鎓2-乙基己酸盐、1-丁基-3-(2-乙基己基)咪唑鎓2-乙基己酸盐、1-丁基-3-十二烷基咪唑鎓2-乙基己酸盐、1-丁基-3-十八烷基咪唑鎓2-乙基己酸盐、1-苄基-3-丁基咪唑鎓2-乙基己酸盐、1,3-二辛基咪唑鎓2-乙基己酸盐、1,3-双(1,1,3,3-四甲基丁基)咪唑鎓2-乙基己酸盐、1-乙基-3-辛基咪唑鎓2-乙基己酸盐、1-乙基-3-(1,1,3,3-四甲基丁基)咪唑鎓2-乙基己酸盐、1-辛基-3-(2-乙基己基)咪唑鎓2-乙基己酸盐、1-(1,1,3,3-四甲基丁基)-3-(2-乙基己基)咪唑鎓2-乙基己酸盐、1-十二烷基-3-辛基咪唑鎓2-乙基己酸盐、1-十二烷基-3-(1,1,3,3-四甲基丁基)咪唑鎓2-乙基己酸盐、1-辛基-3-十八烷基咪唑鎓2-乙基己酸盐、1-(1,1,3,3-四甲基丁基)-3-十八烷基咪唑鎓2-乙基己酸盐、1-苄基-3-辛基咪唑鎓2-乙基己酸盐、1-苄基-3-(1,1,3,3-四甲基丁基)咪唑鎓2-乙基己酸盐、1,3-双(2-乙基己基)咪唑鎓2-乙基己酸盐、1-乙基-3-(2-乙基己基)咪唑鎓2-乙基己酸盐、1-(2-乙基己基)-3-十二烷基咪唑鎓2-乙基己酸盐、1-(2-乙基己基)-3-十八烷基咪唑鎓2-乙基己酸盐、1-苄基-3-(2-乙基己基)咪唑鎓2-乙基己酸盐、1,3-二(十二烷基)咪唑鎓2-乙基己酸盐、1-十二烷基-3-十八烷基咪唑鎓2-乙基己酸盐、1-苄基-3-十二烷基咪唑鎓2-乙基己酸盐、1,3-二(十八烷基)咪唑鎓2-乙基己酸盐、1-苄基-3-十八烷基咪唑鎓2-乙基己酸盐、1,3-二苄基咪唑鎓2-乙基己酸盐;
[0029]
1,3-二甲基苯并咪唑鎓甲酸盐、1,3-二甲基苯并咪唑鎓乙酸盐、3-二甲基苯并咪唑鎓-2-乙基己酸盐。
[0030]
作为咪唑鎓羧酸盐(1),优选为:1,3-二甲基咪唑鎓乙酸盐、1-乙基-3-甲基咪唑鎓乙酸盐、1-丁基-3-甲基咪唑鎓乙酸盐、1-甲基-3-辛基咪唑鎓乙酸盐、1-甲基-3-(1,1,3,3-四甲基丁基)咪唑鎓乙酸盐、1-甲基-3-(2-乙基己基)咪唑鎓乙酸盐、1-十二烷基-3-甲基咪唑鎓乙酸盐、1-苄基-3-甲基咪唑鎓乙酸盐、1,3-二丁基咪唑鎓乙酸盐、1-丁基-3-乙基咪唑鎓乙酸盐、1-丁基-3-辛基咪唑鎓乙酸盐、1-丁基-3-(1,1,3,3-四甲基丁基)咪唑鎓乙酸盐、1-丁基-3-(2-乙基己基)咪唑鎓乙酸盐、1-丁基-3-十二烷基咪唑鎓乙酸盐、1-苄基-3-丁基咪唑鎓乙酸盐、1,3-二辛基咪唑鎓乙酸盐、1,3-双(1,1,3,3-四甲基丁基)咪唑鎓乙酸盐、1-乙基-3-辛基咪唑鎓乙酸盐、1-乙基-3-(1,1,3,3-四甲基丁基)咪唑鎓乙酸盐、1-辛基-3-(2-乙基己基)咪唑鎓乙酸盐、1-(1,1,3,3-四甲基丁基)-3-(2-乙基己基)咪唑鎓乙酸盐、1-十二烷基-3-辛基咪唑鎓乙酸盐、1-十二烷基-3-(1,1,3,3-四甲基丁基)咪唑鎓乙酸盐、1-苄基-3-辛基咪唑鎓乙酸盐、1-苄基-3-(1,1,3,3-四甲基丁基)咪唑鎓乙酸盐、1,3-双(2-乙基己基)咪唑鎓乙酸盐、1-乙基-3-(2-乙基己基)咪唑鎓乙酸盐、1-(2-乙基己基)-3-十二烷基咪唑鎓乙酸盐、1-苄基-3-(2-乙基己基)咪唑鎓乙酸盐、1,3-二(十二烷基)咪唑鎓乙酸盐、1-苄基-3-十二烷基咪唑鎓乙酸盐、1,3-二苄基咪唑鎓乙酸盐。
[0031]
咪唑鎓羧酸盐(1)也可以使用市售的咪唑鎓羧酸盐。咪唑鎓羧酸盐(1)也可以使用以公知方法制得的咪唑鎓羧酸盐,另外,也可以使用按下述说明的方法制得的咪唑鎓羧酸盐。
[0032]
使下述式(6)所示的二羰基化合物、下述式(7a)所示的伯胺化合物、下述式(7b)所示的伯胺化合物、甲醛以及下述式(8)所示的羧酸反应而获得式(1)的羧酸盐化合物。
[0033]
式(6):
[0034]
[化学式18](式中,r2以及r3如上述所定义)。
[0035]
式(7a):
[0036]
[化学式19]r
1-nh2ꢀꢀꢀ
(7a)(式中,r1如上述所定义)。
[0037]
式(7b):
[0038]
[化学式20]r
4-nh2ꢀꢀꢀ
(7b)(式中,r4如上述所定义)。
[0039]
式(8):
[0040]
[化学式21]
[0041]
式中,r5如上述所定义。
[0042]
作为式(6)所示的二羰基化合物(以下,称为二羰基化合物(6)。),可举出:乙二醛、联乙酰、3,4-己二酮、2,3-戊二酮、2,3-庚二酮、5-甲基-2,3-己二酮、3-甲基-2,3-环戊二酮、1,2-环己二酮、1-苯基-1,2-丙二酮、联苯甲酰,优选为乙二醛以及联乙酰,更优选为乙二醛。
[0043]
作为式(7a)所示的伯胺化合物(以下,称为伯胺化合物(7a)。)以及式(7b)所示的伯胺化合物(以下,称为伯胺化合物(7b)。),为选自于由甲胺、乙胺、丙胺、异丙胺、丁胺、叔丁胺、己胺、辛胺、1,1,3,3-四甲基丁胺、2-乙基己胺、十二烷基胺、十四基胺、十六基胺、十八烷基胺、2-甲氧基乙胺、2-乙氧基乙胺、3-甲氧基丙胺、3-乙氧基丙胺、3-丙氧基丙胺、3-异丙氧基丙胺、3-丁氧基丙胺、3-(2-乙基己基氧基)丙胺、烯丙基胺、苄基胺、苯胺、2,6-二异丙基苯胺、2,4,6-三甲基苯胺所构成组中的至少一种伯胺化合物,优选为甲胺、乙胺、丁胺、己胺、辛胺、(1,1,3,3-四甲基丁基)胺、2-乙基己胺、十二烷基胺、十八烷基胺、苄基胺,更优选为丁胺、辛胺、1,1,3,3-四甲基丁胺、2-乙基己胺、苄基胺。
[0044]
作为式(8)所示羧酸(以下,称为羧酸(8)。),为甲酸、乙酸、丙酸、丁酸、戊酸、己酸、庚酸、辛酸、2-乙基己酸、癸酸、月桂酸、十四烷酸、棕榈酸、十八烷酸、环己酸、乙氧基乙酸、丙氧基乙酸、2-(2-甲氧基乙氧基)乙酸、2-(2-乙氧基乙氧基)乙酸、2-(2-丙氧基乙氧基)乙酸、3-甲氧基丙酸、3-乙氧基丙酸、3-(2-甲氧基乙氧基)丙酸、3-(2-乙氧基乙氧基)丙酸、3-(2-丙氧基乙氧基)丙酸、3-(3-甲氧基丙氧基)丙酸、3-(3-乙氧基丙氧基)丙酸、3-(3-丙氧基丙氧基)丙酸、油酸、亚油酸、山梨酸、苯甲酸、邻苯二甲酸、间苯二甲酸、对苯二甲酸、乳酸、水杨酸、三氟乙酸等羧酸,优选为甲酸、乙酸、丙酸、丁酸、戊酸、己酸、庚酸、辛酸、2-乙基己酸,更优选为乙酸。
[0045]
二羰基化合物(6)也可以直接使用水溶液或甲醇、丁醇等醇溶液。
[0046]
作为伯胺化合物(7a)以及伯胺化合物(7b)(以下,将伯胺化合物(7a)以及伯胺化合物(7b)统称为胺化合物(7)。)的使用量,通常,相对于1摩尔二羰基化合物(6),伯胺化合物(7a)与伯胺化合物(7b)的合计量为0.1~10摩尔,优选为0.5~3摩尔。相对于1摩尔二羰基化合物(6),伯胺化合物(7)会有2摩尔反应而生成1摩尔咪唑鎓羧酸盐(1),在例如伯胺化合物(7)不足2摩尔时,除咪唑鎓羧酸盐(1)以外,还能够获得二羰基化合物(6)(原料)与1摩尔胺化合物(7)反应而得到的单羰基-单氨基化合物作为混合物。另外,在相对于1摩尔二羰基化合物(6)使用超过2摩尔的伯胺化合物(7)时,除了目标的咪唑鎓羧酸盐(1)外,还会存在过剩量的伯胺化合物(7)。即使使用这些咪唑鎓羧酸盐(1)以外的化合物共存的咪唑鎓羧酸盐(1),也能够获得羧酸盐化合物(3a)。
[0047]
伯胺化合物(7a)与伯胺化合物(7b)的比率(摩尔比)并没有特别限定,为伯胺化合物(7a):伯胺化合物(7b)=0:100~100:0的范围。此外,在伯胺化合物(7a):伯胺化合物(7b)=0:100或伯胺化合物(7a):伯胺化合物(7b)=100:0时,r1=r4,即使在伯胺化合物(7a):伯胺化合物(7b)=1:1时,式(1)的化合物仍为(r1、r1)、(r1、r4)、(r4、r4)的3种组合的混合物,在伯胺化合物(7a):伯胺化合物(7b)=0:100~100:0时,(r1、r1)、(r1、r4)、(r4、r4)这3种组合的比率不同,这些3种为在r1与r4可以相同也可以相异下包含于式(1)的化合物中。
[0048]
甲醛可以直接使用水溶液或甲醇、丁醇等醇溶液。作为甲醛的使用量方面,通常相对于1摩尔二羰基化合物(6),甲醛为0.1~10摩尔,优选为0.5~5.0摩尔。
[0049]
作为羧酸(8)的使用量,通常相对于1摩尔二羰基化合物(6)而为0.1~10摩尔,优选为0.5~2摩尔,进一步优选为1~1.5摩尔。
[0050]
反应温度根据使用原料、溶剂等而最适的温度而有所不同,但通常为-10℃以上,优选为0℃~100℃。反应时间通常为0.1~24小时,优选为1~10小时。
[0051]
溶剂可以使用也可以不使用。在使用溶剂时,使用的溶剂只要不对反应造成影响即不特别受限。作为溶剂的具体例,可举出:甲苯、苯、二甲苯等芳香族烃溶剂、甲基环己烷、环己烷、己烷、庚烷以及辛烷等烃溶剂、二氯甲烷以及氯仿等卤代烃溶剂、二乙醚、四氢呋喃以及1,4-二噁烷等醚溶剂、甲醇以及乙醇等醇溶剂、n,n-二甲基甲酰胺、乙腈以及水等,优选为芳香族烃溶剂、醇溶剂以及水,特别优选为甲苯以及水。溶剂也能够根据需要而混合两种以上使用。
[0052]
相对于1质量份二羰基化合物(6),溶剂的使用量通常为50质量份以下,优选为0.1~10质量份。
[0053]
也可以根据需要而在氮、氩、氦等不会对反应造成影响的非活性气体气氛下反应。
[0054]
反应结束后,能够通过利用使用有机溶剂清洗的杂质(例如,未反应原料)的去除、或反应液的浓缩等来分离咪唑鎓羧酸盐(1),也可以根据需要进行重结晶等纯化。
[0055]
对式(2)所示的碳酸酯(以下,称为碳酸酯(2)。)进行说明。
[0056]
在式(2)中,r6以及r7相同或不同,表示碳原子数1~6的烃基,优选为碳原子数1~4的烃基,特别优选为甲基。在另一方式中,碳原子数1~6的烃基优选为碳原子数1~6的烷基,更优选为碳原子数1~4的烷基。r6以及r7也可以与它们所键合的氧原子共同形成环结构。作为碳酸酯(2)的具体例,可举出:碳酸二甲酯、碳酸二乙酯、碳酸二丙酯、碳酸二丁酯、碳酸二戊酯、碳酸二己酯等碳酸二烷酯,碳酸亚乙酯、碳酸亚丙酯、碳酸亚丁酯等碳酸亚烷酯,优选为碳酸二甲酯、碳酸二乙酯、碳酸二丙酯、碳酸二丁酯,特别优选为碳酸二甲酯。
[0057]
在羧酸盐化合物(3a)的制备以及(工序1)中,碳酸酯(2)的使用量相对于1摩尔咪唑鎓羧酸盐(1)通常为1摩尔以上,优选为1~6摩尔。另外,在咪唑鎓羧酸盐(1)中含有过量羧酸或水时,由于这些会与碳酸酯(2)反应,因此相对在咪唑鎓羧酸盐(1)中过剩的羧酸以及水的合计1摩尔,优选过量使用通常1摩尔以上碳酸酯(2),优选为1~6摩尔。
[0058]
在羧酸盐化合物(3a)的制备以及(工序1)中,溶剂可以使用也可以不使用。在使用溶剂时,所用溶剂只要不对反应造成影响即不特别受限。溶剂的具体例可举出:甲醇、乙醇、丙醇、丁醇、戊醇、己醇、1-甲氧基-2-丙醇、乙氧基乙醇等一元醇溶剂,乙二醇、丙二醇、二乙二醇等多元醇溶剂,二丙二醇单丁基醚、二丙二醇单甲基醚、三丙二醇单甲基醚等二醇单烷基醚溶剂,甲苯、苯、二甲苯等芳香族烃溶剂,甲基环己烷、环己烷、己烷、庚烷、辛烷等脂肪族烃溶剂,乙酸乙酯或乙酸丁酯等酯溶剂,甲基乙基酮、4-甲基-2-戊酮等酮溶剂等,优选为一元醇溶剂,特别优选为甲醇。相对于1质量份咪唑鎓羧酸盐(1),溶剂的使用量通常为50质量份以下,优选为10质量份以下。
[0059]
在羧酸盐化合物(3a)的制备以及(工序1)中,反应温度能够根据使用的原料、溶剂等而最适的温度有所不同,但通常为室温以上,优选为20~200℃。反应时间通常为0.1~48小时,优选为1~24小时。此外,在本说明书中室温通常是指20℃左右。
[0060]
在羧酸盐化合物(3a)的制备以及(工序1)中,也可以根据需要而在氮、氩、氦等不会对反应造成影响的非活性气体气氛下反应。
[0061]
在羧酸盐化合物(3a)的制备中,反应结束后能够浓缩反应液并去除溶剂而制成羧酸盐化合物(3a)。也可以根据需要进行重结晶或管柱分取等纯化。另外,能够使羧酸盐化合物(3a)与式(4)所示含氮化合物根据需要在加热下反应,从而制备式(5)所示的酰胺化物化合物。在通过该方法制备式(5)所示酰胺化物化合物时,能够采用与后述的(工序2)相同的方法。通过(工序1)而获得的反应物(a)也可以在(工序2)中直接作为原料的反应物(a)使用。另外,在(工序1)中,所获得的反应物(a)中有碳酸酯(2)或溶剂残留时,能够在浓缩反应液并去除碳酸酯(2)或溶剂的基础上,制成作为反应物(a)(工序2)的原料。
[0062]
<工序2>将工序1所获得的反应物(a)根据需要进行加热,并使其与式(4)所示的含氮化合物根据需要在加热下反应,从而能够制备式(5)所示的酰胺化物化合物。加热下是指从40℃至溶剂沸腾的温度,例如40~200℃。工序2的反应可以在室温下进行也可以在加热下进行。在此,如上所述,在本发明的一个优选实施方式中,反应物(a)包含羧酸盐化合物(3a),但反应物(a)除了羧酸盐化合物(3a)以外,也能够包含下述式(3b)~(3f)所示的化合物(以下,分别称为化合物(3b)、化合物(3c)、化合物(3d)、化合物(3e)、化合物(3f)(反应式1)。其中,化合物(3b)是在式(3a)中r2为氢原子时,在化合物(3c)是在式(3a)中r3为氢原子时,能够包括在反应物(a)中。
[0063]
(反应式1)
[0064]
[化学式22](式中,r1~r4、r6、r7如上述所定义)。
[0065]
式(3d)所示的化合物或/和式(3e)所示的化合物作为工序1的反应的中间体而生成,并从这些生成羧酸盐化合物(3a)或/和式(3f)所示的化合物。在式(3a)中r2为氢原子时、式(3c)所示的化合物是在r3为氢原子时,能够通过与羧酸盐化合物(3a)的平衡而产生
化合物(3b)。
[0066]
化合物(3b)以及化合物(3c)与羧酸盐化合物(3a)平衡,因此在工序2中若羧酸盐化合物(3a)被消耗,则平衡会偏离,而化合物(3b)、化合物(3c)转换成羧酸盐化合物(3a)。因此,推测化合物(3b)以及化合物(3c)能够作为与羧酸盐化合物(3a)等价来处理。
[0067]
化合物(3d)以及化合物(3e)如下述反应物2所示,能够以与羧酸盐化合物(3a)同样的方式与式(4a)所示的化合物反应而制备酰胺化物化合物(5)。因此,能够作为与羧酸盐化合物(3a)等价来处理。并且,会副生成下述反应式中的(4b')或(4b”)所示的化合物。式(4b')或(4b”)所示的化合物会因热而如下述反应式所示分解成对应的式(9a)或(9b)所示的醇化合物以及式(4a)所示的异氰酸酯化合物。经分解而产生的式(4a)所示的异氰酸酯化合物会被消耗在与反应物(a)所含有的羧酸盐化合物(3a)、化合物(3b)~(3f)的反应上。在下述反应式2中,示出了式(4)中q为-nco基的情况,但q为-nhco2r8的情况也是相同的。
[0068]
(反应式2)
[0069]
[化学式23]
[0070]
(式中,r1~r4、r6~r7、a、n如上述所定义)。另外,在反应物(a)中,化合物(3f)能够通过脱水而转换成羧酸盐化合物(3a)。该脱水反应认为是在常温常压下能够轻易发生的反应。因而推测能够作为与羧酸盐化合物(3a)等价来处理。
[0071]
针对式(4)所示的含氮化合物(以下,称为含氮化合物(4)。)进行说明。
[0072]
式(4)中,a为经取代或未取代的烃基,优选为经取代或未取代的碳原子数1~100的烃基,更优选为被卤素原子取代或未被卤素原子取代的烃基或被杂原子取代或未被杂原子取代的烃基,特别优选为被卤素原子取代或未被卤素原子取代的碳原子数1~30的烃基
或被杂原子取代或未被杂原子取代的碳原子数1~30的烃基。作为a表示的经取代或未取代的烃基中的“烃基”,可举出:芳基、烷基、芳烷基,具体而言,可举出:甲基、乙基、正丙基、异丙基、正丁基、正戊基、正己基、正庚基、正辛基、正壬基、正癸基、正十二烷基、正十八烷基、环己基等的直链、支链或环状的烷基,苯基、2-甲基苯基、2,6-二甲基苯基、2,4-二甲基苯基、2,3-二甲基苯基、萘基等芳基,苯基甲基、苯基乙基、1-苯基丙基、2-苯基丙基、1-苯基丁基、2-苯基丁基、萘基甲基、萘基乙基等芳烷基,上述烷基与芳基经适当组合而成的芳烷基等。
[0073]
在a为具有取代基的烃基时,作为取代基的例子,可举出:氟原子、氯原子、溴原子以及碘原子等卤素原子、二甲基氨基等二烷基氨基、甲氧基以及乙氧基等烷氧基、苄氧基等芳氧基、三氟甲基等卤化烷基、硝基、氰基、磺酰基、(烷基氨基)羰基氨基、(二烷基氨基)羰基氨基或异氰酸酯基等。另外,a的烃基可以被氧原子、氮原子、硫原子等杂原子取代。在a的烃基被氧原子、氮原子、硫原子等杂原子取代时,烃基为例如具有-o-、-n<、-s-、-so
2-等基团,而烃链被这些基团中断。
[0074]
作为上述二烷基氨基、烷氧基、卤化烷基、(烷基氨基)羰基氨基以及(二烷基氨基)羰基氨基的烷基部分,可举出:甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基以及正戊基等直链状或支链状的碳原子数1~6的烷基。烷基的碳原子数优选为碳原子数1~3,更优选为碳原子数1或2。
[0075]
作为上述芳氧基的芳基部分,可举出:例如碳原子数6~10的芳基。具体而言,可举出:例如苯基、萘基等。
[0076]
能够将取代基的数量设为1~5个,优选为1~3个,更优选为1或2个。
[0077]
式(4)中,n为1以上的整数,优选为1~6,更优选为1~4,特别优选为1或2。
[0078]
式(4)中,q为-nco基或-nhco2r8基。r8为能够含有杂原子的烃基,优选为能够含有杂原子的碳原子数1~50的烃基,更优选为能够含有杂原子的碳原子数1~30的烃基,特别优选为能够含有杂原子的碳原子数1~8的烃基。作为能够含有杂原子的烃基,可举出:甲基、乙基、丙基、异丙基、丁基、仲丁基、叔丁基、戊基、己基、辛基、癸基、十二烷基、烯丙基、苄基、环己基、金刚烷基、苯基、2,6-二异丙基苯基、2,4,6-三甲基苯基、2-甲氧基乙基、2-乙氧基乙基以及2-(二甲基氨基)乙基等。优选为甲基、乙基、丙基、异丙基、叔丁基、辛基、环戊基、环己基、2,4,6-三甲基苯基,更优选为甲基、乙基、异丙基、叔丁基、辛基、苯基,特别优选为甲基、异丙基、叔丁基、辛基、苯基。
[0079]
本发明中,作为含氮化合物(4),优选为式(4-1)、(4-2)或(4-3)中任一项所示的含氮化合物,优选为式(4-1)所示的含氮化合物。
[0080]
式(4-1):
[0081]
[化学式24]r
9-q
ꢀꢀꢀ
(4-1)(式中,q如上述所定义,r9为被卤素原子取代或未被卤素原子取代的烃基或被杂原子取代或未被杂原子取代的烃基)。式(4-2):
[0082]
[化学式25]q-r
10-q
ꢀꢀꢀ
(4-2)
(式中,q如上述所定义,r
10
为被卤素原子取代或未被卤素原子取代的二价烃基或被杂原子取代或未被杂原子取代的二价烃基)。式(4-3):
[0083]
[化学式26](式中,q为相同或相异,并如上述所定义,e1、e2以及e3各自独立表示被卤素原子取代或未被卤素原子取代的烃基、被杂原子取代或未被杂原子取代的烃基、卤素原子、二烷基氨基、烷氧基、芳氧基、硝基、氰基、磺酰基、(烷基氨基)羰基氨基、(二烷基氨基)羰基氨基或异氰酸酯基,f以及g各自独立表示0~4的整数,a以及b各为0或1,c、d以及e各自独立表示0~4的整数,其中,f为0时,a或b中至少一者为1)。
[0084]
在q为-nco基时,含氮化合物(4)为下述式(4a)所示的异氰酸酯化合物(以下,称为异氰酸酯化合物(4a)。),在q为-nhco2r8基时,则为下述式(4b)所示的氨基甲酸酯化合物(以下,称为氨基甲酸酯化合物(4b)。)。
[0085]
式(4a):
[0086]
[化学式27](式中,a、n如上述所定义)。
[0087]
式(4b):
[0088]
[化学式28](式中,a、n、r8如上述所定义)。
[0089]
式(4-1)、(4-2)以及(4-3)中,在q为-nco基时,式(4-1)、(4-2)以及(4-3)所示的含氮化合物分别为式(4a-1)、(4a-2)以及(4a-3)所示的结构。
[0090]
式(4a-1):
[0091]
[化学式29]r
9-nco
ꢀꢀꢀ
(4a-1)
[0092]
(式中,r9如上述所定义)。
[0093]
式(4a-2):
[0094]
[化学式30]ocn-r
10-nco
ꢀꢀꢀ
(4a-2)
[0095]
(式中,r
10
如上述所定义)。
[0096]
式(4a-3):
[0097]
[化学式31]
[0098]
(式中,e1、e2、e3、a、b、c、d、e、f、g如上述所定义)。
[0099]
本发明中,异氰酸酯化合物(4a)也能够使用聚亚甲基聚苯基聚异氰酸酯(polymeric mdi)等聚合物。
[0100]
式(4a-1)中,r9为被卤素原子取代或未被卤素原子取代的烃基或被杂原子取代或未被杂原子取代的烃基,优选为被卤素原子取代或未被卤素原子取代的碳原子数1~50的烃基或被杂原子取代或未被杂原子取代的碳原子数1~50的烃基,更优选为被卤素原子取代或未被卤素原子取代的碳原子数1~30的烃基或被杂原子取代或未被杂原子取代的碳原子数1~30的烃基,特别优选为被卤素原子取代或未被卤素原子取代的碳原子数1~12的烃基或被杂原子取代或未被杂原子取代的碳原子数1~12的烃基。另外,作为烃基,优选为芳基、芳烷基等芳香族烃基。作为r9所示的被卤素原子取代或未被卤素原子取代的烃基或被杂原子取代或未被杂原子取代的烃基,具体而言,可举出:甲基、乙基、丙基、异丙基、丁基、仲丁基、叔丁基、戊基、己基、庚基、癸基、十二烷基、十八烷基、环丙基、环戊基、环己基、苯基、氯苯基、萘基、苄基、苯乙基、甲苯基、烯丙基等,优选为苄基、苯基。
[0101]
作为r9表示的被卤素原子取代或未被卤素原子取代的烃基或被杂原子取代或未被杂原子取代的烃基中的卤素原子,可举出:氟原子、氯原子、溴原子、碘原子等。此外,r9的烃基可以被氧原子、氮原子以及硫原子等杂原子取代。在r9的烃基被氧原子、氮原子、硫原子等杂原子取代时,烃基为例如具有-o-、-n<、-s-、-so
2-等基团,而烃链被这些基团中断。
[0102]
式(4a-2)中,r
10
为被卤素原子取代或未被卤素原子取代的二价烃基或被杂原子取代或未被杂原子取代的二价烃基,优选为被卤素原子取代或未被卤素原子取代的碳原子数1~100的二价烃基或被杂原子取代或未被杂原子取代的碳原子数1~100的二价烃基,更优选为被卤素原子取代或未被卤素原子取代的碳原子数1~50的二价烃基或被杂原子取代或未被杂原子取代的碳原子数1~50的二价烃基,特别优选为被卤素原子取代或未被卤素原子取代的碳原子数1~30的二价烃基或被杂原子取代或未被杂原子取代的碳原子数1~30的二价烃基。另外,烃基优选为亚芳基、芳基亚烷基、亚芳基亚烷基等二价芳香族烃基。作为被卤素原子取代或未被卤素原子取代的二价烃基或被杂原子取代或未被杂原子取代的二价烃基,具体而言,可举出:亚甲基、二甲基亚甲基、亚乙基、亚正丙基、亚正丁基、亚正戊基、亚正己基、亚正庚基、亚正辛基、亚正壬基、亚正癸基、亚正十二烷基、亚正十八烷基、亚环己基等亚烷基,亚苯基、2-甲基亚苯基、2,6-二甲基亚苯基、2,4-二甲基亚苯基、2,3-二甲基亚苯基、亚萘基等亚芳基,苯基亚甲基、苯基亚乙基、1-苯基亚丙基、2-苯基亚丙基、1-苯基亚丁基、2-苯基亚丁基、萘基亚甲基、萘基亚乙基等芳基亚烷基、上述亚烷基与亚芳基适当组合而成的亚芳基亚烷基等。这些二价烃基也可以重复或组合而构成1个二价烃基。
[0103]
在r
10
所示的二价烃基被卤素原子取代时,与二价烃基中的碳原子键合的氢原子的
一部分或全部可以被卤素原子取代。作为卤素原子,可举出:氟原子、氯原子、溴原子、碘原子等。作为被卤素原子取代的二价烃基,具体而言,可举出:1-氯-3,5-亚苯基、2-氯-1,4-亚苯基、1-溴-3,5-亚苯基、1,4-二氯-3,5-亚苯基、1,2,4,5-四氯-3,6-亚苯基、1-氯-4,5-亚萘基等。此外,r
10
的二价烃基可以被氧原子、氮原子以及硫原子等杂原子取代。r
10
的二价烃基被氧原子、氮原子、硫原子等杂原子取代时,烃基为例如具有-o-、-n<、-s-、-so
2-等基团,而烃链被这些基团中断。
[0104]
式(4a-3)中,e1、e2以及e3各自独立为被卤素原子取代或未被卤素原子取代的烃基、被杂原子取代或未被杂原子取代的烃基、卤素原子、二烷基氨基、烷氧基、芳氧基、硝基、氰基、磺酰基、(烷基氨基)羰基氨基、(二烷基氨基)羰基氨基或异氰酸酯基,优选为被卤素原子取代或未被卤素原子取代的烃基或被杂原子取代或未被杂原子取代的烃基、(烷基氨基)羰基氨基、(二烷基氨基)羰基氨基、异氰酸酯基,更优选为(烷基氨基)羰基氨基、(二烷基氨基)羰基氨基。作为各自独立而被卤素原子取代或未被卤素原子取代的烃基或被杂原子取代或未被杂原子取代的烃基,优选为被卤素原子取代或未被卤素原子取代的碳原子数1~50的烃基或被杂原子取代或未被杂原子取代的碳原子数1~50的烃基,更优选为被卤素原子取代或未被卤素原子取代的碳原子数1~30的烃基或被杂原子取代或未被杂原子取代的碳原子数1~30的烃基,特别优选为被卤素原子取代或未被卤素原子取代的碳原子数1~12的烃基或被杂原子取代或未被杂原子取代的碳原子数1~12的烃基。e1、e2以及e3各自独立为卤素原子时,卤素原子可举出:氟原子、氯原子、溴原子、碘原子等。
[0105]
作为e1、e2或e3所示的被卤素原子取代或未被卤素原子取代的烃基的卤素原子,可举出:氟原子、氯原子、溴原子、碘原子等。另外,e1、e2或e3的烃基可以被氧原子、氮原子、硫原子等杂原子取代。在e1、e2或e3的烃基被氧原子、氮原子、硫原子等杂原子取代时,烃基为例如具有-o-、-n<、-s-、-so
2-等基团,而烃链被这些基团中断。
[0106]
作为上述二烷基氨基、烷氧基、(烷基氨基)羰基氨基以及(二烷基氨基)羰基氨基的烷基部分,可举出:甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、正戊基等直链状或支链状的碳原子数1~6的烷基。烷基的碳原子数优选为碳原子数1~3,更优选为碳原子数1或2。
[0107]
作为上述芳氧基的芳基部分,可举出:例如碳原子数6~10的芳基。具体而言,可举出:例如苯基、萘基等。
[0108]
f以及g各自独立表示0~4的整数,a以及b各为0或1,c、d以及e各自独立表示0~4的整数,其中,f为0时,a或b中至少一者为1。
[0109]
以下示出了异氰酸酯化合物(4a)的具体例。但是,本发明并不限定于此。
[0110]
[化学式32]
[0111]
[化学式33]
[0112]
[化学式34]
[0113]
(式中,m如上述所定义)。作为异氰酸酯化合物(4a),优选为式(4a-1-1)、式(4a-2-8)、式(4a-2-15)、式(4a-3-1)所示的化合物。
[0114]
异氰酸酯化合物(4a)可以为单独1种,也可以为两种以上的混合物。
[0115]
在式(4-1)、(4-2)、(4-3)中,q为-nhco2r8基时,式(4-1)、(4-2)、(4-3)所示的含氮化合物分别成为式(4b-1)、(4b-2)、(4b-3)所示的结构。
[0116]
式(4b-1):
[0117]
[化学式35]
[0118]
(式中,r8、r9如上述所定义)。
[0119]
式(4b-2):
[0120]
[化学式36]
[0121]
(式中,r8、r
10
如上述所定义)。
[0122]
式(4b-3):
[0123]
[化学式37]
[0124]
(式中,r8、e1、e2、e3、a、b、c、d、e、f以及g如上述所定义)。
[0125]
以下示出氨基甲酸酯化合物(4b)的具体例。但是,本发明并不限定与此。下述具体例中,et表示乙基,bu表示正丁基,t-bu表示叔丁基,oct表示正辛基,ph表示苯基。
[0126]
[化学式38][化学式38][化学式39]
[0127]
作为氨基甲酸酯化合物(4b),优选为式(4b-1-1)~式(4b-1-7)、式(4b-2-8)~式(4b-2-21)、式(4b-3-1)~式(4b-3-7)所示的化合物,特别优选为(4b-1-1)、式(4b-2-8)、式(4b-3-1)所示的化合物。
[0128]
作为原料使用的氨基甲酸酯化合物(4b)可以使用市售物,也可以通过公知方法来制备。
[0129]
接着说明式(5)所示酰胺化物化合物(以下称为酰胺化物化合物(5))。
[0130]
式(5)中,式中,a、r1、r2、r3、r4、n各自如上述所定义。
[0131]
作为酰胺化物化合物(5),优选为式(5-1)、式(5-2)或式(5-3)中任一项所示的酰胺化物化合物。式(5-1):
[0132]
[化学式40](式中,r1、r2、r3、r4以及r9如上述所定义)。式(5-2):
[0133]
[化学式41](式中,r1、r2、r3、r4以及r
10
如上述所定义)。式(5-3):
[0134]
[化学式42](式中,r1、r2、r3、r4、e1、e2、e3、a、b、c、d、e、f以及g如上述所定义)。
[0135]
式(5-1)中,r1、r2、r3、r4以及r9如上述所定义。
[0136]
式(5-2)中,r1、r2、r3、r4以及r
10
如上述所定义。
[0137]
式(5-3)中,r1、r2、r3、r4、e1、e2、e3、a、b、c、d、e、f以及g如上述所定义。
[0138]
接着,示出酰胺化物化合物(5)的具体例。但是,本发明并不限定于此。下述具体例中,et表示乙基,pr表示正丙基,bu表示正丁基,oct表示正辛基,t-oct表示1,1,3,3-四甲基丁基。
[0139]
[化学式43]
[化学式44]
[化学式45]
[0140]
酰胺化物化合物(5)优选为式(5-1-1)~式(5-1-8)、式(5-2-9)~式(5-2-24)、式(5-3-1)~式(5-3-8)所示的化合物,特别优选为式(5-1-4)、式(5-1-5)、式(5-1-8)、式(5-2-13)、式(5-3-5)所示的化合物。
[0141]
在酰胺化物化合物(5)具有光学异构体、立体异构体、位置异构体等异构体时,只要未明确记载为何种异构体,任一异构体的混合物都包含于酰胺化物化合物(5)中。例如,当酰胺化物化合物(5)中存在有光学异构体时,其由消旋体分割出的光学异构体也能够包含于酰胺化物化合物(5)中。这些异构体能够通过以往已知的分离手法(浓缩、溶剂萃取、管柱层析、重结晶等)而分别以单一化合物的形式制得。
[0142]
工序2中,通常,作为含氮化合物(4)的使用量,为以相对于反应物(a)中所含羧酸盐化合物(3a)以及化合物(3b)~(3f)的合计1摩尔,使含氮化合物(4)中q所示的基团成为0.8摩尔以上(优选为1~3摩尔)的量进行反应。此时,作为反应物(a)中所含有的羧酸盐化合物(3a)以及化合物(3b)~(3f)的合计,也能够设为从工序1所使用的咪唑鎓羧酸盐(1)的
量计算出的量。在反应物(a)中含有羧酸盐化合物(3a)的情况下,为以相对于羧酸盐化合物(3a)1摩尔,使含氮化合物(4)中q所示的基团成为0.8摩尔以上(优选为1~3摩尔)的量进行反应。此时,在反应物(a)含有化合物(3b)~(3f)的情况下,也将反应物化合物(3b)~化合物(3f)设为羧酸盐化合物(3a)来决定含氮化合物(4)的使用量即可。
[0143]
工序2的反应温度并没有特别限制,通常为-10℃以上,优选为0~200℃,更优选为20~150℃,反应时间通常为0.1~24小时,优选为1~10小时。
[0144]
当使用溶剂时,作为溶剂,例如,可举出:甲苯、苯、二甲苯等芳香族烃溶剂,甲基环己烷、环己烷、己烷、庚烷、辛烷等脂肪族烃溶剂,氯丁烷、1,2-二氯乙烷等卤代烃溶剂,氯苯等卤化芳香族烃溶剂,乙酸乙酯或乙酸丁酯等酯溶剂,甲基乙基酮、4-甲基-2-戊酮等的酮溶剂等,优选为芳香族烃溶剂与卤化芳香族烃溶剂、酯溶剂、酮溶剂,特别优选为甲苯、二甲苯、氯苯、乙酸丁酯、4-甲基-2-戊酮。溶剂能够根据需要而混合两种以上使用。另外,在反应物(a)中包含工序1中所使用的溶剂时,也能够将该溶剂在工序2作为溶剂使用,但也可以进一步追加上述溶剂。此时,可以使用与工序1不同的溶剂。
[0145]
使用溶剂时,相对于羧酸盐化合物(3a)以及化合物(3b)~化合物(3f)的总质量1质量份,溶剂的使用量通常为50质量份以下,优选为0.1质量份以上且35质量份以下。作为另一方式,溶剂的使用量优选相对于工序1的反应物(a)中溶剂以外的成分的质量1质量份而通常为50质量份以下,优选为0.1质量份以上且35质量份以下。在此,反应物(a)中的溶剂以外的成分表示从工序1所获得的反应液去除溶剂后的浓缩残物。浓缩残物实际上能够通过从反应液浓缩或过滤来馏除溶剂,由此求出浓缩残物重量,也可以利用1h-nmr分析或gc分析计算出反应液中所含的溶剂重量,由此从反应液重量扣除计算出的溶剂重量而求得。
[0146]
也能够根据需要而在氮、氩、氦等不会对反应造成影响的非活性气体气氛下反应。
[0147]
反应结束后,能够通过浓缩或过滤反应液去除溶剂而制得酰胺化物化合物(5),也可以根据需要进行重结晶或管柱分取等纯化。实施例
[0148]
以下,基于实施例来具体说明本发明,但本发明不受这些任何限制。此外,在实施例中,1h-nmr为使用bruker株式会社制的av400,在400mhz下进行测定。另外,在实施例中,wt%表示质量百分比浓度。
[0149]
制备例1[doi][oac]的合成[化学式46]在经氮置换的3l的4口反应器中倒入辛胺1049.9g(8.12mol),升温至80℃。之后,历时1小时滴加乙酸366.0g(6.09mol)与42wt%福尔马林水溶液290.4g(甲醛纯质份量4.06mol)的混合液。滴加后,搅拌反应器中的混合液30分钟并冷却至40℃。在经冷却的混合液中历时30分钟滴加41wt%乙二醛水溶液581.0g(乙二醛纯质份量4.06mol),搅拌5小时。
搅拌后,将所获得的反应溶液减压浓缩,而获得上述式所示[doi][oac]1582.0g。在所获得[doi][oac]添加四氢萘作为内部标准物质并进行1h-nmr分析,结果得知含有[doi][oac]1224.9g(3.47mol,产率85.5%)。[doi][oac]的1h-nmr分析结果在以下示出。1h-nmr(dmso-d6)δ(ppm)=9.32(s,1h)、7.80(s,2h)、4.17(t,j=9.6hz,4h)、1.78(m,4h)、1.63(s,3h)、1.23(m,20h)、0.85(t,j=6.4hz,6h)
[0150]
制备例2[dbi][oac]的合成[化学式47]在经氮置换的200ml的4口反应器中倒入丁胺40g(0.55mol),冷却至0℃。之后,历时2小时滴加乙酸24.6g(0.41mol)与40wt%福尔马林水溶液20.8g(0.28mol)的混合液。滴加后,搅拌反应器中的混合液30分钟。在混合液中历时30分钟滴加40wt%乙二醛水溶液39.6g(0.27mol),滴加后搅拌16小时。搅拌后,在所获得的反应溶液添加庚烷100ml并分液,进行两次去除庚烷层的操作,获得褐色溶液。将所获得的褐色溶液减压浓缩,获得上述式所示[dbi][oac]75.8g(0.27mol,产率98%)。[dbi][oac]的1h-nmr分析结果在以下示出。1h-nmr(dmso-d6)δ(ppm)=9.53(s,1h)、7.82(s,2h)、4.19(t,j=6.8hz,4h)、1.81(m,4h)、1.68(s,4.5h)、1.29(m,4h)、0.91(t,j=7.2hz、6h)
[0151]
制备例3[d2ehi][oac]的合成[化学式48]在经氮置换的2l的4口反应器中倒入2-乙基己胺750.0g(5.80mol),历时1小时30分钟滴加乙酸261.3g(4.35mol)与40wt%福尔马林水溶液217.8g(2.90mol)的混合液。滴加后,搅拌反应器中的混合液30分钟。在混合液中历时20分钟滴加40wt%乙二醛水溶液421.0g(2.90mol),滴加后搅拌5小时。将所获得的反应溶液减压浓缩,获得上述式所示[d2ehi][oac]1219.1g(2.89mol,产率99%)。将[d2ehi][oac]的1h-nmr分析结果在以下示出。1h-nmr(dmso-d6)δ(ppm)=9.35(s,1h)、7.82(s,2h)、4.15(d,j=7.2hz,4h)、1.84(m,2h)、1.71(s,3h)、1.25(m,16h)、0.87(t,j=7.2hz,12h)
[0152]
制备例4[dtocti][oac]的合成[化学式49]
在经氮置换的100ml的3口反应器中倒入乙酸6.97g(0.116mol)与40wt%福尔马林水溶液5.80g(甲醛纯质份量0.077mol)、40wt%乙二醛水溶液11.2g(乙二醛纯质份量0.077mol),升温至50℃。然后,在反应器中的混合液中历时2小时滴加1,1,3,3-四甲基丁胺20.00g(0.154mol),搅拌2小时。搅拌后将所获得的反应溶液减压浓缩,获得上述式所示[dtocti][oac]24.83g(0.069mol,产率90%)。将[dtocti][oac]的1h-nmr分析结果在以下示出。1h-nmr(cdcl3)δ(ppm)=10.63(s,1h)、7.34(s,2h)、2.04(s,3h)、2.04(s,4h)、1.83(s,12h)、0.87(s,18h)
[0153]
实施例1doim_pi的合成[化学式50](工序1)制备1,3-二正辛基咪唑鎓-2-羧酸盐在5l的耐压容器中倒入制备例1所获得的[doi][oac]1070.1g(doi][oac]的纯质份量:828.6g(2.35mol))、甲苯1069.5g、碳酸二甲酯756.0g(8.39mol),并进行氮置换。其后,将混合液在120℃下搅拌15小时。搅拌后,将所获得的反应混合物冷却。将经冷却的反应混合物减压浓缩成1043.5g为止并将过量的碳酸二甲酯与副生成的乙酸甲酯去除,对其添加甲苯而制成2058.6g。使用二甲亚砜作为内部标准物质对所获得的甲苯溶液进行1h-nmr分析,结果得知获得1,3-二正辛基咪唑鎓-2-羧酸盐339.3g(1.01mol,产率42.8%)。另外,已知在所获得的甲苯溶液中含有1,3-二正辛基咪唑鎓-4-羧酸盐128.0g(0.38mol,产率16.2%)、1,3-二正辛基咪唑鎓碳酸甲酯盐211.7g(0.57mol,产率24.4%)。将1,3-二正辛基咪唑鎓-2-羧酸盐的1h-nmr分析结果在以下示出。1h-nmr(cdcl3)δ(ppm)=7.21(s,2h)、4.55(t,j=7.6hz,4h)、1.78(m,4h)、1.31(m,20h)、0.88(t,j=6.4hz,6h)将1,3-二正辛基咪唑鎓-4-羧酸盐的1h-nmr分析结果在以下示出。1h-nmr(cdcl3)δ(ppm)=7.49(s,1h)、4.73(t,j=7.2hz,2h)、4.26(t,j=7.2hz,2h)、1.78(m,4h)、1.31(m,20h)、0.88(t,j=6.4hz,6h)将1,3-二正辛基咪唑鎓碳酸甲酯盐的1h-nmr分析结果在以下示出。1h-nmr(cdcl3)δ(ppm)=7.44(s,2h)、4.32(t,j=7.2hz,4h)、3.39(s,3h)、1.78(m,4h)、1.31(m,20h)、0.88(t,j=6.4hz,6h)(工序2)在经氮置换的3l的4口反应器中倒入工序1所获得的甲苯溶液1700.2g、甲苯807.4g,并使其加热回流。一边使其加热回流,一边历时2小时滴加苯基异氰酸酯229.7g(1.93mol),搅拌10小时。搅拌后,到将所获得的反应混合物浓缩成1433.1g为止,添加庚烷761.0g并加热至50℃,使固体全部溶解而制成庚烷溶液。将庚烷溶液从50℃冷却至30℃使结晶析出,在30℃下搅拌1小时后,以每小时10℃历时2小时将庚烷溶液冷却至10℃,并在10℃下使其再搅拌1小时而获得浆料液。通过过滤所获得浆料液,获得制成微黄色固体的上述
式所示的化合物(doim_pi)426.8g(1.04mol,从工序1以来的全程产率62.2%)。将doim_pi的1h-nmr分析结果在以下示出。1h-nmr(dmso-d6)δ(ppm)=9.32(s,1h)、7.80(s,2h)、4.17(t,j=9.6hz,4h)、1.78(m,4h)、1.63(s,3h)、1.23(m,20h)、0.85(t,j=6.4hz,6h)
[0154]
实施例2dbim_pi的合成[化学式51](工序1)在180ml的耐压容器中倒入制备例2所获得的[dbi][oac]30.0g(纯质份量0.11mol)、碳酸二甲酯44.8g(0.50mol)、甲苯30.0g,并进行氮置换。然后,将混合液在120℃下搅拌7小时。搅拌后,将所获得的反应混合物减压浓缩,获得褐色液体25.2g。将所获得的褐色液体进行1h-nmr分析并由积分比来计算,结果得知获得了1,3-二正丁基咪唑鎓-2-羧酸盐9.8g(0.04mol,产率39.2%)。另外,已知在所获得的甲苯溶液中含有1,3-二正丁基咪唑鎓-4-羧酸盐1.8g(0.008mol,产率7.4%)、1,3-二正丁基咪唑鎓碳酸甲酯盐13.8g(0.05mol,产率48.5%)。在所获得褐色液体中添加氯苯25.2g,制成氯苯溶液。将1,3-二正丁基咪唑鎓-2-羧酸盐的1h-nmr分析结果在以下示出。1h-nmr(dmso-d6)δ(ppm)=7.71(s,2h)、4.45(t,j=7.2hz,4h)、1.81(m,4h)、1.28(m,4h)、0.89(m,6h)将1,3-二正丁基咪唑鎓-4-羧酸盐的1h-nmr分析结果在以下示出。1h-nmr(dmso-d6)δ(ppm)=9.45(s,1h)、7.60(s,1h)、4.59(t,j=7.2hz,2h)、4.15(t,j=7.2hz,2h)、1.81(m,4h)、1.28(m,4h)、0.89(m,6h)将1,3-二正丁基咪唑鎓碳酸甲酯盐的1h-nmr分析结果在以下示出。1h-nmr(dmso-d6)δ(ppm)=9.73(s,1h)、7.89(s,2h)、4.22(t,j=7.2hz,4h)、3.17(s,3h)、1.81(m,4h)、1.28(m,4h)、0.89(m,6h)(工序2)在经氮置换的180ml的3口反应器中倒入工序1所获得的氯苯溶液40.0g、氯苯40.0g、n-苯基胺甲酸甲酯13.4g(0.10mol),并加热回流5小时。加热回流后,将所获得的反应混合物减压浓缩,获得干固残留物26.8g。接着,在干固残留物中添加乙酸丁酯17.1g,升温至60℃并使固体全部溶解后冷却至室温,获得上述式所示的化合物(dbim_pi)5.8g(19.4mmol,从工序1以来的全程产率21.8%)。将dbim_pi的1h-nmr分析结果在以下示出。1h-nmr(dmso-d6)δ(ppm)=7.60(s,2h)、7.42(d,j=8.4hz,2h)、7.14(d,j=7.6hz,2h)、6.80(t,j=7.6hz,1h)、4.48(t,j=7.6hz,4h)、1.80(m,4h)、1.30(m,4h)、0.91(t,j=7.6hz,6h)
[0155]
实施例3d2him_pi的合成[化学式52]
(工序1)在5l的耐压容器中倒入制备例3所获得的[d2ehi][oac]1104.2g(纯质份量3.07mol)、碳酸二甲酯744.9g(8.27mol)、甲苯1104.2g并进行氮置换。然后,将混合液升温至120℃后,搅拌12小时。搅拌后,将所获得的反应混合物减压浓缩,获得褐色液体1095.8g。将所获得褐色液体进行1h-nmr分析并由积分比来计算,结果得知获得了1,3-二-2-乙基己基咪唑鎓-2-羧酸盐526.8g(1.49mol,产率46.6%)。另外,已知在所获得的甲苯溶液中含有1,3-二-2-乙基己基咪唑鎓-4-羧酸盐142.4g(0.423mol,产率13.8%)、1,3-二-2-乙基己基咪唑鎓碳酸甲酯盐466.6g(1.27mol,产率41.2%)。将1,3-二-2-乙基己基咪唑鎓-2-羧酸盐的1h-nmr分析结果在以下示出。1h-nmr(dmso-d6)δ(ppm)=7.70(s,2h)、4.38(t,j=6.0hz,4h)、1.84(m,2h)、1.25(m,16h)、0.87(m,12h)将1,3-二-2-乙基己基咪唑鎓-4-羧酸盐的1h-nmr分析结果在以下示出。1h-nmr(dmso-d6)δ(ppm)=9.18(s,1h)、7.64(s,1h)、4.53(t,j=6.0hz,2h)、4.05(t,j=6.0hz,2h)、1.84(m,2h)、1.25(m,16h)、0.87(m,12h)将1,3-二-2-乙基己基咪唑鎓碳酸甲酯盐的1h-nmr分析结果在以下示出。1h-nmr(dmso-d6)δ(ppm)=9.51(s,1h)、7.89(s,2h)、4.24(t,j=7.6hz,4h)、3.18(s,3h)、1.84(m,2h)、1.25(m,16h)、0.87(m,12h)(工序2)在经氮置换的5l的4口反应器中加入工序1所获得的褐色液体882.7g(1,3-二-2-乙基己基咪唑鎓-2-羧酸盐以及作为这些的等价物的1,3-二-2-乙基己基咪唑鎓-4-羧酸盐和1,3-二-2-乙基己基咪唑鎓碳酸甲酯盐合计:2.56mol)、甲苯2487.8g,并进行加热回流。其后,在反应器中的液体中历时2小时滴加苯基异氰酸酯292.3g(2.45mol),滴加后,一边回流一边使其反应13小时30分钟。反应后,将所获得的反应混合物减压浓缩,获得了上述式所示的化合物(d2him_pi)1078.6g。在所获得的d2him_pi中添加四氢萘作为内部标准物质并进行1h-nmr分析,结果得知d2him_pi含有990.9g(2.41mol,产率93.8%)。将d2him_pi的1h-nmr分析结果在以下示出。1h-nmr(dmso-d6)δ(ppm)=7.59(s,2h)、7.39(d,j=8.4hz,2h)、7.12(t,j=8.4hz,2h)、6.76(t,j=8.4hz,1h)、4.44(t,j=6.8hz,4h)、1.86(m,2h)、1.25(m,16h)、0.82(m,12h)
[0156]
实施例4d2him_crmdi的合成[化学式53]
(工序1)在180ml的耐压容器中倒入以与制备例3相同的制备方法制得的[d2ehi][oac]40.0g(纯质份量99.5mmol)、碳酸二甲酯26.9g(299mmol),并进行氮置换。其后,将耐压容器中的混合液在120℃下搅拌6小时。搅拌后,将所获得的反应混合物减压浓缩,获得褐色液体35.3g。在所获得的褐色液体中添加二甲基砜作为内部标准物质并进行1h-nmr内部标准分析,结果得知获得1,3-二-2-乙基己基咪唑鎓-2-羧酸盐7.5g(0.02mol,产率22.3%)。另外,已知所获得的褐色液体中含有1,3-二-2-乙基己基咪唑鎓-4-羧酸盐5.7g(0.02mol,产率17.1%)、1,3-二-2-乙基己基咪唑鎓碳酸甲酯盐18.3g(0.05mol,产率50.0%)。(工序2)在经氮置换的200ml的4口反应器中加入甲苯30.2g并进行回流。一边使甲苯回流,一边于反应器历时2小时滴加工序1所获得的褐色液体30.1g(1,3-二-2-乙基己基咪唑鎓-2-羧酸盐以及作为这些的等价物的1,3-二-2-乙基己基咪唑鎓-4-羧酸盐和1,3-二-2-乙基己基咪唑鎓碳酸甲酯盐合计:75.7mmol)与甲苯30.4g的混合液。另外,同时在反应器历时2小时滴加聚亚甲基聚苯基聚异氰酸酯(sumika covestro urethane co.,ltd.制造的desmodur 44v20l、nco含量:7.86mmol/g)10.6g(nco含量:83.1mmol)与甲苯30.5g的混合液,一边使其回流一边搅拌1小时。搅拌后,将所获得的反应混合物减压浓缩,获得含有上述式所示的化合物的反应物(d2him_crmdi)37.4g。将所获得的反应物的1h-nmr分析结果在以下示出。1h-nmr(cdcl3)δ(ppm)=7.51-6.91(m)、4.52-4.37(m)、4.01-3.66(m)、1.88(br)、1.34-1.26(m)、0.89-0.82(m)
[0157]
实施例5d2him_tdi的合成[化学式54]
在180ml的耐压容器中倒入以与制备例3相同的制备方法制得的[d2ehi][oac]70.1g(纯质份量0.17mol)、碳酸二甲酯53.9g(0.60mol),并进行氮置换。其后,将耐压容器中的混合液在120℃下搅拌6小时。搅拌后,将所获得的反应混合物减压浓缩,获得褐色液体67.7g。在所获得褐色液体中添加二甲基砜作为内部标准物质并进行1h-nmr内标分析,结果得知获得了1,3-二-2-乙基己基咪唑鎓-2-羧酸盐5.3g(0.02mol,产率9.3%)。另外,已知在所获得的褐色液体中含有1,3-二-2-乙基己基咪唑鎓-2-羧酸盐的等价物1,3-二-2-乙基己基咪唑鎓-4-羧酸盐10.3g(0.03mol,产率18.1%)、1,3-二-2-乙基己基咪唑鎓碳酸甲酯盐41.8g(0.11mol,产率66.8%)。(工序2)在经氮置换的200ml的4口反应器中加入甲苯30.3g并进行回流。然后,一边使甲苯回流,一边于反应器历时2小时滴加工序1所获得的褐色液体30.0g(1,3-二-2-乙基己基咪唑鎓-2-羧酸盐以及作为这些的等价物的1,3-二-2-乙基己基咪唑鎓-4-羧酸盐和1,3-二-2-乙基己基咪唑鎓碳酸甲酯盐合计:70.0mmol)与甲苯30.2g的混合液。另外,同时于反应器历时2小时滴加甲苯二异氰酸酯(东京化成工业株式会社制造、2,4-甲苯二异氰酸酯约80%、2,6-甲苯二异氰酸酯约20%)6.7g(38.4mmol)与甲苯30.5g的混合液,一边使其回流一边搅拌1小时。搅拌后,将所获得的反应混合物减压浓缩,获得含有上述式所示的化合物的反应物(d2him_tdi)31.2g。将所获得的反应物的1h-nmr分析结果在以下示出。1h-nmr(cdcl3)δ(ppm)=7.28-6.88(m、5h)、4.59-4.43(m、8h)、2.24-2.17(m、3h)、1.92(m、4h)、1.37-1.27(m、32h)、0.9-0.83(m、24h)
[0158]
实施例6dtoctim_pi的合成[化学式55]
[0159]
(工序1)在180ml耐压容器中倒入制备例4所获得的[dtocti][oac]24.8g(0.069mol)、碳酸二甲酯27.0g(0.297mol)、甲苯30.0g,并进行氮置换。然后,将耐压容器中的混合液在120℃
下搅拌6小时。搅拌后,将所获得的反应混合物减压浓缩,获得反应物(a)。(工序2)在经氮置换的100ml的3口反应器中倒入工序1所获得的反应物(a)的一半量以及氯苯40.0g,并进行加热回流。将加热回流后的混合液冷却至60℃,并对其历时10分钟滴加苯基异氰酸酯3.9g(0.032mol)与氯苯12.2g的混合液后,在60℃下搅拌1小时。搅拌后,将所获得的反应混合物冷却至室温,对其添加庚烷50.0g后进行过滤,将滤渣以庚烷50.0g清洗,获得上述式所示的化合物(dtoctim_pi)7.55g(0.014mmol,从工序1以来的全程产率40.0%)。将dtoctim_pi的1h-nmr分析结果在以下示出。1h-nmr(cdcl3)δ(ppm)=7.59(d,j=9.2hz,2h)、7.30(t,j=7.6hz,2h)、7.08(s,2h)6.93(t,j=7.2hz,1h)、2.40(m,4h)、1.87(m,12h)、0.99(s,18h)。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1