与CD3结合的双特异性抗体的制作方法
与cd3结合的双特异性抗体
技术领域
1.本发明涉及一种与cd3结合的双特异性抗体或该双特异性抗体片段、编码该双特异性抗体或该双特异性抗体片段的dna、包含该dna的载体、生产该双特异性抗体或该双特异性抗体片段的杂交瘤及转化株、该双特异性抗体或该双特异性抗体片段的制造方法、包含该双特异性抗体或双特异性抗体片段的治疗和/或诊断药物、使用该双特异性抗体或双特异性抗体片段的治疗和/或诊断方法、以及包含该双特异性抗体或该双特异性抗体片段的检测或测定试剂。
背景技术:
2.已知迄今为止已批准的针对癌症的抗体药物具有各种作用机理(非专利文献1)。代表性的机理有:抑制生长因子等配体与受体结合的中和活性、激活所结合的受体的激动剂活性、以及抗体依赖性细胞毒性活性(antibody-dependent cellular cytotoxicity:以下称为adcc活性)、补体依赖性细胞毒性活性(complement-dependent cytotoxicity:以下cdc活性)等igg型的抗体分子所具有的效应子功能等。其中,对利妥昔单抗(rituximab)、曲妥珠单抗(trastuzumab)的临床试验的生物标志物分析显示,adcc活性是抗体药物在临床上的重要机理(非专利文献2、3)。
3.adcc活性是一种通过自然杀伤细胞(以下称为nk细胞)等经由fc受体的一种fcγriiia(cd16a)识别与癌细胞表面的膜型抗原结合的igg型的抗体的fc而产生的细胞毒性的机理(非专利文献1)。
4.人体中,igg1亚类能够与fc受体牢固结合,从而引发adcc活性,小鼠中,igg2a亚类能够与fc受体牢固结合,从而引发adcc活性。因此,通过人工改变抗体药物的人igg1型的fc,提升其与fcγriiia的结合能力,能够增强adcc活性。
5.已知实际上,通过fc的氨基酸的修饰、或者对与fc结合的n-结合型复合型糖链的糖链进行改型,能够增强adcc活性(非专利文献4),特别是利用糖链改型的adcc活性增强技术已应用于莫格利珠单抗(mogamulizumab)(非专利文献5)、阿托珠单抗(obinutuzumab)(非专利文献6)等经批准的抗体药物。
6.双特异性抗体与天然的抗体不同,其是可以与两种不同种类的抗原结合的人工改型抗体分子,已报道了诸多分子形式(非专利文献7)。作为其在药物中的应用示例,可列举通过与癌细胞上的抗原及t细胞表面的cd3结合,使两者交联来杀伤癌细胞的技术。
7.本文中,将由cd3/癌抗原双特异性抗体与t细胞上的cd3结合所产生的由t细胞介导的细胞毒性活性称作adtc活性(antibody-dependent t-cell-mediated cytotoxicity)。
8.作为cd3/癌抗原双特异性抗体的示例,可列举:针对cd3和癌抗原epcam的igg型的双特异性抗体卡妥索单抗(catumaxomab)(非专利文献8)、双特异性t细胞接合器(bispecific t cell engager)[bite(注册商标)](非专利文献9)及针对cd3和癌抗原cea的igg型的双特异性抗体rg7802等。
[0009]
此外,还存在多种分子形式(非专利文献7),但这些抗cd3双特异性抗体通常具备仅具有adtc活性而不具有adcc活性或者adcc活性被抑制的结构。
[0010]
例如bite(注册商标)是与cd3及癌抗原结合的两种不同的被称为单链fv(single chain fv,scfv)的抗体片段通过肽接头结合而成的,不包括fc,因此,不具有如adcc活性那样由fc介导的作用机理[图1(c)]。另外,rg7802虽然具有fc,但因p329g的变异导入fc而消除了对fc受体的结合能力,最终也不显示adcc活性(非专利文献10)。
[0011]
卡妥索单抗(catumaxomab)属于例外,已知该抗cd3双特异性抗体具有与fc受体结合的小鼠igg2a/大鼠igg2b的杂合型的fc,因此能够引发adcc活性(非专利文献8)。然而,与用于常用抗体药物的人源fc相比,来自啮齿动物的fc引发adcc活性的能力较低(非专利文献11)。
[0012]
之所以未就在抗cd3双特异性抗体上组合具有较强fc受体结合能力的fc进行研究,是因为由fc受体介导cd3簇(在细胞膜上的凝聚)会激活t细胞,可能会随之导致副作用。
[0013]
例如,用于抑制脏器移植时的排斥的抗cd3抗体okt3会引起细胞因子释放综合征的副作用,但认为由okt3的小鼠igg2a型的fc介导的、来自具有fc受体的白细胞的cd3簇是引起该副作用的原因(非专利文献12)。
[0014]
卡妥索单抗(catumaxomab)是cd3和epcam的双特异性抗体,具有对fc受体的结合能力,推测卡妥索单抗(catumaxomab)给药后伴随细胞因子释放综合征所产生的严重副作用的原因在于由具有fc受体的肝脏的kupffer细胞介导的t细胞激活(非专利文献13)。
[0015]
另外,作为具有fc的双特异性抗体的形式(format),为了避免cd3的非特异性激活所导致的副作用,通常使用用于以一价具有cd3结合位点的异二聚体型结构(专利文献1~4)。
[0016]
还制作了使用对于cd3的亲和力低的抗cd3抗体的抗cd3双特异性抗体。作为这样的双特异性抗体,临床开发了对cd3的亲和力为kd=1.0
×
10-7
的rg7802(非专利文献14、15)。rg7802具有不具备对fc受体的结合能力的fc区,不具有以adcc活性为代表的效应子活性(非专利文献15)。
[0017]
现有技术文献
[0018]
专利文献
[0019]
专利文献1:国际公开第2011/028952号
[0020]
专利文献2:国际公开第2014/151910号
[0021]
专利文献3:国际公开第2015/048272号
[0022]
专利文献4:国际公开第2014/054804号
[0023]
非专利文献
[0024]
非专利文献1:carter p.nat rev cancer.1:118-129,2001
[0025]
非专利文献2:cartron g,dacheux l,salles g,et al.blood.99:754-758,2002
[0026]
非专利文献3:weng wk,levy r.j clin oncol.21:3940-3947,2003
[0027]
非专利文献4:shinkawa t,nakamura k,yamane n,et al.j biol chem.278:3466-3473,2003
[0028]
非专利文献5:beck a,reichert jm.mabs.4:419-425,2012
[0029]
非专利文献6:gagez al,cartron g.curr opin oncol.26:484-491,2014
[0030]
非专利文献7:carter pj,lazar ga.nat rev drug disc.17:197-223,2018
[0031]
非专利文献8:bokemeyer c.expert opin biol ther.10:1259-1269,2010
[0032]
非专利文献9:nagorsen d,kufer p,baeuerle pa,bargou r.pharmacol ther.136:334-342,2012
[0033]
非专利文献10:lehmann s,et al.clin cancer res.22:4417-4427,2016
[0034]
非专利文献11:bergman i,basse p,barmada m,griffin j,cheung n.cancer immunol immunother.49:259-266,2010
[0035]
非专利文献12:ceuppens jl,bloemmen fj,van wauwe jp.j immunol.135:3882-3886,1985
[0036]
非专利文献13:borlak j,langer f,spanel r.,schondorfer g.,dittrich c.oncotarget.7:28059-28074,2016
[0037]
非专利文献14:bacac m,klein c.,umana p oncoimmunology.5(8):e1203498,2016
[0038]
非专利文献15:bacac m,fauti t,sam j,et al.clin cancer res.22(13):3286-97,2016
技术实现要素:
[0039]
发明要解决的问题
[0040]
目前,虽然已知有与cd3和特定的抗原结合的各种抗cd3双特异性抗体,但均未获得充分的药效,另外,还存在细胞因子释放综合征等过度免疫反应所导致的严重副作用的课题。
[0041]
另外,并未就发挥adcc活性或发挥高adcc活性的异二聚体型的cd3/癌抗原双特异性抗体、及其细胞毒性活性进行过详细研究,尚不存在具有高细胞毒性活性的同时,抑制过度诱导细胞因子产生的抗cd3双特异性抗体。
[0042]
另一方面,包括通过氨基酸残基改型fc或糖链改型fc增强了fc受体亲和力的fc区的抗体有助于单克隆抗体的高adcc活性,但并没有动机在存在严重副作用这一课题的抗cd3双特异性抗体中使用通过氨基酸残基改型fc或糖链改型fc增强了fc受体亲和力的fc区来提高adcc活性,从而提高双特异性抗体引起的免疫反应。
[0043]
本发明的目的在于提供一种抑制了其诱导细胞因子产生的抗cd3双特异性抗体、与cd3及疾病相关抗原特异性结合的双特异性抗体。另外,本发明的目的还在于提供一种包括与cd3结合的抗原结合结构域及与疾病相关抗原结合的抗原结合结构域的双特异性抗体、该双特异性抗体片段、编码该双特异性抗体或该双特异性抗体片段的dna、包括该dna的载体、生产该双特异性抗体或该双特异性抗体片段的杂交瘤及转化株、该双特异性抗体或该双特异性抗体片段的制造方法、包括该双特异性抗体或该双特异性抗体片段的治疗及诊断剂、使用该双特异性抗体或该双特异性抗体片段的治疗及诊断方法、以及包括该双特异性抗体或该双特异性抗体片段的检测或测定试剂、用于制造抗cd3双特异性抗体的、对于cd3的亲和力减弱的cd3结合结构域、用于抑制抗cd3双特异性抗体诱导细胞因子产生的、对于cd3的亲和力减弱的cd3结合结构域。
[0044]
解决问题的方法
[0045]
本发明涉及以下内容。
[0046]
1.一种抗cd3双特异性抗体或该双特异性抗体片段,其包括具有对fc受体的结合能力的fc区,该fc区的c端侧结合有一个对于cd3的亲和力减弱的cd3结合结构域,该抗cd3双特异性抗体或该双特异性抗体片段还包括疾病相关抗原结合结构域。
[0047]
2.一种抗cd3双特异性抗体或该双特异性抗体片段,其包括具有对fc受体的结合能力的fc区,该fc区的c端侧结合有一个cd3结合结构域,该抗cd3双特异性抗体或该双特异性抗体片段还包括疾病相关抗原结合结构域,其中,
[0048]
在cd3阳性t细胞及疾病相关抗原阳性细胞的存在下,与使用抗cd3单克隆抗体sp34的抗cd3双特异性抗体比较,诱导细胞因子产生的能力降低。
[0049]
3.根据上述1或2所述的抗cd3双特异性抗体或该双特异性抗体片段,其中,上述cd3结合结构域对于cd3的解离常数(kd)为6
×
10-8
以上。
[0050]
4.根据上述1~3中任一项所述的抗cd3双特异性抗体或该双特异性抗体片段,其中,上述cd3结合结构域对于cd3的解离常数大于作为比较对照的抗cd3单克隆抗体sp34或km14。
[0051]
5.根据上述1~4中任一项所述的抗cd3双特异性抗体或该双特异性抗体片段,其中,上述cd3结合结构域的氨基酸序列与作为比较对照的抗cd3单克隆抗体sp34或km14的cd3结合结构域的氨基酸序列具有90%以上的同源性,且与该抗cd3单克隆抗体sp34或km14相比,对于cd3的亲和力降低了10%以上。
[0052]
6.根据上述1~5中任一项所述的抗cd3双特异性抗体或该双特异性抗体片段,其包括一个或两个上述疾病相关抗原结合结构域。
[0053]
7.根据上述1~6中任一项所述的抗cd3双特异性抗体或该双特异性抗体片段,其中,上述cd3结合结构域及上述疾病相关抗原结合结构域分别为选自scfv、fab及vhh的任意一种。
[0054]
8.根据上述1~7中任一项所述的抗cd3双特异性抗体或该双特异性抗体片段,其中,上述cd3结合结构域和/或上述疾病相关抗原结合结构域经由接头与上述fc区结合。
[0055]
9.根据上述1~8中任一项所述的抗cd3双特异性抗体或该双特异性抗体片段,其中,上述cd3结合结构域包括含有抗体重链的互补决定区(complementarity determining region;简称cdr)1~3的重链可变区(heavy chain variable region;简称vh)及含有抗体轻链的cdr1~3的轻链可变区(light chain variable region;简称vl)。
[0056]
10.根据上述1~9中任一项所述的抗cd3双特异性抗体或该双特异性抗体片段,其中,上述cd3结合结构域为scfv。
[0057]
11.根据上述1~10中任一项所述的抗cd3双特异性抗体或该双特异性抗体片段,其中,上述cd3结合结构域的vh的cdr1~3(hcdr1~3)及vl的cdr1~3(lcdr1~3)的氨基酸序列与选自下述(a)~(h)的任意一个hcdr1~3及lcdr1~3的氨基酸序列分别具有90%以上的同源性,
[0058]
(a)分别包括序列编号118~120表示的氨基酸序列的hcdr1~3、及分别包括序列编号121~123表示的氨基酸序列的lcdr1~3;
[0059]
(b)分别包括序列编号83~85表示的氨基酸序列的hcdr1~3、及分别包括序列编号86~88表示的氨基酸序列的lcdr1~3;
[0060]
(c)分别包括序列编号98~100表示的氨基酸序列的hcdr1~3、及分别包括序列编号132、96、97表示的氨基酸序列的lcdr1~3;
[0061]
(d)分别包括序列编号98~100表示的氨基酸序列的hcdr1~3、及分别包括序列编号133、96、97表示的氨基酸序列的lcdr1~3;
[0062]
(e)分别包括序列编号98、134、100表示的氨基酸序列的hcdr1~3、及分别包括序列编号95~97表示的氨基酸序列的lcdr1~3;
[0063]
(f)分别包括序列编号98、135、100表示的氨基酸序列的hcdr1~3、及分别包括序列编号95~97表示的氨基酸序列的lcdr1~3;
[0064]
(g)分别包括序列编号98、136、100表示的氨基酸序列的hcdr1~3、及分别包括序列编号95~97表示的氨基酸序列的lcdr1~3;
[0065]
(h)分别包括序列编号98、137、100表示的氨基酸序列的hcdr1~3、及分别包括序列编号95~97表示的氨基酸序列的lcdr1~3。
[0066]
12.根据上述1~11中任一项所述的抗cd3双特异性抗体或该双特异性抗体片段,其中,上述cd3结合结构域的vh及vl的氨基酸序列与选自下述(aa)~(rr)的任意一个vh及vl的氨基酸序列分别具有80%以上的同源性,
[0067]
(aa)包括序列编号124表示的氨基酸序列的vh、及包括序列编号125表示的氨基酸序列的vl;
[0068]
(bb)包括序列编号115表示的氨基酸序列的vh、及包括序列编号116表示的氨基酸序列的vl;
[0069]
(cc)包括序列编号94表示的氨基酸序列的vh、及包括序列编号126表示的氨基酸序列的vl;
[0070]
(dd)包括序列编号94表示的氨基酸序列的vh、及包括序列编号127表示的氨基酸序列的vl;
[0071]
(ee)包括序列编号128表示的氨基酸序列的vh、及包括序列编号93表示的氨基酸序列的vl;
[0072]
(ff)包括序列编号129表示的氨基酸序列的vh、及包括序列编号93表示的氨基酸序列的vl;
[0073]
(gg)包括序列编号130表示的氨基酸序列的vh、及包括序列编号93表示的氨基酸序列的vl;
[0074]
(hh)包括序列编号131表示的氨基酸序列的vh、及包括序列编号93表示的氨基酸序列的vl;
[0075]
(ii)包括序列编号159表示的氨基酸序列的vh、及包括序列编号165表示的氨基酸序列的vl;
[0076]
(jj)包括序列编号160表示的氨基酸序列的vh、及包括序列编号165表示的氨基酸序列的vl;
[0077]
(kk)包括序列编号161表示的氨基酸序列的vh、及包括序列编号166表示的氨基酸序列的vl;
[0078]
(ll)包括序列编号162表示的氨基酸序列的vh、及包括序列编号166表示的氨基酸序列的vl;
[0079]
(mm)包括序列编号168表示的氨基酸序列的vh、及包括序列编号180表示的氨基酸序列的vl;
[0080]
(nn)包括序列编号169表示的氨基酸序列的vh、及包括序列编号181表示的氨基酸序列的vl;
[0081]
(oo)包括序列编号170表示的氨基酸序列的vh、及包括序列编号182表示的氨基酸序列的vl;
[0082]
(pp)包括序列编号171表示的氨基酸序列的vh、及包括序列编号183表示的氨基酸序列的vl;
[0083]
(qq)包括序列编号172表示的氨基酸序列的vh、及包括序列编号184表示的氨基酸序列的vl;
[0084]
(rr)包括序列编号173表示的氨基酸序列的vh、及包括序列编号185表示的氨基酸序列的vl。
[0085]
13.根据上述1~12中任一项所述的抗cd3双特异性抗体或该双特异性抗体片段,其中,上述cd3结合结构域的hcdr1~3及lcdr1~3的氨基酸序列为选自下述(a)~(h)的任意一个,
[0086]
(a)分别包括序列编号118~120表示的氨基酸序列的hcdr1~3、及分别包括序列编号121~123表示的氨基酸序列的lcdr1~3;
[0087]
(b)分别包括序列编号83~85表示的氨基酸序列的hcdr1~3、及分别包括序列编号86~88表示的氨基酸序列的lcdr1~3;
[0088]
(c)分别包括序列编号98~100表示的氨基酸序列的hcdr1~3、及分别包括序列编号132、96、97表示的氨基酸序列的lcdr1~3;
[0089]
(d)分别包括序列编号98~100表示的氨基酸序列的hcdr1~3、及分别包括序列编号133、96、97表示的氨基酸序列的lcdr1~3;
[0090]
(e)分别包括序列编号98、134、100表示的氨基酸序列的hcdr1~3、及分别包括序列编号95~97表示的氨基酸序列的lcdr1~3;
[0091]
(f)分别包括序列编号98、135、100表示的氨基酸序列的hcdr1~3、及分别包括序列编号95~97表示的氨基酸序列的lcdr1~3;
[0092]
(g)分别包括序列编号98、136、100表示的氨基酸序列的hcdr1~3、及分别包括序列编号95~97表示的氨基酸序列的lcdr1~3;
[0093]
(h)分别包括序列编号98、137、100表示的氨基酸序列的hcdr1~3、及分别包括序列编号95~97表示的氨基酸序列的lcdr1~3。
[0094]
14.根据上述1~13中任一项所述的抗cd3双特异性抗体或该双特异性抗体片段,其中,上述cd3结合结构域的vh及vl的氨基酸序列为选自下述(aa)~(rr)的任意一个,
[0095]
(aa)包括序列编号124表示的氨基酸序列的vh、及包括序列编号125表示的氨基酸序列的vl;
[0096]
(bb)包括序列编号115表示的氨基酸序列的vh、及包括序列编号116表示的氨基酸序列的vl;
[0097]
(cc)包括序列编号94表示的氨基酸序列的vh、及包括序列编号126表示的氨基酸序列的vl;
[0098]
(dd)包括序列编号94表示的氨基酸序列的vh、及包括序列编号127表示的氨基酸序列的vl;
[0099]
(ee)包括序列编号128表示的氨基酸序列的vh、及包括序列编号93表示的氨基酸序列的vl;
[0100]
(ff)包括序列编号129表示的氨基酸序列的vh、及包括序列编号93表示的氨基酸序列的vl;
[0101]
(gg)包括序列编号130表示的氨基酸序列的vh、及包括序列编号93表示的氨基酸序列的vl;
[0102]
(hh)包括序列编号131表示的氨基酸序列的vh、及包括序列编号93表示的氨基酸序列的vl;
[0103]
(ii)包括序列编号159表示的氨基酸序列的vh、及包括序列编号165表示的氨基酸序列的vl;
[0104]
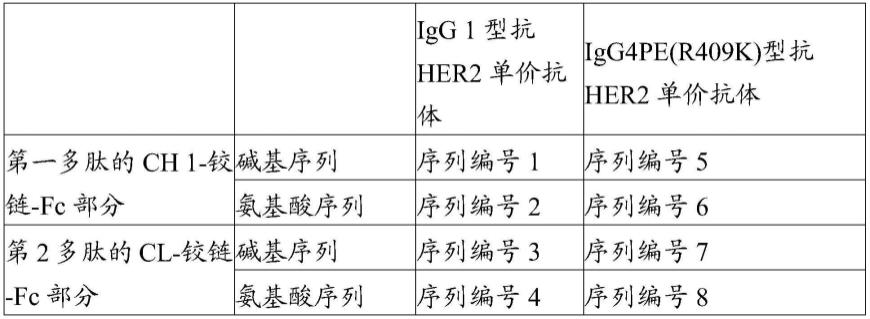
(jj)包括序列编号160表示的氨基酸序列的vh、及包括序列编号165表示的氨基酸序列的vl;
[0105]
(kk)包括序列编号161表示的氨基酸序列的vh、及包括序列编号166表示的氨基酸序列的vl;
[0106]
(ll)包括序列编号162表示的氨基酸序列的vh、及包括序列编号166表示的氨基酸序列的vl;
[0107]
(mm)包括序列编号168表示的氨基酸序列的vh、及包括序列编号180表示的氨基酸序列的vl;
[0108]
(nn)包括序列编号169表示的氨基酸序列的vh、及包括序列编号181表示的氨基酸序列的vl;
[0109]
(oo)包括序列编号170表示的氨基酸序列的vh、及包括序列编号182表示的氨基酸序列的vl;
[0110]
(pp)包括序列编号171表示的氨基酸序列的vh、及包括序列编号183表示的氨基酸序列的vl;
[0111]
(qq)包括序列编号172表示的氨基酸序列的vh、及包括序列编号184表示的氨基酸序列的vl;
[0112]
(rr)包括序列编号173表示的氨基酸序列的vh、及包括序列编号185表示的氨基酸序列的vl。
[0113]
15.根据上述1~14中任一项所述的抗cd3双特异性抗体或该双特异性抗体片段,其中,上述fc区为对fc受体的结合活性增强的fc区。
[0114]
16.根据上述15所述的抗cd3双特异性抗体或该双特异性抗体片段,其中,上述对fc受体的结合活性增强的fc区为包括氨基酸残基改型和/或糖链改型的fc区。
[0115]
17.根据上述15或16所述的抗cd3双特异性抗体或该双特异性抗体片段,其中,上述对fc受体的结合活性增强的fc区为包括氨基酸残基改型及糖链改型两者的fc区。
[0116]
18.根据上述16或17所述的抗cd3双特异性抗体或该双特异性抗体片段,其中,上述氨基酸残基改型为至少包括一个对fc受体的结合活性增强的氨基酸残基改型的氨基酸残基改型。
[0117]
19.根据上述16或17所述的抗cd3双特异性抗体或该双特异性抗体片段,其中,上述糖链改型为使与fc区的eu编号中第297位asn结合的n结合型糖链的还原端的n-乙酰葡萄糖胺(n-acetylglucosamine)上α1,6-结合的岩藻糖缺失的糖链改型。
[0118]
20.根据上述1~19中任一项所述的抗cd3双特异性抗体或该双特异性抗体片段,其包括两个fab作为上述疾病相关抗原结合结构域,各个fab的重链(vh-ch1)的c端与上述fc区直接或经由接头结合。
[0119]
21.根据上述1~19中任一项所述的抗cd3双特异性抗体或该双特异性抗体片段,其包括一个fab作为上述疾病相关抗原结合结构域,fab的重链(vh-ch1)及轻链(vl-cl)的c端与上述fc区直接或经由接头结合。
[0120]
22.根据上述1~19或21中任一项所述的抗cd3双特异性抗体或该双特异性抗体片段,其包括一个fab作为上述疾病相关抗原结合结构域,上述cd3结合结构域与和fab的重链(vh-ch1)结合的一侧的fc链直接或经由接头结合。
[0121]
23.根据上述1~19或21中任一项所述的抗cd3双特异性抗体或该双特异性抗体片段,其包括一个fab作为上述疾病相关抗原结合结构域,上述cd3结合结构域与和fab的轻链(vl-cl)结合的一侧的fc链直接经由接头结合。
[0122]
24.根据上述20~23中任一项所述的抗cd3双特异性抗体或该双特异性抗体片段,其中,上述接头为铰链或其改型体。
[0123]
25.一种dna,其编码上述1~24中任一项所述的抗cd3双特异性抗体或该双特异性抗体片段。
[0124]
26.一种重组体载体,其含有上述25所述的dna。
[0125]
27.一种转化株,其将上述26所述的重组体载体导入宿主细胞而得到。
[0126]
28.一种上述1~24中任一项所述的抗cd3双特异性抗体或该双特异性抗体片段的制造方法,其特征在于,在培养基中培养上述27所述的转化株,在培养物中生成并积累上述1~24中任一项所述的抗cd3双特异性抗体或该双特异性抗体片段,从该培养物中采集该抗cd3双特异性抗体或该双特异性抗体片段。
[0127]
29.一种与上述cd3及所述疾病相关抗原中的至少一者相关的疾病的治疗和/或诊断药物,其含有上述1~24中任一项所述的抗cd3双特异性抗体或该双特异性抗体片段作为有效成分。
[0128]
30.根据上述29所述的治疗和/或诊断药物,其中,与上述cd3及上述疾病相关抗原中的至少一者相关的疾病为癌症。
[0129]
31.一种与上述cd3及上述疾病相关抗原中的至少一者相关的疾病的治疗和/或诊断方法,其使用上述1~24中任一项所述的抗cd3双特异性抗体或该双特异性抗体片段。
[0130]
32.根据上述31所述的治疗和/或诊断方法,其中,与上述cd3及上述疾病相关抗原中的至少一者相关的疾病为癌症。
[0131]
33.根据上述1~24中任一项所述的抗cd3双特异性抗体或该双特异性抗体片段,其中,上述抗cd3双特异性抗体或该双特异性抗体片段用于治疗和/或诊断与上述cd3及上述疾病相关抗原中的至少一者相关的疾病。
[0132]
34.根据上述33所述的抗cd3双特异性抗体或该双特异性抗体片段,其中,与上述cd3及上述疾病相关抗原中的至少一者相关的疾病为癌症。
[0133]
35.一种上述1~24中任一项所述的抗cd3双特异性抗体或该双特异性抗体片段用于制造与上述cd3及上述疾病相关抗原中的至少一者相关的疾病的治疗和/或诊断剂的用途。
[0134]
36.根据上述35所述的用途,其中,与上述cd3及上述疾病相关抗原中的至少一者相关的疾病为癌症。
[0135]
37.一种用于检测或测定与上述cd3及上述疾病相关抗原中的至少一者的试剂,其包含上述1~24中任一项所述的抗cd3双特异性抗体或该双特异性抗体片段。
[0136]
38.一种制造抗cd3双特异性抗体或该双特异性抗体片段的方法,该抗cd3双特异性抗体或该双特异性抗体片段包括具有对fc受体的结合能力的fc区及疾病相关抗原结合结构域,该方法的特征在于,使对于cd3的亲和力减弱的cd3结合结构域结合于fc区。
[0137]
39.一种抑制抗cd3双特异性抗体或该双特异性抗体片段诱导细胞因子产生的方法,上述抗cd3双特异性抗体或该双特异性抗体片段包括具有对fc受体的结合能力的fc区及疾病相关抗原结合结构域,该方法的特征在于,使用对于cd3的亲和力减弱的cd3结合结构域。
[0138]
40.根据上述38或39所述的方法,其中,上述cd3结合结构域对于cd3的解离常数(kd)为6
×
10-8
以上。
[0139]
41.根据上述38~40中任一项所述的方法,其中,上述cd3结合结构域对于cd3的解离常数大于作为比较对照的抗cd3单克隆抗体sp34或km14。
[0140]
42.根据上述38~41中任一项所述的方法,其中,上述cd3结合结构域的氨基酸序列与作为比较对照的抗cd3单克隆抗体sp34或km14的cd3结合结构域的氨基酸序列具有90%以上的同源性,且与抗cd3抗体sp34或km14相比,亲和力降低了10%以上。
[0141]
43.根据上述38~42中任一项所述的方法,其中,上述抗cd3双特异性抗体或该双特异性抗体片段包括一个或两个疾病相关抗原结合结构域。
[0142]
44.根据上述38~43中任一项所述的方法,其中,上述cd3结合结构域及所述疾病相关抗原结合结构域分别为选自scfv、fab及vhh的任意一种。
[0143]
45.根据上述38~44中任一项所述的方法,其中,上述cd3结合结构域和/或上述疾病相关抗原结合结构域经由接头与fc区结合。
[0144]
46.根据上述38~45中任一项所述的方法,其中,上述cd3结合结构域包括包含抗体重链的cdr1~3的vh及包含抗体轻链的cdr1~3的vl。
[0145]
47.根据上述38~46中任一项所述的方法,其中,上述cd3结合结构域为scfv。
[0146]
48.根据上述38~47中任一项所述的方法,其中,上述cd3结合结构域的vh的cdr1~3(hcdr1~3)及vl的cdr1~3(lcdr1~3)的氨基酸序列与选自下述(a)~(h)的任意一个hcdr1~3及lcdr1~3的氨基酸序列分别具有90%以上的同源性,
[0147]
(a)分别包括序列编号118~120表示的氨基酸序列的hcdr1~3、及分别包括序列编号121~123表示的氨基酸序列的lcdr1~3;
[0148]
(b)分别包括序列编号83~85表示的氨基酸序列的hcdr1~3、及分别包括序列编号86~88表示的氨基酸序列的lcdr1~3;
[0149]
(c)分别包括序列编号98~100表示的氨基酸序列的hcdr1~3、及分别包括序列编号132、96、97表示的氨基酸序列的lcdr1~3;
[0150]
(d)分别包括序列编号98~100表示的氨基酸序列的hcdr1~3、及分别包括序列编号133、96、97表示的氨基酸序列的lcdr1~3;
[0151]
(e)分别包括序列编号98、134、100表示的氨基酸序列的hcdr1~3、及分别包括序列编号95~97表示的氨基酸序列的lcdr1~3;
[0152]
(f)分别包括序列编号98、135、100表示的氨基酸序列的hcdr1~3、及分别包括序列编号95~97表示的氨基酸序列的lcdr1~3;
[0153]
(g)分别包括序列编号98、136、100表示的氨基酸序列的hcdr1~3、及分别包括序列编号95~97表示的氨基酸序列的lcdr1~3;
[0154]
(h)分别包括序列编号98、137、100表示的氨基酸序列的hcdr1~3、及分别包括序列编号95~97表示的氨基酸序列的lcdr1~3。
[0155]
49.根据上述38~48中任一项所述的方法,其中,上述cd3结合结构域的vh及vl的氨基酸序列与选自下述(aa)~(rr)的任意一个vh及vl的氨基酸序列分别具有80%以上的同源性,
[0156]
(aa)包括序列编号124表示的氨基酸序列的vh、及包括序列编号125表示的氨基酸序列的vl;
[0157]
(bb)包括序列编号115表示的氨基酸序列的vh、及包括序列编号116表示的氨基酸序列的vl;
[0158]
(cc)包括序列编号94表示的氨基酸序列的vh、及包括序列编号126表示的氨基酸序列的vl;
[0159]
(dd)包括序列编号94表示的氨基酸序列的vh、及包括序列编号127表示的氨基酸序列的vl;
[0160]
(ee)包括序列编号128表示的氨基酸序列的vh、及包括序列编号93表示的氨基酸序列的vl;
[0161]
(ff)包括序列编号129表示的氨基酸序列的vh、及包括序列编号93表示的氨基酸序列的vl;
[0162]
(gg)包括序列编号130表示的氨基酸序列的vh、及包括序列编号93表示的氨基酸序列的vl;
[0163]
(hh)包括序列编号131表示的氨基酸序列的vh、及包括序列编号93表示的氨基酸序列的vl;
[0164]
(ii)包括序列编号159表示的氨基酸序列的vh、及包括序列编号165表示的氨基酸序列的vl;
[0165]
(jj)包括序列编号160表示的氨基酸序列的vh、及包括序列编号165表示的氨基酸序列的vl;
[0166]
(kk)包括序列编号161表示的氨基酸序列的vh、及包括序列编号166表示的氨基酸序列的vl;
[0167]
(ll)包括序列编号162表示的氨基酸序列的vh、及包括序列编号166表示的氨基酸序列的vl;
[0168]
(mm)包括序列编号168表示的氨基酸序列的vh、及包括序列编号180表示的氨基酸序列的vl;
[0169]
(nn)包括序列编号169表示的氨基酸序列的vh、及包括序列编号181表示的氨基酸序列的vl;
[0170]
(oo)包括序列编号170表示的氨基酸序列的vh、及包括序列编号182表示的氨基酸序列的vl;
[0171]
(pp)包括序列编号171表示的氨基酸序列的vh、及包括序列编号183表示的氨基酸序列的vl;
[0172]
(qq)包括序列编号172表示的氨基酸序列的vh、及包括序列编号184表示的氨基酸序列的vl;
[0173]
(rr)包括序列编号173表示的氨基酸序列的vh、及包括序列编号185表示的氨基酸序列的vl。
[0174]
50.根据上述38~49中任一项所述的方法,其中,上述cd3结合结构域的hcdr1~3及lcdr1~3的氨基酸序列为选自下述(a)~(h)的任意一个,
[0175]
(a)分别包括序列编号118~120表示的氨基酸序列的hcdr1~3、及分别包括序列编号121~123表示的氨基酸序列的lcdr1~3;
[0176]
(b)分别包括序列编号83~85表示的氨基酸序列的hcdr1~3、及分别包括序列编号86~88表示的氨基酸序列的lcdr1~3;
[0177]
(c)分别包括序列编号98~100表示的氨基酸序列的hcdr1~3、及分别包括序列编号132、96、97表示的氨基酸序列的lcdr1~3;
[0178]
(d)分别包括序列编号98~100表示的氨基酸序列的hcdr1~3、及分别包括序列编号133、96、97表示的氨基酸序列的lcdr1~3;
[0179]
(e)分别包括序列编号98、134、100表示的氨基酸序列的hcdr1~3、及分别包括序列编号95~97表示的氨基酸序列的lcdr1~3;
[0180]
(f)分别包括序列编号98、135、100表示的氨基酸序列的hcdr1~3、及分别包括序列编号95~97表示的氨基酸序列的lcdr1~3;
[0181]
(g)分别包括序列编号98、136、100表示的氨基酸序列的hcdr1~3、及分别包括序列编号95~97表示的氨基酸序列的lcdr1~3;
[0182]
(h)分别包括序列编号98、137、100表示的氨基酸序列的hcdr1~3、及分别包括序列编号95~97表示的氨基酸序列的lcdr1~3。
[0183]
51.根据上述38~50中任一项所述的方法,其中,上述cd3结合结构域的vh及vl的氨基酸序列为选自下述(aa)~(rr)的任意一个,
[0184]
(aa)包括序列编号124表示的氨基酸序列的vh、及包括序列编号125表示的氨基酸序列的vl;
[0185]
(bb)包括序列编号115表示的氨基酸序列的vh、及包括序列编号116表示的氨基酸序列的vl;
[0186]
(cc)包括序列编号94表示的氨基酸序列的vh、及包括序列编号126表示的氨基酸序列的vl;
[0187]
(dd)包括序列编号94表示的氨基酸序列的vh、及包括序列编号127表示的氨基酸序列的vl;
[0188]
(ee)包括序列编号128表示的氨基酸序列的vh、及包括序列编号93表示的氨基酸
序列的vl;
[0189]
(ff)包括序列编号129表示的氨基酸序列的vh、及包括序列编号93表示的氨基酸序列的vl;
[0190]
(gg)包括序列编号130表示的氨基酸序列的vh、及包括序列编号93表示的氨基酸序列的vl;
[0191]
(hh)包括序列编号131表示的氨基酸序列的vh、及包括序列编号93表示的氨基酸序列的vl;
[0192]
(ii)包括序列编号159表示的氨基酸序列的vh、及包括序列编号165表示的氨基酸序列的vl;
[0193]
(jj)包括序列编号160表示的氨基酸序列的vh、及包括序列编号165表示的氨基酸序列的vl;
[0194]
(kk)包括序列编号161表示的氨基酸序列的vh、及包括序列编号166表示的氨基酸序列的vl;
[0195]
(ll)包括序列编号162表示的氨基酸序列的vh、及包括序列编号166表示的氨基酸序列的vl;
[0196]
(mm)包括序列编号168表示的氨基酸序列的vh、及包括序列编号180表示的氨基酸序列的vl;
[0197]
(nn)包括序列编号169表示的氨基酸序列的vh、及包括序列编号181表示的氨基酸序列的vl;
[0198]
(oo)包括序列编号170表示的氨基酸序列的vh、及包括序列编号182表示的氨基酸序列的vl;
[0199]
(pp)包括序列编号171表示的氨基酸序列的vh、及包括序列编号183表示的氨基酸序列的vl;
[0200]
(qq)包括序列编号172表示的氨基酸序列的vh、及包括序列编号184表示的氨基酸序列的vl;
[0201]
(rr)包括序列编号173表示的氨基酸序列的vh、及包括序列编号185表示的氨基酸序列的vl。
[0202]
52.根据上述38~51中任一项所述的方法,其中,上述fc区为对fc受体的结合活性增强的fc区。
[0203]
53.一种对于cd3的亲和力减弱的cd3结合结构域,其用于制造包括fc区及疾病相关抗原结合结构域的抗cd3双特异性抗体或该双特异性抗体片段。
[0204]
54.一种对于cd3的亲和力减弱的cd3结合结构域,其用于抑制包括fc区及疾病相关抗原结合结构域的抗cd3双特异性抗体或该双特异性抗体片段诱导细胞因子产生。
[0205]
55.一种对于cd3的亲和力减弱的cd3结合结构域用于制造包括fc区及疾病相关抗原结合结构域的抗cd3双特异性抗体或该双特异性抗体片段的用途。
[0206]
发明的效果
[0207]
根据本发明,能够提供一种包括与cd3结合的抗原结合结构域及与疾病相关抗原结合的抗原结合结构域的双特异性抗体、该双特异性抗体片段、编码该双特异性抗体或该双特异性抗体片段的dna、包括该dna的载体、生产该双特异性抗体或该双特异性抗体片段
的杂交瘤及转化株、该双特异性抗体或该双特异性抗体片段的制造方法、包括该双特异性抗体或该双特异性抗体片段的治疗及诊断剂、使用该双特异性抗体或该双特异性抗体片段的治疗及诊断方法、包括该双特异性抗体或该双特异性抗体片段的检测或测定试剂、以及用于制造抗cd3双特异性抗体的对于cd3的亲和力减弱的cd3结合结构域、用于抑制抗cd3双特异性抗体释放细胞因子的对于cd3的亲和力减弱的cd3结合结构域。
[0208]
本发明的双特异性抗体或该特异性抗体片段包括具有对fc受体的结合能力的fc区,该fc区的c端侧结合有一个对于cd3的亲和力减弱的cd3结合结构域,上述双特异性抗体或该特异性抗体片段还包括疾病相关结合结构域,由此,上述双特异性抗体或该特异性抗体片段具有adcc活性及adtc活性(由t细胞介导的抗体依赖性细胞毒性活性、antibody-dependent t-cell-mediated cytotoxicity)带来的疾病相关抗原特异性的细胞毒性活性。因此,本发明的组合物能够以与各种疾病相关的细胞所表达的抗原作为靶标,而用于治疗相应疾病。
附图说明
[0209]
图1的(a)~(c)示出抗体医药品的分子型的示意图。图1的(a)为常规igg抗体,图1的(b)为cd3/epcam双特异性抗体卡妥索单抗(catumaxomab),图1的(c)为作为bispecific t-cell engager[bite(注册商标)]的贝林妥欧单抗(blinatumomab)。
[0210]
图2的(a)及(b)中,图2的(a)示出igg1型单价抗体的分子型的示意图以及分子型中所包含的氨基酸改型部位;图2的(b)示出igg4pe(r409k)型单价抗体的分子型的示意图以及分子型中所包含的氨基酸改型部位。各单价抗体中,将h链作为第一多肽,将轻链-fc融合蛋白作为第二多肽。
[0211]
图3的(a)及(b)中,图3的(a)示出igg1型单价抗体的第一多肽(h链,vh-ch1-hinge-fc)侧fc区的c端上赋予抗cd3 scfv而成的双特异性抗体分子的示意图及氨基酸改型部位;图3的(b)示出igg4pe(r409k)型单价抗体的第一多肽(h链,vh-ch1-hinge-fc)侧fc区的c端上赋予抗cd3 scfv而成的双特异性抗体分子的示意图及氨基酸改型部位。
[0212]
图4是以荧光标记的曲妥珠单抗(trastuzumab)的结合抑制为指标测定igg抗体、单价抗体及双特异性抗体分子与细胞膜上的her2的结合所得到的结果。横轴表示受试抗体分子的浓度,纵轴表示细胞的平均荧光强度的相对值(%)。对于her2的结合力越高的分子,通过抑制荧光标记的曲妥珠单抗(trastuzumab)的结合使纵轴的值越浓度依赖性地减小。
[0213]
图5是使用荧光标记二抗测定igg抗体、单价抗体及双特异性抗体分子与膜上的cd3的结合而得到的结果。纵轴通过对数轴表示细胞的平均荧光强度的相对值(将基准值设为1)。显示具有抗cd3 scfv的分子与t细胞结合。
[0214]
图6是通过实时细胞分析装置测得的对于bt-20细胞的细胞毒性活性的结果。横轴表示测定开始后的时间(h),纵轴表示加入受试抗体后的孔的细胞指数值。细胞指数值越低,表示粘附于孔的细胞数越少,即细胞毒性活性越高。显示与仅具有adcc活性的抗体、仅具有adtc活性的抗体相比,将两者分别半量混合后,细胞毒性活性提高。
[0215]
图7是通过实时细胞分析装置测得的对于bt-20细胞的细胞毒性活性的结果。横轴表示测定开始后的时间(h),纵轴表示加入受试抗体后的孔的细胞指数值。细胞指数值越低,表示细胞毒性活性越高。显示与仅具有adcc活性的抗体、仅具有adtc活性的抗体分别半
量混合时相比,一分子中具有adcc、adtc这两种活性的抗体的细胞毒性活性提高。
[0216]
图8的(a)~(e)是通过实时细胞分析装置测得的对于mcf-7细胞的细胞毒性活性的结果。横轴表示测定开始后的时间(h),纵轴表示加入受试抗体后的孔的细胞指数值。细胞指数值越低,表示细胞毒性活性越高。在仅具有adcc活性的抗体、仅具有adtc活性的抗体几乎不显示细胞毒性活性的条件下,一分子中具有adcc、adtc两种活性的抗体显示高细胞毒性活性。
[0217]
图9是以荧光标记的曲妥珠单抗(trastuzumab)的结合抑制为指标测定cd3/her2双特异性抗体分子与膜上的her2的结合而得到的结果。横轴表示受试抗体分子的浓度,纵轴表示细胞的平均荧光强度的相对值(基准值设为1)。分子对于her2的结合力越高,通过抑制荧光标记的曲妥珠单抗(trastuzumab)的结合使纵轴的值越浓度依赖性减小。显示虽然受试分子中将fc区的c端侧和抗cd3 scfv的n端侧结合的接头部分不同,但对于her2的结合活性不变。
[0218]
图10是使用荧光标记的二抗测定igg抗体、单价抗体及双特异性抗体分子与膜上的cd3的结合而得到的结果。纵轴通过对数轴表示细胞的平均荧光强度的相对值(将基准值设为1)。显示虽然受试分子中将fc区的c端侧和抗cd3 scfv的n端侧结合的接头部分不同,但对于cd3的结合活性变化不大。
[0219]
图11是通过实时细胞分析装置测得的对于bt-20细胞的细胞毒性活性的结果。横轴表示测定开始后的时间(h),纵轴示出加入受试抗体后的孔的细胞指数值。细胞指数值越低,表示细胞毒性活性越高。显示虽然受试分子中将fc区的c端侧和抗cd3 scfv的n端侧结合的接头部分不同,但具有大致同等程度的细胞毒性活性。
[0220]
图12是通过实时细胞分析装置测得的对于bt-20细胞的细胞毒性活性的结果。横轴表示测定开始后的时间(h),纵轴表示加入受试抗体后的孔的细胞指数值。细胞指数值越低,表示细胞毒性活性越高。显示虽然受试分子中将fc区的c端侧和抗cd3 scfv的n端侧结合的接头部分不同,但具有大致同等程度的细胞毒性活性。
[0221]
图13是通过实时细胞分析装置测得的针对mkn-7细胞的细胞毒性活性的结果。横轴表示测定开始后的时间,纵轴表示加入受试抗体后的孔的细胞指数值。细胞指数值越低,表示细胞毒性活性越高。
[0222]
图14是通过实时细胞分析装置测得的对于mkn-45细胞的细胞毒性活性的结果。横轴表示测定开始后的时间(h),纵轴表示加入受试抗体后的孔的细胞指数值。细胞指数值越低,表示细胞毒性活性越高。
[0223]
图15是以公知的抗cd3双特异性抗体为对照抗体,测定对照抗体(左列)及4d5_mvg1_sct3a(df)(右列)对于bt-20抗体的细胞毒性活性及培养上清中的细胞因子浓度,将测定得到的结果绘制在同一图表上而得到的结果的图。在每个图表中,横轴表示受试物质浓度,左纵轴表示细胞毒性活性(%),右纵轴表示各细胞因子浓度(pg/ml)。用黑色方块(
■
)及实线表示细胞毒性活性,用
◇
及虚线表示细胞因子浓度。
[0224]
图16的(a)~(f)是示出为了验证adcc活性和adtc活性的组合所带来的细胞毒性活性的协同提升所设计的分子型的图。图16的(a)示出在单价抗体的第一多肽(h链)的fc区的c端结合有抗cd3 scfv的分子型,图16的(b)示出在双价抗体的单侧的重链的c端结合有抗cd3 scfv的分子型,图16的(c)示出分子型与图16的(a)相同但其具有添加有α1,6岩藻糖
的糖链的分子型,图16的(d)示出在单价抗体的第二多肽(轻链-fc融合蛋白或vl-cl-hinge-fc)的fc区的c端结合有抗cd3 scfv的分子型,图16的(e)示出癌抗原侧fab和抗cd3 scfv均位于fc区的n端侧的分子型,图16的(f)示出在单价抗体的第一、第二多肽的c端分别结合有一个cd3 scfv的分子型。
[0225]
图17的(a)及(b)是作为分子型的验证通过实时细胞分析装置测得的癌抗原侧为双价[图17的(a)]及单价[图17的(b)]的cd3/her2双特异性抗体对于bt-20细胞的细胞毒性活性的结果。横轴表示测定开始后的时间(h),纵轴表示加入受试抗体后的孔的细胞指数值。细胞指数值越低,表示细胞毒性活性越高。
[0226]
图18的(a)及(b)是作为分子型的验证通过实时细胞分析装置测得的癌抗原侧为二价的cd3/gm2双特异性抗体对于sbc-3细胞的细胞毒性活性的结果。图18的(a)是癌抗原侧可变区使用抗dnp抗体的阴性对照分子,图18的(b)是使用抗gm2抗体的分子。横轴表示测定开始后的时间(h),纵轴表示加入受试抗体后的孔的细胞指数值。细胞指数值越低,表示细胞毒性活性越高。
[0227]
图19的(a)是示出作为分子型的验证通过实时细胞分析装置测得的具有α1,6岩藻糖的cd3/her2双特异性抗体等对于bt-20细胞的细胞毒性活性的结果的图。图19的(b)是示出具有α1,6岩藻糖的抗cd3/her2双特异性抗体等对于bt-20细胞的细胞毒性活性与不具有α1,6岩藻糖的cd3/her2双特异性抗体等的比较结果的图。横轴表示测定开始后的时间(h),纵轴表示加入受试抗体后的孔的细胞指数值。细胞指数值越低,表示细胞毒性活性越高。
[0228]
图20的(a)是示出作为分子型的验证通过实时细胞分析装置测得的单价抗体的第二多肽(轻链-fc融合蛋白或vl-cl-hinge-fc)的c端结合有抗cd3 scfv的分子等对于bt-20细胞的细胞毒性活性的结果的图。图20的(b)是示出第二多肽的c端结合有抗cd3 scfv的分子等对于bt-20细胞的细胞毒性活性与单价抗体的第一多肽(vh-ch1-hinge-fc)的c端结合有抗cd3 scfv的分子的比较结果的图。横轴表示测定开始后的时间(h),纵轴表示加入受试抗体后的孔的细胞指数值。细胞指数值越低,表示细胞毒性活性越高。
[0229]
图21是示出作为分子型的验证通过实时细胞分析装置测得的作为不与her2结合的阴性对照的抗cd3双特异性抗体、及her2/cd3双特异性抗体对于bt-20细胞的细胞毒性活性的结果的图。横轴表示测定开始后的时间(h),纵轴表示加入受试抗体后的孔的细胞指数值。细胞指数值越低,表示细胞毒性活性越高。靶标+pbmc(target+pbmc)表示无受试物质,0.5%tritonx-100表示100%毒性活性。受试物质在最终浓度50nm、5nm、0.5nm这3点进行了测定。*和**时测定值接近,因此在下部显示每种受试物质。
[0230]
图22a是示出作为分子型的验证通过实时细胞分析装置测得的不与her2结合的抗cd3双特异性抗体对于bt-20细胞的细胞毒性活性的结果的图。横轴表示测定开始后的时间(h),纵轴表示加入受试抗体后的孔的细胞指数值。细胞指数值越低,表示细胞毒性活性越高。靶标+pbmc表示无受试物质,0.5%tritonx-100表示100%毒性活性。由于可变区4d5mut不与her2结合,因此该测定中观察到的细胞毒性活性是非特异性活性。
[0231]
图22b是示出作为分子型的验证通过实时细胞分析装置测得的不与her2结合的抗cd3双特异性抗体对于bt-20细胞的细胞毒性活性的结果的图。横轴表示测定开始后的时间(h),纵轴表示加入受试抗体后的孔的细胞指数值。细胞指数值越低,表示细胞毒性活性越高。靶标+pbmc表示无受试物质,0.5%triton x-100表示100%毒性活性。由于可变区
4d5mut不与her2结合,因此该测定中观察到的细胞毒性活性是非特异性活性。
[0232]
图22c是示出作为分子型的验证通过实时细胞分析装置检测到的不与her2结合的抗cd3双特异性抗体对于bt-20细胞的细胞毒性活性的结果的图。横轴表示测定开始后的时间(h),纵轴表示加入受试抗体后的孔的细胞指数值。细胞指数值越低,表示细胞毒性活性越高。靶标+pbmc表示无受试物质,0.5%triton x-100表示100%毒性活性。由于可变区4d5mut不与her2结合,因此该测定中观察到的细胞毒性活性是非特异性活性。
[0233]
图22d示出通过表面等离子共振(spr)法测得的抗cd3双特异性抗体对于人cd3d&e蛋白质的结合活性的感应谱。图中示出受试抗体名称及大致kd值。
[0234]
图22e示出通过表面等离子共振(spr)法测得的抗cd3双特异性抗体对于人cd3d&e蛋白质的结合活性的感应谱。图中示出了受试抗体名称及大致kd值。
[0235]
图22f示出通过表面等离子共振(spr)法测得的抗cd3双特异性抗体对于人cd3d&e蛋白质的结合活性的感应谱。图中示出受试抗体名称及大致kd值。
[0236]
图22g示出图22f的虚线部的放大图。
[0237]
图23的(a)及(b)是作为分子型的验证通过实时细胞分析装置测得的不与her2结合的两种抗cd3双特异性抗体对于bt-20细胞的细胞毒性活性的结果的图。横轴表示测定开始后的时间(h),纵轴表示加入受试抗体后的孔的细胞指数值。细胞指数值越低,表示细胞毒性活性越高。由于可变区4d5mut、dnp2均不与her2结合,因此该测定中观察到的细胞毒性活性是非特异性活性。
[0238]
图24a是对使用高亲和力的抗cd3 scfv的抗cd3/her2或阴性对照双特异性抗体的细胞毒性活性进行测定而得到的图。通过实时细胞分析装置测定对于bt-20细胞的细胞毒性活性。横轴表示测定开始后的时间(h),纵轴表示加入受试抗体后的孔的细胞指数值。细胞指数值越低,表示细胞毒性活性越高。
[0239]
图24b是对使用高亲和力的抗cd3 scfv的抗cd3/her2或阴性对照双特异性抗体的非特异性细胞因子产生进行测定而得到的图。测定人pbmc与受试抗体混合时的细胞因子产生。横轴表示受试抗体浓度,纵轴表示培养上清中的细胞因子浓度。使用说明及缩写示于图的下部。
[0240]
图25的(a)及(b)示出供导入抗cd3单克隆抗体克隆sp34的cdr的氨基酸改型的设计例。图25的(a)示出向抗cd3单克隆抗体克隆sp34的vl的cdr或vh的cdr导入1个氨基酸的改型的设计。表中最左栏中用一个字母表示改型的序列编号,左侧第二栏中用一个字母表示经改型的残基的基于kabat编号的氨基酸残基编号和氨基酸残基改型前后的氨基酸残基。表中的各cdr的氨基酸序列中用粗体显示的氨基酸残基表示改型后的氨基酸残基。图25的(b)示出抗cd3单克隆抗体克隆sp34的cdr中的两个以上cdr改型残基的组合的示例。
[0241]
图26的(a)及(c)针对vl示出了使用抗cd3单克隆抗体克隆sp34的改型后cdr的人源化抗体的fr序列的设计例。图26的(b)及(d)针对vh示出了使用抗cd3单克隆抗体克隆sp34的改型后cdr的人源化抗体的fr序列的设计例。
[0242]
图27示出通过表面等离子共振(spr)法测得的使用抗cd3单克隆抗体克隆sp34的cdr改型体的cd3/her2双特异性抗体的结合活性的结果。从左列起示出受试双特异性抗体名称、变异导入部位、测定中的循环数、ka(m-1
s-1
)、kd(s-1
)、kd(m)。突变列中的
“‑”
表示无变异导入,“未获得蛋白质”表示无法以纯化蛋白质的形式获得受试双特异性抗体。
[0243]
图28的(a)~(c)是通过实时细胞分析装置测得的使用抗cd3单克隆抗体克隆sp34的cdr改型体的cd3/her2双特异性抗体对于bt-20细胞的细胞毒性活性的结果的图。横轴表示测定开始后的时间(h),纵轴表示加入受试抗体后的孔的细胞指数值。细胞指数值越低,表示细胞毒性活性越高。靶标+pbmc表示无受测物质,0.5%triton x-100表示100%毒性活性。图28的(a)中被方框围成的部分放大后则为图28的(b)及图28的(c),图28的(b)中,将4d5_mvg1_scsp34(h04’)(df)的活性与图中的其它抗体组比较并显示,图28(c)中,将4d5_mvg1_scsp34(h05’)(df)的活性与图中的其它抗体组比较并显示。
[0244]
图29的(a)~(d)是对使用抗cd3单克隆抗体克隆sp34的cdr改型体的cd3/her2双特异性抗体bt-20细胞进行细胞杀伤时的细胞因子产生进行测定而得到的结果的图。示出通过流式细胞仪测得的培养上清中的细胞因子浓度(il-2、il-6、ifn-γ、tnf-α)的结果。纵轴表示细胞因子浓度(pg/ml),横轴表示抗体浓度(nm)。
[0245]
图30是对使用抗cd3单克隆抗体克隆sp34的cdr改型体的cd3/her2双特异性抗体的非特异性细胞因子产生(il-2,il-6,ifn-γ,tnf-α)进行测定而得到的结果的图。培养基(medium)表示仅加入pbmc和培养基,溶剂对照(vehicle)表示等量加入溶解有受试物质的缓冲液(柠檬酸缓冲液)。纵轴表示细胞因子浓度(pg/ml),横轴表示抗体的种类及浓度(μg/ml)。图中的受试物质名称用缩写,缩写对应物质示于下方。
[0246]
图31示出导入抗cd3单克隆抗体克隆km14的cdr的氨基酸改型的设计例。图的上方示出向vl的cdr导入的改型,下方示出向vh的cdr导入的改型。表左侧示出改型的序列编号,表右侧示出改型后的残基的基于kabat编号的氨基酸残基的编号。粗体显示的残基表示改型后的残基。
[0247]
图32的表中示出通过biacore(光学表面等离子共振生物分析仪)测得的、具有将抗cd3单克隆抗体克隆km14改型后的序列作为抗cd3 sc fv的双特异性抗体对于人cd3蛋白质的结合活性的结果[kd(m)biacore]、通过实时细胞分析装置测得的对于bt-20细胞的细胞毒性活性的结果(特异性细胞毒性,specific cytotoxicity)。细胞毒性活性的“+”的数量表示活性的强度。
[0248]
图33的(a)及(b)是通过实时细胞分析装置测得的、具有将抗cd3单克隆抗体克隆km14改型后的序列作为抗cd3 scfv的双特异性抗体对于bt-20细胞的细胞毒性活性的结果。横轴表示测定开始后的时间(h),纵轴表示加入受试抗体后的孔的细胞指数值。细胞指数值越低,表示细胞毒性活性越高。t+p是表示无受试物质的孔的线,0.5%tritonx-100是表示100%毒性的线。图33的(a)和图33的(b)是在相同条件下进行的试验,但结果是在不同测定用板上测得的。
[0249]
图34的(a)及(b)是通过流式细胞仪测得的、具有将抗cd3单克隆抗体克隆km14改型后的序列作为抗cd3 scfv的双特异性抗体杀伤bt-20细胞时的细胞因子产生量的结果。受试物质的浓度为10nm,图34的(a)中示出inf-γ在培养上清中的浓度,图34的(b)中示出il-6在培养上清中的浓度。lloq表示试剂盒中规定的定量极限值。
[0250]
图35的(a)及(b)是通过实时细胞分析装置测得的、具有将克隆km14改型后的序列作为抗cd3 scfv的双特异性抗体对于bt-20细胞的细胞毒性活性的结果。将未添加受试物质的孔的细胞指数值设为0%,添加0.5%tritonx-100的孔的细胞指数值设为100%,计算并示出特定时间时的细胞毒性活性。图35的(a)、图35的(b)分别为添加受试物质48、120小
时后的细胞毒性活性。纵轴表示细胞毒性活性(%),横轴表示各抗体的种类。
[0251]
图36的(a)~(c)是示出cd3/ccr4双特异性抗体等对于peer细胞的浓度依赖性细胞毒性活性的图。纵轴表示细胞毒性活性(%),横轴表示抗体浓度(nm)。
[0252]
图37的(a)及(b)是示出cd3/ccr4双特异性抗体等杀伤peer细胞时的浓度依赖性的培养上清中的细胞因子(il-2及ifn-γ)浓度的图。纵轴表示细胞因子浓度(pg/ml),横轴表示抗体浓度(nm)。
[0253]
图38的(a)及(b)中,图38的(a)示出cd3/cd123双特异性抗体对于molm13细胞的浓度依赖性细胞毒性活性;图38的(b)示出此时的培养上清中的细胞因子浓度。纵轴表示细胞毒性活性(%),横轴表示抗体浓度(nm)。
[0254]
图39的(a)及(b)是示出cd3/cd123双特异性抗体的浓度依赖性细胞毒性活性及此时培养上清中的细胞因子浓度的图。图39的(a)表示对于molm13细胞的细胞毒性活性,图39的(b)表示对相同抗体对于oci-aml3细胞的细胞毒性活性。各个纵轴表示细胞毒性活性(%),横轴表示抗体浓度(nm)。
[0255]
图40的(a)~(d)是示出cd3/cd123双特异性抗体杀伤细胞时的浓度依赖性的培养上清中的细胞因子浓度的图。图40的(a)表示杀伤molm13细胞时培养上清中的il-2浓度,图40的(b)表示ifn-γ浓度。图40的(c)表示相同抗体杀伤oci-aml3细胞时培养上清中的il-2浓度,图40的(d)表示ifn-γ浓度。各个纵轴表示细胞因子浓度(pg/ml),横轴表示抗体浓度(nm)。
[0256]
图41的(a)~(c)中,图41的(a)为具有将抗cd3单克隆抗体克隆km14改型后的序列作为抗cd3 scfv的双特异性抗体对于bt-20细胞的细胞毒性活性;图41的(b)及(c)是通过流式细胞仪测得的杀伤细胞时的细胞因子产生量的结果。图41的(a)的纵轴表示双特异性抗体的名称,横轴表示细胞毒性活性(%)。图41的(b)及(c)的纵轴表示双特异性抗体的名称,横轴表示细胞因子浓度(pg/ml)。图41的(b)表示inf-γ在培养上清中的浓度,图41的(c)表示il-6在培养上清中的浓度。lloq表示试剂盒中规定的定量极限值。
[0257]
图42是示出为提高双特异性抗体的生产性及理化稳定性而向ch3区域及抗cd3 scfv导入的氨基酸改型的设计例、及结构上的位置的图。
[0258]
图43是关于为了提高生产性及理化稳定性所设计的向抗cd3双特异性抗体导入的改型,针对每个因素列举出ch3部分的改型、scfv克隆、scfv的vh和vl的顺序、及导入scfv的氨基酸改型的图。
[0259]
图44示出通过表面等离子共振(spr)法测得的、向fc(ch3)导入了改型的双特异性抗体、使抗cd3 scfv为vl-接头-vh型的双特异性抗体、及向抗cd3 scfv导入改型的双特异性抗体对于可溶型cd3的结合活性的结果。从左列起示出受试双特异性抗体名称、kd(m)。
[0260]
图45a是示出向fc(ch3)导入了改型的双特异性抗体、使抗cd3 scfv为vl-接头-vh型的双特异性抗体、及向抗cd3 scfv导入了改型的双特异性抗体对于bt-20的细胞毒性活性的测定结果的图。将未添加受试物质的孔的活性值设为0%,添加0.5%tritonx-100的孔的活性值设为100%,示出48小时后的细胞毒性活性。纵轴表示细胞毒性活性(%),横轴表示各双特异性抗体。
[0261]
图45b是示出向fc(ch3)导入了改型的双特异性抗体、使抗cd3 scfv为vl-接头-vh型的双特异性抗体、及向抗cd3 scfv导入了改型的双特异性抗体对于bt-20的细胞毒性活
性的测定结果的图。将未添加受试物质的孔的活性值设为0%,添加0.5%tritonx-100的孔的活性值设为100%,示出48小时后的细胞毒性活性。纵轴表示各双特异性抗体,横轴表示细胞毒性活性(%)。
[0262]
图45c是向fc(ch3)导入了改型的双特异性抗体、使抗cd3 scfv为vl-接头-vh型的双特异性抗体、及向抗cd3 scfv导入改型的双特异性抗体对于bt-20的细胞毒性活性的测定结果。将未添加受试物质的孔的活性值设为0%,添加0.5%tritonx-100的孔的活性值设为100%,示出48小时后的细胞毒性活性。纵轴表示各双特异性抗体,横轴表示细胞毒性活性(%)。
[0263]
图45d是向fc(ch3)导入了改型的双特异性抗体、使抗cd3 scfv为vl-接头-vh型的双特异性抗体、及向抗cd3 scfv导入了改型的双特异性抗体对于bt-20的细胞毒性活性的测定结果。将未添加受试物质的孔的活性值设为0%,添加0.5%tritonx-100的孔的活性值设为100%,示出48小时后的细胞毒性活性。纵轴表示各双特异性抗体,横轴表示细胞毒性活性(%)。
[0264]
图46a是通过流式细胞仪测定的、向fc(ch3)导入了改型的双特异性抗体、使抗cd3 scfv为vl-接头-vh型的双特异性抗体、及向抗cd3 scfv导入了改型的双特异性抗体杀伤bt-20细胞时的细胞因子产生量的结果。图46(a)示出inf-γ在培养上清中的浓度。
[0265]
图46b是通过流式细胞仪测得的、向fc(ch3)导入了改型的双特异性抗体、使抗cd3 scfv为vl-接头-vh型的双特异性抗体、及向抗cd3 scfv导入了改型的双特异性抗体杀伤bt-20细胞时的细胞因子产生量的结果。图46(b)示出il-6在培养上清中的浓度。
[0266]
图46c是通过流式细胞仪测得的、向fc(ch3)导入改型的双特异性抗体及向抗cd3 scfv导入了改型的双特异性抗体杀伤bt-20细胞时的细胞因子产生量的结果。图46(c)示出inf-γ在培养上清中的浓度。
[0267]
图46d是通过流式细胞仪测得的、向fc(ch3)导入了改型的双特异性抗体及向抗cd3 scfv导入了改型的双特异性抗体杀伤bt-20细胞时的细胞因子产生量的结果。图46(d)示出il-6在培养上清中的浓度。
[0268]
图46e是通过流式细胞仪测得的、向fc(ch3)导入了改型的双特异性抗体、使抗cd3 scfv为vl-接头-vh型的双特异性抗体、及向抗cd3 scfv导入了改型的双特异性抗体杀伤bt-20细胞时的细胞因子产生量的结果。图46(e)示出inf-γ在培养上清中的浓度。
[0269]
图46f是通过流式细胞仪测得的、向fc(ch3)导入了改型的双特异性抗体、使抗cd3 scfv为vl-接头-vh型的双特异性抗体、及向抗cd3 scfv导入了改型的双特异性抗体杀伤bt-20细胞时的细胞因子产生量的结果。图46(f)示出il-6在培养上清中的浓度。
[0270]
发明的具体实施方式
[0271]
本发明涉及一种包括与cd3结合的抗原结合结构域及与疾病相关抗原结合的抗原结合结构域的双特异性抗体、或该双特异性抗体片段(以下,也记作本发明的双特异性抗体或该双特异性抗体片段)。
[0272]
作为本发明的双特异性抗体,可列举:包括对于cd3的亲和力减弱的cd3结合结构域的双特异性抗体、包括与cd3结合的抗原结合结构域及与疾病相关抗原结合的抗原结合结构域的双特异性抗体、包含具有对fc受体的结合能力的fc区、且包括对于cd3的亲和力减弱的cd3结合结构域及与疾病相关抗原结合的抗原结合结构域的双特异性抗体、包括对fc
受体的亲和力增强的fc区且包括对于cd3的亲和力减弱的cd3结合结构域及与疾病相关抗原结合的抗原结合结构域的双特异性抗体等。本发明的双特异性抗体通过与cd3和疾病相关抗原两者结合,能够杀伤t细胞和/或nk细胞依赖性地表达疾病相关抗原的细胞,而不会引起产生过量细胞因子。
[0273]
本发明中的cd3与cd3e、t3e、t细胞表面糖蛋白cd3ε链(t-cell surface glycoprotein cd3 epsilon chain)作为相同含义使用。作为cd3,可列举例如:包括ncbi(http://www.ncbi.nlm.nih.gov/)中genbank登录号np_000724.1或序列编号138表示的氨基酸序列的人cd3、及包含genbank登录号np_001270544.1或序列编号139表示的氨基酸序列的猴cd3等。另外,还可列举例如:由序列编号138、genbank登录号np_000724.1、序列编号139、或genbank登录号np_001270544.1表示的氨基酸序列中缺失、取代或添加一个以上氨基酸而成的氨基酸序列构成,且具有cd3的功能的多肽。
[0274]
包括与序列编号138、genbank登录号np_000724.1、序列编号139、或genbank登录号np_001270544.1表示的氨基酸序列通常具有70%以上、优选具有80%以上、进一步优选具有90%以上的同源性的氨基酸序列的多肽;及由最优选具有95%以上,96%以上,97%以上,98%以上及99%以上的同源性的氨基酸序列构成且具有cd3的功能的多肽也包括在本发明的cd3中。
[0275]
具有在序列编号138、genbank登录号np_000724.1或序列编号139,genbank登录号np_001270544.1表示的氨基酸序列中缺失、取代、或添加1个以上氨基酸残基而成的氨基酸序列的多肽能够通过使用定点突变导入法[molecular cloning,a laboratory manual,second edition,cold spring harbor laboratory press(1989),current protocols in molecular biology,john wiley&sons(1987-1997),nucleic acids research,10,6487(1982),proc.natl.acad.sci.usa,79,6409(1982),gene,34,315(1985),nucleic acids research,13,4431(1985),proceeding of the national academy of sciences in usa,82,488(1985)]等,向例如编码序列编号138、genbank登录号np_000724.1或序列编号139、genbank登录号np_001270544.1表示的氨基酸序列的dna导入定点突变来获得。缺失、取代或添加的氨基酸的数量不受特别限定,优选为1个~数10个氨基酸,例如,1~20个氨基酸;更优选为1个~数个氨基酸,例如,1~5个氨基酸。
[0276]
作为编码cd3的基因,可列举例如:序列编号141或genbank登录号nm_000733.3表示的人cd3的碱基序列、及序列编号142或genbank登录号nm_001283615.1表示的猴cd3的碱基序列等。
[0277]
另外,本发明的编码cd3的基因例如也包括下述基因等:
[0278]
包括下述dna的基因,该dna由序列编号141、genbank登录号nm_000733.3或序列编号142、genbank登录号nm_001283615.1表示的碱基序列中缺失、取代或添加1个以上碱基而成的碱基序列构成,且编码具有cd3的功能的多肽;
[0279]
包括下述dna的基因,该dna由与序列编号141、genbank登录号nm_000733.3或序列编号142、genbank登录号nm_001283615.1表示的碱基序列优选具有60%以上的同源性的碱基序列、更优选具有80%以上的同源性的碱基序列、进一步优选具有95%以上的同源性的碱基序列构成,且编码具有cd3的功能的多肽;以及
[0280]
包括下述dna的基因,该dna由与序列编号141、genbank登录号nm_000733.3或序
列编号142、genbank登录号nm_001283615.1表示的碱基序列构成的dna在严格条件下杂交的dna构成,且编码具有cd功能的多肽。
[0281]
在严格条件下杂交的dna表示通过集落杂交法、菌斑杂交法、southern印迹杂交法或dna微阵列法等得到的可杂交dna,这些方法将例如具有序列编号141、genbank登录号nm_000733.3或序列编号142、genbank登录号nm_001283615.1表示的碱基序列的dna用于探针。
[0282]
具体而言,可列举能够通过进行如下操作而能够鉴定的dna,即使用固定有来自杂交后的集落或菌斑的dna、或者具有该序列的pcr产物或寡聚dna的过滤片或载玻片,在0.7~1.0mol/l氯化钠存在下,于65℃进行杂交[molecular cloning,a laboratory manual,second edition,cold spring harbor laboratory press(1989),current protocols in molecular biology,john wiley&sons(1987-1997),dna cloning 1:core techniques,a practical approach,second edition,oxford university(1995)]后,使用0.1~2倍浓度的ssc溶液(1倍浓度的ssc溶液的组成为150mmol/l氯化钠、15mmol/l柠檬酸钠),在65℃的条件下清洗过滤片或载玻片,由此能够进行鉴定。作为可杂交的dna,可列举例如:与序列编号141、genbank登录号nm_000733.3或序列编号142、genbank登录号nm_001283615.1表示的碱基序列优选具有60%以上的同源性的dna、更优选具有80%以上的同源性的dna、进一步优选具有95%以上的同源性的dna。
[0283]
编码真核生物的蛋白质的基因的碱基序列中经常可见基因的多态性。在本发明所使用的基因中,通过这样的多态性导致碱基序列产生了小规模变异的基因也包括在本发明的编码cd3的基因中。
[0284]
除特别说明外,本发明中的同源性的数值可以为使用本领域技术人员公知的同源性检索程序算得的数值,关于碱基序列,可列举使用blast[j.mol.biol.,215,403(1990)]中默认的参数算得的数值等,关于氨基酸序列,可列举使用blast2[nucleic acids research,25,3389(1997),genome research,7,649(1997),http://www.ncbi.nlm.nih.gov/education/blastinfo/information3.html]中默认的参数算得的数值等。
[0285]
作为默认的参数,g(起始空位罚分,cost to open gap)在碱基序列的情况下,为5,在氨基酸序列的情况下,为11;-e(空位延伸罚分,cost to extend gap)在碱基序列的情况下,为2,在氨基酸序列的情况下,为1,-q(核苷酸错位罚分,penalty for nucleotide mismatch)为-3,-r(核苷酸匹配奖分,reward for nucleotide match)为1,-e(期望值,expect value)为10,-w(序列长度,wordsize)在碱基序列的情况下,为11个残基;在氨基酸序列的情况下,为3个残基;-y[以位数表示的非空位延伸下降值(x),dropoff(x)for blast extensions in bits]在blastn的情况下,为20;在除blastn之外的程序中,为7,-x(以位数表示的空位比对下降值x,x dropoff value for gapped alignment in bits)为15,且-z(以位数表示的最终空位比对下降值x,final x dropoff value for gapped alignment in bits)在blastn的情况下,为50,在除blastn之外的程序中,为25(http://www.ncbi.nlm.nih.gov/blast/html/blastcgihelp.html)。
[0286]
由cd3的氨基酸序列的部分序列构成的多肽能够通过本领域技术人员公知的方法来制作,例如,由cd3的部分序列构成的多肽能够通过使编码序列编号138、genbank登录号
np_000724.1或序列编号139,genbank登录号np_001270544.1表示的氨基酸序列的dna部分缺失,并培养导入有包括该序列的表达载体的转化体来制作。
[0287]
另外,基于通过上述方法制作的多肽或dna,通过与上述相同的方法,能够获得例如具有在序列编号138、genbank登录号np_000724.1或序列编号139、genbank登录号np_001270544.1表示的氨基酸序列的部分序列中缺失、取代或添加1个以上氨基酸而成的氨基酸序列的多肽。
[0288]
并且,由cd3的氨基酸序列的部分序列构成的多肽、或具有在cd3的氨基酸序列的部分序列中缺失、取代或添加1个以上氨基酸而成的氨基酸序列的多肽也可以通过芴基甲氧基羰基(fmoc)法、叔丁氧基羰基(tboc)法等化学合成法来制造。
[0289]
作为本发明中的cd3的胞外区,可列举例如:使用公知的跨膜区预测程序sosui(http://sosui.proteome.bio.tuat.ac.jp/sosuiframe0.html)、tmhmm ver.2(http://www.cbs.dtu.dk/services/tmhmm-2.0/)或expasy proteomics server(http://ca.expasy.org/)等预测到由genbank登录号np_000724.1表示的人cd3的氨基酸序列的区域等。具体而言,作为cd3的胞外区,可列举序列编号140或genbank登录号np_000724.1的第22位~第126位表示的氨基酸序列。
[0290]
作为cd3的功能,可列举:与t细胞受体(tcr)直接缔合,形成蛋白质复合物的亚基结构,识别与主要组织相容性复合体(mhc)结合的抗原肽,并参与胞内信号的传递。表达cd3的细胞可列举例如:t细胞、nkt细胞、γδt细胞、及这些的前体细胞或成熟胸腺细胞。
[0291]
本发明中的疾病相关抗原只要为参与癌症、免疫疾病、过敏性疾病、自身免疫性疾病、中枢神经系统疾病、或循环系统疾病等各疾病的抗原,则可以为任意抗原,可列举例如:细胞因子、趋化因子、生长因子及该受体、以及分化簇(cluster of differentiation,以下记作cd)抗原等。
[0292]
作为细胞因子或生长因子的受体,可列举例如:针对干扰素(以下记作ifn)-α、ifn-β、ifn-γ、白细胞介素(以下记作il)-2、il-3、il-4、il-5、il-6、il-7、il-8、il-9、il-10、il-12、il-13、il-15、il-17、il-18、il-21、il-23、il-27、粒细胞集落刺激因子(g-csf)、粒细胞/巨噬细胞集落刺激因子(gm-csf)、或巨噬细胞集落刺激因子(m-csf)的受体等。
[0293]
作为趋化因子受体,可列举例如针对slc、elc、i-309、tarc、mdc、mip-3α、ctack的受体。
[0294]
作为生长因子的受体,可列举例如:针对表皮生长因子(epidermal growth factor、egf)、血管內皮生长因子(vascular endothelial growth factor、vegf)、血管生成素(angiopoietin)、成纤维细胞生长因子(fibroblast growth factor、fgf)、肝细胞生长因子(hepatocyte growth factor、hgf)、血小板衍生生长因子(platelet-derived growth factor、pdgf)、类胰岛素样生长因子(insulin-like growth factor、igf)、红细胞生成素(erythropoietin、epo)、tgfβ、肝配蛋白(iephrin)、血管生成素(angiopoietin)、frizzled ligand、sdf-1的受体等。
[0295]
作为cd抗原、可列举:cd1a、cd1c(bdca1)、cd1d、cd2、cd3、cd4、cd5、cd6、cd7、cd8、cd10、cd11a、cd11b、cd11c、cd14、cd16、cd18、cd19、cd20、cd21、cd22、cd23、cd24、cd25、cd26(dpp-4)、cd27、cd28、cd30、cd32、cd34、cd37、cd38、cd39、cd40、cd43、cd44、cd45、cd47、cd49、cd51、cd52、cd53、cd54、cd55、cd56、cd57、cd59、cd62e、cd62l、cd62p、cd64、cd66a
(ceacam1)、cd66b(nca-95)、cd66c(nca-50/90)、cd66d(cgm1)、cd66e(cea)、cd66f(psg)、cd68、cd69、cd70、cd72、cd73、cd74、cd75、cd76、cd77、cd78、cd79a、cd79b、cd80(b7.1)、cd81、cd82、cd83、cd84(slamf5)、cd85a(ilt-5)、cd85b(ilt8)、cd85c(lir8)、cd85d(ilt4)、cd85f(ilt11)、cd85g(ilt7)、cd85h(ilt1)、cd85i(lir6a)、cd85j(ilt2)、cd85k(ilt3)、cd85m(ilt10)、cd86(b7.2)、cd87、cd89、cd94(nkg2)、cd95(fas)、cd98、cd103、cd107a(lamp1)、cd114(g-csfr)、cd115(m-csfr)、cd116(gm-csfr)、cd117(scf-r)、cd119(ifngr1)、cd121a(il-1r1)、cd122(il-2rb)、cd123(il-3ra)、cd124(il-4ra)、cd125(il-5ra)、cd126(il-6ra)、cd127(il-7ra)、cd134(ox40)、cd135(flt3)、cd137(4-1bb)、cd138(syndecan-1)、cd140(pdgfr)、cd146(muc18)、cd147(emmrrin)、cd152(ctla-4)、cd158a(kir2dl1)、cd158b1(kir2dl2)、cd158b2(kir2dl3)、cd158c(kir2ds6)、cd158d(kir2dl4)、cd158e1(kir3dl1)、cd158e2(kir3ds1)、cd158f(kir2dl5)、cd158g(kir2ds5)、cd158h(kir2ds1)、cd158i(kir2ds4)、cd158j(kir2ds2)、cd158k(kir3dl2)、cd159a(nkg2a)、cd159c(nkg2c)、cd161(nkrp1a)、cd162(psgl-1)、cd163、cd169(siglec1)、cd178(fasl)、cd183(cxcr3)、cd184(cxcr4)、cd185(cxcr5)、cd191(ccr1)、cd193(ccr3)、cd194(ccr4)、cd195(ccr5)、cd196(ccr6)、cd197(ccr7)、cd198(ccr8)、cd199(ccr9)、cd200(ox2)、cd206(mmr)、cd207(langerin)、cd209(dc-sign)、cd212(il-12rβ1)、cd213a1(il-13ra1)、cd213a2(il-13ra2)、cd215(il-15ra)、cd217(il-17r)、cd218a(il-18ra)、cd218b(il-18rβ)、cd223(lag3)、cd226(dnam-1)、cd229(slamf3)、cd252(ox40l)、cd269(bcma)、cd272(btla)、cd274(pd-l1)、cd276(b7h3)、cd278(icos)、cd279(pd-1)、cd281(tlr1)、cd282(tlr2)、cd283(tlr3)、cd284(tlr4)、cd286(tlr6)、cd288(tlr8)、cd289(tlr9)、cd294(crth2)、cd301(mgl)、cd302(dcl1)、cd303(bdca2)、cd304(bdca4)、cd317(bst2)、cd324(e-cadherin)、cd326(epcam)、cd357(gitr)、cd358(dr6)、cd360(il-21r)、cd365(tim-1)、cd366(tim-3)、cd369(dectin-1)、cd370(clec9a)、人类白细胞抗原(human leukocyte antigen、hla)-class ii及hla-i等。
[0296]
此外,作为与癌症、免疫疾病、过敏性疾病、自身免疫性疾病、中枢神经系统或循环系统疾病等相关的抗体的抗原,可列举例如:神经节苷脂gm1、gm2、gd2、gd3、lewis x、lewis y、聚糖蛋白3(glypican-3)、密蛋白(claudin)、asct-2、cd3、cd4、cd40、cd40配体、b7家族分子(例如,cd80、cd86、cd274、b7-dc、b7-h2、b7-h3或b7-h4)、b7家族分子的配体(例如,cd28、ctla-4、icos、pd-1或btla)、ox-40、ox-40配体、cd137、肿瘤坏死因子(tumor necrosis factor、tnf)受体家族分子(例如,dr3、dr4、dr5、baffr、light、tnfr1或tnfr2)、肿瘤坏死因子相关凋亡诱导配体受体(tnf-related apoptosis-inducing ligand receptor、trail)家族分子、trail家族分子的受体家族(例如,trail-r1、trail-r2、trail-r3或trail-r4)、核因子κ-b配体受体致活剂(receptor activator of nuclear factor kappa b ligand、rank)、rank配体、cd25、叶酸受体、间皮蛋白(mesothelin)、siglec8、细胞因子
·
趋化因子受体[例如,il-1rii、il-12rβ2、il-17rb、il-23r、il-27rα、il-31r、il-33rα、il-36r、转化生长因子(transforming growth factor、tgf)βrii、ccr2、ccr10、cxcr1、cxcr2]、nk细胞受体(例如,nkg2d、e4bp4、nkp30、nkp44、nkp46、ahr)、t细胞受体(例如,tcrα/β、tcr vβ11、tcrγ/δ、tslpr、slam、slamf6、lap、garp、sr-a1、cd200r、dcr3、tigit)、b细胞受体(例如,blys、april、tslpr)、树突状细胞受体(例如,fcer1a、tlr7、cadm1、xcr1、btla、sirpa、dcir、
trop2、axl、siglec6、siglec15、cx3cr1、s100a8、s100a9、asgr1)等。
[0297]
本发明的抗体是指来自对构成免疫球蛋白的重链的可变区及重链的恒定区、以及轻链的可变区及轻链的恒定区的全部或一部分进行编码的基因(称为“抗体基因”)的蛋白质。本发明的抗体也包括具有任意免疫球蛋白类及亚类的抗体或抗体片段。
[0298]
重链(h链)是指构成免疫球蛋白分子的两种多肽中分子量较大的多肽。重链决定抗体的类和亚类。iga、igd、ige、igg及igm分别具有α链、δ链、ε链、γ链及μ链作为重链,重链的恒定区由不同氨基酸序列表征。轻链(l链)是指构成免疫球蛋白分子的两种多肽中分子量较小的多肽。作为人的抗体,轻链中存在κ链和λ链两种。
[0299]
可变区(v区)通常是指免疫球蛋白的n端侧的氨基酸序列内存在的富有多样性的区域。可变区之外的部分采用多样性较少的结构,因此被称为恒定区(c区域)。重链和轻链的各个可变区缔合形成抗原结合位点,决定抗体对于抗原的结合特性。
[0300]
在人的抗体的重链中,可变区相当于kabat等人提出的eu索引(kabat et.al.,sequences of proteins of immunological interest,1991fifth edition)(以下也简称为eu索引)中第1位~第117位氨基酸序列,恒定区相当于第118位以后的氨基酸序列。在人的抗体的轻链中,kabat等人提出的编号(kabat numbering)中第1位~第107位氨基酸序列相当于可变区,第108位以后的氨基酸序列相当于恒定区。以下,将重链可变区或轻链可变区简记为vh或vl。
[0301]
抗原结合位点是抗体中识别并结合抗原的位点,是指与抗原决定簇(表位)形成互补立体结构的位点。抗原结合位点与抗原决定簇之间产生很强的分子间相互作用。抗原结合位点由至少包括三个互补决定区(cdr)的vh及vl构成。作为人的抗体,vh及vl分别具有三个cdr。这些cdr从n端侧起依次称为cdr1、cdr2及cdr3。
[0302]
恒定区中,重链恒定区或轻链恒定区分别记作ch或cl。ch根据作为重链的亚类的α链、δ链、ε链、γ链及μ链分类。ch由从n端侧起依次排列的ch1区、铰链区、ch2区、ch3区构成,将ch2区和ch3区一并称为fc区。另一方面,cl被分为称作cλ链及cκ链的两个亚类。
[0303]
本发明的抗cd3抗体是指特异性识别并结合cd3的胞外区的单克隆抗体。另外,本发明的抗体也包括多克隆抗体及寡克隆抗体。
[0304]
在本发明中,能够通过使用例如公知的免疫学检测法(优选荧光细胞染色法等)确认表达cd3或疾病相关抗原的细胞与抗体的结合性的方法来确认双特异性抗体或该双特异性抗体片段与cd3或疾病相关抗原结合。另外,也可以组合使用公知的免疫学检测法[monoclonal antibodies-principles and practice,third edition,academic press(1996),antibodies-a laboratory manual,cold spring harbor laboratory(1988),单克隆抗体实验手册,讲谈社科学(1987)]等。
[0305]
单克隆抗体是保持单克隆性(monoclonality)的产抗体细胞所分泌的抗体,其识别单一表位(也称为抗原决定簇)。单克隆抗体分子彼此具有相同的氨基酸序列(一级结构),形成单一结构。多克隆抗体是指不同的克隆的产抗体细胞所分泌的抗体分子群。寡克隆抗体是指多个不同单克隆抗体混合而成的抗体分子群。
[0306]
表位是由抗体识别并结合的抗原的结构部位。作为表位,可列举例如:单克隆抗体识别并结合的单一的氨基酸序列、由氨基酸序列构成的立体结构、结合有糖链的氨基酸序列及包含结合有糖链的氨基酸序列的立体结构等。
[0307]
作为本发明的单克隆抗体,可列举:由杂交瘤产生的抗体、及由经包括抗体基因的表达载体转化后的转化体产生的基因重组抗体。
[0308]
杂交瘤例如能够通过如下方式制备:制备抗原,从用该抗原免疫后的动物中获得具有抗原特异性的产抗体细胞,再将该产抗体细胞与骨髓瘤细胞融合。培养该杂交瘤或将该杂交瘤给与动物使该杂交瘤腹水癌化,分离并纯化该培养液或腹水,由此能够获得所需的单克隆抗体。作为用抗原免疫的动物,只要其能够制作杂交瘤,则可以使用任意动物,优选使用小鼠、大鼠、仓鼠及兔子等。另外,从这样的被免疫动物中获得具有产抗体能力的细胞,体外对该细胞实施免疫后,将其与骨髓瘤细胞融合,从而能够制作杂交瘤。
[0309]
作为本发明的基因重组抗体,可列举通过基因重组技术制造的抗体,例如,重组小鼠抗体、重组大鼠抗体、重组仓鼠抗体、重组兔子抗体、人型嵌合抗体(也称为嵌合抗体)、人源化抗体(也称为cdr移植抗体)及人抗体等。在基因重组抗体中,能够根据目标动物的物种(作为对象的动物的物种)及目的来决定应用来自哪些动物物种的重链及轻链的可变区以及恒定区。例如,在目标动物物种为人的情况下,能够使可变区来自人或小鼠等非人动物,使恒定区及接头来自人。
[0310]
嵌合抗体是指由人之外的动物(非人动物)的抗体的vh及vl和人抗体的ch及cl构成的抗体。作为非人动物,只要为小鼠、大鼠、仓鼠及兔子等可以制作杂交瘤的动物,则可以使用任意动物。从来自生产单克隆抗体的非人动物的杂交瘤获得编码vh及vl的cdna,并分别将其插入具有编码人抗体的ch及cl的dna的动物细胞用表达载体,构建嵌合抗体表达载体,并将载体导入动物细胞并使其表达,由此能够制造嵌合抗体。
[0311]
人源化抗体是指将非人动物抗体的vh及vl的cdr移植于人抗体的vh及vl相对应的cdr而成的抗体。vh及vl的cdr之外的区域称为框架区域(以下记作fr)。构建对由非人动物抗体的vh的cdr的氨基酸序列和任意的人抗体的vh的fr的氨基酸序列构成的vh的氨基酸序列进行编码的cdna、及对由非人动物抗体的vl的cdr的氨基酸序列和任意的人抗体的vl的fr的氨基酸序列构成的vl的氨基酸序列进行编码的cdna,将其分别插入具有编码人抗体的ch及cl的dna的动物细胞用表达载体,构建人源化抗体表达载体,并将载体导入动物细胞并使其表达,由此能够制造人源化抗体。
[0312]
人抗体是指原本人体内天然存在的抗体,但也包括从通过近来的基因工程、细胞工程、发育工程技术的进步而制作的人抗体噬菌体库及产人抗体转基因动物中得到的抗体等。
[0313]
例如,使人外周血淋巴细胞感染eb病毒等后永生化并进行克隆,从而培养产生该抗体的淋巴细胞,从该培养上清中纯化该抗体,由此能够获得人体内天然存在的抗体。
[0314]
人抗体噬菌体库是指通过将由人b细胞制备的抗体基因插入噬菌体基因而使fab、scfv等抗体片段在噬菌体表面表达的库。能够以对于固定有抗原的底物的结合活性为指标,从该库中回收表面表达具有所需的抗原结合活性的抗体片段的噬菌体。该抗体片段可以进一步通过基因工程方法转换为由2条完整h链及2条完整l链构成的人抗体分子。
[0315]
产人抗体转基因动物表示胞内整合有人抗体基因的动物。具体而言,例如,向小鼠es细胞导入人抗体基因,将该es细胞移植于小鼠的初期胚胎,并使其发育成个体,由此能够制作产人抗体转基因小鼠。通过使用在普通非人动物中进行的杂交瘤制作法获得并培养杂交瘤,在培养上清中产生并积累抗体,由此能够制备来自产人抗体转基因动物的人抗体。
[0316]
基因重组抗体的ch只要属于人免疫球蛋白,则可以为任意重链,优选人免疫球蛋白g(human immunoglobulin、ghigg)类重链。并且,能够使用属于higg类的higg1、higg2、higg3及higg4等任意亚类。另外,基因重组抗体的cl只要属于人免疫球蛋白,则可以为任意轻链,能够使用κ类或λ类轻链。
[0317]
在本发明中,抗体片段是包括抗原结合位点,且具有对于该抗原的抗原结合活性的蛋白质。可列举例如:fab、fab’、f(ab’)2、scfv、双链抗体(diabody)、dsfv、vhh或包括cdr的肽等。
[0318]
fab是igg抗体经作为蛋白水解酶的木瓜蛋白酶处理后得到的片段中(被h链的第224位氨基酸残基切断),h链的n端侧约一半与整个l链通过二硫键(s-s键)结合而成的具有抗原结合活性的分子量约5万的抗体片段。将包括vh及ch1的fab的多肽链记作fab的重链(h链)或vh-ch1。另外,将包括vl及cl的fab的多肽链记作fab的轻链(l链)或vl-cl。
[0319]
f(ab’)2是igg经作为蛋白水解酶的胃蛋白酶处理后得到的片段中(被h链的第234位氨基酸残基切断),比经由铰链区的s-s键结合有fab的片段稍大的具有抗原结合活性的分子量约10万的抗体片段。
[0320]
fab’是切断了上述f(ab’)2的铰链区的s-s键的具有抗原结合活性的分子量约5万的抗体片段。
[0321]
scfv是使用12个残基以上的合适的肽接头(p)将1条vh和1条vl连接而成的vh-p-vl或vl-p-vh多肽,是具有抗原结合活性的抗体片段。
[0322]
双链抗体(diabody)是抗原结合特异性相同或不同的scfv形成二聚物而得到的抗体片段,是具有对于相同抗原的二价的抗原结合活性、或对于不同抗原分别具有特异性抗原结合活性的抗体片段。
[0323]
dsfv是指经由半胱氨酸残基间的s-s键结合有vh及vl中的各1个氨基酸残基取代为该半胱氨酸残基的多肽而成的片段。
[0324]
vhh(也称为纳米抗体)是指vhh抗体中的重链可变区,其能够在不存在其它多肽时与抗原结合。
[0325]
vhh抗体是存在于羊驼等骆驼科动物及鲨鱼等软骨鱼中的抗体,不具有轻链和ch1,仅由重链构成。
[0326]
包括cdr的肽包括vh或vl的cdr中的至少一个区域而构成。包括多个cdr的肽能够通过使cdr彼此直接结合或通过合适的肽接头结合来制作。构建编码本发明的双特异性抗体的vh及vl的cdr的dna,将该dna插入用于原核生物的表达载体或用于真核生物的表达载体,将该载体导入原核生物或真核生物并使其表达,由此能够制造包括cdr的肽。另外,包括cdr的肽也可以通过fmoc法或tboc法等化学合成法来制造。
[0327]
在本发明中,双特异性抗体片段实质上是指由双特异性抗体的部分结构构成,且具有对于两种抗原的抗原结合活性的双特异性抗体片段。
[0328]
本发明的双特异性抗体片段与fc区结合而成的融合蛋白、该fc区与天然存在的配体或受体结合而成的fc融合蛋白(也称为免疫粘附素)、及使多个fc区融合而成的fc融合蛋白等也包括在本发明中。另外,包括氨基酸残基改型的fc区也能够用于本发明的双特异性抗体,上述氨基酸残基改型用于增强或缺失抗体的效应子活性、稳定抗体、及控制血液半衰期。
[0329]
本发明的双特异性抗体是指具有特异性不同的两种抗原结合结构域的多肽或蛋白质。双特异性抗体的抗原结合结构域分别可以与单一的抗原的不同表位结合,也可以与不同抗原结合。
[0330]
在本发明中,抗原结合结构域是具有特异性识别并结合抗原的功能的部分结构。本发明的抗原结合结构域可以为任意形式,例如,抗体、该抗体片段、配体、受体、及天然存在的相互作用分子等可以通过基因重组技术制作的多肽、蛋白质分子及其片段、以及与该蛋白质分子的低分子或天然物的偶联物等
[0331]
本发明的双特异性抗体的两种抗原结合结构域是cd3结合结构域及疾病相关抗原结合结构域。在包括多个疾病相关抗原结合结构域的情况下,可以与相同抗原结合,也可以与不同抗原结合。
[0332]
本发明的双特异性抗体包括具有对fc受体的结合能力的fc区、cd3结合结构域及疾病相关抗原结合结构域,该fc区的c端与cd3结合结构域直接或经由接头结合。
[0333]
本发明中的cd3结合结构域是指与cd3结合的抗原结合结构域。
[0334]
本发明中的疾病相关抗原结合结构域是指与疾病相关抗原结合的抗原结合结构域。
[0335]
本发明中的cd3结合结构域只要特异性识别并结合cd3,则也可以为任意结构域,可列举:包括来自抗cd3抗体的cdr序列的cd3结合结构域、包括来自抗cd3抗体的vh及vl的cd3结合结构域等。包括来自抗cd3抗体的cdr序列或vh及vl的cd3抗原结合结构域优选为scfv。
[0336]
在本发明中,疾病相关抗原结合结构域只要特异性识别并结合疾病相关抗原,则可以为任意结构域,优选为由抗体的fab或vh及vl构成的可变区。
[0337]
在本发明中,例如,使用公知的免疫学检测法(优选荧光细胞染色法等),确认已表达想要评价的抗原的细胞与抗体的结合性,由此能够确认多肽、抗体或者该抗体片段、或双特异性抗体或者该双特异性抗体片段与cd3和/或疾病相关抗原结合。另外,还可以组合使用公知的免疫学检测法[monoclonal antibodies-principles and practice,third edition,academic press(1996),antibodies-a laboratory manual,cold spring harbor laboratory(1988),单克隆抗体实验手册,讲谈社科学(1987)]等。
[0338]
作为本发明的双特异性抗体或该双特异性抗体片段,可列举例如:与cd3结合结构域中包括来自抗cd3单克隆抗体sp34(美国专利第10,066,015号说明书)的cd3结合结构域的抗cd3双特异性抗体相比,在cd3阳性t细胞及疾病相关抗原阳性细胞的存在下诱导细胞因子产生的能力降低的抗cd3双特异性抗体。这样的双特异性抗体或该双特异性抗体片段伴随细胞因子产生所出现的发冷、恶心、萎靡不振、头痛、发烧、心跳加速、和/或血压波动等副作用少,不易引起细胞因子释放综合征,故优选。
[0339]
在本发明中,诱导细胞因子产生的能力是指通过本发明的双特异性抗体或该双特异性抗体片段与t细胞上的cd3、nk细胞上的fc受体和/或靶细胞上的疾病相关抗原结合来诱导该t细胞、该靶细胞、及nk细胞等产生活细胞因子的活性。
[0340]
作为优选降低其产生的细胞因子,只要其为与上述过量或多余的细胞因子产生所导致的副作用相关的细胞因子,则可以为任意细胞因子,可列举例如:干扰素-γ(interferon-γ、ifn-γ)、肿瘤坏死因子-α(tumor necrosis factor-α、tnf-α)、及白介
素-6(interleukin-6、il-6)等炎症性细胞因子、il-2、il-4以及il-10等。
[0341]
本发明的双特异性抗体或该双特异性抗体片段优选为与在不同细胞上表达的cd3及疾病相关抗原结合的抗体或抗体片段。
[0342]
作为本发明的双特异性抗体或该双特异性抗体片段,优选通过与t细胞上的cd3及靶细胞上的疾病相关抗原结合来诱导靶细胞的细胞死亡的抗体或抗体片段,更优选在cd3阳性t细胞及靶细胞存在下仅特异性杀伤靶细胞,在cd3阳性细胞不存在下或靶细胞不存在下不发挥细胞毒性活性的抗体或抗体片段。
[0343]
作为本发明的双特异性抗体或该双特异性抗体片段的细胞毒性活性的机理,可列举:adcc活性、cdc活性、adcp活性及adtc活性等。
[0344]
即,作为本发明的双特异性抗体或该双特异性抗体片段,具体而言,可列举:与cd3阳性细胞及疾病相关抗原阳性细胞两者结合后,特异性诱导疾病相关抗原阳性细胞的细胞毒性和/或细胞死亡的双特异性抗体或该双特异性抗体片段等。
[0345]
一分子的双特异性抗体所具有的针对某一抗原的结合结构域的数量称为结合的价数。例如,在本发明中,在一分子的双特异性抗体分别具有两个与cd3结合的抗原结合结构域及与疾病特异性抗原结合的抗原结合位点结构域的情况下,该双特异性抗体分别以二价与cd3及疾病特异性抗原结合。
[0346]
另外,经由包括免疫球蛋白结构域或其片段的接头等合适的接头结合的多个抗原结合结构域的抗体也包括在本发明的双特异性抗体中。
[0347]
在本发明中,用作接头的免疫球蛋白结构域以具有与免疫球蛋白类似的氨基酸序列,且由存在至少2个半胱氨酸残基的约100个氨基酸残基构成的肽为最小单位。在本发明中,免疫球蛋白结构域也包括含有多个上述最小单位的免疫球蛋白结构域的多肽。作为免疫球蛋白结构域,可列举例如:免疫球蛋白重链的vh、ch1、ch2及ch3、以及免疫球蛋白轻链的vl及cl等。
[0348]
免疫球蛋白的动物物种不受特别限定,优选为人。另外,免疫球蛋白重链的恒定区的亚类可以为igd、igm、igg1、igg2、igg3、igg4、iga1、iga2及ige中的任意一种,优选可列举来自igg及来自igm。另外,免疫球蛋白轻链的恒定区的亚类可以为κ及λ中的任意一种。
[0349]
另外,免疫球蛋白结构域也存在于免疫球蛋白之外的蛋白质中,可列举例如:主要组织相容性复合体(mhc)、cd1、b7及t细胞受体(tcr)等属于免疫球蛋白超家族的蛋白质所包含的免疫球蛋白结构域。作为用于本发明的双特异性抗体的免疫球蛋白结构域,所有免疫球蛋白结构域均可使用。
[0350]
在人的igg中,ch1是指具有eu索引中所示的第118位~第215位氨基酸序列的区域。同理,ch2是指具有kabat等人提出的eu索引中所示的第231位~第340位氨基酸序列的区域,ch3是指具有kabat等人提出的eu索引中所示的第341位~第447位氨基酸序列的区域。在ch1和ch2之间存在被称为铰链(合页)区(以下,有时也记作铰链)的富有柔性的氨基酸区域。铰链区是指具有kabat等人提出的eu索引所示的第216位~第230位氨基酸序列的区域。
[0351]
在人的抗体的κ链中,cl是指具有kabat编号所示的第108位~第214位氨基酸序列的区域,在λ链中,cl是指具有第108位~第215位氨基酸序列的区域。
[0352]
作为本发明的双特异性抗体或该双特异性抗体片段所具有的fc区,能够使用来自
任意动物物种的抗体的fc区,优选来自人的fc区,其中也优选来自igg1的fc区。
[0353]
在本发明中,“具有对fc受体的结合能力的fc区”是指具有对各种fc受体的结合能力至经由fc受体能够发挥adcc活性等效应子活性的程度以上的fc区。具体而言,可列举:人igg1的fc区、人igg3的fc区、及小鼠igg2a的fc区等。另外,对fc受体的结合能力增强的fc区也包括在具有对fc受体的结合能力的fc区中。
[0354]
作为本发明的双特异性抗体或该双特异性抗体片段所具有的“具有对fc受体的结合能力的fc区”,优选具有对fcγr的结合能力的fc区,更优选具有对fcγriiia的结合能力的fc区。
[0355]
另外,作为本发明的双特异性抗体或该双特异性抗体片段所具有的“具有对fc受体的结合能力的fc区”,也优选“增强了对fc受体的亲和力的fc区”。
[0356]
增强了对fc受体的亲和力的fc区只要对fc受体的亲和力相比天然存在的抗体的fc区增强,则可以为任意fc区,可列举:包括糖链改型的fc区、包括氨基酸残基改型的fc区等。
[0357]
作为包括糖链改型的fc,可列举例如:减少或缺失α1,6岩藻糖的加成量的fc区、或加入了使对fc受体的亲和力增强的氨基酸改型(基于天然型氨基酸残基、非天然型氨基酸残基的改型)的fc区等。
[0358]
作为包括氨基酸残基改型的fc区,可列举例如:包括选自人igg1恒定区中的p247i、a339d、f243l、r292p、y300l、p396l、t393a、h433p、s239d、s298a、a330l、i332e、e333a及k334a、及current opinion in biotechnology 2009,20:685-691中所述的氨基酸改型的至少一个氨基酸残基改型的fc区。
[0359]
需要说明的是,以下氨基酸残基改型的表记按照[改型前的氨基酸残基的单字母表记]、[eu索引所示的氨基酸位置]及[改型后的氨基酸残基的单字母表记]的顺序表示。
[0360]
上述fc区或抗体恒定区优选igg类,可以缺失、添加、取代、和/或插入它们的氨基酸序列的一部分。另外,能够将由igg的重链的ch1、铰链、ch2及ch3构成的氨基酸序列的全部或部分片段适当组合后使用。另外,也可以将这些氨基酸序列部分缺失或调序后使用。
[0361]
用于本发明的双特异性抗体的fc区或抗体恒定区的igg的亚类不受特别限定,可以为来自igg1、igg2、igg3及igg4中的任意亚类的fc区或恒定区,优选igg1。
[0362]
作为igg1的fc区或重链恒定区,可列举例如:包括铰链区的第216~220位氨基酸残基缺失以及选自c220s、h435r及y436f的氨基酸残基改型的至少一个改型的fc区或重链恒定区;包括铰链区的第216~220位氨基酸残基缺失及c220s的氨基酸残基改型的fc区或恒定区;包括选自s354c、t366w、y349c、t366s、l368a及y407v的至少一个改型的fc区或重链恒定区。
[0363]
构成本发明的fc区的2条多肽链也分别称为fc多肽链,或简称为fc链。
[0364]
在本发明的双特异性抗体中,一个cd3结合结构域与fc区的任意一个fc链直接或经由接头结合。因此,本发明中的fc区由包括“fc链”及“fc链的c端结合有cd3结合结构域的fc链”的fc区构成。
[0365]
另外,作为本发明中的包括fc区的重链恒定区,可列举:由“ch的多肽链”及“ch的多肽链的c端结合有cd3结构域的ch链”构成的重链恒定区、由“ch的多肽链(也记作ch1-fc)”及“fc链上融合有cl的多肽链(以下,简称为cl-fc)”构成的恒定区等,该恒定区的任意
一个多肽链的c端结合有cd3结合结构域。cd3结合结构域可以与构成上述fc区或恒定区的2条多肽链中的任意多肽链结合。
[0366]
另外,也可以通过在fc区或重链恒定区中所含的多肽链上分别结合构成cd3结合结构域的vh或vl、vh-ch或vl-cl来制作。
[0367]
在本发明的双特异性抗体中所含的fc区或恒定区中,如上所述,由于构成各区域的2条多肽链的任意一者结合有cd3结合结构域,因此形成异二聚体。只要能够构成该异二聚体结构,也可以包括添加、缺失、取代中的任意改型。
[0368]
具体而言,在由2条fc多肽链或ch多肽链构成的情况下,能够通过向ch3结构域加入适当氨基酸残基取代来形成异二聚体,例如通过向2条fc多肽链中的一条加入s354c及t366w的氨基酸残基取代,向另一条加入y349c、t366s、l368a及y407v的氨基酸残基取代,能够形成fc区或ch区的异二聚体[杵臼结构(knobs into holes)改型(nature biotechnology,vol16:677-681,1998)]。也将该改型也称为kih改型。
[0369]
在向本发明的双特异性抗体中所含的fc区中加入kih改型的情况下,无论构成fc区的2条多肽链中的哪一条结合有cd3结合结构域,均可以向任意多肽链加入knobs改型、holes改型。另外,除构成二硫键的改型(s354c和y349c)之外后的kih改型也适用于ch3部分。在该情况下,向2条fc多肽链中的一条加入t366w的氨基酸残基取代,向另一条加入t366s、l368a及y407v的氨基酸残基取代。
[0370]
作为导入有上述kih改型的fc区的具体氨基酸序列的示例,可以列举包括包含序列编号147表示的氨基酸序列的多肽及包含序列编号148表示的氨基酸序列的多肽的fc区、包括包含序列编号149表示的氨基酸序列的多肽及包含序列编号150表示的氨基酸序列的多肽的fc区、包括包含序列编号151表示的氨基酸序列的多肽及包含序列编号152表示的氨基酸序列的多肽的fc区、包括包含序列编号153表示的氨基酸序列的多肽及包含序列编号154表示的氨基酸序列的多肽的fc区,但不限定于此。
[0371]
另外,作为由2条异源ch链构成的ch区(下面称为异源ch区),可列举包括ch多肽链及cl-fc的异源ch区,更优选包括包含c220s的ch多肽链以及包含216-220的氨基酸残基的缺失及c214s的cl-fc的ch区;包括包含c220s的ch多肽以及包含216-220的氨基酸残基的缺失、c214s及h435r的cl-fc的ch区;包括包含c220s的ch多肽以及包含216-220的氨基酸残基的缺失、c214s、h435r及y436f的cl-fc的ch区。
[0372]
本发明的cd3结合结构域只要具有对于cd3的抗原结合能力,则可以为单链,也可以为由多个多肽链构成的多聚物。作为cd3抗原结合结构域,可列举例如:包括针对cd3的抗体的三个或六个cdr序列的cd3结合结构域、或包括针对cd3的抗体的vh及vl的cd3结合结构域,优选fab、fab’、scfv、dsfv及vhh,更优选为fab及scfv。另外,同样也可以使用针对细胞表面抗原的配体分子或受体分子。
[0373]
在本发明的cd3结合结构域为scfv的情况下,作为scfv,已知有从n端侧起vh、接头、vl依次结合而成的结构域(也称为vh-接头-vl型或hl型)、及vl、接头、vh依次结合而成的结构域(也称为vl-接头-vh型或lh型),以上均可以用于本发明的scfv。
[0374]
在本发明的cd3结合结构域为scfv的情况下,可以向scfv的框架加入改型。作为改型的示例,可以考虑例如:用于提高理化稳定性的改型、用于提高生产性的改型、scfv的vh及vl的相互作用面的氨基酸改型等。具体而言,可列举:将scfv的vh的第44位(基于kabat编
号)氨基酸取代为cys,将vl的第100位(基于kabat编号)氨基酸取代为cys的改型(cc改型)、将vh的第44位氨基酸取代为ser,将vl的第100位氨基酸取代为glu的改型(se改型)等。
[0375]
优选本发明的cd3结合结构域对于cd3的亲和力减弱。cd3结合结构域的亲和力减弱表示例如对于cd3的解离常数(kd)为6
×
10-8
以上。cd3结合结构域对于cd3的解离常数(kd)更优选为7
×
10-8
以上,进一步优选为8
×
10-8
以上,进一步优选为9
×
10-8
以上。另外,cd3结合结构域对于cd3的亲和力减弱表示例如对于cd3的解离常数大于抗cd3单克隆抗体sp34或km14。
[0376]
本发明的cd3结合结构域的解离常数可列举例如:使用biacore t100(ge healthcare公司)通过表面等离子共振(spr)法算得的值。
[0377]
作为本发明的cd3结合结构域的一个方式,可列举:cdr或vh/vl的氨基酸序列与作为比较对照的抗cd3单克隆抗体sp34或km14的cdr或vh/vl的氨基酸序列相比具有80%以上、85%以上、86%以上、87%以上、88%以上、89%以上、90%以上、91%以上、92%以上、93%以上、94%以上、95%以上、96%以上、97%以上、98%以上、或99%以上的同源性,且与sp34或km14相比,对于cd3的亲和力优选为降低了10%以上,更优选降低了20%以上,进一步优选降低了30%以上。
[0378]
作为本发明的cd3结合结构域的一个方式,可列举:cdr或vh/vl的氨基酸序列与作为比较对照的抗cd3单克隆抗体sp34的氨基酸序列相比具有80%以上、85%以上、86%以上、87%以上、88%以上、89%以上、90%以上、91%以上、92%以上、93%以上、94%以上、95%以上、96%以上、97%以上、98%以上、或99%以上的同源性,且与sp34相比,亲和力降低了70%以上,优选降低了80%以上,更优选降低了85%以上,更进一步优选降低了90%以上。
[0379]
另外,作为本发明的cd3结合结构域的一个方式,可列举:cdr或vh/vl的氨基酸序列与作为比较对照的抗cd3单克隆抗体km14的氨基酸序列相比具有80%以上、85%以上、86%以上、87%以上、88%以上、89%以上、90%以上、91%以上、92%以上、93%以上、94%以上、95%以上、96%以上、97%以上、98%以上、或99%以上的同源性,且与km14相比,亲和力优选降低了10%以上,更优选降低了15%以上,进一步优选降低了30%以上,更进一步优选降低了40%以上。
[0380]
在本发明中,亲和力降低了a%以上是指,将比较对照cd3结合结构域对于cd3的解离常数设为k
d0
,受试cd3结合结构域对于cd3的解离常数设为k
d1
时,两者的比k
d0
/k
d1
为(100-a)%以下。
[0381]
在本发明中,将包括抗cd3单克隆抗体sp34的vh及vl的氨基酸序列、或sp34的六个cdr的氨基酸序列的抗体称为sp34克隆。
[0382]
在本发明中,将包括抗cd3单克隆抗体km14的vh及vl的氨基酸序列、或km14的六个cdr的氨基酸序列的抗体称为km14克隆。
[0383]
在本发明中,接头只要能够将fc区与cd3结合结构域或者fc区与疾病相关抗原结合结构域结合,则可以为任意分子结构,可列举例如免疫球蛋白结构域或其片段及肽链等,优选肽链。作为肽链的氨基酸序列,可列举例如:由sgggg或者sgggg的重复序列构成的gs接头、由eaaak或者其重复序列构成的接头、由氨基酸序列papap构成的接头、或来自抗体的铰链区及ch1结构域等恒定区的序列、或者其改型序列等。
[0384]
本发明的双特异性抗体或该双特异性抗体片段可以具有一个疾病相关抗原结合结构域,也可以具有两个以上。
[0385]
疾病相关抗原结合结构域与fc区可以直接结合,也可以经由接头结合。另外,可以结合于fc区的c端侧,也可以结合于n端侧,优选结合于c端侧。在一个cd3结合结构域结合于fc区的c端侧的情况下,cd3结合结构域可以结合于构成fc区的2条多肽链中的任意多肽链。
[0386]
本发明中的疾病相关抗原结合结构域只要具有对于疾病相关抗原的抗原结合能力,则可以为单链,也可以为由多个多肽链构成的多聚物。作为疾病相关抗原结合结构域,可列举例如:包括针对疾病相关抗原的抗体的三个或六个cdr序列的抗原结合结构域、或包括针对疾病相关抗原的抗体的vh及vl的抗原结合结构域,可列举:fab、fab’、scfv、dsfv及vhh等,优选为由vh及vl构成的抗原结合结构域或fab。另外,同样也可以使用针对细胞表面抗原的配体分子、受体分子。
[0387]
作为针对疾病相关抗原的抗体,优选单克隆抗体,只要为已知特异性识别并结合与各疾病相关的抗原的单克隆抗体或已经作为抗体药品上市的单克隆抗体等能够进行基因重组的抗体,则所有具有特异性的抗体均可以用作本发明的抗cd3双特异性抗体中所含的疾病相关抗原结合结构域。
[0388]
在构成本发明的双特异性抗体或该双特异性抗体片段的氨基酸序列中,缺失、添加、取代或插入一个以上的氨基酸残基,且具有与上述抗体或其抗体片段相同的活性的抗体或该双特异性抗体片段也包括在本发明的双特异性抗体或该双特异性抗体片段中。
[0389]
缺失、取代、插入和/或添加的氨基酸的数量为1个以上,其数量不受特别限制,可以是通过molecular cloning,the second edition,cold spring harbor laboratory press(1989),current protocols in molecular biology,john wiley&sons(1987-1997),nucleic acids research,10,6487(1982),proc.natl.acad.sci.,usa,79,6409(1982),gene,34,315(1985),nucleic acids research,13,4431(1985),proc.natl.acad.sci usa,82,488(1985)等中所述的定点突变导入法等公知技术缺失、取代、插入或者添加的数量。例如,通常为1~数十个,优选为1~20个,更优选为1~10个,进一步优选为1~5个。
[0390]
在上述本发明的双特异性抗体的氨基酸序列中缺失、取代、插入或添加一个以上氨基酸残基表示如下内容。在相同序列中的任意一个或者多个氨基酸序列中具有一个或多个氨基酸残基的缺失、取代、插入或添加。另外,有时也同时产生缺失、取代、插入或添加,所取代、插入或添加的氨基酸残基为天然型和非天然型的任意一种情况。
[0391]
作为天然型氨基酸残基,可列举例如:l-丙氨酸、l-天冬酰胺、l-天冬氨酸、l-谷氨酰胺、l-谷氨酸、甘氨酸、l-组氨酸、l-异亮氨酸、l-亮氨酸、l-赖氨酸、l-精氨酸、l-蛋氨酸、l-苯丙氨酸、l-脯氨酸、l-丝氨酸、l-苏氨酸、l-色氨酸、l-酪氨酸、l-缬氨酸及l-半胱氨酸等。
[0392]
以下,将示出可相互取代的氨基酸残基的优选示例。同一组中所含的氨基酸残基可以相互取代。
[0393]
a组:亮氨酸、异亮氨酸、正亮氨酸、缬氨酸、正缬氨酸、丙氨酸、2-氨基丁酸、蛋氨酸、o-甲基丝氨酸、叔丁基甘氨酸、叔丁基丙氨酸、环己基丙氨酸
[0394]
b组:天冬氨酸、谷氨酸、异天冬氨酸、异谷氨酸、2-氨基己二酸、2-氨基辛二酸
[0395]
c组:天冬酰胺、谷氨酰胺
[0396]
d组:赖氨酸、精氨酸、鸟氨酸、2,4-二氨基丁酸、2,3-二氨基丙酸
[0397]
e组:脯氨酸、3-羟基脯氨酸、4-羟基脯氨酸
[0398]
f组:丝氨酸、苏氨酸、高丝氨酸
[0399]
g组:苯丙氨酸、酪氨酸
[0400]
本发明的双特异性抗体也包括包含经翻译后修饰的任意氨基酸残基的抗体。作为翻译后修饰,可列举例如:h链的c端的赖氨酸残基缺失[赖氨酸剪切(lysine clipping)]及多肽的n端的谷氨酰胺残基取代为焦谷氨酰胺(pyroglu)等[beck et al,analytical chemistry,85,715-736(2013)]。
[0401]
作为本发明的双特异性抗体或该双特异性抗体片段,具体而言,可列举例如:选自下述(1)~(3)中的任意一个双特异性抗体或该双特异性抗体片段等。
[0402]
(1)包括具有对fc受体的结合能力的fc区,该fc区的c端侧结合一个cd3结合结构域,进一步在该fc区的n端侧包括一个以上疾病相关抗原结合结构域的抗cd3双特异性抗体或该双特异性抗体片段。
[0403]
(2)包括具有对fc受体的结合能力的fc区,该fc区的c端侧结合一个cd3结合结构域,进一步在该fc区的c端侧包括一个以上疾病相关抗原结合结构域的抗cd3双特异性抗体或该双特异性抗体片段。
[0404]
(3)包括具有对fc受体的结合能力的fc区,该fc区的c端侧结合一个cd3结合结构域,进一步在该fc区的c端侧包括一个以上疾病相关抗原结合结构域,且该fc区的n端侧包括一个以上疾病相关抗原结合结构域的抗cd3双特异性抗体或该双特异性抗体片段。
[0405]
作为本发明的一个方式,可列举如下的双特异性抗体或该双特异性抗体片段,其为上述(1)所述的抗cd3双特异性抗体或该双特异性抗体片段,其中,fc区形成了向ch3部分导入杵臼结构(knobs into holes)改型(nature biotechnology.vol 16:677-681,1998)(也称为kih改型)、或从该kih改型中除去用于构成二硫键的改型(s354c和y349c)之外的改型而成的异二聚体,该异二聚体的任意一个c端经由接头结合有cd3结合结构域,该异二聚体的n端的单侧或两侧结合有疾病相关抗原结合结构域。
[0406]
作为本发明的一个方式,可列举如下的双特异性抗体或该双特异性抗体片段,其为上述(1)所述的抗cd3双特异性抗体或该双特异性抗体片段,其中,fc区的2条多肽链的n端侧分别结合cl、ch1,形成由ch1-fc和cl-fc构成的异二聚体,ch1-fc和cl-fc中任意一者的c端经由接头结合有cd3结合结构域,
[0407]
(a)ch1-fc及cl-fc的n端分别结合vh及vl,形成一个疾病相关抗原结合结构域的双特异性抗体或该双特异性抗体片段;
[0408]
(b)ch1-fc及cl-fc的n端分别结合vl及vh,形成一个疾病相关抗原结合结构域的双特异性抗体或该双特异性抗体片段;以及
[0409]
(c)ch1-fc和/或cl-fc的n端结合fab、vhh和/或scfv,包含一个以上疾病相关抗原结合结构域的双特异性抗体或该双特异性抗体片段。
[0410]
其中,优选ch1-fc及cl-fc的n端分别结合有vl及vh、或分别结合有vh及vl,更优选ch1-fc及cl-fc的n端分别结合有vh及vl。
[0411]
另外,优选对ch1-fc和cl-fc的氨基酸序列进行氨基酸改型,以在细胞中表达时形
成异二聚体,具体而言,优选cl-fc中包括216-220的缺失、以及c214s、h435r、及y436f的氨基酸残基改型;ch1-fc中包括c220s的氨基酸残基改型。作为以上改型,上述kih改型或该kih改型中除用于构成二硫键的改型之外的改型均可导入。
[0412]
作为疾病相关抗原结合结构域,可列举由fab、vh及vl构成的可变区、vhh及scfv等。具体而言,优选在上述异二聚体的n端的两侧结合有fab作为疾病相关抗原结合结构域。形成fab的vh-ch1、vl-cl的多肽链中的任意一者均可与fc区的n端结合,更优选结合vh-ch1。
[0413]
作为本发明的一个方式,可列举如下的双特异性抗体或该双特异性抗体片段,其为上述(2)所述的抗cd3双特异性抗体或该双特异性抗体片段,其中,fc区的2条多肽链的n端侧分别结合cl、ch1,形成ch1-fc和cl-fc的异二聚体,ch1-fc和cl-fc的任意一者的c端经由接头结合有cd3结合结构域,ch1-fc和/或cl-fc的c端侧结合有fab、vhh、和/或scfv作为疾病相关抗原结合结构域。
[0414]
此时,疾病相关抗原结合结构域与ch1-fc和/或cl-fc可以直接结合,也可以经由接头结合,还可以进而与cd3结合结构域的c端侧结合。
[0415]
优选对上述异二聚体的氨基酸序列进行氨基酸改型,以在细胞中表达时形成异二聚体,具体而言,在cl-fc中优选进行216-220氨基酸残基的缺失、以及c214s、h435r、及y436f的氨基酸残基改型,在ch1-fc中优选进行c220s的氨基酸残基改型。
[0416]
作为本发明的另一方式,可列举下述双特异性抗体,其为上述(2)所述的抗cd3双特异性抗体或该双特异性抗体片段,其中,fc区上加入有杵臼结构(knobs into holes)改型或该kih改型中除s354c和y349c之外的改型,在形成该fc区的异二聚体的c端侧具有一个以上疾病相关抗原结合结构域。作为该疾病相关抗原结合结构域,可列举例如:由fab、vh及vl构成的抗体可变区、vhh、及scfv等。疾病相关抗原结合结构域与ch1-fc和/或cl-fc可以直接结合,也可以经由接头结合,还可以进而结合于cd3结合结构域的c端侧。
[0417]
作为本发明的一个方式,可列举下述双特异性抗体或该双特异性抗体片段,其为上述(3)所述的抗cd3双特异性抗体或该双特异性抗体片段,其中,fc区的2条多肽链的n端侧分别结合cl、ch1,形成由ch1-fc和cl-fc构成的异二聚体,ch1-fc和cl-fc的任意一者的c端经由接头结合cd3结合结构域,ch1-fc和cl-fc的n端侧具有一个以上疾病相关抗原结合结构域,并且,ch1-fc和cl-fc的c端侧也具有一个以上疾病相关抗原结合结构域。
[0418]
在与ch1-fc和/或cl-fc的n端侧结合的疾病相关抗原结合结构域中,可以在ch1-fc及cl-fc的n端分别结合vh及vl(或分别结合vl及vh),形成一个疾病相关抗原结合结构域,也可以在ch1-fc及cl-fc中的至少一者的n端结合fab、vhh和/或scfv,形成至少一个疾病相关抗原结合结构域。
[0419]
另外,作为上述疾病相关抗原结合结构域,优选在ch1-fc及cl-fc的n端分别结合vh及vl(或分别结合vl及vh),形成一个疾病相关抗原结合结构域,更优选在ch1-fc及cl-fc的n端分别结合有vh及vl。
[0420]
与ch1-fc和/或cl-fc的c端侧结合的疾病相关抗原结合结构域与这些多肽链可以直接结合,也可以经由接头结合,还可以经由cd3结合结构域结合。作为该疾病相关抗原结合结构域,可列举例如:fab、vhh、及scfv等。
[0421]
另外,优选对ch1-fc和cl-fc的氨基酸序列进行氨基酸改型,以在细胞中表达时形
成异二聚体,具体而言,优选在cl-fc中进行216-220的氨基酸残基的缺失、以及c214s、h435r、及y436f的氨基酸残基改型,在ch1-fc中进行c220s的氨基酸残基改型。
[0422]
作为本发明的另一方式,可列举如下的双特异性抗体或该双特异性抗体片段,其为上述(3)所述的抗cd3双特异性抗体或该双特异性抗体片段,其中,向fc区加入有杵臼结构(knobs into holes)改型或该kih改型中除s354c和y349c之外的改型,该fc区的异二聚体的n端侧具有一个以上疾病相关抗原结合结构域,并且,该fc区的异二聚体的c端侧也具有一个以上疾病相关抗原结合结构域。
[0423]
作为疾病相关抗原结合结构域,可列举例如:fab、vhh及scfv等。在上述异二聚体的n端侧结合有fab作为疾病相关抗原结合结构域的情况下,形成fab的vh-ch1、vl-cl的多肽链中的任意一个均可以与fc区的n端结合,更优选在fc区的n端结合有vh-ch1。
[0424]
另外,与上述异二聚体的c端侧结合的疾病相关抗原结合结构域与异二聚体的c端可以直接结合,也可以经由接头结合,还可以进而与cd3结合结构域的c端侧结合。
[0425]
在上述(1)~(3)的任意方式中,均可以同样使用增强了对fc受体的亲和力的fc区作为具有对fc受体的结合能力的fc区。
[0426]
在上述(1)~(3)的任意方式中,均可以通过将构成cd3结合结构域的vh及vl分别结合于构成fc区的2条多肽链来制造在fc区的c端结合有一个cd3结合结构域的抗cd3双特异性抗体或该双特异性抗体片段。
[0427]
本发明的抗cd3双特异性抗体或该双特异性抗体片段还可以利用上述之外的公知的异二聚体制作技术来制作。作为公知的技术,可列举例如:crossmab技术、beat技术、xmab技术、art-ig技术、及azymetric技术(均记载于nat rev drug discov.18:585-608,2019)、以及nat rev drug discov.18:585-608,2019中所述的其它异二聚体制作技术等。
[0428]
作为本发明的再一优选方式,可列举该cd3结合结构域为scfv的双特异性抗体或该双特异性抗体片段。
[0429]
作为本发明的一种更优选方式,可列举cd3结合结构域对于cd3的解离常数(kd)为6
×
10-8
以上、7
×
10-8
以上、8
×
10-8
以上或9
×
10-8
以上的双特异性抗体或该双特异性抗体片段。
[0430]
作为本发明的一个方式,可列举cd3结合结构域对于cd3的解离常数大于作为比较对照的抗cd3单克隆抗体sp34或km14的双特异性抗体或该双特异性抗体片段。
[0431]
作为本发明的一个方式,可列举cd3结合结构域的cdr或vh/vl的氨基酸序列与作为比较对照的抗cd3单克隆抗体sp34或km14的cd3结合结构域的cdr或vh/vl的氨基酸序列具有90%以上的同源性,且与抗cd3抗体sp34或km14相比,亲和力降低了10%以上的双特异性抗体或该双特异性抗体片段。
[0432]
作为本发明的一个更优选方式,可列举具有对于疾病相关抗原的表达细胞的adcc活性及adtc活性,并在对于疾病相关抗原表达细胞杀伤细胞时抑制诱导细胞因子产生的双特异性抗体。
[0433]
作为一个更优选方式,可列举fc区和cd3结合结构域之间的接头的氨基酸序列为选自(sgggg)n(n=1~3)、(eaaak)n(n=1~3)或papap中的一个的双特异性抗体或该双特异性抗体片段。
[0434]
作为本发明中的cd3结合结构域,具体而言,可列举cd3结合结构域的vh的cdr1~3
(hcdr1~3)及vl的cdr1~3(lcdr1~3)的氨基酸序列与选自下述(a)~(h)的任意一个hcdr1~3及lcdr1~3的氨基酸序列分别具有90%以上的同源性的cd3结合结构域。
[0435]
(a)分别包括序列编号118~120表示的氨基酸序列的hcdr1~3、及分别包括序列编号121~123表示的氨基酸序列的lcdr1~3;
[0436]
(b)分别包括序列编号83~85表示的氨基酸序列的hcdr1~3、及分别包括序列编号86~88表示的氨基酸序列的lcdr1~3;
[0437]
(c)分别包括序列编号98~100表示的氨基酸序列的hcdr1~3、及分别包括序列编号132、96、97表示的氨基酸序列的lcdr1~3;
[0438]
(d)分别包括序列编号98~100表示的氨基酸序列的hcdr1~3、及分别包括序列编号133、96、97表示的氨基酸序列的lcdr1~3;
[0439]
(e)分别包括序列编号98、134、100表示的氨基酸序列的hcdr1~3、及分别包括序列编号95~97表示的氨基酸序列的lcdr1~3;
[0440]
(f)分别包括序列编号98、135、100表示的氨基酸序列的hcdr1~3、及分别包括序列编号95~97表示的氨基酸序列的lcdr1~3;
[0441]
(g)分别包括序列编号98、136、100表示的氨基酸序列的hcdr1~3、及分别包括序列编号95~97表示的氨基酸序列的lcdr1~3;
[0442]
(h)分别包括序列编号98、137、100表示的氨基酸序列的hcdr1~3、及分别包括序列编号95~97表示的氨基酸序列的lcdr1~3。
[0443]
作为本发明中的cd3结合结构域,具体而言,可列举cd3结合结构域的vh及vl的氨基酸序列与选自下述(aa)~(rr)的任意一个的vh及vl的氨基酸序列分别具有80%以上的同源性的cd3结合结构域。
[0444]
(aa)包括序列编号124表示的氨基酸序列的vh、及包括序列编号125表示的氨基酸序列的vl;
[0445]
(bb)包括序列编号115表示的氨基酸序列的vh、及包括序列编号116表示的氨基酸序列的vl;
[0446]
(cc)包括序列编号94表示的氨基酸序列的vh、及包括序列编号126表示的氨基酸序列的vl;
[0447]
(dd)包括序列编号94表示的氨基酸序列的vh、及包括序列编号127表示的氨基酸序列的vl;
[0448]
(ee)包括序列编号128表示的氨基酸序列的vh、及包括序列编号93表示的氨基酸序列的vl;
[0449]
(ff)包括序列编号129表示的氨基酸序列的vh、及包括序列编号93表示的氨基酸序列的vl;
[0450]
(gg)包括序列编号130表示的氨基酸序列的vh、及包括序列编号93表示的氨基酸序列的vl;
[0451]
(hh)包括序列编号131表示的氨基酸序列的vh、及包括序列编号93表示的氨基酸序列的vl;
[0452]
(ii)包括序列编号159表示的氨基酸序列的vh、及包括序列编号165表示的氨基酸序列的vl;
[0453]
(jj)包括序列编号160表示的氨基酸序列的vh、及包括序列编号165表示的氨基酸序列的vl;
[0454]
(kk)包括序列编号161表示的氨基酸序列的vh、及包括序列编号166表示的氨基酸序列的vl;
[0455]
(ll)包括序列编号162表示的氨基酸序列的vh、及包括序列编号166表示的氨基酸序列的vl;
[0456]
(mm)包括序列编号168表示的氨基酸序列的vh、及包括序列编号180表示的氨基酸序列的vl;
[0457]
(nn)包括序列编号169表示的氨基酸序列的vh、及包括序列编号181表示的氨基酸序列的vl;
[0458]
(oo)包括序列编号170表示的氨基酸序列的vh、及包括序列编号182表示的氨基酸序列的vl;
[0459]
(pp)包括序列编号171表示的氨基酸序列的vh、及包括序列编号183表示的氨基酸序列的vl;
[0460]
(qq)包括序列编号172表示的氨基酸序列的vh、及包括序列编号184表示的氨基酸序列的vl;
[0461]
(rr)包括序列编号173表示的氨基酸序列的vh、及包括序列编号185表示的氨基酸序列的vl。
[0462]
作为本发明中的cd3结合结构域,可列举:包括与选自上述(a)~(h)、(aa)~(rr)以及抗cd3单克隆抗体sp34及km14的任意一者的cd3结合结构域竞争地与cd3结合的cd3结合结构域、与包括选自上述(a)~(h),(aa)~(rr)以及抗cd3单克隆抗体sp34及km14的任意一者的cd3结合结构域所结合的cd3上的表位结合的cd3结合结构域、与包括选自上述(a)~(h)、(aa)~(rr)以及抗cd3单克隆抗体sp34及km14的任意一者的cd3结合结构域所结合的表位中所含的表位结合的cd3结合结构域。
[0463]
作为本发明的cd3结合结构域所结合的cd3分子上存在的表位,可列举从人cd3的氨基酸序列的n端起至第27位的氨基酸序列。由于抗cd3单克隆抗体sp34及km14均与本表位结合,因此,作为本发明中的cd3的表位,可优选列举:包括从cd3的氨基酸序列的n端起至第27位的氨基酸序列中所含的至少一个氨基酸残基的表位、包括由该氨基酸序列构成的立体结构的表位等。
[0464]
上述与抗cd3单克隆抗体sp34和/或km14竞争结合的抗体、与该抗体所结合的表位结合的抗体能够通过使用人cd3的氨基酸序列的第1位-第27位氨基酸序列进行抗体结合测定来获得。
[0465]
作为本发明的抗cd3双特异性抗体,具体而言,可列举包括上述cd3结合结构域的双特异性抗体。
[0466]
本发明的cd3结合结构域也可以用于制造抑制诱导细胞因子产生的能力的抗cd3双特异性抗体的目的、抑制抗cd3双特异性抗体诱导产生过量细胞因子的目的。
[0467]
本发明的双特异性抗体或该双特异性抗体片段也包括具有效应子活性的双特异性抗体或该双特异性抗体片段。
[0468]
效应子活性是指由抗体的fc区介导引起的抗体依赖性的细胞毒性活性,可列举例
如:adcc活性、补体依赖性细胞毒性活性(complement-dependent cytotoxicity activity;cdc活性)、巨噬细胞及树突状细胞等吞噬细胞产生的抗体依赖性细胞介导吞噬作用(antibody-dependent cellular phagocytosis activity;adcp活性)及调理(opsonin)效应等。
[0469]
在本发明中,adcc活性及cdc活性能够使用公知的测定方法[cancer immunol.immunother.,36,373(1993)]来测定。
[0470]
adcc活性是指通过与靶细胞上的抗原结合后的抗体经由抗体的fc区与免疫细胞的fc受体结合来激活免疫细胞(自然杀伤细胞等),以杀伤靶细胞的活性。
[0471]
fc受体(fcr)是与抗体的fc区结合的受体,通过抗体的结合引发各种效应子活性。各fcr对应于抗体的亚类,igg、ige、iga、igm分别与fcγr、fcεr、fcαr、fcμr特异性结合。并且,fcγr存在fcγri(cd64)、fcγrii(cd32)及fcγriii(cd16)的亚型,这些亚型中存在fcγria、fcγrib、fcγric、fcγriia、fcγriib、fcγriic、fcγriiia及fcγriiib的同种型。以上不同的fcγr存在于不同的细胞上[annu.rev.immunol.9:457-492(1991)]。在人类中,fcγriiib在中性粒细胞中特异性表达,fcγriiia在单核细胞、自然杀伤细胞(nk细胞)、巨噬细胞及部分t细胞中表达。通过抗体与fcγriiia结合,引发nk细胞依赖性adcc活性。
[0472]
cdc活性是指,与靶细胞上的抗原结合后的抗体激活由血液中的补体相关蛋白质组构成的一系列级联(补体激活途径),从而杀伤靶细胞的活性。另外,通过补体激活所产生的蛋白质片段引发免疫细胞的迁移及激活。c1q首先与fc区结合,接着与两个作为丝氨酸蛋白酶的c1r及c1s结合,从而形成c1复合物,而引发cdc活性的级联。
[0473]
本发明的双特异性抗体或该双特异性抗体片段对于抗原表达细胞的cdc活性或adcc活性能够通过公知的测定方法[cancer immunol.immunother.,36,373(1993)]来评价。
[0474]
作为本发明的双特异性抗体的效应子活性的控制方法,已知有下述方法:控制与n-乙酰氨基葡萄糖(glcnac)以α-1,6结合的岩藻糖(也称为核心岩藻糖)的量,其中,上述n-乙酰氨基葡萄糖存在于与抗体的fc区(由ch2及ch3区构成的恒定区)中的第297位天冬酰胺(asn)结合的n-结合型复合型糖链的还原端(国际公开第2005/035586号、国际公开第2002/31140号及国际公开第00/61739号);及通过抗体的fc区的氨基酸残基的改型进行控制的方法(国际公开第00/42072号)等。
[0475]
通过控制与双特异性抗体结合的核心岩藻糖的量,能够增加或降低抗体的adcc活性。例如,作为降低与抗体的fc结合的n-结合复合型糖链上结合的核心岩藻糖的含量的方法,通过使用α1,6-岩藻糖转移酶基因缺失的宿主细胞表达双特异性抗体,能够获得具有高adcc的双特异性抗体。另一方面,作为增加与双特异性抗体的fc结合的n-结合复合型糖链上所结合的岩藻糖的含量,通过使用导入α1,6-岩藻糖转移酶基因后的宿主细胞表达抗体,能够获得具有低adcc活性的双特异性抗体。
[0476]
另外,通过对双特异性抗体的fc区的氨基酸残基进行改型,能够增加或降低adcc活性及cdc活性。例如,通过使用美国专利申请公开第2007/0148165号说明书中所述的fc区的氨基酸序列,能够增加双特异性抗体的cdc活性。另外,通过进行美国专利第6,737,056号说明书、美国专利第7,297,775号说明书或美国专利第7,317,091号说明书等中所述的氨基
酸改型,也能够增加或降低adcc活性或cdc活性。
[0477]
并且,通过将上述方法组合,也可以获得效应子活性得到控制的双特异性抗体。
[0478]
本发明的双特异性抗体的稳定性能够通过测定纯化过程及在一定条件下保存后的样本中形成的凝聚体(寡聚物)量来进行评价。即,相同条件下凝聚体量降低时,评价抗体的稳定性提高。凝聚体量能够通过使用包括凝胶过滤色谱在内的合适的色谱法将凝聚的抗体和未凝聚的抗体分离来测定。
[0479]
本发明的双特异性抗体的生产性能够通过测定由产抗体细胞在培养液中所产生的抗体量来进行评价。更具体而言,可以通过利用hplc法及elisa法等合适的方法测定从培养液中除去产生细胞后得到的培养上清中所含的抗体的量来进行评价。
[0480]
本发明的双特异性抗体或该双特异性抗体片段包括通过化学或基因工程向本发明的双特异性抗体或该双特异性抗体片段上结合放射性同位素、低分子药剂、高分子药剂、蛋白质或抗体药物等而得到的抗体的衍生物。
[0481]
本发明中的抗体的衍生物能够通过利用化学方法[抗体工学入门,地人书馆(1994)]在本发明的双特异性抗体或该双特异性抗体片段的h链或l链的n端侧或者c端侧、该抗体或其抗体片段中的合适的取代基或者侧链、以及该抗体或其抗体片段中的糖链等上结合放射性同位素、低分子药剂、高分子药剂、免疫刺激剂、蛋白质或抗体药物等来制造。
[0482]
另外,本发明中的抗体的衍生物能够通过基因工程方法制造,即,将编码本发明的双特异性抗体或该双特异性抗体片段的dna与编码所需的蛋白质或抗体药物的dna连接,并插入表达载体,将该表达载体导入合适的宿主细胞并使其表达。
[0483]
作为放射性同位素,可列举例如:
111
in、
131
i、
125
i、
90
y、
64
cu、
99
tc、
77
lu或
211
at等。放射性同位素能够通过氯胺t法等与抗体直接结合。另外,还可以将螯合放射性同位素的物质与抗体结合。作为螯合剂,可列举例如1-异硫氰酸基苄基-3-甲基二亚乙基三胺五乙酸(mx-dtpa)等。
[0484]
作为低分子药剂,可列举例如:烷基化剂、亚硝基脲剂、代谢拮抗剂、抗生素、植物生物碱、拓扑异构酶抑制剂、激素疗法剂、激素拮抗剂、芳香酶抑制剂、p糖蛋白抑制剂、铂络合物衍生物、m期抑制剂或者激酶抑制剂等抗癌剂[临床肿瘤学,癌症和化学疗法社(1996)]、氢化可的松或者泼尼松等类固醇剂、阿司匹林或者吲哚美辛等非类固醇剂、硫代苹果酸金或者青霉胺等免疫调节剂、环磷酰胺或者硫唑嘌呤等免疫抑制剂或马来酸氯苯那敏或者氯马斯汀之类的抗组胺剂等消炎剂[炎症及消炎剂疗法,医齿药出版株式会社(1982)]等。
[0485]
作为抗癌剂,可列举例如:氨磷汀(依硫磷酸,ethyol)、顺铂、达卡巴嗪(dtic)、更生霉素、双氯乙基甲胺(氮芥)、链脲菌素、环磷酰胺、异环磷酰胺、卡莫司汀(bcnu)、罗莫司汀(ccnu)、多柔比星(阿霉素)、表柔比星、吉西他滨(gemzer)、柔红霉素、丙卡巴肼、丝裂霉素、阿糖胞苷、依托泊苷、5-氟尿嘧啶、氟尿嘧啶、长春碱、长春新碱、博来霉素、道诺霉素、倍洛霉素、雌莫司汀、紫杉醇(taxol)、多西紫杉醇(taxotere)、阿地白介素、天冬酰胺酶、白消安、卡铂、奥沙利铂、奈达铂、克拉屈滨、喜树碱、10-羟基-7-乙基-喜树碱(sn38)、氟尿苷、氟达拉滨、羟基脲、伊达比星、美司钠、伊立替康(cpt-11)、盐酸拓扑替康、米托蒽醌、拓扑替康、亮丙瑞林、甲地孕酮、美法仑、巯嘌呤、羟基脲、普利霉素、米托坦、培门冬酶(pegasparagase)、喷司他丁、哌泊溴烷、链脲菌素、他莫昔芬、戈舍瑞林、亮丙瑞林、氟他胺、
替尼泊苷、睾酮、硫鸟嘌呤、噻替帕、尿嘧啶氮芥、长春瑞滨、苯丁酸氮芥、氢化可的松、泼尼松龙、甲基泼尼松龙、长春地辛、尼莫司汀、司莫司汀、卡培他滨、雷替曲塞、阿扎胞苷、uft、奥沙利铂、吉非替尼(易瑞沙)、伊马替尼(sti571)、厄洛替尼、fms样酪氨酸激酶3(fms-like tyrosine kinase 3、flt3)抑制剂、血管内皮生长因子受体(vascular endothelial growth facotr receptor、vegfr)抑制剂、成纤维生长因子受体(fibroblast growth factor receptor、fgfr)抑制剂、埃罗替尼等表皮生长因子受体(epidermal growth factor receptor、egfr)抑制剂、根次壳菌素、17-烯丙基氨基-17-去甲氧基格尔德霉素、雷帕霉素、安吖啶、全反式维甲酸、沙利度胺、来那度胺、阿那曲唑、法屈唑、来曲唑、依西美坦、硫代苹果酸金、d-青霉胺、布西拉明、硫唑嘌呤、咪唑立宾、环孢素、雷帕霉素、氢化可的松、贝沙罗汀(蓓萨罗丁)、他莫昔芬、地塞米松、孕激素类、雌激素类、阿那曲唑(瑞宁得)、柳培林、阿司匹林、吲哚美辛、塞来昔布、硫唑嘌呤、青霉胺、硫代苹果酸金、马来酸氯苯那敏、氯苯那敏、氯马斯汀、维甲酸、贝沙罗汀、砷、硼替佐米、别嘌醇、加利车霉素、替伊莫单抗、蓓萨罗丁、奥佐米星、克拉霉素、亚叶酸、酮康唑、氨鲁米特、苏拉明、甲氨蝶呤或者美登素或其衍生物等。
[0486]
作为使低分子药剂与本发明的双特异性抗体或该双特异性抗体片段结合的方法,可列举例如:经由戊二醛使药剂与该抗体的氨基之间结合的方法、或经由水溶性碳二亚胺使药剂的氨基与该抗体的羧基结合的方法等。
[0487]
作为高分子药剂,可列举:聚乙二醇(peg)、白蛋白、葡聚糖、聚氧乙烯、苯乙烯马来酸共聚物、聚乙烯吡咯烷酮、吡喃共聚物、或羟基丙基甲基丙烯酰胺等。通过将这些高分子化合物结合于本发明的双特异性抗体或抗体片段,有望获得如下等效果:(1)提高对于化学、物理或者生物的各种因子的稳定性;(2)显著延长血液半衰期;或(3)使免疫原性消失或者抑制抗体产生[生物偶联物药品,广川书店(1993)]。
[0488]
例如,作为使peg与本发明的双特异性抗体结合的方法,可列举使其与peg化修饰试剂反应的方法等[生物偶联物药品,广川书店(1993)]。作为peg化修饰试剂,可列举:将对赖氨酸的ε-氨基的修饰剂(日本特开昭61-178926号公报)、对天冬氨酸及谷氨酸的羧基的修饰剂(日本特开昭56-23587号公报)、或对精氨酸的胍基的修饰剂(日本特开平2-117920号公报)等。
[0489]
免疫刺激剂可以为已知作为免疫佐剂的天然物,作为具体示例,增强免疫的药剂可列举:β(1
→
3)葡聚糖(例如,香菇多糖或裂皱菌多糖)或α半乳糖神经酰胺(krn7000)等。
[0490]
作为蛋白质,可列举例如:激活nk细胞、巨噬细胞或中性粒细胞等免疫活性细胞的细胞因子或者生长因子或毒素蛋白质等。
[0491]
作为细胞因子或生长因子,可列举例如:干扰素(以下记作ifn)-α、ifn-β、ifn-γ、白细胞介素(以下记作il)-2、il-5、il-6、il-10、il-12、il-15、il-18、il-21、il-23、肿瘤坏死因子(tumor necrosis factor;tnf)-α、tnf-β、粒细胞集落刺激因子(g-csf)、粒细胞/巨噬细胞集落刺激因子(gm-csf)或巨噬细胞集落刺激因子(m-csf)等。
[0492]
作为毒素蛋白质,可列举例如:赖氨酸、白喉毒素或ontak等,也包括向蛋白质导入变异以调节毒性的蛋白质毒素。
[0493]
在编码本发明的双特异性抗体或抗体片段的cdna上连接编码蛋白质的cdna,构建编码融合抗体的dna,将该dna插入用于原核生物或真核生物的表达载体,将该表达载体导
入原核生物或真核生物使其表达,从而能够制造与蛋白质或抗体药物的融合抗体。
[0494]
在将上述抗体的衍生物用作检测方法、定量方法、检测用试剂、定量用试剂或诊断药物的情况下,作为与本发明的双特异性抗体或其抗体片段结合的药剂,可列举通常免疫学检测方法或测定用方法中使用的标记物。作为标记物,可列举例如:碱性磷酸酶、过氧化物酶或者萤光素酶等酶、吖啶酯或者洛芬碱等发光物质、或异硫氰酸荧光素(fitc)或者四甲基罗丹明异硫氰酸酯(ritc)、alexa(注册商标)fluor 488、r-藻红素(r-phycoerythrin)(r-pe)等荧光物质等。
[0495]
本发明中包括具有cdc活性或adcc活性等细胞毒性活性的双特异性抗体及该双特异性抗体片段。本发明的双特异性抗体或该双特异性抗体片段对于抗原表达细胞的cdc活性或adcc活性能够通过公知的测定方法[cancer immunol.immunother.,36,373(1993)]来评价。
[0496]
另外,本发明还涉及包括特异性识别并结合cd3及疾病相关抗原的双特异性抗体或者该双特异性抗体片段的组合物、或含有该双特异性抗体或者该双特异性抗体片段作为有效成分的、cd3及疾病相关抗原中的至少一者相关的疾病、优选疾病相关抗原的表达细胞所参与的疾病的治疗药物。
[0497]
作为cd3及疾病相关抗原中的至少一者相关的疾病,只要为cd3及疾病相关抗原中的至少一者相关的疾病,则可以为任意疾病,可列举例如恶性肿瘤及癌症等。
[0498]
含有本发明的双特异性抗体或该双特异性抗体片段、或其衍生物的治疗药物可以仅包含作为有效成分的该双特异性抗体或者该双特异性抗体片段、或其衍生物,但通常优选作为与药学上可接受的一种以上载体一起混合后,通过制剂学技术领域中公知的任意的方法制成药物制剂来提供。
[0499]
给药途径优选治疗时最有效的途径,可列举例如:口服给药、或口腔内给药、气管内给药、直肠内给药、皮下给药、肌肉内给药或静脉内给药等非口服给药。其中,优选静脉内给药。
[0500]
作为给药形式,可列举例如:喷雾剂、胶囊剂、片剂、散剂、颗粒剂、糖浆剂、乳剂、栓剂、注射剂、软膏或贴剂等。
[0501]
给药量或给药次数根据目标治疗效果、给药方法、治疗时间、年龄及体重等不同,通常成人每天10μg/kg~10mg/kg。
[0502]
并且,本发明还涉及含有本发明的双特异性抗体或该双特异性抗体片段的、cd3及疾病相关抗原中的至少一者的免疫学检测试剂或者测定试剂、或cd3及疾病相关抗原中的至少一者相关的疾病、优选疾病相关抗原的表达细胞所参与的疾病的诊断药物。另外,本发明还涉及使用本发明的双特异性抗体或该双特异性抗体片段的、cd3及疾病相关抗原中的至少一者的免疫学检测方法或者测定方法、cd3及疾病相关抗原中的至少一者相关的疾病、优选疾病相关抗原的表达细胞所参与的疾病的治疗方法、或cd3及疾病相关抗原中的至少一者相关的疾病、优选疾病相关抗原的表达细胞所参与的疾病的诊断方法。
[0503]
在本发明中,作为cd3及疾病相关抗原中的至少一者的量的检测或测定方法,可列举任意公知的方法。可列举例如免疫学检测或测定方法等。
[0504]
免疫学检测或测定方法是使用施加标记后的抗原或抗体来检测或测定抗体量或抗原量的方法。作为免疫学检测或测定方法,可列举例如:放射免疫测定法(ria)、酶免疫测
harbor laboratory press(1989)及current protocols in molecular biology,john wiley&sons(1987-1997)等中记载的方法等,通过例如以下的方法,使编码该cd3或疾病相关抗原的dna在宿主细胞中表达,由此能够制造本发明中使用的cd3或疾病相关抗原。
[0517]
通过将包括编码cd3或疾病相关抗原的部分的全长cdna插入合适的表达载体的启动子的下游来制作重组载体。除上述全长cdna之外,也可以使用基于全长cdna所制备的、包括编码多肽的部分的合适长度的dna片段。接着,将得到的该重组载体导入适合该表达载体的宿主细胞,由此能够获得产生cd3或疾病相关抗原的转化体。
[0518]
作为表达载体,只要其为可以在所使用的宿主细胞中进行自主复制或整合入染色体中、并且在能够转录编码cd3或疾病相关抗原的dna的位置处含有合适的启动子的表达载体,则均可使用。
[0519]
作为宿主细胞,只要其为例如大肠杆菌等属于埃希氏菌属等的微生物、酵母、昆虫细胞或动物细胞等能够表达目标基因的细胞,则均可以使用。
[0520]
在使用大肠杆菌等原核生物作为宿主细胞的情况下,重组载体优选为可以在原核生物中自主复制,同时包括启动子、核糖体结合序列、编码cd3或疾病相关抗原的部分的dna、以及转录终止序列的载体。另外,该重组载体中转录终止序列不是必须的,但优选在结构基因的正下方配置转录终止序列。并且,该重组载体还可以包含控制启动子的基因。
[0521]
该重组载体优选使用将作为核糖体结合序列的shine-dalgarno序列与起始密码子之间调节为合适的距离(例如,6~18个碱基)的质粒。
[0522]
另外,作为编码该cd3或疾病相关抗原的dna的碱基序列,能够进行碱基取代以形成最适合宿主内表达的密码子,从而可以提高目标cd3或疾病相关抗原的生产率。
[0523]
作为表达载体,只要是能够在所使用的宿主细胞中发挥功能的载体,则均能使用,可列举例如:pbtrp2、pbtac1、pbtac2(以上由罗氏诊断产品公司制)、pkk233-2(pharmacia公司制)、pse280(invitrogen公司制)、pgemex-1(promega公司制)、pqe-8(qiagen公司制)、pkyp10(日本特开昭58-110600号公报)、pkyp200[agricultural biological chemistry,48,669(1984)]、plsa1[agric.biol.chem.,53,277(1989)]、pgel1[proc.natl.acad.sci.usa,82,4306(1985)]、pbluescript ii sk(-)(stratagene公司制)、ptrs30[由大肠杆菌jm109/ptrs30(ferm bp-5407)制备]、ptrs32[由大肠杆菌jm109/ptrs32(ferm bp-5408)制备]、pgha2[由大肠杆菌igha2(ferm bp-400)制备、日本特开昭60-221091号公报]、pgka2[由大肠杆菌igka2(ferm bp-6798)制备、日本特开昭60-221091号公报]、pterm2(美国专利第4,686,191号说明书、美国专利第4,939,094号说明书、美国专利第5,160,735号说明书)、psupex、pub110、ptp5、pc194、peg400[j.bacteriol.,172,2392(1990)]、pgex(pharmacia公司制)、pet系统(novagen公司制)或pme18sfl3(东洋纺公司制)等。
[0524]
作为启动子,只要能够在所使用的宿主细胞中发挥功能,则可以为任意启动子。可列举例如:trp启动子(ptrp)、lac启动子、pl启动子、pr启动子或t7启动子等来自大肠杆菌或噬菌体等的启动子。另外,还可列举例如:将两个ptrp串联的串联启动子;tac启动子、lact7启动子、或let i启动子等人为设计改型的启动子等。
[0525]
作为宿主细胞,可列举例如:大肠杆菌xl1-blue、大肠杆菌xl2-blue、大肠杆菌dh1、大肠杆菌mc1000、大肠杆菌ky3276、大肠杆菌w1485、大肠杆菌jm109、大肠杆菌hb101、
edition,cold spring harbor laboratory press(1989)]。作为cd3或疾病相关抗原的生产方法,可列举例如:在宿主胞内生产的方法、在宿主细胞外分泌的方法或在宿主细胞外膜上生产的方法,通过改变所使用的宿主细胞及所生产的cd3或疾病相关抗原的结构,能够选择合适的方法。
[0536]
例如,在编码胞外区的氨基酸序列的dna上连接编码抗体的fc区的dna、编码谷胱甘肽s-转移酶(gst)的dna、或者编码flag标签的dna或编码组氨酸(histidine)标签的dna等,制作dna并表达纯化,由此能够制作抗原融合蛋白质。具体而言,可列举例如:使cd3或疾病相关抗原的胞外区结合于人igg的fc区而成的fc融合蛋白质、cd3或疾病相关抗原的胞外区与谷胱甘肽s-转移酶(gst)的融合蛋白质。
[0537]
在宿主胞内或宿主细胞外膜上生产cd3或疾病相关抗原的情况下,通过使用paulson(鲍尔森)等人提出的方法[j.biol.chem.,264,17619(1989)]、low等人提出的方法[proc.natl.acad.sci.,usa,86,8227(1989),genes develop.,4,1288(1990)]、日本特开平05-336963号公报或国际公开第94/23021号等中所述的方法,能够使cd3或疾病相关抗原积极分泌至宿主细胞外。另外,还可以利用使用二氢叶酸还原酶基因等的基因扩增系统(日本特开平2-227075号公报)提升cd3或疾病相关抗原的生产量。
[0538]
所生产的cd3或疾病相关抗原能够例如如下操作进行分离、纯化。
[0539]
在cd3或疾病相关抗原以溶解状态在细胞内表达的情况下,培养结束后,通过离心分离回收细胞,将细胞悬浮于水性缓冲液后,使用超声波破碎机、弗氏压碎器、manton-gaulin高压均质机或dyno-mill等破碎细胞,得到无细胞提取液。可以通过普通的蛋白质分离纯化法单独或组合使用从该无细胞提取液离心分离得到的上清中获得纯化蛋白质,上述分离纯化法包括溶剂提取法、利用硫安等的盐析法、脱盐法、利用有机溶剂的沉淀法、使用二乙基氨基乙基(deae)-琼脂糖凝胶、diaion hpa-75(三菱化学公司制)等树脂的阴离子交换色谱法、使用s-sepharose ff(pharmacia公司制)等树脂的阳离子交换色谱法、使用丁基琼脂糖凝胶、苯基琼脂糖凝胶等树脂的疏水性色谱法、使用分子筛的凝胶过滤法、亲和色谱法、色谱聚焦法、或等电聚焦电泳等电泳法等方法。
[0540]
在cd3或疾病相关抗原在细胞内形成不溶体后表达的情况下,与上述相同,回收细胞后,破碎并进行离心分离,由此作为沉淀组分回收该cd3或疾病相关抗原的不溶体。将回收后的该cd3或疾病相关抗原的不溶体用蛋白质变性剂增溶。通过对该增溶液稀释或透析,使cd3或疾病相关抗原恢复正常的立体结构后,可以通过与上述相同的分离纯化法获得多肽的纯化蛋白质。
[0541]
在cd3或疾病相关抗原或其糖修饰体等衍生物分泌至细胞外的情况下,能够在培养上清中回收该cd3或疾病相关抗原、或其糖修饰体等衍生物。通过与上述相同地利用离心分离等方法处理该培养上清,获得可溶性组分,并可以通过与上述相同的分离纯化法从该可溶性组分中获得纯化蛋白质。
[0542]
另外,本发明中使用的cd3或疾病相关抗原也可以通过fmoc法或tboc法等化学合成法来制造。具体而言,能够利用例如advanced chemtech公司、perkinelmer公司、pharmacia公司、protein technology instrument公司、synthecell-vega公司、perceptive公司或岛津制作所公司等制造的肽合成机进行化学合成。
[0543]
(2)产抗体细胞的制备工程
[0544]
利用(1)中得到的抗原免疫小鼠、大鼠、仓鼠、兔子、牛或羊驼等动物,采集该动物的脾、淋巴结或外周血中的产抗体细胞。另外,作为动物,可列举例如富塚等人提出的文献[tomizuka.et al.,proc natl acad sci usa.,97,722,(2000)]中所述的产生人源抗体的转基因小鼠、为了提高免疫原性而条件性敲除cd3或疾病相关抗原的小鼠等作为被免疫动物。
[0545]
通过与完全弗氏佐剂或氢氧化铝凝胶和百日咳疫苗等合适的佐剂一同投予抗原来进行免疫。小鼠免疫时的免疫原给药法可以为皮下注射、腹腔内注射、静脉内注射、皮内注射、肌肉内注射或足底注射等中的任意一种,优选腹腔内注射、足底注射或静脉内注射。在抗原为部分肽的情况下,制作与bsa(牛血清白蛋白)或klh(keyhole limpet hemocyanin)等载体蛋白的偶联物,并将其用作免疫原。
[0546]
抗原在第一次给药后每隔1~2周给药5~10次。每次给药后第3~7天从眼底静脉丛采血,使用酶免疫测定法[antibodies-a laboratory manual,cold spring harbor laboratory(1988)]等测定其血清的抗体效价。如果将上述血清对于用于免疫的抗原显示出充分抗体效价的动物用作用于融合的产抗体细胞的供应源,则能够提高之后的操作的效果。
[0547]
抗原最后给药后第3~7天,从经免疫的动物中摘取脾等包含产抗体细胞的组织,从而采集产抗体细胞。产抗体细胞是浆细胞及作为其祖细胞的淋巴细胞,可以从个体的任意部位获得,通常能够从脾、淋巴结、骨髄、扁桃体、外周血或以上适当的组合等中获得,最常用的是脾细胞。在使用脾细胞的情况下,将脾切碎松解之后,离心分离,并除去红细胞,从而获得用于融合的产抗体细胞。
[0548]
(3)骨髓瘤的制备工序
[0549]
骨髓瘤可以使用来自小鼠、大鼠、豚鼠、仓鼠、兔子或人等哺乳动物的不具有自身产抗体能力的细胞,通常使用从小鼠得到的株化细胞,例如,8-氮鸟嘌呤耐药性小鼠(来自balb/c)骨髓瘤细胞株p3-x63ag8-u1(p3-u1)[current topics in microbiology and immunology,18,1(1978)]、p3-ns1/1-ag41(ns-1)[european j.immunology,6,511(1976)],sp2/0-ag14(sp-2)[nature,276,269(1978)]、p3-x63-ag8653(653)[j.immunology,123,1548(1979)]或p3-x63-ag8(x63)[nature,256,495(1975)]等。该细胞株在例如8-氮鸟嘌呤培养基[加入有谷氨酰胺、2-巯基乙醇、庆大霉素、fcs及8-氮鸟嘌呤的rpmi-1640培养基]、iscove’s改良杜氏培养基(iscove’s modified dulbecco’s medium;以下称为“imdm”)、或dulbecco改良eagle培养基(dulbecco’s modified eagle medium;以下称为“dmem”)等合适的培养基中传代培养。细胞融合3~4天前,将上述细胞株在普通培养基(例如,含10%fcs的dmem培养基)中传代培养,进行融合当天确保2
×
107个以上的细胞数。
[0550]
(4)细胞融合
[0551]
将(2)中得到的用于融合的产抗体细胞和(3)中得到的骨髓瘤细胞用最低基本培养基(minimum essential medium)(mem)培养基或pbs(磷酸二钠1.83g,磷酸一钾0.21g,食盐7.65g,蒸馏水1l,ph7.2)充分清洗,以用于融合的产抗体细胞:骨髓瘤细胞=5:1~10:1的方式进行混合,离心分离后,除去上清。将沉淀后的细胞团充分松解后,在37℃下搅拌,同时加入聚乙二醇-1000(peg-1000)、mem培养基及二甲基亚砜的混合液。并且每1~2分加入
数次mem培养基1~2ml,然后加入mem培养基,使总量达到50ml。离心分离后,除去上清,将沉淀后的细胞团慢慢松解之后,将细胞缓慢悬浮在hat培养基[加入有次黄嘌呤、胸苷及氨基蝶呤的普通培养基]中。将该悬浮液在5%co2培养箱中于37℃下培养7~14天。
[0552]
另外,也可以通过以下的方法进行细胞融合。将脾细胞和骨髓瘤细胞用无血清培养基(例如dmem)或磷酸缓冲生理食盐液(以下称为“磷酸缓冲液”)充分清洗,以脾细胞和骨髓瘤细胞的细胞数的比达到5:1~10:1左右的方式混合,并离心分离。除去上清,将沉淀后的细胞团充分松解之后,进行搅拌,同时滴加包含1ml 50%(w/v)聚乙二醇(分子量1000~4000)的无血清培养基。然后,缓慢加入10ml无血清培养基,随后进行离心分离。再次舍弃上清,将沉淀的细胞悬浮于包含适量的次黄嘌呤-氨基蝶呤-胸苷(hat)液及人白细胞介素-2(il-2)的普通培养基(以下称为hat培养基)中,并分注于培养板(以下称为平板)的各孔中,在5%二氧化碳存在下于37℃培养2周左右。期间适当补充hat培养基。
[0553]
(5)杂交瘤群的选择
[0554]
在用于融合的骨髓瘤细胞为8-氮鸟嘌呤耐药性株的情况下,即为次黄嘌呤-鸟嘌呤-磷酸核糖转移酶(hgprt)缺失株的情况下,未融合的骨髓瘤细胞及骨髓瘤细细胞彼此的融合细胞不能在hat培养基中存活。而产抗体细胞彼此的融合细胞及产抗体细胞和骨髓瘤细胞的杂交瘤则能够在hat培养基中存活,产抗体细胞彼此的融合细胞不久将达到寿命。因此,通过在hat培养基中继续培养,仅产抗体细胞和骨髓瘤细胞的杂交瘤存活,最终能够获得杂交瘤。
[0555]
针对发育成集落状的杂交瘤,将培养基更换为从hat培养基中除去氨基蝶呤后的培养基(以下称为ht培养基)。然后,采集培养上清的一部分,使用后述的抗体效价测定法,能够选择产生抗体的杂交瘤。作为抗体效价的测定方法,可列举例如:放射性同位素免疫定量法(ria法)、固相酶免疫定量法(elisa法)、荧光抗体法及被动血细胞凝集反应法等各种公知技术,从检测敏感性、快速性、准确性及操作自动的可能性等观点出发,优选ria法或elisa法。
[0556]
将通过测定抗体效价判断会产生所需抗体的杂交瘤转移至另外的平板进行克隆。作为其克隆方法,可列举例如:以平板的1个孔中包含1个细胞的方式进行稀释并培养的有限稀释法、在软琼脂培养基中培养后回收集落的软琼脂法、通过显微操纵器分离1个细胞的方法、通过细胞分选仪分离1个细胞的方法等。
[0557]
针对已确认抗体效价的孔,重复利用例如有限稀释法进行2~4次克隆,使其稳定后,将已确认抗体效价的细胞株选择作为产生针对cd3或疾病相关抗原的单克隆抗体的杂交瘤株。
[0558]
(6)单克隆抗体的制备
[0559]
向经姥鲛烷处理[腹腔内给药0.5ml 2,6,10,14-四甲基十五烷(pristane),并饲养2周]的8~10周龄小鼠或裸鼠腹腔内注射(5)中得到的产单克隆抗体杂交瘤。在10~21天时杂交瘤腹水癌化。从该小鼠中采集腹水,离心分离后除去固体成分,然后用40~50%硫酸铵盐析,通过辛酸沉淀法、deae-琼脂糖凝胶柱、蛋白质a柱或凝胶过滤柱进行纯化,收集igg或igm组分作为纯化单克隆抗体。另外,在相同品系的小鼠(例如,balb/c)或者nu/nu小鼠、大鼠、豚鼠、仓鼠或兔子等的腹腔内使该杂交瘤增殖,由此能够获得包含大量与cd3或疾病相关抗原结合的单克隆抗体的腹水。
[0560]
将(5)中得到的产单克隆抗体杂交瘤用添加有10%fbs的rpmi1640培养基等培养之后,通过离心分离除去上清,悬浮于git培养基或添加有5%daigo gf21的hybridoma sfm培养基等,通过摇瓶培养、旋转培养或袋培养等培养3~7天。将得到的细胞悬浮液离心分离,通过蛋白质a柱或蛋白质g柱对得到的上清进行纯化,收集igg组分,由此也能获得纯化单克隆抗体。作为简单的纯化方法,也可以利用市售的单克隆抗体纯化试剂盒(例如,mabtrap gii试剂盒;amersham pharmacia biotech公司制)等。
[0561]
使用亚类分型试剂盒通过酶免疫测定法来确定抗体的亚类。蛋白质量可以通过lowry法及由280nm处的吸光度[1.4(od
280
)=免疫球蛋白1mg/ml]计算的方法来定量。
[0562]
(7)单克隆抗体与cd3或疾病相关抗原的结合的测定
[0563]
本发明的抗cd3双特异性抗体包括对于cd3的亲和力减弱的cd3结合结构域,该cd3结合结构域能够在上述结合测定中使用作为对照的抗cd3单克隆抗体sp34或km14来建立。
[0564]
例如,从抗cd3单克隆抗体库中筛选与抗cd3单克隆抗体sp34或km14相比亲和力降低10%以上的抗体,由此能够建立所需的cd3结合结构域。另外,还可以基于抗cd3单克隆抗体sp34或km14的cdr或vh/vl的氨基酸序列,制作向cdr或fr区域的氨基酸序列导入随机变异的抗体库,并从该库中筛选与抗cd3单克隆抗体sp34或km14相比亲和力降低10%以上的抗体,由此建立所需的cd3结合结构域。
[0565]
单克隆抗体对于cd3或疾病相关抗原的结合活性能够通过琼脂双向免疫扩散(ouchterlony)法、elisa法、ria法、流式细胞仪法(fcm)或表面等离子共振(spr)法等结合测定系统来测定。
[0566]
琼脂双向免疫扩散法虽然很简便,但当抗体浓度较低时需要浓缩操作。而在使用elisa法或ria法的情况下,使培养上清直接与抗原吸附固相进行反应,并使用与各种免疫球蛋白同种型、亚类对应的抗体作为二抗,由此可以鉴定抗体的同种型、亚类,同时测定抗体的结合活性。
[0567]
作为流程的具体示例,使纯化或部分纯化后的重组cd3或疾病相关抗原吸附于elisa用96孔板等固相表面,再将未吸附抗原的固相表面通过例如牛血清白蛋白(bsa)等与抗原无关的蛋白质进行封闭。将elisa平板用包含磷酸盐缓冲液(phosphate buffer saline、pbs)及0.05%tween20的pbs(tween-pbs)等清洗后,使经连续稀释后的第一抗体(例如小鼠血清、培养上清等)进行反应,使抗体与固定于平板的抗原结合。接着,分注经生物素、酶(辣根过氧化物酶,horse radish peroxidase;hrp,碱性磷酸酶,alkaline phosphatase;alp等)、化学发光物质或辐射化合物等标记的抗免疫球蛋白抗体作为第二抗体,并使与平板结合后的第一抗体与第二抗体进行反应。用tween-pbs充分清洗之后,进行与第二抗体的标记物质对应的反应,选择与靶抗原特异性反应的单克隆抗体。
[0568]
在fcm法中,能够测定抗体对于抗原表达细胞的结合活性[cancer immunol.immunother.,36,373(1993)]。抗体与在细胞膜上表达的膜蛋白抗原结合表示该抗体识别并结合天然存在的抗原的立体结构。
[0569]
作为spr法,可列举利用biacore的动力学(kinetics)分析。例如,使用biacore t100,测定抗原和受试物质之间的结合的动力学(kinetics),将其结果用设备自带的分析软件进行分析。作为流程的具体示例,将抗小鼠igg抗体通过胺偶联法固定于传感器芯片cm5之后,流通杂交瘤培养上清或纯化单克隆抗体等受试物质,使其适量结合,再流通浓度
已知的多种浓度的抗原,从而测定结合及解离。接着,使用设备自带的软件,利用1:1结合模型对得到的数据进行动力学(kinetics)分析,获得各种参数。或者,通过例如胺偶联法将cd3或疾病相关抗原固定于传感器芯片上之后,流通浓度已知的多种浓度的纯化单克隆抗体,从而测定结合及解离。使用设备自带的软件,通过1:1结合模型或二价结合模型对得到的数据进行动力学(kinetics)分析,获得各种参数。
[0570]
另外,在本发明中,通过在上述结合测定系统中共存受试抗体并使其进行反应,能够选择与针对cd3或疾病相关抗原的抗体竞争地与cd3或疾病相关抗原结合的抗体。即,通过筛选加入了受试抗体后与抗原的结合被抑制的抗体,能够得到与上述所获得的抗体竞争地和cd3或疾病相关抗原结合的抗体。
[0571]
(8)针对cd3或疾病相关抗原的单克隆抗体的表位的鉴定
[0572]
在本发明中,能够如下鉴定抗体识别并结合的表位。
[0573]
例如,制作抗原的部分缺失体、物种间不同的氨基酸残基经改型后的变异体、或特定结构域经改型的变异体,如果抗体对于该缺失体或变异体的反应性降低,则表明缺失位点或氨基酸改型位点为该抗体的表位。这样的抗原的部分缺失体及变异体可以使用例如大肠杆菌、酵母、植物细胞或哺乳动物细胞等合适的宿主细胞作为分泌蛋白质获得,也可以使其在宿主细胞的细胞膜上表达而作为抗原表达细胞制备。在膜型抗原的情况下,为了在保持抗原的立体结构下进行表达,优选在宿主细胞的膜上表达。另外,也可以制作模仿抗原的一级结构或立体结构的合成肽,从而确认抗体的反应性。作为合成肽,可列举使用公知的肽合成技术来制作其分子的各种部分肽的方法等。
[0574]
例如,针对人及小鼠的cd3或疾病相关抗原的胞外区,制作构成各区的结构域适当组合而成的嵌合蛋白质,确认抗体对于该蛋白质的反应性,由此能够鉴定抗体的表位。然后,使用本领域技术人员熟知的寡聚肽合成技术进一步分别合成其对应部分的寡聚肽或该肽的变异体等,确认抗体对于该肽的反应性,由此能够确定表位。作为用于获得多种寡聚肽的简便的方法,也可以利用市售的试剂盒[例如,spots试剂盒(genosys biotechnologies ltd.,制)、使用多针(multipin)合成法的一系列多针(multipin)肽合成试剂盒(chiron公司制)等]。
[0575]
鉴定通过上述结合测定系统得到的抗体的表位,制作该表位的局部合成肽、模仿该表位的立体结构的合成肽或该表位的重组体等并进行免疫,由此能够获得和与cd3或疾病相关抗原结合的抗体所结合的表位相同的表位上结合的抗体。
[0576]
例如,如果表位为膜蛋白,将制作整个胞外区或部分胞外结构域与例如flag标签、histidine标签、gst蛋白质或抗体fc区等合适的标签连接的重组融合蛋白质,并对该重组蛋白质进行免疫,由此能够更高效地制作该表位特异性的抗体。
[0577]
2.基因重组抗体的制作
[0578]
基因重组抗体的制作例在p.j.delves.,antibody production essential techniques.,1997wiley,p.shepherd and c.dean.monoclonal antibodies.,2000oxford university press及j.w.goding.,monoclonal antibodies:principles and practice.,1993academic press等中进行了简要叙述,下面将示出嵌合抗体、人源化抗体及人抗体的制作方法。另外,基因重组小鼠、大鼠、仓鼠及兔子抗体也可以通过相同的方法来制作。
[0579]
(1)从杂交瘤获取编码单克隆抗体的v区的cdna
1997)],由此来制备编码vh或vl的cdna。
[0591]
将所选择的cdna利用合适的限制性内切酶等切断后,克隆至pbluescript sk(-)(stratagene公司制)等质粒,通过常用的碱基序列分析方法等确定该cdna的碱基序列。例如,进行双脱氧法[proc.natl.acad.sci.usa,74,5463(1977)]等反应之后,使用a.l.f.dna测序仪(pharmacia公司制)等碱基序列自动分析装置等进行分析。
[0592]
根据所确定的全碱基序列分别推测vh及vl的全氨基酸序列,通过与已知的抗体的vh及vl的全氨基酸序列[sequences of proteins of immunological interest,us dept.health and human services(1991)]进行比较,确认所获得的cdna是否编码包括分泌信号序列在内的抗体的vh及vl各自的完整氨基酸序列。
[0593]
关于包括分泌信号序列的抗体的vh及vl各自的完整氨基酸序列,通过与已知的抗体的vh及vl的全氨基酸序列[sequences of proteins of immunological interest,us dept.health and human services(1991)]进行比较,能够推测分泌信号序列的长度及n端氨基酸序列,进而能够鉴定它们所属的亚群。
[0594]
另外,vh及vl的各个cdr的氨基酸序列能够通过与已知的抗体的vh及vl的氨基酸序列[sequences of proteins of immunological interest,us dept.health and human services(1991)]进行比较来推测。
[0595]
另外,针对得到的vh及vl的完整氨基酸序列,使用例如swiss-prot或pir-protein等任意数据库通过blast法[j.mol.biol.,215,403(1990)]等进行同源性检索,由此能够确认该vh及vl的完整氨基酸序列是否为新序列。
[0596]
(2)基因重组抗体表达用载体的构建
[0597]
基因重组抗体表达用载体能够通过向动物细胞用表达载体中克隆编码人抗体的ch及cl中的至少一者的dna来构建。
[0598]
作为人抗体的c区域,能够使用任意的人抗体的ch及cl,例如,能够使用人抗体的γ1亚类的ch及κ类的cl等。虽然编码人抗体的ch及cl的dna使用了cdna,但也可以使用由外显子和内含子构成的染色体dna。
[0599]
作为动物细胞用表达载体,只要为能够整合入编码人抗体的c区的基因并表达的表达载体,则可以使用任意载体,能够使用例如page107[cytotechnol.,3,133(1990)]、page103[j.biochem.,101,1307(1987)]、phsg274[gene,27,223(1984)]、pkcr[proc.natl.acad.sci.usa,78,1527(1981)]、psg1bd2-4[cytotechnol.,4,173(1990)]、或pse1uk1sed1-3[cytotechnol.,13,79(1993)]、inpep4(biogen-idec公司制)、n5kg1val(美国专利第6,001,358号说明书)、n5kg4pe r409k(参见国际公开第2006/033386号)、n5kg2载体(参见国际公开第2003/033538号)、转座子载体(国际公开第2010/143698号)等。
[0600]
作为动物细胞用表达载体的启动子与增强子,能够使用sv40的初始启动子[j.biochem.,101,1307(1987)]、莫洛尼小鼠白血病病毒ltr[biochem.biophys.res.commun.,149,960(1987)]、cmv启动子(美国专利第5,168,062号说明书)或免疫球蛋白h链的启动子[cell,41,479(1985)]与增强子[cell,33,717(1983)]等。
[0601]
表达基因重组抗体时,从载体构建的难易度、向动物细胞导入的难易度、细胞内抗体h链及l链的表达量的均衡性等观点出发,使用搭载有抗体h链及l链两个基因的载体(串联型载体)[j.immunol.methods,167,271(1994)],但也可以将分别搭载有抗体h链和l链的
每个基因的多个载体(分离型载体)组合后使用。
[0602]
作为串联型的基因重组抗体表达用载体,使用pkantex93(国际公开第97/10354号)、pee18[hybridoma,17,559(1998)]、n5kg1val(美国专利第6,001,358号说明书)、n5kg4pe r409k(参见国际公开第2006/033386号)、n5kg2载体(参见国际公开第2003/033538号)、tol2转座子载体(国际公开第2010/143698号)等。
[0603]
(3)嵌合抗体表达载体的构建
[0604]
通过在(2)中得到的基因重组抗体表达用载体中的编码人抗体的ch或cl的每个基因的上游分别克隆(1)中得到的编码非人抗体的vh或vl的cdna,能够构建嵌合抗体表达载体。
[0605]
首先,为了将编码非人抗体的vh或vl的cdna的3’末端侧与人抗体的ch或cl的5’末端侧连接,制作vh及vl的cdna,上述cdna被设计为连接部分的碱基序列编码合适的氨基酸,且形成合适的限制性内切酶识别序列。接着,将所制作的vh及vl的cdna克隆至(2)中得到的基因重组抗体表达用载体中的用于编码人抗体的ch或cl的每个基因的上游,以使其按照合适的形式表达,从而构建嵌合抗体表达载体。
[0606]
另外,通过使用两端具有合适的限制性内切酶的识别序列的合成dna,通过pcr法,分别扩增编码非人抗体的vh或vl的cdna,并将其克隆至(2)中得到的基因重组抗体表达用载体,也能够构建嵌合抗体表达载体。
[0607]
(4)编码人源化抗体的v区的cdna的制作
[0608]
编码人源化抗体的vh或vl的cdna能够如下制作。首先,分别选择供移植(1)中得到的非人抗体的vh或vl的cdr的氨基酸序列的人抗体的vh或vl的框架区域(以下记作fr)的氨基酸序列。
[0609]
作为所选择的fr的氨基酸序列,只要其为来自人抗体的氨基酸序列,则均可使用。使用例如protein data bank等数据库中登录的人抗体的fr的氨基酸序列、或人抗体的fr的各亚群的共同氨基酸序列[sequences of proteins of immunological interest,us dept.health and human services(1991)]等。为了抑制抗体的结合活性降低,选择与原始非人抗体的vh或vl的fr的氨基酸序列具有尽可能高的同源性(60%以上)的人fr的氨基酸序列。
[0610]
接着,在所选择的人抗体的vh或vl的fr的氨基酸序列上分别移植原始非人抗体的cdr的氨基酸序列,从而分别设计人源化抗体的vh或vl的氨基酸序列。基于抗体基因的碱基序列中见到的密码子的使用频率[sequences of proteins of immunological interest,us dept.health and human services(1991)],将所设计的氨基酸序列转换为dna序列,由此分别设计人源化抗体的vh或vl的cdna序列。
[0611]
基于所设计的cdna序列,合成100~150个碱基左右长度的多条合成dna,并使用这些dna进行pcr反应。在该情况下,从pcr反应的反应效率及可以合成的dna长度的观点出发,优选针对h链及l链分别设计4~6条合成dna。另外,也可以合成并使用可变区全长的合成dna。
[0612]
此外,通过在位于两端的合成dna的5’末端导入合适的限制性内切酶的识别序列,能够容易地向(2)中得到的基因重组抗体表达用载体中克隆编码人源化抗体的vh或vl的cdna。pcr反应后,将扩增产物分别克隆至pbluescript sk(-)(stratagene公司制)等质粒,
and practice,third edition,academic press(1996),antibodies-a laboratory manual,cold spring harbor laboratory(1988)]等来测定。
[0635]
3.双特异性抗体的设计
[0636]
本发明的双特异性抗体能够通过分别设计cd3结合结构域、fc区或包括fc区的恒定区、及疾病相关抗原结合结构域,并设计将它们连接而成的双特异性抗体来制作。
[0637]
3-1.cd3结合结构域的设计
[0638]
作为cd3结合结构域,使用上述1.中所述的方法获得所需的cd3结合结构域,并使用上述2.中所述的方法确定编码各结合结构域中所含的cdr或可变区的氨基酸序列的cdna序列。
[0639]
3-2.fc区或包括fc区的恒定区的设计
[0640]
本发明中的fc区或包括fc区的重链恒定区中,c端侧结合有一个cd3结合结构域。因此,在fc区中所含的2条fc链或重链恒定区中所含的2条ch链中,可以在各自任意一个多肽上结合scfv、dsfv等一个cd3结合结构域,也可以通过在各2条的多肽上分别结合cd3结合结构域的vh或vl来结合一个cd3结合结构域。
[0641]
制作一个ch3区添加有s354c及t366w的氨基酸残基取代的氨基酸序列、另一个ch3区添加有y349c、t366s、l368a及y407v的氨基酸残基取代的氨基酸序列,以使fc多肽链或cl-fc能够与连接有上述cd3结合结构域的氨基酸序列的fc多肽链或ch1-fc形成异二聚体结构。
[0642]
另外,对于连接有cd3结合结构域的氨基酸序列的ch1-fc和cl-fc的异源ch区,制备在ch1-fc加入了c220s的氨基酸残基取代的氨基酸序列、以及在cl-fc加入了216-220的氨基酸残基的缺失及c214s的氨基酸残基取代的氨基酸序列。另外,为了更有效地形成异源ch区,可以进一步在cl-fc加入h435r及y436f的氨基酸残基取代、或适当组合使用上述ch3结构域的氨基酸残基取代。
[0643]
3-3.疾病相关抗原结合结构域的设计
[0644]
在3-2中制作的fc区或ch区的各多肽链上连接所需的针对疾病相关抗原的结合结构域的氨基酸序列。例如,在分别将与疾病相关抗原特异性结合的单克隆抗体的vh/vl、vh-ch1/vl-cκ、scfv、vhh的氨基酸序列连接于第一或第二多肽的n端侧的情况下,能够制作具有一价或二价的疾病相关抗原结合结构域的抗cd3双特异性抗体。另外,如果在第一或第二多肽的c端侧连接scfv、vhh的氨基酸序列,则能够制作c端侧以一价具有疾病相关抗原结合结构域的双特异性抗体、或与n端的结合价数对应地具有二价或三价的疾病相关抗原结合结构域的双特异性抗体。在疾病相关抗原结合结构域为二价或三价的情况下,无论相同表位,还是不同表位,均可以制作各自的抗原结合结构域。该双特异性抗体具有除cd3之外的双特异性或三特异性。
[0645]
4.双特异性抗体的制作
[0646]
通过上述设计,能够制作各种分子型的抗cd3双特异性抗体,下面将示出若干典型的示例。以下,只要没有特别说明,则vh/vl、scfv、fab表示疾病相关抗原特异性的抗体的vh/vl、scfv、fab。
[0647]
4-1.fc区的n端包含一价疾病相关抗原结合结构域、fc区的c端包含一价抗cd3结合结构域的抗cd3双特异性抗体。
[0648]
vh-ch1-fc-cd3scfv及vl-cl-fc
[0649]
vl-ch1-fc-cd3scfv及vh-cl-fc
[0650]
vh-ch1-fc及vl-cl-fc-cd3scfv
[0651]
vl-ch1-fc及vh-cl-fc-cd3scfv
[0652]
vh-ch1-fc-cd3vh及vl-cl-fc-cd3vl
[0653]
vl-ch1-fc-cd3vh及vh-cl-fc-cd3vl
[0654]
vh-ch1-fc-cd3vl及vl-cl-fc-cd3vh
[0655]
vl-ch1-fc-cd3vl及vh-cl-fc-cd3vh
[0656]
4-2.fc区的n端包含二价疾病相关抗原结合结构域、fc区的c端包含一价抗cd3结合结构域的抗cd3双特异性抗体。
[0657]
fab1-fc-cd3scfv及fab2-fc
[0658]
fab1-fc及fab2-fc-cd3scfv
[0659]
scfv1-ch1-fc-cd3scfv及scfv2-cl-fc
[0660]
scfv1-ch1-fc及scfv2-cl-fc-cd3scfv
[0661]
scfv1-ch1-fc-cd3scfv及scfv2-cl-fc
[0662]
scfv1-ch1-fc及scfv2-cl-fc-cd3scfv
[0663]
向上述氨基酸序列中加入形成异二聚体所需的氨基酸残基取代,将包括编码该氨基酸序列的cdna的载体导入动物细胞并表达,由此制作双特异性抗体。另外,通过将上述载体导入fut8ko细胞并表达,还可以制作无α1,6-岩藻糖的双特异性抗体。另外,还可以制作加入fc氨基酸残基取代且具有高adcc活性的双特异性抗体。蛋白质表达及纯化能够通过上述2项中的方法来实施。
[0664]
5.本发明的双特异性抗体或其抗体片段的活性评价
[0665]
能够如下对纯化后的双特异性抗体或该双特异性抗体片段的活性进行评价。
[0666]
本发明的双特异性抗体对于表达cd3及疾病相关抗原中的至少一者的细胞株的结合活性能够使用上述1.(7)中所述的结合测定系统来测定。
[0667]
对于表达cd3及疾病相关抗原中的至少一者的细胞的cdc活性或adcc活性能够通过公知的测定方法[cancer immunol.immunother.,36,373(1993)]来测定。
[0668]
本发明的双特异性抗体的细胞毒性活性能够通过下面的方法来测定。例如,将表达疾病相关抗原的靶细胞及pbmc接种于专用平板,添加双特异性抗体并培养一定时间,通过实时细胞分析仪(real time cell analyzer)xcelligence(acea biosciences公司)等分析细胞数的变化。另外,将经荧光染色的靶细胞和非染色的pbmc接种于96孔板,添加双特异性抗体并培养一定时间,进行死亡细胞染色,通过流式细胞仪仅对存活靶细胞计数,由此计算细胞毒性活性。
[0669]
本发明的双特异性抗体的诱导细胞因子产生的能力能够通过下面的方法测定。例如,将表达疾病相关抗原的靶细胞及pbmc接种于96孔板,添加双特异性抗体并培养一定时间之后,使用elisa、bio-plex悬浮阵列系统或bd流式微珠阵列(bd cytometric bead array,cba)试剂盒测定培养上清中的细胞因子浓度。
[0670]
6.使用本发明的双特异性抗体或其抗体片段治疗疾病的方法
[0671]
本发明的双特异性抗体或该双特异性抗体片段能够用于治疗cd3及疾病相关抗原
中的至少一者相关的疾病、优选疾病相关抗原的表达细胞所参与的疾病。作为cd3及疾病相关抗原中的至少一者相关的疾病,可列举例如恶性肿瘤及癌症等。
[0672]
作为恶性肿瘤及癌症,可列举例如:大肠癌、结直肠癌、肺癌、乳腺癌、胶质瘤、恶性黑色素瘤(黑色素瘤)、甲状腺癌、肾细胞癌、白血病、淋巴瘤、t细胞淋巴瘤、胃癌、胰腺癌、宫颈癌、子宫内膜癌、卵巢癌、胆管癌、食管癌、肝癌、头颈部癌、鳞状细胞癌、皮肤癌、尿路癌、膀胱癌、前列腺癌、绒毛癌、咽癌、喉癌、胸膜瘤、男性生殖细胞瘤、子宫内膜增生、子宫内膜异位症、胚芽瘤、纤维肉瘤、卡波西肉瘤、血管瘤、海绵状血管瘤、血管母细胞瘤、视网膜母细胞瘤、星形细胞瘤、神经纤维瘤、少突胶质细胞瘤、髓母细胞瘤、神经母细胞瘤、神经胶质瘤、横纹肌肉瘤、胶质母细胞瘤、成骨肉瘤、平滑肌肉瘤及威尔姆斯肿瘤等。
[0673]
含有本发明的双特异性抗体或该双特异性抗体片段或其衍生物的治疗药物可以仅包含作为有效成分的该抗体或者该抗体片段或其衍生物,但通常作为与药学上可接受的一种以上载体一同混合后,通过制剂学技术领域公知的方法所制造的药物制剂来提供。
[0674]
作为给药途径,可列举例如:口服给药、或口腔内给药、气管内给药、直肠内给药、皮下给药、肌肉内给药或者静脉内给药等非口服给药。作为给药形式,可列举例如:喷雾剂、胶囊剂、片剂、散剂、颗粒剂、糖浆剂、乳剂、栓剂、注射剂、软膏或贴剂等。各种制剂能够使用常用的赋形剂、填充剂(增量剂)、结合剂、润湿剂、崩解剂、表面活性剤、润滑剂、分散剂、缓冲剂、保存剂、助溶剂、防腐剂、着色剂、增香剂、及稳定剂等通过常规方法来制造。
[0675]
作为赋形剂,可列举例如:乳糖、果糖、葡萄糖、玉米淀粉、山梨糖醇、结晶纤维素、无菌水、乙醇、甘油、生理盐水及缓冲液等。作为崩解剂,可列举例如:淀粉、海藻酸钠、明胶、碳酸钙、柠檬酸钙、糊精、碳酸镁及合成硅酸镁等。
[0676]
作为结合剂,可列举例如:甲基纤维素或其盐、乙基纤维素、阿拉伯树胶、明胶、羟基丙基纤维素及聚乙烯吡咯烷酮等。作为润滑剂,可列举例如:滑石、硬脂酸镁、聚乙二醇及氢化植物油等。
[0677]
作为稳定剂,可列举例如:精氨酸、组氨酸、赖氨酸、蛋氨酸等氨基酸、人血清白蛋白、明胶、葡聚糖40、甲基纤维素、亚硫酸钠、焦亚硫酸钠等。
[0678]
作为其它添加剂,可列举例如:糖浆、凡士林、甘油、乙醇、丙二醇、柠檬酸、氯化钠、亚硝酸钠及磷酸钠等。
[0679]
作为适合口服给药的制剂,可列举例如:乳剂、糖浆剂、胶囊剂、片剂、散剂或颗粒剂等。
[0680]
诸如乳剂或糖浆剂之类的液体制备物使用水、蔗糖、山梨糖醇或者果糖等糖类、聚乙二醇或者丙二醇等二醇类、芝麻油、橄榄油或者豆油等油类、对羟基苯甲酸酯类等防腐剂、或草莓香料(风味剂)或者薄荷等香料类等作为添加剂来制造。
[0681]
胶囊剂、片剂、散剂或颗粒剂等使用乳糖、葡萄糖、蔗糖或者甘露醇等赋形剂、淀粉或者海藻酸钠等崩解剂、硬脂酸镁或者滑石等润滑剂、聚乙烯醇、羟基丙基纤维素或者明胶等结合剂、脂肪酸酯等表面活性剂、或甘油等增塑剂等作为添加剂来制造。
[0682]
作为适于非口服给药的制剂,可列举例如:注射剂、栓剂或喷雾剂等。注射剂使用盐溶液、葡萄糖溶液、或由两者的混合物构成的载体等制造。
[0683]
栓剂使用可可脂、氢化脂肪或羧酸等载体制造。喷雾剂使用不会刺激接受者的口腔及气道粘膜,且能够将本发明的单克隆抗体或其抗体片段分散为微小粒子以使其容易吸
收的载体等制造。作为载体,可列举例如乳糖或甘油等。另外,还可以制成气雾剂或干粉。并且,上述非口服剂也可以添加在适合口服给药的制剂中作为添加剂示例的成分。
[0684]
作为有效量的本发明的双特异性抗体与合适的稀释剂及药学上可用的载体的组合所给药的有效量为每次每1kg体重0.0001mg~100mg,间隔2天~8周给药。
[0685]
7.使用本发明的双特异性抗体或该双特异性抗体片段诊断疾病的方法
[0686]
通过使用本发明的双特异性抗体或该双特异性抗体片段检测或测定表达cd3及疾病相关抗原中的至少一者的细胞,能够诊断cd3及疾病相关抗原中的至少一者相关的疾病、优选疾病相关抗原结合结构域的表达细胞所参与的疾病。
[0687]
例如,可以通过如下检测或测定cd3及疾病相关抗原中的至少一者来诊断作为cd3及疾病相关抗原中的至少一者相关的疾病的恶性肿瘤或癌症。
[0688]
首先,对于从多名健康者机体采集的生物样本,使用本发明的双特异性抗体或者该双特异性抗体片段或其衍生物,通过下述的免疫学方法,检测或测定cd3及疾病相关抗原中的至少一者,并考察健康者的生物样本中的cd3及疾病相关抗原中的至少一者的存在量。
[0689]
接着,对于测试者的生物样本,也同样考察cd3及疾病相关抗原中的至少一者的存在量,并将该存在量与健康者的存在量比较。例如,在测试者的疾病相关抗原的存在量与健康者相比增加的情况下,诊断该测试者患有癌症等疾病。对于cd3及疾病相关抗原中的至少一者相关的其它疾病的诊断,也可以通过相同的方法进行诊断。
[0690]
免疫学方法是使用施加标记后的抗原或抗体检测或测定抗体量或抗原量的方法。可列举例如:放射性物质标记免疫抗体法、酶免疫测定法、荧光免疫测定法、发光免疫测定法、蛋白质印迹法或理化方法等。
[0691]
作为放射性物质标记免疫抗体法,例如可列举如下方法:使抗原或表达抗原的细胞等与本发明的双特异性抗体或该双特异性抗体片段反应,再与施加了射线标记的抗免疫球蛋白抗体或结合片段反应之后,通过闪烁计数器等进行测定。
[0692]
作为酶免疫测定法,例如可列举如下方法:使抗原或表达抗原的细胞等与本发明的双特异性抗体或该双特异性抗体片段反应,再与施加了标记的抗免疫球蛋白抗体或结合片段反应之后,通过吸光光度仪测定显色色素。可列举例如夹心elisa法等。
[0693]
作为酶免疫测定法中使用的标记物,能够使用公知的酶标记[酶免疫测定法,医学书院(1987)]。例如使用碱性磷酸酶标记、过氧化物酶标记、萤光素酶标记或生物素标记等。
[0694]
夹心elisa法是在固相上结合抗体之后,捕捉待检测或测定的抗原,并使捕捉到的抗原与第二抗体反应的方法。在该elisa法中,准备与想要检测或测定的抗原结合的抗体或抗体片段,它们是抗原结合位点不同的两种抗体,其中,将第一抗体或抗体片段预先吸附于平板(例如,96孔板),接着,将第二抗体或抗体片段预先用fitc等荧光物质、过氧化物酶等酶或生物素等标记。在吸附有上述抗体的平板上,使从生物体内分离出的细胞或者其破碎液、组织或者其破碎液、细胞培养上清、血清、胸水、腹水或眼液等进行反应之后,与标记后的抗体或抗体片段进行反应,并进行与标记物质相应的检测反应。根据将已知的抗原梯度稀释浓度后制作的校准曲线,计算测试样本中的抗原浓度。
[0695]
夹心elisa法中使用的抗体可以使用多克隆抗体或单克隆抗体中的任意一种,也可以使用fab、fab’或f(ab)2等抗体片段。夹心elisa法中使用的两种抗体的组合可以为与不同表位结合的单克隆抗体或该抗体片段的组合,也可以为多克隆抗体与单克隆抗体或其
抗体片段的组合。
[0696]
作为荧光免疫测定法,使用例如文献[monoclonal antibodies-principles and practice,third edition,academic press(1996),单克隆抗体实验手册,讲谈社科学(1987)]等中所述的方法进行测定。荧光免疫测定法中使用的标记物能够使用公知的荧光标记[荧光抗体法,soft science公司(1983)]。使用例如fitc或ritc等。
[0697]
作为发光免疫测定法,通过例如文献[生物发光和化学发光临床检查42,广川书店(1998)]等中所述的方法进行测定。作为发光免疫测定法中使用的标记物,可列举公知的发光体标记,使用例如吖啶酯或洛芬碱等。
[0698]
作为蛋白质印迹法,用sds(十二烷基硫酸钠)-page[antibodies-a laboratory manual cold spring harbor laboratory(1988)]将抗原或表达抗原的细胞等分级之后,将该凝胶转印至聚偏氟乙烯(pvdf)膜或硝基纤维素膜,使该膜和与抗原结合的抗体或抗体片段进行反应,再与施加了fitc等荧光物质、过氧化物酶等酶标记或生物素标记等的抗igg抗体或其抗体片段进行反应之后,将该标记可视化,由此进行测定。下面将示出一个示例。
[0699]
首先,将表达具有所需的氨基酸序列的多肽的细胞或组织溶解,在还原条件下,通过sds-page法,每个泳道对0.1~30μg的蛋白量进行电泳。接着,将电泳后的蛋白质转移至pvdf膜,并使其与包含1~10%bsa的pbs(以下记作bsa-pbs)在室温下反应30分钟,以进行封闭操作。在此使本发明的双特异性抗体反应,并用包含0.05~0.1%tween-20的pbs(tween-pbs)清洗,使过氧化物酶标记山羊抗小鼠igg在室温下反应2小时。用tween-pbs清洗,使用ecl蛋白质印迹检测试剂(western blotting detection reagents)(amersham公司制)等检测结合了该抗体的条带,由此检测抗原。作为用于蛋白质印迹检测的抗体,使用能够与未保持天然型的立体结构的多肽结合的抗体。
[0700]
作为理化方法,例如可以通过使作为抗原的cd3及疾病相关抗原中的至少一者与本发明的双特异性抗体或该双特异性抗体片段结合,形成凝聚体,并检测该凝聚体。作为其它理化方法,还可以使用毛细管法,单向免疫扩散法、免疫比浊法或乳胶免疫比浊法[临床检查法提要,金原出版(1998)]等。
[0701]
在乳胶免疫比浊法中,如果使用使抗体或抗原致敏的粒径0.1~1μm左右的聚苯乙烯乳胶等载体,并通过对应的抗原或抗体引起抗原抗体反应,则反应液中的散射光增加,透射光减少。作为吸光度或积分球浊度来检测该变化,从而测定受试样本中的抗原浓度等。
[0702]
另一方面,检测或测定表达cd3及疾病相关抗原中的至少一者的细胞时,能够使用公知的免疫学检测法,优选使用免疫沉淀法、免疫细胞染色法、免疫组织染色法或荧光抗体染色法等。
[0703]
作为免疫沉淀法,使表达cd3及疾病相关抗原中的至少一者的细胞等与本发明的双特异性抗体或其抗体片段反应之后,加入蛋白质g琼脂糖凝胶等具有与免疫球蛋白特异性结合的能力的载体,使抗原抗体复合物沉淀。
[0704]
或者,也可以通过如下所示方法进行。首先,在elisa用96孔板上将本发明的双特异性抗体或该双特异性抗体片段固相化之后,通过bsa-pbs进行封闭。接着,丢弃bsa-pbs,用pbs充分清洗之后,与表达cd3及疾病相关抗原中的至少一者的细胞或组织的溶解液进行反应。从充分清洗后的平板上通过sds-page用样本缓冲液提取免疫沉淀物,并通过上述蛋白质印迹进行检测。
[0705]
免疫细胞染色法或免疫组织染色法是指如下方法:将表达抗原的细胞或组织等根据情况为了改善抗体的透过性用表面活性剂或甲醇等进行处理,然后,与本发明的双特异性抗体进行反应,再与施加fitc等荧光标记、过氧化物酶等酶标记或生物素标记等后的抗免疫球蛋白抗体或其结合片段进行反应,然后将该标记可视化,通过显微镜放大显示。另外,还可以通过使荧光标记抗体与细胞进行反应,并通过流式细胞仪分析的荧光抗体染色法[monoclonal antibodies-principles and practice,third edition,academic press(1996),单克隆抗体实验手册,讲谈社科学(1987)]进行检测。特别是,本发明的双特异性抗体或该双特异性抗体片段能够通过荧光抗体染色法来检测细胞膜上表达的cd3及疾病相关抗原中的至少一者。
[0706]
另外,在荧光抗体染色法中,使用fmat8100hts系统(applied biosystems公司制)等时,可以测定抗原量或抗体量,而无需将形成的抗体-抗原复合物与不参与抗体-抗原复合物形成的游离抗体或抗原分离。
实施例
[0707]
下面,将列举具体实施例进行说明,但本发明并不限定于这些实施例。
[0708]
[实施例1]抗her2单价抗体及cd3/her2双特异性抗体的动物细胞用表达载体的制作
[0709]
(1)抗her2单价抗体的动物细胞用表达载体的制作
[0710]
依据国际公开第2014/054804号中所述的方法,分别制作igg1型抗her2单价抗体及igg4pe(r409k)型her2单价抗体[分别记作mvg1、mvg4pe(r409k)。具有图2的(a)的结构]的动物细胞用表达载体(分别记作pkantex93mvg1及pkantex93mvg4pe(r409k))。
[0711]
单价抗体是由2条不同多肽构成的异二聚体,将包括vh的多肽记作第一多肽(vh-ch1-hinge-fc,也称为多肽1),将包括vl的多肽记作第二多肽(vl-cl-hinge-fc,也称为多肽2)。
[0712]
表1中示出制作各单价抗体中使用的第一多肽的ch1-hinge-fc部分的氨基酸序列及碱基序列。
[0713]
[表1]
[0714][0715]
表1所示的igg4pe(r409k)型具有将igg4的重链恒定区的第228位ser残基取代为pro、将第235位leu残基取代为glu、及将第409位arg残基取代为lys而成的恒定区,不具有adcc活性。
[0716]
另外,对于上述抗her2单价抗体的vh及vl的氨基酸序列以及碱基序列,均使用抗her2抗体曲妥珠单抗(trastuzumab)的vh及vl的氨基酸序列以及碱基序列(参见proc.natl.acad.sci.u.s.a.89:4285,1992)。
[0717]
(2)cd3/her2双特异性抗体的动物细胞表达载体的制作
[0718]
基于上述igg1型抗her2单价抗体、及igg4pe(r409k)型抗her2单价抗体,通过下面记载的方法制作该动物细胞表达载体,以制作经由接头在各单价抗体的第一多肽的c端结合抗cd3 scfv的异二聚体型的cd3/her2双特异性抗体[图2的(b)]。
[0719]
利用限制性内切酶位点,将对上述(1)中制作的igg1型抗her2单价抗体表达载体pkantex93mvg1的第一多肽的h链恒定区的c端部分的一部分进行编码的碱基序列替换为编码h链恒定区c端部分的一部分+肽接头+抗cd3 scfv的碱基序列。由此,得到igg1型cd3/her2双特异性抗体的表达载体pkantex93mvg1_sct3a。
[0720]
肽接头的氨基酸序列使用[serglyglyglygly(序列编号143)]3。抗cd3scfv的氨基酸序列及碱基序列使用us7575923b2中所述的抗cd3 scfv的氨基酸序列及碱基序列。抗cd3 scfv的氨基酸序列示于序列编号9。下面将该序列称为sct3a。
[0721]
通过相同的方法,由上述(1)中制作的igg4pe(r409k)型抗her2单价抗体表达载体pkantex93mvg4pe(r409k),获得igg4pe(r409k)型cd3/her2双特异性抗体的表达载体pkantex93mvg4pe(r409k)_sct3a。
[0722]
上述(1)及本项中制作的抗体表达用载体均以大肠杆菌competent quick dh5α(toyobo)为宿主并使用pureyield plasmid midiprep system(promega)制备,用于以后的试验。
[0723]
[实施例2]抗her2单价抗体及cd3/her2双特异性抗体的表达及纯化
[0724]
使用实施例1中制备的各种用于抗体表达的载体,通过下面所述的方法,获得高adcc igg1型抗her2单价抗体4d5_mvg1(df)、igg4pe(r409k)型her2抗体4d5_mvg4 pe(r409k)(f)、高adcc igg1型cd3/her2双特异性抗体4d5_mvg1_sct3a(df)及igg4pe(r409k)型cd3/her2双特异性抗体4d5_mvg4pe(r409k)_sct3a(f)。
[0725]
表2中示出各抗体的名称、对应的表达载体、使用的宿主细胞、fc的糖链的结构及有无抗cd3 scfv。
[0726]
[表2]
[0727][0728]
表中的cho/dg44表示来自中国仓鼠卵巢(chinese hamster ovary)的cho/dg44细胞(somatic cell mol genet 12;555,1986),fut8ko cho表示敲除α1,6岩藻糖基转移酶基因(fut8)的cho/dg44细胞(美国专利第6,946,292号说明书)。
[0729]
向4
×
106个上述宿主细胞中加入8μg各种表达载体,通过电穿孔法(cytotechnology.3:133,1990)进行基因导入。导入基因后,各细胞在包含10%透析牛血清(以下,简称为dfbs)的imdm培养基(gibco公司)中培养2天,然后,再用包含0.5mg/ml g418硫酸盐的上述培养基继续培养2周左右,获得g418耐药性株。使用excell302培养基(safc biosciences公司)培养g418耐药性株,回收包含表达蛋白质的培养上清。
[0730]
使用填充有蛋白质a(mabselect sure:ge healthcare公司)的柱,以0.5~1.0ml/min的流速使培养上清1l通过。将该柱用10ml磷酸盐缓冲液(phosphate buffer saline、pbs)清洗2次后,使用0.1m柠檬酸缓冲液(ph3.9)洗脱抗体。通过2mtris盐酸缓冲液(ph8.0)将得到的洗脱液立即中和,然后,通过10mm柠檬酸、150mm氯化钠(ph6.0)透析,由此将缓冲液置换。
[0731]
进一步使用凝胶过滤色谱从上述抗体溶液中除去多聚物或者分解物。在akta explore 10s(ge healthcare公司)上连接superdex 200 10/300gl柱(ge healthcare公司),将流道置换为10mm柠檬酸、150mm氯化钠(ph6.0)。将制备的抗体溶液添加于该柱,使其以0.5ml/min的流速通过,利用级分收集器每次回收0.5ml。将回收的各组分中显示od
280
的主峰的组分作为包含目标抗体单体的组分回收,将抗体溶液通过0.22μm过滤片杀菌后保存。对得到的抗体样本进行sds-page分析,结果均显示出预测的分子量大小,确认获得了目标抗体。另外,作为比较对照样本,按照clin cancer res.13:1875-1882,2007中所述的方法制作除去抗her2抗体曲妥珠单抗(trastuzumab)的n结合型糖链中的α1,6岩藻糖后的抗体曲妥珠单抗(trastuzumab)(df),并将其用于部分试验。
[0732]
并且,使用clin cancer res.11(8):3126-3135,2005中所述的编码抗2,4-二硝基苯基(2,4-dinitrophenyl、dnp)igg1抗体的dna片段(克隆名称dnp2),按照实施例1及2所述
的方法制作作为阴性对照的igg1型抗2,4-二硝基苯基(dnp)抗体,并将其用于部分试验。
[0733]
[实施例3]抗her2单价抗体及cd3/her2双特异性抗体的抗原结合活性的评价
[0734]
(1)her2结合活性的评价
[0735]
通过对于曲妥珠单抗(trastuzumab)的结合抑制的试验来评价实施例2中获得的各种抗体的her2结合活性。首先,使用alexa fluor 488抗体标记试剂盒(antibody labeling kit)(life technologies公司),利用alexa488标记曲妥珠单抗(trastuzumab)(roche公司),制作trastuzumab_alx。接着,使用her2阳性人乳腺癌细胞株sk-br-3(atcc htb-30),通过流式细胞仪进行结合抑制分析。
[0736]
分别添加最终浓度2.0μg/ml的trastuzumab_alx、最终浓度105、21、4.2、及0.84nm的非标记igg1抗体、曲妥珠单抗(trastuzumab)、各种抗her2单价抗体或cd3/her2双特异性抗体,在4℃下反应1.5小时。阴性对照中加入相同浓度的来自人血清的igg1/kappa(millipore公司)。清洗后,用流式细胞仪cytomics fc 500mpl(beckman coulter公司)测定与sk-br-3细胞结合的平均荧光强度(mean fluorescent intensity、(mfi)。将结果示于图4。
[0737]
如图4所示,曲妥珠单抗(trastuzumab)、各种抗her2单价抗体、及各种cd3/her2双特异性抗体以抗体浓度依赖性的方式抑制trastuzumab_alx的结合,确认其具有her2特异性结合活性。关于抗her2单价抗体、及cd3/her2双特异性抗体这四种,可知它们对于her2的结合活性为相同程度。
[0738]
(2)cd3结合活性的评价
[0739]
通过对于市售冷冻t细胞(allcells公司)的结合活性来评价实施例2中获得的各种抗体的cd3结合活性。按照10μg/ml的最终浓度将各种抗体加入t细胞,在4℃下反应1小时。清洗后,加入稀释为30μg/ml的山羊抗人(goat anti-human)igg f(ab)
2-fitc(acris antibodies公司),在4℃下反应1小时。
[0740]
需要说明的是,作为阳性对照,一抗使用30μg/ml抗cd3抗体okt-3(abcam公司),二抗使用山羊抗小鼠(goat anti-mouse)igg f(ab)
2-fitc(dako公司)。清洗后,用流式细胞仪cytomics fc 500mpl(beckman coulter公司)测定与t细胞结合的抗体的mfi。将结果示于图5。
[0741]
如图5所示,所评价的抗体中,cd3/her2双特异性抗体4d5_mvg1_sct3a(df)及4d5_mvg4pe(r409k)_sct3a(f)均与t细胞同等程度地结合。而曲妥珠单抗(trastuzumab)以及抗her2单价抗体4d5_mvg1(df)及4d5_mvg4pe(r409k)(f)不与t细胞结合。由此表明,4d5_mvg1_sct3a(df)及4d5_mvg4per409k)_sct3a(f)能够以相同程度的强度与cd3结合。
[0742]
[实施例4]抗her2单价抗体及cd3/her2双特异性抗体的细胞毒性活性的评价
[0743]
对于实施例2中制作的各种抗体,使用经时检测附着于平板的癌细胞的细胞量的实时细胞分析仪(real time cell analyzer)xcelligence(acea biosciences公司),按照下面所述的方法,测定细胞毒性活性,其中,细胞毒性活性包括由fc区介导的adcc活性及通过与cd3结合所产生的adtc活性这两者。利用了电阻值根据平板上的细胞量的变化而变化。即,测得的细胞指数值与平板上的细胞量呈现正相关。
[0744]
已知主要表达fc受体fcγriiia的nk细胞是adcc活性的主要效应细胞,表达cd3的
t细胞是adtc活性的主要效应细胞,因此,通过将包括两者的来自人外周血的单核球(pbmc)用作效应子,将her2阳性癌细胞株用作标靶,能够测定各种抗体的包括adcc活性及adtc活性两者的细胞毒性活性。
[0745]
首先,向e-plate view 16(acea biosciences公司)中加入rpmi1640培养基(添加10%fbs),进行基线校正。将her2中阳性乳腺癌细胞株bt-20细胞(atcc htb-19)或her2低表达mcf-7细胞(atcc htb-22)用0.02%edta(nacalai tesque公司)从烧瓶上剥离,用pbs清洗后,用rpmi1640(10%fbs,10μg/ml庆大霉素(gentamicin))分别稀释至2.0
×
105cells/ml,按照50μl/孔加入到上述平板。
[0746]
将上述平板在co2培养箱中保温30分后,开始测定细胞指数值。大概20小时后,将通过密度梯度法从健康者外周血中采集的pbmc稀释为1
×
106cells/ml,按照50μl/孔加入上述平板,再按照50μl/孔加入制备为最终浓度的4倍浓度的各种抗体,再次开始测定。最终数据用即将添加抗体前的癌细胞量的值进行归一化。将得到的结果示于图6~8。
[0747]
图6示出仅bt-20细胞时的细胞指数;、向bt-20细胞添加pbmc时的细胞指数;或进一步向其中添加igg1型抗her2单价抗体4d5_mvg1(df)(最终浓度50nm)、igg4pe(r409k)型cd3/her2双特异性抗体4d5_mvg4_sct3a(f)(最终浓度50nm)时的细胞指数、或者它们的混合液(最终浓度分别为25nm的混合液)时的细胞指数。
[0748]
图6中,靶细胞与添加pbmc时的癌细胞量、以及与进一步添加抗体时的癌细胞量的差为该抗体所具有的细胞毒性活性。如图6所示表明,4d5_mvg1(df)及4d5_mvg4pe(r409k)_sct3a(f)分别具有中等程度的细胞毒性活性;及它们各半量的混合物具有高于各4d5_mvg1(df)或4d5_mvg4pe(r409k)_sct3a(f)单独的细胞毒性活性的高细胞毒性活性。
[0749]
如表2所示,igg1型抗her2单价抗体4d5_mvg1(df)具有α1,6岩藻糖缺失的n-结合型糖链所结合的igg1型的恒定区,如国际公开第2014/054804号所述,其具有由fcγriiia结合活性介导的高adcc活性,但不具有cd3结合位点,因此不具有adtc活性。
[0750]
如表2所示,igg4pe(r409k)型cd3/her2双特异性抗体4d5_mvg4(r409k)_sct3a(f)具有如下分子结构:添加了α1,6岩藻糖的igg4型的恒定区,且导入了降低效应子活性的氨基酸残基改型,因此不具有引起adcc活性的能力或能力非常低,但具有由cd3介导的adtc活性。
[0751]
将这两种抗体分别各添加25nm的组的细胞毒性活性比仅添加50nm4d5_mvg1(df)或仅添加50nm 4d5_mvg4pe(r409k)_sct3a(f)的组的细胞毒性活性高,表明通过将仅具有adcc活性的分子和仅具有adtc活性的分子混合,显示协同的细胞毒性活性。
[0752]
因此,该结果显示,与将仅具有adcc活性的抗体或仅具有adtc活性的抗体中的任意一者单独作用于癌细胞时相比,将两者分别半量同时作用于癌细胞时,抗肿瘤效果更高。
[0753]
另外,4d5_mvg1(df)及4d5_mvg4pe(r409k)_sct3a(f)的细胞毒性活性均为中等程度,其中一者的活性在相同浓度没有达到饱和表明,该试验中adcc活性和adtc活性的有效浓度范围的偏差不大。
[0754]
图7示出仅bt-20细胞时的细胞指数;向bt-20细胞中添加pbmc时的细胞指数;进一步向其中添加4d5_mvg1(df)和4d5_mvg4_sct3a(f)的混合液(各0.3nm的混合液)或igg1型cd3/her2双特异性抗体4d5_mvg1_sct3a(df)(0.6nm)时的细胞指数。
[0755]
将4d5_mvg1(df)及4d5_mvg4pe(r409k)_sct3a(f)的混合(各0.3nm)与4d5_mvg1_sct3a(df)(0.6nm)的细胞毒性活性的比较结果示于图7。
[0756]
如图7所示,4d5_mvg1_sct3a(df)相比于同时添加4d5_mvg1(df)及4d5_mvg4pe(r409k)_sct3a(f)显示出更高的抗肿瘤效果。
[0757]
如表2所示,4d5_mvg1_sct3a(df)具备具有α1,6岩藻糖缺失的n-结合型糖链所结合的igg1型的恒定区带来的高adcc活性、及由cd3介导的adtc活性的分子结构。
[0758]
由此表明,图6所示的仅具有adcc活性的分子及仅具有adtc活性的分子联用所产生的高的抗肿瘤效果通过在同一分子具备adcc及adtc这两种活性而进一步增强,协同效果提高。
[0759]
图8的(a)~(e)示出仅mcf-7细胞时的细胞指数;向mcf-7细胞中添加pbmc时的细胞指数;或进一步向其中添加抗her2抗体曲妥珠单抗(trastuzumab)(df)、igg1型抗her2单价抗体4d5_mvg1(df)、igg4pe(r409k)型cd3/her2双特异性抗体4d5_mvg4pe(r409k)_sct3a(f)或者igg1型cd3/her2双特异性抗体4d5_mvg1_sct3a(df)(最终浓度均为50nm)时的细胞指数。
[0760]
如图8的(a)~(e)所示表明,对于mcf-7细胞,曲妥珠单抗(trastuzumab)(df)、4d5_mvg1(df)、及4d5_mvg4pe(r409k)_sct3a(f)均几乎不显示细胞毒性活性,而4d5_mvg1_sct3a(df)显示非常高的细胞毒性活性。
[0761]
该结果显示,即使对于仅具有adcc活性的抗体或仅具有adtc活性的抗体几乎不显示细胞毒性活性的癌细胞,一分子中具有adcc活性及adtc活性的抗体也能够发挥特别高的抗肿瘤效果。
[0762]
[实施例5]对cd3/her2双特异性抗体的接头序列的研究
[0763]
本项中,针对cd3/her2双特异性抗体4d5_mvg1_sct3a(df),制作改变用于将第一多肽的ch3的c端与抗cd3 scfv之间相连的肽接头的序列的种类及长度后的双特异性抗体,从而就该肽接头对生物活性的影响进行研究。
[0764]
表3示出所制作的各cd3/her2双特异性抗体的名称和肽接头的氨基酸序列及其结构。
[0765]
[表3]
[0766]
接头的序列
[0767][0768][0769]
在表3记载的抗体中,h1、h3分别为α螺旋旋转1或者3圈的双特异性抗体,pro为具有包含脯氨酸的肽接头的双特异性抗体。这些抗体所具有的肽接头与[serglyglyglygly(序列编号143)]n(n为1~3)接头相比均具有较硬的结构(chen x,et al.adv.drug deliv.rev.65:1357-1369,2013)。因此,通过比较具有上述不同肽接头的各种双特异性抗体的生物活性,可以掌握接头部分的硬度、长度对cd3/her2双特异性抗体的细胞毒性活性的影响。
[0770]
利用实施例1中制作的双特异性抗体表达载体pkantex93mvg1_sct3a的限制性内切酶位点ecot22i-bamhi,将包括编码第一多肽的c端-[serglyglyglygly(序列编号143)]3接头-抗cd3 scfv的碱基序列的基因片段替换为包括编码第一多肽的c端-表3中所述的肽接头-抗cd3 scfv的碱基序列的基因片段,从而制作表3中所述的各种双特异性抗体的动物细胞用表达载体。
[0771]
通过实施例2中所述的方法将这些表达载体导入fut8ko cho细胞,表达蛋白质并纯化。对于所制作的双特异性抗体中的g1、g2、h1、h3、及pro,得到的纯化蛋白质在sds-page分析中显示预测的分子量大小,确认得到了目标抗体。
[0772]
通过实施例3中所述的方法测定所制作的各种双特异性抗体的her2及cd3结合活性。将得到的结果示于图9及图10。由图9表明,4d5_mvg1_sct3a(df)、g1、g2、h1、h3及pro均具有同等的her2结合活性;由图10表明,虽然抗体间可见略微差异,但每个抗体都具有变化不大的cd3结合活性。
[0773]
另外,通过实施例3所述的方法测定上述双特异性抗体对于bt-20细胞的细胞毒性活性(最终浓度0.617nm)。比较对照采用仅靶细胞、或者仅靶细胞和pbmc(未添加抗体)。将得到的结果示于图11及图12。
[0774]
如图11及图12所示表明,cd3/her2双特异性抗体g1、g2、h1、h3、及pro均显示出大于等于4d5_mvg1_sct3a(df)的细胞毒性活性。该结果显示,igg1型cd3/her2双特异性抗体4d5_mvg1_sct3a(df)所具有的高细胞毒性活性并不依赖于接头部分的结构。
[0775]
[实施例6]cd3/her2双特异性抗体对于胃癌细胞株的细胞毒性活性
[0776]
将编码表4所示的各多肽的氨基酸序列的基因插入将promega公司的pci载体改型所制作的抗体表达用载体。在此,关于记作例如dnp2的抗体,示出了使用与dnp结合的抗体的可变区作为癌抗原侧可变区的阴性对照抗体。抗体名称的末尾记载的(f)是岩藻糖基化(fucosylated)的简称,(df)是去岩藻糖基化(defucosylated)的简称,表示添加于fc区的糖链的α1,6岩藻糖的有无。
[0777]
基因序列的重链侧(第一多肽侧)插入cag启动子,轻链侧(第二多肽侧)插入cmv启动子的下游。使用该载体、及作为表达系统的freestyle cho expression kit(thermo fisher scientific公司)、cho-s细胞或敲除了α1,6岩藻糖基转移酶基因(fut8)的悬浮cho细胞[以下记作cho(fut8ko)]进行瞬态表达。或者通过使用作为表达系统的expi293 expression system(thermo fisher scientific公司)及expi293f细胞或敲除了fut8的expi293f细胞(以下记作expi293f(fut8 ko)),也能够制作相同的抗体组。
[0778]
具有α1,6岩藻糖的抗体分子使用cho-s细胞或者expi293f细胞制作,α1,6岩藻糖缺失的抗体分子使用cho(fut8 ko)细胞或者expi293f(fut8ko)细胞制作。
[0779]
对细胞培养液进行离心分离,通入0.2μm过滤片(thermo scientific公司),回收培养上清。使用mabselect sure(ge healthcare公司)对培养上清进行亲和纯化,从而获得粗纯化抗体。具体而言,填充在柱中的树脂用pbs平衡后,向该柱中添加培养上清,并用以0.1%的最终浓度包含triton x-114的pbs及pbs分别清洗一次之后,使用洗脱出缓冲液(100mm柠檬酸-naoh、ph3.9或20mm乙酸-naoh、50mm nacl,ph3.9)洗脱抗体。
[0780]
向得到的抗体溶液中加入1/10量的中和缓冲液(1m磷酸-naoh,ph7.0)进行中和,使用amicon ultra-4离心过滤装置(centrifugal filter units)(millipore公司)通过超滤进行浓缩。由于粗纯化抗体包含一定比例的缔合物,因此为了仅分离单体,使用akta色谱法系统及superdex 200increase 10 300gl柱(均由ge healthcare公司制)进行凝胶过滤层析。
[0781]
流动相使用柠檬酸缓冲液(10mm柠檬酸-naoh,150mm nacl,ph6.0)。仅分离单体组分,使用nanodrop(thermo fisher scientific公司)测定吸光度a280,从而进行抗体溶液浓度的测定及制备。
[0782]
[表4]
[0783]
所制作的各种cd3/her2双特异性抗体的名称和序列及表达细胞
[0784]
通过实施例3中所述的方法测定上述双特异性抗体对于her2中阳性人胃癌细胞株mkn-7细胞(riken brc rcb0999)的细胞毒性活性(最终浓度50nm)。比较对照采用仅靶细胞或者仅靶细胞和pbmc(不添加抗体)。将得到的结果示于图13。可变区为dnp2的抗体均不显示细胞毒性活性。
[0785]
而仅具有adcc活性的抗体(4d5_mvg1(df)及4d5_igg1(df))中可见细胞毒性活性,但与仅具有adtc活性的抗体(4d5_mvg4pe(r409k)_sct3a(f))相比,活性减弱。将4d5_mvg1(df)及4d5_mvg4pe(r409k)_sct3a(f)各半量混合成50nm后,显示出比上述抗体组更高的活性。并且,能够在一个分子型下发挥adcc活性及adtc活性的4d5_mvg1_sct3a(df)在所有抗体组中显示出最高的细胞毒性活性。
[0786]
同样地,将对于her2中阳性人胃癌细胞株mkn-45细胞(jcrb细胞库jcrb0254)测得的细胞毒性活性的结果示于图14。作为阴性对照的可变区为dnp2的抗体均不显示细胞毒性活性。可变区为4d5的抗体中仅4d5_mvg1_sct3a(df)显示明确的细胞毒性活性。以上结果表明,本技术对于bt-20细胞之外的her2阳性细胞株也通过协同作用发挥较高的细胞毒性活性。
[0787]
[实施例7]cd3/her2双特异性抗体的细胞毒性活性及培养上清中的细胞因子产生
[0788]
为了对如背景技术所述的代表性抗cd3双特异性抗体和在本发明中制作的双特异性抗体的性状进行比较,制作比较对照分子,并测定细胞毒性活性及杀伤细胞时培养上清中的细胞因子产生。作为比较对照分子,制作公知的抗cd3双特异性抗体(国际公开第2016/071004号中所述的具有序列编号160、359及399所表示的氨基酸序列的抗cd3双特异性抗体)。下面也记作cd3/her2 fab
×
scfv。
[0789]
与实施例6中所示的方法相同地制作表达载体,使用expi293 expression system
(thermo scientific公司)表达抗体。下面的纯化流程按照实施例6中所述的方法进行。
[0790]
通过实施例4中所述的方法测定所制作的作为比较对照的双特异性抗体及4d5_mvg1_sct3a(df)对于bt-20细胞的细胞毒性活性。将未添加受试物质的孔的细胞指数值设为活性0%,将添加0.5%triton x-100代替受试物质的孔的细胞指数值设为活性100%,根据day2(抗体添加后48小时)时的细胞指数值计算各抗体的细胞毒性活性值。
[0791]
在相同时间回收培养上清,使用bd流式微珠阵列(cytometric bead array)(cba)human th1/th2 cytokine kit ii(bd pharmingen公司)测定细胞因子(ifn-γ、tnf-α、il-6)浓度。将各个浓度时的细胞毒性活性和细胞因子浓度绘制在同一图表上,并将结果示于图15。最大的细胞毒性活性在4d5_mvg1_sct3a(df)、对照抗体均为相同程度。另一方面,两者细胞因子产生的程度存在很大差异。即,对照抗体在抗体浓度依赖性细胞毒性活性提升的同时,观察到细胞因子产生提升,表明细胞毒性活性出现的浓度范围与诱导细胞因子产生的浓度范围的偏差较小。而4d5_mvg1_sct3a(df)几乎未观察到细胞因子产生随着细胞毒性活性的提升而提升。
[0792]
[实施例8]cd3/her2双特异性抗体的各种分子型的设计
[0793]
实施例1~7中示出基于igg1型抗her2单价抗体,在其第一多肽的c端结合抗cd3 scfv而成的异二聚体型的cd3/her2双特异性抗体[图2的(b)]的制作过程及活性评价的结果。由该结果首次发现,通过在一分子中发挥adcc活性及adtc活性,使诱导细胞因子产生的能力较低,同时协同地发挥较高的细胞毒性活性。
[0794]
为了对获得adcc活性与adtc活性的协同作用的分子型进行更详细考察,设计了图16的(a)~(f)所示的各种分子型。图16的(a)示出了现有实施例中使用的分子。图16的(b)是在二价型抗体的单侧的重链的c端结合有抗cd3 scfv的分子,癌抗原侧fab变为二价。为了制作异源重链,在ch3部分导入有杵臼结构(knobs into holes)改型(nature biotechnology.vol 16:677-681,1998)。
[0795]
图16的(c)是虽然与图16的(a)具有相同的氨基酸序列,但通过将普通cho细胞用作表达细胞而具有添加了α1,6岩藻糖的糖链的分子。图16的(d)是在一价型抗体的第二多肽(vl-cl-hinge-fc)的c末端结合有抗cd3 scfv的分子。图16的(e)是癌抗原侧fab和抗cd3 scfv均位于n端侧的分子,为了制作异源重链,与上述图16的(b)相同地导入了杵臼结构(knobs into holes)改型。图16的(f)是在一价型抗体的第一、第二多肽各自的c末端分别结合有一个抗cd3 scfv的分子,从而其在一分子内具有两个抗cd3 scfv。
[0796]
[实施例9]各种分子的制作及细胞毒性活性评价
[0797]
(1)所设计的双特异性抗体分子的制作
[0798]
与实施例6所示的方法相同地制作实施例8中设计的分子。表5中示出了所制作的抗体及其氨基酸序列。
[0799]
[表5]
[0800]
所制作的cd3/her2双特异性抗体的名称和序列及表达细胞
[0801][0802]
表5中的“分子型”与图16的(b)~(f)相对应。关于评价每种分子型时用作阴性对照的不具有scfv的分子,将其分类为与具有scfv的分子相同的分子型。
[0803]
表5中的“抗体名称”按照(1)癌抗原侧的抗体克隆名称、(2)恒定区的抗体亚类的来源及结构、(3)cd3克隆名称、及(4)有无岩藻糖的顺序来表示分子的特征。mvg1、mvg4pe(r409k)等抗体名称中的“mv”表示癌抗原侧为一价结合型的抗体。mvg1、mvg4pe(r409k)等抗体名称中的“g1”表示具有来自igg1的fc,“g4pe(r409k)”表示具有来自igg4的fc上添加s228p、l235e、及r409k变异后的fc。
[0804]
表5中的(f)表示具有岩藻糖,(df)表示不具有岩藻糖。抗体名称中记作(df)时在cho(fut8 ko)中表达,记作(f)时在cho-s中表达。sct3a、scsp34等抗体名称中的“sc”是scfv的简称,scsp34表示使用来自sp34的vh、vl的scfv。(lc)表示如图14的(d)所示那样scfv与包含cl-fc的第二多肽结合。
[0805]
分子型(e)中的sp34是文献(embo j.1985.4(2):337-344;j.immunol.1986,137(4):1097-100;j.exp.med.1991,174:319-326;j.immunol.1991,147(9):3047-52)中所述的抗cd3单克隆抗体,美国专利第10,066,015号说明书中的序列编号5及序列编号10等中公开其氨基酸序列。
[0806]
sp34(h05’)表示通过对sp34的可变区序列进行氨基酸改型而降低了对于cd3的亲和力的抗cd3抗体的序列(在后述的实施例11中制作)。表5中,“4d5mut”表示通过向曲妥单抗(trastuzumab)的重链可变区的cdr导入2个氨基酸残基的改型使对于her2的结合性完全消失的抗体的可变区。
[0807]
(2)cd3/her2及cd3/gm2双特异性抗体的癌抗原侧结合价数及细胞毒性活性
[0808]
通过实施例4中所述的方法测定表5所示的分子型(b)对于bt-20细胞的细胞毒性活性。添加4d5_igg4pe(r409k)(f)、4d5_igg1(df)、4d5_igg4pe(r409k)_sct3a(f)、及4d5_igg1_sct3a(df),以其最终浓度分别为50nm。分子型(a)的4d5_mvg1_sct3a(df)及4d5_mvg4pe(r409k)_sct3a(f)也在相同条件下测定细胞毒性活性,以用于比较。将结果示于图17的(a)及(b)。
[0809]
如图17的(a)所示,4d5_igg4pe(r409k)(f)不具有效应子活性,仅通过与her2结合时,并未观察到细胞毒性活性。如图17的(b)所示,4d5_igg4pe(r409k)_sct3a(f)及4d5_igg1(df)均观察到细胞毒性活性,表明4d5_igg1_sct3a(df)与4d5_igg4pe(r409k)_sct3a(f)相比具有高细胞毒性活性。癌抗原结合结构域的fab为二价的4d5_igg1_sct3a(df)的活性强度与癌抗原结合结构域的fab为一价的4d5_mvg1_sct3a(df)相同程度。
[0810]
以上表明,一个抗体分子具有adtc活性及adcc活性所产生的细胞毒性活性的协同效果不仅在癌抗原结合结构域为一价时观察到,二价时也能观察到。
[0811]
同样,测定分子型(b)的抗癌症特异性抗原(tsa)抗体采用抗神经节苷脂gm2单克隆抗体的分子对于人小细胞肺癌细胞株sbc-3细胞(jcrb细胞库jcrb0818)的细胞毒性活性。添加8962_igg1(df),8962_mvg1_sct3a(df)及8962_igg1_sct3a(df),使其最终浓度分别为50nm。将结果示于图18的(a)及(b)。
[0812]
将包括抗dnp抗体的可变区作为抗tsa抗体可变区的阴性对照的抗体分子的活性示于图18的(a),包括作为受试物质的抗gm2单克隆抗体的可变区的抗体分子的活性示于图18的(b)。在该条件下,作为二价型adcc抗体的8962_igg1(df)未观察到细胞毒性活性,而二价型的具有adcc和adtc两种活性的8962_igg1_sct3a(df)则观察到高细胞毒性活性。
[0813]
(3)cd3/her2双特异性抗体的α1,6岩藻糖有无及其细胞毒性活性
[0814]
通过实施例4中所述的方法测定表5所示的分子型(c)对于bt-20细胞的细胞毒性活性。添加4d5_mvg4pe(r409k)(f)、4d5_mvg1(f)、4d5_mvg4pe(r409k)_sct3a(f)及4d5_mvg1_sct3a(f),使其最终浓度分别为50nm。
[0815]
将结果示于图19的(a)。4d5_igg4pe(r409k)(f)未显示细胞毒性活性(数据未显示)。4d5_mvg1(f)及4d5_igg4pe(r409k)_sct3a(f)虽然细胞毒性活性较弱但显示细胞毒性活性。并且还表明,4d5_mvg1_sct3a(f)具有比上述两种分子更高的细胞毒性活性。表明即使在具有α1,6岩藻糖的情况下,以一个分子发挥adcc活性和adtc活性也会使活性提升。
[0816]
然而,如图19的(b)所示,通过与除去了α1,6岩藻糖的分子进行比较发现,高adcc活性抗体4d5_mvg1(df)的细胞毒性活性比4d5_mvg1_sct3a(f)强,4d5_mvg1_sct3a(df)的细胞毒性活性更强。以上结果表明,通过在一分子中发挥adcc和adtc而协同提升细胞毒性活性的现象具有普遍性,不依赖于有无α1,6岩藻糖。并且还表明,一分子中发挥除去α1,6岩藻糖带来的高adcc活性和atdc活性时,将会提供更高的细胞毒性活性。
[0817]
(4)cd3/her2双特异性抗体的抗cd3 scfv的融合位置及细胞毒性活性
[0818]
通过实施例4中所述的方法测定表5所示的分子型(d)对于bt-20细胞的细胞毒性活性。添加4d5_mvg4pe(r409k)、4d5_mvg1(df)、4d5_mvg4pe(r409k)_sct3a(lc)(f)及4d5_mvg1_sct3a(lc)(df),使其最终浓度分别为50nm。将结果示于图20的(a)。
[0819]
4d5_mvg4pe(r409k)_sct3a(lc)(f)示出与4d5_mvg1(df)相同程度的细胞毒性活性,4d5_mvg1_sct3a(lc)(df)示出比它们更高的细胞毒性活性。另外,同样地比较分子型(a)和分子型(d)的活性,并将结果示于图20的(b)。使用4d5_mvg4pe(r409k)_sct3a(f)(lc)和4d5_mvg4pe(r409k)_sct3a(f)、及4d5_mvg1_sct3a(df)(lc)和4d5_mvg1_sct3a(df)的组合进行比较时,所有组合均显示出大致相同程度的细胞毒性活性。
[0820]
即表明,无论抗cd3 scfv被添加于第一多肽或第二多肽的哪一个的c端,都不会对抗cd3双特异性抗体的adtc活性或adtc活性及adcc活性的协同效果中的任意一者的活性增加带来影响。
[0821]
通过实施例4中所述的方法测定表5所示的分子型(e)对于bt-20细胞的细胞毒性活性。添加4d5_sct3a_igg1(df)及4d5mut_sct3a_igg1(df),使其最终浓度分别为50nm、5nm、0.5nm。将结果示于图21。
[0822]
4d5_sct3a_igg1(df)在任何浓度下均显示高的细胞毒性活性。如上所述,4d5mut_sct3a_igg1(df)虽然不与her2结合,但在任何浓度下均显示非特异性细胞毒性活性。
[0823]
同样地测定4d5mut_scsp34_igg1(df)及4d5mut_scsp34(h05’)_igg1(df)的活性,并将与4d5mut_sct3a_igg1(df)的比较结果示于图22a~图22c。所有抗体均显示非特异性的细胞毒性活性,4d5mut_scsp34(h05’)_igg1(df)及4d5mut_scsp34_igg1(df)显示出比4d5mut_sct3a_igg1(df)更高的细胞毒性活性。
[0824]
通过biacore(ge healthcare公司)测定这些抗体对于cd3的结合性。具体而言,使用胺偶联试剂盒(ge healthcare公司),以8000ru为标准在cm5传感器芯片上固相化anti-tetra his小鼠抗体(qiagen公司)。偶合缓冲液使用10mm乙酸钠(ph4.5)。按照5μl/min用时120秒捕获溶解于hbs-ep(+)缓冲液达到5μg/ml的his标签融合人cd3d&e蛋白质(sino biological公司)作为配体。
[0825]
接着,按照30μl/min的流速添加从10μg/ml起通过5次连续稀释且每次稀释2倍后的双特异性抗体溶液作为分析物,测定各抗体与分析物的结合反应2分钟、解离反应5分钟。测定通过单循环动力学法进行。得到的感应谱,使用bia evaluation software(ge healthcare公司)进行分析,计算各抗体的动力学常数。
[0826]
将结果示于图22d~图22g。4d5mut_scsp34_igg1(df)的kd值为1.26
×
10-8
m,4d5mut_scsp34(h05’)_igg1(df)的kd值为1.08
×
10-7
m。4d5mut_sct3a_igg1(df)的kd值无法算出,但观察到感应谱上的结合性,添加最高浓度时,在6ru左右达到结合解离平衡
状态。4d5mut_scsp34(h05’)_igg1(df)在添加最高浓度时在100ru左右达到结合解离平衡状态,因此4d5mut_sct3a_igg1(df)的kd值比其更大,判断为kd》1.08
×
10-7
m。
[0827]
即显示,通过不是在fc区或恒定区的c端侧,而是在n端侧结合抗cd3 scfv,即使在使用cd3结合结构域的亲和力为kd》1.08
×
10-7
m的弱抗cd3scfv的情况下,也会产生与疾病相关抗原的特异性结合无关的不希望的非特异性毒性活性。
[0828]
(5)cd3/her2双特异性抗体的抗cd3 scfv的价数及细胞毒性活性
[0829]
通过实施例4中所述的方法测定表5所示的分子型(f)对于bt-20细胞的细胞毒性活性。作为细胞毒性活性的阳性对照,添加4d5mut_mvg1_scsp34(h05’),使其达到50nm。添加4d5mut_mvg1_sct3a(df)、dnp2_mvg1_(sct3a)2(df),使其最终浓度达到50nm、5nm、0.5nm。将结果分别示于图23的(a)及(b)。
[0830]
这些分子均不与her2结合,4d5mut_mvg1_sct3a(df)在所有浓度下均未观察到细胞毒性活性,而dnp2_mvg1_(sct3a)2(df)在50nm、5nm下观察到抗体浓度依赖性细胞毒性活性。即显示,通过使抗cd3 scfv为二价,可以产生非特异性细胞毒性活性。
[0831]
综上所述,由上述(4)及(5)的结果显示,具有adcc活性和adtc活性的一分子的抗cd3双特异性抗体协同发挥高细胞毒性活性,且为了不会产生抗cd3双特异性抗体的非特异性细胞毒性活性,需要以一价在抗cd3双特异性抗体的fc的c端侧添加cd3结合结构域。
[0832]
[实施例10]具有强亲和力的抗cd3 scfv的cd3/her2双特异性抗体的制作以及细胞毒性活性、细胞因子产生的评价
[0833]
验证抗cd3 scfv的亲和力的影响对于双特异性抗体的活性产生的影响。作为抗cd3 scfv,使用序列编号73所表示的氨基酸序列(美国专利公开第2011/0275787号说明书中所述的具有克隆i2c的vh及vl的scfv,kd值为1
×
10-8
左右),与实施例6的流程相同地制作具有表5所示的分子型(a)的结构的dnp2_mvg1_sci2c(df)及4d5_mvg1_sci2c(df)。通过实施例4中所述的方法测定这些分子(最终浓度50nm)对于bt-20细胞的细胞毒性活性。将结果示于图24a。
[0834]
如图24a所示,关于使用sct3a作为抗cd3 scfv的分子(实施例6中制作),不与her2特异性结合的dnp2_mvg1_sct3a(df)未观察到细胞毒性活性,与her2特异性结合的4d5_mvg1_sct3a(df)观察到细胞毒性活性。另一方面,使用克隆sci2c作为抗cd3 scfv的分子无论是否与her2特异性结合,在dnp2_mvg1_sci2c(df)及4d5_mvg1_sci2c(df)两者中均观察到高的细胞毒性活性。由此表明,即使是相同的分子型,在抗cd3 scfv使用克隆sci2c的情况下,也会产生非特异性细胞毒性活性。
[0835]
接着,孵育4d5_mvg1_sct3a(df)或4d5_mvg1_sci2c(df)和人pbmc,测定细胞因子产生量。具体而言,将人pbmc(1
×
106cells/100μl/管)与抗体(最终浓度100,10,1μg/ml)和x-vivo(注册商标)15无血清造血细胞培养基混合,在37℃下培养24小时。回收培养后的上清,按照实施例7中所示的方法测定细胞因子量。将结果示于图24b。
[0836]
如图24b所示,在4d5_mvg1_sct3a(df)添加组中,100μg/ml时还可见产生量提升的细胞因子,但10μg/ml、1μg/ml时则几乎未观察到。而4d5_mvg1_sci2c(df)中,从低浓度起即观察到显著产生细胞因子。以上表明,在使用亲和力强的克隆i2c作为抗cd3 scfv的情况下,产生非特异性细胞毒性活性,且显著产生细胞因子。
[0837]
[实施例11]抗cd3 scfv部分的亲和力调节后的cd3/her2双特异性抗体的制作及
活性评价
[0838]
(1)氨基酸改型的设计
[0839]
由实施例10表明,适当控制抗cd3 scfv部分的亲和力至关重要。使用实施例9(1)中所示的作为抗cd3单克隆抗体的sp34,并尝试通过向cdr导入氨基酸改型来将其亲和力降低至合适的范围。用作scfv型的scsp34的碱基序列、氨基酸序列、及cdr的氨基酸序列分别示于序列编号74、75、76~81。
[0840]
通过使用molecular operating environment 2016.08(molsis公司)的立体结构建模,由sp34的氨基酸序列制作抗体的模型结构。选出存在于表面且参与结合的可能性高的氨基酸残基作为改型候选残基,设计各种氨基酸改型cdr。图25的(a)示出导入1个氨基酸改型的设计,图25的(b)示出导入2个氨基酸残基以上改型的设计。表中的氨基酸序列中的粗体氨基酸残基为经改型的氨基酸残基。另外,通过与国际专利公开第2019/017401号说明书的实施例15(1)中所述的方法相同的流程,设计sp34的cdr改型体的人源化抗体的氨基酸序列,将其vl及vh的框架的氨基酸序列分别示于图26的(a)和(c)及(b)和(d)。
[0841]
(2)抗体的制作及亲和力测定
[0842]
与实施例6中所述的方法相同地,将(1)中设计的氨基酸序列的一部分实际制成her2/cd3双特异性抗体,并考察其结合活性。表达细胞使用expi293f细胞。亲和力测定按照实施例9(4)所示的方法进行。将结果示于图27。表明与由亲本克隆sp34制作的作为抗cd3 scfv的scsp34相比,通过导入1个氨基酸残基以上的氨基酸残基改型使亲和力降低kd=10-7
的数量级。
[0843]
(3)细胞毒性活性及杀伤细胞时的细胞因子产生
[0844]
使用fut8ko cho细胞制作具有(2)中发现的scsp34 cdr改型体scsp34(h04’)及scsp34(h05’)的her2/cd3双特异性抗体4d5_mvg1_scsp34(h04’)(df)及4d5_mvg1_scsp34(h05’)(df)。关于这些抗体,按照实施例7中所示的方法测定对于bt-20细胞的细胞毒性活性(抗体的最终浓度:400pm)及杀伤细胞时的细胞因子产生。将结果分别示于图28的(a)~(c)及图29的(a)~(d)。
[0845]
如图28的(a)~(c)所示表明,4d5_mvg1_sct3a(df)的细胞毒性活性稍高于4d5_mvg1(df),但相差不大。另一方面,4d5_mvg1_scsp34(h04’)(df)及4d5_mvg1_scsp34(h05’)(df)稍低于4d5_mvg1_scsp34(df),但具有高毒性活性。
[0846]
如图29的(a)~(d)所示表明,培养上清中的细胞因子量在4d5_mvg1_scsp34(df)时非常多,在4d5_mvg1_scsp34(h04’)(df)则显著减少,在4d5_mvg1_scsp34(h05’)(df)时更低。特别是il-2及ifn-γ,在4d5_mvg1_scsp34(h04’)(df)及4d5_mvg1_scsp34(h05’)(df)添加组中,在本次的试验条件下几乎未确认到产生。
[0847]
以上结果表明,通过向抗cd3 scfv导入氨基酸残基改型来调节亲和力,能够控制细胞毒性活性及细胞因子产生。作为亲和力调节后的抗cd3 scfv的scsp34(h04’)的氨基酸序列示于序列编号117,重链cdr1~3的氨基酸序列示于序列编号118~120,轻链cdr1~3的氨基酸序列示于序列编号121~123,vh、vl的氨基酸序列示于序列编号124、125。同样,scsp34(h05’)的氨基酸序列示于序列编号82,重链cdr1~3的氨基酸序列示于序列编号83~85,轻链cdr1~3的氨基酸序列示于序列编号86~88,vh、vl的氨基酸序列示于序列编号115、116。
[0848]
(4)非特异性细胞因子产生
[0849]
与实施例10中所述的方法相同地,测定4d5_mvg1_scsp34(df)、4d5_mvg1_scsp34(h04’)(df)及4d5_mvg1_scsp34(h05’)(df)等的非特异性细胞因子产生诱导能力。作为不诱导非特异性细胞因子产生的阴性对照,使用4d5_mvg1_sct3a(df);作为诱导非特异性细胞因子产生的阳性对照,使用4d5_mvg1_sci2c(df)。将结果示于图30。
[0850]
关于所测定的全部四种细胞因子,4d5_mvg1_scsp34(df)添加组中,从低浓度起可见显著细胞因子的产生,而4d5_mvg1_scsp34(h04’)(df)及4d5_mvg1_scsp34(h05’)(df)中,诱导细胞因子产生的能力降低,另外表明,其降低程度与抗cd3 scfv的亲和力的降低相关。
[0851]
[实施例12]从产人抗体小鼠获得抗cd3单克隆抗体、及调节亲和力后的cd3/her2双特异性抗体的制作及活性评价
[0852]
(1)对动物的免疫及抗cd3单克隆抗体产生细胞的制备
[0853]
按照40μg/只向产人抗体小鼠[ishida&lonberg,ibc’s 11
th antibody engineering,abstract 2000;ishida,i.et al.,cloning&stem cells 4,91-102(2002)及石田功(2002)试验医学20,6,846-851]投予作为免疫原的与klh蛋白质偶联的人cd3ε的n端侧非乙酰化肽:h2n-qdgneemggitqtpykvsisgttviltc-klh(序列编号146)(scrum公司),共计给药6次。仅在初次免疫时,向20μl抗原溶液中添加等量的titermax gold(titermax usa)或者sigma adjuvant system(西格玛奥德里奇公司)作为佐剂。
[0854]
最终免疫4天后解剖,以外科方式摘取淋巴结或者脾。将摘取的淋巴结或者脾均质化后,通过细胞过滤器(falcon公司),将细胞转移到试管中,离心分离并使细胞沉淀。将得到的脾细胞与红细胞除去试剂(西格玛奥德里奇公司)混合,在37℃的热水浴中反应1分钟后,用mem培养基进行稀释,然后再进行离心分离。得到的脾细胞或淋巴细胞用mem培养基清洗2次后,用于细胞融合。
[0855]
(2)抗cd3单克隆抗体产生杂交瘤的制作
[0856]
将8-氮鸟嘌呤耐药性小鼠骨髓瘤细胞株p3-u1(p3x63ag8u.1,atcc:crl-1597,european journal of immunology.6:511,1976)用rpmi1640培养基中添加10%fbs和抗生素而成的培养基进行培养,并放大培养至细胞融合时所需的细胞数(3
×
107cells以上)。将(1)中得到的小鼠脾细胞或淋巴细胞与骨髓瘤细胞按照2:1混合,并进行离心分离(1500rpm,5分钟)。松解细胞之后,使用genomone-cf(石原产业公司制)进行细胞融合。在冰上反应5分钟后,在37℃下孵育15分钟。
[0857]
然后,向克隆培养基cm-b(sekisui medical公司)中加入添加有10%fbs、hat supplement(thermo fisher scientific公司)及抗生素的培养基,以达到2.5
×
106cells/18ml的方式进行悬浮,按照每孔200μl接种于96孔板。在37℃、5%co2的条件下培养8~10天,使用其培养上清筛选下述杂交瘤,选择产生对于目标抗原显示特异性反应性的抗体的孔,利用细胞分选仪sh800(索尼公司)进行单细胞分选,从而建立产单克隆抗体杂交瘤。
[0858]
(3)抗cd3抗体产生杂交瘤的筛选
[0859]
抗cd3抗体产生杂交瘤的筛选通过流式细胞仪进行。回收在悬浮细胞培养用烧瓶中培养后的细胞,用pbs清洗2次之后,悬浮于染色缓冲液(包含0.02%edta、0.05%nan3、1%bsa的pbs),调节活细胞数达到2.0~5.0
×
105cells/50μl。人cd3表达细胞使用人t淋巴
瘤细胞株hut-78细胞(atcc tib-161),猴cd3表达细胞使用hsc-f细胞(jcrb细胞库jcrb1164),分别用cfse(西格玛奥德里奇公司,最终浓度0.2μm)、vpd450(bd biosciences公司,最终浓度1μm)染色。阴性对照细胞使用无染色的khyg-1细胞(jcrb细胞库jcrb156)。
[0860]
将以上三种细胞分别等量混合,按照50μl/孔分注于96孔板,并在冰上孵育30分钟之后,添加等量的杂交瘤上清原液并混合,在4℃下反应30分钟。离心分离细胞,并用染色缓冲液清洗1~2次,然后,添加50μl使用染色缓冲液调节为2μg/ml的alexa 647山羊抗人(goat anti-human)igg(h+l)(thermo fisher scientific公司),避光、4℃下反应30分钟。离心分离细胞,并用染色缓冲液清洗2次,然后,悬浮于染色缓冲液,用流式细胞仪cyan adp(beckman coulter公司)测定荧光强度。
[0861]
按照以上(1)~(3)的流程,建立特异性识别人cd3及食蟹猴cd3的杂交瘤克隆km14。
[0862]
(4)杂交瘤km14的抗体基因克隆
[0863]
使用qiagen rneasy plus mini kit(qiagen公司)从杂交瘤km14中提取总rna,使用smarter race 5’/3’kit(takara bio公司),通过5’race法合成1st strand cdna。使用试剂盒自带的通用引物和序列编号89、90所示的引物,进行利用primestar(注册商标)max dna polymerase(takara bio公司)的pcr,扩增具有轻链及重链可变区的碱基序列的基因片段。针对得到的pcr片段,使用新一代测序仪ion pgm(thermo fisher scientific公司)确定轻链的序列,使用sanger测序仪3130xl genetic analyzer(applied biosystems公司)确定重链的序列,获得抗cd3单克隆抗体km14的抗体基因的碱基序列。
[0864]
将编码抗cd3单克隆抗体km14的轻链可变区及重链可变区的氨基酸序列的碱基序列分别记载于序列编号91及92。另外,将这些碱基序列翻译后得到的氨基酸序列分别记载于序列编号93及94,将轻链cdr1~3及重链cdr1~3的氨基酸序列分别记载于序列编号95~97、98~100。另外,将制成scfv的sckm14的碱基序列及氨基酸序列分别示于序列编号101及102。
[0865]
(5)基于抗cd3单克隆抗体km14设计氨基酸残基改型
[0866]
使用抗cd3单克隆抗体km14的可变区制作的sckm14对于cd3的亲和力比之前的实施例中使用的抗cd3scfv即sct3a及scsp34(h05’)更强,考虑通过与adcc活性组合可能会表达非特异性细胞毒性活性。因此,按照实施例11(1)中所述的方法设计抗cd3单克隆抗体km14的cdr的氨基酸残基改型。将该设计的一部分示于图31。表中的氨基酸序列的粗体氨基酸残基表示经改型的氨基酸残基。
[0867]
(6)双特异性抗体的制作及亲和力测定
[0868]
与实施例6中所述的方法相同地,将(5)中设计的氨基酸序列实际制成双特异性抗体,并考察其结合活性。使用作为表达系统的expi293(商标)expression system(thermo fisher scientific公司)及expi293f细胞。使用本细胞表达后,虽然抗体分子添加了α1,6岩藻糖,但仍可以测得对cd3的亲和力及以adtc活性为主的细胞毒性活性、杀伤细胞时的细胞因子产生。
[0869]
亲和力测定按照实施例9(4)所示的方法进行。将结果示于图32。与由亲本抗体克隆km14制作的抗cd3 scfv即sckm14进行比较表明,通过导入1个氨基酸残基以上的氨基酸残基改型,能够使亲和力降低至kd=10-7
的数量级。
[0870]
(7)细胞毒性活性及杀伤细胞时细胞因子的产生
[0871]
与实施例3及实施例7中所述的方法相同地,测定所制作的抗体对于bt-20细胞的细胞毒性活性及杀伤细胞时的细胞因子产生量。测定细胞毒性活性时,受试物质的最终浓度为400pm,测定细胞因子产生量时,受试物质的最终浓度为10nm。细胞毒性活性比4d5_mvg1(f)强但为4d5_mvg1_sct3a(f)以下时分类为+,比4d5_mvg1_sct3a(f)强但为4d5_mvg1_scsp34(h05’)(f)以下时分类为++,比4d5_mvg1_scsp34(h05’)(f)强但为4d5_mvg1_sckm14(f)以下时分类为+++,将这些结果的概要记载于(6)中所示的图32。
[0872]
关于mut1-03、mut1-04、mut1-18、mut1-22、mut1-25、及mut1-26这六种改型体,将scfv的氨基酸序列分别记载于序列编号103~108,将细胞毒性活性及细胞因子产生量的详细结果分别示于图33的(a)及(b)以及图34的(a)及(b)。图33的(a)表明,4d5_mvg1_sckm14(mut1-25)(f)的细胞毒性活性稍低于4d5_mvg1_sct3a(f)。
[0873]
另外还表明,4d5_mvg1_sckm14(mut1-03)(f)、4d5_mvg1_sckm14(mut1-04)(f)、4d5_mvg1_sckm14(mut1-18)(f)、4d5_mvg1_sckm14(mut1-22)(f)的细胞毒性活性比4d5_mvg1_sct3a(f)更强,但低于4d5_mvg1_scsp34(h05’)(f)。另外,图33的(b)表明,4d5_mvg1_sckm14(mut1-26)(f)的活性与4d5_mvg1_scsp34(h05’)(f)相同。图中,4d5_mvg1_sckm14(f)的活性最高。
[0874]
关于作为亲本抗体的抗cd3单克隆抗体km14、及mut1-03、mut1-04、mut1-18、mut1-22、mut1-25及mut1-26这六种改型体,将vh、vl、及cdr的氨基酸序列记载于表6。
[0875]
[表6]
[0876]
km14及其改型体的vh、vl和cdr的氨基酸序列
[0877][0878]
由图34的(a)及(b)可知,4d5_mvg1_sckm14(f)杀伤细胞时表现出高的细胞因子产生。与使用原始km14的双特异性抗体相比,使用调节亲和力后的km14改型体的双特异性抗体的细胞因子产生减少。添加各种双特异性抗体时,ifn-γ及il-6的产生量与图33的(a)及(b)所示的细胞毒性活性的强度具有相关关系。
[0879]
接着,对于4d5_mvg1_sckm14(df)、4d5_mvg1_sckm14(mut1-xx)(df)(xx:03、04、18、22、25、26)、4d5_mvg1_scsp34(h05’)(df)及4d5_mvg1(df),与实施例3中所述的方法相同地,测定所制作的抗体对于bt-20细胞的细胞毒性活性。受试物质的最终浓度设为50、5、0.5nm,未添加受试物质的孔的细胞指数值设为活性0%,添加0.5%tritonx-100的孔的细胞指数值设为活性100%,计算受试物质添加后48小时及120小时时的细胞毒性活性。将受试物质添加后48小时的结果示于图35的(a),将受试物质添加后120小时的结果示于图35的(b)。
[0880]
如图35的(a)及(b)所示,无论在哪个时间,抗体浓度依赖性细胞毒性活性的强度均与图33的(a)及(b)所示的改型克隆之间的顺序相关。
[0881]
(8)通过使用96孔板的系统进行细胞毒性活性测定等
[0882]
构建并使用利用96孔板的试验系统,以针对多种受试抗体测定所制作的双特异性抗体对于bt-20细胞的细胞毒性活性及杀伤细胞时的细胞因子产生量。
[0883]
首先,将bt-20细胞用rpmi1640培养基(10%fbs,10μg/ml庆大霉素(gentamicin))制备为2.0
×
105cells/ml,并按照50μl/孔加入到96孔板。接着,将用rpmi培养基调制为4mg/ml的人免疫球蛋白(日本血液制剂机构)按照1
×
106cells/ml的细胞密度制备的来自
健康者外周血的pbmc按照50μl/孔加入到上述平板。最后按照50μl/孔加入调制为最终浓度的4倍的各种双特异性抗体,在37℃、5%co2的条件下孵育48小时。
[0884]
细胞毒性活性测定时使用检测活细胞的细胞增殖/细胞毒性测定试剂盒cell counting kit-8(同仁化学研究所)。从反应后的96孔板中除去培养上清,用pbs清洗2次后,添加显色试剂进行呈色反应,通过读板器测定450nm的吸光度。
[0885]
将仅接种细胞但未添加受试物质的孔的吸光度设为活性0%,添加0.5%tritonx-100而使细胞溶解的孔的吸光度设为活性100%,计算细胞毒性活性的值。测定细胞因子产生量时,使用孵育48小时后的培养上清,与实施例7中所述的方法相同地实施测定。
[0886]
对于4d5_mvg1_sckm14(mut1-xx)(df)(xx:03、04、18、22、25、26)、及实施例7中制作的抗cd3双特异性抗体cd3/her2 fab
×
scfv,通过上述方法测定其对于bt-20细胞的细胞毒性活性及细胞因子产生量。将细胞毒性活性的结果示于图41的(a),将细胞因子产生量的结果示于图41的(b)及(c)。
[0887]
如图41的(a)所示,在4d5_mvg1_sckm14(mut1-xx)(df)(xx:03、04、18、22、25、或26)中,添加各种双特异性抗体时的抗体浓度依赖性细胞毒性活性与图35的(a)及(b)所示的改型克隆之间的活性顺序相关。
[0888]
另外,如图41的(b)及(c)所示,这些双特异性抗体的ifn-γ及il-6的产生量与cd3/her2 fab
×
scfv相比非常少。这些双特异性抗体的细胞因子产生量与图35的(a)及(b)、图41的(a)所示的细胞毒性活性的强度、图34的(a)及(b)所示的细胞因子产生量相关。可知在岩藻糖除去型的双特异性抗体中,细胞因子产生量也与岩藻糖添加型时同样显示出较低值。
[0889]
以上(6)~(8)表明,通过利用向抗cd3单克隆抗体km14的cdr导入氨基酸残基改型将对于cd3的亲和力调节为合适的范围,能够将杀伤细胞时的细胞因子产生抑制得较低,同时发挥高得细胞毒性活性。
[0890]
[实施例13]对于各种血液癌抗原的cd3/癌抗原双特异性抗体的制作及活性评价
[0891]
(1)cd3/ccr4双特异性抗体及cd3/cd123双特异性抗体的制作
[0892]
制作具有针对血液癌抗原的抗体的可变区的双特异性抗体,并考察对于来自血液癌(血癌)的细胞株的细胞毒性活性。按照实施例6中所述的方法制作表7所示的双特异性抗体。
[0893]
作为与cc趋化因子受体(cc-chemokine receptor 4、ccr4)结合的单克隆抗体,使用抗ccr4单克隆抗体km2160的vl及vh的氨基酸序列制作cd3/ccr4双特异性抗体。
[0894]
关于cd123,为了与通用的抗cd3双特异性抗体进行比较验证,基于国际专利公开第2017/210443号的序列编号1~3的氨基酸序列,制作cd3/cd123双特异性抗体xenp14045作为比较对照。
[0895]
xenp14045是具有通过氨基酸改型缺失了对fc受体的结合活性的fc(沉默fc)的cd3/cd123双特异性抗体,仅通过adtc活性杀伤癌细胞。将xenp14045的抗cd123抗体部分的vl及vh的氨基酸序列示于序列编号109及110。使用这些序列制作具有xenp14045的抗cd123抗体部分的vh、vl的双特异性抗体cd123-2_mvg1_scsp34(h05’)(df)。
[0896]
[表7]
[0897]
所制作的双特异型抗体等的名称和序列及表达细胞
[0898][0899][0900]
(2)cd3/ccr4双特异性抗体的细胞毒性活性及细胞因子产生的评价
[0901]
使用来自ccr4阳性t细胞淋巴瘤的细胞株peer细胞(jcrb细胞库jcrb0830),通过流式细胞仪测定所制作的cd3/ccr4双特异性抗体的细胞毒性活性。通过cellvue(注册商标)claret far red fluorescent cell linker kit(西格玛奥德里奇公司)预先将peer细胞进行荧光标记,稀释至2.0
×
105cells/ml,按照50μl/孔加入96孔板。接着,按照50μl/孔
将用rpmi培养基调制为4mg/ml的人免疫球蛋白(日本血液制剂机构)按照1
×
106cells/ml的细胞密度制备的来自健康者外周血的pbmc加入到上述(平)板。
[0902]
最后按照50μl/孔加入制备为最终浓度的4倍浓度的各种双特异性抗体,在37℃、5%co2的条件下保温。添加抗体48小时后,将该平板离心,除去培养上清,以100μl/孔添加用染色缓冲液(与实施例12使用的缓冲液相同)稀释为1/1000的sytox(注册商标)死细胞染色试剂(thermo fisher scientific公司),在室温下静置5~10分钟。用染色缓冲液清洗细胞2次之后,通过流式细胞仪facs cantoii(bd biosciences公司)测定apc和bv421的流道的荧光强度。
[0903]
通过fsc、ssc选择peer细胞组分,将apc(+)、bv421(-)组分作为活细胞计数,以未添加受试物质的活细胞数为标准,计算添加各种双特异性抗体导致的活细胞数的减少比例,将其作为细胞毒性活性(%)。另外,在相同时间回收培养上清,按照实施例7中所述的方法测定细胞因子浓度。将细胞毒性活性的测定结果示于图36的(a)~(c)。
[0904]
如图36的(a)~(c)所示,在不具有效应子活性的km2160_mvg4(r409k)(f)、及具有adcc,adtc活性但不与peer细胞株结合的抗her2双特异性抗体4d5_mvg1_scsp34(h05’)(df)中,未观察到细胞毒性活性。在仅具有adcc活性的km2160_mvg1(df)、仅具有adtc活性的km2160_mvg4pe(r409k)_scxx(f)[xx:t3a,sp34(h05’)、km14(mut1-04),km14(mut1-18)]中,观察到了细胞毒性活性,km2160_mvg1(df)具有活性比km2160_mvg4pe(r409k)_scxx(f)更高的倾向。
[0905]
并且,具有adcc活性及adtc活性的km2160_mvg1_scxx(df)(xx:t3a、sp34(h05’)、km14(mut1-04)、km14(mut1-18))显示出远远大于上述抗体的细胞毒性活性。即使与具有强adcc活性,并以二价结合的igg1型抗体km2160_igg1(df)相比,km2160_mvg1_scsp34(h05’)(df)也显示较高的细胞毒性活性。
[0906]
将细胞因子(il-2及ifn-γ)产生量的测定结果示于图37的(a)及(b)。如图37的(a)所示,上述中显示高细胞毒性活性的km2160_mvg1_scxx(df)(xx:t3a、sp34(h05’)、km14(mut1-04)、km14(mut1-18))中,几乎未观察到il-2产生量增加。如图37的(b)所示,关于ifn-γ产生量,仅在最高浓度50nm时,km2160_mvg1_scsp34(h05’)(df)、km2160_mvg1_sckm14(mut1-18)(df)中可见增加。
[0907]
以上表明,即使在cd3/ccr4双特异性抗体中,通过在一分子中兼具adcc活性和adcc活性两者,也能够在发挥高细胞毒性活性的同时,不会伴有细胞因子产生显著增加。
[0908]
(3)cd3/cd123双特异性抗体的细胞毒性活性及细胞因子产生的评价
[0909]
使用cd123阳性的来自急性骨髄性白血病(aml)的细胞株molm13细胞(dsmz acc 554)及oci-aml3细胞(damz acc 582),按照实施例13(2)中所述的方法,通过流式细胞仪测定所制作的cd3/cd123双特异性抗体的细胞毒性活性及细胞因子产生。将具有cd123-1作为可变区的分子对于molm13细胞的细胞毒性活性的测定结果示于图38的(a),将细胞因子产生示于图38的(b)。
[0910]
如图38的(a)所示,用作阴性对照的4d5_mvg1_scsp34(h05’)(df)中未观察到细胞毒性活性。具有adcc活性的cd123-1_mvg1(df)、cd123-1_higg1(df)、具有adtc活性的cd123-1_mvg4(r409k)_scsp34(h05’)(df)的细胞毒性活性依次增高,并且,具有adcc活性和adtc活性两者的cd123-1_mvg1_scsp34(h05’)(df)分子的细胞毒性活性最高。另外,
scfv的序列而导入。
[0921]
并且,作为scfv,除从n端侧起vh、接头、vl依次结合之外(vh-接头-vl型,也记作hl型),还可以按照vl、接头、vh的顺序依次结合(vl-接头-vh型,也记作lh型)。
[0922]
由此,本发明中的抗cd3 scfv也并不限定于实施例1~13中制作的vh-接头-vl型,还可以按照vl-接头-vh型进行设计,两者均可以导入图42所示的氨基酸改型。
[0923]
综上所述,关于导入到本发明的抗cd3双特异性抗体的改型,将ch3部分的改型、scfv克隆名称、scfv的vh和vl的顺序、及导入到scfv的氨基酸改型制成表格(图43)。关于scsp34(h05’),同样也可以使用利用图26中所示的fr序列的氨基酸序列。举例而言,可列举序列编号159表示的vh(hv3)、序列编号160表示的vh(hv5)、及序列编号165表示的vl(lv8a)等。需要说明的是,癌抗原侧为二价的抗cd3双特异性抗体也可以用于图43的改型。
[0924]
[实施例15]将ch3区域及抗cd3 scfv区域改型后的抗cd3/her2双特异性抗体的制作、细胞毒性活性及细胞因子产生的评价
[0925]
(1)双特异性抗体的制作
[0926]
将实施例14中设计的导入了kih改型的4组fc区(kih-1~kih-4)的氨基酸序列示于序列编号147~154。另外,通过依据实施例6中所述方法的方法,制作包括具有以上四种kih改型和/或scfv的cc改型或者se改型的scfv的各种双特异性抗体。将所制作的各种双特异性抗体及其构成要素的氨基酸序列的序列编号示于表8及表9。表8中的双特异性抗体的scfv即scsp34(h05’)的氨基酸序列由序列编号82表示。
[0927]
导入了cc改型或se改型的scfv的vh及vl的具体氨基酸序列示于序列编号155~191。作为由这些vh及vl构成的抗cd3 scfv的具体氨基酸序列的具体示例,将vh-接头-vl型的序列示于序列编号192~205,vl-接头-vh型的序列示于序列编号206~217(关于未导入cc改型或se改型的序列,也示出vl-接头-vh型的序列)。
[0928]
另外,将使用这些scfv序列,按照实施例6中所述的方法所制作的抗cd3/her2双特异性抗体的具体示例及其抗cd3 scfv序列示于表9。双特异性抗体的名称中依次记载了双特异性抗体的各构成要素(所导入的kih改型的种类、抗cd3 scfv克隆名称、scfv的vh和vl的顺序、及导入scfv的改型)。
[0929]
具体而言,例如4d5_mvg1(kih-1)_scxx(yy)(zz)(df)表示fab的克隆为4d5;mvg1表示癌抗原侧为一价且fc区基于igg1;kih-1表示fc(ch3)部分的改型模式为kih-1型;scxx表示抗cd3 scfv的克隆为xx;(yy)部分中记作(lh)时表示vl-接头-vh型(未记载该部分时表示vh-接头-vl型);(zz)部分中记载(cc)时表示scfv上进行cc改型;(zz)部分中记载(se)时表示scfv上进行了se改型;(df)表示不具有岩藻糖。
[0930]
表10中按照序列编号示出了各种cd3 scfv中所含的vh、vl、重链cdr及轻链cdr的氨基酸序列。需要说明的是,无论scfv为hl型还是lh型,均适用于表10。
[0931]
[表8]
[0932]
导入了kih改型的双特异型抗体及氨基酸序列
[0933][0934]
[表9]
[0935]
所制作的各种双特异性抗体的名称及氨基酸序列
[0936][0937]
[0938]
[表10]
[0939]
各种cd3 scfv中所含的vh、vl、cdr序列的序列编号
[0940][0941]
[0942]
(2)所制作的双特异性抗体对于cd3的亲和力测定
[0943]
按照实施例9(4)的方法测定所制作的双特异性抗体对于cd3的亲和力。将结果示于图44。可知即使在向fc(ch3)导入了改型的分子、使抗cd3 scfv为vl-接头-vh型的分子及向抗cd3 scfv导入了改型的分子中,也保持有对于可溶型cd3的结合活性。另外,作为其亲和力,与实施例11-(2)及实施例12-(6)中所述的双特异性抗体相同,基本上kd值为10-7
数量级,所有的kd值为8
×
10-8
以上。
[0944]
(3)细胞毒性活性及杀伤细胞时的细胞因子产生
[0945]
按照实施例12-(8)中所述的方法测定所制作的双特异性抗体对于bt-20细胞的细胞毒性活性及杀伤细胞时的细胞因子产生量。bt-20细胞接种时的细胞密度调节为5.0
×
105cells/ml。将细胞毒性活性及细胞因子产生量的结果分别示于图45a~d及图46a~f。
[0946]
根据图45a可知,向4d5_mvg1_scsp34(h05’)(df)的fc(ch3)导入kih-1~kih-4这四种kih改型的双特异性抗体显示与改型前相同的细胞毒性活性。由此表明,kih改型的有无及其模式不会影响本发明的双特异性抗体的活性。
[0947]
根据图45b~d可知,即使在使scfv为vl-接头-vh型的双特异性抗体、向scfv导入了cc改型或se改型的双特异性抗体中,也具有比不具有scfv的4d5_mvg1(df)更高的细胞毒性活性,并保持cd3 scfv的功能。仅scm14(mut1-25)因制成lh型而活性降低。获得了多个这些活性与具有改型前的抗cd3 scfv的双特异性抗体的活性(实施例11及实施例12)相同程度的情况。在scfv为sp34(h05’)的情况下,加入cc改型之后,可见细胞毒性活性降低的倾向。
[0948]
另外,根据图45b可知,具有scsp34(h05’)作为抗cd3 scfv的双特异性抗体显示与具有scsp34(h05’)(se)、scsp34(h05’_hv3lv8a)或scsp34(h05’_hv5lv8a)的双特异性抗体相同程度的细胞毒性活性。可知具有scsp34(h05’)(cc)作为scfv的双特异性抗体显示与具有scsp34(h05’_hv3lv8a)(cc)或scsp34(h05’_hv5lv8a)(cc)的双特异性抗体相同程度的细胞毒性活性。这些双特异性抗体即使在(lh)中也显示同等的细胞毒性活性,由此可知,双特异性抗体的活性不受scfv为vh-接头-vl型还是vl-接头-vh型的影响。
[0949]
根据图46a~f可知,在向fc(ch3)导入了改型的双特异性抗体、使抗cd3 scfv为vl-接头-vh型的双特异性抗体及向抗cd3 scfv导入了改型的双特异性抗体中,将杀伤细胞时的细胞因子产生量,抑制得低于具有强亲和力的抗cd3 scfv的cd3/her2双特异性抗体(cd3/her2 fab
×
scfv)。另外,图45b~d表示的各双特异性抗体的细胞毒性活性的序列和对应图46的细胞因子产生量的序列相同。
[0950]
综上所述表明,在本发明的抗cd3双特异性抗体中,无论是否向fc(ch3)导入kih改型,无论抗cd3 scfv为vh-接头-vl型还是vl-接头-vh型,另外,无论是否向抗cd3 scfv导入cc改型或se改型,对cd3的亲和力在合适的范围的情况下,通过在一分子中兼具adtc活性和adcc活性这两者,均能够发挥高细胞毒性活性,而不导致显著产生细胞因子。
[0951]
另外,参考特定的实施方案对本发明进行了详细说明,但本领域技术人员可以理解,可以在不脱离本发明的主旨和范围下进行各种变更及变形。本技术基于2020年2月14日申请的日本专利申请(日本特愿2020-023855),通过引用援用其全体。
[0952]
[序列表自由文本]
[0953]
序列编号1:igg1型抗her2单价抗体第一多肽的ch1-hinge-fc部分的碱基序列
[0954]
序列编号2:igg1型抗her2单价抗体第一多肽的ch1-hinge-fc部分的氨基酸序列
[0955]
序列编号3:igg1型抗her2单价抗体第二多肽的cl-hinge-fc部分的碱基序列
[0956]
序列编号4:igg1型抗her2单价抗体第二多肽的cl-hinge-fc部分的氨基酸序列
[0957]
序列编号5:igg4pe(r409k)型抗her2单价抗体第一多肽的ch1-hinge-fc部分的碱基序列
[0958]
序列编号6:igg4pe(r409k)型抗her2单价抗体第一多肽的ch1-hinge-fc部分的氨基酸序列
[0959]
序列编号7:igg4pe(r409k)型抗her2单价抗体第二多肽的cl-hinge-fc部分的碱基序列
[0960]
序列编号8:igg4pe(r409k)型抗her2单价抗体第二多肽的cl-hinge-fc部分的氨基酸序列
[0961]
序列编号9:抗cd3 scfv(sct3a)的氨基酸序列
[0962]
序列编号10:dnp2_mvg4pe(r409k)(f)多肽1的氨基酸序列
[0963]
序列编号11:dnp2_mvg4pe(r409k)(f)多肽2的氨基酸序列
[0964]
序列编号12:dnp2_mvg1(df)多肽1的氨基酸序列
[0965]
序列编号13:dnp2_mvg1(df)多肽2的氨基酸序列
[0966]
序列编号14:dnp2_mvg4pe(r409k)_sct3a(f)多肽1的氨基酸序列
[0967]
序列编号15:dnp2_mvg4pe(r409k)_sct3a(f)多肽2的氨基酸序列
[0968]
序列编号16:dnp2_mvg1_sct3a(df)多肽1的氨基酸序列
[0969]
序列编号17:dnp2_mvg1_sct3a(df)多肽2的氨基酸序列
[0970]
序列编号18:dnp2_igg1(df)多肽1的氨基酸序列
[0971]
序列编号19:dnp2_igg1(df)多肽2的氨基酸序列
[0972]
序列编号20:4d5_mvg4pe(r409k)(f)多肽1的氨基酸序列
[0973]
序列编号21:4d5_mvg4pe(r409k)(f)多肽2的氨基酸序列
[0974]
序列编号22:4d5_mvg1(df)多肽1的氨基酸序列
[0975]
序列编号23:4d5_mvg1(df)多肽2的氨基酸序列
[0976]
序列编号24:4d5_mvg4pe(r409k)_sct3a(f)多肽1的氨基酸序列
[0977]
序列编号25:4d5_mvg4pe(r409k)_sct3a(f)多肽2的氨基酸序列
[0978]
序列编号26:4d5_mvg1_sct3a(df)多肽1的氨基酸序列
[0979]
序列编号27:4d5_mvg1_sct3a(df)多肽2的氨基酸序列
[0980]
序列编号28:4d5_igg1(df)多肽1的氨基酸序列
[0981]
序列编号29:4d5_igg1(df)多肽2的氨基酸序列
[0982]
序列编号30:dnp2_igg4pe(r409k)(f)多肽1的氨基酸序列
[0983]
序列编号31:dnp2_igg4pe(r409k)(f)多肽2的氨基酸序列
[0984]
序列编号32:dnp2_igg4pe(r409k)_sct3a(f)多肽1的氨基酸序列
[0985]
序列编号33:dnp2_igg4pe(r409k)_sct3a(f)多肽2的氨基酸序列
[0986]
序列编号34:dnp2_igg4pe(r409k)_sct3a(f)多肽3的氨基酸序列
[0987]
序列编号35:dnp2_igg1(df)多肽1的氨基酸序列
[0988]
序列编号36:dnp2_igg1(df)多肽2的氨基酸序列
[0989]
序列编号37:dnp2_igg1_sct3a(df)多肽1的氨基酸序列
[0990]
序列编号38:dnp2_igg1_sct3a(df)多肽2的氨基酸序列
[0991]
序列编号39:dnp2_igg1_sct3a(df)多肽3的氨基酸序列
[0992]
序列编号40:4d5_igg4pe(r409k)(f)多肽1的氨基酸序列
[0993]
序列编号41:4d5_igg4pe(r409k)(f)多肽2的氨基酸序列
[0994]
序列编号42:4d5_igg4pe(r409k)_sct3a(f)多肽1的氨基酸序列
[0995]
序列编号43:4d5_igg4pe(r409k)_sct3a(f)多肽2的氨基酸序列
[0996]
序列编号44:4d5_igg4pe(r409k)_sct3a(f)多肽3的氨基酸序列
[0997]
序列编号45:4d5_igg1_sct3a(df)多肽1的氨基酸序列
[0998]
序列编号46:4d5_igg1_sct3a(df)多肽2的氨基酸序列
[0999]
序列编号47:4d5_igg1_sct3a(df)多肽3的氨基酸序列
[1000]
序列编号48:8962_igg1(df)多肽1的氨基酸序列
[1001]
序列编号49:8962_igg1(df)多肽2的氨基酸序列
[1002]
序列编号50:8962_igg1_sct3a(df)多肽1的氨基酸序列
[1003]
序列编号51:8962_igg1_sct3a(df)多肽2的氨基酸序列
[1004]
序列编号52:8962_igg1_sct3a(df)多肽3的氨基酸序列
[1005]
序列编号53:4d5_mvg4pe(r409k)_sct3a(lc)(f)多肽1的氨基酸序列
[1006]
序列编号54:4d5_mvg4pe(r409k)_sct3a(lc)(f)多肽2的氨基酸序列
[1007]
序列编号55:4d5_mvg1_sct3a(lc)(df)多肽1的氨基酸序列
[1008]
序列编号56:4d5_mvg1_sct3a(lc)(df)多肽2的氨基酸序列
[1009]
序列编号57:4d5_sct3a_igg1(df)多肽1的氨基酸序列
[1010]
序列编号58:4d5_sct3a_igg1(df)多肽2的氨基酸序列
[1011]
序列编号59:4d5_sct3a_igg1(df)多肽3的氨基酸序列
[1012]
序列编号60:4d5mut_sct3a_igg1(df)多肽1的氨基酸序列
[1013]
序列编号61:4d5mut_sct3a_igg1(df)多肽2的氨基酸序列
[1014]
序列编号62:4d5mut_sct3a_igg1(df)多肽3的氨基酸序列
[1015]
序列编号63:4d5mut_scsp34(h05’)_igg1(df)多肽1的氨基酸序列
[1016]
序列编号64:4d5mut_scsp34(h05’)_igg1(df)多肽2的氨基酸序列
[1017]
序列编号65:4d5mut_scsp34(h05’)_igg1(df)多肽3的氨基酸序列
[1018]
序列编号66:4d5mut_scsp34_igg1(df)多肽1的氨基酸序列
[1019]
序列编号67:4d5mut_scsp34_igg1(df)多肽2的氨基酸序列
[1020]
序列编号68:4d5mut_scsp34_igg1(df)多肽3的氨基酸序列
[1021]
序列编号69:4d5mut_mvg1_sct3a(df)多肽1的氨基酸序列
[1022]
序列编号70:4d5mut_mvg1_sct3a(df)多肽2的氨基酸序列
[1023]
序列编号71:dnp2_mvg1_(sct3a)2(df)多肽1的氨基酸序列
[1024]
序列编号72:dnp2_mvg1_(sct3a)2(df)多肽2的氨基酸序列
[1025]
序列编号73:抗cd3 scfv(sci2c)的氨基酸序列
[1026]
序列编号74:抗cd3 scfv(scsp34)的碱基序列
[1027]
序列编号75:抗cd3 scfv(scsp34)的氨基酸序列
[1028]
序列编号76:抗cd3 scfv(scsp34)cdr h1的氨基酸序列
[1029]
序列编号77:抗cd3 scfv(scsp34)cdr h2的氨基酸序列
[1030]
序列编号78:抗cd3 scfv(scsp34)cdr h3的氨基酸序列
[1031]
序列编号79:抗cd3 scfv(scsp34)cdr l1的氨基酸序列
[1032]
序列编号80:抗cd3 scfv(scsp34)cdr l2的氨基酸序列
[1033]
序列编号81:抗cd3 scfv(scsp34)cdr l3的氨基酸序列
[1034]
序列编号82:抗cd3 scfv(scsp34(h05’))的氨基酸序列
[1035]
序列编号83:抗cd3 scfv(scsp34(h05’))cdr h1的氨基酸序列
[1036]
序列编号84:抗cd3 scfv(scsp34(h05’))cdr h2的氨基酸序列
[1037]
序列编号85:抗cd3 scfv(scsp34(h05’))cdr h3的氨基酸序列
[1038]
序列编号86:抗cd3 scfv(scsp34(h05’))cdr l1的氨基酸序列
[1039]
序列编号87:抗cd3 scfv(scsp34(h05’))cdr l2的氨基酸序列
[1040]
序列编号88:抗cd3 scfv(scsp34(h05’))cdr l3的氨基酸序列
[1041]
序列编号89:抗体基因克隆用引物(vl)的碱基序列
[1042]
序列编号90:抗体基因克隆用引物(vh)的碱基序列
[1043]
序列编号91:抗cd3抗体km14 vl的碱基序列
[1044]
序列编号92:抗cd3抗体km14 vh的碱基序列
[1045]
序列编号93:抗cd3抗体km14 vl的氨基酸序列
[1046]
序列编号94:抗cd3抗体km14 vh的氨基酸序列
[1047]
序列编号95:抗cd3抗体km14 cdr l1的氨基酸序列
[1048]
序列编号96:抗cd3抗体km14 cdr l2的氨基酸序列
[1049]
序列编号97:抗cd3抗体km14 cdr l3的氨基酸序列
[1050]
序列编号98:抗cd3抗体km14 cdr h1的氨基酸序列
[1051]
序列编号99:抗cd3抗体km14 cdr h2的氨基酸序列
[1052]
序列编号100:抗cd3抗体km14 cdr h3的氨基酸序列
[1053]
序列编号101:抗cd3 scfv(sckm14)的碱基序列
[1054]
序列编号102:抗cd3 scfv(sckm14)的氨基酸序列
[1055]
序列编号103:抗cd3 scfv(sckm14(mut1-03))的氨基酸序列
[1056]
序列编号104:抗cd3 scfv(sckm14(mut1-04))的氨基酸序列
[1057]
序列编号105:抗cd3 scfv(sckm14(mut1-18))的氨基酸序列
[1058]
序列编号106:抗cd3 scfv(sckm14(mut1-22))的氨基酸序列
[1059]
序列编号107:抗cd3 scfv(sckm14(mut1-25))的氨基酸序列
[1060]
序列编号108:抗cd3 scfv(sckm14(mut1-26))的氨基酸序列
[1061]
序列编号109:xenp14045抗cd123抗体vl的氨基酸序列
[1062]
序列编号110:xenp14045抗cd123抗体vh的氨基酸序列
[1063]
序列编号111:km2160抗ccr4抗体vl的氨基酸序列
[1064]
序列编号112:km2160抗ccr4抗体vh的氨基酸序列
[1065]
序列编号113:抗cd123抗体(cd123-1)vl的氨基酸序列
[1066]
序列编号114:抗cd123抗体(cd123-1)vh的氨基酸序列
[1067]
序列编号115:sp34(h05’)vh的氨基酸序列
[1068]
序列编号116:sp34(h05’)vl的氨基酸序列
[1069]
序列编号117:抗cd3 scfv(scsp34(h04’))的氨基酸序列
[1070]
序列编号118:抗cd3 scfv(scsp34(h04’))cdr h1的氨基酸序列
[1071]
序列编号119:抗cd3 scfv(scsp34(h04’))cdr h2的氨基酸序列
[1072]
序列编号120:抗cd3 scfv(scsp34(h04’))cdr h3的氨基酸序列
[1073]
序列编号121:抗cd3 scfv(scsp34(h04’))cdr l1的氨基酸序列
[1074]
序列编号122:抗cd3 scfv(scsp34(h04’))cdr l2的氨基酸序列
[1075]
序列编号123:抗cd3 scfv(scsp34(h04’))cdr l3的氨基酸序列
[1076]
序列编号124:sp34(h04’)vh的氨基酸序列
[1077]
序列编号125:sp34(h04’)vl的氨基酸序列
[1078]
序列编号126:mut1-03 vl的氨基酸序列
[1079]
序列编号127:mut1-04 vl的氨基酸序列
[1080]
序列编号128:mut1-18 vh的氨基酸序列
[1081]
序列编号129:mut1-22 vh的氨基酸序列
[1082]
序列编号130:mut1-25 vh的氨基酸序列
[1083]
序列编号131:mut1-26 vh的氨基酸序列
[1084]
序列编号132:mut1-03 cdr l1的氨基酸序列
[1085]
序列编号133:mut1-04 cdr l1的氨基酸序列
[1086]
序列编号134:mut1-18 cdr h2的氨基酸序列
[1087]
序列编号135:mut1-22 cdr h2的氨基酸序列
[1088]
序列编号136:mut1-25 cdr h2的氨基酸序列
[1089]
序列编号137:mut1-26 cdr h2的氨基酸序列
[1090]
序列编号138:人cd3蛋白质的氨基酸序列
[1091]
序列编号139:猴cd3蛋白质的氨基酸序列
[1092]
序列编号140:人cd3蛋白质胞外区的氨基酸序列
[1093]
序列编号141:人cd3蛋白质的碱基序列
[1094]
序列编号142:猴cd3蛋白质的碱基序列
[1095]
序列编号143:肽接头的氨基酸序列
[1096]
序列编号144:肽接头的氨基酸序列
[1097]
序列编号145:肽接头的氨基酸序列
[1098]
序列编号146:人cd3ε的n端侧非乙酰化肽的氨基酸序列
[1099]
序列编号147:fc部分的杵臼结构(knobs into holes)的模式1(kih-1)的氨基酸序列
[1100]
序列编号148:fc部分的杵臼结构(knobs into holes)的模式1(kih-1)的氨基酸序列
[1101]
序列编号149:fc部分的杵臼结构(knobs into holes)的模式2(kih-2)的氨基酸序列
[1102]
序列编号150:fc部分的杵臼结构(knobs into holes)的模式2(kih-2)的氨基酸
序列
[1103]
序列编号151:fc部分的杵臼结构(knobs into holes)的模式3(kih-3)的氨基酸序列
[1104]
序列编号152:fc部分的杵臼结构(knobs into holes)的模式3(kih-3)的氨基酸序列
[1105]
序列编号153:fc部分的杵臼结构(knobs into holes)的模式4(kih-4)的氨基酸序列
[1106]
序列编号154:fc部分的杵臼结构(knobs into holes)的模式4(kih-4)的氨基酸序列
[1107]
序列编号155:scsp34(h05
′
)的cc改型vh的氨基酸序列
[1108]
序列编号156:scsp34(h05
′
)的se改型vh的氨基酸序列
[1109]
序列编号157:scsp34(h05
′
)的cc改型vl的氨基酸序列
[1110]
序列编号158:scsp34(h05
′
)的se改型vl的氨基酸序列
[1111]
序列编号159:人源化scsp34(h05
′
)的vh(hv3)的氨基酸序列
[1112]
序列编号160:人源化scsp34(h05
′
)的vh(hv5)的氨基酸序列
[1113]
序列编号161:人源化scsp34(h05
′
)的cc改型vh(hv3)的氨基酸序列
[1114]
序列编号162:人源化scsp34(h05
′
)的cc改型vh(hv5)的氨基酸序列
[1115]
序列编号163:人源化scsp34(h05
′
)的se改型vh(hv3)的氨基酸序列
[1116]
序列编号164:人源化scsp34(h05
′
)的se改型vh(hv5)的氨基酸序列
[1117]
序列编号165:人源化scsp34(h05
′
)的vl(lv8a)的氨基酸序列
[1118]
序列编号166:人源化scsp34(h05
′
)的cc改型vl(lv8a)的氨基酸序列
[1119]
序列编号167:人源化scsp34(h05
′
)的se改型vl(lv8a)的氨基酸序列
[1120]
序列编号168:sckm14(mut1-03)的cc改型vh的氨基酸序列
[1121]
序列编号169:sckm14(mut1-04)的cc改型vh的氨基酸序列
[1122]
序列编号170:sckm14(mut1-18)的cc改型vh的氨基酸序列
[1123]
序列编号171:sckm14(mut1-22)的cc改型vh的氨基酸序列
[1124]
序列编号172:sckm14(mut1-25)的cc改型vh的氨基酸序列
[1125]
序列编号173:sckm14(mut1-26)的cc改型vh的氨基酸序列
[1126]
序列编号174:sckm14(mut1-03)的se改型vh的氨基酸序列
[1127]
序列编号175:sckm14(mut1-04)的se改型vh的氨基酸序列
[1128]
序列编号176:sckm14(mut1-18)的se改型vh的氨基酸序列
[1129]
序列编号177:sckm14(mut1-22)的se改型vh的氨基酸序列
[1130]
序列编号178:sckm14(mut1-25)的se改型vh的氨基酸序列
[1131]
序列编号179:sckm14(mut1-26)的se改型vh的氨基酸序列
[1132]
序列编号180:sckm14(mut1-03)的cc改型vl的氨基酸序列
[1133]
序列编号181:sckm14(mut1-04)的cc改型vl的氨基酸序列
[1134]
序列编号182:sckm14(mut1-18)的cc改型vl的氨基酸序列
[1135]
序列编号183:sckm14(mut1-22)的cc改型vl的氨基酸序列
[1136]
序列编号184:sckm14(mut1-25)的cc改型vl的氨基酸序列
[1137]
序列编号185:sckm14(mut1-26)的cc改型vl的氨基酸序列
[1138]
序列编号186:sckm14(mut1-03)的se改型vl的氨基酸序列
[1139]
序列编号187:sckm14(mut1-04)的se改型vl的氨基酸序列
[1140]
序列编号188:sckm14(mut1-18)的se改型vl的氨基酸序列
[1141]
序列编号189:sckm14(mut1-22)的se改型vl的氨基酸序列
[1142]
序列编号190:sckm14(mut1-25)的se改型vl的氨基酸序列
[1143]
序列编号191:sckm14(mut1-26)的se改型vl的氨基酸序列
[1144]
序列编号192:scsp34(h05
′
)_cc改型型的scfv全长的氨基酸序列
[1145]
序列编号193:人源化scsp34(h05
′
_hv3lv8a)_cc改型型的scfv全长的氨基酸序列
[1146]
序列编号194:人源化scsp34(h05
′
_hv5lv8a)_cc改型型的scfv全长的氨基酸序列
[1147]
序列编号195:scsp34(h05
′
)_se改型型的scfv全长的氨基酸序列
[1148]
序列编号196:sckm14(mut1-03)_cc改型型的scfv全长的氨基酸序列
[1149]
序列编号197:sckm14(mut1-04)_cc改型型的scfv全长的氨基酸序列
[1150]
序列编号198:sckm14(mut1-18)_cc改型型的scfv全长的氨基酸序列
[1151]
序列编号199:sckm14(mut1-22)_cc改型型的scfv全长的氨基酸序列
[1152]
序列编号200:sckm14(mut1-25)_cc改型型的scfv全长的氨基酸序列
[1153]
序列编号201:sckm14(mut1-26)_cc改型型的scfv全长的氨基酸序列
[1154]
序列编号202:sckm14(mut1-18)_se改型型的scfv全长的氨基酸序列
[1155]
序列编号203:sckm14(mut1-22)_se改型型的scfv全长的氨基酸序列
[1156]
序列编号204:sckm14(mut1-25)_se改型型的scfv全长的氨基酸序列
[1157]
序列编号205:sckm14(mut1-26)_se改型型的scfv全长的氨基酸序列
[1158]
序列编号206:scsp34(h05
′
)_lh型的scfv全长的氨基酸序列
[1159]
序列编号207:scsp34(h05
′
)_cc改型lh型的scfv全长的氨基酸序列
[1160]
序列编号208:人源化scsp34(h05
′
_hv3lv8a)_lh型的scfv全长的氨基酸序列
[1161]
序列编号209:人源化scsp34(h05
′
_hv5lv8a)_lh型的scfv全长的氨基酸序列
[1162]
序列编号210:人源化scsp34(h05
′
_hv3lv8a)_cc改型lh型的scfv全长的氨基酸序列
[1163]
序列编号211:人源化scsp34(h05
′
_hv5lv8a)_cc改型lh型的scfv全长的氨基酸序列
[1164]
序列编号212:sckm14(mut1-03)_lh型的scfv全长的氨基酸序列
[1165]
序列编号213:sckm14(mut1-04)_lh型的scfv全长的氨基酸序列
[1166]
序列编号214:sckm14(mut1-18)_lh型的scfv全长的氨基酸序列
[1167]
序列编号215:sckm14(mut1-22)_lh型的scfv全长的氨基酸序列
[1168]
序列编号216:sckm14(mut1-25)_lh型的scfv全长的氨基酸序列
[1169]
序列编号217:sckm14(mut1-26)_lh型的scfv全长的氨基酸序列
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1