交联透明质酸,以及其用途的制作方法
1.涉及一种交联透明质酸,以及其用途。
背景技术:
2.透明质酸(ha)为通常具有高平均分子量的线性多糖类。作为d-葡萄糖醛酸和n-乙酰-d-氨基葡萄糖的聚合物,透明质酸具有负电荷。透明质酸通常在细胞外基质和细胞间基质发现,但是也存在细胞内。如上所述,透明质酸因已存在于体内而具有生物相容性,并且,还可以容易通过使用交联剂等制备交联透明质酸凝胶。因此,自从由galderma在1990年代最初上市restylane产品后,在全世界上广泛使用利用交联透明质酸的填充物产品。
3.已知,利用交联透明质酸的填充物产品可以区分为包括单相(monophasic)的交联透明质酸或包括二相(biphasic)的交联透明质酸。单相的交联透明质酸具有高粘性模量(viscous modulus)和低弹性模量(elastic modulus)。二相的交联透明质酸具有低粘性模量和高弹性模量。单相和二相的交联透明质酸如上所述显示不同特征是因为填充物中含有的交联透明质酸是否处在可以额外承载水的状态根据相的种类不同。对于单相交联透明质酸凝胶而言,处于能够额外承载水的状态,形成为粘性和凝聚力特性高的均质的凝胶;相反,二相交联透明质酸处于无法额外承载水的状态,因此形成为水凝胶粒子形式和未被交联凝胶吸收的溶液,而不是一个均质的凝胶,因此,相比于单相交联透明质酸凝胶较低的粘性和凝聚性(cohesiveness)特性。已知,二相交联透明质酸凝胶如此制成粒子形式,因此通过注射针注入时的注入力较高,为了回复到较低的注入力,添加非交联透明质酸作为润滑剂。
4.由于单相交联透明质酸凝胶和二相交联透明质酸凝胶的不同特性,现有的交联透明质酸凝胶在体内也可以具有不同特性。例如,具有低弹性模量和高粘性模量的单相交联透明质酸凝胶具有优异的凝聚力,因此脱离注入的部位的可能性较低,但是,由于具有能够额外承载水的特性,在体内也具有要继续吸收周围水分的性质。因此,单相交联透明质酸凝胶通常注入体内时无法维持在注入初期阶段注入的原形,而其体积相比于最初注入的体积增加。相反,二相交联透明质酸具有高弹性模量和低粘性模量,因此可以以小的体积变化长期间维持注入的形态,但是,具有容易脱离注入部位或无法均匀分布在注入部位的特性。
5.wo2017-213404a1已提供同时具有单相和二相的特性的交联透明质酸,并公开经粒化的单相交联透明质酸的制备方法作为制备所述交联透明质酸的方法。根据现有技术,仍然存在对交联透明质酸,其具有类似于单相交联透明质酸凝胶的高凝聚力特性的同时类似于二相交联透明质酸无法承载水的特性;以及其用途的需要。
技术实现要素:
6.技术问题
7.一方面提供一种交联透明质酸,其具有0.1%至8%的临界应变和3n至15n的粘着力。
journal.19.375-398)。这种现象是可以从通过使用对具有相应特性的透明质酸进行交联而得的水凝胶制备的填充物中确认的。通常,目前市售的填充物为在交联后稀释为具有20mg/ml左右的浓度的交联透明质酸凝胶。假如,将具有不同致密度的交联透明质酸水凝胶稀释为具有相同浓度,各水凝胶能够承载的水分量不同,因此可以推测稀释后的形状会不同,并且,也可以推测现有已知的相(phase)的概念也起源于如上所述的水凝胶的特性。例如将交联透明质酸凝胶稀释为具有20mg/ml的浓度,若存在该的水凝胶能够额外承载的水分量(swelling capacity),由于所有溶液吸收于透明质酸交联凝胶中,因此具有无法看见除了交联凝胶之外的水分的性状(monophasic),在交联透明质酸凝胶已超过能够承载的水分量的情况下,形成为除了交联凝胶之外还存在溶液的形式,因此具有如二相的性状。那么,可以认为其中仅存在交联凝胶的性状即单相和交联凝胶和溶液同时存在的性状即二相具有不同的物质结构,且在物质结构内部作用的力也可以不同。可以认为,起因于物质内部结构的力是形成内部结构的相互作用(interaction)的总和。所述内部结构由交联透明质酸交联,或交联透明质酸凝胶和溶液组成,并且,可以从此确认的相互作用可以为分为凝胶-凝胶相互作用、凝胶-溶液相互作用、溶液-溶液相互作用。对于溶液而言,其分子流动性高于凝胶的分子流动性,且接触面积小于凝胶的接触面积,因此,可以认为相互作用的强度是凝胶-凝胶>凝胶-溶液>溶液-溶液。因此可以预测,单相性状,即其中仅存在交联凝胶的性状,可能比二相性状,即其中交联凝胶和溶液同时存在的性状,具有更大的内部相互作用力。
20.临界应变是一种测量指标,其用于在将剪切应变施加到物质时为引起包括线性粘弹性(linear viscoelastic)性质的物质内部结构的破坏所需的应变值。对于不存在多余的溶剂且仅存在透明质酸交联凝胶的单相而言,存在于物质内部的相互作用中,可以认为凝胶-凝胶相互作用是形成物质内部力的最大的力且凝胶-溶液相互作用和溶液-溶液相互作用的力会很小,可以预测,由于具有更大的相互作用,可能在更高的应变处破坏内部结构。相反,对二相交联凝胶而言,相比于透明质酸交联凝胶,溶液存在于物质外部,因此凝胶-凝胶相互作用减少,然而凝胶-溶液相互作用和溶液-溶液相互作用更多,预测内部结构的相互作用总和可能少于单相,因此可以预测在更低的应变发生内部结构的破坏。因此,相对于无法额外承载附加的水的二相交联凝胶,能够额外承载附加的水的单相交联凝胶会具有更高的临界应变值。
21.并且,作为类似现象的结果,常规的单相填充物产品具有凝聚力强的特性,对于二相填充物产品而言,可以预测其凝聚力可能相比于单相填充物的凝聚力相对弱一些。凝聚力特性是一种可以用作对生物体内注入物质凝聚的程度的预测指标的特性。为了检证凝聚力特性,基于测量二相填充物产品和单相填充物产品的凝聚力程度的指标即粘着力数值进行比较的结果,确认单相产品比二相产品显示更高的粘着力数值。
22.通过上述的事项预测生物体内的举动,对于单相产品而言,虽然相比于二相产品具有更强的凝聚力特性但能够额外地承载附加的水,以后进行生物体内注入时,体积可能更大于所注入的体积,因此难以调节体积。二相产品的优点在于因无法额外地承载附加的水而能够持续保持注入生物体内的体积,然而,由于二相产品的凝聚力低于单相产品的凝聚力,因此可以预期,二相产品的缺点可能在于不均匀地分布在注入部位且皮肤表面可能显示不自然的性状,如肿块或注入部位的凹陷。
23.已确认,根据本发明一方面的中间相的特性是均包括现有的二相和单相的所有特征。通过生物体内注入测试和较低的临界应变确认,中间相特征如现有的二相产品具有无法额外地承载水的特性。同时,通过粘着力测试确认所述中间相产品也具有高凝聚力特性,即现有的单相产品的特征。因此,在本说明书中,将中间相特性定义为临界应变和粘着率的两种参数的组合。
24.所述交联透明质酸可以具有0.1%至8.0%,例如0.5%至7.0%、1.0%至7.0%、或3.0%至7.0%的临界应变,和3n至15n,例如4n至15n、或4n至12n的粘着力。
25.并且,所述交联透明质酸的弹性模量(g')可以为400pa至2000pa,例如,500pa至1900pa、600pa至1800pa、或600pa至1700pa。
26.并且,所述交联透明质酸的粘性模量(g”)可以为100pa至600pa,例如可以为120pa至500pa、150pa至450pa、或160pa至350pa。
27.并且,所述交联透明质酸的压缩力(compression)可以为15n
·
s至100n
·
s,例如,20n
·
s至90n
·
s、25n
·
s至80n
·
s,或30n
·
s至75n
·
s。
28.并且,所述交联透明质酸的平均注入力可以为1n至50n,例如,3n至45n、4n至40n,或7n至35n。所述平均注入力可以是指通过施用27号(gauge;g)、13mm长度的针以12mm/min速度测量填充于1ml玻璃注射器的情况下的平均注入力。
29.并且,所述交联透明质酸的平均粒径(μm)可以为30μm至900μm,例如50μm至750μm、70μm至650μm、100μm至600μm、150μm至500μm、200μm至450μm、250μm至400μm,或250μm至350μm。
30.根据一个具体实施例中,所述交联透明质酸可以具有0.1%至8.0%的临界应变和3n至15n的粘着力,且可以满足
ⅰ
)弹性模量(g')为400pa至2000pa、
ⅱ
)粘性模量(g”)为100pa至600pa、
ⅲ
)压缩力为15n
·
s至100n
·
s;
ⅳ
)注入力为1n至50n、v)平均粒径(μm)为30μm至900μm中的1个、2个、3个、4个、或5个条件。
31.在另一具体实施例中,所述交联透明质酸可以具有0.5%至7.0%的临界应变和3n至15n的粘着力,且可以满足
ⅰ
)弹性模量(g')为500pa至1900pa、
ⅱ
)粘性模量(g”)为120pa至500pa、
ⅲ
)压缩力为20n
·
s至90n
·
s、
ⅳ
)注入力为3n至45n、v)平均粒径(μm)为50μm至750μm中的1个、2个、3个、4个,或5个条件。
32.在另一具体实施例中,所述透明质酸交联物可以具有1.0%至7.0%的临界应变、4n至15n的粘着力、600pa至1800pa的弹性模量(g')、150pa至450pa的粘性模量、25n
·
s至80n
·
s的压缩力、5n至40n的注入力、以及70μm至650μm的平均粒径(μm)。
33.在另一具体实施例中,所述交联透明质酸可以具有3.0%至7.0%的临界应变、4n至12n的粘着力、600pa至1700pa的弹性模量(g')、160pa至350pa的粘性模量(g”)、30n
·
s至75n
·
s的压缩力、7n至35n的注入力、以及100μm至600μm的平均粒径。
34.对于所述交联透明质酸,交联之前的所述透明质酸可以是源自任意的来源的。交联前的所述透明质酸例如可以是源自非动物体的。交联前的所述透明质酸可以是源自细菌的。所述细菌可以是源自链球菌属的。所述链球菌属细菌可以是马链球菌(streptococcus equi)、化脓性链球菌(s.pyogenes)或兽疫链球菌(s.zooepidemicus)。交联之前的所述透明质酸可以是商购的。交联前所述透明质酸的特性粘度(intrinsic viscosity)可以是从1.0m3/kg至4.0m3/kg。
35.所述交联透明质酸可以是通过一种方法制备的,所述方法包括通过孵化包括交联剂和透明质酸的反应混合物来进行交联反应的步骤。所述交联剂可以具有多官能团。所述交联剂可以具有双官能环氧基团。所述具有双官能环氧基团的交联剂可以包括选自由1,4-丁二醇缩水甘油醚、聚(乙二醇)二缩水甘油醚、聚(丙二醇)二缩水甘油醚、聚(丁二醇)二缩水甘油醚、聚甘油聚缩水甘油醚、甘油二缩水甘油醚、三乙烯二缩水甘油醚、三羟甲基丙烷三缩水甘油醚、乙烯二缩水甘油醚、新戊二醇二缩水甘油醚、以及1,6-己二醇二缩水甘油醚组成的组中的至少一种。
36.所述交联透明质酸可以具有0.5%至7%的交联率。所述交联率例如可以是0.6%至7%、0.7%至7%、0.8%至7%、0.9%至7%、1.0%至7%、1.5%至7%、2.0%至7%、2.5%至7%、3.0%至7%、1.5%至4.5%、3.0%至4.0%、3.2%至4.0%、3.4%至3.8%、1.0%至4.0%,或1.5%至4.0%。
37.在本说明书中,术语“交联率(cross-link rate,%)”是指共价键结合的透明质酸二糖重复单位对每透明质酸的二糖重复单位的比率。所述二糖重复单位由d-葡萄糖醛酸和n-乙酰氨基葡萄糖组成。可以根据公知的方法确认交联率。例如可以通过离子交换色谱法(ion exchange chromatography,iec)或nmr来确认交联率。离子交换色谱法是一种在固定相和流动相之间进行可逆性离子交换,并使用试料离子的亲和性对固定相的差异来进行分离和分析的方法。在使用ice的情况下,交联率的计算式如下。
38.交联率(%)=σ(峰值面积
×
透明质酸的二糖重复单位的数
×
经交联的二糖重复单位的比率)
×
100/σ(峰值面积
×
透明质酸的二糖重复单位的数)
39.所述透明质酸交联物可以具有中间相(semiphasic)特性,而既不是单相(monophasic)也不是二相(biphasic)。所述透明质酸交联物可以具有类似于单相的交联透明质酸交联物的高凝聚力特性,同时可以具有类似于二相的交联透明质酸的无法额外地承载水的特性。
40.另一方面提供包含所述交联透明质酸的填充剂(filler)组合物。
41.在所述组合物中,所述交联透明质酸凝胶的最终浓度可以为至少10mg/ml、至少15mg/ml、至少18mg/ml、或至少19mg/ml。例如,所述交联透明质酸的浓度可以为10mg/ml至30mg/ml、12mg/ml至28mg/ml、14mg/ml至26mg/ml、16mg/ml至24mg/ml、18mg/ml至22mg/ml、或约20mg/ml。
42.所述组合物可以用于修复个体组织。
43.对于所述组合物,所述个体可以是哺乳动物。所述哺乳动物可以包括人、狗、猫、牛、猪、大鼠,或羊。
44.所述组合物可以不进一步包括非交联透明质酸。“进一步包括”非交联透明质酸是指将非交联透明质酸通过人为的方式附加至交联透明质酸,相反,不进一步包括非交联透明质酸是指不将非交联透明质酸附加至交联透明质酸。
45.所述组合物可以进一步包含麻醉剂。所述麻醉剂可以是局部麻醉剂。所述麻醉剂可以选自由氨布卡因(ambucaine)、阿莫拉酮(amolanone)、异戊卡因(amylocaine)、丁氧普鲁卡因(benoxinate)、苯佐卡因(benzocaine)、贝托卡因(betoxycaine)、苯柳胺酯(biphenamine)、布比卡因(bupivacaine)、布大卡因(butacaine)、氨苯丁酯(butamben)、布坦卡因(butanilicaine)、丁胺卡因(butethamine)、丁托西卡因(butoxycaine)、卡铁卡因
(carticaine)、氯普鲁卡因(chloroprocaine)、可卡乙碱(cocaethylene)、可卡因(cocaine)、环甲卡因(cyclomethycaine)、地布卡因(dibucaine)、二甲异喹(dimethysoquin)、二甲卡因(dimethocaine)、地哌冬(diperodon)、双环胺(dycyclonine)、芽子定(ecgonidine)、芽子碱(ecgonine)、氯乙烷(ethyl chloride)、依替卡因(etidocaine)、β-优卡因(beta-eucaine)、尤普罗辛(euprocin)、苯醇胺(fenalcomine)、福莫卡因(formocaine)、己卡因(hexylcaine)、羟丁卡因(hydroxytetracaine)、对氨基苯甲酸异丁酯(isobutyl paminobenzoate)、甲磺酸亮氨卡因(leucinocaine mesylate)、左沙屈尔(levoxadrol)、利多卡因(lidocaine)、甲哌卡因(mepivacaine)、甲丙卡因(meprylcaine)、美布卡因(metabutoxycaine)、氯甲烷(methyl chloride)、麦替卡因(myrtecaine)、对氨苯酸戊胺乙酯(naepaine)、奥他卡因(octacaine)、原卡因(orthocaine)、羟乙卡因(oxethazaine)、对乙氧卡因(parethoxycaine)、芬那卡因(phenacaine)、苯酚(phenol)、哔哌卡因(piperocaine)、吡啶卡因(piridocaine)、聚多卡醇(polidocanol)、普拉莫星(pramoxine)、丙胺卡因(prilocaine)、普鲁卡因(procaine)、普鲁派奴卡因(propanocaine)、丙对卡因(proparacaine)、丙哌卡因(propipocaine)、丙氧卡因(propoxycaine)、伪可卡因(psuedococaine)、吡咯卡因(pyrrocaine)、罗哌卡因(ropivacaine)、水杨醇(salicyl alcohol)、丁卡因(tetracaine)、托利卡因(tolycaine)、三甲卡因(trimecaine)、佐拉敏(zolamine),以及其盐组成的组中的至少一种,但不限于此。
46.所述组合物可以不包含选自由蛋白、透明质酸以外的糖胺聚糖以及羟丙基甲基纤维素组成的组中的药学上活性物质。
47.所述组合物可以填充在注射器中。
48.所述组合物可以用于面部整形、皱纹改善、面部轮廓手术、乳房整形、隆胸手术、生殖器扩大、龟头扩大、尿失禁治疗,以及关节炎治疗组成的组中的至少一种。
49.对于所述组合物,在使用27号(gauge;g)、13mm的针以12mm/min速度测量填充于1ml注射器中的所述组合物的情况下,注入力可以小于或等于50n。所述注入力例如可以为1n至50n、3n至45n、4n至40n、5n至35n。
50.所述组合物可以进一步包含药学上可接受的载体、赋形剂以及稀释剂。所述载体例如可以包括水或缓冲液。所述缓冲液可以使溶液的ph几乎不随着所述组合物组分的添加而改变。所述组合物可以是水性液体组合物。所述组合物可以是经水性缓冲的组合物。所述经水性缓冲的组合物的ph可以属于生物ph范围内,例如,约6.0与8.0之间。可以通过添加诸如hcl、na2co3或naoh的适当的酸或碱来调整所述ph。根据一个具体例子,所述经水性缓冲的组合物可以包括磷酸缓冲溶液(phosphate buffered saline:pbs)。在其它具体例子中,所述经水性缓冲的组合物可以包括三(羟甲基)氨基甲烷(tris(hydroxymethyl)aminomethane;tris)。在一些具体例子中,可以添加注入氯化钠、氯化钙、以及氯化钾的附加溶质(solutes)以调节渗透压(osmolarity)浓度和离子浓度。
51.所述组合物是将所述交联透明质酸悬浮在水性溶剂中而获得的。所述水性溶剂可以是诸如pbs的缓冲液、水或盐水。所述组合物可以是经过灭菌的。
52.所述组合物可以是在容器中包括的。所述容器可以是注射器。所述组合物可以在使用前预先填充在注射器内。所述组合物可以通过使用预先填充的注射器施用的。
53.另一方面提供包括所述组合物的装置。所述装置可以是经过预先填充的注射器。所述装置可以是经过灭菌的。
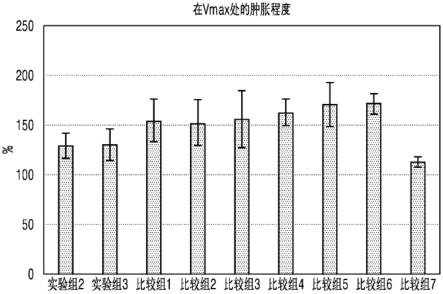
54.另一方面提供包括所述预先填充的注射器的试剂盒。所述试剂盒可以包括一种说明书,所述说明书包括关于所述组合物施用的信息。
55.另一方面提供一种填充个体组织的方法,所述方法包括将治疗学上有效量的所述组合物施用于个体的步骤。所述方法可以用于增加、修复或强化个体中的组织或用于填充体腔。从这角度来看,体积增大(volumne augmentation)可以是由形成填充剂组合物的成分发生的、持续长期间的体积增加。形成所述填充剂组合物的成分可以是不经过迅速的扩散的成分。在所述方法中,“组合物”和“个体”如上所述。所述施用可以是指对皮肤例如真皮内或关节腔内进行施用。在所述方法中,所述施用可以通过注射器,例如预先填充的注射器施用于皮肤,例如真皮内。在所述方法中,所述施用可以是指每次施用0.1ml至50ml、0.5ml至30ml、0.5ml至20ml、0.5ml至15ml,或0.8ml至12ml。在所述方法中,所述施用可以是将所述组合物施用至少每3个月一次、至少每4个月一次、至少每5个月一次、至少每6个月一次、至少每12个月一次,或至少每18个月一次。
56.有益效果
57.提供一种交联透明质酸,其具有类似于单相交联透明质酸凝胶的高凝聚力特性的同时具有类似于二相交联透明质酸凝胶的无法承载水的特性;以及其用途。
附图说明
58.图1为示出将交联透明质酸注入无毛小鼠中,并相对于初期注入部位的体积显示经测量的注入部位最大体积的图。
59.图2为将交联透明质酸试剂注入无毛小鼠中,并根据注入后经过的时间显示所注入的透明质酸凝胶的体积的图。
具体实施方式
60.下面,参照实施例进一步详细描述本发明。然而,这些实施例仅用于示例性地描述本发明,本发明的范围并不限于这些实施例。
61.材料和方法
62.在以下实施例中使用下面的材料和方法。
63.(1)材料:交联透明质酸产品
64.使用如下的市售的交联透明质酸产品作为比较组。购买了allergan社的juvederm voluma lidocaine、韩美药品社的gugupill、以及medytox社的neuramis volume lidocaine作为单相透明质酸(monophasic hyaluronic acid)。并且,购买galderma社的restylane lyft lidocaine作为二相透明质酸(biphasic hyaluronic acid)。
65.(2)方法
66.(2.1)临界应变(critical strain)测量方法
67.通过应变扫描测试(strain-sweep test)测量了临界应变。具体地,驱动了dhr-2流变仪(ta instruments社)。在应变扫描测试中,将机器温度设定为25℃且安装直径25mm的几何体来执行纠正(calibration)。将适量的试料加载于所述机器的珀尔贴板上部和下
部几何体之间的中央部分。超载(over-loading)充分分量的试料以防止试料量不够,并加载了适量的试料,使得即使割掉几何体下部面积外面的剩余物也不会沾在几何体侧面和上面。使几何体以设定的间隔下降后确认试料是否稳定地填充在几何体下方,然后,割掉并除去(trimming)几何体外部的残留的试料。然后,测量了在使用几何体向试料施加0.1%至1000%的应变(strain)时在各应变处测量的弹性模量值。以应变%(strain%)的对数作为x轴,以弹性模量作为y轴,并绘制半对数图。将绘制该图值微分而获得的图表时产生的具有最小值y的应变%值中的最低应变%定义为临界应变。
68.(2.2)粘着力测量方法
69.粘着力测量如下。驱动了dhr-2流变仪(ta instruments)。在粘着力测试中,将机器温度设定为25℃并安装直径40mm的几何体来执行纠正。将适量的试料加载于所述机器的珀尔贴板上部和下部几何体之间的中央部分。超载充分分量的试料以防止试料量不够,并加载了不会沾在几何体侧面和上面的适量的试料。使几何体以设定的间隔下降后确认试料是否稳定地填充在几何体下方,然后,割掉并除去几何体外部的残余的试料。然后,测量在将几何体间隔设定为1000μm并在下部珀尔贴板上在垂直轴方向上以100.0μm/s的恒定速度牵引180秒时施加到几何体的力。由于介于几何体与珀尔贴之间的试料的粘着力,在初期试料脱离时会测量最大的力,并将该力定义为粘着力。
70.(2.3)粘弹性测量方法
71.驱动了dhr-2流变仪(ta instruments)。在粘弹性测试中,将机器温度设定为25℃,并安装直径40mm的几何体执行纠正。将适量的试料加载于所述机器的珀尔贴板上部和下部几何体之间的中央部分。超载充分分量的试料以防止试料量不够,并加载了不会沾在几何体侧面和上面的适量的试料。使几何体以设定的间隔下降后确认试料是否填充在几何体下方,然后,割掉并除去几何体外部的残余的试料。然后,通过使用几何体的一定应变根据特定频率(frequency)将剪切应变(shear strain)周期性地施加到试料,并在由此获得弹性模量(modulus)值中约0.1hz频率处的储存模量(storage modulus)和损失模量(loss modulus)分别定义为弹性和粘性。
72.(2.4)注入力测量方法
73.对于注入力测量,使用mecmesin的multitest 2.5-i universal testing machine来进行测量。作为用于测量施加到机器的力的负载单元(load cell),安装并使用适当的负载单元,其具有高于注入力测量范围的容忍值。在机器的负载单元下方设置容纳有试料的注射器,并将27g 1/2”注射针结合至所述注射器。在注射器上设置具有平坦的末端部的推杆,使得负载单元施加力时可以均匀地施加力。在将距离调节至负载单元部分接触推杆末端部分直前,并将以12mm/min的速度使用负载单元按压推杆部分,并测量所施加的力。对于测量值的初期部分和结束部分而言,试料流入注射针时产生的压力值低于在使用注射器注入时所需的压力。并且,在注入物质的注入几乎结束时,可以发生即使没有试料也可以继续施加力的情况,此时,所施加的力是与试料的注入力无关的。因此,将除外与试料流入注射针的部分和注入几乎结束的部分对应的值而测量的值,即在除外初期注入力和末期注入力值的在注射器填充液的中间部分测量的注入力值的平均定义为注入力。
74.(2.5)压缩力测量方法
75.驱动了dhr-2流变仪机器(ta instruments)。在压缩力测试中,将机器温度设定为
25℃并安装直径25mm的几何体来执行纠正。将1ml的试料加载于所述机器的珀尔贴板上部和下部几何体之间的中央部分。在使几何体以设定的间隔下降后,使几何体低速旋转并将试料调节为相对于几何体位于中央。然后,使几何体以13.33μm/s的一定速度从2500μm下降至900μm位置的同时测量了施加到几何体的力。对于压缩力而言,将绘制以从开始测试测量至结束的力为y轴、以移动时间为x轴的图表时相当于图表的积分值,即相当于图表下部面积值的值定义为压缩力。
76.(2.6)粒度测量方法
77.通过使用microtrac社的particle size analyzer s3500执行粒度测量。通过将试料添加至溶剂中,并通过激光折射分析法执行粒度测量。通过使用蒸馏水测量溶剂。执行前,使用蒸馏水充分洗涤试料投入口,将蒸馏水的折射率和试料的折射率分别输入为1.33和1.37,将试料的类型设定为透明且具有不规矩的性状的粒子。测量前,将蒸馏水填充于机器的试料投入口,将试料投入管子等后加入过量的蒸馏水进行稀释,并使用vortex等充分分散试料后将其投入机器中来实施测量。使用测量结果值中的平均粒度(d50)作为数据。
78.实施例:制备交联透明质酸并确认物性
79.1.制备交联透明质酸
80.如下制备了具有0.1%至8%的临界应变和3n至15n的粘着力的交联透明质酸(以下,称之“实验组”)。
81.实验组1:
82.首先,制备了1%(w/w)的naoh溶液。将5g的透明质酸钠(iv1.7至1.9)与所制备的1%氢氧化钠溶液混合至14.50%(w/w)并进行搅拌,并充分溶解。在此,iv是指特性粘度(intrinsic viscosity)。将0.528g的丁二醇二缩水甘油醚(butanediol diglycidyl ether,bdde)(sigma-aldrich)投入该溶液中进行附加搅拌来促进混合,引出所述溶液并在25℃下执行交联反应18小时来制备了交联透明质酸凝胶。接着,将所制得的交联凝胶投入渗析膜并进行密封,并使用1mol/kg的氯化钠水溶液和1
×
pbs水溶液作为渗析液进行了渗析。析结束后,考虑和计算损失率来计算出已结束交联和渗析的透明质酸钠的重量,并使用1
×
pbs来进行含量纠正使得透明质酸钠的总浓度为2%(w/w),此时,对于盐酸利多卡因,进行含量纠正至0.3%(w/w)。结果,制备了含有2%(w/w)的交联透明质酸和0.3%的利多卡因的pbs溶液。将所制得的含交联透明质酸的溶液1ml填充在玻璃注射器中,并实施了高温蒸汽灭菌。
83.实验组2:
84.首先,制备了1%(w/w)naoh溶液。将5g的透明质酸钠(iv 1.7至1.9)与所制备的1%氢氧化钠溶液混合至14.0%(w/w)并进行搅拌,并溶解6小时。向所述溶液添加0.428g的bdde(sigma-aldrich)并进行附加搅拌10分钟以促进混合,引出所述混合物并在25℃下放置18小时并进行交联反应来制备了交联透明质酸凝胶。接着,与实验组相同地进行渗析和含量纠正,并将所述交联透明质酸凝胶填充在玻璃注射器中。
85.实验组3:
86.首先,制备了1%(w/w)naoh溶液。将5g的透明质酸钠(iv 1.7至1.9)与所制备的1%氢氧化钠溶液混合至15.0%(w/w)并进行搅拌,并溶解6小时。向所述溶液添加0.251g的bdde(sigma-aldrich)并进行附加搅拌10分钟以促进混合,引出所述混合物并在40℃下放
置18小时并进行交联反应来制备了交联透明质酸凝胶。接着,与实验组1相同地实施渗析和含量纠正,并将所述交联透明质酸凝胶填充在玻璃注射器中。
87.比较组1至3:
88.除了根据以下表1的记载设定透明质酸溶解浓度、bdde添加量、交联温度和交联时间之外,按照实验组1相同的方法制备了比较组1至3的交联透明质酸。表1表示用于制备实验组1至3和比较组1至3的交联透明质酸的物质和条件。bdde浓度是指相对于所投入的透明质酸(hyaluronic acid,ha)单体(monomer)的摩尔数的所投入的bdde摩尔的%。
89.[表1]
[0090]
名称透明质酸(%,w/w)bdde(摩尔%)温度(℃)时间(小时)实验组114.5212518实验组214.0172518实验组315.0104018比较组112.0222518比较组211.0212518比较组311.0162518
[0091]
对于该实验组和比较组的制备样本实施了基于触感的官能评估。换言之,通过触感确认了所制备的物质具有哪种相,并且可以通过触感明确地确认,在单相中触摸不到粒子等,在二相中触摸到像沙粒的粒子。在官能评价中,实验组1至3的交联透明质酸具有既不是单相也不是二相的凝胶性状。相反,通过官能评估确认,比较组1至3中的交联透明质酸凝胶具有单相。
[0092]
比较组4至7:
[0093]
作为比较组4至6,分别使用了单相的交联透明质酸,即allergan社的juvederm voluma lidocaine(比较组4)、韩美药品社的九九丸(比较组5)、以及medytox社的neuramis volume lidocaine(比较组6)。并且,使用galderma社的restylane lyft lidocaine(比较组7)即二相的交联透明质酸作为比较组7。
[0094]
2.分析所制备的交联透明质酸的物理特性
[0095]
分析了在第一节中所制备的交联透明质酸凝胶的物理特性。对所制备的交联透明质酸实验组1至3、以及比较组1至7测量的物性如表2所示。
[0096]
[表2]
[0097][0098]
在表2中,除非另有提及,注入力是指在使用27g的13mm注射针的情况下的注入力。
[0099]
3.测量将所制备的交联透明质酸应用于动物时的上升和体积增加的影响:上升和体积增加测试(lifting and volumizing test)
[0100]
将实验组2和3、比较组1至7的交联透明质酸和作为阴性比较组的盐水(saline)注入动物中,并测量注入部位的高度、最大长度、以及体积。作为动物,使用了总84只的六周龄雌性无毛小鼠(skh1-hr)(18.0g至24.0g,平均22.3g)。对于一个试料使用了8只,对于作为比较组的盐水使用了4只。
[0101]
具体地,将所述交联透明质酸试料0.1ml分别使用玻璃注射器施用于所述每一只无毛小鼠的一个背侧区域部位(dorsal region site)。在注入后,按照指定的日使用primose装置(primos 5.8e(canfield scientific inc,nj,usa))来测量了注入部位的高度、注入物质的最大长度和体积。并且,对注入部位进行肉眼观察和拍摄。根据肉眼观察结果,比较组1至6中出现较大的肿胀(swelling)高度。
[0102]
图1为示出将交联透明质酸注入无毛小鼠中,并相对于初期注入部位的体积显示经测量的注入部位最大体积的图。已确认,如图1所示,在实验组2、3和比较组7中的体积增加少于比较组1、2、3、4以及5。这表示实验组2和3中的交联透明质酸凝胶在注入部位引起较少的肿胀(swelling)。
[0103]
图2示出将透明质酸交联凝胶注入皮内后观察体积变化至180日的结果。如图2所示,对于单相而言,在注入后第四周,比较组2和5中的交联透明质酸的体积相对于初期体积分别增加了168%和143%。如图2所示,在注入后第180天,实验组2和3中的交联透明质酸的体积大于或等于其它比较组和比较组中的交联透明质酸的体积。这表示,实验组2和3的交联透明质酸在经过180天的期间的损失相对少。即,与其它比较组和比较组相比,实验组2和3中的交联透明质酸在体内具有更优异的续性。
[0104]
总之,确认实验组2和3中注入后肿胀(swelling)现象少于比较组1至6,因此注入后体积变化较小,到注入后180天的体积等于比较组1至6,且优于比较组7,由此确认具有优异的生物体内持续性。
[0105]
4.测量将所制备的交联透明质酸凝胶应用于动物时的刺激性:刺激测试(irritation test)
[0106]
经实验组2和3、比较组1至7的交联透明质酸和作为阴性比较组的盐水(saline)注入动物中,并在注入部位测量红斑和浮肿来确认刺激引发程度。根据iso109993-10“tests for irritation and skin sensitization”中记载的指南委托(株)knotus(韩国)来执行试验。对于动物,根据iso10993-10选择新西兰白兔(new zealand white rabbit),并使用了总12只。对一个试料使用了三只动物。具体地,将所述交联透明质酸试料200μl分别施用于所述兔子中每一只的背侧区域部位(dorsal region site)皮下的5处并观察45天。注入后,通过根据所述指南评价红斑和浮肿来赋予分数。将各试料的分数与使用盐水的比较组的评价分数之间的差异积累起来,并计算出对合算值的各部位(site)的平均。结果,在施用试料的所有动物中没有观察到红斑。表3是表示将交联透明质酸试料施用于兔子后在3天和45天后观察的浮肿分数的表。在施用试料的动物中,施用组之间的浮肿分数(erythema score)没有显示统计上显著的差异。
[0107]
[表3]
[0108]
试料第三天浮肿分数实验组20.6实验组30.9比较组11.3比较组21.3比较组31.8比较组41.1比较组50.8比较组60.9比较组71.1盐水0.0
[0109]
根据所述iso109993-10指南,根据测量至第3天的红斑和浮肿形成的结果,实验组2、3和比较组5、6的试料符合所述指南的标准。因此,根据注入第3天的浮肿形成结果,实验组2和3中的试料显示等于或优于其它比较组中的试料的效果。
[0110]
在所述实施例中确认,与其它比较组的交联透明质酸凝胶相比,实验组2和3的交联透明质酸凝胶在注入动物时在体积上升抵抗性和低刺激性方面具有更优异的特性。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1