(1R,3S)-3-(5-氰基-4-苯基-1,3-噻唑-2-基氨基甲酰基)环戊烷羧酸的共晶的制作方法
of pharmaceutical co-crystals guidance for industry,february 2018,http://www.fda.gov/drugs/guidancecomplianceregulatoryinformation/guidances/default.htm)。
10.共晶形成可以改变数个性质,诸如熔点(其被认为是需要考虑的首要物理化学性质之一)、储存稳定性、溶解度、溶解速率、吸湿性和生物利用度等。(izutsu,k et al,characterization and quality control of pharmaceutical cocrystals,chem.pharm.bull.64,1421
–
1430(2016))。
11.鉴于大量药学上可接受的共形成物的可用性以及药学上可接受的共形成物的性质与相应共晶的最终性质之间缺乏相关性,找到合适的共晶是一个困难的过程,并且其结果是先验的,不可预测的。
12.需要提供改善(1r,3s)-3-(5-氰基-4-苯基-1,3-噻唑-2-基氨基甲酰基)环戊烷羧酸的物理化学和药物性质的共晶,特别是改善吸湿性而不会对其他重要参数诸如活性化合物的结晶度或生物利用度产生不利影响的共晶。特别地,有必要在药物储存的通常条件下(《75%rh),降低(1r,3s)-3-(5-氰基-4-苯基-1,3-噻唑-2-基氨基甲酰基)环戊烷羧酸的吸湿性,同时确保其良好水平的稳定性和溶解性,以获得所述酸的生产、处理、储存和药物性质的改善。
技术实现要素:
13.本发明提供了(1r,3s)-3-(5-氰基-4-苯基-1,3-噻唑-2-基氨基甲酰基)环戊烷羧酸的共晶。
14.在尝试获得(1r,3s)-3-(5-氰基-4-苯基-1,3-噻唑-2-基氨基甲酰基)环戊烷羧酸与大量潜在晶体形成化合物的共晶后,本发明人惊奇地发现龙胆酸、尿素和烟酰胺相对于游离酸形式的化合物表现出特别好的吸湿性和生物利用度性质以及更高的熔点。上述性质的改善意味着所述化合物的生产、处理和储存过程以及所述产品的药物特性的优点。具体而言,本发明的共晶物体显示了口服生物利用度的显著改善,这将使得能够施用显著较低剂量的化合物以达到目标治疗水平。
15.就本发明的主题而言,已知现有技术中没有涉及属于专利申请wo 2009/044250 a1中公开的化合物家族的化合物的任何共晶的制备和使用的公开内容,更不用说(1r,3s)-3-(5-氰基-4-苯基-1,3-噻唑-2-基氨基甲酰基)环戊烷羧酸的共晶,甚至更不用说与龙胆酸、尿素和烟酰胺的共晶。
16.因此,在第一方面,本发明涉及(1r,3s)-3-(5-氰基-4-苯基-1,3-噻唑-2-基氨基甲酰基)环戊烷羧酸与选自龙胆酸、尿素和烟酰胺的共晶形成化合物的共晶。
17.在第二方面,本发明涉及用于制备第一方面中限定的共晶的方法,其包括:
18.a)在液体存在下使(1r,3s)-3-(5-氰基-4-苯基-1,3-噻唑-2-基氨基甲酰基)环戊烷羧酸与选自龙胆酸、尿素和烟酰胺的共晶形成化合物接触,并且
19.b)分离所得的共晶。
20.在第三方面,本发明涉及包含根据第一方面的共晶和一种或多种治疗剂的组合产品,该治疗剂选自血管紧张素转化酶抑制剂(ace抑制剂)、血管紧张素受体拮抗剂、他汀类药物、β-阻滞剂、钙拮抗剂和利尿剂。
21.在第四方面,本发明涉及包含根据第一方面的共晶或根据第三方面的组合产品以及药学上可接受的赋形剂的药物组合物。
22.在第五方面,本发明涉及根据第一方面的共晶、根据第三方面的组合产品或根据第四方面的药物组合物,用作药物。
23.在第六方面,本发明涉及根据第一方面的共晶、根据第三方面的组合产品或根据第四方面的药物组合物,用于治疗和/或预防已知通过a1腺苷受体拮抗作用而改善的疾病。
附图说明
24.图1示出了(1r,3s)-3-(5-氰基-4-苯基-1,3-噻唑-2-基氨基甲酰基)环戊烷羧酸的1h nmr谱。
25.图2示出了(1r,3s)-3-(5-氰基-4-苯基-1,3-噻唑-2-基氨基甲酰基)环戊烷羧酸的xrpd图。
26.图3示出了(1r,3s)-3-(5-氰基-4-苯基-1,3-噻唑-2-基氨基甲酰基)环戊烷羧酸的dsc图,其显示了在对应于该化合物的熔点的179.59℃下起始的吸热事件。
27.图4示出了实施例2的(1r,3s)-3-(5-氰基-4-苯基-1,3-噻唑-2-基氨基甲酰基)环戊烷羧酸和龙胆酸的共晶的1h nmr谱。
28.图5示出了实施例2的(1r,3s)-3-(5-氰基-4-苯基-1,3-噻唑-2-基氨基甲酰基)环戊烷羧酸和龙胆酸的共晶的xrpd图。
29.图6示出了实施例2的(1r,3s)-3-(5-氰基-4-苯基-1,3-噻唑-2-基氨基甲酰基)环戊烷羧酸和龙胆酸的共晶的dsc图,其显示了在对应于该共晶的熔点的181.69℃下起始的吸热事件。
30.图7示出了实施例3的(1r,3s)-3-(5-氰基-4-苯基-1,3-噻唑-2-基氨基甲酰基)环戊烷羧酸与尿素的共晶的1h nmr谱。
31.图8示出了实施例3的(1r,3s)-3-(5-氰基-4-苯基-1,3-噻唑-2-基氨基甲酰基)环戊烷羧酸与尿素的共晶的xrpd图。
32.图9示出了实施例3的(1r,3s)-3-(5-氰基-4-苯基-1,3-噻唑-2-基氨基甲酰基)环戊烷羧酸和尿素的共晶的dsc图,其显示了在对应于该共晶的熔点的197.7℃下起始的吸热事件。
33.图10示出了实施例4的(1r,3s)-3-(5-氰基-4-苯基-1,3-噻唑-2-基氨基甲酰基)环戊烷羧酸和烟酰胺的共晶的1h nmr谱。
34.图11示出了实施例4的(1r,3s)-3-(5-氰基-4-苯基-1,3-噻唑-2-基氨基甲酰基)环戊烷羧酸和烟酰胺的共晶的xrpd图。
35.图12示出了实施例4的(1r,3s)-3-(5-氰基-4-苯基-1,3-噻唑-2-基氨基甲酰基)环戊烷羧酸和烟酰胺的共晶的dsc图,其显示了在对应于该共晶的熔点的189.55℃下起始的吸热事件。
36.图13示出了实施例2的(1r,3s)-3-(5-氰基-4-苯基-1,3-噻唑-2-基氨基甲酰基)环戊烷羧酸和龙胆酸的共晶的dvs图,其显示了作为相对湿度(rh)的函数的所述共晶的重量变化(以%计)。
37.图14示出了实施例3的(1r,3s)-3-(5-氰基-4-苯基-1,3-噻唑-2-基氨基甲酰基)
环戊烷羧酸与尿素的共晶的dvs图,其显示了作为相对湿度(rh)的函数的所述共晶的重量变化(以%计)。
38.图15示出了实施例4的(1r,3s)-3-(5-氰基-4-苯基-1,3-噻唑-2-基氨基甲酰基)环戊烷羧酸与烟酰胺的共晶的dvs图,其显示了作为相对湿度(rh)的函数的所述共晶的重量变化(以%计)。
39.图16显示了(1r,3s)-3-(5-氰基-4-苯基-1,3-噻唑-2-基氨基甲酰基)环戊烷羧酸与实施例2、3和4中获得的不同共晶的dvs图之间的比较。
具体实施方式
40.本专利申请公开了(1r,3s)-3-(5-氰基-4-苯基-1,3-噻唑-2-基氨基甲酰基)环戊烷羧酸的几种共晶。由(1r,3s)-3-(5-氰基-4-苯基-1,3-噻唑-2-基氨基甲酰基)环戊烷羧酸和选自龙胆酸、尿素和烟酰胺的共晶形成化合物获得以下共晶。它们都显示出相对于游离酸改善的物理化学和药代动力学性质。
41.龙胆酸共晶
42.发明人惊奇地发现(1r,3s)-3-(5-氰基-4-苯基-1,3-噻唑-2-基氨基甲酰基)环戊烷羧酸和龙胆酸的共晶具有以下有利的性质:
43.1)在强制条件下(1周)和4周稳定性测定中的稳定性:在获得的共晶中没有观察到结晶度变化、颜色或任何其他方面的变化。
44.2)吸湿性:其显示出比游离酸更小的吸湿性,特别是在药物的通常储存条件下(《75%rh)。
45.3)生物利用度:与游离酸相比,龙胆酸共晶在口服暴露和生物利用度方面的改善令人惊讶。
46.因此,所述龙胆酸共晶为制备含有药理学活性化合物的固体剂型提供了优势,这便于其操作并允许更好的给药方案。此外,本发明的龙胆酸共晶物体即使在强制稳定条件下也是稳定的固体。这种共晶比游离酸的吸湿性低(特别是高达75%rh下),如在比较龙胆酸共晶(75%rh下为0.10%)与游离酸(75%rh下为0.43%)所达到的水分含量变化的实施例中所见的。
47.尿素共晶
48.还制备了(1r,3s)-3-(5-氰基-4-苯基-1,3-噻唑-2-基氨基甲酰基)环戊烷羧酸与尿素的共晶,发现具有以下所有优点:
49.1)在强制条件下(1周)和4周稳定性测定中的稳定性:在获得的共晶中没有观察到结晶度变化、颜色或任何其他方面的变化。
50.2)吸湿性:其显示出比游离酸更小的吸湿性,特别是在药物的通常储存条件下(《75%rh)。
51.3)生物利用度:与游离酸相比,尿素共晶在口服暴露和生物利用度方面的改善令人惊讶。
52.因此,所述尿素共晶为制备含有药理学活性化合物的固体剂型提供了优势,着便于其操作并允许更好的给药方案。此外,本发明的尿素共晶物体即使在强制稳定条件下也是稳定的固体。这种共晶比游离酸的吸湿性低(特别是高达75%rh下),如在比较尿素共晶
(在75%rh下为0.08%)与游离酸(在75%rh下为0.43%)所达到的水分含量变化的实施例中所见的。
53.烟酰胺共晶
54.发明人惊奇地发现(1r,3s)-3-(5-氰基-4-苯基-1,3-噻唑-2-基氨基甲酰基)环戊烷羧酸与烟酰胺的共晶具有以下所有优点:
55.1)在强制条件下(1周)和4周稳定性测定中的稳定性:在两种稳定性测定期间,在获得的共晶中没有观察到结晶度变化、颜色或任何其他方面的变化。
56.2)吸湿性:其显示比游离酸更小的吸湿性,特别是在5-70%rh之间。
57.3)生物利用度:与游离酸相比,烟酰胺共晶在口服暴露和生物利用度方面的改善令人惊讶。
58.因此,所述烟酰胺共晶为制备含有药理学活性化合物的固体剂型提供了优势,着便于其操作并允许更好的给药方案。此外,本发明的烟酰胺共晶物体即使在强制稳定条件下也是稳定的固体。这种共晶比游离酸的吸湿性低(特别是在5-70%rh之间的范围内),如在比较烟酰胺共晶所达到的水分含量变化的实施例中所见的。
59.如实施例5至8中所示,获得的共晶显示出相对于游离酸的熔点、吸湿性和生物利用度性质的改善。
60.因此,本发明的第一方面涉及(1r,3s)-3-(5-氰基-4-苯基-1,3-噻唑-2-基氨基甲酰基)环戊烷羧酸与选自龙胆酸、尿素和烟酰胺的共晶形成化合物的共晶。
61.在本发明的上下文中,术语“共晶”用于表示由相同晶格内以限定化学计量比的两种或更多种不同分子组成的结晶材料,它们通过非离子键和非共价键相互作用。通常,共晶由api部分诸如(1r,3s)-3-(5-氰基-4-苯基-1,3-噻唑-2-基氨基甲酰基)环戊烷羧酸和共晶形成化合物(共形成物、共晶形成物、客体分子)组成。
62.在本发明的上下文中,术语“共晶形成化合物”或“共形成物”用于表示在室温下通常为固体并且在晶格中与api非离子相互作用的组分。
63.在本发明的上下文中,液体是在室温下,例如在25℃下为液体的任何物质,优选地为根据ich指南q3c(r6)的1类、2类或3类溶剂,优选地选自水、甲醇、乙醇、异丙醇、丙醇、丁醇、乙腈、乙酸乙酯、乙酸异丁酯、丙-2-酮(丙酮)、甲基异丁基酮(mibk)、四氢呋喃(thf)、1,4-二烷、二氯甲烷(dcm)、对二甲苯、乙醚、甲基叔丁基醚(tmbe)和庚烷。
64.在优选的实施方式中,共晶是(1r,3s)-3-(5-氰基-4-苯基-1,3-噻唑-2-基氨基甲酰基)环戊烷羧酸和龙胆酸的共晶。
65.在更优选的实施方式中,所述共晶中的(1r,3s)-3-(5-氰基-4-苯基-1,3-噻唑-2-基氨基甲酰基)环戊烷羧酸与龙胆酸的摩尔比包含在0.9和1.1之间,优选地为1:1。
66.在更优选的实施方式中,(1r,3s)-3-(5-氰基-4-苯基-1,3-噻唑-2-基氨基甲酰基)环戊烷羧酸和龙胆酸的共晶具有包括在约181.69℃下的吸热峰的差示扫描量热法(dsc)热分析图。
67.在更优选的实施方式中,(1r,3s)-3-(5-氰基-4-苯基-1,3-噻唑-2-基氨基甲酰基)环戊烷羧酸和龙胆酸的共晶的特征在于显示出x射线粉末衍射图包括在6.99、13.29、13.42、14.02、17.82(均
±
0.20)2θ
°
下的2θ
°
峰,其中x射线衍射图使用cukα辐射测量。在更优选的实施方式中,x射线衍射图包括在6.99、13.29、13.42、14.02、17.82、18.71、21.09、
26.34、26.58、27.28、28.24、31.56(均
±
0.20)2θ
°
下的2θ
°
峰。
68.在另一个优选方式中,共晶为(1r,3s)-3-(5-氰基-4-苯基-1,3-噻唑-2-基氨基甲酰基)环戊烷羧酸和尿素的共晶。
69.在更优选的实施方式中,所述共晶中(1r,3s)-3-(5-氰基-4-苯基-1,3-噻唑-2-基氨基甲酰基)环戊烷羧酸与尿素的摩尔比包含在0.9和1.1之间,优选地为1:1。
70.在更优选的实施方式中,(1r,3s)-3-(5-氰基-4-苯基-1,3-噻唑-2-基氨基甲酰基)环戊烷羧酸和尿素的共晶具有包括在约197.7℃下的吸热峰的差示扫描量热法(dsc)热分析图。
71.在更优选的实施方式中,(1r,3s)-3-(5-氰基-4-苯基-1,3-噻唑-2-基氨基甲酰基)环戊烷羧酸和尿素的共晶的特征在于显示出x射线粉末衍射图包括在8.32、8.82、13.86、15.60、16.47、24.86(均
±
0.20)2θ
°
下的2θ
°
峰,其中x射线衍射图使用cukα辐射测量。在更优选的实施方式中,x射线衍射图包括在7.77、8.32、8.82、13.86、15.60、16.47、18.23、18.94、19.38、19.86、20.05、20.71、21.38、21.84、22.76、23.02、24.86、26.10、27.28、28.40(均
±
0.20)2θ
°
下的2θ
°
峰。
72.在优选的实施方式中,共晶是(1r,3s)-3-(5-氰基-4-苯基-1,3-噻唑-2-基氨基甲酰基)环戊烷羧酸和烟酰胺的共晶。
73.在更优选的实施方式中,(1r,3s)-3-(5-氰基-4-苯基-1,3-噻唑-2-基氨基甲酰基)环戊烷羧酸与烟酰胺共晶的摩尔比包含在0.9和1.1之间,优选地为1:1。
74.在更优选的实施方式中,(1r,3s)-3-(5-氰基-4-苯基-1,3-噻唑-2-基氨基甲酰基)环戊烷羧酸和烟酰胺的共晶具有包括在约189.55℃下的吸热峰的差示扫描量热法(dsc)热分析图。
75.在更优选的实施方式中,(1r,3s)-3-(5-氰基-4-苯基-1,3-噻唑-2-基氨基甲酰基)环戊烷羧酸和烟酰胺的共晶的特征在于显示出x射线粉末衍射图包括在6.40、8.54、11.75、17.29、20.88、23.66(均
±
0.20)2θ
°
下的2θ
°
峰,其中x射线衍射图使用cukα辐射测量。在更优选的实施方式中,x射线衍射图包括在6.40、8.54、11.28、11.75、13.02、17.29、18.33、19.56、20.11、20.55、20.88、21.36、21.62、22.73、22.96、23.66、24.26、24.46、25.12、26.17、26.46、27.53、28.81、29.36、30.28、32.96(均
±
0.20)2θ
°
下的2θ
°
峰。
76.在本发明中,(1r,3s)-3-(5-氰基-4-苯基-1,3-噻唑-2-基氨基甲酰基)环戊烷羧酸的pka为4.3。游离酸与选定的共晶形成化合物之间的δpka为《1,如下表1中所示。
77.表1
78.化合物pka共轭碱δpka龙胆酸非碱性的-尿素非碱性的-烟酰胺3.40.9
79.(1r,3s)-3-(5-氰基-4-苯基-1,3-噻唑-2-基氨基甲酰基)环戊烷羧酸共晶的一般制备方法
80.另一方面,本发明涉及一种制备本发明的(1r,3s)-3-(5-氰基-4-苯基-1,3-噻唑-2-基氨基甲酰基)环戊烷羧酸共晶物体的方法,其包括:
81.a)在液体存在下使(1r,3s)-3-(5-氰基-4-苯基-1,3-噻唑-2-基氨基甲酰基)环戊
烷羧酸与晶体形成化合物接触,以及
82.b)分离(1r,3s)-3-(5-氰基-4-苯基-1,3-噻唑-2-基氨基甲酰基)环戊烷羧酸-共形成物共晶。
83.步骤a)包括在液体存在下使(1r,3s)-3-(5-氰基-4-苯基-1,3-噻唑-2-基氨基甲酰基)环戊烷羧酸与选自龙胆酸、尿素和烟酰胺的晶体形成化合物接触。在一个实施方式中,使两种起始化合物接触可以通过将它们混合来进行。在一个实施方式中,从步骤a)得到的混合物可以用所需共晶化合物的小晶体作为晶种以促进沉淀,但是这对于获得共晶不是必需的。
84.(1r,3s)-3-(5-氰基-4-苯基-1,3-噻唑-2-基氨基甲酰基)环戊烷羧酸是使用专利申请wo2009/044250a1中公开的方法制备的,通过引用该文献并入本文。
85.在具体实施方式中,当共晶形成化合物是龙胆酸时,在步骤a)中,(1r,3s)-3-(5-氰基-4-苯基-1,3-噻唑-2-基氨基甲酰基)环戊烷羧酸与龙胆酸的摩尔比为0:9至1:1.5,优选地为1:1至1:1.5,优选地为1:1至1:1.2。使两种起始化合物接触可以通过将它们混合来进行。两种化合物的混合物可以例如通过磁力搅拌来进行。该混合物可以是溶液或悬浮液。优选地,步骤a)包括将酸和龙胆酸的混合物制备至形成部分溶液或悬浮液的液体的回流温度,优选地直到获得溶液。在具体实施方式中,混合物优选地在回流温度和搅拌下保持30分钟至24小时,更优选地保持5小时至18小时,仍更优选地保持10小时至15小时。
86.该液体可以是不与(1r,3s)-3-(5-氰基-4-苯基-1,3-噻唑-2-基氨基甲酰基)环戊烷羧酸或龙胆酸反应的任何合适的液体。优选地,液体选自链烷醇、脂肪烃、芳香烃、醚、酮、酯、二氯甲烷、氯仿、二甲亚砜、乙腈、水及其混合物,优选水、乙腈、甲醇、异丙醇、乙酸乙酯、丙酮、甲基异丁基酮、甲基叔丁基醚、四氢呋喃、二烷、二氯甲烷、二甲苯、庚烷及其混合物。
87.在另一个具体实施方式中,当共晶形成化合物为尿素时,在步骤a)中,(1r,3s)-3-(5-氰基-4-苯基-1,3-噻唑-2-基氨基甲酰基)环戊烷羧酸与尿素摩尔比为0.9:1至1:1.5,优选地为1:1至1:1.5,优选地为1:1至1:1.2。使两种起始化合物接触可以通过将它们混合来进行。两种化合物的混合物可以例如通过磁力搅拌来进行。该混合物可以是溶液或悬浮液。优选地,步骤a)包括将酸和尿素的混合物制备至形成部分溶液或悬浮液的液体的回流温度,优选地直到获得溶液。在具体的实施方式中,混合物优选地在回流温度和搅拌下保持30分钟至24小时,更优选地保持5小时至18小时,仍更优选地保持10小时至15小时。
88.该液体可以是不与(1r,3s)-3-(5-氰基-4-苯基-1,3-噻唑-2-基氨基甲酰基)环戊烷羧酸或尿素反应的任何合适的液体。优选地,该液体选自链烷醇、脂肪烃、芳香烃、醚、酮、酯、二氯甲烷、氯仿、二甲亚砜、乙腈、水及其混合物,优选地乙腈、甲醇、异丙醇、乙酸异丁酯、丙酮、甲基异丁基酮、二氯甲烷、二甲苯、庚烷及其混合物。
89.在具体的实施方式中,当共晶形成化合物为烟酰胺时,在步骤a)中,(1r,3s)-3-(5-氰基-4-苯基-1,3-噻唑-2-基氨基甲酰基)环戊烷羧酸与烟酰胺的摩尔比为0:9至1:1.5,优选地为1:1至1:1.5,优选地为1:1至1:1.2。使两种起始化合物接触可以通过将它们混合来进行。两种化合物的混合物可以例如通过磁力搅拌来进行。该混合物可以是溶液或悬浮液。优选地,步骤a)包括将酸和烟酰胺的混合物制备至形成部分溶液或悬浮液的液体的回流温度,优选地直至获得溶液。在具体实施方式中,混合物优选地在回流温度和搅拌下
保持30分钟至24小时,更优选地保持5小时至18小时,仍更优选地保持10小时至15小时。
90.该液体可以是不与(1r,3s)-3-(5-氰基-4-苯基-1,3-噻唑-2-基氨基甲酰基)环戊烷羧酸或烟酰胺反应的任何合适的液体。优选地,该液体选自链烷醇、脂肪烃、芳香烃、醚、酮、酯、二氯甲烷、氯仿、二甲亚砜、乙腈、水及其混合物,优选地乙腈、丙酮、甲基异丁基酮及其混合物。
91.如本文所用,术语烷基包括直链或支链烃链,其具有1至12个碳原子,优选地1至6个碳原子,并且不具有不饱和度。当术语烷基伴随有表示碳原子数的表述,诸如c
1-c3时,它意味着所述烷基具有指定的碳原子数,诸如1-3个碳原子。
92.如本文所用,术语链烷醇包括与羟基(oh)相连的如先前限定的直链或支链烷基链。优选的链烷醇是异丙醇、丙醇、乙醇、甲醇、丁醇、叔丁醇、异丁醇及其混合物,更优选地异丙醇、丙醇、乙醇、甲醇及其混合物。
93.如本文所用,术语脂肪烃是指饱和或具有一个或多个不饱和度(双键或三键),例如,一个、两个或三个不饱和度的直链、支链或环状的由碳和氢原子组成的化合物;优选地具有5至12个碳原子,更优选地具有5至8个碳原子,仍更优选地具有6或7个碳原子。脂肪烃的实例是戊烷、己烷、庚烷、环戊烷、环己烷和及其混合物等,优选地是庚烷和环己烷及其混合物。
94.如本文所用,术语芳香烃是指不饱和的并且符合休克尔规则的由碳和氢原子组成的环状化合物,其优选在环中具有6个碳原子,任选被一个、两个或三个可能相同或不同地c
1-c3烷基取代。芳香烃的实例是甲苯和二甲苯及其混合物。
95.如本文所用,术语醚是指式r-o-r'的化合物,其中r和r'选自:(a)如先前限定的烷基链,(b)其中r和r'一起形成亚烷基链(alkylenic chain)-(ch2)m,m是选自4至6的整数,其任选地被c
1-c3烷基取代,或(c)其中r和r'一起形成-(ch2)
n-o-(ch2)
p-基,n和p独立地选自1至3的整数。醚实例是二乙醚、叔丁基甲基醚、二烷、四氢呋喃、甲基四氢呋喃及其混合物等。
96.如本文所用,术语酮是指式r-c(=o)-r'的化合物,其中r和r'独立地选自如先前限定的烷基。酮的实例是丙酮和甲基异丁基酮及其混合物等。
97.如本文所用,术语酯是指r-coor'基团,其中r和r'独立地为如先前限定的烷基。酯的实例是乙酸乙酯和乙酸异丁酯及其混合物。
98.如本文所用,术语龙胆酸在本文件中用于表示其iupac名称为2,5-二羟基苯甲酸的化合物。
99.如本文所用,术语尿素在本文件中用于表示其式为(nh2)
2-c=o的化合物。
100.如本文所用,术语烟酰胺在本文中用于表示其iupac名称为3-吡啶甲酰胺的化合物。
101.根据本发明的一个实施方式,步骤a)的液体选自水、甲醇、乙醇、异丙醇、丙醇、丁醇、乙腈、乙酸乙酯、乙酸异丁酯、丙-2-酮(丙酮)、甲基异丁基酮(mibk)、四氢呋喃(thf)、1,4-二烷、二氯甲烷(dcm)、对二甲苯二乙醚、甲基叔丁基醚(tmbe)和庚烷及其混合物。
102.本领域技术人员可以确定要在该方法中使用的液体的体积。优选地,使用(1r,3s)-3-(5-氰基-4-苯基-1,3-噻唑-2-基氨基甲酰基)环戊烷羧酸摩尔量的1-50倍的体积(以ml计),更优选地在1-10倍之间。
103.本领域技术人员可以通过常规步骤确定何时形成(1r,3s)-3-(5-氰基-4-苯基-1,3-噻唑-2-基氨基甲酰基)环戊烷羧酸共晶,例如,使用薄层色谱、核磁共振或高效液相色谱。
104.一旦形成所述共晶,就进行步骤b),即,通过本发明领域中的常用方法,例如,通过过滤分离所得共晶。
105.优选地,步骤b)可以进一步包括洗涤所得共晶以便除去杂质和干燥所述共晶的步骤。洗涤优选地用与步骤a)中使用的相同液体进行。干燥优选地在真空和室温下进行。
106.组合和药物组合物
107.本发明进一步提供了一种组合产品,其包含本发明的共晶和一种或多种选自以下的治疗剂:a)血管紧张素转化酶抑制剂(ace抑制剂),b)血管紧张素受体拮抗剂,c)他汀类药物,d)β受体阻滞剂,e)钙拮抗剂和f)利尿剂。
108.ace抑制剂的实例是,例如,卡托普利、依那普利和贝那普利等。
109.血管紧张素受体拮抗剂的实例是,例如,氯沙坦、阿齐沙坦、厄贝沙坦和依普罗沙坦等。
110.他汀类药物的实例是,例如,阿托伐他汀、氟伐他汀、辛伐他汀和洛伐他汀等。
111.β-阻滞剂的实例是,例如,醋丁洛尔、阿替洛尔、倍他洛尔、卡维地洛和普萘洛尔等。
112.钙拮抗剂的实例是,例如,氨氯地平、维拉帕米、维地平和伊拉地平等。
113.利尿剂的实例是,例如,氯噻嗪、氯噻酮、呋塞米和螺内酯等。
114.所述组合产品可以是包含共晶和一种或多种治疗剂的药物组合物。可选地,在组合产品中,共晶和一种或多种治疗剂处于不同的组合物中。
115.此外,本发明还包括包含如上限定的共晶或如上限定的组合和药学上可接受的赋形剂的药物组合物。特别地,共晶为治疗有效量。治疗剂,当存在时,也优选为治疗有效量。
116.药物或药理学活性剂的“有效量”或“治疗有效量”是指无毒但足以提供所需效果的药物或药剂的量。“有效”的量将因受试者而变化,取决于个体的年龄和一般状况、特定的一种或多种活性剂等。因此,并不总是可以指定准确的“有效量”。然而,在任何个别情况下,合适的“有效”量可以由技术人员使用常规实验来确定。
117.本发明的共晶和一种或多种以上限定的治疗剂可以同时、顺序或分开施用。
118.例如,同时施用可以以包含本发明的共晶和一种或多种以上限定的治疗剂的组合物的形式进行,或者,即,当它们不是同一组合物的一部分时,通过同时施用,即,同时施用独立配制的本发明的共晶和以上限定的一种或多种治疗剂进行。
119.顺序施用优选地是指以交错方式在一个时间点施用本发明的共晶并且在不同的时间点施用一种或多种以上限定的治疗剂。
120.分开施用优选地是指本发明的共晶和一种或多种以上限定的治疗剂在不同时间点彼此独立地施用。
121.术语“药学上可接受的赋形剂”是指与活性成分一起施用的载体、稀释剂或佐剂。这种药物赋形剂可以是无菌液体,诸如水和油,包括石油、动物、植物或合成来源的那些,诸如花生油、大豆油、矿物油、芝麻油等。优选使用水或水性共晶溶液以及右旋糖和甘油的水溶液,特别是可注射溶液作为载体。
122.用于本发明的口服剂量药物组合物的药学上可接受的赋形剂的实例是本领域已知的常规赋形剂,诸如粘合剂,例如,糖浆、阿拉伯树胶、明胶、山梨醇、黄蓍胶或聚乙烯吡咯烷酮;填料,例如,乳糖、甘露醇、木糖醇、山梨醇、蔗糖、玉米淀粉、磷酸钙、山梨醇、甘氨酸、右旋糖、麦芽糖糊精、葡聚糖、糊精、改性淀粉;助流剂和片剂润滑剂,例如,硬脂酸镁、硬脂酸钙、硬脂酸、硬脂酸锌、单硬脂酸甘油酯、棕榈硬脂酸甘油酯、氢化蓖麻油、胶体二氧化硅、二氧化硅、无水胶体硅、甘油、氢化植物油、矿物油、聚乙二醇、苯甲酸钠、十二烷基硫酸钠、硬脂富马酸钠或滑石;崩解剂,例如,淀粉、聚乙烯吡咯烷酮、淀粉乙醇酸钠、交联聚维酮、微晶纤维素、羟丙基纤维素或山梨醇脂肪酸酯;药学上可接受的润湿剂,诸如十二烷基硫酸钠;水溶性助剂,诸如尿素、甜菜碱一水合物、硫酸钾、乙酸钾、甘露醇;碱化剂,诸如碳酸钾、碳酸钠、碳酸氢钠、磷酸三钠、磷酸三钾、柠檬酸三钠、柠檬酸三钾;甜味剂,诸如糖精钠、甜蜜素钠和阿斯巴甜;调味剂,诸如薄荷醇和薄荷油。
123.本发明的药物组合物可以肠胃外、口服或局部施用,优选地通过口服途径施用。
124.在优选的实施方式中,药物组合物是适合于肠胃外施用的剂型,诸如适合剂量单位形式的无菌溶液、悬浮液或冻干产品。可以使用合适的赋形剂,诸如填料、缓冲剂或表面活性剂。
125.药物组合物也可以是固体或液体的口服形式。用于口服施用的合适剂型可以是片剂、胶囊、溶液或口服悬浮液的糖浆或粉末溶液、颗粒剂、小袋。优选地,剂型选自片剂和胶囊。
126.上述制剂将使用标准方法制备,诸如在西班牙和美国药典和类似参考文献中描述或考虑的那些。
127.医疗用途
128.本发明的共晶物体展现/维持对a1腺苷受体的有效拮抗剂活性。
129.因此,本发明还涉及如上所述的共晶、如上限定的本发明的共晶与一种或多种治疗剂的组合产品或如上限定的药物组合物用作药物的用途。
130.该方面还可以配制成如上所述的本发明的共晶、如上限定的本发明的共晶与一种或多种治疗剂的组合产品或如上限定的药物组合物,以制备药物。
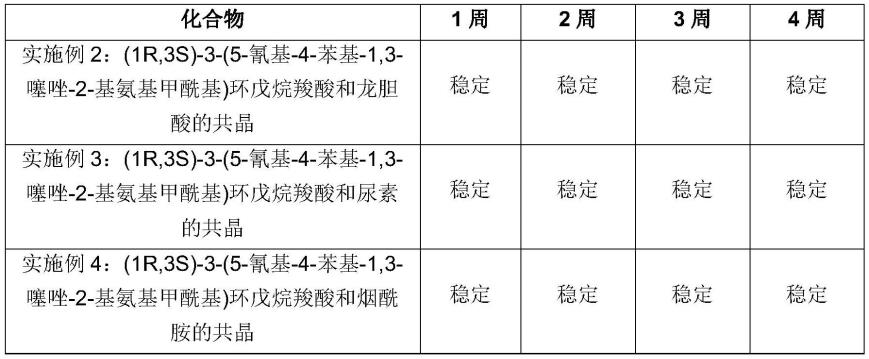
131.本发明的另一方面涉及如上所述的本发明的共晶、如上限定的本发明的共晶与一种或多种治疗剂的组合产品或如上限定的药物组合物在治疗和/或预防已知通过a1腺苷受体拮抗作用而改善的疾病中的用途。
132.该方面还可以配制成如上所述的本发明的共晶、如上限定的本发明的共晶与一种或多种治疗剂的组合产品或如先前限定的药物组合物在制备用于治疗和/或预防已知通过a1腺苷受体拮抗作用改善的疾病的药物中的用途。
133.该方面还可以配制成治疗和/或预防已知通过腺苷a1受体拮抗作用而改善的疾病的方法,其包括向需要这种治疗的受试者施用如上所述的本发明的共晶,如上限定的本发明的共晶与一种或多种治疗剂的组合产品或如上限定的药物组合物。
134.适于通过腺苷a1受体拮抗作用而改善的疾病或病症选自高血压、心力衰竭、缺血、室上性心律失常、急性肾衰竭或由液体潴留引起的任何其他疾病、心肌再灌注损伤、哮喘、过敏反应,其包括但不限于高血压、心力衰竭、缺血、室上性心律失常、急性肾功能衰竭、心肌再灌注损伤、哮喘、过敏反应(其包括鼻炎和荨麻疹)、硬皮病和自身免疫性疾病,诸如多
发性硬化。在优选的实施方式中,通过a1腺苷受体拮抗作用而改善的疾病或病症选自心力衰竭、急性肾衰竭、哮喘、动脉高血压和透析中低血压。
135.如本文所用,术语“治疗”和“处理”是指逆转、减轻、抑制所述术语或所述疾病或病症的一种或多种症状所适用的疾病或病症的进展。
136.如本文所用,术语“预防”和“防止”是指抑制该术语适用的疾病或病症或这种疾病或病症的一种或多种症状的发生。
137.在根据本发明的用途中,本发明的共晶、组合产品或药物组合物可以每天施用1、2、3、4或5次。在使用中,可以施用本发明的共晶、组合产品或药物组合物,直到待治疗的疾病或病症的症状在其进展中被逆转、减轻或抑制。
138.以下非限制性实施例旨在说明本发明并且不应被视为对本发明范围的限制。
139.实施例
140.一般性描述
[0141]1h nmr分析。在varian mercury 400mhz光谱仪中,将核磁共振分析记录在dmso-d6中,该光谱仪配备有5mm的宽带探头atb 1h/19f/x。将5-10mg样品溶解在0.7ml氘代溶剂中获得光谱。
[0142]
xrpd分析。在环境条件下在240mm反射几何半径的panalytical x'pert proθ-θ衍射仪上进行起始材料和筛选样品的衍射测量,该衍射仪配备cu kα辐射和pixcel检测器,其在45kv和40ma下运行。每个样品都安装在零背景硅支架上,并在数据收集期间以0.25转/秒旋转。测量角度范围为3.0-40.0
°
(2θ),步长为0.013
°
。研究期间,起始材料的扫描速度为0.082
°
/s(40.80s/步),生成的样品的扫描速度为0.328
°
/s(10.20s/步)。
[0143]
用mettler toledo dsc2记录dsc分析。将样品称重到带有针孔盖的40μl铝坩埚中,并在氮气(50ml/min)下以10℃/min的速率从25℃加热到300℃。
[0144]
结晶稳定性研究在加速稳定性条件(40℃,75
±
5rh%)下进行一周。将储存在xrpd硅支架上的每种形式的样品暴露在气候室中。值得注意的是,这些条件非常极端(drastic),因为暴露于存储条件下的高表面可能有利于可能的结晶转化。通过xrpd定期分析样品以观察可能的转化。
[0145]
在加速稳定性条件(40℃,75
±
5rh%)下进行了额外的结晶稳定性研究。共晶样品储存在开口小瓶中,并暴露在气候室中,保持准确设定的条件(40℃
–
75%rh
±
5rh)。这些样品每周分析一次,持续1个月。
[0146]
吸湿性研究。用q5000 ta仪器通过dvs(动态蒸气吸附)测定共晶的吸湿性。这是测量样品在不同相对湿度(rh)下吸收或解吸的水量的重量分析技术。在每个rh水平上,必须让样品质量达到重量平衡(或超过时间限制),然后才能进入下一个湿度水平。吸附和解吸等温线在25℃下、0
–
95%rh范围内进行。样品先前没有干燥,但在开始dvs循环之前将其暴露于0%rh直到达到稳定的重量。这个平衡步骤允许从大气中消除可能吸附的湿度。相对湿度(rh)由湿氮气流和干氮气流的混合物控制。rh保持恒定,直到达到平衡(恒定重量)或达到最大时间,然后将rh更改为下一个水平。
[0147]
实施例1.(1r,3s)-3-(5-氰基-4-苯基-1,3-噻唑-2-基氨基甲酰基)环戊烷羧酸的合成
[0148]
化合物(1r,3s)-3-(5-氰基-4-苯基-1,3-噻唑-2-基氨基甲酰基)环戊烷羧酸的合
成在专利申请wo2009/044250 a1中详细描述,该专利通过引用并入本文。
[0149]1h-nmr(300mhz,dmso-d6):δ=1.88(m,4h),1.99(m,1h),2.22(m,1h),2.79(m,1h),3.06(m,1h),7.57(m,3h),7.99(m,2h),12.37(s,1h),12.89(s,1h)。
[0150]
图1示出了(1r,3s)-3-(5-氰基-4-苯基-1,3-噻唑-2-基氨基甲酰基)环戊烷羧酸的1h nmr谱。
[0151]
图2示出了(1r,3s)-3-(5-氰基-4-苯基-1,3-噻唑-2-基氨基甲酰基)环戊烷羧酸的xrpd图。
[0152]
图3示出了(1r,3s)-3-(5-氰基-4-苯基-1,3-噻唑-2-基氨基甲酰基)环戊烷羧酸的dsc图,其显示了在对应于该化合物的熔点的179.59℃下起始的吸热事件。
[0153]
实施例2.(1r,3s)-3-(5-氰基-4-苯基-1,3-噻唑-2-基氨基甲酰基)环戊烷羧酸和龙胆酸共晶的制备
[0154]
向配备有磁力搅拌器并含有(1r,3s)-3-(5-氰基-4-苯基-1,3-噻唑-2-基氨基甲酰基)环戊烷羧酸(300mg,0.88)和龙胆酸(169mg,1.10mmol,1.25eq.)的混合物的圆底烧瓶中,添加tbme(3ml)。将所得混合物在室温下搅拌15小时。然后,将悬浮液通过烧结漏斗(孔隙度n
°
3)过滤并用tbme(2
×
0.2ml)洗涤。在室温下真空干燥后,获得(1r,3s)-3-(5-氰基-4-苯基-1,3-噻唑-2-基氨基甲酰基)环戊烷羧酸和龙胆酸的共晶,其为白色固体。
[0155]
图4示出了实施例2的证实为1:1摩尔比的(1r,3s)-3-(5-氰基-4-苯基-1,3-噻唑-2-基氨基甲酰基)环戊烷羧酸和龙胆酸的共晶的1h-nmr图谱。
[0156]
实施例2的共晶的特征还在于xrpd。图5显示了相应的图,并且表2显示了主峰。
[0157]
表2
[0158]
pos.[
°
2th
±
0.2]相对强度[%]6.9910013.296.213.426.314.025.617.824.218.712.721.09326.341.826.581.127.281.528.242.531.561.1
[0159]
图6示出了实施例2的共晶的dsc图,其显示了在对应于所述共晶的熔点的181.69℃下起始的吸热事件。
[0160]
实施例3.(1r,3s)-3-(5-氰基-4-苯基-1,3-噻唑-2-基氨基甲酰基)环戊烷羧酸和尿素共晶的制备
[0161]
向配备有磁力搅拌器并含有(1r,3s)-3-(5-氰基-4-苯基-1,3-噻唑-2-基氨基甲酰基)环戊烷羧酸(260mg,0.77mmol,1.3eq.)和尿素(35.2mg,0.59mmol)的混合物的圆底烧
瓶中,添加acn(2ml)。将所得混合物在室温下搅拌15小时。然后,将悬浮液通过烧结漏斗(孔隙度n
°
3)过滤并用acn(2
×
0.2ml)洗涤。在室温下真空干燥后,获得(1r,3s)-3-(5-氰基-4-苯基-1,3-噻唑-2-基氨基甲酰基)环戊烷羧酸和尿素的共晶,其为白色固体。
[0162]
图7示出了证实为1:1摩尔比的(1r,3s)-3-(5-氰基-4-苯基-1,3-噻唑-2-基氨基甲酰基)环戊烷羧酸和尿素的共晶的1h-nmr图谱。
[0163]
实施例3的共晶的特征还在于xrpd。图8显示了相应的图,并且表3显示了主峰。
[0164]
表3
[0165]
pos.[
°
2th
±
0.2]相对强度[%]7.7778.32278.8210013.863115.601916.471818.231718.94619.381419.861620.051520.711021.38721.84522.76723.021124.861926.10627.281628.406
[0166]
图9示出了实施例3的共晶的dsc图,其显示了在对应于该共晶的熔点的197.72℃下起始的吸热事件。
[0167]
实施例4.(1r,3s)-3-(5-氰基-4-苯基-1,3-噻唑-2-基氨基甲酰基)环戊烷羧酸和烟酰胺共晶的制备
[0168]
向含有(1r,3s)-3-(5-氰基-4-苯基-1,3-噻唑-2-基氨基甲酰基)环戊烷羧酸(400mg,1.17mmol,2eq.)和烟酰胺(71.5mg,0.59mmol)的配备有磁力搅拌器的圆瓶中,添加mibk(4ml)。将所得混合物在室温下搅拌15小时。然后,将悬浮液通过烧结漏斗(孔隙度n
°
3)过滤并用mibk(3
×
0.2ml)洗涤。在室温下真空干燥后,获得(1r,3s)-3-(5-氰基-4-苯基-1,3-噻唑-2-基氨基甲酰基)环戊烷羧酸和烟酰胺的共晶,其为白色固体。
[0169]
图10示出了证实为1:1摩尔比的(1r,3s)-3-(5-氰基-4-苯基-1,3-噻唑-2-基氨基甲酰基)环戊烷羧酸和烟酰胺共晶的1h-nmr图谱。
[0170]
实施例4的共晶的特征还在于xrpd。图11显示了相应的图,并且表4显示了主峰。
[0171]
表4
[0172]
pos.[
°
2th
±
0.2]相对强度[%]6.401008.545511.281111.756413.022017.297018.332419.563220.111520.551120.884121.361221.621322.731922.962923.664424.261224.462325.121926.171326.461127.53728.811229.36830.281532.965
[0173]
图12示出了实施例4的共晶的dsc图,其显示了在对应于该共晶的熔点的189.55℃下起始的吸热事件。
[0174]
实施例5.稳定性测定
[0175]
研究了(1r,3s)-3-(5-氰基-4-苯基-1,3-噻唑-2-基氨基甲酰基)环戊烷羧酸的共晶形式在加速储存条件下(40℃,75
±
5rh%)持续一至四周的稳定性。见表5中的结果。
[0176]
表5
[0177][0178]
在暴露时间后,根据xrpd分析,共晶保持稳定。在分析条件的检测限内未检测到非晶化或结晶形式的出现。
[0179]
实施例6.吸湿性研究
[0180]
下表(表6)显示了吸湿性研究中母体羧酸和共晶的水分含量。
[0181]
表6
[0182][0183]
从上表可以看出,与龙胆酸的共晶和与尿素的共晶的吸湿性低于游离酸,特别地在高达75%rh下。参见图13-16。
[0184]
实施例7.口服生物利用度测定
[0185]
该研究的目的是研究在雄性sd大鼠的单次静脉内(iv)和口服(po)施用后,从(1r,3s)-3-(5-氰基-4-苯基-1,3-噻唑-2-基氨基甲酰基)环戊烷羧酸获得的不同共晶的血浆药代动力学。
[0186]
动物分为两组:第1组(iv:1mg/kg)和第2组(po:5mg/kg)。对第1组和第2组中的动物施用生理盐水中的(1r,3s)-3-(5-氰基-4-苯基-1,3-噻唑-2-基氨基甲酰基)环戊烷羧酸的不同共晶的溶液。在给药前、0.083、0.25、0.5、1、2、4、8和24小时(iv)以及给药前、0.25、0.5、1、2、4、6、8和24小时(po)时,在每个时间点在含有k2edta溶液作为抗凝剂的标记微量离心管中从一组三只大鼠收集血液样品。血浆样品通过全血离心分离并储存在低于-70
±
10℃下直至生物分析。所有样品均使用乙腈通过蛋白质沉淀进行分析,并使用适合用途的
lc-ms/ms方法(lloq=1.00ng/ml)进行分析。使用phoenix(版本6.3)的非房室性分析(non-compartmental)工具计算药代动力学参数。
[0187]
从实施例1-4获得的主要药代动力学参数显示在以下表7中。
[0188]
表7
[0189][0190]
po:口服施用(per os)
[0191]
iv:静脉内施用
[0192]cmax
是指在给药时间和最终观察时间点之间口服施用药物后获得的最大血浆药物浓度。
[0193]
auc
最后
是指从给药时间到最后一次观察时间的曲线下面积,其大于定量限。
[0194]
清除率是指测量身体从血浆中清除药物的能力,并根据静脉内给药计算得出。
[0195]
f%是指生物利用度。使用以下等式计算口服施用后化合物的全身利用度:
[0196]
f(%)=(auc
最后
po
×
剂量iv/auc
最后
iv
×
剂量po)
×
100
[0197]
从上表可以看出,与游离酸相比,和龙胆酸、尿素以及烟酰胺的共晶呈现出更高的生物利用度。
[0198]
实施例8.健康志愿者中的比较生物利用度测定
[0199]
该研究中的健康志愿者是18岁或以上的男性,以便评估实施例2的化合物与实施例1的化合物在禁食条件下的比较生物利用度,并研究高脂肪、高热量膳食的影响。化合物将以实施例1(5mg)和实施例2(7.3mg)的单剂量口服施用。该研究将采用随机、开放标签、四重交叉设计。
[0200]
为了确定比较生物利用度,auc
0-t
(auc
0-t
:从时间0h到最后可测量浓度的血浆浓度-时间曲线下面积)和c
max
(c
max
:观察到的最大血浆浓度(峰暴露))将在每次施用后确定。
[0201]
结果
[0202]
该研究中包括16名志愿者。在所有志愿者中,基础样品显示不存在实施例1的化合物。因此,所有数据都包括在所有药代动力学测量和计算中,无需任何调整。见表8。
[0203]
表8
[0204][0205]
*:中位数和范围
[0206]
auc
0-t
=使用梯形法计算的相对于上至最后一个可量化样品的时间(时间t)的血浆浓度曲线下面积。
[0207]
auc
0-∞
:如下计算的外推到无穷大的相对于时间的曲线下面积:
[0208]
auc
0-∞
=auc
0-t
+c
t
/ke,
[0209]
其中c
t
是时间t的量化浓度,并且ke是消除常数。后者将在最后一个单指数消除阶段期间使用线性回归分析进行计算(phoenix winnonlin)。在所有情况下,至少三个血浆浓度值将用于限定该阶段。
[0210]cmax
:最大浓度。
[0211]
t
max
=达到c
max
的时间。
[0212]
实施例1的生物利用度与实施例2的生物利用度相似,其中在禁食条件下的auc
0-t
和c
max
的情况下和在进食条件下的auc
0-t
的情况下的90%置信区间均在生物等效性的可接受范围内(80.00%
–
125.00%)。实施例2的c
max
在高脂肪膳食后施用时稍微更高。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1