酰胺化物化合物及其制造方法、封端剂解离催化剂以及热固性树脂组合物与流程
1.本发明涉及酰胺化物化合物及其制造方法、封端剂解离催化剂以及热固性树脂组合物。
背景技术:
2.作为现有的酰胺化物化合物的制造方法,已知有使n-杂环卡宾(以下称为nhc卡宾)与异氰酸酯反应的方法(非专利文献1)。
3.专利文献1公开了能够作为封端剂解离催化剂使用的酰胺化物化合物。现有技术文献专利文献
4.专利文献1:wo2019065953a1非专利文献
5.非专利文献1:struct.chem.2013年24卷2059-2068页
技术实现要素:
发明所要解决的技术问题
6.在非专利文献1中记载的使nhc卡宾与异氰酸酯反应的方法中,通常需要使用对氧、水不稳定的nhc卡宾,需要使用手套箱等特殊的设备在禁水、禁氧条件下进行制造。
7.本发明的目的在于,提供一种不需要手套箱等特殊设备的酰胺化物化合物的制造方法。用于解决技术问题的手段
8.本发明提供以下的酰胺化物化合物及其制造方法、封端剂解离催化剂以及热固性树脂组合物。〔1〕一种酰胺化物化合物的制造方法,其包括使下述式(1)表示的咪唑鎓羧酸盐和下述式(2)表示的多异氰酸酯化合物反应的工序:
9.[化1]
[0010]
(式(1)中,r1和r4相同或不同,表示可被杂原子取代的碳原子数1~20的烃基。r2和r3相同或不同,表示氢原子或可被杂原子取代的碳原子数1~20的烃基,或者r2和r3可以与它们键合的碳原子一起形成环结构。r5表示氢原子、或可被杂原子取代的碳原子数1~20的烃基。);
[0011]
[化2]
[0012]
(式(2)中,a表示从选自脂肪族多异氰酸酯、脂环式多异氰酸酯、芳香族多异氰酸酯和芳香脂肪族多异氰酸酯中的至少1种多异氰酸酯中除去异氰酸酯基而得到的残基、或者从由选自脂肪族多异氰酸酯、脂环式多异氰酸酯、芳香族多异氰酸酯和芳香脂肪族多异氰酸酯中的至少1种形成的改性异氰酸酯中除去异氰酸酯基而得到的残基。x为2以上20以下的整数。),
[0013]
所述酰胺化物化合物由下述式(3)表示:[化3]
[0014]
(式(3)中,y和z为1以上且19以下的整数,y、z的合计为2以上且20以下,a、r1、r2、r3、r4、r5分别如上所述定义。)〔2〕如[1]所述的酰胺化物化合物的制造方法,其中,式(2)所示的多异氰酸酯化合物为芳香族多异氰酸酯。〔3〕如[1]所述的酰胺化物化合物的制造方法,其中,式(2)所示的多异氰酸酯化合物是由选自2,4-甲苯二异氰酸酯、2,6-甲苯二异氰酸酯、4,4
’‑
二苯基甲烷二异氰酸酯或多亚甲基多苯基多异氰酸酯中的1种或2种以上形成的2聚体或3聚体的多异氰酸酯。〔4〕如[1]所述的酰胺化物化合物的制造方法,其中,式(2)所示的多异氰酸酯化合物为选自2,4-甲苯二异氰酸酯、2,6-甲苯二异氰酸酯、4,4
’‑
二苯基甲烷二异氰酸酯或多亚甲基多苯基多异氰酸酯中的至少1种多异氰酸酯。〔5〕如[1]~[4]中任一项所述的酰胺化物化合物的制造方法,其中,r2和r3为氢原子。〔6〕一种式(3)表示的酰胺化物化合物。
[0015]
[化4]
[0016]
(式(3)中,y及z为1以上且19以下的整数,y、z的合计为2以上且20以下。r1及r4相同
或不同,表示可被杂原子取代的碳原子数1~20的烃基。r2及r3相同或不同,表示氢原子或可被杂原子取代的碳原子数1~20的烃基,或者r2及r3可与它们所键合的碳原子一起形成环结构。r5表示氢原子或可被杂原子取代的碳原子数1~20的烃基。)〔7〕如[6]所述的酰胺化物化合物,其中,r2和r3为氢原子。〔8〕如[6]所述的酰胺化物化合物,其中,r1和r4为可被杂原子取代的碳原子数1~20的烷基。〔9〕一种用于封闭型异氰酸酯的封端剂解离催化剂,其含有〔6〕~〔8〕中任一项所述的酰胺化物化合物。〔10〕一种热固性树脂组合物,其含有如〔6〕~〔8〕中任一项所述的酰胺化物化合物、封闭型异氰酸酯、具有异氰酸酯反应性基团的化合物。〔11〕一种固化物,其是将〔10〕所述的热固性树脂组合物固化而成的。〔12〕一种固化物的制造方法,其包括将〔10〕所述的热固性树脂组合物加热使其固化的工序。发明效果
[0017]
可以提供一种不需要手套箱等特殊设备的新型酰胺化物化合物的制造方法。
[0018]
另外,可通过本发明制造的式(3)所示的酰胺化物化合物是新型化合物,作为封端剂解离催化剂是有用的。
具体实施方式
[0019]
《式(3))表示的酰胺化物化合物及其制造方法>在本发明中,式(3)表示的酰胺化物化合物(以下称为酰胺化物化合物(3))通过使式(1)表示的咪唑鎓羧酸盐(以下称为咪唑鎓羧酸盐(1))和式(2)表示的多异氰酸酯化合物(以下称为多异氰酸酯化合物(2))根据需要在溶剂的存在下反应来制造。反应通常以如下方式使用咪唑鎓羧酸盐(1)和多异氰酸酯化合物(2)即可:将咪唑鎓羧酸盐(1)的摩尔数设为a、将多异氰酸酯化合物(2)中的异氰酸酯基的摩尔数设为c时,c/2a=0.5~2.0。在通过后述的咪唑鎓羧酸盐(1)的制造方法制造咪唑鎓羧酸盐(1)的情况下,有时在咪唑鎓羧酸盐(1)中残留有羧酸(6)。在这样的情况下,如果将咪唑鎓羧酸盐(1)的摩尔数设为a、将残存于咪唑鎓羧酸盐(1)中的羧酸(6)的摩尔数设为b、将多异氰酸酯化合物(2)中的异氰酸酯基的摩尔数设为c,则以成为c/(2a+b)=0.5~2.0的方式使用咪唑鎓羧酸盐(1)和多异氰酸酯化合物(2)。
[0020]
通常,在-10℃以上、优选0℃~150℃的反应温度、0.5~12小时的反应时间下,反应有利地进行。
[0021]
溶剂可以使用也可以不使用。使用溶剂时,作为其具体例,可列举出甲苯、苯、二甲
苯等芳香族烃,甲基环己烷、环己烷、己烷、庚烷、辛烷等脂肪族或脂环式烃,二氯甲烷、氯仿、四氯化碳、1,2-二氯乙烷等卤代烃,氯苯、二氯苯等卤代芳香族烃,二乙醚、四氢呋喃、1,4-二噁烷等醚类等,优选为芳香族烃、卤代芳香族烃,特别优选为甲苯。溶剂也可以根据需要混合使用2种以上。
[0022]
相对于咪唑鎓羧酸盐(1)1质量份,溶剂的使用量通常为50质量份以下,优选为0.1~10质量份。
[0023]
根据需要,也可以在氮、氩、氦等不对反应造成影响的非活性气体气氛下进行反应。
[0024]
反应结束后,通过浓缩或过滤反应液除去溶剂,可以得到酰胺化物化合物(3),根据需要,也可以进行重结晶或柱分离等精制。
[0025]
式(1)中,r1和r4表示可被杂原子取代的碳原子数1~20的烃基,可优选列举出可被杂原子取代的碳原子数1~12的烃基,可特别优选列举出可被杂原子取代的碳原子数1~8的烃基。作为上述烃基,优选为脂肪族烃基,更优选为烷基。作为可被杂原子取代的碳原子数1~20的烃基,可以举出甲基、乙基、丙基、异丙基、丁基、仲丁基、叔丁基、戊基、己基、庚基、辛基、1,1,3,3-四甲基丁基、1-乙基戊基、2-乙基己基、癸基、十二烷基、十四烷基、十六烷基、十八烷基、烯丙基、苄基、环己基、金刚烷基、苯基、2,6-二异丙基苯基、2,4,6-三甲基苯基、2-甲氧基乙基、2-乙氧基乙基、2-(二甲基氨基)乙基等。优选为甲基、乙基、丙基、异丙基、丁基、辛基、十二烷基、环戊基、环己基、2-乙基己基、苄基、苯基、2,4,6-三甲基苯基,特别优选可列举出甲基、乙基、丁基、辛基、2-乙基己基、苄基。
[0026]
r1及r4中,作为杂原子,可举出氮原子、氧原子、硫原子等。烃基被氧原子、氮原子、硫原子等杂原子取代时,烃基具有例如-o-、-n<、-s-、-so
2-等基团,且烃链被这些基团中断。烃基被氧原子、氮原子、硫原子等杂原子取代时,优选烃基被氧原子取代,且烃链被-o-的基团中断。
[0027]
r2及r3表示氢原子或可被杂原子取代的碳原子数1~20的烃基,优选为氢原子。另外,作为可被杂原子取代的碳原子数1~20的烃基,优选为可被杂原子取代的碳原子数1~6的烃基,特别优选为可被杂原子取代的碳原子数1~4的烃基。作为可被杂原子取代的碳原子数1~20的烃基,可举出甲基、乙基、丙基、异丙基、丁基、仲丁基、叔丁基、戊基、己基、辛基、2-乙基己基、癸基、十二烷基、十四烷基、十六烷基、十八烷基、烯丙基、苄基、环己基、金刚烷基、苯基、2,6-二异丙基苯基、2,4,6-三甲基苯基、2-甲氧基乙基、2-乙氧基乙基、2-(二甲基氨基)乙基等。优选甲基、乙基、丙基、异丙基、丁基、环戊基、环己基、苯基、2-甲氧基乙基、2-乙氧基乙基、2-(二甲基氨基)乙基,特别优选甲基、乙基、丁基、2-甲氧基乙基、2-乙氧基乙基、2-(二甲基氨基)乙基。
[0028]
r2及r3中,作为杂原子,可举出氮原子、氧原子、硫原子等。烃基被氧原子、氮原子、硫原子等杂原子取代时,烃基具有例如-o-、-n<、-s-、-so
2-等基团,且烃链被这些基团中断。烃基被氧原子、氮原子、硫原子等杂原子取代时,优选烃基被氧原子取代,且烃链被-o-的基团中断。
[0029]
r2和r3可以与它们所键合的碳原子一起形成环结构。r2及r3在与它们所键合的碳原子一起形成环结构的情况下,例如可以采用以下所示的苯并咪唑鎓环结构。
[0030]
[化5]
[0031]
(式中,r1、r4和r5如上所述定义,rw、r
x
、ry和rz分别表示氢原子或碳原子数1~20的烃基。作为rw、r
x
、ry和rz所示的碳原子数1~20的烃基,可列举出甲基、乙基、丙基、异丙基、丁基、仲丁基、叔丁基、戊基、己基、辛基、2-乙基己基、癸基、十二烷基、十四烷基、十六烷基、十八烷基、烯丙基、苄基、环己基、金刚烷基、苯基、2,6-二异丙基苯基、2,4,6-三甲基苯基。
[0032]
r5表示氢原子或可被杂原子取代的碳原子数1~20的烃基,优选为可被杂原子取代的碳原子数1~20的烃基。作为可被杂原子取代的碳原子数1~20的烃基,优选为可被杂原子取代的碳原子数1~8的烃基,特别优选为可被杂原子取代的碳原子数1或2的烃基。作为上述烃基,优选为脂肪族烃基,更优选为烷基。作为可被杂原子取代的碳原子数1~20的烃基,可列举出甲基、乙基、丙基、异丙基、丁基、仲丁基、叔丁基、戊基、己基、庚基、辛基、1-乙基戊基、壬基、2-乙基己基、十一烷基、十三烷基、十五烷基、十七烷基、乙烯基、烯丙基、苄基、环己基、金刚烷基、苯基、2-甲氧基甲基、2-乙氧基甲基、2-(二甲基氨基)甲基等,优选可列举出甲基、乙基、丙基、异丙基、丁基、庚基、环己基、1-乙基戊基、苯基,特别优选可列举出甲基、乙基、庚基、1-乙基戊基。
[0033]
r5中,作为杂原子,可举出氮原子、氧原子、硫原子等。烃基被氧原子、氮原子、硫原子等杂原子取代时,烃基具有例如-o-、-n<、-nh-、-s-、-so
2-等基团,且烃链被这些基团中断。烃基被氧原子、氮原子、硫原子等杂原子取代时,优选烃基被氧原子取代,且烃链被-o-的基团中断。另外,作为另一方式,烃基被氧原子、氮原子、硫原子等杂原子取代时,可以形成具有-oh、-nh2等基团的烃基。
[0034]
作为咪唑鎓羧酸盐(1),例如可列举出1,3-二甲基咪唑鎓甲酸盐、1-乙基-3-甲基咪唑鎓甲酸盐、1-丁基-3-甲基咪唑鎓甲酸盐、1-甲基-3-辛基咪唑鎓甲酸盐、1-甲基-3-(1,1,3,3-四甲基丁基)咪唑鎓甲酸盐、1-甲基-3-(2-乙基己基)咪唑鎓甲酸盐、1-十二烷基-3-甲基咪唑鎓甲酸盐、1-甲基-3-十八烷基咪唑鎓甲酸盐、1-苄基-3-甲基咪唑鎓甲酸盐、1,3-二丁基咪唑鎓甲酸盐、1-丁基-3-乙基咪唑鎓甲酸盐、1-丁基-3-辛基咪唑鎓甲酸盐、1-丁基-3-(1,1,3,3-四甲基丁基)咪唑鎓甲酸盐、1-丁基-3-(2-乙基己基)咪唑鎓甲酸盐、1-丁基-3-十二烷基咪唑鎓甲酸盐、1-丁基-3-十八烷基咪唑鎓甲酸盐、1-苄基-3-丁基咪唑鎓甲酸盐、1,3-二辛基咪唑鎓甲酸盐、1,3-双(1,1,3,3-四甲基丁基)咪唑鎓甲酸盐、1-乙基-3-辛基咪唑鎓甲酸盐、1-乙基-3-(1,1,3,3-四甲基丁基)咪唑鎓甲酸盐、1-辛基-3-(2-乙基己基)咪唑鎓甲酸盐、1-(1,1,3,3-四甲基丁基)-3-(2-乙基己基)咪唑鎓甲酸盐、1-十二烷基-3-辛基咪唑鎓甲酸盐、1-十二烷基-3-(1,1,3,3-四甲基丁基)咪唑鎓甲酸盐、1-辛基-3-十八烷基咪唑鎓甲酸盐、1-(1,1,3,3-四甲基丁基)-3-十八烷基咪唑鎓甲酸盐、1-苄基-3-辛基咪唑鎓甲酸盐、1-苄基-3-(1,1,3,3-四甲基丁基)咪唑鎓甲酸盐、1,3-双(2-乙基己基)咪唑鎓甲酸盐、1-乙基-3-(2-乙基己基)咪唑鎓甲酸盐、1-(2-乙基己基)-3-十二烷基咪唑鎓
二(十八烷基)咪唑鎓2-乙基己酸盐、1-苄基-3-十八烷基咪唑鎓2-乙基己酸盐、1,3-二苄基咪唑鎓2-乙基己酸盐;1,3-二甲基苯并咪唑鎓甲酸盐、1,3-二甲基苯并咪唑鎓乙酸盐、3-二甲基苯并咪唑鎓2-乙基己酸盐。
[0035]
优选的咪唑鎓羧酸盐(1)为1,3-二甲基咪唑鎓乙酸盐、1-丁基-3-甲基咪唑鎓乙酸盐、1-甲基-3-辛基咪唑鎓乙酸盐、1-甲基-3-(1,1,3,3-四甲基丁基)咪唑鎓乙酸盐、1-甲基-3-(2-乙基己基)咪唑鎓乙酸盐、1-十二烷基-3-甲基咪唑鎓乙酸盐、1,3-二丁基咪唑鎓乙酸盐、1-丁基-3-辛基咪唑鎓乙酸盐、1-丁基-3-(1,1,3,3-四甲基丁基)咪唑鎓乙酸盐、1-丁基-3-(2-乙基己基)咪唑鎓乙酸盐、1-丁基-3-十二烷基咪唑鎓乙酸盐、1,3-二辛基咪唑鎓乙酸盐、1-辛基-3-(1,1,3,3-四甲基丁基)咪唑鎓乙酸盐、1-辛基-3-(2-乙基己基)咪唑鎓乙酸盐、1-十二烷基-3-辛基咪唑鎓乙酸盐、1-(1,1,3,3-四甲基丁基)-3-(2-乙基己基)咪唑鎓乙酸盐、1-十二烷基-3-(1,1,3,3-四甲基丁基)咪唑鎓乙酸盐、双(2-乙基己基)咪唑鎓乙酸盐、1-(2-乙基己基)-3-十二烷基咪唑鎓乙酸盐、1,3-二(十二烷基)咪唑鎓2-乙基己酸盐、1,3-二甲基咪唑鎓2-乙基己酸盐、1-丁基-3-甲基咪唑鎓2-乙基己酸盐、1-甲基-3-辛基咪唑鎓2-乙基己酸盐、1-甲基-3-(1,1,3,3-四甲基丁基)咪唑鎓2-乙基己酸盐、1-甲基-3-(2-乙基己基)咪唑鎓2-乙基己酸盐、1-十二烷基-3-甲基咪唑鎓2-乙基己酸盐、1,3-二丁基咪唑鎓2-乙基己酸盐、1-丁基-3-辛基咪唑鎓2-乙基己酸盐、1-丁基-3-(1,1,3,3-四甲基丁基)咪唑鎓2-乙基己酸盐、1-丁基-3-(2-乙基己基)咪唑鎓2-乙基己酸盐、1-丁基-3-十二烷基咪唑鎓2-乙基己酸盐、1,3-二辛基咪唑鎓2-乙基己酸盐、1-辛基-3-(1,1,3,3-四甲基丁基)咪唑鎓2-乙基己酸盐、1-辛基-3-(2-乙基己基)咪唑鎓2-乙基己酸盐、1-十二烷基-3-辛基咪唑鎓2-乙基己酸盐、1-(1,1,3,3-四甲基丁基)咪唑鎓2-乙基己酸盐、1-十二烷基-3-(1,1,3,3-四甲基丁基)咪唑鎓2-乙基己酸盐、双(2-乙基己基)咪唑鎓2-咪唑鎓2-乙基己酸盐、1,3-二(十二烷基)咪唑鎓2-乙基己酸盐,更优选为双(2-乙基己基)咪唑鎓乙酸盐、双(2-乙基己基)咪唑鎓2-乙基己酸盐。
[0036]
咪唑鎓羧酸盐(1)可以使用市售品。咪唑鎓羧酸盐(1)可以使用通过公知的方法得到的咪唑鎓羧酸盐,另外,也可以使用通过以下说明的方法制造的咪唑鎓羧酸盐。
[0037]
使下述式(4)所示的二羰基化合物、下述式(5a)及下述式(5b)所示的伯胺化合物、甲醛、下述式(6)所示的羧酸反应而得到式(1)的咪唑鎓羧酸盐。
[0038]
式(4):
[0039]
[化6](式中,r2和r3如上所述定义。)
[0040]
式(5a):
[0041]r1-nh2ꢀꢀꢀ
(5a)(式中,r1如上所述定义。)
[0042]
式(5b):
[0043]r4-nh2ꢀꢀꢀ
(5b)(式中,r4如上所述定义。)
[0044]
式(6):
[0045]
[化7](式中,r5如上所述定义。)
[0046]
作为式(4)所示的二羰基化合物(以下称为二羰基化合物(4)),优选列举乙二醛、二乙酰、3,4-己二酮、2,3-戊二酮、2,3-庚二酮、5-甲基-2,3-己二酮、3-甲基-2,3-环戊二酮、1,2-环己烷二酮、1-苯基-1,2-丙二酮、二苯甲酰基,更优选列举乙二醛、二乙酰,更优选为乙二醛。
[0047]
作为式(5a)所示的伯胺化合物(以下称为伯胺化合物(5a))及式(5b)所示的伯胺化合物(以下称为伯胺化合物(5b)),为选自甲胺、乙胺、丙胺、异丙胺、丁胺、叔丁胺、己胺、辛胺、1,1,3,3-四甲基丁胺、2-乙基己胺、十二烷胺、十四烷胺、十六烷胺、十八烷胺、2-甲氧基乙胺、2-乙氧基乙胺、3-甲氧基丙胺、3-乙氧基丙胺、3-丙氧基丙胺、3-异丙氧基丙胺、3-丁氧基丙胺、3-(2-乙基己氧基)丙胺、烯丙胺、苄胺、苯胺、2,6-二异丙基苯胺、2,4,6-三甲基苯胺中的至少1种伯胺化合物,优选为甲胺、乙胺、丁胺、己胺、辛胺、1,1,3,3-四甲基丁胺、2-乙基己胺、十二烷胺、十八烷胺、苄胺,更优选为甲胺、丁胺、辛胺、2-乙基己胺。
[0048]
作为式(6)所示的羧酸(以下称为羧酸(6)),优选列举出甲酸、乙酸、丙酸、丁酸、戊酸、己酸、庚酸、辛酸、2-乙基己酸、癸酸、月桂酸、十四烷酸、棕榈酸、十八烷酸、环己烷酸、乙氧基乙酸、丙氧基乙酸、2-(2-甲氧基乙氧基)乙酸、2-(2-乙氧基乙氧基)乙酸、2-(2-丙氧基乙氧基)乙酸、3-甲氧基丙酸、3-乙氧基丙酸、3-(2-甲氧基乙氧基)丙酸、3-(2-乙氧基乙氧基)丙酸、3-(2-丙氧基乙氧基)丙酸、3-(3-甲氧基丙氧基)丙酸、3-(3-乙氧基丙氧基)丙酸、3-(3-丙氧基丙氧基)丙酸、油酸、亚油酸、山梨酸、苯甲酸、邻苯二甲酸、间苯二甲酸、对苯二甲酸、乳酸、水杨酸、三氟乙酸等羧酸,更优选列举出甲酸、乙酸、丙酸、丁酸、戊酸、己酸、庚酸、辛酸、2-乙基己酸,特别优选为乙酸、2-乙基己酸。
[0049]
二羰基化合物(4)可以直接使用水溶液、甲醇、丁醇等醇溶液。
[0050]
作为伯胺化合物(5a)及伯胺化合物(5b)(以下,将伯胺化合物(5a)及伯胺化合物(5b)合称为胺化合物(5))的使用量,通常相对于二羰基化合物(4)1摩尔,胺化合物(5)为0.1~10摩尔,优选为0.5~3摩尔。相对于二羰基化合物(4)1摩尔,胺化合物(5)反应2摩尔而成为1摩尔的咪唑鎓羧酸盐(1),例如在胺化合物(5)小于2摩尔的情况下,除了目标咪唑鎓羧酸盐(1)以外,还存在二羰基化合物(4)(原料)与二羰基化合物(4)的聚合物。另外,相对于二羰基化合物(4)1摩尔,使用超过2摩尔的胺化合物(5)时,除了目标咪唑鎓羧酸盐(1)以外,还存在过量的胺化合物(5)。即使使用这些咪唑鎓羧酸盐(1)以外的化合物共存的咪唑鎓羧酸盐(1),也能够得到酰胺化物化合物(3)。
[0051]
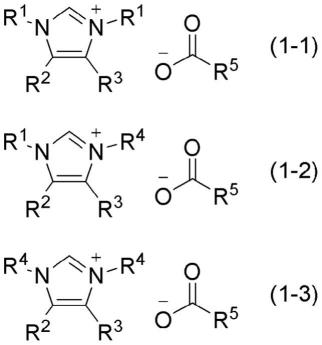
伯胺化合物(5a)与伯胺化合物(5b)的比例没有特别限定,为伯胺化合物(5a)∶伯胺化合物(5b)=0∶100~100∶0(摩尔比)的范围。另外,在伯胺化合物(5a)∶伯胺化合物(5b)=0∶100或伯胺化合物(5a)∶伯胺化合物(5b)=100∶0的情况下,r1=r4。另外,在r1=r4以外的情况下,即,在伯胺化合物(5a)∶伯胺化合物(5b)不为0∶100或100∶0的情况下,式(1)的化合物可以成为下述式(1-1)、式(1-2)、式(1-3)所示的化合物的混合物。
[0052]
[化8]
[0053]
(式(1-1)、式(1-2)和式(1-3)中,r1、r2、r3、r4、r5分别如上述定义。该混合物中的式(1-1)表示的化合物、式(1-2)表示的化合物、式(1-3)表示的化合物的比例根据反应中使用的伯胺化合物(5a)与伯胺化合物(5b)的比例而不同。式(1-1)所示的化合物、式(1-2)所示的化合物、式(1-3)所示的化合物均包含在咪唑鎓羧酸盐(1)中。
[0054]
甲醛可以直接使用水溶液、甲醇、丁醇等醇溶液。作为甲醛的使用量,通常,相对于二羰基化合物(6)1摩尔,甲醛为0.1~10摩尔,优选为0.5~5.0摩尔。
[0055]
作为羧酸(6)的使用量,通常相对于二羰基化合物(4)1摩尔为0.1~10摩尔,优选为0.5~2摩尔,进一步优选为1~1.5摩尔。
[0056]
反应温度根据所使用的原料、溶剂等而最佳的温度不同,通常为-10℃以上,优选为0℃~100℃。反应时间没有特别限定,优选为0.5~48小时。
[0057]
溶剂可以使用也可以不使用。在使用溶剂的情况下,所使用的溶剂只要不对反应造成影响,则并无特别限制。作为溶剂的具体例,可列举出甲苯、苯、二甲苯等芳香族烃,甲基环己烷、环己烷、己烷、庚烷、辛烷等脂肪族或脂环式烃,二氯甲烷、氯仿、四氯化碳、1,2-二氯乙烷等卤代烃,二乙醚、四氢呋喃、1,4-二噁烷等醚类,甲醇、乙醇等低级醇类,n,n-二甲基甲酰胺、乙腈、水等,优选为芳香族烃、低级醇类、水,特别优选为甲苯、水。溶剂也可以根据需要混合使用2种以上。
[0058]
溶剂的使用量相对于二羰基化合物(4)1质量份通常为50质量份以下,优选为0.1~10质量份。
[0059]
根据需要,也可以在氮、氩、氦等不对反应造成影响的非活性气体气氛下进行反应。
[0060]
反应结束后,通过使用有机溶剂的清洗除去杂质(例如,未反应的原料)、反应液的浓缩等,能够分离咪唑鎓羧酸盐(1),根据需要,也可以进行重结晶等的精制。
[0061]
在制造咪唑鎓羧酸盐(1)时,相对于化学计量量过量使用的羧酸(6)有时会残留在咪唑鎓羧酸盐(1)中。此时,通过与碳酸酯反应,能够将残留的羧酸(6)转化为对应的酯化合物。
[0062]
作为碳酸酯的具体例,可举出碳酸二甲酯、碳酸二乙酯、碳酸二丙酯、碳酸二丁酯、碳酸二戊酯、碳酸二己酯等碳酸二烷基酯、碳酸亚乙酯、碳酸亚丙酯、碳酸亚丁酯等环状的碳酸亚烷基酯,优选为碳酸二甲酯、碳酸二乙酯、碳酸二丙酯、碳酸二丁酯,特别优选为碳酸二甲酯。
[0063]
碳酸酯的使用量相对于残留的羧酸(6)1摩尔通常为1摩尔以上,优选为1~6摩尔。另外,在咪唑鎓羧酸盐(1)中与羧酸(6)一起含有水的情况下,水与碳酸酯反应,因此,相对于咪唑鎓羧酸盐(1)中所含的羧酸(6)及水的合计1摩尔,通常使用1摩尔以上、优选过量使用1~6摩尔的碳酸酯。反应温度为30~100℃、反应时间为1~8小时可将羧酸(6)转化为相应的酯化合物。通过使用有机溶剂的洗涤、反应液的浓缩等除去变换后的酯化合物,结果可以除去咪唑鎓羧酸盐(1)中所含的羧酸(6)。另外,即使在使用含有通过碳酸酯变换的酯化合物的咪唑鎓羧酸盐(1)的情况下,根据本发明的制造方法,也能够得到作为目标物的酰胺酸酯化合物(3)。
[0064]
接着,对多异氰酸酯化合物(2)进行说明。
[0065]
式(2)中,a表示下述(i)~(v)中的任一残基(以下,有时简称为“残基”)。(i)从脂肪族多异氰酸酯中除去异氰酸酯基而得到的残基、(ii)从脂环式多异氰酸酯中除去异氰酸酯基而得到的残基、(iii)从芳香族多异氰酸酯中除去异氰酸酯基而得到的残基、(iv)从芳香脂肪族多异氰酸酯中除去异氰酸酯基而得到的残基、(v)从由选自脂肪族多异氰酸酯、脂环式多异氰酸酯、芳香族多异氰酸酯和芳香脂肪族多异氰酸酯中的至少1种形成的改性异氰酸酯中除去异氰酸酯基而得到的残基。
[0066]
脂肪族多异氰酸酯、脂环式多异氰酸酯、芳香族多异氰酸酯、芳香脂肪族多异氰酸酯或它们的改性异氰酸酯为具有异氰酸酯基的化合物,残基a自身表示脂肪族多异氰酸酯、脂环式多异氰酸酯、芳香族多异氰酸酯、芳香脂肪族多异氰酸酯或它们的改性异氰酸酯的异氰酸酯基以外的部分。残基a通常为异氰酸酯基以外的可以具有取代基的x价烃基,优选由可被杂原子或卤素原子取代的x价烃基构成,此时,烃基的碳原子数更优选为1~100。另外,在另一方式中,优选残基不具有羟基、氨基之类的活性氢基。需要说明的是,上述x价的x为与式(2)中的x相同的数。
[0067]
作为残基a所示的异氰酸酯基以外的可以具有取代基的x价烃基的取代基的例子,可以举出氟原子、氯原子、溴原子、碘原子等卤素原子、二烷基氨基、烷氧基、芳氧基、硝基、氰基、磺酰基、(单烷基氨基)羰基氨基或(二烷基氨基)羰基氨基。另外,残基a的烃基可被氧原子、氮原子、硫原子等杂原子取代。残基a的烃基被氧原子、氮原子、硫原子等杂原子取代时,烃基具有例如-o-、-n<、-s-、-so
2-等基团,且烃链被这些基团中断。
[0068]
作为取代或未取代的x价烃基,可以举出亚乙基、正亚丙基、正亚丁基、正亚戊基、正亚己基、正亚庚基、正亚辛基、正亚壬基、正亚癸基、正亚十二烷基、正亚十八烷基、亚环己基、环己烷-1,2-二基二亚甲基、环己烷-1,4-二基二亚甲基等亚烷基、对亚苯基、间亚苯基、2-甲基-间亚苯基、4-甲基-间亚苯基、5-甲基-间亚苯基、亚萘基等亚芳基、苯基亚乙基、1-苯基亚丙基、2-苯基亚丙基、1-苯基亚丁基、2-苯基亚丁基、萘基亚乙基等芳基亚烷基、上述亚烷基与亚芳基适当组合而成的亚甲基二亚苯基、聚亚甲基聚亚苯基等亚烷基亚芳基等。
[0069]
作为残基a,可优选列举例如以下的基团。
[0070]
[化9]
[0071]
(式中,m为0~4的整数。)
[0072]
x为2以上且20以下的整数,优选为2~6,更优选为2~4,特别优选为2或3。
[0073]
多异氰酸酯化合物(2)可以举出脂肪族多异氰酸酯、脂环式多异氰酸酯、芳香族多异氰酸酯和芳香脂肪族多异氰酸酯或它们的改性异氰酸酯。多异氰酸酯化合物(2)可以为单体、二聚体、三聚体或多聚体。
[0074]
作为脂肪族多异氰酸酯,例如可列举出脂肪族二异氰酸酯、赖氨酸三异氰酸酯、4-异氰酸根合甲基-1,8-八亚甲基二异氰酸酯、双(2-异氰酸根合乙基)2-异氰酸根合戊二酸酯。
[0075]
作为上述脂肪族二异氰酸酯,优选碳原子数为4~30的脂肪族二异氰酸酯,例如可列举出1,4-四亚甲基二异氰酸酯、1,6-六亚甲基二异氰酸酯(以下表示为hdi)、2,2,4-三甲基六亚甲基二异氰酸酯、2,4,4-三甲基六亚甲基二异氰酸酯、赖氨酸二异氰酸酯等,优选hdi。脂肪族多异氰酸酯可以单独使用,也可以并用2种以上。
[0076]
作为脂环式多异氰酸酯,例如优选碳原子数为8~30的脂环式多异氰酸酯,具体而言,可列举出1,3-双(异氰酸根合甲基)环己烷、1,4-双(异氰酸根合甲基)环己烷、异氰脲酸3-异氰酸根合甲基-3,3,5-三甲基环己烷(以下,表示为ipdi)、双(4-异氰酸根合环己基)甲烷、降冰片烷二异氰酸酯、二聚酸二异氰酸酯等,优选为ipdi。脂环式多异氰酸酯可以单独使用,也可以并用2种以上。
[0077]
作为芳香族多异氰酸酯,例如可列举出芳香族二异氰酸酯、多亚甲基多苯基多异氰酸酯(以下表示为聚合mdi)。作为芳香族二异氰酸酯,可列举出2,4
’‑
二苯基甲烷二异氰酸酯、4,4
’‑
二苯基甲烷二异氰酸酯、粗制二苯基甲烷二异氰酸酯、1,4-亚苯基二异氰酸酯、2,4-甲苯二异氰酸酯、2,6-甲苯二异氰酸酯、3,3
’‑
二甲基-4,4
’‑
二异氰酸酯基联苯、3,3
’‑
二甲基-4,4
’‑
二异氰酸酯基二苯基甲烷、1,5-萘二氰酸酯等。芳香族多异氰酸酯可以单独使用,也可以并用2种以上。从工业上获得的容易性出发,优选为2,4-甲苯二异氰酸酯、2,6-甲苯二异氰酸酯、4,4
’‑
二苯基甲烷二异氰酸酯、聚合mdi。
[0078]
作为芳香脂肪族多异氰酸酯,例如可列举出1,3-亚二甲苯基二异氰酸酯、1,4-亚二甲苯基二异氰酸酯、α,α,α’,α
’‑
四甲基亚二甲苯基二异氰酸酯等。芳香脂肪族多异氰酸酯可以单独使用,也可以并用2种以上。
[0079]
这些多异氰酸酯化合物中,优选为芳香族多异氰酸酯,更优选为2,4-甲苯二异氰酸酯、2,6-甲苯二异氰酸酯、4,4
’‑
二苯基甲烷二异氰酸酯、聚合mdi。
[0080]
作为改性异氰酸酯,例如可列举出通过形成缩二脲键、脲键、异氰脲酸酯键、脲二酮键、氨基甲酸酯键、脲基甲酸酯键、噁二嗪三酮键等而制造的上述多异氰酸酯的2~20聚
体的低聚物。具有缩二脲键的多异氰酸酯是使水、叔丁醇、尿素等所谓的缩二脲化剂与多异氰酸酯以缩二脲化剂/多异氰酸酯的异氰酸酯基的摩尔比为约1/2~约1/100进行反应后,将未反应多异氰酸酯除去精制而得到的。具有异氰脲酸酯键的多异氰酸酯例如通过催化剂等进行环状3量化反应,在转化率达到约5~约80质量%时停止反应,将未反应多异氰酸酯除去精制而得到。
[0081]
改性异氰酸酯中包含的具有氨基甲酸酯键的多异氰酸酯化合物例如可以通过使三羟甲基丙烷等2~6元的醇系化合物与多异氰酸酯以醇系化合物的羟基/多异氰酸酯的异氰酸酯基的摩尔比约1/2~约1/100反应后,将未反应多异氰酸酯除去精制而得到。不一定需要未反应多异氰酸酯的除去精制。作为改性异氰酸酯化合物,优选由选自由2,4-甲苯二异氰酸酯、2,6-甲苯二异氰酸酯、4,4
’‑
二苯基甲烷二异氰酸酯或多亚甲基多苯基多异氰酸酯组成的组中的1种或2种以上形成的2聚体或3聚体的多异氰酸酯。
[0082]
式(3)
[0083]
[化10]
[0084]
式(3)中,y和z为1以上且19以下的整数,y、z的合计为2以上且20以下。优选y和z为1~5,y、z的合计为2~6,更优选y和z为1~3,y、z的合计为2~4,特别优选y和z为1或2,y、z的合计为2或3。
[0085]
a、r1、r2、r3、r4、r5分别如上所述定义。
[0086]
在酰胺化物化合物(3)具有光学异构体、立体异构体、位置异构体等异构体的情况下,只要没有明确记载是哪一种异构体,则哪一种异构体的混合物都包含在酰胺化物化合物(3)中。例如,在酰胺化物化合物(3)中存在光学异构体的情况下,从外消旋体分割的该光学异构体也可以包含在酰胺化物化合物(3)中。这些异构体可以通过以往已知的分离方法(浓缩、溶剂萃取、柱色谱、重结晶等)分别以单一化合物的形式得到。
[0087]
作为本发明的酰胺化物化合物(3),可以列举以下的物质。下述具体例中,et表示乙基,bu表示正丁基,hept表示正庚基,oct表示正辛基,1-etpent表示1-乙基戊基,2-ethex表示2-乙基己基。
[0088]
[化11]
[0089]
[化12]
[0090]
[化13]
[0091]
式(3-5-1)~(3-5-18)中,m为0~4的整数。
[0092]
[化14]
[0093]
式(3-6-1)~(3-6-18)及式(3-7-1)~(3-7-18)中,m为0~4的整数。
[0094]
[化15]
[0095]
式(3-8-1)~(3-8-18)中,m为0~4的整数。
[0096]
酰胺酸酯化合物(3)优选为式(3-1-4)、(3-1-6)、(3-1-10)、(3-1-12)、(3-1-16)、(3-1-18)、(3-2-4)、(3-2-6)、(3-2-10)、(3-2-12)、(3-2-16)、(3-2-18)、(3-3-4)、(3-3-6)、(3-3-10)、(3-3-12)、(3-3-18)、(3-4-4)、(3-4-6)、(3-4-10)、(3-4-12)、(3-4-16)、(3-4-18)、(3-5-4)、(3-5-6)、(3-5-10)、(3-5-12)、(3-5-18)、(3-6-4)、(3-6-12)、(3-6-16)、(3-6-18)、(3-7-4)、(3-7-6)、(3-7-10)、(3-7-12)、(3-7-16)、(3-7-7)、(3-8)、(3-所示的化合物,更优选为式(3-1-6)、(3-1-18)、(3-2-6)、(3-2-18)、(3-3-6)、(3-3-18)、(3-4-6)、(3-4-18)、(3-5-6)、(3-5-18)、(3-6-6)、(3-6-18)、(3-7-6)、(3-7-18)、(3-8-6)、(3-8-18)。
[0097]
通过本发明的制造方法,除了目标的酰胺化物化合物(3)以外,在反应混合物中还可以存在式(p)、式(q)、式(r)表示的副产物。
[0098]
[化16]
[0099]
(式中,r1~r5、x、y、z、a如上所述定义。)也可以分离式(p)、式(q)、式(r)表示的副产物,分离酰胺化物化合物(3)作为用于封闭型异氰酸酯的封端剂解离催化剂使用,但也可以将同时含有式(p)、式(q)、式(r)表示的至少1种副产物和酰胺化物化合物(3)的混合物作为本发明的用于封闭型异氰酸酯的封端剂解离催化剂使用。另外,可以将同时含有式(p)、式(q)、式(r)所示的至少1种副产物和酰胺化物化合物(3)的混合物与封闭型异氰酸酯、具有异氰酸酯反应性基团的化合物混合,制成本发明的热固性树脂组合物。式(p)、式(q)、式(r)表示的副产物中,式(r)表示的副产物与酰胺化物化合物(3)同样地具有酰胺化物基团,因此认为如酰胺化物化合物(3)那样作为用于封闭型异氰酸酯的封端剂解离催化剂发挥功能。
[0100]
与酰胺化物化合物(3)一起含有式(p)、式(q)、式(r)所示的至少1种副产物的混合物包含在本发明的酰胺化物化合物(3)中。
[0101]
《用于封闭型异氰酸酯的封端剂解离催化剂》酰胺化物化合物(3)可以作为用于封闭型异氰酸酯的封端剂解离催化剂(以下称为封端剂解离催化剂)使用。封端剂解离催化剂是指能够使封闭型异氰酸酯中封闭异氰酸
酯基从而抑制反应的封端剂解离、进而促进再生的异氰酸酯基与共存的异氰酸酯反应性基团发生反应的催化剂。
[0102]
在使用酰胺化物化合物(3)作为用于封闭型异氰酸酯的封端剂解离催化剂的情况下,在式(3)中,r1和r4相同或不同,表示可被杂原子取代的碳原子数1~20的烃基,可优选列举可被杂原子取代的碳原子数1~12的烃基,可特别优选列举可被杂原子取代的碳原子数1~8的烃基。作为上述烃基,优选为脂肪族烃基,更优选为烷基。作为可被杂原子取代的碳原子数1~20的烃基,可以举出甲基、乙基、丙基、异丙基、丁基、仲丁基、叔丁基、戊基、己基、庚基、辛基、1,1,3,3-四甲基丁基、1-乙基戊基、2-乙基己基、癸基、十二烷基、十四烷基、十六烷基、十八烷基、烯丙基、苄基、环己基、金刚烷基、苯基、2,6-二异丙基苯基、2,4,6-三甲基苯基、2-甲氧基乙基、2-乙氧基乙基、2-(二甲基氨基)乙基等。优选为甲基、乙基、丙基、异丙基、丁基、辛基、十二烷基、环戊基、环己基、2-乙基己基、苄基、苯基、2,4,6-三甲基苯基,特别优选可列举出甲基、乙基、丁基、辛基、2-乙基己基、苄基。
[0103]
r1及r4中,作为杂原子,可举出氮原子、氧原子、硫原子等。烃基被氧原子、氮原子、硫原子等杂原子取代时,烃基具有例如-o-、-n<、-s-、-so
2-等基团,且烃链被这些基团中断。烃基被氧原子、氮原子、硫原子等杂原子取代时,优选烃基被氧原子取代,且烃链被-o-的基团中断。
[0104]
对含有酰胺化物化合物(3)的封端剂解离催化剂进行说明。
[0105]
封端剂解离催化剂可以单独使用1种,也可以作为2种以上的混合物使用。另外,也可以根据需要混合溶剂等来使用。
[0106]
作为溶剂,没有特别限定,例如可举出苯、甲苯、二甲苯、环己烷、矿物油精、石脑油等烃溶剂;丙酮、甲乙酮、甲基异丁基酮等酮溶剂;乙酸乙酯、乙酸丁酯、乙酸溶纤剂等酯溶剂;甲醇、乙醇、2-丙醇、丁醇、2-甲氧基乙醇、2-乙氧基乙醇、2-丁氧基乙醇等醇溶剂;乙二醇、丙二醇、二乙二醇、聚乙二醇、甘油等多元醇溶剂;水等,这些溶剂可以单独使用,也可以并用2种以上。
[0107]
本发明的封端剂解离催化剂是促进封闭型异氰酸酯和具有异氰酸酯反应性基团的化合物的混合物的固化的催化剂。
[0108]
本发明的封端剂解离催化剂只要含有酰胺化物化合物(3)作为有效成分,就能够充分实现本发明的目的,根据需要也可以含有公知的封端剂解离催化剂。
[0109]
本发明的封端剂解离催化剂可以适合用作例如封闭型异氰酸酯的封端剂的解离方法的催化剂。在该封端剂解离方法中,在上述封端剂解离催化剂存在下对封闭型异氰酸酯进行加热。
[0110]
在本发明的封端剂解离方法中,作为封端剂解离催化剂的使用量,没有特别限定,通常,封端剂解离催化剂中所含的酰胺化物化合物(3)的量相对于以下说明的热固性树脂组合物中的固体成分为0.01~15重量%、优选为0.05~10重量%、更优选为0.1~5重量%的量。
[0111]
需要说明的是,本说明书中,“固体成分”是指在热固性树脂组合物中除去后述的溶剂后的成分的总质量。因此,在树脂组合物不含溶剂的情况下,该组合物的总质量与固体成分一致。
[0112]
反应温度根据所使用的封闭型异氰酸酯而不同,可以设为60~250℃左右,优选设
为80~200℃左右。反应时间为30秒~5小时左右,优选为30秒~2小时左右。
[0113]
《热固性树脂组合物》本发明的热固性树脂组合物含有酰胺化物化合物(3)、封闭型异氰酸酯和具有异氰酸酯反应性基团的化合物。
[0114]
作为封闭型异氰酸酯,例如可以举出使公知的多异氰酸酯与公知的封端剂反应、将多异氰酸酯中的异氰酸酯基用封端剂封端的化合物。封闭型异氰酸酯可以是单独的,也可以是2种以上混合而成的。
[0115]
本发明中,多异氰酸酯只要是具有2个以上异氰酸酯基的化合物就没有特别限定,作为公知的多异氰酸酯,可以举出脂肪族多异氰酸酯、脂环式多异氰酸酯、芳香族多异氰酸酯、芳香脂肪族多异氰酸酯、它们的改性异氰酸酯等。这些多异氰酸酯可以单独使用,也可以混合2种以上。
[0116]
作为脂肪族多异氰酸酯,例如可列举出1,4-四亚甲基二异氰酸酯、1,6-六亚甲基二异氰酸酯、2,2,4-三甲基六亚甲基二异氰酸酯、2,4,4-三甲基六亚甲基二异氰酸酯、赖氨酸二异氰酸酯等。
[0117]
作为脂环式多异氰酸酯,例如可列举出1,3-双(异氰酸根合甲基)环己烷、1,4-双(异氰酸根合甲基)环己烷、异氰脲酸3-异氰酸根合甲基-3,3,5-三甲基环己烷(异佛尔酮二异氰酸酯)、双(4-异氰酸根合环己基)甲烷、降冰片烷二异氰酸酯、二聚酸二异氰酸酯等。
[0118]
作为芳香族多异氰酸酯,例如可列举出2,4
’‑
二苯基甲烷二异氰酸酯、4,4
’‑
二苯基甲烷二异氰酸酯、粗制二苯基甲烷二异氰酸酯、1,4-亚苯基二异氰酸酯、2,4-甲苯二异氰酸酯、2,6-甲苯二异氰酸酯、3,3
’‑
二甲基-4,4
’‑
二异氰酸酯基联苯、3,3
’‑
二甲基-4,4
’‑
二异氰酸酯基二苯基甲烷、1,5-亚萘基二异氰酸酯等。
[0119]
作为芳香脂肪族多异氰酸酯,例如可列举出1,3-亚二甲苯基二异氰酸酯、1,4-亚二甲苯基二异氰酸酯、α,α,α’,α
’‑
四甲基亚二甲苯基二异氰酸酯等。
[0120]
作为改性异氰酸酯,例如可列举出:通过上述多异氰酸酯化合物与具有活性氢基的化合物的反应而得到的异氰酸酯基末端化合物、多异氰酸酯化合物或/和该异氰酸酯基末端化合物的反应物(例如,通过加合型多异氰酸酯、脲基甲酸酯化反应、碳二亚胺化反应、脲二酮化反应、异氰脲酸酯化反应、脲酮亚胺化反应、缩二脲化反应等而得到的异氰酸酯改性体等)。
[0121]
作为公知的封端剂,例如可列举出甲醇、乙醇、丙醇、异丙醇、丁醇、仲丁醇、叔丁醇、2-乙基己醇、丁基溶纤剂等醇类、2,2,2-三氟乙醇、1,1,1,3,3,3-六氟-2-丙醇等氟化醇类、苯酚、甲酚、2-羟基吡啶等酚类、二异丙胺等胺类、ε-己内酰胺、δ-戊内酰胺、γ-丁内酰胺等内酰胺类、甲醛肟、乙醛肟、丙酮肟、甲乙酮肟、甲基异丁酮肟等肟类、乙酰丙酮等酮烯醇类、1,2-吡唑、3,5-二甲基吡唑等吡唑类、三唑等三唑类等,优选为内酰胺类、肟类、吡唑类,特别优选为ε-己内酰胺、甲乙酮肟、3,5-二甲基吡唑。
[0122]
作为具有异氰酸酯反应性基团的化合物,可列举出多元醇、多胺、烷醇胺等具有2个以上活性氢基的化合物。这些具有异氰酸酯反应性基团的化合物可以为2种以上的混合物。
[0123]
本发明中,多元醇为具有2个以上羟基的化合物。作为多元醇,可举出聚醚多元醇、聚酯多元醇、丙烯酸多元醇、聚烯烃多元醇、氟多元醇、聚碳酸酯多元醇、聚氨酯多元醇等。
这些多元醇可以是2种以上的混合物。
[0124]
作为聚醚多元醇,可以举出脂肪族胺多元醇、芳香族胺多元醇、曼尼希多元醇、多元醇、多元酚、双酚类等活性氢化合物、以及在它们上加成了环氧烷的化合物等。这些聚醚多元醇可以为2种以上的混合物。
[0125]
作为脂肪族胺多元醇,可列举出亚烷基二胺系多元醇、烷醇胺系多元醇等。这些多元醇化合物是以亚烷基二胺、烷醇胺作为引发剂使环氧乙烷、环氧丙烷等环状醚中的至少1种开环加成而成的末端羟基的多官能多元醇化合物。作为亚烷基二胺,可以没有限定地使用公知的化合物。具体而言,优选使用乙二胺、丙二胺、丁二胺、六亚甲基二胺、新戊二胺等碳原子数为2~8的亚烷基二胺。这些脂肪族胺多元醇可以是2种以上的混合物。
[0126]
芳香族胺多元醇是以芳香族二胺为引发剂使环氧乙烷、环氧丙烷等环状醚中的至少1种开环加成而成的末端羟基的多官能聚醚多元醇化合物。作为引发剂,可以没有限定地使用公知的芳香族二胺。具体而言,可列举出2,4-甲苯二胺、2,6-甲苯二胺、二乙基甲苯二胺、4,4
’‑
二氨基二苯基甲烷、对苯二胺、邻苯二胺、萘二胺等。其中,特别优选甲苯二胺(2,4-甲苯二胺、2,6-甲苯二胺或它们的混合物)的使用。这些芳香族胺多元醇可以是2种以上的混合物。
[0127]
曼尼希多元醇是通过苯酚和/或其烷基取代衍生物、甲醛和烷醇胺的曼尼希反应而得到的活性氢化合物或通过使环氧乙烷、环氧丙烷中的至少1种与该化合物进行开环加成聚合而得到的多元醇化合物。这些曼尼希多元醇可以是2种以上的混合物。
[0128]
作为多元醇,可列举出2元醇(例如乙二醇、丙二醇、1,4-丁二醇、1,6-己二醇、二乙二醇、三乙二醇、二丙二醇、新戊二醇等)、3元以上的醇(例如甘油、三羟甲基丙烷、季戊四醇、甲基葡糖苷、山梨糖醇、蔗糖等)等。这些多元醇可以是2种以上的混合物。
[0129]
作为多元酚,可列举出邻苯三酚、氢醌等。这些多元酚可以为2种以上的混合物。
[0130]
作为双酚类,可列举出双酚a、双酚s、双酚f、苯酚与甲醛的低缩合物等。这些双酚类可以是2种以上的混合物。
[0131]
作为聚酯多元醇,可列举出例如通过选自琥珀酸、己二酸、癸二酸、二聚酸、马来酸酐、邻苯二甲酸酐、间苯二甲酸、对苯二甲酸等羧酸的组中的二元酸的单独或混合物与选自乙二醇、丙二醇、二乙二醇、新戊二醇、三羟甲基丙烷、甘油等组中的多元醇的单独或混合物的缩合反应而得到的聚酯多元醇、以及例如通过使用了多元醇的ε-己内酯的开环聚合而得到的聚己内酯类等。这些聚酯多元醇可以是2种以上的混合物。
[0132]
丙烯酸多元醇是通过使具有羟基的含烯属不饱和键的单体的单独或混合物与可与其共聚的其它含烯属不饱和键的单体的单独或混合物共聚而得到的化合物。作为具有羟基的含烯属不饱和键的单体,例如可列举出丙烯酸羟基乙酯、丙烯酸羟基丙酯、丙烯酸羟基丁酯、甲基丙烯酸羟基乙酯、甲基丙烯酸羟基丙酯、甲基丙烯酸羟基丁酯等,优选为丙烯酸羟基乙酯、甲基丙烯酸羟基乙酯。这些丙烯酸多元醇可以是2种以上的混合物。
[0133]
作为能够与具有羟基的含烯属不饱和键的单体共聚的其它含烯属不饱和键的单体,例如可列举出丙烯酸甲酯、丙烯酸乙酯、丙烯酸丙酯、丙烯酸异丙酯、丙烯酸丁酯、丙烯酸异丁酯、丙烯酸己酯、丙烯酸环己酯、丙烯酸-2-乙基己酯、丙烯酸月桂酯、丙烯酸苄酯、丙烯酸苯酯等丙烯酸酯;甲基丙烯酸甲酯、甲基丙烯酸乙酯、甲基丙烯酸丙酯、甲基丙烯酸异丙酯、甲基丙烯酸正丁酯、甲基丙烯酸异丁酯、甲基丙烯酸己酯、甲基丙烯酸环己酯、甲基丙
烯酸-2-乙基己酯、甲基丙烯酸月桂酯、甲基丙烯酸苄酯、甲基丙烯酸苯酯等甲基丙烯酸酯;丙烯酸、甲基丙烯酸、马来酸、衣康酸等不饱和羧酸;丙烯酰胺、甲基丙烯酰胺、n,n-亚甲基双丙烯酰胺、双丙酮丙烯酰胺、双丙酮甲基丙烯酰胺、马来酰胺、马来酰亚胺等不饱和酰胺;以及甲基丙烯酸缩水甘油酯、苯乙烯、乙烯基甲苯、乙酸乙烯酯、丙烯腈、富马酸二丁酯等乙烯基系单体;乙烯基三甲氧基硅烷、乙烯基甲基二甲氧基硅烷、γ-(甲基)丙烯酰氧基丙基三甲氧基硅烷等具有水解性甲硅烷基的乙烯基系单体等。
[0134]
作为聚烯烃多元醇,例如可列举出具有2个以上羟基的聚丁二烯、氢化聚丁二烯、聚异戊二烯、氢化聚异戊二烯等。这些聚烯烃多元醇可以是2种以上的混合物。
[0135]
氟多元醇为分子内含有氟的多元醇,例如可列举氟烯烃、环乙烯基醚、羟基烷基乙烯基醚、单羧酸乙烯酯等的共聚物。这些氟多元醇可以为2种以上的混合物。
[0136]
作为聚碳酸酯多元醇,可以举出将碳酸二甲酯等碳酸二烷基酯、碳酸亚乙酯等碳酸亚烷基酯、碳酸二苯酯等碳酸二芳基酯等低分子碳酸酯化合物与上述聚酯多元醇中使用的低分子多元醇缩聚而得到的聚碳酸酯多元醇。这些聚碳酸酯多元醇可以是2种以上的混合物。
[0137]
聚氨酯多元醇可以通过利用常规方法使例如多元醇与多异氰酸酯反应而得到。作为不含羧基的多元醇,作为低分子量的多元醇,可举出乙二醇、丙二醇等,作为高分子量的多元醇,可举出丙烯酸多元醇、聚酯多元醇、聚醚多元醇等。这些聚氨酯多元醇可以是2种以上的混合物。
[0138]
在本发明中,多胺是具有2个以上的伯氨基或仲氨基的化合物。作为多胺,例如可列举出低分子量多胺、高分子量多胺、烷醇胺等。这些多胺可以是2种以上的混合物。
[0139]
作为低分子量多胺,例如可列举出4,4
’‑
二苯基甲烷二胺等芳香族胺、1,3-或1,4-苯二甲胺或其混合物等芳香脂肪族胺、3-氨基甲基-3,5,5-三甲基环己胺、1,3-双(氨基甲基)环己烷、1,4-环己二胺等脂环式胺、乙二胺、1,3-丙二胺、1,4-丁二胺、1,6-六亚甲基二胺、肼、二亚乙基三胺、三亚乙基四胺、四亚乙基五胺等脂肪族胺等。这些低分子量多胺可以是2种以上的混合物。
[0140]
作为高分子量多胺,例如可列举出聚氧化烯二胺(重均分子量400~4000)、聚氧化烯三胺(重均分子量400~5000)等。这些高分子量多胺可以是2种以上的混合物。
[0141]
作为烷醇胺,例如可列举出单乙醇胺、二乙醇胺、n-(2-氨基乙基)乙醇胺、n-(2-羟基丙基)乙二胺、单丙醇胺、单异丙醇胺、二丙醇胺、二异丙醇胺、乙二醇双(3-氨基丙基)醚、新戊醇胺、甲基乙醇胺等。
[0142]
本发明的热固性树脂组合物中,封闭型异氰酸酯与具有异氰酸酯反应性基团的化合物的配混比率根据所需的物性来确定,没有特别限定,通常为[封闭型异氰酸酯的有效异氰酸酯基(mol)]/[具有异氰酸酯反应性基团的化合物的活性氢基(mol)]=0.2~3的范围。需要说明的是,封闭型异氰酸酯的有效异氰酸酯基是指封端剂从封闭型异氰酸酯解离时再生的异氰酸酯基。
[0143]
本发明的热固性树脂组合物中,作为本发明的封端剂解离催化剂的使用量,没有特别限定,通常,热固性树脂组合物中,封端剂解离催化剂中所含的酰胺化物化合物(3)的量相对于热固性树脂组合物中的固体成分为0.01~15重量%、优选为0.05~10重量%、更优选为0.1~5重量%的量。
[0144]
本发明的热固性树脂组合物中,根据需要,可以使用该技术领域中常用的公知的聚氨酯制造用催化剂、添加剂、颜料、溶剂等。
[0145]
作为公知的聚氨酯制造用催化剂,没有特别限定,例如,二月桂酸二丁基锡、二-2-乙基己酸二丁基锡、二月桂酸二辛基锡、二乙酸二丁基锡、二氧化二丁基锡、二氧化二辛基锡、乙酰丙酮锡、乙酸锡、辛酸锡、月桂酸锡等锡化合物;辛酸铋、环烷酸铋、乙酰丙酮铋等铋化合物;钛酸四正丁酯、钛酸四异丙酯、对苯二甲酸钛等钛化合物;三乙胺、n,n,n’,n
’‑
四甲基乙二胺、n,n,n’,n
’‑
四甲基丙二胺、n,n,n’,n”,n
”‑
五甲基二亚乙基三胺、n,n,n’,n”,n
”‑
五甲基二亚丙基三胺、n,n,n’,n
’‑
四甲基胍、1,3,5-三(n,n-二甲基氨基丙基)六氢-均三嗪、1,4-二氮杂双环[2.2.2]辛烷(dabco)、1,8-二氮杂双环[5.4.0]十一碳烯-7、三亚乙基二胺、n,n,n’,n
’‑
四甲基六亚甲基二胺、n-甲基-n
’‑
(2-二甲基氨基乙基)哌嗪、n,n
’‑
二甲基哌嗪、二甲基环己胺、n-甲基吗啉、n-乙基吗啉、双(2-乙基吗啉。-二甲基氨基乙基)醚、1-甲基咪唑、1,2-二甲基咪唑、1-异丁基-2-甲基咪唑、1-二甲基氨基丙基咪唑等叔胺化合物、四甲基氯化铵等四烷基卤化铵、四甲基氢氧化铵盐等四烷基氢氧化铵、四甲基铵-2-乙基己酸盐、2-羟基丙基三甲基铵甲酸盐、2-羟基丙基三甲基铵-2-乙基己酸盐等四烷基铵有机酸盐类等季铵盐化合物。
[0146]
作为添加剂,没有特别限定,例如可以举出:受阻胺类、苯并三唑类、二苯甲酮类等紫外线吸收剂;高氯酸盐类、羟基胺类等着色防止剂;受阻酚类、磷系、硫系、酰肼类等抗氧化剂;锡系、锌系、胺类等氨基甲酸酯化催化剂;流平剂;流变控制剂;颜料分散剂等。
[0147]
作为颜料,没有特别限定,例如可以举出:喹吖啶酮类、偶氮类、酞菁类等有机颜料;氧化钛、硫酸钡、碳酸钙、二氧化硅等无机颜料;以及碳系颜料、金属箔状颜料、防锈颜料等颜料。
[0148]
作为溶剂,没有特别限定,例如可举出苯、甲苯、二甲苯、环己烷、矿物油精、石脑油等烃类,丙酮、甲乙酮、甲基异丁基酮等酮类,乙酸乙酯、乙酸丁酯、乙酸溶纤剂等酯类,甲醇、乙醇、2-丙醇、丁醇、2-甲氧基乙醇、2-乙氧基乙醇、2-丁氧基乙醇等醇类,乙二醇、丙二醇、二乙二醇、聚乙二醇、甘油等多元醇类,水等,这些溶剂可以单独使用,也可以并用2种以上。
[0149]
设想在高温下保管等的情况下,也可以将本发明的热固性树脂组合物分成封闭型异氰酸酯和具有异氰酸酯反应性基团的化合物而制成二液型热固性组合物,在使用时混合上述二液型热固性组合物而作为本发明的热固性树脂组合物使用。在这样的情况下,封端剂解离催化剂也可以在混合前述二液型热固性组合物时添加使用,也可以预先混合具有异氰酸酯反应性基团的化合物和封端剂解离催化剂。
[0150]
本发明的热固性树脂组合物可以用于汽车用、建筑物用、钢制家具等金属制品用、乐器等木工制品用、建筑机械等机械车辆用、窗框等建筑材料用、办公设备等家电用等的涂料、人造皮革用、橡胶辊用等的涂布材料、油墨、粘接剂、粘合剂、电子部件用的密封材料、汽车用、建筑物用等的密封材料、3d打印机用等的成型材料等。
[0151]
接着,对本发明的热固性树脂组合物的固化方法进行说明。
[0152]
本发明的方法中,在上述封端剂解离催化剂存在下,对封闭型异氰酸酯与具有异氰酸酯反应性基团的化合物的混合物进行加热。
[0153]
反应温度根据所使用的封闭型异氰酸酯而不同,可以设为60~250℃左右,优选设
为80~200℃左右。反应时间可以为30秒~5小时左右,优选为1分钟~60分钟左右。
[0154]
本发明的固化物可以通过经过上述本发明的热固性树脂组合物的固化方法来制造。实施例
[0155]
使用制造例及实施例更详细地说明本发明,但本发明并不限定于这些实施例。
[0156]
(i)1h-nmr分析条件装置:bruker株式会社制av400频率:400mhz
[0157]
(ii)液相色谱质谱(以下称为lc-ms)条件lc装置:thermo fisher scientific株式会社制ultimate 3000柱:株式会社住化分析中心制sumipax ods z-clue(长度50mm、内径3.0mm、粒径2μm)柱温:35℃检测方法:光电二极管阵列(pda)检测器,240nm流速:0.5ml/分钟流动相:a=10mm甲酸铵水溶液,b=甲醇梯度:参照下述表1试样:样品10mg/甲醇20ml试样注入量:1μlms装置:exactive离子化:esi+扫描量程:m/z 50~1000
[0158]
[表1]
[0159]
(iii)固化温度测定条件装置:株式会社cyber制造的自动固化时间测定装置madoka搅拌棒:型号3jc-5060w搅拌速度:自转100rpm、公转25rpm
[0160]
(iv)聚合mdi的nco基含有率(%)的测定方法此处的nco基含有率(%)是以质量分率表示存在于多异氰酸酯中的异氰酸酯基量的值,通过以下的方法测定、算出。
[0161]
将聚合mdi(sumidur 44v20,sumika covestro urethane co.,ltd.制)1.6341g采
集到200ml三角烧瓶中,加入0.2mol/l二丁胺的甲苯溶液50ml,使聚合mdi溶解。接着,在聚合mdi溶液中少量添加溴甲酚绿,用滴定管滴加0.5mol/l盐酸乙醇溶液。另外,除了不使用聚合mdi以外,以同样的操作实施试验。烧瓶中的溶液从蓝色变色为黄色为止所需的盐酸乙醇溶液的量在试验中为50.17ml,在使用聚合mdi的体系中为25.24ml。
[0162]
由下述式算出聚合mdi的nco基含有率为32.0%。nco基含有率(%)=[{(试验的盐酸乙醇溶液滴定量(ml)-试样的盐酸乙醇溶液滴定量(ml)}
×
盐酸乙醇溶液浓度(mol/ml)]/聚合mdi的重量(g)
×
4.202=[{(50.17(ml)-25.24(ml)}
×
0.5(mol/ml)]/1.6341(g)
×
4.202
[0163]
(v)有效nco基含有率(%)的计算方法此处的有效nco基含有率(%)是指对封端化反应后的封闭型异氰酸酯中存在的可参与交联反应的封闭型异氰酸酯基量进行定量化的值,以异氰酸酯基的质量(%)表示,通过下式算出。有效nco基含量(%)={(封闭型异氰酸酯的固体成分(质量(%)))
×
(反应中使用的多异氰酸酯质量
×
前体的多异氰酸酯的nco基含量(%))}/(封端反应后的封闭型异氰酸酯的树脂质量)。另外,在被溶剂等稀释的情况下,记载被稀释的状态下的值。
[0164]
(vi)固体成分的计算方法将约1.5g试样在110℃下加热3小时,由加热前后的质量算出试样中的固体成分(%)。
[0165]
(vii)热固性树脂组合物的组成以有效nco基(mol):羟基(mol):酰胺化物基(mol)=1.00:0.95:0.05的方式加入封闭型异氰酸酯、多元醇、酰胺化物化合物,以相对于封闭型异氰酸酯的固体成分总溶剂量为1.0重量倍的方式加入甲基异丁基酮。有效nco基(mol)和羟基(mol)由下述式算出。有效nco基(mol)=封闭型异氰酸酯投入量(g)
÷
封闭型异氰酸酯的有效nco基含有率(%)
÷
4.202羟基(mol)=多元醇加入量(g)
×
多元醇的羟值(mg koh/g)
÷
56.1
[0166]
酰胺化物基在本说明书中,将下述式(a)所示的骨架作为酰胺化物基。
[0167]
[化17]
[0168]
(式中,r1~r4分别如前述定义。)
[0169]
实施例中,酰胺化物基浓度通过以下的方法算出。将四氢化萘、二甲基砜等内标物质(pmmol)添加到酰胺化物化合物(qg)中,使其溶解于任意的氘溶剂中,进行1h-nmr分析。在酰胺化物基(a)的r1和r4的氢原子中,求出与r个键合在与咪唑鎓骨架的氮原子相邻的碳原子上的氢原子对应的峰的积分强度(s)和与t个键合在内标物质的任意基团上的氢原子对应的峰的积分强度(u),通过下式算出。酰胺化物
基浓度(mmmol/g)=p
×s×
t/(r
×u×
q)实施例中,wt%表示质量%。
[0170]
制备例1[d2ehi][oac]的合成
[0171]
[化18]
[0172]
在氮气置换后的500ml的4口反应器中投入乙酸52.3g(0.87mol)、41wt%福尔马林水溶液42.1g(0.56mol)、41wt%乙二醛水溶液82.8g(0.58mol),加热至50℃。接着,用2小时向反应器内滴加2-乙基己胺150.1g(1.16mol),进一步搅拌2小时30分钟。接着,在反应溶液中追加41wt%福尔马林水溶液3.4g(0.05mol)、41wt%乙二醛水溶液6.7g(0.05mol),进一步搅拌30分钟。将得到的反应溶液减压浓缩,得到225.8g暗褐色粘性液体。在得到的暗褐色粘性液体中加入作为内标物质的四氢化萘,进行1h-nmr分析,结果可知,在得到的暗褐色粘性液体中含有198.4g(0.56mol、收率96.9%)的上述式所示的[d2ehi][oac]、25.2g(0.42mol)的乙酸。[d2ehi][oac]的1h-nmr分析结果如下所示。1h-nmr(dmso-d6)δ(ppm)=9.35(s,1h)、7.82(s,2h)、4.15(d,j=7.2hz,4h)、1.84(m,2h)、1.71(s,3h)、1.25(m,16h)、0.87(t,j=7.2hz,12h)
[0173]
制造例2[d2ehi][2eha]的合成
[0174]
[化19]
[0175]
在氮气置换后的200ml的3口反应器中投入2-乙基己酸25.1g(0.17mol)、41wt%福尔马林水溶液8.6g(0.12mol)、41wt%乙二醛水溶液16.8g(0.12mol),加热至80℃。接着,在80℃下用2小时向反应器内滴加2-乙基己胺30.0g(0.23mol),搅拌2小时。接着,在反应溶液中追加41wt%福尔马林水溶液0.9g(0.01mol)、41wt%乙二醛水溶液1.7g(0.01mol),进一步搅拌1小时30分钟。将得到的反应溶液减压浓缩,得到暗褐色粘性液体59.6g。在所得到的暗褐色粘性液体中加入四氢化萘作为内标物质并进行1h-nmr分析,结果可知,在所得到的暗褐色粘性液体中含有35.4g(0.08mol、收率72.0%)的由上述式表示的[d2ehi][2eha]、12.1g(0.08mol)的2-乙基己酸。[d2ehi][2eha]的1h-nmr分析结果如下所示。1h-nmr(cdcl3)δ(ppm)=10.91-10.84(m,1h)、7.07(s,2h)、4.33-4.21(m,4h)、2.23-2.15(m,2h)、1.83-1.77(m,2h)、1.64-1.54(m,4h)、1.48-1.28(m,20h)、0.87(t,j=7.2hz,12h)
[0176]
制备例3[d2ehi][oac]的合成
[0177]
[化20]
[0178]
在氮气置换后的2l的4口反应器中,加入制造例1中得到的[d2ehi][oac]40.0g(纯度99.5mmol)和碳酸二甲酯39.9g(443mmol),回流搅拌5小时。将得到的反应溶液减压浓缩,得到暗褐色粘性液体34.1g。在得到的暗褐色粘性液体中加入二甲基砜作为内标物质,进行1h-nmr分析,结果可知,在得到的暗褐色粘性液体中含有31.7g(83.8mmol、收率84.2%)的上述式所示的[d2ehi][oac],过量的乙酸消失。
[0179]
制备例4[d2ehi][2eha]的合成
[0180]
[化21]
[0181]
在氮气置换后的100ml的3口反应器中加入制造例2中得到的[d2ehi][2eha]16.2g(纯度22.7mmol)和碳酸二甲酯16.2g(180mmol),在90℃下搅拌4小时。将得到的反应溶液减压浓缩,得到12.4g暗褐色粘性液体。在得到的暗褐色粘性液体中加入四氢化萘作为内标物质并进行1h-nmr分析,结果可知,在得到的暗褐色粘性液体中含有9.7g(22.1mmol、收率97.3%)的上述式所示的[d2ehi][2eha],过量的2-乙基己酸消失。
[0182]
制造例5缩二脲型hdi的meko封端体的合成在氮气置换后的200ml 3口反应器中投入缩二脲型hdi(desmodur n3200a、nco基含有率:22.8(%)、sumika covestro urethane株式会社制)60.0g(nco基:326mmol)、甲基异丁基酮36.9g,升温至65℃。升温后,向反应器内加入三乙胺0.6g。然后,将甲基乙基酮肟27.0g(333mmol)和甲基异丁基酮22.9g滴加到反应器内,搅拌2小时。将得到的反应溶液减压浓缩,加入甲基异丁基酮17.4g,得到缩二脲型hdi的meko封端体119.0g。得到的缩二脲型hdi的meko封端体的固体成分为74.7%,有效nco基含有率为11.6%。
[0183]
实施例1d2ehim_tdi_me的合成
[0184]
[化22]
[0185]
在氮气置换后的200ml的3口反应器中投入甲苯30.0g,进行加热回流。然后,用2小时向反应器内滴加制造例3中得到的[d2ehi][oac]30.0g(纯度79.3mmol)和甲苯30.0g的混合溶液、甲苯二异氰酸酯(2,4-甲苯二异氰酸酯约80%和2,6-甲苯二异氰酸酯约20%的混合物、东京化成工业株式会社制)15.7g(89.9mmol)和甲苯30.0g的混合溶液,搅拌2小时。搅拌后,将得到的反应混合物浓缩,由此作为暗褐色粘性液体,得到包含上述式所示的化合物(d2ehim_tdi_me)的混合物38.1g。另外,由于1h-nmr的峰宽化、多重化,因此推测原料中使用的甲苯二异氰酸酯的一部分异氰酸酯基低聚物化而成的改性异氰酸酯与[d2ehi][oac]的反应物也副产。在得到的暗褐色粘性液体中加入二甲基砜作为内标物质,进行1h-nmr分析,结果可知,如果假定与咪唑鎓基的氮原子邻接的亚甲基的氢4h部分的峰(4.53-4.36ppm)全部来自上述式所示的d2ehim_tdi_me,则含有30.3g(62.5mmol、收率78.7%)的上述式所示的d2ehim_tdi_me,可知暗褐色粘性液体中的酰胺化物基浓度为1.640mmol/g。用离子色谱法得到的目标物(主产物)的1h-nmr和质谱分析(lc-ms)结果、2个副产物的质谱分析(lc-ms)结果如下所示。(目标物、主生成物)
[0186]
[化23]
[0187]1h-nmr(cdcl3)δ(ppm)=7.43-6.90(m,5h)、4.53-4.36(m,4h)、2.22-1.91(m,8h)、1.37-1.26(m,16h)、0.88-0.79(m,12h)lc-ms:c
29h47
n4o
2+
的计算值=483.3694、实测值(m+h
+
)=483.3668(副产物)
[0188]
[化24]
[0189]
lc-ms:c
11h15
n2o
2+
的计算值=207.1128、实测值(m+h
+
)=207.1119
[0190]
[化25]
[0191]
lc-ms:c
37h55
n6o
3+
的计算值=631.4330、实测值(m+h
+
)=631.4300本发明的封端剂解离催化剂可以仅将目标物分离而使用,但即使使用包含目标物和副产物的混合物,在热固性树脂组合物中也能够充分发挥封端剂解离催化剂的作用。
[0192]
实施例2d2ehim_tdi_2eh的合成
[0193]
[化26]
[0194]
在氮气置换后的100ml的3口反应器中投入甲苯10.5g并加热回流。然后,用2小时将制造例4中得到的[d2ehi][2eha]10.0g(纯度17.8mmol)和甲苯10.0g的混合溶液、甲苯二异氰酸酯(2,4-甲苯二异氰酸酯约80%和2,6-甲苯二异氰酸酯约20%的混合物、东京化成工业株式会社制)3.1g(17.9mmol)和甲苯10.1g的混合溶液滴加到反应器内,搅拌1小时。搅拌后,将得到的反应混合物浓缩,由此作为暗褐色粘性液体,得到9.1g包含上述式所示的化合物(d2ehim_tdi_2eh)的混合物。在得到的暗褐色粘性液体中加入四氢化萘作为内标物质,进行1h-nmr分析,结果可知,如果假定与咪唑鎓基的氮原子相邻的亚甲基的氢4h成分全部来自上述式所示的d2ehim_tdi_2eh,则含有5.1g(9.1mmol,收率51.2%)的上述式所示的d2ehim_tdi_2eh,可知暗褐色粘性液体中的酰胺化物基浓度为1.000mmol/g。用离子色谱法得到的目标物(主产物)的1h-nmr和质谱分析(lc-ms)结果、2个副产物的质谱分析(lc-ms)结果如下所示。(目标物、主生成物)
[0195]
[化27]
[0196]1h-nmr(cdcl3)δ(ppm)=7.27-6.86(m,5h)、4.54-4.47(m,4h)、2.24-2.15(m,3h)、1.94-1.86(m,1h)、1.78-1.62(m,2h)、1.39-1.19(m,24h)、1.01-0.81(m,18h)lc-ms:c
35h59
n4o
2+
的计算值=567.4633、实测值(m+h
+
)=567.4598(副产物)
[0197]
[化28]
[0198]
lc-ms:c
23h39
n2o
2+
的计算值=375.3006、实测值(m+h
+
)=375.2982
[0199]
[化29]
[0200]
lc-ms:c
15h25
n2o
+
的计算值=249.1961、实测值(m+h
+
)=249.1947
[0201]
实施例3d2ehim_mmdi_me的合成
[0202]
[化30]
[0203]
在进行了氮置换的30ml的3口反应器中投入甲苯3.0g,进行加热回流。然后,用2小时向反应器内滴加制造例3中得到的[d2ehi][oac]5.0g(纯度13.2mmol)和甲苯5.9g的混合
溶液、4,4
’‑
二苯基甲烷二异氰酸酯(东京化成工业株式会社制)3.7g(14.8mmol)和甲苯5.0g的混合溶液,搅拌1小时。搅拌后,将得到的反应混合物浓缩,由此得到8.3g包含上述式所示的化合物(d2ehim_mmdi_me)的混合物作为褐色粘性液体。用离子色谱法得到的目标物(主产物)的1h-nmr和质谱分析(lc-ms)结果、3个副产物的质谱分析(lc-ms)结果如下所示。(目标物、主生成物)
[0204]
[化31]
[0205]1h-nmr(cdcl3)δ(ppm)=7.43-7.06(m,8h)、6.86(s,2h)、4.47(m,4h)、2.36(s,3h)、2.12(s,2h)、1.86(m,2h)、1.31(m,16h)、0.91(m,12h)lc-ms:c
35h51
n4o
2+
的计算值=559.4007、实测值(m+h
+
)=559.3976(副产物)
[0206]
[化32]
[0207]
lc-ms:c
17h19
n2o
2+
的计算值=283.1441、实测值(m+h
+
)=283.1426
[0208]
[化33]
[0209]
lc-ms:c
15h17
n2o
+
的计算值=241.1335、实测值(m+h
+
)=241.1325
[0210]
[化34]
[0211]
lc-ms:c
49h63
n6o
3+
的计算值=783.4956、实测值(m+h
+
)=783.4919
[0212]
实施例4d2ehim_crmdi_me的合成
[0213]
[化35]
[0214]
式中,x1~x3中的至少任一个被(a)所示的基团取代,其余被(b)取代。可以在反应混合物中包含x1~x3全部被(a)取代的化合物、或x1~x3全部被(b)取代的化合物,反应混合物的主要成分为至少1个(a)和至少1个(b)取代的化合物。m为0~4的整数。
[0215]
在进行了氮置换的180ml的3口反应器中投入甲苯30.0g,进行加热回流。然后,用2小时向反应器内滴加制造例1中得到的[d2ehi][oac]30.0g(纯度:0.075mol)和甲苯30.0g的混合溶液、聚合mdi(sumidur 44v20:nco基含有率:32.0%、sumika covestro urethane株式会社制)26.1g(nco基:198.9mmol)和甲苯24.0g的混合溶液,搅拌1小时。搅拌后,将所得到的反应混合物浓缩干固,由此以褐色固体的形式得到含有上述式所示的化合物(d2ehim_crmdi_me)的混合物48.6g。在得到的褐色固体中加入作为内标物质的四氢化萘,进行1h-nmr分析,结果由与咪唑鎓基的氮原子邻接的亚甲基的氢4h部分可知,褐色固体中的酰胺化物基浓度为0.765mmol/g。得到的混合物的1h-nmr分析结果如下所示。1h-nmr(cdcl3)δ(ppm)=7.41-6.88(m)、4.46-4.36(m)3.94-3.87(m)、2.12(s)、2.03-1.88(m)、1.38-1.10(m)、0.90-0.73(m)
[0216]
实施例5d2ehim_crmdi_2eh的合成
[0217]
[化36]
[0218]
式中,x1~x3中的至少任一个被(a)所示的基团取代,其余被(b)取代。可以在反应混合物中包含x1~x3全部被(a)取代的化合物、或x1~x3全部被(b)取代的化合物,反应混合
物的主要成分为至少1个(a)和至少1个(b)取代的化合物。m为0~4的整数。在进行了氮置换的180ml的3口反应器中投入甲苯30.0g,进行加热回流。然后,用2小时向反应器内滴加制造例2中得到的[d2ehi][2eha]30.0g(纯度:42.1mmol)与甲苯30.0g的混合溶液、聚合mdi(sumidur 44v20:nco基含有率:32.0%、sumika covestro urethane株式会社制)17.6g(nco基:134.1mol)与甲苯24.0g的混合溶液,搅拌1小时。搅拌后,将所得到的反应混合物浓缩干固,由此以褐色固体的形式得到含有上述式所示的化合物(d2ehim_crmdi_2eh)的混合物50.1g。在得到的褐色固体中加入作为内标物质的四氢化萘,进行1h-nmr分析,结果由与咪唑鎓基的氮原子邻接的亚甲基的氢4h部分可知,褐色固体中的酰胺化物基浓度为0.622mmol/g。得到的混合物的1h-nmr分析结果如下所示。1h-nmr(cdcl3)δ(ppm)=7.50-6.89(m)、4.53-4.37(m)4.01-3.81(m)、2.13-2.05(m)、1.93-1.84(m)、1.76-1.65(m)、1.60-1.47(m)、1.40-1.28(m)、0.99-0.80(m)
[0219]
评价例1按照热固性树脂组合物的组成成为有效nco基(mol):羟基(mol):酰胺化物基(mol)=1.00:0.95:0.05的方式,加入制造例5中得到的缩二脲型hdi的meko(甲乙酮肟)封端体、聚酯多元醇(p-510、株式会社kuraray制)、实施例1中得到的d2ehim_tdi_me,按照相对于封闭型异氰酸酯的固体成分,总溶剂量成为1.0重量倍的方式加入甲基异丁基酮,搅拌30分钟,制备热固性树脂组合物。
[0220]
采集约0.6ml制备的热固性树脂组合物,添加到预先加热至规定温度的自动固化时间测定装置的热板上,进行搅拌。此时,将搅拌转矩超过20%(0.86mn
·
m)的时间作为固化时间,进行各温度下的固化时间的测定。将结果示于表2。
[0221]
评价例2~5除了将d2ehim_tdi_me变更为表2所示的酰胺化物化合物以外,与评价例1同样地制备热固性树脂组合物,测定固化时间。将结果示于表2。
[0222]
对比例1将d2ehim_tdi_me变更为二月桂酸二丁基锡(以下称为dbtdl),使热固性树脂组合物的组成为有效nco基(mol):羟基(mol):dbtdl(mol)=1.00:0.95:0.05,除此以外,与评价例1同样地制备热固性树脂组合物,测定固化时间。将结果示于表2。
[0223]
[表2]
(1)制造例5中得到的缩二脲型hdi的meko封端体(2)株式会社kuraray生产的聚酯多元醇p-510(3)表中的
″‑″
意为无数据。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1