用于激肽释放酶(KLKB1)基因编辑的组合物和方法与流程
用于激肽释放酶(klkb1)基因编辑的组合物和方法
1.本专利申请要求以下美国临时专利申请的优先权:于2020年2月7日提交的美国临时专利申请第62/971,906号;于2020年2月26日提交的美国临时专利申请第62/981,965号;以及于2020年5月1日提交的美国临时专利申请第63/019,076号,所述美国临时专利申请中的每个美国临时专利申请的内容出于所有目的整体并入本文。
2.本技术含有已经以ascii格式电子提交的序列表,并且特此整体并入。创建于2021年2月4日的所述ascii副本命名为01155-0031-00pct_st25.txt并且大小为184,584字节。
3.遗传性血管性水肿(hae)影响50,000人中的一人并且每年造成15,000到30,000次急诊。hae是一种罕见的常染色体显性遗传血液病症,其特征是严重肿胀(血管性水肿)的反复发作。身体最容易出现肿胀的部位是四肢、面部、gi道和气道。轻微的创伤或压力可能会引发发作,但肿胀通常在没有已知触发因素的情况下发生。涉及肠道的发作会导致严重的腹痛、恶心和呕吐。气道的肿胀会限制呼吸并导致危及生命的气道阻塞或窒息。hae的症状通常始于儿童期并在青春期恶化。平均而言,未经治疗的个体每1到2周发作一次,并且大多数发作持续约3到4天。存在三种类型的遗传性血管性水肿,称为i型、ii型和iii型,并且不同的类型具有相似的体征和症状。
4.遗传性血管性水肿源于血液中过量的缓激肽,从而促进血管渗透性和肿胀的发作。大多数患有hae的患者具有c1抑制剂(也称为c1酯酶抑制剂或c1-inh)蛋白质缺乏症。在不存在c1-inh的情况下,缓激肽水平会升高,引发血管渗漏,并引起肿胀发作。其的产生通过激肽释放酶-激肽(接触)途径控制,所述途径被c1-inh内源性地抑制。当高分子量激肽原(hmwk)被血浆激肽释放酶(pkal)切割时形成缓激肽肽,pkal是蛋白质前激肽释放酶的激活形式。前激肽释放酶由klkb1编码并且还称为klkb1蛋白。klkb1蛋白在肝脏产生并分泌到血浆中,在所述血浆中其可被因子xiia激活。一旦klkb1被激活,pkal可以增加缓激肽水平。血液中过量的缓激肽会导致流体通过血管壁渗漏到身体组织中。流体身体组织中的过量累积会导致患有hae的个体出现肿胀。
5.已经开发了若干种靶向激肽释放酶-激肽途径的药物,包含c1酯酶抑制剂重组c1-inh替代疗法(rhc1inh;conestat alfaalfa)和缓激肽受体拮抗剂(艾替班特(icatibant),)。还开发了使用激肽释放酶或前激肽释放酶(klkb1)抑制剂的方法(艾卡拉肽(ecallantide),拉那鲁单抗(lanadelumab),takhzyro
tm
)。
6.本公开提供了使用crispr/cas系统敲除klkb1基因的组合物和方法,由此在患有hae的受试者中减少前激肽释放酶(klkb1)的产生、减少激肽释放酶和减少缓激肽产生。
7.因此,提供了以下实施例。在一些实施例中,本发明提供了使用向导rna与rna引导的dna结合剂,如crispr/cas系统显著降低或敲除klkb1基因的表达,由此显著降低或消除缓激肽产生的组合物和方法。通过改变klkb1基因来显著减少或消除缓激肽的产生可以是长期或永久性治疗。
8.本文提供了以下实施例。
9.实施例a1是一种向导rna,其包括:
10.a.向导序列,所述向导序列包括与选自seq id no:15、8和41的序列至少95%、90%或85%相同的序列;
11.b.向导序列,所述向导序列包括选自seq id no:15、8和41的序列的至少17个、18个、19个或20个连续核苷酸;或
12.c.向导序列,所述向导序列选自seq id no:15、8和41。
13.实施例a2是根据实施例a1所述的向导rna,其进一步包括seq id no:202的核苷酸序列。
14.实施例a3是根据实施例a1所述的向导rna,其中所述向导rna进一步包括选自seq id no:170、171、172和173的核苷酸序列,其中seq id no:170、171、172或173的所述序列在所述向导序列的3'位。
15.实施例a4是根据实施例a1到a3中任一项所述的向导rna,其中所述向导rna进一步包括3'尾。
16.实施例a5是根据实施例a1到a4中任一项所述的向导rna,其中所述向导rna包括至少一个修饰。
17.实施例a6是根据实施例a5所述的向导rna,其中所述修饰包括5'端修饰。
18.实施例a7是根据实施例a5或a6所述的向导rna,其中所述修饰包括3'端修饰。
19.实施例a8是根据实施例a1到a7中任一项所述的向导rna,其中所述向导rna包括发夹区中的修饰。
20.实施例a9是根据实施例a1到a8中任一项所述的向导rna,其中所述修饰包括2'-o-甲基(2'-o-me)修饰的核苷酸。
21.实施例a10是根据实施例a1到a9中任一项所述的向导rna,其中所述修饰包括核苷酸之间的硫代磷酸酯(ps)键。
22.实施例a11是根据实施例a1到a10中任一项所述的向导rna,其中所述修饰包括2'-氟(2'f)修饰的核苷酸。
23.实施例a12是根据实施例a1或a3到a11中任一项所述的向导rna,其进一步包括seq id no:171的核苷酸序列。
24.实施例a13是根据实施例a12所述的向导rna,其根据seq id no:405的核苷酸序列的模式进行修饰。
25.实施例a14是根据实施例a1或a3到a11中任一项所述的向导rna,其进一步包括seq id no:173的核苷酸序列。
26.实施例a15是根据实施例a14所述的向导rna,其根据seq id no:248-255或450的模式进行修饰。
27.实施例a16是根据实施例a12到a15中任一项所述的向导rna,其中所述向导序列是seq id no:15。
28.实施例a17是根据实施例a12到a15中任一项所述的向导rna,其中所述向导序列是seq id no:8。
29.实施例a18是根据实施例a12到a15中任一项所述的向导rna,其中所述向导序列是seq id no:41。
30.实施例a19是根据实施例a1或a4到a11中任一项所述的向导rna,其中所述向导rna
根据seq id no:300的模式进行修饰,其中n共同作为实施例a1的向导序列。
31.实施例a20是根据实施例a16所述的向导rna,其中seq id no:300中的每个n是任何天然核苷酸或非天然核苷酸。
32.实施例a21是根据实施例a19所述的向导rna,其中所述向导序列是seq id no:15,并且所述向导rna根据mg*mg*ma*uugcguaugggacacaaguuuuagamgmcmumamgmamamamumamgmcaaguuaaaauaaggcuaguccguuaucamamcmumumgmamamamamamgmumgmgmcmamcmcmgmamgmumcmgmgmumgmcmu*mu*mu*mu进行修饰,其中“ma”、“mc”、“mu”或“mg”表示已用2'-o-me修饰的核苷酸,*表示硫代磷酸酯键,并且n是天然核苷酸。
33.实施例a22是根据实施例a19所述的向导rna,其中所述向导序列是seq id no:8,并且所述向导rna根据mu*ma*mc*ccgggaguugacuuuggguuuuagamgmcmumamgmamamamumamgmcaaguuaaaauaaggcuaguccguuaucamamcmumumgmamamamamamgmumgmgmcmamcmcmgmamgmumcmgmgmumgmcmu*mu*mu*mu进行修饰,其中“ma”、“mc”、“mu”或“mg”表示已用2'-o-me修饰的核苷酸,*表示硫代磷酸酯键,并且n是天然核苷酸。
34.实施例a23是根据实施例a19所述的向导rna,其中所述向导序列是seq id no:41,并且所述向导rna根据mu*ma*mu*uaucaaaucacauuaccguuuuagamgmcmumamgmamamamumamgmcaaguuaaaauaaggcuaguccguuaucamamcmumumgmamamamamamgmumgmgmcmamcmcmgmamgmumcmgmgmumgmcmu*mu*mu*mu进行修饰,其中“ma”、“mc”、“mu”或“mg”表示已用2'-o-me修饰的核苷酸,*表示硫代磷酸酯键,并且n是天然核苷酸。
35.实施例a24是一种组合物,其包括根据实施例a1到a23中任一项所述的向导rna。
36.实施例a25是根据实施例a24所述的组合物,其进一步包括rna引导的dna结合剂或编码rna引导的dna结合剂的核酸。
37.实施例a26是根据实施例a25所述的组合物,其中所述编码rna引导的dna结合剂的核酸包括mrna,所述mrna包括编码rna引导的dna结合剂的开放阅读框(orf)。
38.实施例a27是根据实施例a25或a26所述的组合物,其中所述rna引导的dna结合剂是cas9。
39.实施例a28是根据实施例a27所述的组合物,其中所述cas9是酿脓链球菌cas9(s.pyogenes cas9)。
40.实施例a29是根据实施例a26到a28中任一项所述的组合物,其中所述orf是经修饰的orf。
41.实施例a30是根据实施例a24到a29中任一项所述的组合物,其进一步包括药用赋形剂。
42.实施例a31是根据实施例a24到a30中任一项所述的组合物,其中所述向导rna与脂质纳米颗粒(lnp)缔合。
43.实施例a32是根据实施例a31所述的组合物,其中所述lnp包括阳离子脂质。
44.实施例a33是根据实施例a32所述的组合物,其中所述阳离子脂质是十八碳-9,12-二烯酸(9z,12z)-3-((4,4-双(辛氧基)丁酰基)氧基)-2-((((3-(二乙基氨基)丙氧基)羰基)氧基)甲基)丙酯,也称为(9z,12z)-十八碳-9,12-二烯酸3-((4,4-双(辛氧基)丁酰基)氧基)-2-((((3-(二乙基氨基)丙氧基)羰基)氧基)甲基)丙酯。
45.实施例a34是根据实施例a31到a33中任一项所述的组合物,其中所述lnp包括十八
碳-9,12-二烯酸(9z,12z)-3-((4,4-双(辛氧基)丁酰基)氧基)-2-((((3-(二乙基氨基)丙氧基)羰基)氧基)甲基)丙酯——也称为(9z,12z)-十八碳-9,12-二烯酸3-((4,4-双(辛氧基)丁酰基)氧基)-2-((((3-(二乙基氨基)丙氧基)羰基)氧基)甲基)丙酯、dspc、胆固醇和peg2k-dmg。
46.实施例a35是包括根据实施例a1到a23中任一项所述的向导rna或根据实施例a24到a34中任一项所述的组合物的药物组合物。
47.实施例a36是一种药物组合物,其包括根据实施例a1到a23中任一项所述的向导rna或根据实施例a24到a34中任一项所述的组合物,所述药物组合物用于诱导细胞中的klkb1基因内的双链断裂或单链断裂或减少细胞中的klkb1的表达,或一种根据实施例a1到a23中任一项所述的向导rna或根据实施例a24到a34中任一项所述的组合物用于诱导细胞中的klkb1基因内的双链断裂或单链断裂或减少细胞中的klkb1的表达的用途。
48.实施例a37是根据实施例a36所述的药物组合物或用途,其用于减少细胞或受试者中的所述klkb1基因的表达。
49.实施例a38是一种药物组合物,其包括根据实施例a1到a23中任一项所述的向导rna或根据实施例a24到a34中任一项所述的组合物,所述药物组合物用于治疗患有遗传性血管性水肿(hae)的受试者,或一种根据实施例a1到a23中任一项所述的向导rna或根据实施例a24到a34中任一项所述的组合物用于治疗患有hae的受试者的用途。
50.实施例a39是根据实施例a38所述的药物组合物或用途,其包括降低hae发作的频率和/或严重程度。
51.实施例a40是一种药物组合物,其包括根据实施例a1到a23中任一项所述的向导rna或根据实施例a24到a34中任一项所述的组合物,所述药物组合物用于治疗或预防与hae相关的血管性水肿、缓激肽产生和累积、缓激肽诱导的肿胀、气道的血管性水肿阻塞或窒息,或一种根据实施例a1到a23中任一项所述的向导rna或根据实施例a24到a34中任一项所述的组合物用于治疗或预防与hae相关的血管性水肿、缓激肽产生和累积、缓激肽诱导的肿胀、气道的血管性水肿阻塞或窒息的用途。
52.实施例a41是一种药物组合物,其用于降低受试者的总血浆激肽释放酶活性或降低前激肽释放酶和/或激肽释放酶水平,或一种根据实施例a1到a23中任一项所述的向导rna或根据实施例a24到a34中任一项所述的组合物用于降低受试者的总血浆激肽释放酶活性或降低前激肽释放酶和/或激肽释放酶水平的用途。
53.实施例a42是根据实施例a41所述的药物组合物或用途,其中所述总血浆激肽释放酶活性降低超过多于60%。
54.实施例a43是一种用于诱导细胞中的klkb1基因内的双链断裂或单链断裂或减少细胞中的klkb1的表达的方法,所述方法包括使细胞与根据实施例a1到a23中任一项所述的向导rna或根据实施例a24到a34中任一项所述的组合物接触。
55.实施例a44是根据实施例a43所述的方法,其中所述细胞位于受试者体内。
56.实施例a45是一种治疗患有遗传性血管性水肿(hae)的受试者的方法,所述方法包括施用根据实施例a1到a23中任一项所述的向导rna或根据实施例a24到a34中任一项所述的组合物,由此治疗所述受试者。
57.实施例a46是根据实施例a45所述的方法,其中治疗所述受试者包括降低hae发作
的频率和/或严重程度。
58.实施例a47是一种治疗或预防与hae相关的血管性水肿、缓激肽产生和累积、缓激肽诱导的肿胀、气道的血管性水肿阻塞或窒息的方法,所述方法包括向受试者施用根据实施例a1到a23中任一项所述的向导rna或根据实施例a24到a34中任一项所述的组合物,由此治疗或预防所述受试者的与hae相关的血管性水肿、缓激肽产生和累积、缓激肽诱导的肿胀、气道的血管性水肿阻塞或窒息。
59.实施例a48是一种降低受试者的总血浆激肽释放酶活性的方法,所述方法包括施用根据实施例a1到a23中任一项所述的向导rna或根据实施例a24到a34中任一项所述的组合物,由此降低受试者的总血浆激肽释放酶活性。
60.实施例a49是根据实施例a48所述的方法,其中所述受试者的所述总血浆激肽释放酶活性降低超过60%。
61.实施例a50是一种根据实施例a1到a23中任一项所述的向导rna或根据实施例a24到a34中任一项所述的组合物在制备用于实践根据实施例a43到a49中任一项所述的方法的药物中的用途。
62.本文提供了另外的实施例。
63.实施例1是一种在klkb1基因内诱导双链断裂(dsb)或单链断裂(ssb)的方法,所述方法包括向细胞递送组合物,其中所述组合物包括:
64.a.向导rna,所述向导rna包括
65.i.选自seq id no:1-149的向导序列;或
66.ii.选自seq id no:1-149的序列的至少17个、18个、19个或20个连续核苷酸;或
67.iii.与选自seq id no:1-149的序列至少95%、90%或85%相同的向导序列;或
68.iv.包括seq id no:1、7、8、15、26、27、28、41、42、46、51、52、53、56、69、71中的任一个的向导序列;或
69.v.包括seq id no:8、15、41、51、69中的任一个的向导序列;或
70.vi.包括表1中所列的基因组坐标的15个连续核苷酸
±
10个核苷酸的序列;或
71.vii.来自(vi)的序列的至少17个、18个、19个或20个连续核苷酸;或
72.viii.与选自(vi)的序列至少95%、90%或85%相同的向导序列;以及任选地
73.b.rna引导的dna结合剂或编码rna引导的dna结合剂的核酸。
74.实施例2是一种减少klkb1基因的表达的方法,所述方法包括向细胞递送组合物,其中所述组合物包括:
75.a.向导rna,所述向导rna包括
76.i.选自seq id no:1-149的向导序列;或
77.ii.选自seq id no:1-149的序列的至少17个、18个、19个或20个连续核苷酸;或
78.iii.与选自seq id no:1-149的序列至少95%、90%或85%相同的向导序列;或
79.iv.包括seq id no:1、7、8、15、26、27、28、41、42、46、51、52、53、56、69、71中的任一个的向导序列;或
80.v.包括seq id no:8、15、41、51、69中的任一个的向导序列;或
81.vi.包括表1中所列的基因组坐标的15个连续核苷酸
±
10个核苷酸的序列;或
82.vii.来自(vi)的序列的至少17个、18个、19个或20个连续核苷酸;或
83.viii.与选自(vi)的序列至少95%、90%或85%相同的向导序列;以及任选地
84.b.rna引导的dna结合剂或编码rna引导的dna结合剂的核酸。
85.实施例3是一种治疗或预防遗传性血管性水肿(hae)的方法,所述方法包括向有需要的受试者施用组合物,其中所述组合物包括:
86.a.向导rna,所述向导rna包括
87.i.选自seq id no:1-149的向导序列;或
88.ii.选自seq id no:1-149的序列的至少17个、18个、19个或20个连续核苷酸;或
89.iii.与选自seq id no:1-149的序列至少95%、90%或85%相同的向导序列;或
90.iv.包括seq id no:1、7、8、15、26、27、28、41、42、46、51、52、53、56、69、71中的任一个的向导序列;或
91.v.包括seq id no:8、15、41、51、69中的任一个的向导序列;或
92.vi.包括表1中所列的基因组坐标的15个连续核苷酸
±
10个核苷酸的序列;或
93.vii.来自(vi)的序列的至少17个、18个、19个或20个连续核苷酸;或
94.viii.与选自(vi)的序列至少95%、90%或85%相同的向导序列;以及任选地
95.b.rna引导的dna结合剂或编码rna引导的dna结合剂的核酸,由此治疗或预防hae。
96.实施例4是一种治疗或预防由hae引起的或与hae相关的血管性水肿的方法,所述方法包括向有需要的受试者施用组合物,其中所述组合物包括:
97.a.向导rna,所述向导rna包括
98.i.选自seq id no:1-149的向导序列;或
99.ii.选自seq id no:1-149的序列的至少17个、18个、19个或20个连续核苷酸;或
100.iii.与选自seq id no:1-149的序列至少95%、90%或85%相同的向导序列;或
101.iv.包括seq id no:1、7、8、15、26、27、28、41、42、46、51、52、53、56、69、71中的任一个的向导序列;或
102.v.包括seq id no:8、15、41、51、69中的任一个的向导序列;或
103.vi.包括表1中所列的基因组坐标的15个连续核苷酸
±
10个核苷酸的序列;或
104.vii.来自(vi)的序列的至少17个、18个、19个或20个连续核苷酸;或
105.viii.与选自(vi)的序列至少95%、90%或85%相同的向导序列;以及任选地
106.b.rna引导的dna结合剂或编码rna引导的dna结合剂的核酸,由此治疗或预防由hae引起的或与hae相关的血管性水肿。
107.实施例5是一种治疗或预防缓激肽产生和累积、缓激肽诱导的肿胀、气道的血管性水肿阻塞或窒息中的任何一种的方法,所述方法包括向有需要的受试者施用组合物,其中所述组合物包括:
108.a.向导rna,所述向导rna包括
109.i.选自seq id no:1-149的向导序列;或
110.ii.选自seq id no:1-149的序列的至少17个、18个、19个或20个连续核苷酸;或
111.iii.与选自seq id no:1-149的序列至少95%、90%或85%相同的向导序列;或
112.iv.包括seq id no:1、7、8、15、26、27、28、41、42、46、51、52、53、56、69、71中的任一个的向导序列;或
113.v.包括seq id no:8、15、41、51、69中的任一个的向导序列;或
114.vi.包括表1中所列的基因组坐标的15个连续核苷酸
±
10个核苷酸的序列;或
115.vii.来自(vi)的序列的至少17个、18个、19个或20个连续核苷酸;或
116.viii.与选自(vi)的序列至少95%、90%或85%相同的向导序列;以及任选地
117.b.rna引导的dna结合剂或编码rna引导的dna结合剂的核酸,由此治疗或预防缓激肽产生和累积、缓激肽诱导的肿胀、气道的血管性水肿阻塞或窒息中的任何一种。
118.实施例6是一种降低hae发作的频率和/或严重程度的方法,所述方法包括向有需要的受试者施用组合物,其中所述组合物包括:
119.a.向导rna,所述向导rna包括
120.i.选自seq id no:1-149的向导序列;或
121.ii.选自seq id no:1-149的序列的至少17个、18个、19个或20个连续核苷酸;或
122.iii.与选自seq id no:1-149的序列至少95%、90%或85%相同的向导序列;或
123.iv.包括seq id no:1、7、8、15、26、27、28、41、42、46、51、52、53、56、69、71中的任一个的向导序列;或
124.v.包括seq id no:8、15、41、51、69中的任一个的向导序列;或
125.vi.包括表1中所列的基因组坐标的15个连续核苷酸
±
10个核苷酸的序列;或
126.vii.来自(vi)的序列的至少17个、18个、19个或20个连续核苷酸;或
127.viii.与选自(vi)的序列至少95%、90%或85%相同的向导序列;以及任选地
128.b.rna引导的dna结合剂或编码rna引导的dna结合剂的核酸,由此降低hae发作的频率和/或严重程度。
129.实施例7是一种用于降低受试者的血管性水肿发作的频率和/或严重程度或实现血管性水肿发作的缓解的方法,所述方法包括向有需要的受试者施用组合物,其中所述组合物包括:
130.a.向导rna,所述向导rna包括
131.i.选自seq id no:1-149的向导序列;或
132.ii.选自seq id no:1-149的序列的至少17个、18个、19个或20个连续核苷酸;或
133.iii.与选自seq id no:1-149的序列至少95%、90%或85%相同的向导序列;或
134.iv.包括seq id no:1、7、8、15、26、27、28、41、42、46、51、52、53、56、69、71中的任一个的向导序列;或
135.v.包括seq id no:8、15、41、51、69中的任一个的向导序列;或
136.vi.包括表1中所列的基因组坐标的15个连续核苷酸
±
10个核苷酸的序列;或
137.vii.来自(vi)的序列的至少17个、18个、19个或20个连续核苷酸;或
138.viii.与选自(vi)的序列至少95%、90%或85%相同的向导序列;以及任选地
139.b.rna引导的dna结合剂或编码rna引导的dna结合剂的核酸,由此降低受试者的血管性水肿发作的频率和/或严重程度或实现血管性水肿发作的缓解。
140.实施例8是一种降低总血浆激肽释放酶活性的方法,所述方法包括向有需要的受试者施用组合物,其中所述组合物包括:
141.a.向导rna,所述向导rna包括
142.i.选自seq id no:1-149的向导序列;或
143.ii.选自seq id no:1-149的序列的至少17个、18个、19个或20个连续核苷酸;或
144.iii.与选自seq id no:1-149的序列至少95%、90%或85%相同的向导序列;或
145.iv.包括seq id no:1、7、8、15、26、27、28、41、42、46、51、52、53、56、69、71中的任一个的向导序列;或
146.v.包括seq id no:8、15、41、51、69中的任一个的向导序列;或
147.vi.包括表1中所列的基因组坐标的15个连续核苷酸
±
10个核苷酸的序列;或
148.vii.来自(vi)的序列的至少17个、18个、19个或20个连续核苷酸;或
149.viii.与选自(vi)的序列至少95%、90%或85%相同的向导序列;以及任选地
150.b.rna引导的dna结合剂或编码rna引导的dna结合剂的核酸,由此实现受试者的血管性水肿发作的缓解,其中总血浆激肽释放酶活性降低。
151.实施例9是根据实施例8所述的方法,其进一步包括将前激肽释放酶转化为其活性形式pkal的激活步骤。
152.实施例10是根据实施例8所述的方法,其中所述总血浆激肽释放酶活性降低超过60%、超过85%或超过60-80%。
153.实施例11是一种降低总血浆激肽释放酶水平的方法,所述方法包括向有需要的受试者施用组合物,其中所述组合物包括:
154.a.向导rna,所述向导rna包括
155.i.选自seq id no:1-149的向导序列;或
156.ii.选自seq id no:1-149的序列的至少17个、18个、19个或20个连续核苷酸;或
157.iii.与选自seq id no:1-149的序列至少95%、90%或85%相同的向导序列;或
158.iv.包括seq id no:1、7、8、15、26、27、28、41、42、46、51、52、53、56、69、71中的任一个的向导序列;或
159.v.包括seq id no:8、15、41、51、69中的任一个的向导序列;或
160.vi.包括表1中所列的基因组坐标的15个连续核苷酸
±
10个核苷酸的序列;或
161.vii.来自(vi)的序列的至少17个、18个、19个或20个连续核苷酸;或
162.viii.与选自(vi)的序列至少95%、90%或85%相同的向导序列;以及任选地
163.b.rna引导的dna结合剂或编码rna引导的dna结合剂的核酸,由此总血浆激肽释放酶水平。
164.实施例12是一种降低前激肽释放酶和/或激肽释放酶水平的方法,所述方法包括向有需要的受试者施用组合物,其中所述组合物包括:
165.a.向导rna,所述向导rna包括
166.i.选自seq id no:1-149的向导序列;或
167.ii.选自seq id no:1-149的序列的至少17个、18个、19个或20个连续核苷酸;或
168.iii.与选自seq id no:1-149的序列至少95%、90%或85%相同的向导序列;或
169.iv.包括seq id no:1、7、8、15、26、27、28、41、42、46、51、52、53、56、69、71中的任一个的向导序列;或
170.v.包括seq id no:8、15、41、51、69中的任一个的向导序列;或
171.vi.包括表1中所列的基因组坐标的15个连续核苷酸
±
10个核苷酸的序列;或
172.vii.来自(vi)的序列的至少17个、18个、19个或20个连续核苷酸;或
173.viii.与选自(vi)的序列至少95%、90%或85%相同的向导序列;以及任选地
174.b.rna引导的dna结合剂或编码rna引导的dna结合剂的核酸,由此减少前激肽释放酶和/或激肽释放酶。
175.实施例13是根据前述实施例中任一项所述的方法,其中编辑百分比中存在剂量依赖性增加。
176.实施例14是根据实施例13所述的方法,其中总血浆激肽释放酶水平中存在剂量依赖性降低。
177.实施例15是根据实施例13或14所述的方法,其中血浆激肽释放酶活性中存在剂量依赖性降低。
178.实施例16是根据前述实施例中任一项所述的方法,其中效果在施用后持续至少1个月、2个月、4个月、6个月、1年、2年、5年、10年或更长时间。
179.实施例17是根据前述实施例中任一项所述的方法,其中所述效果持续至少6个月。
180.实施例18是根据前述实施例中任一项所述的方法,其中所述效果持续至少1年。
181.实施例19是根据实施例6所述的方法,其中hae发作的所述频率降低。
182.实施例20是根据实施例19所述的方法,其中所述频率降低了至少40%、至少50%、至少60%、至少70%、至少80%、至少90%、至少60-80%或至少40-90%。
183.实施例21是根据实施例20所述的方法,其中所述频率降低了至少60-80%。
184.实施例22是根据实施例20所述的方法,其中所述频率降低了至少40-90%。
185.实施例23是根据前述实施例中任一项所述的方法,其中所述效果在施用后持续至少1个月、2个月、4个月、6个月、1年、2年、5年、10年或更长时间。
186.实施例24是根据前述实施例中任一项所述的方法,其中所述效果在施用后持续至少6个月。
187.实施例25是根据前述实施例中任一项所述的方法,其中所述效果在施用后持续至少1年。
188.实施例26是根据前述实施例中任一项所述的方法,其中所述效果与基础水平进行比较。
189.实施例27是根据前述实施例中任一项所述的方法,其中所述效果与受试者的基础水平进行比较。
190.实施例28是根据前述实施例中任一项所述的方法,其中施用rna引导的dna结合剂或编码rna引导的dna结合剂的核酸。
191.实施例29是一种组合物,其包括:
192.a.向导rna,所述向导rna包括
193.i.选自seq id no:1-149的向导序列;或
194.ii.选自seq id no:1-149的序列的至少17个、18个、19个或20个连续核苷酸;或
195.iii.与选自seq id no:1-149的序列至少95%、90%或85%相同的向导序列;或
196.iv.包括seq id no:1、7、8、15、26、27、28、41、42、46、51、52、53、56、69、71中的任一个的向导序列;或
197.v.包括seq id no:8、15、41、51、69中的任一个的向导序列;或
198.vi.包括表1中所列的基因组坐标的15个连续核苷酸
±
10个核苷酸的序列;或
199.vii.来自(vi)的序列的至少17个、18个、19个或20个连续核苷酸;或
200.viii.与选自(vi)的序列至少95%、90%或85%相同的向导序列;以及任选地
201.b.rna引导的dna结合剂或编码rna引导的dna结合剂的核酸。
202.实施例30是一种包括短单向导rna(短-sgrna)的组合物,所述组合物包括:
203.a.向导序列,所述向导序列包括:
204.i.选自seq id no:1-149的向导序列;或
205.ii.选自seq id no:1-149的序列的至少17个、18个、19个或20个连续核苷酸;或
206.iii.与选自seq id no:1-149的序列至少95%、90%或85%相同的向导序列;或
207.iv.包括seq id no:1、7、8、15、26、27、28、41、42、46、51、52、53、56、69、71中的任一个的向导序列;或
208.v.包括seq id no:8、15、41、51、69中的任一个的向导序列;或
209.vi.包括表1中所列的基因组坐标的15个连续核苷酸
±
10个核苷酸的序列;或
210.vii.来自(vi)的序列的至少17个、18个、19个或20个连续核苷酸;或
211.viii.与选自(vi)的序列至少95%、90%或85%相同的向导序列;以及
212.b.sgrna的包括发夹区的保守部分,其中所述发夹区缺少至少5-10个核苷酸,并且任选地其中所述短-sgrna包括5'端修饰和3'端修饰中的一个或多个。
213.实施例31.根据实施例29所述的组合物,其包括seq id no:202的所述序列。
214.实施例32是根据实施例29或实施例30所述的组合物,其包括5'端修饰。
215.实施例33是根据实施例29到32中任一项所述的组合物,其中所述短-sgrna包括3'端修饰。
216.实施例34是根据实施例29到33中任一项所述的组合物,其中所述短-sgrna包括5'端修饰和3'端修饰。
217.实施例35是根据实施例29到34中任一项所述的组合物,其中所述短-sgrna进一步包括3'尾。
218.实施例36是根据实施例35所述的组合物,其中所述3'尾包括1个、2个、3个、4个、5个、6个、7个、8个、9个或10个核苷酸。
219.实施例37是根据实施例35所述的组合物,其中所述3'尾包括约1-2个、1-3个、1-4个、1-5个、1-7个、1-10个、至少1-2个、至少1-3个、至少1-4个、至少1-5个、至少1-7个或至少1-10个核苷酸。
220.实施例38是根据实施例29到37中任一项所述的组合物,其中所述短-sgrna不包括3'尾。
221.实施例39是根据实施例29到38中任一项所述的组合物,其包括所述发夹区中的修饰。
222.实施例40是根据实施例29到39中任一项所述的组合物,其包括3'端修饰和所述发夹区中的修饰。
223.实施例41是根据实施例29到40中任一项所述的组合物,其包括3'端修饰、所述发夹区中的修饰以及5'端修饰。
224.实施例42是根据实施例29到41中任一项所述的组合物,其包括5'端修饰和所述发夹区中的修饰。
225.实施例43是根据实施例29到42中任一项所述的组合物,其中所述发夹区缺少至少
5个连续核苷酸。
226.实施例44是根据实施例29到43中任一项所述的组合物,其中所述至少5-10个缺少的核苷酸:
227.a.处于发夹1内;
228.b.处于发夹1以及位于发夹1与发夹2之间的“n”内;
229.c.处于发夹1以及紧接在发夹1的3'位的两个核苷酸内;
230.d.包含发夹1的至少一部分;
231.e.处于发夹2内;
232.f.包含发夹2的至少一部分;
233.g.处于发夹1和发夹2内;
234.h.包含发夹1的至少一部分并且包含位于发夹1与发夹2之间的“n”;
235.i.包含发夹2的至少一部分并且包含位于发夹1与发夹2之间的“n”;
236.j.包含发夹1的至少一部分,包含位于发夹1与发夹2之间的“n”,并且包含发夹2的至少一部分;
237.k.处于发夹1或发夹2内,任选地包含位于发夹1与发夹2之间的“n”;
238.l.是连续的;
239.m.是连续的并且包含位于发夹1与发夹2之间的“n”;
240.n.是连续的并且跨越发夹1的至少一部分和发夹2的一部分;
241.o.是连续的并且跨越发夹1的至少一部分以及位于发夹1与发夹2之间的“n”;
242.p.是连续的并且跨越发夹1的至少一部分和紧接在发夹1的3'位的两个核苷酸;
243.q.由5-10个核苷酸组成;
244.r.由6-10个核苷酸组成;
245.s.由5-10个连续核苷酸组成;
246.t.由6-10个连续核苷酸组成;或
247.u.由seq id no:400的核苷酸54-58组成。
248.实施例45是根据实施例29到44中任一项所述的组合物,其包括sgrna的包括连结区的保守部分,其中所述连结区缺少至少一个核苷酸。
249.实施例46是根据实施例45所述的组合物,其中所述连结区中缺少的所述核苷酸包括以下中的任何一个或多个:
250.a.所述连结区中的至少2个、3个、4个、5个、6个、7个、8个、9或10个核苷酸;
251.b.所述连结区中的至少或确切地1-2个核苷酸、1-3个核苷酸、1-4个核苷酸、1-5个核苷酸、1-6个核苷酸、1-10个核苷酸或1-15个核苷酸;以及
252.c.所述连结区中的每个核苷酸。
253.实施例47是一种包括经修饰的单向导rna(sgrna)的组合物,所述组合物包括:
254.a.向导序列,所述向导序列包括:
255.i.选自seq id no:1-149的向导序列;或
256.ii.选自seq id no:1-149的序列的至少17个、18个、19个或20个连续核苷酸;或
257.iii.与选自seq id no:1-149的序列至少95%、90%或85%相同的向导序列;或
258.iv.包括seq id no:1、7、8、15、26、27、28、41、42、46、51、52、53、56、69、71中的任一
个的向导序列;或
259.v.包括seq id no:8、15、41、51、69中的任一个的向导序列;或
260.vi.包括表1中所列的基因组坐标的15个连续核苷酸
±
10个核苷酸的序列;或
261.vii.来自(vi)的序列的至少17个、18个、19个或20个连续核苷酸;或
262.viii.与选自(vi)的序列至少95%、90%或85%相同的向导序列;以及
263.所述组合物进一步包括:
264.b.一种或多种选自以下的修饰:
265.1.一个或多个向导区ya位点处的ya修饰;
266.2.一个或多个保守区ya位点处的ya修饰;
267.3.一个或多个向导区ya位点处和一个或多个保守区ya位点处的ya修饰;
268.4.i)两个或更多个向导区ya位点处的ya修饰;
269.ii)保守区ya位点2、3、4和10中的一个或多个处的ya修饰;以及
270.iii)保守区ya位点1和8中的一个或多个处的ya修饰;或
271.5.i)一个或多个向导区ya位点处的ya修饰,其中所述向导区ya位点位于从5'末端的5'端开始的核苷酸8处或之后;
272.ii)保守区ya位点2、3、4和10中的一个或多个处的ya修饰;以及任选地:
273.iii)保守区ya位点1和8中的一个或多个处的ya修饰;或
274.6.i)一个或多个向导区ya位点处的ya修饰,其中所述向导区ya位点处于所述向导区的3'末端核苷酸的13个核苷酸内;
275.ii)保守区ya位点2、3、4和10中的一个或多个处的ya修饰;以及
276.iii)保守区ya位点1和8中的一个或多个处的ya修饰;或
277.7.i)5'端修饰和3'端修饰;
278.ii)保守区ya位点2、3、4和10中的一个或多个处的ya修饰;以及
279.iii)保守区ya位点1和8中的一个或多个处的ya修饰;或
280.8.i)向导区ya位点处的ya修饰,其中所述向导区ya位点的所述修饰包括定位于所述向导区ya位点的5'位的至少一个核苷酸不包括的修饰;
281.ii)保守区ya位点2、3、4和10中的一个或多个处的ya修饰;以及
282.iii)保守区ya位点1和8中的一个或多个处的ya修饰;或
283.9.i)保守区ya位点2、3、4和10中的一个或多个处的ya修饰;以及
284.ii)保守区ya位点1和8处的ya修饰;或
285.10.i)一个或多个向导区ya位点处的ya修饰,其中所述ya位点位于从5'末端开始的核苷酸8处或之后;
286.ii)保守区ya位点2、3、4和10中的一个或多个处的ya修饰;以及
287.iii)h1-1和h2-1中的一个或多个处的修饰;或
288.11.i)保守区ya位点2、3、4和10中的一个或多个处的ya修饰;ii)保守区ya位点1、5、6、7、8和9中的一个或多个处的ya修饰;以及iii)h1-1和h2-1中的一个或多个处的修饰;或
289.12.i)定位于从5'末端开始的核苷酸6处或之后的一个或多个核苷酸处的修饰,如ya修饰;
290.ii)一个或多个向导序列ya位点处的ya修饰;
291.iii)b3、b4和b5中的一个或多个处的修饰,其中b6不包括2'-ome修饰或包括除了2'-ome之外的修饰;
292.iv)ls10处的修饰,其中ls10包括除了2'-氟之外的修饰;和/或
293.v)n2、n3、n4、n5、n6、n7、n10或n11处的修饰;并且
294.其中以下中的至少一个为真:
295.i.一个或多个向导区ya位点处的ya修饰;
296.ii.一个或多个保守区ya位点处的ya修饰;
297.iii.一个或多个向导区ya位点处和一个或多个保守区ya位点处的ya修饰;
298.iv.从5'末端的5'端开始的核苷酸8-11、13、14、17或18中的至少一个不包括2'-氟修饰;
299.v.从5'末端的5'端开始的核苷酸6-10中的至少一个不包括硫代磷酸酯连接;
300.vi.b2、b3、b4或b5中的至少一个不包括2'-ome修饰;
301.vii.ls1、ls8或ls10中的至少一个不包括2'-ome修饰;
302.viii.n2、n3、n4、n5、n6、n7、n10、n11、n16或n17中的至少一个不包括2'-ome修饰;
303.ix.h1-1包括修饰;
304.x.h2-1包括修饰;或
305.xi.h1-2、h1-3、h1-4、h1-5、h1-6、h1-7、h1-8、h1-9、h1-10、h2-1、h2-2、h2-3、h2-4、h2-5、h2-6、h2-7、h2-8、h2-9、h2-10、h2-11、h2-12、h2-13、h2-14或h2-15中的至少一个不包括硫代磷酸酯连接。
306.实施例48是根据实施例47所述的组合物,其包括seq id no:450。
307.实施例49是根据实施例29到48中任一项所述的组合物,其用于在细胞或受试者中的klkb1基因内诱导双链断裂(dsb)或单链断裂。
308.实施例50是根据实施例29到48中任一项所述的组合物,其用于减少细胞或受试者中的klkb1基因的表达。
309.实施例51是根据实施例29到48中任一项所述的组合物,其用于治疗或预防受试者的hae。
310.实施例52是根据实施例29到48中任一项所述的组合物,其用于减少受试者的血清和/或血浆缓激肽浓度。
311.实施例53是根据实施例29到48中任一项所述的组合物,其用于降低受试者的缓激肽介导的血管舒张浓度。
312.实施例54是根据实施例29到48中任一项所述的组合物,其用于治疗或预防缓激肽产生和累积、缓激肽介导的血管舒张、肿胀或血管性水肿、气道的阻塞或窒息。
313.实施例55是根据实施例29到48中任一项所述的组合物,其用于治疗或预防由hae引起的或与hae相关的血管性水肿。
314.实施例56是根据实施例29到48中任一项所述的组合物,其用于降低血管性水肿发作的频率。
315.实施例57是根据实施例29到48中任一项所述的组合物,其用于降低血管性水肿发作的严重程度。
316.实施例58是根据实施例29到48中任一项所述的组合物,其用于降低发作的频率和/或严重程度。
317.实施例59是根据实施例29到48中任一项所述的组合物,其用于实现血管性水肿发作的缓解。
318.实施例60是根据实施例29到48中任一项所述的组合物,其用于降低hae发作的频率和/或严重程度。
319.实施例61是根据实施例60中所述的组合物,其用于降低hae发作的频率。
320.实施例62是根据实施例61所述的组合物,其中所述频率降低了至少40%、至少50%、至少60%、至少70%、至少80%、至少90%、至少60-80%或至少40-90%。
321.实施例63是根据实施例61所述的方法,其中所述频率降低了至少60-80%。
322.实施例64是根据实施例61所述的方法,其中所述频率降低了至少40-90%。
323.实施例65是根据实施例60中所述的组合物,其用于降低总血浆激肽释放酶活性。
324.实施例66是根据实施例60中所述的组合物,其用于降低总血浆激肽释放酶水平。
325.实施例67是根据实施例60中所述的组合物,其用于降低前激肽释放酶和/或激肽释放酶水平。
326.实施例68是根据实施例65到67中任一项所述的组合物,其中编辑百分比中存在剂量依赖性增加。
327.实施例69是根据实施例65到68中任一项所述的组合物,其中总血浆激肽释放酶水平中存在剂量依赖性降低。
328.实施例70是根据实施例65到69中任一项所述的组合物,其中血浆激肽释放酶活性中存在剂量依赖性降低。
329.实施例71是根据实施例29到70中任一项所述的组合物,其中所述效果在施用后持续至少1个月、2个月、4个月、6个月、1年、2年、5年、10年或更长时间。
330.实施例72是根据实施例29到71中任一项所述的组合物,其中所述效果持续至少6个月。
331.实施例73是根据实施例29到72中任一项所述的组合物,其中所述效果持续至少1年。
332.实施例74是根据实施例1到28中任一项所述的方法,其进一步包括:
333.a.在细胞或受试者中的klkb1基因内诱导双链断裂(dsb);
334.b.减少细胞或受试者中的klkb1基因的表达;
335.c.治疗或预防受试者的hae;
336.d.降低受试者的血清和/或血浆缓激肽浓度;
337.e.减少缓激肽的产生;
338.f.减少缓激肽介导的血管舒张;
339.g.治疗或预防缓激肽介导的肿胀和血管性水肿;和/或
340.h.治疗或预防由肿胀引起的气道阻塞或窒息。
341.实施例75是根据前述实施例中任一项所述的方法、组合物或供使用的组合物,其中所述组合物减少klkb1 mrna产生。
342.实施例76是根据前述实施例中任一项所述的方法、组合物或供使用的组合物,其
中所述组合物降低血浆或血清中的前激肽释放酶蛋白水平。
343.实施例77是根据前述实施例中任一项所述的方法、组合物或供使用的组合物,其中所述组合物降低血浆或血清中的总激肽释放酶(前激肽释放酶和pkal)蛋白水平。
344.实施例78是根据前述实施例中任一项所述的方法、组合物或供使用的组合物,其中所述组合物降低了与柠檬酸血清或柠檬酸血浆中的总hmwk相比的循环切割的hmwk(chmwk)的比例。
345.实施例79是根据前述实施例中任一项所述的方法、组合物或供使用的组合物,其中所述组合物将受试者在柠檬酸血浆中chmwk的比例降低到总hmwk的30%以下。
346.实施例80是根据前述实施例中任一项所述的方法、组合物或供使用的组合物,其中所述组合物降低血清或血浆中的自发pkal活性。
347.实施例81是根据前述实施例中任一项所述的方法、组合物或供使用的组合物,其中所述组合物降低激肽释放酶活性。
348.实施例82是根据前述实施例中任一项所述的方法、组合物或供使用的组合物,其中所述激肽释放酶活性包括总激肽释放酶活性、前激肽释放酶活性和/或pkal活性。
349.实施例83是根据前述实施例中任一项所述的方法、组合物或供使用的组合物,其中所述组合物在所述方法或使用所述组合物之前将受试者的pkal活性降低至少约40%。
350.实施例84是根据前述实施例中任一项所述的方法、组合物或供使用的组合物,其中所述组合物在所述方法或使用所述组合物之前将受试者的pkal活性降低至少约50%。
351.实施例85是根据前述实施例中任一项所述的方法、组合物或供使用的组合物,其中所述组合物在所述方法或使用所述组合物之前将受试者的pkal活性降低至少约60%。
352.实施例86是根据前述实施例中任一项所述的方法、组合物或供使用的组合物,其中所述组合物将受试者的pkal活性降低到低于基础水平的约40%。
353.实施例87是根据前述实施例中任一项所述的方法、组合物或供使用的组合物,其中所述组合物将受试者的pkal活性降低到基础水平的约40-50%。
354.实施例88是根据前述实施例中任一项所述的方法、组合物或供使用的组合物,其中所述组合物将受试者的pkal活性降低到基础水平的20-40%或20-50%。
355.实施例89是根据前述实施例中任一项所述的方法、组合物或供使用的组合物,其中所述组合物增加血清和/或血浆缓激肽水平。
356.实施例90是根据前述实施例中任一项所述的方法、组合物或供使用的组合物,其中所述组合物导致klkb1基因的编辑。
357.实施例91是根据实施例90所述的方法、组合物或供使用的组合物,其中所述编辑被计算为被编辑的群体的百分比(编辑百分比)。
358.实施例92是根据实施例91所述的方法、组合物或供使用的组合物,其中所述编辑百分比介于群体的30与99%之间。
359.实施例93是根据实施例91所述的方法、组合物或供使用的组合物,所述编辑百分比介于群体的30与35%之间、35与40%之间、40与45%之间、45与50%之间、50与55%之间、55与60%之间、60与65%之间、65与70%之间、70与75%之间、75与80%之间、80与85%之间、85与90%之间、90与95%之间或95与99%之间。
360.实施例94是根据前述实施例中任一项所述的方法、组合物或供使用的组合物,其
中所述组合物降低血清和/或血浆缓激肽浓度。
361.实施例95是根据前述实施例中任一项所述的方法、组合物或供使用的组合物,其中所述组合物降低血清和/或血浆缓激肽浓度,并且其中血清和/或血浆缓激肽的降低导致包含肢体、面部、gi道或气道等器官组织的肿胀减少。
362.实施例96是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中所述向导序列选自:
363.a.seq id no:1-149;或
364.b.seq id no:1、7、8、15、26、27、28、41、42、46、51、52、53、56、69、71;或
365.c seq id no:8、15、41、51、69中的任一个;或
366.d.包括表1中所列的基因组坐标的15个连续核苷酸
±
10个核苷酸的序列;或
367.e.来自(d)的序列的至少17个、18个、19个或20个连续核苷酸;或
368.f.与选自(d)的序列至少95%、90%或85%相同的向导序列。
369.实施例97是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中所述组合物包括包含以下的sgrna:
370.a.seq id no:1、7、8、15、26、27、28、41、42、46、51、52、53、56、69、71;或
371.b.seq id no:8、15、41、51、69中的任一个;或
372.c.包括表1中所列的基因组坐标的15个连续核苷酸
±
10个核苷酸的序列;或
373.d.来自(c)的序列的至少17个、18个、19个或20个连续核苷酸;或
374.e.与选自(c)的序列至少95%、90%或85%相同的向导序列。
375.实施例98是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中靶序列位于人klkb1基因的外显子1、外显子3、外显子4、外显子5、外显子6或外显子8、外显子9、外显子10、外显子11、外显子12、外显子13、外显子14或外显子15中。
376.实施例99是根据实施例98所述的方法、供使用的组合物或组合物,其中所述靶序列位于所述人klkb1基因的外显子1中。
377.实施例100是根据实施例98所述的方法、供使用的组合物或组合物,其中所述靶序列位于所述人klkb1基因的外显子3中。
378.实施例101是根据实施例98所述的方法、供使用的组合物或组合物,其中所述靶序列位于所述人klkb1基因的外显子4中。
379.实施例102是根据实施例98所述的方法、供使用的组合物或组合物,其中所述靶序列位于所述人klkb1基因的外显子5中。
380.实施例103是根据实施例98所述的方法、供使用的组合物或组合物,其中所述靶序列位于所述人klkb1基因的外显子6中。
381.实施例104是根据实施例98所述的方法、供使用的组合物或组合物,其中所述靶序列位于所述人klkb1基因的外显子8中。
382.实施例105是根据实施例98所述的方法、供使用的组合物或组合物,其中所述靶序列位于所述人klkb1基因的外显子9中。
383.实施例106是根据实施例98所述的方法、供使用的组合物或组合物,其中所述靶序列位于所述人klkb1基因的外显子10中。
384.实施例107是根据实施例98所述的方法、供使用的组合物或组合物,其中所述靶序
列位于所述人klkb1基因的外显子11中。
385.实施例108是根据实施例98所述的方法、供使用的组合物或组合物,其中所述靶序列位于所述人klkb1基因的外显子12中。
386.实施例109是根据实施例98所述的方法、供使用的组合物或组合物,其中所述靶序列位于所述人klkb1基因的外显子13中。
387.实施例110是根据实施例98所述的方法、供使用的组合物或组合物,其中所述靶序列位于所述人klkb1基因的外显子14中。
388.实施例111是根据实施例98所述的方法、供使用的组合物或组合物,其中所述靶序列位于所述人klkb1基因的外显子15中。
389.实施例112是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中所述向导序列与klkb1的正链中的靶序列互补。
390.实施例113是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中所述向导序列与klkb1的负链中的靶序列互补。
391.实施例114是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中第一向导序列与klkb1基因的正链中的第一靶序列互补,并且其中所述组合物进一步包括与klkb1基因的负链中的第二靶序列互补的第二向导序列。
392.实施例115是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中所述向导rna包括选自seq id no 1-149中的任一个的向导序列并且进一步包括seq id no:170的核苷酸序列,其中seq id no:170的核苷酸在其3'端处跟随所述向导序列。
393.实施例116是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中所述向导rna包括选自seq id no:1-149的任一项的向导序列,并且进一步包括seq id no:171、seq id no:172、seq id no:173或seq id no:400-450中的任一个的核苷酸序列,其中seq id no:171、seq id no:172、seq id no:173的核苷酸或来自表4的sgrna的保守部分中的任一个在其3'端处跟随所述向导序列。
394.实施例117是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中所述向导rna是单向导rna(sgrna)。
395.实施例118是根据实施例117所述的方法、供使用的组合物或组合物,其中所述sgrna包括包含seq id no:8、15、41、51、69中的任一个的向导序列。
396.实施例119是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中所述向导rna根据seq id no:300的模式进行修饰,其中n共同作为表1的向导序列(seq id no:1-149)中的任何一个。
397.实施例120是根据实施例119所述的方法、供使用的组合物或组合物,其中在seq id no:300中的每个n是任何天然核苷酸或非天然核苷酸,其中n形成所述向导序列,并且所述向导序列将cas9靶向到klkb1基因。
398.实施例121是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中所述sgrna包括seq id no:1-149的向导序列中的任一个向导序列以及seq id no:171、seq id no:172、seq id no:173的核苷酸或来自表4的sgrna的保守部分中的任一个,其中seq id no:171、seq id no:172、seq id no:173的所述核苷酸或来自表4的sgrna的保守部分中的任一个在其3'端处跟随所述向导序列。
399.实施例122是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中所述sgrna包括与选自seq id no:1-149的序列至少95%、90%或85%相同的向导序列。
400.实施例123是根据实施例122所述的方法、供使用的组合物或组合物,其中所述sgrna包括选自seq id no:8、15、41、51、69的序列。
401.实施例124是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中所述向导rna包括至少一个修饰。
402.实施例125是根据实施例124所述的方法、供使用的组合物或组合物,其中所述至少一个修饰包含经2'-o-甲基(2'-o-me)修饰的核苷酸。
403.实施例126是根据实施例124到125中任一项所述的方法、供使用的组合物或组合物,其包括核苷酸之间的硫代磷酸酯(ps)键。
404.实施例127是根据实施例124到126中任一项所述的方法、供使用的组合物或组合物,其包括经2'-氟(2'-f)修饰的核苷酸。
405.实施例128是根据实施例124到127中任一项所述的方法、供使用的组合物或组合物,其包括所述向导rna的5'端处的前五个核苷酸中的一个或多个核苷酸处的修饰。
406.实施例129是根据实施例124到128中任一项所述的方法、供使用的组合物或组合物,其包括所述向导rna的3'端处的最后五个核苷酸中的一个或多个核苷酸处的修饰。
407.实施例130是根据实施例124到129中任一项所述的方法、供使用的组合物或组合物,其包括所述向导rna的前四个核苷酸之间的ps键。
408.实施例131是根据实施例124到130中任一项所述的方法、供使用的组合物或组合物,其包括所述向导rna的最后四个核苷酸之间的ps键。
409.实施例132是根据实施例124到131中任一项所述的方法、供使用的组合物或组合物,其包括所述向导rna的5'端处的前三个核苷酸处的经2'-o-me修饰的核苷酸。
410.实施例133是根据实施例124到132中任一项所述的方法、供使用的组合物或组合物,其包括所述向导rna的3'端处的最后三个核苷酸处的经2'-o-me修饰的核苷酸。
411.实施例134是根据实施例124到133中任一项所述的方法、供使用的组合物或组合物,其中所述向导rna包括seq id no:300的经修饰的核苷酸。
412.实施例135是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中所述组合物进一步包括药学上可接受的赋形剂。
413.实施例136是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中所述向导rna与脂质纳米颗粒(lnp)缔合。
414.实施例137是根据实施例136所述的方法、供使用的组合物或组合物,其中所述lnp包括阳离子脂质。
415.实施例138是根据实施例137所述的方法、供使用的组合物或组合物,其中所述阳离子脂质是十八碳-9,12-二烯酸(9z,12z)-3-((4,4-双(辛氧基)丁酰基)氧基)-2-((((3-(二乙基氨基)丙氧基)羰基)氧基)甲基)丙酯,也称为(9z,12z)-十八碳-9,12-二烯酸3-((4,4-双(辛氧基)丁酰基)氧基)-2-((((3-(二乙基氨基)丙氧基)羰基)氧基)甲基)丙酯。
416.实施例139是根据实施例136到138中任一项所述的方法、供使用的组合物或组合物,其中所述lnp包括中性脂质。
417.实施例140是根据实施例139所述的方法、供使用的组合物或组合物,其中所述中
性脂质是dspc。
418.实施例141是根据实施例136到140中任一项所述的方法、供使用的组合物或组合物,其中所述lnp包括辅助脂质。
419.实施例142是根据实施例141所述的方法、供使用的组合物或组合物,其中所述辅助脂质是胆固醇。
420.实施例143是根据实施例136到142中任一项所述的方法、供使用的组合物或组合物,其中所述lnp包括隐形脂质。
421.实施例144是根据实施例143所述的方法、供使用的组合物或组合物,其中所述隐形脂是peg2k-dmg。
422.实施例145是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中所述组合物进一步包括rna引导的dna结合剂。
423.实施例146是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中所述组合物进一步包括编码rna引导的dna结合剂的mrna。
424.实施例147是根据实施例145或146所述的方法、供使用的组合物或组合物,其中所述rna引导的dna结合剂是cas9。
425.实施例148是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中所述组合物是药物调配物并且进一步包括药学上可接受的载体。
426.实施例149是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:1。
427.实施例150是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:2。
428.实施例151是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:3。
429.实施例152是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:4。
430.实施例153是根据实施例1到89中任一项所述的方法、供使用的组合物或组合物,其中选自seq id no:1-149的所述序列是seq id no:5。
431.实施例154是根据实施例1到89中任一项所述的方法、供使用的组合物或组合物,其中选自seq id no:1-149的所述序列是seq id no:6。
432.实施例155是根据实施例1到89中任一项所述的方法、供使用的组合物或组合物,其中选自seq id no:1-149的所述序列是seq id no:7。
433.实施例156是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:8。
434.实施例157是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:9。
435.实施例158是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:10。
436.实施例159是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:11。
437.实施例160是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:12。
438.实施例161是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:13。
439.实施例162是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:14。
440.实施例163是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:15。
441.实施例164是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:16。
442.实施例165是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:17。
443.实施例166是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:18。
444.实施例167是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:19。
445.实施例168是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:20。
446.实施例169是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:21。
447.实施例170是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:22。
448.实施例171是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:23。
449.实施例172是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:24。
450.实施例173是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:25。
451.实施例174是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:26。
452.实施例175是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:27。
453.实施例176是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:28。
454.实施例177是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:29。
455.实施例178是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:30。
456.实施例179是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其
中包括选自seq id no:1-149的序列的所述组合物是seq id no:31。
457.实施例180是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:32。
458.实施例181是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:33。
459.实施例182是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:34。
460.实施例183是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:35。
461.实施例184是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:36。
462.实施例185是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:37。
463.实施例186是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:38。
464.实施例187是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:39。
465.实施例188是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:40。
466.实施例189是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:41。
467.实施例190是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:42。
468.实施例191是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:43。
469.实施例192是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:44。
470.实施例193是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:45。
471.实施例194是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:46。
472.实施例195是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:47。
473.实施例196是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:48。
474.实施例197是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:49。
475.实施例198是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:50。
476.实施例199是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:51。
477.实施例200是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:52。
478.实施例201是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:53。
479.实施例202是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:54。
480.实施例203是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:55。
481.实施例204是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:56。
482.实施例205是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:57。
483.实施例206是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:58。
484.实施例207是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:59。
485.实施例208是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:60。
486.实施例209是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:61。
487.实施例210是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:62。
488.实施例211是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:63。
489.实施例212是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:64。
490.实施例213是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:65。
491.实施例214是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:66。
492.实施例215是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:67。
493.实施例216是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:68。
494.实施例217是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:69。
495.实施例218是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其
中包括选自seq id no:1-149的序列的所述组合物是seq id no:70。
496.实施例219是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:71。
497.实施例220是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:72。
498.实施例221是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:73。
499.实施例222是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:74。
500.实施例223是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:75。
501.实施例224是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:76。
502.实施例225是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:77。
503.实施例226是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:78。
504.实施例227是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:79。
505.实施例228是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:80。
506.实施例229是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:81。
507.实施例230是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:82。
508.实施例231是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:83。
509.实施例232是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:84。
510.实施例233是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:85。
511.实施例234是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:86。
512.实施例235是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:87。
513.实施例236是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:88。
514.实施例237是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:89。
515.实施例238是根据实施例1到89中任一项所述的方法、供使用的组合物或组合物,其中选自seq id no:1-1491-149的所述序列是seq id no:90。
516.实施例239是根据实施例1到89中任一项所述的方法、供使用的组合物或组合物,其中选自seq id no:1-1491-149的所述序列是seq id no:91。
517.实施例240是根据实施例1到89中任一项所述的方法、供使用的组合物或组合物,其中选自seq id no:1-1491-149的所述序列是seq id no:92。
518.实施例241是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:93。
519.实施例242是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:94。
520.实施例243是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:95。
521.实施例244是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:96。
522.实施例245是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:97。
523.实施例246是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:98。
524.实施例247是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:99。
525.实施例248是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:100。
526.实施例249是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:101。
527.实施例250是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:102。
528.实施例251是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:103。
529.实施例252是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:104。
530.实施例253是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:105。
531.实施例254是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:106。
532.实施例255是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:107。
533.实施例256是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:108。
534.实施例257是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其
中包括选自seq id no:1-149的序列的所述组合物是seq id no:109。
535.实施例258是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:110。
536.实施例259是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:111。
537.实施例260是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:112。
538.实施例261是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:113。
539.实施例262是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:114。
540.实施例263是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:115。
541.实施例264是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:116。
542.实施例265是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:117。
543.实施例266是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:118。
544.实施例267是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:119。
545.实施例268是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:120。
546.实施例269是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:121。
547.实施例270是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:122。
548.实施例271是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:123。
549.实施例272是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:124。
550.实施例273是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:125。
551.实施例274是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:126。
552.实施例275是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:127。
553.实施例276是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:128。
554.实施例277是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:129。
555.实施例278是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:130。
556.实施例279是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:131。
557.实施例280是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:132。
558.实施例281是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:133。
559.实施例282是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:134。
560.实施例283是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:135。
561.实施例284是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:136。
562.实施例285是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:137。
563.实施例286是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:138。
564.实施例287是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:139。
565.实施例288是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:140。
566.实施例289是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:141。
567.实施例290是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:142。
568.实施例291是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:143。
569.实施例292是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:144。
570.实施例293是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:145。
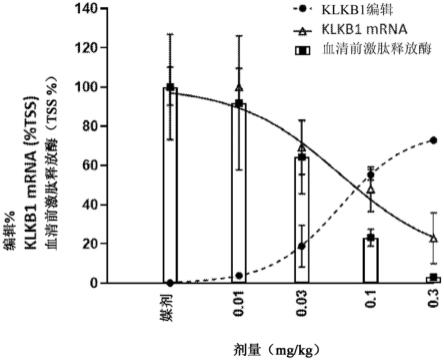
571.实施例294是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:146。
572.实施例295是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:147。
573.实施例296是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其
中包括选自seq id no:1-149的序列的所述组合物是seq id no:148。
574.实施例297是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中包括选自seq id no:1-149的序列的所述组合物是seq id no:149。
575.实施例298是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中所述向导序列选自seq id no:310-386。
576.实施例299是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中所述向导序列选自seq id no:310-311、313-326、329-337、339-342、344-346、348、350、352-356、361、362、364、365、366、367、369-374、376-380和382-386。
577.实施例300是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其中选自seq id no:310-386的所述向导序列是seq id no:310。
578.实施例301是根据前述实施例中任一项所述的方法、供使用的组合物或组合物,其包括包含seq id no:1-149中的任一个的所述向导序列的sgrna和来自表4的sgrna的保守部分中的任一个,任选地具有seq id no:450的修饰模式或表4的修饰模式中的任一个,任选地其中所述sgrna包括5'端修饰和3'端修饰。
579.实施例302是根据实施例1到301中任一项所述的方法、组合物或供使用的组合物,其中所述组合物作为单剂量施用。
580.实施例303是根据实施例1到301中任一项所述的方法、组合物或供使用的组合物,其中所述组合物被施用一次。
581.实施例304是根据实施例302或303中任一项所述的方法、组合物或供使用的组合物,其中所述单剂量或一次施用:
582.a.在细胞或受试者中的klkb1基因内诱导双链断裂(dsb);和/或
583.b.减少细胞或受试者中的所述klkb1基因的表达;和/或
584.c.治疗或预防受试者的hae;和/或
585.d.治疗或预防受试者的由hae引起或与所述hae相关的血管性水肿;和/或
586.e.降低受试者的血清和/或血浆缓激肽浓度;
587.f.减少缓激肽介导的血管舒张;
588.g.治疗或预防缓激肽介导的肿胀和血管性水肿;和/或
589.h.治疗或预防由肿胀引起的气道阻塞或窒息。
590.实施例305是根据实施例304所述的方法或组合物,其中所述单剂量或一次施用在3、4、5、6、7、8、9、10、11、12、13、14或15周内实现a)-h)中的任何一个或多个。
591.实施例306是根据实施例304所述的方法或组合物,其中所述单剂量或一次施用实现持久性效果。
592.实施例307是根据实施例1到306中任一项所述的方法、组合物或供使用的组合物,其进一步包括实现持久性效果。
593.实施例308是根据实施例307所述的方法、组合物或供使用的组合物,其中所述持久性效果持续至少1个月、至少3个月、至少6个月、至少一年或至少5年。
594.实施例309是根据实施例1到308中任一项所述的方法、组合物或供使用的组合物,其中所述组合物的施用导致血清和/或血浆中激肽释放酶活性、总血浆激肽释放酶水平、前激肽释放酶和/或激肽释放酶水平或缓激肽的治疗相关降低。
595.实施例310是根据实施例1到309中任一项所述的方法、组合物或供使用的组合物,其中所述组合物的施用导致血清和/或血浆缓激肽水平在治疗范围内。
596.实施例311是根据前述实施例中任一项所述的方法、组合物或供使用的组合物,其中所述组合物的施用导致所述血清和/或血浆缓激肽水平在正常范围的100、120或150%内。
597.实施例312是一种根据前述组合物实施例中任一项所述的组合物的用途,其用于制备用于治疗患有hae的人类受试者的药物。
598.实施例313是一种根据前述组合物实施例中任一项所述的组合物的用途,其用于制备用于治疗和预防缓激肽产生和累积、缓激肽诱导的肿胀、气道的血管性水肿阻塞或窒息的药物。
599.实施例314是一种根据前述组合物实施例中任一项所述的组合物的用途,其用于制备用于治疗或预防由hae引起或与所述hae相关的血管性水肿的药物。
600.实施例315是一种根据前述组合物实施例中任一项所述的组合物的用途,其用于制备用于降低血管性水肿发作的频率的药物。
601.实施例316是一种根据前述组合物实施例中任一项所述的组合物的用途,其用于制备用于降低血管性水肿发作的严重程度的药物。
602.实施例317是一种根据前述组合物实施例中任一项所述的组合物的用途,其用于制备用于降低hae发作的所述频率和/或所述严重程度的药物。
603.实施例318是一种根据前述组合物实施例中任一项所述的组合物的用途,其用于制备用于实现血管性水肿发作的缓解的药物。
604.实施例319是一种根据前述组合物实施例中任一项所述的组合物的用途,其用于制备用于实现持久缓解,例如维持至少1个月、2个月、4个月、6个月、1年、2年、5年、10年或更长时间的药物。
附图说明
605.图1a-1d示出了在原代人肝细胞(phh)(图1a-1b)和原代食蟹猴肝细胞(pch)(图1c-1d)中使用向导rna在klkb1基因座内的不同位点处检测到的编辑百分比(插入缺失频率)。
606.图2a-2d示出了phh(图2a-2b)和pch(图2c-2d)中的klkb1 sgrna的编辑百分比(插入缺失频率)。
607.图3a-3e示出了在三个不同phh批次(hu8300、hu8284和hu8296)中用靶向klkb1的向导rna转染phh后的编辑百分比(插入缺失频率)(图3a)、分泌的klkb1蛋白水平(图3b)和相关图(图3c-e)。
608.图4a-4d示出了原代人肝细胞(phh)中klkb1向导的编辑百分比(图4a-4b),以及原代食蟹猴肝细胞(pch)中klkb1向导的编辑百分比(图4c-4d)。
609.图5a-5j示出了phh(图5a-5d)和pch(图5e-5h)中某些向导序列的编辑百分比和分泌的激肽释放酶的剂量响应数据,以及phh和pch中编辑百分比和分泌蛋白的相关图(图5i-5j)。
610.图6a-6d提供phh(图6a-6b)和pch(图6c-6d)中某些向导序列的插入缺失频率的剂
量响应曲线数据。
611.图7a-7e示出了phh(图7a和7c)和pch(图7b和7d)中某些向导序列的插入缺失频率(图7a和7b)和klkb1分泌(图7c和7d)的剂量响应曲线数据,以及测量分泌蛋白的蛋白质印迹分析(图7e)。
612.图8a示出了在hu klkb1小鼠体内各种经修饰的sgrna的klkb1编辑%。
613.图8b和8c示出了分别使用elisa和基于电化学发光的阵列在hu klkb1小鼠中测量的klkb1蛋白水平(实例6)。
614.图8d示出了hu klkb1小鼠中每个序列的klkb1 mrna水平的变化倍数。
615.图9a-9d示出了klkb1编辑水平(图9a)、血清klkb1蛋白(前激肽释放酶和激肽释放酶)(图9b)、经处理的小鼠中的tss百分比(图9c)以及肝脏编辑百分比与klkb1蛋白百分比的相关性(图9d)。
616.图10示出了在hu klkb1小鼠模型中klkb1基因编辑的剂量依赖性水平、klkb1mrna的敲低百分比和血浆激肽释放酶。
617.图11a示出了在hu klkb1小鼠模型中用指定剂量的sgrna处理后,剂量响应测定中klkb1基因编辑和血浆激肽释放酶的水平。
618.图11b示出了在hu klkb1小鼠模型中用指定剂量的sgrna处理后在剂量响应血管渗透性测定中,在600nm光下检测来自结肠样品的伊文思蓝(eb)染料的吸光度水平,以响应渗透剂处理。
619.图12a-12b分别示出了在食蟹猴中以1.5mg/kg、3mg/kg或6mg/kg单剂量施用具有g013901的crispr/cas9组分后,循环总激肽释放酶活性(图12a)和蛋白质水平(图12b)的体内剂量依赖性降低。
620.图13a-13b分别示出了在食蟹猴中以指定剂量单剂量施用具有g012267的crispr/cas9组分后,循环总激肽释放酶活性(图13a)和蛋白质水平(图13b)在体内降低。
621.图14在示例性sgrna序列(seq id no:201)中从1到10标记了10个保守区ya位点。数字25、45、50、56、64、67和83指示ya位点1、5、6、7、8、9和10的嘧啶在sgrna中的位置,其中向导区指示为(n)x,例如,其中x任选地为20。
622.图15示出了可能的次级结构中的示例性sgrna(seq id no:401;未示出所有修饰),其中标签指定sgrna的保守区的单独的核苷酸,包含下部茎区、凸起区、上部茎区、连结点(其核苷酸在5'到3'方向上可以分别指代n1到n18)、发夹1区和发夹2区。发夹1与发夹2之间的核苷酸被标记为n。sgrna上可以存在向导区,并且所述向导区在此图中指示为在sgrna的保守区之前的“(n)x”。
具体实施方式
623.现在将详细参照本发明的某些实施例,在附图中展示所述实施例的实例。尽管将结合所展示的实施例描述本发明,但应当理解,所述实施例并不旨在将本发明限制于那些实施例。相反,本发明旨在涵盖如所附权利要求和所包含的实施例定义的可以包含在本发明内的所有替代方案、修饰和等效物。
624.在详细描述本教导之前,应当理解,本公开不限于具体的组合物或工艺步骤,因为此类组合物或工艺步骤可以变化。应注意的是,除非上下文另外明确指示,否则如在本说明
书和所附权利要求中所使用的,单数形式“一个(a/an)”以及“所述(the)”均包含复数指代物。因此,例如,对“缀合物(a conjugate)”的引用包含多个缀合物,并且对“单元(a cell)”的引用包含多个单元等。
625.数值范围包含定义所述范围的数字。考虑到有效数字和与测量相关的误差,测得值和可测量值被理解为近似值。而且,“包括(comprise/comprises/comprising)”、“含有(contain/contains/containing)”和“包含(include/includes/including)”的使用不旨在是限制性的。应当理解,上述的一般描述和详细描述两者均仅是示例性和解释性的,并且不限制本教导。
626.除非说明书中特别指出,否则说明书中叙述“包括”各个组分的实施例也被考虑是“由所述组分组成”或“基本上由所述组分组成”;说明书中叙述“由各个组分组成”的实施例也被认为是“包括所述组分”或“基本上由所述组分组成”;并且说明书中叙述“基本上由各个组分组成”的实施例也被认为是“由所述组分组成”或“包括所述组分”(这种可互换性不适用于这些术语在权利要求书中的使用)。
627.术语“或”以开放性意义使用,即,相当于“和/或”,除非上下文另外明确指示。
628.本文所使用的章节标题仅仅是出于组织的目的并且不应被解释为以任何方式限制期望的主题。如果通过引用并入的任何材料与本说明书中限定的任何术语或本说明书的任何其它明确的内容矛盾,则以本说明书为准。虽然结合各个实施例对本发明教导进行了描述,但是本发明教导不旨在受限于此类实施例。相反,本发明教导涵盖各种替代方案、修改和等效物,如本领域的技术人员将理解的。
629.i.定义
630.除非另有说明,否则如本文中所使用的以下术语和短语旨在具有以下含义:
631.本文中使用“多核苷酸”和“核酸”指代包括核苷或核苷类似物的多聚体化合物,所述核苷或核苷类似物具有沿骨架连接在一起的含氮杂环碱基或碱基类似物,所述骨架包含常规rna、dna、混合的rna-dna和其类似物的聚合物。核酸“骨架”可以由多种连接构成,包含以下中的一个或多个:糖-磷酸二酯连接、肽-核酸键(“肽核酸”或pna;pct号:wo 95/32305)、硫代磷酸酯连接、甲基膦酸酯连接或其组合。核酸的糖部分可以是核糖、脱氧核糖,或具有取代(例如,2'甲氧基和/或2'卤化物取代)的类似化合物。含氮碱基可以是常规碱基(a、g、c、t、u),其类似物(例如,经修饰的尿苷,如5-甲氧基尿苷、假尿苷或n1-甲基假尿苷等等);肌苷;嘌呤或嘧啶的衍生物(例如,n
4-甲基脱氧鸟苷、脱氮-或氮杂-嘌呤、脱氮-或氮杂-嘧啶、在5或6位置具有取代基的嘧啶碱基(例如,5-甲基胞嘧啶)、在2、6或8位置具有取代基的嘌呤碱基、2-氨基-6-甲基氨基嘌呤、o
6-甲基鸟嘌呤、4-硫代-嘧啶、4-氨基-嘧啶、4-二甲基肼-嘧啶和o
4-烷基-嘧啶;美国专利第5,378,825号和pct第wo 93/13121号)。有关一般讨论,参见《核酸的生物化学(the biochemistry of the nucleic acids)》5-36,adams等人,编辑,第11版,1992。核酸可以包含一个或多个“无碱基”残基,其中骨架不包含聚合物的一个或多个位置的含氮碱基(美国专利第5,585,481号)。核酸可以仅包括常规的rna或dna糖、碱基和键,或可以包含常规的组分和取代(例如,具有2’甲氧基键的常规碱基,或含有常规碱基和一种或多种碱基类似物两者的聚合物)。核酸包含“锁定核酸”(lna),一种含有一种或多种lna核苷酸单体的类似物,其中二环呋喃糖单元被锁定在模拟糖构型的rna中,这增强了对互补rna和dna序列的杂交亲和力(vester和wengel,2004,《生物化学
(biochemistry)》43(42):13233-41)。rna和dna具有不同的糖部分并且可以通过其尿嘧啶或类似物在rna中的存在以及其胸腺嘧啶或类似物在dna中的存在进行区分。
[0632]“向导rna”、“grna”和简单的“向导”在本文中可互换使用以指代将rna引导的dna结合剂引导到靶dna的向导,并且可以是crrna(也称为crispr rna),或crrna和trrna的组合(也称为tracrrna)。crrna和trrna可以作为单个rna分子(单向导rna、sgrna)或在两个单独的rna分子(双向导rna、dgrna)中缔合。“向导rna”或“grna”是指每种类型。trrna可以是天然存在的序列,或与天然存在的序列相比具有修饰或变异的trrna序列。
[0633]
如本文所使用的,“向导序列”是指在向导rna内与靶序列互补并且用作将向导rna引导到靶序列以通过rna引导的dna结合剂进行结合或修饰(例如,切割)的序列。“向导序列”也可以被称为“靶向序列”或“间隔序列”。向导序列的长度可以是20个碱基对,例如,在酿脓链球菌(即spy cas9)和相关的cas9同源物/直系同源物的情况下。较短或较长的序列还可以用作向导,例如,长度为15个、16个、17个、18个、19个、21个、22个、23个、24个或25个核苷酸。例如,在一些实施例中,向导序列包括选自seq id no:1-149的序列的至少17个、18个、19个或20个连续核苷酸。在一些实施例中,靶序列例如在基因中或在染色体上,并且与向导序列互补。在一些实施例中,向导序列与其对应靶序列之间的互补性或同一性程度可以为约75%、80%、85%、90%、95%、96%、97%、98%、99%或100%。例如,在一些实施例中,向导序列包括与选自seq id no:1-149的序列的至少17个、18个、19个或20个连续核苷酸具有约75%、80%、85%、90%、95%、96%、97%、98%、99%或100%同一性的序列。在一些实施例中,向导序列和靶区可以100%互补或相同。在其它实施例中,向导序列和靶区可以含有至少一个错配。例如,向导序列和靶序列可以含有1个、2个、3个或4个错配,其中靶序列的总长度为至少17个、18个、19个、20个或更多个碱基对。在一些实施例中,向导序列和靶区可以含有1-4个错配,其中向导序列包括至少17个、18个、19个、20个或更多个核苷酸。在一些实施例中,向导序列和靶区可以含有1个、2个、3个或4个错配,其中向导序列包括20个核苷酸。
[0634]
rna引导的dna结合剂的靶序列包含基因组dna的正链和负链两者(即,给定的序列和序列的反向互补物),因为rna引导的dna结合剂的核酸底物是双链核酸。因此,在向导序列被称为“与靶序列互补”的情况下,应当理解,向导序列可以将向导rna引导为与靶序列的反向补体结合。因此,在一些实施例中,在向导序列结合靶序列的反向补体的情况下,除了向导序列中的u代替t之外,向导序列与靶序列的某些核苷酸(例如,不包含pam的靶序列)相同。
[0635]
如本文所使用的,“rna引导的dna结合剂”意指具有rna和dna结合活性的多肽或多肽复合物,或此类复合物的dna结合亚基,其中dna结合活性是序列特异性的并取决于rna的序列。示例性rna引导的dna结合剂包含cas切割酶/切口酶及其失活形式(“dcas dna结合剂”)。如本文所使用的“cas核酸酶”,也称为“cas蛋白”涵盖cas切割酶、cas切口酶和dcas dna结合剂。cas切割酶/切口酶和dcas dna结合剂包含iii型crispr系统的csm或cmr复合物、其cas10、csm1或cmr2亚基、i型crispr系统的级联复合物、其cas3亚基和第2类cas核酸酶。如本文所使用的,“第2类cas核酸酶”是具有rna引导的dna结合活性的单链多肽。第2类cas核酸酶包含第2类cas切割酶/切口酶(例如,h840a、d10a或n863a变体),所述切割酶/切口酶进一步具有rna引导的dna切割酶/切口酶活性,以及第2类dcas dna结合剂,其中切割
酶/切口酶活性失活。第2类cas核酸酶包含例如,cas9、cpf1、c2c1、c2c2、c2c3、hf cas9(例如,n497a、r661a、q695a、q926a变体)、hypacas9(例如,n692a、m694a、q695a、h698a变体)、espcas9(1.0)(例如,k810a、k1003a、r1060a变体)和espcas9(1.1)(例如,k848a、k1003a、r1060a变体)蛋白和其修饰。cpf1蛋白,zetsche等人,《细胞(cell)》,163:1-13(2015),与cas9同源并且含有ruvc样核酸酶结构域。zetsche的cpf1序列整体并入。参见例如zetsche,表s1和s3。参见例如,makarova等人,《自然综述:微生物学(nat rev microbiol)》,13(11):722-36(2015);shmakov等人,《分子细胞(molecular cell)》,60:385-397(2015)。
[0636]
如本文所使用的,“核糖核蛋白”(rnp)或“rnp复合物”是指向导rna以及rna引导的dna结合剂,如cas核酸酶、例如cas切割酶、cas切口酶或dcas dna结合剂(例如,cas9)。在一些实施例中,向导rna将如cas9等rna引导的dna结合剂引导到靶序列,并且向导rna与靶序列杂交并且所述试剂与靶序列结合;在试剂是切割酶或切口酶的情况下,结合之后可以是切割或切口。
[0637]
如本文所使用的,如果第一序列与第二序列的比对表明第二序列的x%或更多的位置整体上与第一序列匹配,则第一序列被认为“包括与第二序列具有至少x%同一性的序列”。例如,序列aaga包括与序列aag具有100%同一性的序列,因为比对将给出100%同一性,因为存在与第二序列的所有三个位置的匹配。只要相关核苷酸(如胸苷、尿苷或经修饰的尿苷)具有相同的互补物(例如,胸苷、尿苷或经修饰的尿苷的全部的腺苷;另一个实例是胞嘧啶和5-甲基胞嘧啶,两者均具有鸟苷或经修饰的鸟苷作为互补物),rna与dna之间的差异(通常是尿苷代替胸苷或反之亦然)以及如经修饰的尿苷等核苷类似物的存在就不会对多核苷酸之间的同一性或互补性差异有贡献。因此,例如,序列5'-axg(其中x为任何经修饰的尿苷,如假尿苷、n1-甲基假尿苷或5-甲氧基尿苷)被认为与aug 100%相同,因为两者与同一序列(5'-cau)完全互补。示例性的比对算法是本领域众所周知的史密斯-沃特曼(smith-waterman)算法和尼德曼-翁施(needleman-wunsch)算法。本领域的技术人员将理解,对于要比对的给定的序列对,适当的算法和参数设置选择是什么;对于长度通常类似并且氨基酸的预期同一性》50%或核苷酸的预期同一性》75%的序列,具有ebi在www.ebi.ac.uk网站服务器上提供的尼德曼-翁施算法的默认设置的尼德曼-翁施算法通常是适当的。
[0638]“mrna”在本文中用于指代非dna的多核苷酸并且包括可以被翻译成多肽的开放阅读框(即,可以充当用于由核糖体和氨基酰化的trna翻译的底物)。mrna可以包括包含核糖残基或其类似物(例如,2'-甲氧基核糖残基)的磷酸糖骨架。在一些实施例中,mrna磷酸-糖骨架的糖基本上由核糖残基、2'-甲氧基核糖残基或其组合组成。
[0639]
表1或表2和整个申请中示出了可用于本文所描述的向导rna组合物和方法的向导序列。
[0640]
如本文所使用的,“插入缺失”是指由在靶核酸中的双链断裂(dsb)位点处插入或缺失的许多核苷酸组成的插入/缺失突变。
[0641]
如本文所使用的,“敲低”是指特定基因产物(例如,蛋白质、mrna或两者)表达的降低。蛋白质的敲低可以通过从所关注的样品,如组织、流体或细胞群中检测蛋白质的细胞总量来测量。其也可以通过测量蛋白质的替代物、标志物或活性来测量。用于测量mrna敲低的方法是已知的并且包含对从所关注的样品中分离的mrna进行测序。在一些实施例中,“敲
低”可以是指特定基因产物表达的一些丧失,例如转录的mrna量的减少或细胞群(包含体内群体,如组织中发现的那些群体)表达的蛋白质量的减少。
[0642]
如本文所使用的,“敲除”是指细胞中特定基因或特定蛋白质表达的丧失。敲除可以通过检测细胞、组织或细胞群中的蛋白质的细胞总量来测量。在一些实施例中,本发明的方法“敲除”一个或多个样品,例如,血清、血浆、组织或细胞中(例如,在包含体内群体的细胞群中,如在组织中发现的那些细胞群中)的klkb1。在一些实施例中,敲除不是形成例如通过插入缺失产生的突变型klkb1蛋白,而是klkb1蛋白在细胞中表达的完全丧失。如本文所使用的,“klkb1”是指是klkb1基因的基因产物的前激肽释放酶。前激肽释放酶被加工成血浆激肽释放酶(pkal),并且抗体可以检测pkal、前激肽释放酶或两者。人野生型klkb1序列可在ncbi基因id:3818;ensembl:ensg00000164344处获得。“pkk”、“ppk”、“klk3”和“pkkd”是基因同义词。人klkb1转录物可在ensembl:enst00000264690处获得,并且食蟹猴野生型klkb1序列可在ensembl:ensmfat00000002355处获得。
[0643]“遗传性血管性水肿”(hae)是一种炎症性病症,其以由于编码c1酯酶抑制剂蛋白(c1-inh)的serping1基因失活突变而反复发作严重肿胀(血管性水肿)为表征。c1-inh阻断促进炎症的某些蛋白质的活性(例如,在激肽系统中)。c1-inh的缺陷水平导致未经检查的因子xii(fxii)和激肽释放酶(pkal,由klkb1蛋白(前激肽释放酶)加工而成)的高水平激活。激肽释放酶切割高分子量激肽原(hmwk)以释放缓激肽,所述缓激肽是影响血管渗透性的肽。血液中过量的缓激肽会导致流体通过血管壁渗漏到身体组织中,从而导致患有hae的个体出现肿胀。因此,在一些实施例中,提供了用于降低klkb1活性的方法,其中一旦降低,缓激肽的产生减少并且肿胀发作减少。可以测量前激肽释放酶/激肽释放酶、hmwk和其裂解产物以及hmwk的经替代标记的底物的蛋白质水平以评估klkb1敲除的功效。
[0644]
如本文所使用的,“靶序列”是指靶基因中的与grna的向导序列互补的核酸序列。靶序列和向导序列的相互作用引导rna引导的dna结合剂在靶序列内结合并潜在地切口或切割(取决于试剂的活性)。
[0645]
本文所用的“ya位点”是指5'-嘧啶-腺嘌呤-3'二核苷酸。“保守区ya位点”存在于sgrna的保守区中。“向导区ya位点”存在于sgrna的向导区中。sgrna中未经修饰的ya位点可能容易被rnase-a样核酸内切酶(例如,rnase a)切割。在一些实施例中,sgrna在其保守区中包括约10个ya位点。在一些实施例中,sgrna在其保守区中包括1个、2个、3个、4个、5个、6个、7个、8个、9个或10个ya位点。示例性保守区ya位点在图14(seq id no:201)中指示为与sgrna结构有关(图15)。图14中未示出示例性的向导区ya位点,因为向导区可以是任何序列,包含任何数量的ya位点。在一些实施例中,sgrna包括图14中所指示的1个、2个、3个、4个、5个、6个、7个、8个、9个或10个ya位点。在一些实施例中,sgrna在以下位置或其子集处包括1个、2个、3个、4个、5个、6个、7个、8个、9个或10个ya位点:ls5-ls6;us3-us4;us9-us10;us12-b3;ls7-ls8;ls12-n1;n6-n7;n14-n15;n17-n18;以及h2-2到h2-3。在一些实施例中,ya位点包括修饰,这意味着ya位点的至少一个核苷酸被修饰。在一些实施例中,ya位点的嘧啶(也被称为嘧啶位置)包括修饰(其包含改变紧接在嘧啶的糖的3'位的核苷间连接的修饰)。在一些实施例中,ya位点的腺嘌呤(也被称为腺嘌呤位置)包括修饰(其包含改变紧接在腺嘌呤的糖的3'位的核苷间连接的修饰)。在一些实施例中,ya位点的嘧啶位置和腺嘌呤位置包括修饰。
[0646]
如本文所使用的,“治疗”是指针对受试者的疾病或病症的治疗剂的任何施用或应用,并且包含抑制疾病、阻止其发展、缓解疾病的一种或多种症状、治愈疾病或预防疾病的一种或多种症状的复发。例如,对hae的治疗可以包括减轻hae的症状。
[0647]
术语“klkb1活性的治疗相关降低”可能意指与基线相比,血浆klkb1活性降低大于约60%。参见banerji等人,《新英格兰医学杂志(n engl j med)》,2017,376:717-728;ferrone等人,《核酸治疗学(nucleic acid therapeutics)》,2019,82-917。klkb1活性通常测量为总激肽释放酶活性,其中前激肽释放酶在样品中转化为激肽释放酶并且测量样品的总激肽释放酶活性。在一些情况下,与基线相比,klkb1活性降低的范围可能意味着血浆klkb1活性降低约60-80%。为了计算受试者中分析物的减少,可以通过从受试者收集预处理样品来获得基础值。在一些情况下,样品是血清样品。在某些方面,与基线相比,靶klkb1活性降低是总激肽释放酶(前激肽释放酶和血浆激肽释放酶)活性降低约60%。例如,在治疗范围内达到klkb1活性水平可能意味着从基线降低总激肽释放酶约》60%。在一些实施例中,“正常激肽释放酶水平”或“正常激肽释放酶范围”降低。在一些实施例中,激肽释放酶活性的治疗相关降低达到受试者基础值的约0-60%、0-50%、0-40%、0-30%、0-25%、0-20%、0-15%、0-10%的水平,或正常激肽释放酶活性水平的10-60%、10-50%、10-40%、10-30%、10-20%或20-60%、20-50%、20-40%或20-30%。klkb1活性可以通过本领域已知的测定法测量,包含本文所描述的测定法。
[0648]
如本文所使用的,术语“靶klkb1蛋白减少”意指与基线相比pkal的靶水平。如本文所描述的,klkb1蛋白水平可以通过本领域已知的测定来测量,如elisa或蛋白质印迹测定法。总klkb1蛋白可以用检测前激肽释放酶和激肽释放酶两者的抗体和/或在样品中将前激肽释放酶转化为激肽释放酶后进行测量。在一些情况下,样品是血清样品。在某些方面,与基线相比,靶klkb1蛋白减少是总激肽释放酶(前激肽释放酶和血浆激肽释放酶)减少约60%。在一些实施例中,总激肽释放酶蛋白的治疗相关减少达到受试者基础值的约0-60%、0-50%、0-40%、0-30%、0-25%、0-20%、0-15%、0-10%的水平,或正常总激肽释放酶蛋白水平的10-60%、10-50%、10-40%、10-30%、10-20%或20-60%、20-50%、20-40%或20-30%。
[0649]
循环血浆chmwk水平低于总hmwk的约30%与用拉那鲁单抗治疗的患者的hae发作减少相关联(参见banerji等人,2017)。在此同一研究中,健康对照组的chmwk的血浆水平为总hmwk的约8.3%。在另一项研究中,suffriti及其同事发现,正常对照中chmwk血浆水平的平均值为约34.8%,缓解期的hae患者为约41.4%,发作期的hae患者为约58.1%(suffritti等人,《临床与实验过敏(clin exp allergy)》2014;44:1503-14)。治疗性治疗可以使循环血浆chmwk与总hmwk的比率小于约60%。在一些实施例中,chmwk与hmwk的比率小于约10%、15%、20%、25%、30%、35%、40%、50%或更多。
[0650]
术语“约”或“大约”意指如本领域的普通技术人员确定的特定值的可接受误差,这将部分取决于如何测量或确定值。
[0651]
ii.组合物
[0652]
a.包括向导rna(grna)的组合物
[0653]
本文提供了用于例如,使用具有rna引导的dna结合剂(例如,crispr/cas系统)的向导rna诱导双链断裂(dsb)、单链断裂和/或导致klkb1基因内核酸修饰的位点特异性结合
的组合物。组合物可以向患有或疑似患有hae的受试者施用。可以将组合物施用于血清和/或血浆缓激肽浓度升高的受试者,所述血清和/或血浆缓激肽浓度例如通过以下来测量:血浆或血清中前激肽释放酶蛋白水平的降低、通过血浆或血清中总激肽释放酶(前激肽释放酶和pkal)蛋白水平的降低、通过循环裂解的hmwk(chmwk)的比例的降低,或者通过柠檬酸血浆中chmwk的比例的降低。可以将组合物施用于血清和/或血浆前激肽释放酶和/或激肽释放酶浓度增加的受试者。可以将组合物施用于血清和/或血浆总激肽释放酶浓度增加的受试者。可以将组合物施用于血清和/或血浆激肽释放酶活性增加的受试者。靶向klkb1基因的向导序列在表1中的seq id no:1-149处示出。
[0654]
表1在的seq id no:1-149处示出的向导序列中的每个向导序列可以进一步包括另外的核苷酸以例如与在3'端处的向导序列之后的以下示例性核苷酸序列形成crrna:在5'到3'朝向上的guuuuagagcuaugcuguuuug(seq id no:167)。在sgrna的情况下,上述向导序列可以进一步包括另外的核苷酸以例如与向导序列的3'端之后的以下示例性核苷酸序列形成sgrna:在5'到3'朝向上的guuuuagagcuagaa auagcaaguuaaaauaaggcuaguccguuaucaacuugaaaaaguggcaccgagucggugcuuuu(seq id no:171)或guuuuagagcuagaaauagcaaguuaa aauaaggcuaguccguuaucaacuugaaaaaguggcaccgagucggugc(seqid no:172,其是没有四个末端u的seq id no:171)。在一些实施例中,seq id no:171的四个末端u不存在在一些实施例中,仅存在seq id no:171的四个末端u中的1个、2个或3个末端。
[0655]
在一些实施例中,sgrna包括seq id no:1-149的向导序列中的任一个向导序列和另外的核苷酸以例如与在3'端处的向导序列之后的以下示例性核苷酸序列形成crrna:在5'到3'朝向上的guuuuagagcuagaaauagcaaguuaaaauaaggcu aguccguuaucaacuuggcaccgagucggugcuuuu(seq id no:170)或guuuuagagcuagaaauagcaaguuaaaauaaggcuaguccguuaucaacuug gcaccgagucggugc(seq id no:173)。参考以下野生型向导rna保守序列,seq id no:173缺少8个核苷酸:guuuuagagcuagaaauagcaaguuaaaauaaggcu aguccguuaucaacuugaaaaaguggcaccgagucggugc(seq id no:172)。
[0656]
在一些实施例中,提供了包括如本文所描述的向导序列和包括发夹区的“sgrna的保守部分”的klkb1短单向导rna(klkb1短-sgrna),其中发夹区缺少至少5-10个核苷酸或6-10个核苷酸。在某些实施例中,参考sgrna的保守部分,例如表3b和图15中的核苷酸h1-1到h2-15,klkb1短单向导rna的发夹区缺少5-10个核苷酸。在某些实施例中,参考sgrna的保守部分,例如表3b和图15中的核苷酸h1-1到h1-12,klkb1短单向导rna的发夹1区缺少5-10个核苷酸。参见例如,wo2019/237069,所述文献的全部内容特此整体并入,例如权利要求1到15。
[0657]
表3a中示出了示例性“sgrna的保守部分”(也参见fig 15),其示出了酿脓链球菌cas9(“spycas9”(还被称为“spcas9”))sgrna的“保守区”。第一行示出了核苷酸的编号,第二行示出了序列(seq id no:500);并且第三行示出了“结构域”。briner ae等人,《分子细胞》56:333
–
339(2014)描述了在本文中指“结构域”的sgrna的功能结构域,包含负责靶向的“间隔”结构域、“下部茎”结构域、“凸起”结构域、“上部茎”(其可以包含四环)结构域、“连结点”结构域以及“发夹1”结构域和“发夹2”结构域。参见briner等人,第334页,图1a。
[0658]
表3b提供了如本文所使用的sgrna结构域的示意图。在表3b中,区之间的“n”代表核苷酸的可变数量,例如,从0到1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20
或更多。在一些实施例中,n等于0。在一些实施例中,n等于1。
[0659]
在一些实施例中,klkb1 sgrna来自酿脓链球菌cas9(“spycas9”)或spycas9等效物。在一些实施例中,sgrna不是来自酿脓链球菌(“非spycas9”)。在一些实施例中,5-10个核苷酸或6-10个核苷酸是连续的。
[0660]
在一些实施例中,klkb1短-sgrna至少缺少如表3a中示出的酿脓链球菌cas9(“spycas9”)sgrna的保守部分的核苷酸54-58(aaaaa)。在一些实施例中,klkb1短-sgrna是至少缺少与例如通过成对或结构比对确定的spycas9的保守部分的核苷酸54-58(aaaaa)相对应的核苷酸的非spycas9 sgrna。在一些实施例中,非spycas9sgrna是金黄色葡萄球菌(staphylococcus aureus)cas9(“sacas9”)sgrna。
[0661]
在一些实施例中,klkb1短-sgrna至少缺少spycas9 sgrna的保守部分的核苷酸54-61(aaaaagug)。在一些实施例中,klkb1短-sgrna至少缺少spycas9 sgrna的保守部分的核苷酸53-60(gaaaaagu)。在一些实施例中,klkb1短-sgrna缺少spycas9 sgrna的保守部分的核苷酸53-60(gaaaaagu)或核苷酸54-61(aaaaagug)或例如通过成对或结构比对确定的非spycas9 sgrna的保守部分的对应核苷酸中的4个、5个、6个、7个或8个核苷酸。
[0662]
表1:靶向人klkb1的向导序列、染色体坐标、和人单向导rna和双向导rna、以及替代食蟹猴(cyno)单向导
[0663]
[0664]
[0665]
[0666]
[0667]
[0668][0669]
表2.靶向cyno klkb1的单向导序列、染色体坐标以及与人的向导序列同源性
[0670]
[0671]
[0672][0673]
上文鉴定为“g0xxxxx”的向导rna是包括表1或表2的经鉴定的20个核苷酸靶向序列的sgrna,其在seq id no:300的向导结构内。在一些实施例中,sgrna包括表1或表2的向导rna的任一个向导rna和seq id no:300的核苷酸,任选地其中sgrna包括表4中所描述的修饰模式中的任一种修饰模式。在一些实施例中,sgrna包括表1或2的向导rna中的任一个向导rna和表4的sgrna的保守部分中的任一个保守部分,任选地具有表4中所描述的修饰模式中的任一种修饰模式。
[0674]
表3a(spycas9 sgrna的保守部分;seq id no:500)
[0675][0676]
表3b
[0677][0678]
在一些实施例中,本发明提供了一种包括包含将rna引导的dna结合剂(其可以是核酸酶(例如,cas核酸酶,如cas9))引导到klkb1中的靶dna序列的向导序列的一个或多个向导rna(grna)的组合物。所述grna可以包括包含表1中所示出的向导序列的crrna。所述grna可以包括包含表1中所示出的向导序列的17个、18个、19个或20个连续核苷酸的crrna。在一些实施例中,grna包括包含与表1中所示出的向导序列的至少17个、18个、19个或20个连续核苷酸具有约75%、80%、85%、90%、95%、96%、97%、98%、99%或100%同一性的序列的crrna。在一些实施例中,grna包括包含与表1中所示出的向导序列具有约75%、80%、85%、90%、95%、96%、97%、98%、99%或100%同一性的序列的crrna。grna可以进一步包
括trrna。在本文所描述的每个组合物和方法实施例中,crrna和trrna可以作为单个rna(sgrna)缔合,或可以位于单独的rna(dgrna)上。在sgrna的上下文下,可以例如通过磷酸二酯键或其它共价键共价连接crrna组分和trrna组分。
[0679]
在本文所描述的组合物、用途和方法实施例中的每个组合物、用途和方法实施例中,向导rna可以包括两个rna分子作为“双向导rna”或“dgrna”。dgrna包括第一rna分子和第二rna分子,所述第一rna分子包括包含例如表1中所示出的向导序列的crrna,所述第二rna分子包括trrna。第一rna分子和第二rna分子可以不共价连接,但可以通过crrna部分与trrna部分之间的碱基配对形成rna双链体。
[0680]
在本文所述的组合物、用途和方法实施例中的每个组合物、用途和方法实施例中,向导rna可以包括单个rna分子作为“单向导rna”或“sgrna”。sgrna可以包括包含表1中所示出的与trrna共价连接的向导序列的crrna(或其一部分)。sgrna可以包括表1中所示出的向导序列的17个、18个、19个或20个连续核苷酸。在一些实施例中,crrna和trrna通过接头共价连接。在一些实施例中,sgrna通过crrna部分与trrna部分之间的碱基配对形成茎环结构。在一些实施例中,crrna和trrna通过一个或多个非磷酸二酯键的键共价连接。
[0681]
在一些实施例中,trrna可以包括源自天然存在的crispr/cas系统的trrna序列的全部或部分。在一些实施例中,trrna包括截短的或经修饰的野生型trrna。trrna的长度取决于所使用的crispr/cas系统。在一些实施例中,trrna包括或由以下组成:5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18个、19个、20个、25个、30个、40个、50个、60个、70个、80个、90个、100个或多于100个核苷酸。在一些实施例中,trrna可以包括某些次级结构,例如一个或多个发夹或茎环结构,或一个或多个凸起结构。
[0682]
在一些实施例中,提供了包括包含seq id no:1-149中的任一个的向导序列的一个或多个向导rna的组合物。在一些实施例中,提供了包括包含seq id no:1-149中的任一个的向导序列的一个或多个向导rna的组合物以及表4中所示出的sgrna的任何保守部分,任选地具有表4中所示出的sgrna中的任何sgrna的修饰模式,任选地其中所述sgrna包括5'端修饰和3'端修饰(如果尚未在表4的构建体中示出)。在一些实施例中,提供了包括包含seq id no:1-149中的任一个的向导序列的一个或多个向导rna的组合物,其中seq id no:170、171、172或173的核苷酸在其3'端跟随所述向导序列。在一些实施例中,一个或多个向导rna包括seq id no:1-149中的任一个的向导序列,其中seq id no:170、171、172或173的核苷酸在其3'端跟随所述向导序列,所述一个或多个向导rna根据seq id no:300的修饰模式进行修饰。
[0683]
在一些实施例中,提供了包括包含seq id no:1-149中的任一个的向导序列的一个或多个向导rna的组合物。在一方面,提供了包括一个或多个grna的组合物,所述组合物包括与seq id no:1-149的核酸中的任何核酸至少99%、98%、97%、96%、95%、94%、93%、92%、91%或90%相同的向导序列。
[0684]
在其它实施例中,提供了组合物,所述组合物包括至少一个,例如至少两个包括选自seq id no:1-149的向导序列中的任何两个或更多个向导序列的向导序列的grna。在一些实施例中,所述组合物包括至少两个各自包括与seq id no:1-149的核酸中的任何核酸至少99%、98%、97%、96%、95%、94%、93%、92%、91%或90%相同的向导序列的grna。
[0685]
本发明的向导rna组合物被设计成识别klkb1基因中的靶序列(例如,与其杂交)。
例如,klkb1靶序列可以被所提供的包括向导rna的cas切割酶识别和切割。在一些实施例中,可以由向导rna将rna引导的dna结合剂,如cas切割酶引导到klkb1基因的靶序列,其中向导rna的向导序列与靶序列杂交,并且rna引导的dna结合剂,如cas切割酶切割靶序列。
[0686]
在一些实施例中,基于klkb1基因内的靶序列确定对一个或多个向导rna的选择。在一些实施例中,包括一个或多个向导序列的组合物包括根据来自人参考基因组hg38的坐标与下表1中所示出的相应基因组区互补的向导序列。另外的实施例的向导序列可以与本文所提供的任何表中所列出的基因组坐标附近的序列互补。例如,另外的实施例的向导序列可以与包括在本文所公开的任何表中所列出的基因组坐标的15个连续核苷酸
±
10个核苷酸的序列互补。
[0687]
在不受任何特定理论束缚的情况下,基因的某些区中的突变(例如,由于作为核酸酶介导的dsb的结果而发生的插入缺失导致的移码突变)可能比基因的其它区中的突变更不耐受,因此dsb的位置是可能导致的蛋白质敲低的数量或类型的重要因素。在一些实施例中,与klkb1内的靶序列互补或具有互补性的grna用于将rna引导的dna结合剂引导到klkb1基因中的特定位置。在一些实施例中,grna被设计成具有与klkb1的外显子1、外显子3、外显子4、外显子5、外显子6、外显子8、外显子9、外显子10、外显子11、外显子12、外显子13、外显子14或外显子15中的靶序列互补或具有互补性的向导序列。
[0688]
在一些实施例中,向导序列与人klkb1基因中存在的靶序列至少99%、98%、97%、96%、95%、94%、93%、92%、91%或90%相同。在一些实施例中,靶序列可以与向导rna的向导序列互补。在一些实施例中,向导rna的向导序列与其对应靶序列之间的互补性或同一性程度可以为至少80%、85%、90%、95%、96%、97%、98%、99%或100%。在一些实施例中,grna的靶序列和向导序列可以是100%互补或相同的。在其它实施例中,grna的靶序列和向导序列可以含有至少一个错配。例如,grna的靶序列和向导序列可以含有1个、2个、3个或4个错配,其中向导序列的总长度为20。在一些实施例中,grna的靶序列和向导序列可以含有1-4个错配,其中向导序列为20个核苷酸。
[0689]
在一些实施例中,本文所公开的组合物或调配物包括包含编码如本文所描述的rna引导的dna结合剂,如cas核酸酶的开放阅读框(orf)的mrna。在一些实施例中,提供、使用或施用包括编码rna引导的dna结合剂,如cas核酸酶的orf的mrna。
[0690]
b.经修饰的grna和mrna
[0691]
在一些实施例中,grna是经化学修饰的。包括一个或多个经修饰的核苷或核苷酸的grna被称为“经修饰的”grna或“经化学修饰的”grna,以描述一个或多个非天然和/或天然存在的用于替代或除了规范的a、g、c和u残基之外的组分或构型。在一些实施例中,经修饰的grna是用非规范核苷或核苷酸合成的,这里称为“经修饰的”。经修饰的核苷和核苷酸可以包含以下中的一种或多种:(i)磷酸二酯骨架连接中的非连接磷酸氧中的一个或两个和/或连接磷酸氧中的一个或多个的改变,例如替代(示例性骨架修饰);(ii)核糖成分(例如,核糖上的2'羟基)的改变,例如替代(示例性糖修饰);(iii)用“脱磷”接头大规模替代磷酸部分(示例性骨架修饰);(iv)天然存在的核碱基(包含用非规范的核碱基进行)的修饰或替换(示例性碱基修饰);(v)核糖磷酸骨架的替代或修饰(示例性骨架修饰);(vi)寡核苷酸3'端或5'端的修饰,例如末端磷酸基的去除、修饰或替代或部分、帽或接头的缀合(此类3'或5'帽修饰可以包括糖和/或骨架修饰);以及(vii)糖的修饰或替代(示例性糖修饰)。
[0692]
化学修饰(如以上列出的那些化学修饰)可以组合以提供包括可以具有两个、三个、四个或更多个修饰的核苷和核苷酸(统称为“残基”)的经修饰的grna和/或mrna。例如,经修饰的残基可以具有经修饰的糖和经修饰的核碱基。在一些实施例中,修饰grna的每个碱基,例如所有碱基都具有经修饰的磷酸基,如硫代磷酸酯基。在某些实施例中,grna分子的磷酸基中的所有或基本上所有的磷酸基都用硫代磷酸酯基替代。在一些实施例中,经修饰的grna包括rna的5'端处或附近的至少一个经修饰的残基。在一些实施例中,经修饰的grna包括rna的3'端处或附近的至少一个经修饰的残基。
[0693]
在一些实施例中,grna包括一个、两个、三个或更多个经修饰的残基。在一些实施例中,经修饰的grna中的至少5%(例如,至少5%、至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%或100%)的位置是经修饰的核苷或核苷酸。
[0694]
未经修饰的核酸可能易于被例如细胞内核酸酶或在血清中发现的核酸酶降解。例如,核酸酶可以水解核酸磷酸二酯键。因此,在一方面,本文所述的grna可以含有一种或多种经修饰的核苷或核苷酸,例如以引入对细胞内或基于血清的核酸酶的稳定性。在一些实施例中,在被体内和体外两方面引入到细胞群体中,本文所述的经修饰的grna分子可以表现出降低的先天免疫应答。术语“先天免疫应答”包含对外源性核酸的细胞应答,所述外源性核酸包含单链核酸,所述细胞应答涉及细胞因子表达和释放的诱导,特别是干扰素和细胞死亡。
[0695]
在骨架修饰的一些实施例中,经修饰的残基的磷酸基可以通过用不同的取代基替代氧中的一个或多个氧来修饰。进一步地,经修饰的残基(例如经修饰的核酸中存在的经修饰的残基)可以包含用本文所述的经修饰的磷酸基大规模替代未经修饰的磷酸部分。在一些实施例中,磷酸骨架的骨架修饰可以包含导致不带电荷的接头或具有不对称电荷分布的带电荷的接头的改变。
[0696]
经修饰的磷酸基的实例包含硫代磷酸酯、硒代磷酸酯、硼烷磷酸(borano phosphate)、硼烷磷酸酯(borano phosphate ester)、氢磷酸酯、磷酰胺酯、烷基或芳基膦酸酯和磷酸三酯。未经修饰的磷酸基中的磷原子是非手性的。然而,用上述原子或原子基团中的一个替代非桥氧中的一个可以使磷原子手性。立构磷原子可以具有“r”构型(本文为rp)或“s”构型(本文为sp)。骨架还可以通过用氮(桥接的磷酰胺酯)、硫(桥接的硫代磷酸酯)和碳(桥接的亚甲基膦酸酯)替代桥氧(即,连接磷酸酯和核苷的氧)来修饰。替换可以发生在连接氧处或连接氧中的两个连接氧处。
[0697]
在某些骨架修饰中,磷酸基可以被不含磷的连接子替代。在一些实施例中,带电荷的磷酸基可以被中性部分替代。可以替代磷酸基的部分的实例可以包含但不限于,例如甲基膦酸酯、羟氨基、硅氧烷、碳酸酯、羧甲基、氨基甲酸酯、酰胺、硫醚、环氧乙烷接头、磺酸盐、磺酰胺、硫代甲缩醛化物、甲缩醛化物、肟、亚甲基亚氨基、亚甲基甲亚氨基、亚甲基亚肼基(methylenehydrazo)、亚甲基二甲亚肼基(methylenedimethylhydrazo)和亚甲基氧甲亚氨基。
[0698]
还可以构建模拟核酸的支架,其中磷酸接头和核糖被耐核酸酶的核苷或核苷酸替代物替代。此类修饰可以包括骨架修饰和糖修饰。在一些实施例中,核碱基可以被替代骨架拴系。实例可以包含但不限于吗啉代、环丁基、吡咯烷和肽核酸(pna)核苷替代物。
[0699]
经修饰的核苷和经修饰的核苷酸可以包含对糖基的一个或多个修饰,即,糖修饰。例如,2'羟基(oh)可以被修饰,例如被许多不同的“氧”或“脱氧”取代基替代。在一些实施例中,对2'羟基的修饰可以增强核酸的稳定性,因为羟基不再能去质子化以形成2'-醇盐离子。
[0700]
2'羟基修饰的实例可以包含烷氧基或芳氧基(or,其中“r”可以是例如烷基、环烷基、芳基、芳烷基、杂芳基或糖);聚乙二醇(peg)、o(ch2ch2o)nch2ch2or,其中r可以是例如h或任选地经取代的烷基,并且n可以是0到20的整数(例如,0到4、0到8、0到10、0到16、1到4、1到8、1到10、1到16、1到20、2到4、2到8、2到10、2到16、2到20、4到8、4到10、4到16和4到20)。在一些实施例中,所述2'羟基修饰可以是2'-o-me。在一些实施例中,所述2'羟基修饰可以是2'-氟修饰,所述修饰用氟化物替代2'羟基。在一些实施例中,所述2'羟基修饰可以包含“锁”核酸(lna),在所述lna中,2'羟基可以例如通过c
1-6
亚烷基或c
1-6
亚杂烷基桥连接到同一核糖的4'碳,其中示例性桥可以包含亚甲基桥、亚丙基桥、醚桥或氨基桥;邻氨基(其中氨基可以是例如nh2;烷基氨基、二烷基氨基、杂环基、芳基氨基、二芳基氨基、杂芳基氨基或二杂芳基氨基、乙二胺或聚氨基)和氨基烷氧基、o(ch2)
n-氨基(其中氨基可以是例如nh2;烷基氨基、二烷基氨基、杂环基、芳基氨基、二芳基氨基、杂芳基氨基或二杂芳基氨基、乙二胺或聚氨基)。在一些实施例中,所述2'羟基修饰可以包含“锁”核酸(una),其中核糖环缺少c2'-c3'键。在一些实施例中,2'羟基修饰可以包含甲氧基乙基(moe),(och2ch2och3,例如peg衍生物)。
[0701]“脱氧”2'修饰可以包含氢(即,脱氧核糖,例如部分dsrna的突出部分);卤素(例如,溴、氯、氟或碘);氨基(其中氨基可以是例如nh2;烷基氨基、二烷基氨基、杂环基、芳基氨基、二芳基氨基、杂芳基氨基、二杂芳基氨基或氨基酸);nh(ch2ch2nh)nch2ch
2-氨基(其中氨基可以是例如如本文所述的)、-nhc(o)r(其中r可以是例如烷基、环烷基、芳基、芳烷基、杂芳基或糖)、氰基;巯基;烷基-硫代-烷基;硫代烷氧基;以及烷基、环烷基、芳基、烯基和炔基,其可以任选地例如被如本文所述的氨基取代。
[0702]
糖修饰可以包括还可以含有具有与核糖中对应碳的立体化学构型相反的立体化学构型的一个或多个碳的糖基。因此,经修饰的核酸可以包含含有例如阿拉伯糖作为糖的核苷酸。经修饰的核酸还可以包含无碱基糖。这些无碱基糖也可以进一步在组成糖原子中的一个或多个糖原子处修饰。经修饰的核酸还可以包含一种或多种呈l形式的糖,例如,l-核苷。
[0703]
本文所述的可以掺入经修饰的核酸中的经修饰的核苷和经修饰的核苷酸可以包含经修饰的碱基,也称为核碱基。核碱基的实例包含但不限于腺嘌呤(a)、鸟嘌呤(g)、胞嘧啶(c)和尿嘧啶(u)。这些核碱基可以被修饰或完全替代,以提供可以掺入经修饰的核酸中的经修饰的残基。核苷酸的核碱基可以独立地选自嘌呤、嘧啶、嘌呤类似物或嘧啶类似物。在一些实施例中,核碱基可以包含例如天然存在的和合成的碱基衍生物。
[0704]
在采用双向导rna的实施例中,crrna和tracr rna中的每一个均可以含有修饰。此类修饰可以在crrna和/或tracr rna的一端或两端处。在包括sgrna的实施例中,可以经化学修饰的sgrna的一端或两端处的一个或多个残基,和/或可以修饰内部核苷,和/或可以化学修饰整个sgrna。某些实施例包括5'端修饰。某些实施例包括3'端修饰。
[0705]
在一些实施例中,本文所公开的向导rna包括在wo2018/107028和/或wo2019/237069中所公开的修饰模式之一,所述文献的内容特此整体并入。例如,本文所公开的向导rna可以包括在wo2019/237069的权利要求1到15中所描述的短-向导结构和/或在权利要求16到462中所描述的修饰模式。在一些实施例中,本文所公开的向导rna包括在wo 2015/
200555中所公开的结构/修饰模式之一,所述文献的内容特此整体并入。在一些实施例中,本文所公开的向导rna包括在wo2017/136794中所公开的结构/修饰模式之一,所述文献的内容特此整体并入。
[0706]
c.ya修饰
[0707]
ya位点处的修饰(本文也被称为“ya修饰”)可以是例如通过化学修饰、取代或其它方式进行的核苷间连接的修饰、碱基(嘧啶或腺嘌呤)的修饰,和/或糖的修饰(例如在2'位置,如2'-o-烷基、2'-f、2'-moe、2'-f阿拉伯糖、2'-h(脱氧核糖)等)。在一些实施例中,“ya修饰”是例如通过干扰rnase对ya位点的识别或切割和/或稳定将切割位点的可及性降低到rnase的rna结构(例如,次级结构)来改变二核苷酸基序的结构以降低rna核酸内切酶活性的任何修饰。参见peacock等人,《有机化学期刊(j org chem.)》76:7295-7300(2011);behlke,《寡核苷酸(oligonucleotides)》18:305-320(2008);ku等人,《先进药物输送评论(adv.drug.delivery rev.)》104:16-28(2016);ghidini等人,《化学通讯(chem.commun.)》2013,49,9036。peacock等人,belhke,ku和ghidini提供适于作为ya修饰的示例性修饰。涵盖本领域的技术人员已知的减少核酸内切酶降解的修饰。影响参与rnase切割的2'羟基的示例性2'核糖修饰是2'-h和2'-o-烷基,包含2'-o-me。如ya位点处的双环核糖类似物、una和残基的经修饰的核苷间连接等修饰可以是ya修饰。可以稳定rna结构的示例性碱基修饰是假尿苷和5-甲基胞嘧啶。在一些实施例中,修饰ya位点的至少一个核苷酸。在一些实施例中,ya位点的嘧啶(也被称为“嘧啶位置”)包括修饰(其包含例如在其2'位置处的改变紧接在嘧啶的糖的3'位的核苷间连接的修饰、嘧啶碱基的修饰和核糖的修饰)。在一些实施例中,ya位点的腺嘌呤(也被称为“腺嘌呤位置”)包括修饰(其包含改变紧接在腺嘌呤的糖的3'位的核苷间连接的修饰、嘧啶碱基的修饰和例如在其2’位置处的核糖的修饰)。在一些实施例中,ya位点的嘧啶和腺嘌呤包括修饰。在一些实施例中,ya修饰降低rna核酸内切酶活性。
[0708]
在一些实施例中,sgrna包括1个、2个、3个、4个、5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、16个或更多个ya位点处的修饰。在一些实施例中,ya位点的嘧啶包括修饰(其包含改变紧接在嘧啶的糖的3'位的核苷间连接的修饰)。在一些实施例中,ya位点的腺嘌呤包括修饰(其包含改变紧接在腺嘌呤的糖的3'位的核苷间连接的修饰)。在一些实施例中,ya位点的嘧啶和腺嘌呤包括修饰,如糖、碱基或核苷间连接修饰。ya修饰可以是本文所示的修饰类型中的任何类型。在一些实施例中,ya修饰包括硫代磷酸酯、2'-ome或2'-氟中的一个或多个。在一些实施例中,ya修饰包括包含硫代磷酸酯、2'-ome或2'-氟中的一个或多个的嘧啶修饰。在一些实施例中,ya修饰包括在含有一个或多个ya位点的rna双链体区内的双环核糖类似物(例如,lna、bna或ena)。在一些实施例中,ya修饰包括在含有ya位点的rna双链体区内的双环核糖类似物(例如,lna、bna或ena),其中ya修饰远离ya位点。
[0709]
在一些实施例中,sgrna包括向导区ya位点修饰。在一些实施例中,向导区包括1个、2个、3个、4个、5个或更多个可以包括ya修饰ya位点(“向导区ya位点”)。在一些实施例中,定位于从5'末端的5'端开始的5端、6端、7端、8端、9端或10端处的一个或多个ya位点(其中“5端”等是指向导区的位置5到3'端,即,向导区中的最3'核苷酸)包括ya修饰。在一些实施例中,定位于从5'末端的5'端开始的5端、6端、7端、8端、9端或10端处的两个或更多个ya位点包括ya修饰。在一些实施例中,定位于从5'末端的5'端开始的5端、6端、7端、8端、9端或10端处的三个或更多个ya位点包括ya修饰。在一些实施例中,定位于从5'末端的5'端开始
的5端、6端、7端、8端、9端或10端处的四个或更多个ya位点包括ya修饰。在一些实施例中,定位于从5'末端的5'端开始的5端、6端、7端、8端、9端或10端处的五个或更多个ya位点包括ya修饰。经修饰的向导区ya位点包括ya修饰。
[0710]
在一些实施例中,经修饰的向导区ya位点处于向导区的3'末端核苷酸的17个、16个、15个、14个、13个、12个、11个、10个或9个核苷酸内。例如,如果经修饰的向导区ya位点处于向导区的3'末端核苷酸的10个核苷酸内,并且向导区为20个核苷酸长,则经修饰的向导区ya位点的经修饰的核苷酸定位于位置11-20中的任何位置处。在一些实施例中,ya修饰定位于从向导区的3'末端核苷酸开始的ya位点20个、19个、18个、17个、16个、15个、14个、13个、12个、11个、10个、9个、8个、7个、6个、5个、4个、3个、2个或1个核苷酸内。在一些实施例中,ya修饰定位于从向导区的3'末端核苷酸开始的20个、19个、18个、17个、16个、15个、14个、13个、12个、11个、10个、9个、8个、7个、6个、5个、4个、3个、2个或1个核苷酸。
[0711]
在一些实施例中,经修饰的向导区ya位点位于从5'末端的5'端开始的核苷酸4、5、6、7、8、9、10或11处或之后。
[0712]
在一些实施例中,经修饰的向导区ya位点不是5'端修饰。例如,sgrna可以包括如本文所述的5'端修饰并且进一步包括经修饰的向导区ya位点。可替代地,sgrna可以包括未经修饰的5'端和经修饰的向导区ya位点。可替代地,sgrna可以包括经修饰的5'端和未经修饰的向导区ya位点。
[0713]
在一些实施例中,经修饰的向导区ya位点包括定位于向导区ya位点的5'位的至少一个核苷酸不包括的修饰。例如,如果核苷酸1-3包括硫代磷酸酯,核苷酸4仅包括2'-ome修饰,并且核苷酸5是ya位点的嘧啶并包括硫代磷酸酯,则经修饰的向导区ya位点包括定位于向导区ya位点的5'位的至少一个核苷酸(核苷酸4)不包括的修饰(硫代磷酸酯)。在另一个实例中,如果核苷酸1-3包括硫代磷酸酯,并且核苷酸4是ya位点的嘧啶并包括2'-ome,则经修饰的向导区ya位点包括定位于向导区ya位点的5'位的至少一个核苷酸(核苷酸1-3中的任何核苷酸)不包括的修饰(2'-ome)。如果未经修饰的核苷酸定位于经修饰的向导区ya位点的5'位,也总是满足这个条件。
[0714]
在一些实施例中,经修饰的向导区ya位点包括如上文针对ya位点所述的修饰。
[0715]
上述概述中阐述了向导区ya位点修饰的另外的实施例。在本公开的其它地方阐述的任何实施例可以与前述实施例中的任何实施例以可行的程度结合。
[0716]
在一些实施例中,sgrna包括保守区ya位点修饰。保守区ya位点1-10在图14中展示。在一些实施例中,1个、2个、3个、4个、5个、6个、7个、8个、9个或10个保守区ya位点包括修饰。
[0717]
在一些实施例中,保守区ya位点1、8或1和8包括ya修饰。在一些实施例中,保守区ya位点1、2、3、4和10包括ya修饰。在一些实施例中,ya位点2、3、4、8和10包括ya修饰。在一些实施例中,保守区ya位点1、2、3和10包括ya修饰。在一些实施例中,ya位点2、3、8和10包括ya修饰。在一些实施例中,ya位点1、2、3、4、8和10包括ya修饰。在一些实施例中,1个、2个、3个、4个、5个、6个、7个或8个另外的保守区ya位点包括ya修饰。
[0718]
在一些实施例中,保守区ya位点2、3、4和10中的1个、2个、3个或4个位点包括ya修饰。在一些实施例中,1个、2个、3个、4个、5个、6个、7个或8个另外的保守区ya位点包括ya修饰。
[0719]
在一些实施例中,经修饰的保守区ya位点包括如上文针对ya位点所述的修饰。
[0720]
上述概述中阐述了保守区ya位点修饰的另外的实施例。在本公开的其它地方阐述的任何实施例可以与前述实施例中的任何实施例以可行的程度结合。
[0721]
在一些实施例中,提供了sgrna,所述sgrna包括seq id no:1-149中的任一个的向导序列以及表4中所示出的sgrna的任何保守部分,任选地具有表4中所示出的sgrna中的任何sgrna的修饰模式,任选地其中所述sgrna包括5'端修饰和3'端修饰(如果尚未在表4的构建体中示出)。
[0722]
在一些实施例中,sgrna包括下表4中所示出的修饰模式中的任何修饰模式,其中n是任何天然或非天然的核苷酸,并且其中所有n’均都包括如本文表1中所描述的klkb1向导序列。表4没有描绘sgrna的向导序列部分。尽管用n取代向导的核苷酸,但修饰仍如表4中所示。也就是说,尽管向导的核苷酸替代了“n”,但核苷酸被修饰,如在表4中所示出的。
[0723]
表4:sgrna修饰模式和sgrna的保守部分。向导序列未示出并且将在其5'端处随附所示出的序列。
[0724]
[0725]
[0726]
[0727]
[0728]
[0729]
[0730]
[0731]
[0732]
[0733][0734]
在一些实施例中,经修饰的sgrna包括以下序列:mn*mn*mn*nnnnnnnnnnnnnnnnnguuuuagamgmcmumamgmamamamumamgmcaaguuaaaauaaggcuaguccguuaucamamcmumumgmamamamamamgmumgmgmcmamcmcmgmamgmumcmgmgmumgmcmu*mu*mu*mu(seq id no:300),其中“n”可以是任何天然或非天然的核苷酸,并且其中所有n都包括如表1中所述的klkb1向导序列。例如,本文涵盖的是seq id no:300,其中n被本文在表1中所公开的向导序列(seq id no:1-149)中的任何向导序列替代。本文还涵盖将表1的向导序列(seq id no:1-149)中的任何向导序列与sgrna的保守部分组合的向导rna,例如表4的序列。
[0735]
下文所描述的修饰中的任何修饰均可以存在于本文所描述的grna和mrna中。
[0736]
术语“ma”、“mc”、“mu”或“mg”可以用于表示已经用2'-o-me修饰的核苷酸。
[0737]
2'-o-甲基的修饰可以描绘如下:
[0738][0739]
已经被示出影响核苷酸糖环的另一个化学修饰是卤素取代。例如,核苷酸糖环上的2'-氟(2'-f)取代可以增加寡核苷酸结合亲和力和核酸酶稳定性。
[0740]
在本技术中,术语“fa”、“fc”、“fu”或“fg”可以用于表示已经被2'-f取代的核苷酸。
[0741]
2'-f的取代可以描绘如下:
[0742][0743]
硫代磷酸酯(ps)连接或键是指在磷酸二酯连接中,例如在核苷酸碱基之间的键中,硫取代一个非桥连磷酸氧的键。当硫代磷酸酯用于产生寡核苷酸时,经修饰的寡核苷酸也可以被称为硫寡核苷酸。
[0744]“*”可以用于描绘ps修饰。在本技术中,术语a*、c*、u*或g*可以用于表示通过ps键与下一个(例如,3')核苷酸连接的核苷酸。
[0745]
在本技术中,术语“ma*”、“mc*”、“mu*”或“mg*”可以用于表示已经被2'-o-me取代并通过ps键与下一个(例如,3')核苷酸连接的核苷酸。
[0746]
下图示出了s-取代为非桥连磷酸氧,从而生成代替磷酸二酯键的ps键:
[0747][0748]
无碱基核苷酸是指缺少含氮碱基的那些核苷酸。下图描述了无碱基(也被称为无嘌呤)位点缺少碱基的寡核苷酸:
[0749][0750]
反向碱基是指具有从正常的5'到3'连接开始(即,5'到5'连接或3'到3'连接)反向的连接的那些反向碱基。例如:
[0751][0752]
无碱基核苷酸可以与反向连接进行连接。例如,无碱基核苷酸可以通过5'到5'连接与末端5'核苷酸连接,或者无碱基核苷酸可以通过3'到3'连接与末端3'核苷酸连接。末端5'或3'核苷酸处的反向无碱基核苷酸也可以被称为反向无碱基端帽。
[0753]
在一些实施例中,修饰5'末端处的前三个、四个或五个核苷酸中的一个或多个核苷酸,以及3’末端处的最后三个、四个或五个核苷酸中的一个或多个核苷酸。在一些实施例中,修饰是2'-o-me、2'-f、反向无碱基核苷酸、ps键或本领域公知的用于增加稳定性和/或性能的其它核苷酸修饰。
[0754]
在一些实施例中,5'末端处的前四个核苷酸和3’末端处的最后四个核苷酸用硫代磷酸酯(ps)键连接。
[0755]
在一些实施例中,5'末端处的前三个核苷酸以及3'末端处的最后三个核苷酸包括经2'-o-甲基(2'-o-me)修饰的核苷酸。在一些实施例中,5'末端处的前三个核苷酸和3'末端处的最后三个核苷酸包括经2'-氟(2'-f)修饰的核苷酸。在一些实施例中,5'末端处的前三个核苷酸和3'末端处的最后三个核苷酸包括反向的无碱基核苷酸。
[0756]
在一些实施例中,向导rna包括经修饰的sgrna。在一些实施例中,向导rna包括表4中所示出的sgrna的任何保守部分,任选地具有表4中所示出的sgrna中的任何sgrna的修饰模式,任选地其中所述sgrna包括5'端修饰和3'端修饰(如果尚未在表4的构建体中示出)。在一些实施例中,sgrna包括表4中所示出的sgrna的任何sgrna的修饰模式,其中n是任何天然核苷酸或非天然核苷酸,并且其中所有n均包括在klkb1中将核酸酶引导到靶序列的向导
序列,例如,如在表1中所示出的。
[0757]
在一些实施例中,向导rna包括包含seq id no:1-149的向导序列中的任一个向导序列的sgrna以及表4中所示出的sgrna的任何保守部分,任选地具有表4中所示出的sgrna中的任何sgrna的修饰模式,任选地其中所述sgrna包括5'端修饰和3'端修饰(如果尚未在表4的构建体中示出)。在一些实施例中,向导rna包括包含seq id no:1-149的向导序列中的任一个向导序列的sgrna以及seq id no:170、171、172和173的核苷酸,其中所述seq id no:170、171、172和173的核苷酸位于向导序列的3'端上,并且其中所述sgrna可以如表4中或seq id no:300中所示出的进行修饰。
[0758]
如上所述,在一些实施例中,本文所公开的组合物或调配物包括包含编码如本文所描述的rna引导的dna结合剂(如cas核酸酶)的开放阅读框(orf)的mrna。在一些实施例中,提供、使用或施用包括编码rna引导的dna结合剂,如cas核酸酶的orf的mrna。在一些实施例中,编码rna引导的dna核酸酶的orf是“经修饰的rna引导的dna结合剂orf”或简称为“经修饰的orf”,其被用作指示orf被修饰的简写。
[0759]
在一些实施例中,经修饰的orf可以至少在一个、多个或所有尿苷位置处包括经修饰的尿苷。在一些实施例中,经修饰的尿苷是在5位置处例如用卤素、甲基或乙基修饰的尿苷。在一些实施例中,经修饰的尿苷是在1位置处例如用卤素、甲基或乙基修饰的假尿苷。经修饰的尿苷可以是例如假尿苷、n1-甲基假尿苷、5-甲氧基尿苷、5-碘尿苷或其组合。在一些实施例中,经修饰的尿苷是5-甲氧基尿苷。在一些实施例中,经修饰的尿苷是5-碘尿苷。在一些实施例中,经修饰的尿苷是假尿苷。在一些实施例中,经修饰的尿苷是n1-甲基假尿苷。在一些实施例中,经修饰的尿苷是假尿苷和n1-甲基假尿苷的组合。在一些实施例中,经修饰的尿苷是假尿苷和5-甲氧基尿苷的组合。在一些实施例中,经修饰的尿苷是n1-甲基假尿苷和5-甲氧基尿苷的组合。在一些实施例中,经修饰的尿苷是5-碘尿苷和n1-甲基假尿苷的组合。在一些实施例中,经修饰的尿苷是假尿苷和5-碘尿苷的组合。在一些实施例中,经修饰的尿苷是5-碘尿苷和5-甲氧基尿苷的组合。
[0760]
在一些实施例中,本文所公开的mrna包括5'帽,如帽0、帽1或帽2。5'帽通常是通过5'-三磷酸与mrna的5'到3'链的第一核苷酸(即,第一帽近端核苷酸)的5'位置连接的7-甲基鸟嘌呤核糖核苷酸(其可以被进一步修饰,如下文例如关于arca所讨论的)。在帽0中,mrna的第一帽近端核苷酸和第二帽近端核苷酸的核糖两者均包括2'-羟基。在帽1中,mrna的第一转录核苷酸和第二转录核苷酸的核糖分别包括2'-甲氧基和2'-羟基。在帽2中,mrna的第一帽近端核苷酸和第二帽近端核苷酸的核糖两者均包括2'-甲氧基。参见例如katibah等人,(2014)《美国国家科学院院刊(proc natl acad sci usa)》111(33):12025-30;abbas等人,(2017)《美国国家科学院院刊》114(11):e2106-e2115。大多数内源性高等真核mrna(包含哺乳动物mrna,如人mrna)包括帽1或帽2。帽0和其它不同于帽1和帽2的帽结构在如人等哺乳动物中可能是免疫原性的,因为先天免疫系统的组分(如ifit-1和ifit-5)将其识别为“非自身”,这可能导致包含i型干扰素的细胞因子水平升高。先天免疫系统的组分,如ifit-1和ifit-5还可以与eif4e竞争以与除了帽1或帽2之外的帽结合mrna,从而潜在地抑制mrna的翻译。
[0761]
可以共转录地包含帽。例如,arca(抗反向帽类似物;赛默飞世尔科技公司(thermo fisher scientific),目录号:am8045)是包括与可以在开始时在体外掺入到转录物中的鸟
嘌呤核糖核苷酸的5'位置连接的7-甲基鸟嘌呤3'-甲氧基-5'-三磷酸的帽类似物。arca产生帽0帽,其中第一个帽近端核苷酸的2'位置是羟基。参见例如,stepinski等人,(2001)“含有新型“抗反向”帽类似物7-甲基(3'-o-甲基)gpppg和7-甲基(3'脱氧)gpppg的mrna的合成和性质(synthesis and properties of mrnas containing the novel
‘
anti-reverse’cap analogs 7-methyl(3'-o-methyl)gpppg and 7-methyl(3'deoxy)gpppg)”,《rna》7:1486
–
1495。arca结构如下所示。
[0762][0763]
cleancap
tm ag(m7g(5')ppp(5')(2'omea)pg;trilink生物技术有限公司(trilink biotechnologies),目录号:n-7113)或cleancap
tm gg(m7g(5')ppp(5')(2'omeg)pg;trilink生物技术有限公司,目录号:n-7133)可以用于共转录地提供帽1结构。cleancap
tm ag和cleancap
tm gg的3'-o-甲基化型式还可以分别从trilink生物技术有限公司,目录号n-7413和n-7433获得。cleancap
tm ag结构如下所示。
[0764][0765]
可替代地,可以在转录后向rna添加帽。例如,牛痘封端酶可商购(新英格兰生物实验室(new england biolabs),目录号:m2080s)并且具有由其d1亚基提供的rna三磷酸酶和尿苷转移酶活性及其d12亚基提供的鸟嘌呤甲基转移酶。如此,所述牛痘封端酶可以在存在s-腺苷甲硫氨酸和gtp的情况下向rna添加7-甲基鸟嘌呤,以提供帽0。参见例如:guo,p.和moss,b.(1990)《美国国家科学院院刊》87,4023-4027;mao,x.和shuman,s.(1994)《生物化学杂志(j.biol.chem.)》269,24472-24479。
[0766]
在一些实施例中,mrna进一步包括多腺苷酸化(poly-a)尾。在一些实施例中,所述poly-a尾包括至少20个、30个、40个、50个、60个、70个、80个、90个或100个腺嘌呤,任选地最多300个腺嘌呤。在一些实施例中,所述polly-a尾包括95个、96个、97个、98个、99个或100个腺嘌呤核苷酸。
[0767]
d.核糖核蛋白复合物
[0768]
在一些实施例中,本公开提供了包括包含来自表1或2的一个或多个向导序列的一个或多个grna以及rna引导的dna结合剂的组合物,例如核酸酶,如cas核酸酶,如cas9。在一
些实施例中,rna引导的dna结合剂具有也可以被称为双链核酸内切酶活性的切割酶活性。在一些实施例中,rna引导的dna结合剂包括cas核酸酶。cas9核酸酶的实例包含酿脓链球菌、金黄色葡萄球菌和其它原核生物的ii型crispr系统(参见例如,下一段中的列表)及其经修饰(例如,工程化或突变型)型式中的那些实例。参见,例如us2016/0312198a1;us 2016/0312199 a1。cas核酸酶的其它实例包含iii型crispr系统的csm或cmr复合物或其cas10、csm1或cmr2亚基;以及i型crispr系统的级联复合物或其cas3亚基。在一些实施例中,cas核酸酶可以来自iia型、iib型或iic型系统。关于各种crispr系统和cas核酸酶的讨论,参见例如makarova等人,《自然综述:微生物学(nat.rev.microbiol.)》9:467-477(2011);makarova等人,《自然综述:微生物学》,13:722-36(2015);shmakov等人,《分子细胞》,60:385-397(2015)。
[0769]
cas核酸酶可以源自的非限制性示例性物种包含酿脓链球菌、嗜热链球菌(streptococcus thermophilus)、链球菌(streptococcus sp.)、金黄色葡萄球菌、无害利斯特菌(listeria innocua)、加氏乳杆菌(lactobacillus gasseri)、新凶手弗朗西丝菌(francisella novicida)、产琥珀酸沃廉菌(wolinella succinogenes)、华德萨特菌(sutterella wadsworthensis)、γ-变形杆菌(gammaproteobacterium)、脑膜炎奈瑟氏球菌(neisseria meningitidis)、空肠弯曲菌(campylobacter jejuni)、多杀巴斯德菌(pasteurella multocida)、产琥珀酸丝状杆菌(fibrobacter succinogene)、深红红螺菌(rhodospirillum rubrum)、达松维尔拟诺卡氏菌(nocardiopsis dassonvillei)、始旋链霉菌(streptomyces pristinaespiralis)、绿产色链霉菌(streptomyces viridochromogenes)、绿产色链霉菌(streptomyces viridochromogenes)、链孢囊菌(streptosporangium roseum)、链孢囊菌、酸热脂环酸芽孢杆菌(alicyclobacillus acidocaldarius)、假蕈状芽孢杆菌(bacillus pseudomycoides)、硒化芽孢杆菌(bacillus selenitireducens)、戟叶鹅绒藤微小杆菌(exiguobacterium sibiricum)、德氏乳杆菌(lactobacillus delbrueckii)、唾液乳杆菌(lactobacillus salivarius)、布氏乳杆菌(lactobacillus buchneri)、齿垢密螺旋体(treponema denticola)、海洋微颤菌(microscilla marina)、伯克霍尔德氏菌(burkholderiales bacterium)、萘降解极地单胞菌(polaromonas naphthalenivorans)、单胞菌(polaromonas sp.)、瓦氏鳄球藻(crocosphaera watsonii)、蓝丝菌(cyanothece sp.)、铜绿微囊藻(microcystis aeruginosa)、聚球藻(synechococcus sp.)、阿拉伯糖醋盐杆菌(acetohalobium arabaticum)、丹氏制氨菌(ammonifex degensii)、热解纤维素菌(caldicelulosiruptor becscii)、金矿菌(candidatus desulforudis)、肉毒梭菌(clostridium botulinum)、艰难梭菌(clostridium difficile)、大芬戈尔德菌(finegoldia magna)、嗜热盐碱厌氧菌(natranaerobius thermophilus)、丙酸降解菌(pelotomaculum thermopropionicum)、喜温嗜酸硫杆菌(acidithiobacillus caldus)、嗜酸氧化亚铁硫杆菌(acidithiobacillus ferrooxidans)、酒色异着色菌(allochromatium vinosum)、海杆菌(marinobacter sp.)、嗜盐亚硝化球菌(nitrosococcus halophilus)、瓦氏亚硝化球菌(nitrosococcus watsoni)、假交替单胞菌(pseudoalteromonas haloplanktis)、消旋纤线杆菌(ktedonobacter racemifer)、甲烷盐菌(methanohalobium evestigatum)、鱼腥藻(nabaena variabilis)、泡沫节球藻(nodularia spumigena)、念珠藻(nostoc sp.)、极大
节旋藻(arthrospira maxima)、最大节螺藻(arthrospira maxima)、节旋藻(arthrospira sp.)、林氏藻(lyngbya sp.)、原型微鞘藻(microcoleus chthonoplastes)、颤藻(oscillatoria sp.)、移动石袍菌(petrotoga mobilis)、非洲栖热腔菌(thermosipho africanus)、巴氏链球菌(streptococcus pasteurianus)、灰色奈瑟球菌(neisseria cinerea)、拉里弯曲杆菌(campylobacter lari)、食清洁剂细小棒菌(parvibaculum lavamentivorans)、白喉棒状杆菌(corynebacterium diphtheriae)、氨基酸球菌(acidaminococcus sp.)、毛螺菌科细菌(lachnospiraceae bacterium)nd2006和深海单细胞蓝细菌(acaryochloris marina)。
[0770]
在一些实施例中,cas核酸酶是来自酿脓链球菌的cas9核酸酶。在一些实施例中,cas核酸酶是来自嗜热链球菌的cas9核酸酶。在一些实施例中,cas核酸酶是来自脑膜炎奈瑟氏球菌的cas9核酸酶。在一些实施例中,cas核酸酶是来自金黄色葡萄球菌的cas9核酸酶。在一些实施例中,cas核酸酶是来自新凶手弗朗西丝菌的cpf1核酸酶。在一些实施例中,cas核酸酶是来自氨基酸球菌的cpf1核酸酶在一些实施例中,cas核酸酶是来自毛螺菌科细菌nd2006的cpf1核酸酶。在另外的实施例中,cas核酸酶是来自以下的cpf1核酸酶:土拉热弗朗西丝菌(francisella tularensis)、毛螺菌科细菌、解蛋白丁酸弧菌(butyrivibrio proteoclasticus)、异域菌门细菌(peregrinibacteria bacterium)、俭菌超门细菌(parcubacteria bacterium)、丙酸氧化菌(smithella)、氨基酸球菌(acidaminococcus)、候选白蚁甲烷枝原体(candidatus methanoplasma termitum)、挑剔真杆菌(eubacterium eligens)、牛眼莫拉氏菌(moraxella bovoculi)、良吉氏钩端螺旋体(leptospira inadai)、牙龈卟啉单胞菌(porphyromonas crevioricanis)、解糖胨普雷沃菌(prevotella disiens)或猕猴卟啉单胞菌(porphyromonas macacae)。在某些实施例中,cas核酸酶是来自氨基酸球菌属或毛螺菌科的cpf1核酸酶。
[0771]
在一些实施例中,grna与rna引导的dna结合剂一起被称为核糖核蛋白复合物(rnp)。在一些实施例中,rna引导的dna结合剂是cas核酸酶。在一些实施例中,grna与cas核酸酶一起被称为cas rnp。在一些实施例中,rnp包括i型、ii型或iii型组分。在一些实施例中,cas核酸酶是来自ii型crispr/cas系统的cas9蛋白。在一些实施例中,grna与cas9一起被称为cas9 rnp。
[0772]
野生型cas9有两个核酸酶结构域:ruvc和hnh。ruvc结构域切割非靶dna链,并且hnh结构域切割靶dna链。在一些实施例中,cas9蛋白包括多于一个ruvc结构域和/或多于一个hnh结构域。在一些实施例中,cas9蛋白是野生型cas9。在组合物、用途和方法实施例中的每一个中,cas诱导靶dna中的双链断裂。
[0773]
在一些实施例中,使用嵌合型cas核酸酶,其中蛋白质的一个结构域或区被不同蛋白质的部分替代。在一些实施例中,cas核酸酶结构域可以被来自如fok1等不同核酸酶的结构域替代。在一些实施例中,cas核酸酶可以是经修饰的核酸酶。
[0774]
在其它实施例中,cas核酸酶可以来自i型crispr/cas系统。在一些实施例中,cas核酸酶可以是i型crispr/cas系统的级联复合物的组分。在一些实施例中,cas核酸酶可以是cas3蛋白。在一些实施例中,cas核酸酶可以来自iii型crispr/cas系统。在一些实施例中,cas核酸酶可以具有rna切割活性。
[0775]
在一些实施例中,rna引导的dna结合剂具有单链切口酶活性,即,可以切割一条
dna链以产生单链断裂,也被称为“切口”。在一些实施例中,rna引导的dna结合剂包括cas切口酶。切口酶是在dsdna中产生切口的酶,即,切割dna双螺旋的一条链而不是另一条链。在一些实施例中,cas切口酶是cas核酸酶(例如,上文所讨论的cas核酸酶)的型式,其中核酸内切酶活性位点例如通过催化结构域中的一种或多种改变(例如,点突变)而失活。参见例如美国专利第8,889,356号有关cas切口酶和示例性催化结构域改变的讨论。在一些实施例中,cas切口酶(如cas9切口酶)具有失活的ruvc或hnh结构域。
[0776]
在一些实施例中,rna引导的dna结合剂被修饰为仅含有一个功能性核酸酶结构域。例如,可以修饰试剂蛋白,使得核酸酶结构域之一发生突变或完全或部分缺失,以降低其核酸切割活性。在一些实施例中,使用具有降低活性的ruvc结构域的切口酶。在一些实施例中,使用具有非活性ruvc结构域的切口酶。在一些实施例中,使用具有降低活性的hnh结构域的切口酶。在一些实施例中,使用具有非活性hnh结构域的切口酶。
[0777]
在一些实施例中,cas蛋白核酸酶结构域内的保守氨基酸被取代以降低或改变核酸酶活性。在一些实施例中,cas核酸酶可以包括ruvc或ruvc样核酸酶结构域中的氨基酸取代。ruvc或ruvc样核酸酶结构域中的示例性氨基酸取代包含d10a(基于酿脓链球菌cas9蛋白)。参见例如zetsche等人,(2015)《细胞(cell)》10月22:163(3):759
–
771。在一些实施例中,cas核酸酶可以包括hnh或hnh样核酸酶结构域中的氨基酸取代。hnh或hnh样核酸酶结构域中的示例性氨基酸取代包含e762a、h840a、n863a、h983a和d986a(基于酿脓链球菌cas9蛋白)。参见例如zetsche等人,(2015)。另外的示例性氨基酸取代包含d917a、e1006a和d1255a(基于新凶手弗朗西丝菌u112 cpf1(fncpf1)序列(uniprotkb-a0q7q2(cpf1_fratn))。
[0778]
在一些实施例中,结合分别与靶序列的有义链和反义链互补的一对向导rna提供编码切口酶的mrna。在此实施例中,向导rna将切口酶引导到靶序列并且通过在靶序列的相反链上产生切口(即,双切口)引入dsb。在一些实施例中,使用双切口可以改善特异性并减少脱靶效应。在一些实施例中,切口酶与两个单独的靶向dna的相反链的向导rna一起使用以在靶dna中产生双切口。在一些实施例中,切口酶与两个单独的被选择成非常接近的向导rna一起使用以在靶dna中产生双切口。
[0779]
在一些实施例中,rna引导的dna结合剂缺少切割酶和切口酶活性。在一些实施例中,rna引导的dna结合剂包括dcas dna结合多肽。dcas多肽具有dna结合活性,但基本上缺少催化(切割酶/切口酶)活性。在一些实施例中,dcas多肽是dcas9多肽。在一些实施例中,缺少切割酶和切口酶活性的rna引导的dna结合剂或dcas dna结合多肽是cas核酸酶(例如,上文所讨论的cas核酸酶)的型式,其中所述核酸酶的核酸内切酶活性位点例如通过其催化结构域中的一种或多种改变(例如,点突变)而失活。参见例如us 2014/0186958 a1;us 2015/0166980 a1。
[0780]
在一些实施例中,rna引导的dna结合剂包括一个或多个异源功能性结构域(例如,是或包括融合多肽)。
[0781]
在一些实施例中,异源功能性结构域可以促进rna引导的dna结合剂运输到细胞核中。例如,异源功能性结构域可以是核定位信号(nls)。在一些实施例中,rna引导的dna结合剂可以与1-10个nls融合。在一些实施例中,rna引导的dna结合剂可以与1-5个nls融合。在一些实施例中,rna引导的dna结合剂可以与一个nls融合。当使用一个nls时,nls可以连接在rna引导的dna结合剂序列的n末端或c末端处。所述nls还可以插在rna引导的dna结合剂
序列中。在其它实施例中,rna引导的dna结合剂可以与多于一个nls融合。在一些实施例中,rna引导的dna结合剂可以与2个、3个、4个或5个nls融合。在一些实施例中,rna引导的dna结合剂可以与两个nls融合。在某些情况下,所述两个nls可以是相同的(例如,两个sv40 nls)或不同的。在一些实施例中,rna引导的dna结合剂与羧基末端处连接的两个sv40 nls序列融合。在一些实施例中,rna引导的dna结合剂可以与两个nls融合,一个在n末端处连接并且一个在c末端处连接。在一些实施例中,rna引导的dna结合剂可以与3个nls融合。在一些实施例中,rna引导的dna结合剂可以不与nls融合。在一些实施例中,nls可以是单分序列,例如sv40 nls、pkkkrkv(seq id no:600)或pkkkrrv(seq id no:601)。在一些实施例中,nls可以是二分序列,如核质蛋白的nls,krpaatkkagqakkkk(seq id no:602)。在具体实施例中,单个pkkkrkv(seq id no:600)nls可以在rna引导的dna结合剂的c末端处连接。在融合位点处任选地包含一个或多个接头。
[0782]
在一些实施例中,异源功能性结构域能够修饰rna引导的dna结合剂的细胞内半衰期。在一些实施例中,可以增加rna引导的dna结合剂的半衰期。在一些实施例中,可以减少rna引导的dna结合剂的半衰期。在一些实施例中,异源功能性结构域能够增加rna引导的dna结合剂的稳定性。在一些实施例中,异源功能性结构域能够减少rna引导的dna结合剂的稳定性。在一些实施例中,异源功能性结构域可以充当蛋白质降解的信号肽。在一些实施例中,蛋白质降解可以由蛋白水解酶介导,所述蛋白水解酶例如蛋白酶体、溶酶体蛋白酶或钙蛋白酶。在一些实施例中,异源功能性结构域可以包括pest序列。在一些实施例中,可以通过添加泛素或多泛素链来修饰rna引导的dna结合剂。在一些实施例中,泛素可以是泛素样蛋白(ubl)。泛素样蛋白的非限制性实例包含小泛素样修饰物(sumo)、泛素交叉反应型蛋白(ucrp,也称为干扰素刺激基因-15(isg15))、泛素相关修饰物-1(urm1)、神经元前体细胞表达的发育下调蛋白-8(nedd8,在酿酒酵母中也称为rub1)、人白细胞抗原f相关(fat10)、自噬-8(atg8)和-12(atg12)、fau泛素样蛋白(fub1)、膜锚定ubl(mub)、泛素折叠修饰物-1(ufm1)和泛素样蛋白-5(ubl5)。
[0783]
在一些实施例中,异源功能性结构域可以是标志物结构域。标志物结构域的非限制性实例包含荧光蛋白、纯化标签、表位标签和报告基因序列。在一些实施例中,标志物结构域可以是荧光蛋白。合适的荧光蛋白的非限制性实例包含绿色荧光蛋白(例如,gfp、gfp-2、taggfp、turbogfp、sfgfp、egfp、祖母绿、azami绿、单体azami绿、copgfp、acegfp、zsgreen1)、黄色荧光蛋白(例如,yfp、eyfp、柠檬黄、venus、ypet、phiyfp、zsyellow1)、蓝色荧光蛋白(例如,ebfp、ebfp2、石青、mkalamal、gfpuv、天蓝色、t-天蓝色(t-sapphire))、青色荧光蛋白(例如,ecfp、蔚蓝色(cerulean)、cypet、amcyan1、midoriishi-青色)、红色荧光蛋白(例如,mkate、mkate2、mplum、dsred单体、mcherry、mrfp1、dsred-表达、dsred2、dsred-单体、hcred-tandem、hcred1、asred2、eqfp611、mrasberry、mstrawberry、jred)和橙色荧光蛋白(例如,morange、mko、kusabira-橙色、单体kusabira-橙色、mtangerine、tdtomato)或任何其它合适的荧光蛋白。在其它实施例中,标志物结构域可以是纯化标签和/或表位标签。非限制性示例性标签包含谷胱甘肽-s-转移酶(gst)、几丁质结合蛋白(cbp)、麦芽糖结合蛋白(mbp)、硫氧还蛋白(trx)、poly(nanp)、串联亲和纯化(tap)标签、myc、acv5、au1、au5、e、ecs、e2、flag、ha、nus、softag 1、softag 3、strep、sbp、glu-glu、hsv、kt3、s、s1、t7、v5、vsv-g、6xhis、8xhis、生物素羧基载体蛋白(bccp)、多his和钙调蛋白。非限制性示例性
报告基因包含谷胱甘肽-s-转移酶(gst)、辣根过氧化物酶(hrp)、氯霉素乙酰转移酶(cat)、β-半乳糖苷酶、β-葡糖醛酸苷酶、荧光素酶或荧光蛋白。
[0784]
在另外的实施例中,异源功能性结构域可以将rna引导的dna结合剂靶向特定细胞器、细胞类型、组织或器官。在一些实施例中,异源功能性结构域可以将rna引导的dna结合剂靶向线粒体。
[0785]
在另外的实施例中,异源功能性结构域可以是效应结构域。当将rna引导的dna结合剂引导到其靶序列时,例如,当通过grna将cas核酸酶引导到靶序列时,效应结构域可以修饰或影响靶序列。在一些实施例中,效应结构域可以选自核酸结合结构域、核酸酶结构域(例如,非cas核酸酶结构域)、表观遗传修饰结构域、转录激活结构域或转录阻遏物结构域。在一些实施例中,异源功能性结构域是核酸酶,如foki核酸酶。参见例如美国专利第9,023,649号。在一些实施例中,异源功能性结构域是转录激活剂或阻遏物。参见例如qi等人,“改变crispr用途作为用于基因表达的序列特异性对照的rna引导的平台(repurposing crispr as an rna-guided platform for sequence-specific control of gene expression)”,《细胞》152:1173-83(2013);perez-pinera等人,“通过基于crispr-cas9的转录因子的rna引导的基因激活(rna-guided gene activation by crispr-cas9-based transcription factors)”《自然方法(nat.methods)》10:973-6(2013);mali等人,“用于靶特异性筛选的cas9转录激活因子和用于合作基因组工程的配对切口酶(cas9 transcriptional activators for target specificity screening and paired nickases for cooperative genome engineering)”,《自然生物技术(nat.biotechnol.)》31:833-8(2013);gilbert等人,“真核生物中crispr介导的模块化rna引导的转录调节(crispr-mediated modular rna-guided regulation of transcription in eukaryotes)”,《细胞》154:442-51(2013)。如此,rna引导的dna结合剂基本上成为可以使用向导rna引导以结合期望的靶序列的转录因子。
[0786]
e.测定grna的功效
[0787]
在一些实施例中,当与形成rnp的其它组分一起递送或表达时,测定grna的功效。在一些实施例中,grna与rna引导的dna结合剂,如cas蛋白,例如,cas9一起表达。在一些实施例中,grna被递送到已经稳定表达rna引导的dna核酸酶,如cas核酸酶或切口酶,例如,cas9核酸酶或切口酶的细胞系或在所述细胞系中表达。在一些实施例中,将grna作为rnp的一部分递送到细胞。在一些实施例中,将grna以及编码rna引导的dna核酸酶,如cas核酸酶或切口酶,例如,cas9核酸酶或切口酶的mrna一起递送到细胞。
[0788]
如本文所描述的,使用本文所公开的rna引导的dna核酸酶和向导rna可以导致双链断裂(dsb)、单链断裂和/或位点特异性结合,从而导致dna中的核酸修饰,这可以在通过细胞机制进行修复时产生插入/缺失(插入缺失)突变形式的错误。许多由于插入缺失造成的突变改变开放阅读框或引入提前终止密码子,并且因此产生非功能性蛋白。
[0789]
在一些实施例中,基于体外模型确定特定grna的功效。在一些实施例中,体外模型是稳定表达cas9的hek293细胞(hek293_cas9)。在一些实施例中,所述体外模型是huh7人肝癌细胞。在一些实施例中,体外模型是hepg2细胞。在一些实施例中,体外模型是原代人肝细胞。在一些实施例中,体外模型是原代食蟹猴肝细胞。关于使用原代人肝细胞,可以使用可商购的原代人肝细胞以在实验之间提供更大的一致性。在一些实施例中,例如通过分析来
自用cas9 mrna和向导rna在体外转染的原代人肝细胞的基因组dna来测定缺失或插入在体外模型中(例如,在原代人肝细胞中)发生的脱靶位点的数量。在一些实施例中,此类测定包括分析来自用cas9 mrna、向导rna和供体寡核苷酸在体外转染的原代人肝细胞的基因组dna。以下工作实例中提供了用于此类测定的示例性程序。
[0790]
在一些实施例中,对于grna选择过程,跨多个体外细胞模型测定特定grna的功效。在一些实施例中,执行数据与选定grna的细胞系比较。在一些实施例中,执行跨多个细胞模型中的交叉筛选。在一些实施例中,对于grna选择过程,在phh或pch中测定特定grna的功效。
[0791]
在一些实施例中,基于体内模型确定特定grna的功效。在一些实施例中,体内模型是啮齿动物模型。在一些实施例中,啮齿动物模型是表达klkb1基因的小鼠。在一些实施例中,啮齿动物模型是表达人klkb1基因的小鼠。在一些实施例中,体内模型是非人灵长类动物,例如食蟹猴。
[0792]
在一些实施例中,向导rna的功效是通过klkb1的编辑百分比来测量的。插入缺失百分比可以从ngs测序中计算出来。在一些实施例中,将klkb1的编辑百分比与实现前激肽释放酶和/或激肽释放酶蛋白,例如在体外模型的情况下在体外模型或含有循环水平的血浆的情况下来自细胞培养基或细胞裂解物的敲低所必需的编辑百分比进行比较。
[0793]
在一些实施例中,通过靶细胞类型的基因组内的脱靶序列处的插入缺失的数量和/或频率测量向导rna的功效。在一些实施例中,提供了在细胞群体中和/或相对于在靶位点处插入缺失产生的频率以非常低的频率(例如,《5%)在脱靶位点处产生插入缺失的有效向导rna。因此,本公开提供了在靶细胞类型(例如,肝细胞如phh)中不表现出脱靶插入缺失形成或在细胞群体中和/或相对于在靶位点处插入缺失产生的频率产生《5%的脱靶插入缺失形成的频率的向导rna。在一些实施例中,本公开提供了在靶细胞类型(例如,肝细胞)中不表现出任何脱靶插入缺失形成的向导rna。在一些实施例中,提供了在例如通过本文所描述的一种或多种方法评估的少于5个脱靶位点处产生插入缺失的向导rna。在一些实施例中,提供了在例如通过本文所描述的一种或多种方法评估的少于或等于4个、3个、2个或1个脱靶位点处产生插入缺失的向导rna。在一些实施例中,一个或多个脱靶位点不出现在靶细胞(例如,肝细胞)基因组中的蛋白质编码区中。
[0794]
在一些实施例中,线性扩增用于检测基因编辑事件,如靶dna中插入/缺失(“插入缺失”)突变、易位和同源定向的修复(hdr)事件的形成。例如,可以使用具有独特序列标记的引物并分离标记的扩增产物(在下文中称为“unit”或“独特标识符标记”方法)的线性扩增。
[0795]
在一些实施例中,向导rna的功效通过测量样品如体液,例如血清、血浆或血液中的klkb1、pkal、总klkb1(前激肽释放酶+pkal)、klkb1活性、hmwk、hmwk活性和/或缓激肽的水平来测定。
[0796]
在一些实施例中,向导rna的功效通过测量klkb1 mrna水平来测定。klkb1mrna水平的降低指示存在有效的向导rna。
[0797]
在一些实施例中,向导rna的功效通过测量样品如体液,例如血清、血浆或血液中的缓激肽的水平来测定。
[0798]
在一些实施例中,向导rna的功效通过测量样品中缓激肽和/或其降解产物的水平
来测定。在一些实施例中,向导rna的功效通过测量血清或血浆中缓激肽和/或其降解产物的水平来测定。血清或血浆中缓激肽和/或其降解产物的水平的降低指示存在有效的向导rna。
[0799]
一种检测循环血液中缓激肽的方法在ferreira等人,《英国药理学杂志(br.j.pharmac.chemother.)》(1967),29,367-377中有所提供。还可以通过用细胞培养基或血清或血浆的酶联免疫吸附测定(elisa)测定法来检测缓激肽。(参见例如艾博抗公司(abcam),目录号ab136936;markit-m缓激肽(gentaur))。在一些实施例中,在用于测量编辑的相同体外或体内系统或模型中测量缓激肽的水平。在一些实施例中,在细胞,例如原代人肝细胞中测量缓激肽的水平。在一些实施例中,在流体如血清或血浆中测量缓激肽的水平。在一些实施例中,测量缓激肽的循环水平。
[0800]
在一些实施例中,向导rna的功效通过测量样品中总激肽释放酶(前激肽释放酶和血浆激肽释放酶(pkal))的水平来测定。在一些实施例中,向导rna的功效通过测量样品如体液,例如血清、血浆或血液中总激肽释放酶的水平来测定。在一些实施例中,向导rna的功效通过测量血清或血浆中总激肽释放酶的水平来测定。血清或血浆中总激肽释放酶的水平的降低指示存在有效的向导rna。在一些实施例中,血清和/或血浆总激肽释放酶降低到低于基础水平的40%。在一些实施例中,使用利用细胞培养基或血清或血浆的酶联免疫吸附测定(elisa)测定法来测量总激肽释放酶的水平。在一些实施例中,在用于测量编辑的相同体外或体内系统或模型中测量总激肽释放酶的水平。在一些实施例中,在细胞,例如原代人肝细胞中测量总激肽释放酶的水平。在一些实施例中,在phh和pch细胞中测量总激肽释放酶的水平。
[0801]
在一些实施例中,向导rna的功效通过测量样品如体液,例如血清、血浆或血液中前激肽释放酶和/或激肽释放酶的水平来测定。在一些实施例中,向导rna的功效通过测量血清或血浆中前激肽释放酶和/或激肽释放酶的水平来测定。血清或血浆中前激肽释放酶和/或激肽释放酶的水平的降低指示存在有效的向导rna。在一些实施例中,使用利用细胞培养基或血清或血浆的酶联免疫吸附测定(elisa)测定法来测量前激肽释放酶和/或激肽释放酶的水平。在一些实施例中,在用于测量编辑的体外或体内系统或模型中测量前激肽释放酶和/或激肽释放酶的水平。在一些实施例中,在细胞,例如原代人肝细胞中、在血浆中或在细胞培养基中测量前激肽释放酶和/或激肽释放酶的水平。在一些实施例中,从血浆样品中测量前激肽释放酶和/或激肽释放酶的水平。在一些实施例中,从血清样品中测量前激肽释放酶和/或激肽释放酶的水平。在将前激肽释放酶转化为其活性形式pkal的激活步骤之后,任选地通过elisa测量前激肽释放酶和/或pkal蛋白水平。
[0802]
在一些实施例中,向导rna的功效通过测量样品中前激肽释放酶的水平来测定。
[0803]
在一些实施例中,向导rna的功效通过测量样品如体液,例如血清、血浆或血液中的前激肽释放酶的水平来测定。在一些实施例中,向导rna的功效通过测量血清或血浆中前激肽释放酶的水平来测定。血清或血浆中前激肽释放酶的水平的降低指示存在有效的向导rna。在一些实施例中,血清和/或血浆前激肽释放酶减少至少60%、70%、80%、85%、90%、95%或更多。在一些实施例中,血清和/或血浆总激肽释放酶、前激肽释放酶和/或激肽释放酶减少约60-80%、60-90%、60-95%、60-100%、85-95%或85-100%。在一些实施例中,使用利用细胞培养基或血清或血浆的酶联免疫吸附测定(elisa)测定法来测量前激肽释放酶的水平。在一些实施例中,在用于测量编辑的体外或体内系统或模型中测量前激肽释放酶
的水平。在一些实施例中,在细胞,例如原代人肝细胞中、在血浆中或在细胞培养基中测量前激肽释放酶的水平。在一些实施例中,从血浆样品中测量前激肽释放酶的水平。在一些实施例中,从血清样品中测量前激肽释放酶的水平。
[0804]
在一些实施例中,向导rna的功效通过测量样品中pkal的水平来测定。在一些实施例中,向导rna的功效通过测量血清或血浆中pkal的水平来测定。血清或血浆中pkal的水平的降低指示存在有效的向导rna。在一些实施例中,pkal的水平降低至少60%、70%、80%、85%、90%、95%或更多。在一些实施例中,血清和/或血浆pkal减少约60-80%、60-90%、60-95%、60-100%、85-95%或85-100%。在一些实施例中,使用利用细胞培养基或血清或血浆的酶联免疫吸附测定(elisa)测定法来测量pkal的水平。在一些实施例中,在用于测量编辑的体外或体内系统或模型中测量pkal的水平。在一些实施例中,在细胞,例如原代人肝细胞中、在血浆中或在细胞培养基中测量pkal的水平。在一些实施例中,从血浆样品中测量pkal的水平。在一些实施例中,从血清样品中测量pkal的水平。
[0805]
在一些实施例中,向导rna的功效通过测量柠檬酸血清或柠檬酸血浆中循环切割的hmwk(chmwk)和总hmwk的水平来测定。在一些实施例中,向导rna的功效通过测量血清或血浆中循环切割的hmwk(chmwk)和总hmwk的水平来测定。与总hmwk相比,切割的hmwk的比例的降低指示存在有效的向导rna。在一些实施例中,与总hmwk相比,切割的hmwk的比例可以使循环血浆chmwk与总hmwk的比率小于约60%。在一些实施例中,chmwk与hmwk的比率小于约10%、15%、20%、25%、30%、35%、40%、50%或更多。在一些实施例中,使用利用细胞培养基或血清或血浆的蛋白质印迹测定法来测量前激肽释放酶的水平。在一些实施例中,在用于测量编辑的体外或体内系统或模型中测量chmwk和总hmwk的水平。在一些实施例中,在细胞,例如原代人肝细胞中、在血浆中或在细胞培养基中测量chmwk和总hmwk的水平。在一些实施例中,从血浆样品中测量chmwk和总hmwk的水平。在一些实施例中,从血清样品中测量chmwk和总hmwk的水平。
[0806]
在一些实施例中,向导rna的功效通过测量样品中pkal活性来测定。pkal活性的降低指示存在有效的向导rna。在一些实施例中,向导rna的功效通过测量血清或血浆中pkal活性来测定。
[0807]
在一些实施例中,pkal活性测量为柠檬酸血清样品或柠檬酸血浆样品将hmwk转化为chmwk的能力(banerji等人,《新英格兰医学杂志》2017;376:717-28)。chmwk与总hmwk的最终比例的降低指示pkal活性降低。可以通过蛋白质印迹测量chmwk和全长hmwk的水平。在其它实施例中,pkal活性被测量为柠檬酸血清样品或柠檬酸血浆样品酶促切割hwmk样肽底物的能力,在这种情况下,底物切割的减少指示pkal活性的降低。
[0808]
在一些实施例中,pkal活性降低至少40%、50%、60%、70%、80%、85%、90%、95%或更多。在一些实施例中,pkal活性降低约60-80%、60-90%、60-95%、60-100%、85-95%或85-100%。在一些实施例中,pkal活性降低到低于基础水平的约40%。在一些实施例中,pkal活性降低到基础水平的约40-50%。在一些实施例中,pkal活性降低到基础水平的20-40或20-50%。在一些实施例中,在用于测量编辑的体外或体内系统或模型中测量pkal活性的水平。在一些实施例中,在细胞,例如原代人肝细胞中、在血浆中或在细胞培养基中测量pkal活性的水平。在一些实施例中,从血浆样品中测量pkal活性的水平。在一些实施例中,从血清样品中测量pkal的水平。
[0809]
iii.治疗方法
[0810]
本文所公开的grna和相关方法和组合物可用于治疗和预防hae并预防hae的症状。在一些实施例中,grna和相关方法和组合物可用于降低hae发作的频率。在一些实施例中,grna和相关方法和组合物可用于预防hae发作。在一些实施例中,本文所公开的grna可用于治疗和预防缓激肽产生和累积、缓激肽诱导的肿胀、气道的血管性水肿阻塞或窒息。在一些实施例中,本文所公开的grna可用于治疗或预防由hae引起的血管性水肿和发作。在一些实施例中,本文所公开的grna可用于降低血管性水肿发作,如hae发作的频率。在一些实施例中,本文所公开的grna可用于降低血管性水肿发作的严重程度。在一些实施例中,本文所公开的grna可用于降低发作,如hae发作的频率和/或严重程度。在一些实施例中,本文所公开的grna可用于实现血管性水肿发作,如hae发作的缓解。在一些实施例中,本文所公开的grna可用于实现持久缓解,例如维持至少1个月、2个月、4个月、6个月、1年、2年、5年、10年或更长时间。
[0811]
本文所公开的grna和相关方法和组合物可用于减少klkb1 mrna产生。因此,在一个方面,治疗/预防的有效性可以通过测量klkb1 mrna水平来评估,其中klkb1mrna水平的降低指示有效性。
[0812]
本文所公开的grna和相关方法和组合物可用于降低血浆或血清中的前激肽释放酶蛋白水平。因此,在一个方面,治疗/预防的有效性可以通过测量前激肽释放酶蛋白水平或总激肽释放酶蛋白水平来评估,其中前激肽释放酶和/或激肽释放酶蛋白的降低指示有效性。在一些实施例中,治疗/预防的有效性可以通过测量样品,如血清或血浆中的前激肽释放酶蛋白来评估,其中前激肽释放酶的降低指示有效性。例如,血浆或血清前激肽释放酶可以通过elisa测量,如在ferrone jd,bhattacharjee g,revenko as等人,ionis-pkk
rx
,一种新型的前激肽释放酶和缓激肽产生的反义抑制剂(ionis-pkk
rx a novel antisense inhibitor of prekallikrein and bradykinin production.)《核酸疗法(nucleic acid ther.)》2019;29(2):82-91中有所描述。类似地,激肽释放酶可以通过本文所描述的elisa测量,并且本文所公开的grna的施用可以降低血浆或血清中激肽释放酶蛋白水平。
[0813]
本文所公开的grna和相关方法和组合物可用于降低血浆或血清中的总激肽释放酶(前激肽释放酶和pkal)蛋白水平。因此,在一个方面,治疗/预防的有效性可以通过测量总激肽释放酶(前激肽释放酶和pkal)蛋白水平来评估,其中总激肽释放酶蛋白的降低指示有效性。总激肽释放酶、前激肽释放酶和/或激肽释放酶可在激活以释放血浆激肽释放酶之前或之后测量。在一些实施例中,治疗/预防的有效性可以通过测量样品,如血清或血浆中的前激肽释放酶和/或pkal蛋白来评估,其中前激肽释放酶蛋白的降低指示有效性。在一些实施例中,治疗/预防的有效性可以通过测量样品,如血清或血浆中的pkal蛋白来评估,其中pkal蛋白的降低指示有效性。例如,前激肽释放酶和pkal蛋白的水平可以通过elisa测量,例如通过使用前激肽释放酶和激肽释放酶人elisa试剂盒(俄勒冈州尤金市艾博抗公司(abcam,eugene,or))测量。在将前激肽释放酶转化为其活性形式pkal的激活步骤之后,任选地通过elisa测量前激肽释放酶和/或pkal蛋白水平。
[0814]
与柠檬酸血清或柠檬酸血浆中的总hmwk相比,本文所公开的grna和相关方法和组合物可用于降低循环切割的hmwk(chmwk)的比例。因此,在一个方面,治疗/预防的有效性可以通过测量总hmwk和chmwk蛋白水平来评估,其中切割的hmwk的比例的降低指示有效性。在
一些实施例中,治疗/预防的有效性可以通过测量样品,如血清或血浆中的总hmwk和chmwk蛋白水平来评估,其中chmwk比例的降低指示有效性。例如,柠檬酸血清或柠檬酸血浆样品中,与总hmwk相比,chmwk的比例可以通过蛋白质印迹测量,如在suffritti c,zanichelli a,maggioni l,bonanni e,cugno m,cicardi m.由于遗传性c1抑制剂缺乏,缓激肽介导的血管性水肿中高分子量激肽原切割与疾病状态相关(high-molecular weight kininogen cleavage correlates with disease states in the bradykinin-mediated angioedema due to hereditary c1-inhibitor deficiency.)《临床与实验过敏》2014;44:1503-14以及在banerji a,busse p,shennak m等人,抑制血浆激肽释放酶用于遗传性血管性水肿的预防(inhibiting plasma kallikrein for hereditary angioedema prophylaxis.)《新英格兰医学杂志》2017;376:717-28中有所描述。
[0815]
循环血浆chmwk水平低于总hmwk的约30%与用拉那鲁单抗治疗的患者的hae发作减少相关联(参见banerji等人,2017)。在此同一研究中,健康对照组的chmwk的血浆水平为总hmwk的约8.3%。在另一项研究中,suffriti及其同事发现,正常对照中chmwk血浆水平的平均值为约34.8%,缓解期的hae患者为约41.4%,发作期的hae患者为约58.1%(suffritti等人,《临床与实验过敏》2014;44:1503-14)。因此,在一些实施例中,本文所公开的grna和相关方法和组合物可用于降低循环chmwk水平,使得受试者表现出减少的hae发作次数。在一些实施例中,本文所公开的grna和相关方法和组合物可用于将受试者在柠檬酸盐血浆中的chmwk比例降低到低于30%。在一些实施例中,本文所公开的grna和相关方法和组合物可用于将受试者在柠檬酸盐血浆中的chmwk比例降低到低于30%、20%和/或10%。在一些实施例中,本文所公开的grna和相关方法和组合物可用于将受试者在柠檬酸盐血浆中的chmwk比例降低到大约健康对照组的比例。
[0816]
本文所公开的grna和相关方法和组合物可以用于降低血清或血浆中的自发型pkal活性。因此,在一个方面,治疗/预防的有效性可以通过测量自发型pkal活性来评估,其中自发型pkal活性的降低指示有效性。在一些实施例中,治疗/预防的有效性可以通过测量样品,如血清或血浆中的自发型pkal活性来评估,其中自发型pkal活性的降低指示有效性。在某些实施例中,本文所公开的grna和相关方法和组合物可用于降低循环pkal和循环pkal活性的基础水平。
[0817]
本文所公开的grna和相关方法和组合物可以用于降低血清或血浆诱导型pkal活性。因此,在一个方面,治疗/预防的有效性可以通过测量诱导型pkal活性来评估,其中诱导型pkal活性的降低指示有效性。在一些实施例中,治疗/预防的有效性可以通过测量样品,如血清或血浆诱导型pkal活性来评估,其中诱导型pkal活性的降低指示有效性。在一些实例中,pkal活性可以通过将样品暴露于fxiia来诱导(参见banerji等人,《新英格兰医学杂志)》2017;376:717-28.)。在一些实例中,pkal活性可以通过将样品与葡聚糖硫酸盐一起温育来诱导(参见ferrone等人,《核酸疗法》2019;29(2):82
–
91.)。在一些实例中,pkal活性可以通过向样品中添加鞣花酸来诱导(等人,《过敏症与临床免疫学杂志(j allergy clin immunol)》2016;138:934-936.)。
[0818]
在一些实例中,pkal活性测量为柠檬酸血清样品或柠檬酸血浆样品将hmwk转化为chmwk的能力(banerji等人,《新英格兰医学杂志》2017;376:717-28),其中chmwk与总hmwk的最终比例的降低指示pkal活性的降低。chmwk和全长hmwk的比例可以通过蛋白质印迹测
量,例如在suffritti等人,《临床与实验过敏》2014;44:1503-14中所描述的。在其它实例中,pkal活性被测量为柠檬酸血清样品或柠檬酸血浆样品酶促切割hwmk样肽底物的能力,在这种情况下,底物切割的减少指示pkal活性的降低。在一个实例中,底物肽可以是显色底物h-d-pro-phe-arg-p-硝基苯胺肽(巴亨公司(bachem),目录l-2120),并且切割可以测量为a405中的变化(参见defendi等人,defendi等人,《公共科学图书馆
·
综合(plos one)》2013;8:e70140)。在另一个实例中,底物肽可以是荧光底物h-pro-phe-arg-amc(西格玛(sigma),目录号p9273),并且切割可以分别作为在360nm和480nm处的激发和发射波长的荧光变化来测量(参见banerji等人,《新英格兰医学杂志》2017;376:717
–
28)。
[0819]
在一项研究中,诱导的pkal活性降低超过40%与hae发作的减少有关(banerji等人,《新英格兰医学杂志》2017;376:717
–
28)。诱导的pkal活性降低至少50%与通过bcx7353治疗,hae发作的减少有关(等人,《新英格兰医学杂志》2018;379:352
–
362)。诱导的pkal活性降低60%与用拉那鲁单抗治疗中发作的减少有关(banerji等人,《新英格兰医学杂志》2017;376:717
–
28)。因此,在一些实施例中,本文所公开的grna和组合物的施用可用于降低激肽释放酶活性(例如,总激肽释放酶活性、前激肽释放酶活性和/或pkal活性),使得受试者表现出更少的hae发作。
[0820]
在一些实施例中,本文所公开的grna和组合物的施用将受试者的pkal活性降低到低于基础水平的约40%。在一些实施例中,本文所公开的grna和组合物的施用将受试者的pkal活性降低到基础水平的约40-50%。在一些实施例中,本文所公开的grna和组合物的施用将受试者的pkal活性降低到基础水平的20-40%或20-50%。
[0821]
在一些实施例中,本文所描述的grna、组合物或药物调配物中的任何一种或多种用于制备用于治疗或预防受试者的疾病或病症的药物。在一些实施例中,治疗和/或预防是用药物/组合物的单剂量(例如,一次性治疗)完成的。在一些实施例中,所述疾病或病症是hae。
[0822]
在一些实施例中,本发明包括一种治疗或预防受试者的疾病或病症的方法,所述方法包括施用本文所描述的grna、组合物或药物调配物中的任何一种或多种。在一些实施例中,所述疾病或病症是hae。在一些实施例中,本文所述的grna、组合物或药物调配物以单剂量施用,例如一次施用。在一些实施例中,单剂量实现持久的治疗和/或预防。在一些实施例中,所述方法实现持久的治疗和/或预防。如本文所使用的持久的治疗和/或预防包含延长至少以下时间的治疗和/或预防:i)3周、4周、5周、6周、7周、8周、9周、10周、11周、12周、13周、14周或15周;ii)1个月、2个月、3个月、4个月、5个月、6个月、7个月、8个月、9个月、10个月、11个月、12个月、18个月、24个月、30个月或36个月;或iii)1年、2年、3年、4年、5年、6年、7年、8年、9年或10年。在一些实施例中,在受试者的生命期间,本文所描述的单剂量的grna、组合物或药物调配物足以治疗和/或预防本文所描述的适应症中的任何适应症。
[0823]
在一些实施例中,本发明包括修饰(例如,产生双链断裂)靶dna的方法或用途,所述方法或用途包括施用或递送本文所描述的grna、组合物或药物调配物中的任何一种或多种。在一些实施例中,靶dna是klkb1基因。在一些实施例中,靶dna位于klkb1基因的外显子中。在一些实施例中,靶dna位于klkb1基因的外显子1、2、3、4、5、6、7、8、9、10、11、12、13、14或15中。
[0824]
在一些实施例中,本发明包括用于调节靶基因的方法或用途,所述方法或用途包括施用或递送本文所描述的grna、组合物或药物调配物中的任何一种或多种。在一些实施
例中,调节是对klkb1靶基因进行编辑。在一些实施例中,调节是由klkb1靶基因编码的蛋白质的表达的变化。
[0825]
在一些实施例中,所述方法或用途导致基因编辑。在一些实施例中,所述方法或用途导致靶klkb1基因内的双链断裂。在一些实施例中,所述方法或用途导致在dsb的非同源端连接期间形成插入缺失。在一些实施例中,所述方法或用途导致靶klkb1基因中核苷酸的插入或缺失。在一些实施例中,靶klkb1基因中核苷酸的插入或缺失导致造成非功能性蛋白的移码突变或提前终止密码子。在一些实施例中,靶klkb1基因中核苷酸的插入或缺失导致靶基因表达的敲低或消除。
[0826]
在一些实施例中,所述方法或用途导致klkb1基因调节。在一些实施例中,klkb1基因调节是基因表达的降低。在一些实施例中,所述方法或用途导致由靶基因编码的蛋白质在细胞的群体或在体内的表达降低。
[0827]
在一些实施例中,提供了一种在klkb1基因内诱导双链断裂(dsb)的方法,所述方法包括施用包括向导rna的组合物,所述向导rna包括seq id no:1-149中的任何一个或多个向导序列。在一些实施例中,施用包括seq id no:1-149的向导序列中的任何一个或多个向导序列的grna以在klkb1基因中诱导dsb。向导rna可以与rna引导的dna核酸酶,如cas核酸酶(例如,cas9)或编码rna引导的dna核酸酶,如cas核酸酶(例如,cas9)的mrna或载体一起施用。
[0828]
在一些实施例中,提供了一种对klkb1基因进行修饰的方法,所述方法包括施用包括向导rna的组合物,所述向导rna包括seq id no:1-149的向导序列中的任何一个或多个向导序列。在一些实施例中,施用包括seq id no:1-149的向导序列中的任何一个或多个向导序列的grna以修饰klkb1基因。向导rna可以与rna引导的dna核酸酶,如cas核酸酶(例如,cas9)或编码rna引导的dna核酸酶,如cas核酸酶(例如,cas9)的mrna或载体一起施用。
[0829]
在一些实施例中,提供了一种治疗或预防遗传性血管性水肿(hae)的方法,所述方法包括施用包括向导rna的组合物,所述向导rna包括seq id no:1-149的向导序列中的任何一个或多个向导序列。在一些实施例中,施用包括seq id no:1-149的向导序列中的任何一个或多个向导序列的grna以治疗或预防hae。向导rna可以与rna引导的dna核酸酶,如cas核酸酶(例如,cas9)或编码rna引导的dna核酸酶,如cas核酸酶(例如,cas9)的mrna或载体一起施用。
[0830]
在一些实施例中,提供了一种减少或消除缓激肽产生和累积的方法,所述方法包括施用向导rna,所述向导rna包括seq id no:1-149的向导序列中的任何一个或多个向导序列。向导rna可以与rna引导的dna核酸酶,如cas核酸酶(例如,cas9)或编码rna引导的dna核酸酶,如cas核酸酶(例如,cas9)的mrna或载体一起施用。
[0831]
在一些实施例中,提供了一种治疗或预防缓激肽诱导的肿胀的方法,所述方法包括施用向导rna,所述向导rna包括seq id no:1-149的向导序列中的任何一个或多个向导序列。向导rna可以与rna引导的dna核酸酶,如cas核酸酶(例如,cas9)或编码rna引导的dna核酸酶,如cas核酸酶(例如,cas9)的mrna或载体一起施用。
[0832]
在一些实施例中,提供了一种治疗或预防缓激肽诱导的血管性水肿的方法,所述方法包括施用向导rna,所述向导rna包括seq id no:1-149的向导序列中的任何一个或多个向导序列。向导rna可以与rna引导的dna核酸酶,如cas核酸酶(例如,cas9)或编码rna引
导的dna核酸酶,如cas核酸酶(例如,cas9)的mrna或载体一起施用。
[0833]
在一些实施例中,提供了一种种治疗或预防气道的阻塞和/或窒息的方法,所述方法包括施用向导rna,所述向导rna包括seq id no:1-149的向导序列中的任何一个或多个向导序列。向导rna可以与rna引导的dna核酸酶,如cas核酸酶(例如,cas9)或编码rna引导的dna核酸酶,如cas核酸酶(例如,cas9)的mrna或载体一起施用。
[0834]
在一些实施例中,施用包括seq id no:1-149的向导序列中的任何一个或多个向导序列的grna以降低血浆、血清或血液中的缓激肽水平。grna可以与rna引导的dna核酸酶,如cas核酸酶(例如,cas9)或编码rna引导的dna核酸酶,如cas核酸酶(例如,cas9)的mrna或载体一起施用。
[0835]
在一些实施例中,施用包括seq id no:1-149的向导序列中的任何一个或多个向导序列的grna以降低血清或血浆中的缓激肽。grna可以与rna引导的dna核酸酶,如cas核酸酶(例如,cas9)或编码rna引导的dna核酸酶,如cas核酸酶(例如,cas9)的mrna或载体一起施用。
[0836]
在一些实施例中,包括表1的向导序列的grna与rna引导的dna核酸酶,如cas核酸酶一起诱导dsb,并且修复期间的非同源端连接(nhej)导致klkb1基因的突变。在一些实施例中,nhej导致一个或多个核苷酸的缺失或插入,这在klkb1基因中诱导移码或无义突变。
[0837]
在一些实施例中,施用本发明的向导rna(例如,在本文所提供的组合物中)降低了受试者的总激肽释放酶、前激肽释放酶和/或激肽释放酶的水平(例如,血清或血浆水平),并且因此预防缓激肽过度产生和累积。在一些实施例中,施用本发明的向导rna(例如,在本文所提供的组合物中)降低了受试者的激肽释放酶活性水平(例如,血清或血浆水平),并且因此预防缓激肽过度产生和累积。
[0838]
在一些实施例中,本文所提供的方法导致包含流体通过血细胞泄漏到组织的更少的发作。在一些实施例中,本文所提供的方法降低了增加器官组织肿胀的发作频率。在一些实施例中,施用本发明的向导rna(例如,在本文所提供的组合物中)降低了血管性水肿发作的频率或严重程度。
[0839]
在一些实施例中,受试者是哺乳动物。在一些实施例中,受试者是灵长类动物,例如人。
[0840]
在一些实施例中,提供了包括表1或表2中的向导序列中的任何一个或多个向导序列(例如,在本文所提供的组合物中)的向导rna的用途以制备用于治疗患有hae的人类受试者的药物。
[0841]
在一些实施例中,静脉内施用向导rna、组合物和调配物。在一些实施例中,通过输注施用向导rna、组合物和调配物。在一些实施例中,将向导rna、组合物和调配物施用到肝循环中。
[0842]
在一些实施例中,单次施用包括本文所提供的向导rna的组合物足以敲除蛋白质的表达。在其它实施例中,多于一次施用包括本文所提供的向导rna的组合物可能有益于最大化治疗效果。
[0843]
在一些实施例中,治疗减缓或停止hae疾病进展。
[0844]
在一些实施例中,治疗减缓或停止血管性水肿的进展。在一些实施例中,治疗使hae的症状变化改善、稳定或减缓。
[0845]
a.递送grna组合物
[0846]
脂质纳米颗粒(lnp)是众所周知的用于递送核苷酸和蛋白货物的方式并且可以用于递送本文所公开的向导rna、组合物或药物调配物。在一些实施例中,lnp递送核酸、蛋白质或与蛋白质一起的核酸。
[0847]
在一些实施例中,本发明包括一种用于将本文所公开的grna中的任何一个grna递送到受试者的方法,其中grna与lnp相关。在一些实施例中,grna/lnp还与cas9或编码cas9的mrna相关。
[0848]
在一些实施例中,本发明包括一种包括所公开的grna和lnp中的任何一个的组合物。在一些实施例中,组合物进一步包括cas9或编码cas9的mrna。
[0849]
在一些实施例中,lnp包括阳离子脂质。在一些实施例中,lnp包括十八碳-9,12-二烯酸(9z,12z)-3-((4,4-双(辛氧基)丁酰基)氧基)-2-((((3-(二乙基氨基)丙氧基)羰基)氧基)甲基)丙酯——也称为(9z,12z)-十八碳-9,12-二烯酸3-((4,4-双(辛氧基)丁酰基)氧基)-2-((((3-(二乙基氨基)丙氧基)羰基)氧基)甲基)丙酯或另一种可电离脂质。参见例如wo/2017/173054的脂质和其中描述的参考文献。在一些实施例中,lnp包括阳离子脂质胺与rna磷酸盐的约4.5、5.0、5.5、6.0或6.5的摩尔比(n:p)。在一些实施例中,术语阳离子和可电离在lnp脂质的上下文中是可互换的,例如,其中根据ph,可电离脂质是阳离子的。
[0850]
在一些实施例中,与本文所公开的grna缔合的lnp用于制备用于治疗疾病或病症的药物。
[0851]
电穿孔是众所周知的用于递送货物的方法,并且可以使用任何电穿孔方法来递送本文所公开的grna中的任何一种grna。在一些实施例中,电穿孔可以用于递送本文所公开的grna和cas9或编码cas9的mrna中的任何一个。
[0852]
在一些实施例中,本发明包括一种用于将本文所公开的grna中的任何一个grna递送到离体细胞的方法,其中grna与lnp相关或与lnp不缔合。在一些实施例中,grna/lnp或grna还与cas9或编码cas9的mrna缔合。
[0853]
在一些实施例中,本文所描述的单独或在一种或多种载体上编码的向导rna组合物在脂质纳米颗粒中调配或经脂质纳米颗粒施用;参见例如wo/2017/173054和wo2019/067992,所述文献的内容特此整体并入。
[0854]
在某些实施例中,本发明包括编码包括本文描述的向导序列中的任何一个或多个向导序列的向导rna中的任何一个向导rna的dna或rna载体。在一些实施例中,除了向导rna序列,载体还进一步包括不编码向导rna的核酸。不编码向导rna的核酸包含但不限于启动子、增强子、调节序列和编码rna引导的dna核酸酶的核酸,所述核酸酶可以是如cas9等核酸酶。在一些实施例中,载体包括编码crrna、trrna或crrna和trrna的一个或多个核苷酸序列。在一些实施例中,载体包括编码sgrna的一个或多个核苷酸序列和编码rna引导的dna核酸酶的mrna,所述核酸酶可以是cas核酸酶,如cas9或cpf1。在一些实施例中,载体包括编码crrna的一个或多个核苷酸序列、trrna以及编码rna引导的dna核酸酶的mrna,所述核酸酶可以是cas蛋白,如cas9。在一个实施例中,所述cas9来自酿脓链球菌(即,spy cas9)。在一些实施例中,编码crrna、trrna或crrna和trrna(其可以是sgrna)的核苷酸序列包括或由两侧是来自天然存在的crispr/cas系统的重复序列的全部或部分的向导序列组成。包括或由crrna、trrna或crrna和trrna组成的核酸可以进一步包括载体序列,其中载体序列包括或由与crrna、trrna或crrna和trrna一起的非天然发现的核酸组成。
[0855]
本说明书和示例性实施例不应视为是限制性的。出于本说明书和所附权利要求书的目的,除非另外说明,否则表示量、百分比或比例的所有数值和本说明书和权利要求书中使用的其它数值在所有情况下应理解为被术语“约”修饰到其尚未如此修饰的程度。因此,除非相反指出,否则以下说明书和所附权利要求书中阐述的数值参数是近似值,其可以根据寻求获得的期望性质而改变。至少,并且不尝试将等效原则的应用限制于权利要求的范围,每个数值参数应该至少根据所报告的有效数字的数量,并且通过应用常规的舍入技术来解释。
[0856]
注意,如在本说明书和所附权利要求中所使用的,单数形式“一个(a)”、“一种(an)”和“所述(the)”以及任何词语的任何单数使用包含复数指示物,除非明确和确切地限于一个指示物。如本文所使用的,术语“包含”和其语法变型旨在是非限制性的,使得列表中项目的叙述不排除可以替换或添加到所列项目的其它相似的项目。
[0857]
实例
[0858]
提供以下实例以说明某些公开的实施例,并且不应被解释为以任何方式限制本公开的范围。
[0859]
实例1:材料与方法
[0860]
1.1核酸酶mrna的体外转录(“ivt”)
[0861]
使用线性化质粒dna模板和t7 rna聚合酶通过体外转录产生含有n1-甲基假-u的封端和聚腺苷酸化酿脓链球菌(“spy”)cas9 mrna。含有t7启动子和转录序列的质粒dna(用于产生包括本文所描述mrna的mrna(关于cas9 orf,见下表5中的seq id no:501-516)通过在37℃下温育以在以下条件下用xbai完全消化线性化:200ng/μl质粒,2u/μl xbai(neb)以及1x反应缓冲液。通过在65℃下加热反应持续20分钟使xbai失活。使用二氧化硅最大旋转柱(大纪元生命科学(epoch life sciences))从酶和缓冲盐中纯化线性化质粒,并通过琼脂糖凝胶分析以确认线性化。将产生cas9 mrna的ivt反应在以下条件下在37℃下温育持续4小时:50ng/μl线性化质粒;gtp、atp、ctp和n1-甲基假-utp(trilink)中的每一种各2mm;10mm arca(trilink);5u/μl t7 rna聚合酶(neb);1u/μl鼠类rnase抑制剂(neb);0.004u/μl无机大肠杆菌(e.coli)焦磷酸酶(neb);以及1x反应缓冲液。在温育4小时后,添加turbo dnase(赛默飞世尔科技公司(thermofisher))到最终浓度为0.01u/μl,并且使反应温育另外的30分钟以去除dna模板。根据制造商的方案(赛默飞世尔科技公司)使用megaclear转录清除试剂盒从酶和核苷酸中纯化cas9 mrna。可替代地,用licl沉淀法纯化cas9 mrna,在一些情况下,在所述沉淀法之后进行通过切向流过滤的另外的纯化。通过测量260nm(纳米滴)下的吸光度来测定转录物浓度,并通过借助于生物分析仪(安捷伦)的毛细管电泳来分析转录物。
[0862]
表5:示例性cas9 mrna序列
[0863]
[0864]
[0865]
[0866]
[0867]
[0868]
[0869]
[0870]
[0871]
[0872]
[0873]
[0874]
[0875]
[0876]
[0877]
[0878]
[0879]
[0880]
[0881]
[0882]
[0883]
[0884]
[0885]
[0886]
[0887]
[0888]
[0889]
[0890][0891]
[0892]
1.2人klkb1向导设计和具有食蟹猴同源向导设计的人klkb1
[0893]
向导rna是针对靶向外显子1、2、3、4、5、6、7、8、9、10、11、12、13、14和15内的蛋白质编码区的人klkb1(ensg00000164344)设计的。向导rna是针对靶向外显子1、2、3、4、5、6、7、8、9、10、11、12、13、14和15内的蛋白质编码区的食蟹猴klkb1(ensmfat00000002355)设计的。上文提供了向导rna和对应的靶基因组坐标(表1)。
[0894]
1.2.cas9(mrna/蛋白质)和向导rna在体外递送
[0895]
1.2.1.细胞制备、在体外递送
[0896]
将原代人肝细胞(phh)(gibco公司(gibco),批次hu8296、hu8300和hu8284、hu8296、hu8290和hu8317)和原代食蟹猴肝细胞(pch)(gibco公司,批次cy367、cy400和10281011)在具有补充剂(gibco公司,目录cm7500)的肝细胞解冻培养基中解冻并重悬,随后进行离心。丢弃上清液,并将沉淀的细胞重悬在肝细胞平板接种培养基(william’s e培养基(william’s e medium)(英杰公司(invitrogen),目录号:a1217601)中,所述肝细胞平板接种培养基具有地塞米松(dexamethosone)+混合物补充剂、fbs内容物和平板接种补充剂(gibco公司,目录号:cm3000))。对细胞进行计数,并以30,000-35,000个细胞/孔(对于phh)和40,000-45,000个细胞/孔(对于pch)的密度平板接种于生物涂层胶原i涂覆的96孔板(赛默飞世尔科技公司,目录877272)上。使平板接种的细胞在37℃和5%co2气氛下的组织培养物温育箱中沉降和粘附,持续4-6小时。温育后,检查细胞是否形成单层,并用肝细胞维持培养基(具有维持补充剂的william’s e培养基(gibco公司,目录cm4000))或cellartis power初级hep培养基(高田公司(takada),目录y20020)洗涤一次。
[0897]
使用具有cas9蛋白的脂质体系统,例如或使用包括cas9 mrna和向导rna的lnp调配物将靶向klkb1的向导rna递送到细胞,如下文进一步所描述的。
[0898]
1.2.2.rnp转染
[0899]
rnp转染使用脂质体系统(lipofectamine rnaimax(赛默飞世尔科技公司,目录13778150)和crispr试剂(向导rna,cas9蛋白)以使核糖核蛋白(rnp)复合物跨细胞膜穿梭。
[0900]
对于利用双向导(dgrna)的研究,通过将等量的试剂混合并在95℃下温育持续2分钟并冷却到室温来对单独的crrna和trrna进行预退火。将由预退火的crrna和trrna组成的grna添加到反应缓冲液(optimem)中的spy cas9蛋白中以形成rnp复合物,并将形成的rnp复合物在室温下温育持续10分钟。用optimem稀释rnp复合物以制备1μm rnp复合物储备溶液。制备包含lipofectamine rnaimax和optimem的转染混合物并温育持续至少5分钟。将转染混合物添加到rnp复合物中并在室温下温育持续10分钟,并且然后将转染剂(转染混合物和rnp复合物)添加到细胞中。用含有spy cas9蛋白(10nm)、单独向导/示踪剂rna(10nm)和lipofectamine rnaimax(1.0μl/孔)和optimem的rnp复合物转染细胞。
[0901]
1.2.3.rnp电穿孔
[0902]
rnp电穿孔与细胞电穿孔系统(lonza 4d nucleofector
tm
试剂盒816b0346)和crispr试剂、grna和cas9蛋白一起使用以使核糖核蛋白(rnp)复合物跨细胞膜穿梭。
[0903]
对于利用dgrna的研究,通过将等量的试剂混合并在95℃下温育持续2分钟并冷却到室温来对单独的crrna和trrna进行预退火。
[0904]
对于利用sgrna的研究,通过将等量的100um sgrna在95℃下的水中温育持续2分钟,然后在冰上冷却持续5分钟来制备50um sgrna储备溶液。将sgrna添加到反应缓冲液
(20mm hepes,100mm kcl,1mm mgcl2,10%甘油,1mm dtt ph 7.5)中的spy cas9蛋白中以形成rnp复合物,并在室温下温育,持续10分钟。用含有spy cas9蛋白(2um)和grna(4um)以及lonza p3缓冲液(目录号:v4sp-3960)的rnp复合物电穿孔细胞(amaxa
tm
96孔shuttle
tm
,目录aam-1001s)。电穿孔后,将肝细胞平板接种培养基(will’s e,目录a12176-01)添加到细胞板中,将具有细胞的培养基转移到经胶原涂覆的板(康宁(corning)354407)。4-6小时后,将培养基更换为维持培养基(william’s e(gibco公司,目录a12176-01,批次2039733)和维持补充剂(gibco公司,目录a12176-01,批次2039733),在整夜为37℃的温度下温育过夜。
[0905]
1.2.4.含有sgrna和cas9 mrna的lnp调配物的制备
[0906]
通常,将脂质纳米颗粒组分以不同的摩尔比溶解在100%乙醇中。将rna货物(例如,cas9 mrna和sgrna)溶解在25mm柠檬酸盐、100mm nacl、ph 5.0中,从而导致rna货物的浓度为大约0.45mg/ml。实例2-10中所使用的lnp含有摩尔比分别为50:38:9:3的可电离脂质(十八烷基-9,12-二烯酸(9z,12z)-3-((4,4-双(辛氧基)丁酰基)氧基)-2-((((3-(二乙基氨基)丙氧基)羰基)氧基)甲基)丙酯,也称为(9z,12z)-十八烷基-9,12-二烯酸3-((4,4-双(辛氧基)丁酰基)氧基)-2-((((3-(二乙基氨基)丙氧基)羰基)氧基)甲基)丙酯)、胆固醇、dspc和peg2k-dmg。用以下调配lnp:脂质胺与rna磷酸盐(n:p)的摩尔比为约6,并且grna与mrna的重量比为1:2。实例2-10中所使用的lnp包括cas9 mrna和sgrna。
[0907]
使用利用乙醇中的脂质与两个体积的rna溶液和一个体积的水的冲击射流混合的交叉流技术制备lnp。通过混合交叉将乙醇中的脂质与所述两个体积的rna溶液混合。通过内联三通将第四水流与交叉的出口流混合(参见wo2016010840,图2)。将lnp在室温下保持持续1小时,并用水进一步稀释(大约1:1v/v)在平板盒(赛多利斯(sartorius),100kd mwco)上使用切向流过滤将经稀释的lnp浓缩,并且然后使用pd-10脱盐柱(ge)将缓冲液交换到ph 7.5的50mm tris、45mm nacl、5%(w/v)蔗糖(tss)中。然后使用0.2μm无菌过滤器过滤所得混合物。对最终lnp进行表征以测定包封效率、多分散指数和平均粒径。将最终lnp储存在4℃或-80℃下直到进一步使用。
[0908]
1.2.5.sgrna和cas9 mrna脂质转染
[0909]
cas9 mrna和grna的脂质转染使用预混合的脂质调配物。脂质转染试剂含有摩尔比分别为50:38:9:3的可电离脂质(十八烷基-9,12-二烯酸(9z,12z)-3-((4,4-双(辛氧基)丁酰基)氧基)-2-((((3-(二乙基氨基)丙氧基)羰基)氧基)甲基)丙酯,也称为(9z,12z)-十八烷基-9,12-二烯酸3-((4,4-双(辛氧基)丁酰基)氧基)-2-((((3-(二乙基氨基)丙氧基)羰基)氧基)甲基)丙酯)、胆固醇、dspc和peg2k-dmg。将此混合物在100%乙醇中重组,然后与rna货物(例如,cas9 mrna和grna)以摩尔比为约6.0的脂质胺与rna磷酸盐(n:p)混合。向导rna由商业供应商或使用标准的具有经修饰的核苷酸的体外合成技术化学合成。参见例如段落[00354],使用2小时的ivt反应时间并通过licl沉淀纯化mrna,随后进行切向流过滤,来通过如在wo2019/067910中所描述的ivt产生表5的cas9orf。用3%食蟹猴血清和重量比为1:1的grna与mrna进行脂肪感染。
[0910]
1.2.6.lnp转染
[0911]
如在实例1中所描述的,在lnp中调配靶向人klkb1的经修饰sgrna。如在实例1中所描述的,对原代人肝细胞进行平板接种。在用lnp处理之前,将细胞在37℃、5%co2下温育,
持续48小时。将lnp在含有3%胎牛血清(fbs)的培养基中在37℃下温育,持续10分钟。温育后,从细胞中吸出培养基,并将具有3%fbs和lnp的培养基的混合物添加到肝细胞中。在转染后72到96小时,收集一部分细胞并进行处理以进行ngs测序,如在实例1中所描述的。
[0912]
1.3.基因组dna分离
[0913]
在转染后48小时或72小时收获转染的phh和pch。根据制造商的方案,使用50μl/孔buccalamp dna提取溶液(epicentre,目录qe09050)或zymo的快速rna/dna提取试剂盒(目录r2130)从96孔板的每个孔中提取gdna。如本文所描述的,对所有dna样品进行pcr和后续ngs分析。
[0914]
1.4.下一代测序(“ngs”)和在靶切割效率分析
[0915]
为了定量地测定基因组中的靶位置处的编辑效率,利用下一代测序来鉴定通过基因编辑引入的插入和缺失的存在。在所关注的基因(例如,klkb1)内的靶位点周围设计pcr引物,并扩增所关注的基因组区。引物序列设计是按照所述领域的标准进行的。
[0916]
根据制造商的方案(依诺米那(illumina))执行另外的pcr以添加化学物质进行测序。在依诺米那miseq仪器上对扩增子进行测序。在消除具有低质量评分的读段后,将读段与人(例如,hg38)参考基因组进行比对。将含有读段的所得文件映射到参考基因组(bam文件),其中选择与所关注的靶区重叠的读段,并且计算野生型读段数相对于含有插入或缺失(“插入缺失”)的读段数。
[0917]
将编辑百分比(例如,“编辑效率”或“编辑百分比”)定义为具有插入或缺失(“插入缺失”)的序列读段的总数占序列读段的总数(包含野生型)。
[0918]
使用生化测定法(参见例如cameron等人,《自然方法(nature methods.)》6,600-606;2017)来发现通过靶向klkb1的cas9切割的潜在的脱靶基因组位点。用cas9和sgrna的体外组装核糖核蛋白(rnp)消化来自细胞的经纯化的基因组dna(gdna),以诱导在与sgrna间隔序列同源的在靶位点和潜在脱靶位点处的dna切割。gdna消化后,用衔接子连接游离gdna片段端以促进经编辑的片段富集和ngs文库构建。对ngs文库进行测序并通过生物信息学分析,分析读段以确定游离dna端的基因组坐标。然后将人基因组中具有读段的累积的位置注释为潜在脱靶位点。
[0919]
在已知的脱靶检测测定中,如上文所使用的生化测定,通常通过设计回收大量潜在脱靶位点,以便在其它环境中,例如在所关注的原代细胞中可以验证的潜在位点“广撒网”。例如,生化测定通常会过度表示潜在脱靶位点的数量,因为所述测定利用了不受细胞环境影响的纯化高分子量基因组dna,并且依赖于所使用的cas9 rnp的剂量。因此,使用对所鉴别的潜在脱靶位点进行靶向测序来验证通过这些测定鉴别的潜在脱靶位点。
[0920]
在一种靶向测序方法中,将cas9和所关注的sgrna(例如,具有潜在脱靶位点的sgrna)引入到phh或pch细胞。然后裂解细胞,并使用侧接潜在脱靶位点的引物生成用于ngs分析的扩增子。在一定水平上鉴定插入缺失可以用于验证潜在脱靶位点,而在潜在脱靶位点处发现的插入缺失的缺少可能指示所利用的脱靶测定中出现假阳性。
[0921]
用此测定法测试了示出靶插入缺失活性的向导的潜在脱靶基因组切割位点。在脱靶切割位点处的具有统计相关插入缺失的基因座处手动检查修复结构以验证修复结构。
[0922]
1.5通过定量pcr进行的转录物分析
[0923]
执行定量pcr以评估klkb1转录物水平。为了分离mrna,使用凯杰公司(qiagen)
rneasy迷你试剂盒(凯杰公司,目录74106)。根据制造商的方案完成rneasy迷你试剂盒程序。
[0924]
使用nanodrop 8000(赛默飞世尔科技公司,目录nd-8000-gl)对rna进行定量。根据制造商的方案完成rna定量程序。在使用前将rna样品储存在-20℃下。
[0925]
使用taqman rna到ct一步法(rna-to-ct 1-step)试剂盒(赛默飞世尔科技公司,目录4392938)创建pcr反应。根据制造商的方案完成反应设置。可替代地,使用细胞到ct一步法(cells-to-ct 1-step)taqman试剂盒(赛默飞世尔科技公司,目录a25603)生产qpcr样品。将靶向人或食蟹猴klkb1的定量pcr探针(赛默飞世尔科技公司,目录4351372,转录物通用基因id hs01111828_m1;赛默飞世尔科技公司,目录4331182,转录物通用基因id hs00168478_m1),内部对照ppib(赛默飞世尔科技公司,目录4351372,转录物通用基因id hs00168719_m1;赛默飞世尔科技公司,目录4331182,转录物通用基因id mf02802985_m1),内部对照gapdh(赛默飞世尔科技公司,目录4351372,转录物通用基因id hs02786624_g1),以及内部对照18s(赛默飞世尔科技公司,目录4319413e)在pcr反应中使用。根据制造商的方案,使用steponeplus实时pcr系统(赛默飞世尔科技公司,目录4376600)进行实时pcr反应和转录物定量。
[0926]
使用从steponeplus实时pcr系统确定的ct值提供klkb1 mrna的双δct分析。与klkb1的值相比,计算每个样品内的内部对照的ct值的双δct值。基于每个序列的双δct值确定表达变化倍数。
[0927]
1.6.通过elisa对组织培养基进行蛋白质分析
[0928]
如前所述转染phh或pch。从转染和平板接种(96孔板)后三天开始,每两天更换一次细胞上的培养基。转染后七到十天,从细胞中取出培养基,并且然后用100μl william’s e培养基或cellartis power初级hep培养基(高田公司,目录y20020)替换。二十四到四十八小时后,收获培养基并在-20℃下储存。使用检测前激肽释放酶和激肽释放酶(也称为总激肽释放酶)的前激肽释放酶elisa试剂盒(艾博抗公司,目录ab202405)测定总分泌的klkb1蛋白水平。使用制造商的方案制备试剂盒试剂和标准品。在运行elisa之前,在室温下解冻冷冻培养基,并在1000rpm下离心持续1分钟以沉淀碎片,然后置于冰上。对于elisa,用样品稀释液ns测定稀释液将10到40μl的培养基稀释到总体积为50ul。根据制造商的方案完成elisa程序。在spectramax m5酶标仪上读取板。总激肽释放酶水平由softmax pro软件版本6.4.2使用标准曲线的四项参数的逻辑曲线拟合计算。当与用对照试剂或未经处理的样品处理的孔相比时,测定用klkb1试剂处理的细胞的总分泌前激肽释放酶蛋白的减少。
[0929]
1.6.1通过elisa对血清进行蛋白质分析
[0930]
使用以下程序在人源化小鼠中测量血清前激肽释放酶水平。在给药后六到七天,在异氟烷麻醉下通过心脏穿刺抽血对动物实施安乐死。将血液收集到血清分离器管中,并使在室温下凝结持续2小时,然后在9000g下旋转10分钟之前以分离血清。将样品在-20℃下储存直至分析。
[0931]
使用检测前激肽释放酶和激肽释放酶(也称为总激肽释放酶)的人前激肽释放酶elisa试剂盒(艾博抗公司,目录ab202405)测定前激肽释放酶蛋白水平。简而言之,在添加到elisa板之前,用试剂盒样品稀释液将血清连续稀释到1:500或1:1000倍的最终稀释度。测定根据制造商的方案进行。在clariostar酶标仪(bmg labtech公司(bmg labtech))上读
取板。前激肽释放酶水平由mars软件使用标准曲线的四项参数的逻辑曲线拟合计算。当与用对照试剂或未经处理的样品处理的孔相比时,测定用klkb1试剂处理的细胞的总分泌前激肽释放酶蛋白的减少。
[0932]
1.6.2.通过蛋白质印迹分析蛋白质
[0933]
如下文进一步描述的,将phh用lnp处理,所述lnp用来自表1的选择向导rna调配。将lnp在37℃下,在含有3%fbs或食蟹猴血清的cellartis power初级hep培养基(高田公司,目录y20020)中温育,持续10分钟。温育后,将lnp添加到人肝细胞中。从转染后三天开始,每两天更换一次细胞上的培养基。转染后十到十四天,对于96孔板中的细胞,去除培养基并将细胞用50μl/孔ripa缓冲液(波士顿生物产品公司(boston bio products),目录bp-115)和新添加的蛋白酶抑制剂混合物裂解,所述蛋白酶抑制剂混合物由完整的蛋白酶抑制剂混合物(西格玛,目录11697498001)、1mm dtt以及每30,000到45,000个细胞250u/ml benzonase(emd密理博公司(emd millipore),目录71206-3)组成。将细胞在冰上保持30分钟,此时添加nacl(最终浓度为1m)。将细胞裂解物充分混合并在冰上保留30分钟。将全细胞提取物(“wce”)转移到pcr板并离心以沉淀碎片。布拉德福德测定(伯乐公司(bio-rad),目录500-0001)用于评估裂解物的蛋白质含量。根据制造商的方案完成布拉德福德测定程序。在使用前将提取物储存在-20℃下。
[0934]
执行蛋白质印迹来评估klkb1蛋白水平。将裂解物与laemmli缓冲液(波士顿生物产品公司,目录bp-111r)混合,并在95℃下变性10分钟。根据制造商的方案,使用nupage系统在4-12%双tris凝胶(赛默飞世尔科技公司,目录np0323box)上运行蛋白质印迹,随后将其湿转移到0.45μm硝酸纤维膜(伯乐公司,目录1620115)上。在转移之后,用水彻底冲洗膜并用ponceau s溶液(波士顿生物制品公司,目录st-180)染色以确认完全和均匀转移。在室温下,在实验室摇杆上使用含5%干乳汁的tbs将印迹封闭,持续30分钟。用tbst冲洗印迹并在tbst中以1:1000用兔α-激肽释放酶单克隆抗体(艾博抗公司,目录ab124938)进行探测。对于具有体外细胞裂解物的印迹,在tbst中以1:2500将gapdh用作加载对照物(诺伟思公司(novus),目录nb600502),并将其与klkb1初级抗体同时温育。温育后,将印迹在tbst中冲洗3次,每次5分钟。使用licor odyssey系统通过光密度法对印迹进行可视化和分析。
[0935]
1.6.3.基于电化学发光的血浆激肽释放酶水平检测
[0936]
使用mesoscale discovery公司(mesoscale discovery,msd)的电化学发光检测平台通过免疫测定测量样品中的血浆激肽释放酶水平。96孔msd标准板(目录号:l15xa)涂覆有25或40μl的浓度为1μg/ml的小鼠激肽释放酶单克隆捕获抗体(ls生物公司(ls-bio),ls-c38308),并在4℃下过夜。第二天,洗涤细胞,并且然后用150μl的3%阻断剂-a(msd,目录号:r93aa)阻断,并在室温下在设定为700rpm的摇床上温育,持续1小时。洗涤之后,将用于测定激肽释放酶浓度的样品与内部制备的已知浓度的人激肽释放酶标准品一起添加到孔中,并在室温下在设定为700rpm的摇床上温育,持续2小时。将样品和标准品两者任选地用0.05%吐温20稀释在1%阻断剂-a中。
[0937]
洗涤之后,添加25μl的检测抗体溶液(在具有0.05%吐温20的1%阻断剂-a中,1ug/ml的lsbio#c185168和500ug/ml的msd#r32ag),并且在室温下温育,持续1小时。洗涤板并将150μl msd黄金读取缓冲液(mesoscale discovery公司,目录号:r92tg)添加到每个孔中。使用quickplex sq 120(mesoscale discovery公司)读取板。在不同步骤之间,用具有
0.05%吐温20的pbs洗涤板3次。
[0938]
1.7.血浆激肽释放酶活性的荧光分析
[0939]
使用荧光法sensolyte rh110血浆激肽释放酶活性测定试剂盒(anaspec公司(anaspec cat),目录号:as-72255)测量样品,如非人灵长类动物(nhp)样品中的总血浆激肽释放酶活性水平。在96孔板中通过混合等量的冷氯仿与k2edta nhp血浆,进行氯仿预处理以抑制c1抑制剂活性。然后将板在16,000x g下在4℃下离心持续5分钟,并从顶层中小心地收集10ul的经处理的血浆。在96孔黑色微孔板中,将10ul的预处理的血浆与30ul的测定缓冲液、10ul的血浆前激肽释放酶激活剂和50ul的底物混合,所有这些均在试剂盒中提供并根据试剂盒方案制备。荧光测量在ex/em=490nm/520nm时立即开始,在spectramax m5酶标仪上每隔5分钟读取一次,持续1小时。将给定处理后血浆样品的动力学荧光读数线性部分的斜率与来自同一动物的处理前血浆样品的斜率进行比较,以计算基础%。
[0940]
1.7.1基于电化学发光的非人灵长类动物中血浆激肽释放酶水平的检测
[0941]
使用mesoscale discovery(msd)的电化学发光检测平台通过免疫测定测量非人灵长类动物(nhp)中的血浆激肽释放酶水平。96孔msd标准板(目录号:l15xa)涂覆有40μl的浓度为1μg/ml的小鼠激肽释放酶单克隆捕获抗体(ls生物公司,ls-c38308),并在4℃下在pbs中过夜。第二天,洗涤细胞,并且然后用150μl的3%阻断剂-a(msd,目录号:r93aa)阻断,并在室温下在设定为700rpm的摇床上温育,持续1小时。洗涤之后,将用于测定激肽释放酶浓度的nhp样品与内部制备的已知浓度的nhp激肽释放酶标准品一起添加到孔中,并在室温下在设定为700rpm的摇床上温育持续2小时。将样品和标准品两者用0.05%吐温20稀释在1%阻断剂-a中。
[0942]
洗涤之后,添加25μl的检测抗体溶液并在室温下温育持续1小时。洗涤板并将150μl msd黄金读取缓冲液(mesoscale discovery公司,目录号:r92tg)添加到每个孔中。使用quickplex sq 120(mesoscale discovery公司)读取板。在不同步骤之间,用具有0.05%吐温20的pbs洗涤板3次。
[0943]
1.8血管渗透性测定
[0944]
伊文思蓝血管渗透性测定是一种已建立的水肿和血管渗漏模型,可用作hae研究中的模型(参见例如,bhattacharjee等人,2013)。所述测定基于在试验动物(通常是小鼠)中注射伊文思蓝(一种白蛋白结合染料)。在生理条件下,内皮对白蛋白是不可渗透的,因此白蛋白结合的伊文思蓝仍然限制于血管内。在促进血管渗透性增加的病理条件下,可以容易地定性观察伊文思蓝的外渗,例如,通过静脉注射后小鼠的耳、脚和鼻子出现蓝色,或通过测量掺入到组织,例如肠中的染料来定量地观察。
[0945]
使用huklkb1小鼠,开发了血管渗透性模型以评估klkb1编辑缓解过度缓激肽产生的影响的潜力(bhattacharjee等人,2013)。以总rna剂量为0.03mg/kg、0.1mg/kg和0.3mg/kg的剂量反应施用靶向sgrna和cas9 mrna的经修饰的klkb1。将另外的组用0.3mg/kg的非靶向lnp对照组和tss媒剂对照进行处理。给药后十三天,使用2.5mg/kg腹腔内注射的血管紧张素转换酶(ace)抑制剂卡托普利(captopril)诱导血管渗透性。15分钟后,通过静脉内尾注射施用伊文思蓝染料(30mg/kg)和葡聚糖硫酸盐(0.3mg/kg)的混合物。在此注射后15分钟对动物实施安乐死,并通过clariostar酶标仪(bmg labtech公司)在600nm的吸光度下通过光密度(od)来评估染料是否外渗到结肠中。收集肝脏和血清以分别定量huklkb1基因
编辑和激肽释放酶蛋白。
[0946]
实例2:筛选和体外向导表征
[0947]
2.1.筛选靶向人klkb1的双向导rna(dgrna)
[0948]
靶向人klkb1的向导作为双向导rna制备,并通过转染到如在实例1中所描述的原代人肝细胞(phh)和原代食蟹猴肝细胞(pch)中进行评估。如在实例1中所描述的,在处理后48小时裂解细胞以进行ngs分析。对表6中所示出的向导进行测试。
[0949]
表6.人和食蟹猴中的双向导和单向导
[0950]
[0951]
[0952][0953]
在两个单独的组的phh和pch群体中测定dgrna的编辑。上述表6中列出了向导序列的筛选数据。表7a和图1a-1b示出了在原代人肝细胞(phh)(n=2)中以及表7b和图1c-1d示出了在原代食蟹猴肝细胞(pch)(n=2)中与spy cas9蛋白共转染的靶向向导的klkb1的编辑百分比。
[0954]
表7a和7b中用星号(*)标记了组2中表现最好的向导rna和对应的编辑数据。当进行比较时,这些组被确定为高度相关(spearman r=0.985)。
[0955]
表7a:递送到原代人肝细胞的双向导的klkb1编辑数据:引物组1和2
[0956]
[0957]
[0958][0959]
*“选定的dgrna”,即,被测向导rna的子集
[0960]
表7b:递送到原代食蟹猴肝细胞的crrna的klkb1编辑数据:组1和2
[0961]
[0962][0963]
*“选定的dgrna”,即,被测向导rna的子集
[0964]
2.1.1 phh和pch中sgrna的交叉筛选,编辑
[0965]
将选定的靶向klkb1的向导序列制备为sgrna,并在phh和pch中进一步评估。如在实例1中所描述的,制备phh和pch(gibco公司,批次hu8298),并用rnp转染。如在实例1中所描述的,分别在处理后48小时和72小时时裂解细胞以进行ngs分析。表8a和图2a-2b示出了phh中的编辑百分比以及表8b和图2c-2d示出了pch中的编辑百分比。
[0966]
表8a:递送到原代人肝细胞的sgrna的klkb1编辑数据:组1和2
[0967]
[0968]
[0969][0970]
*“选定的dgrna”,即,被测向导rna的子集
[0971]
表8b:递送到原代食蟹猴肝细胞的sgrna的klkb1编辑数据:组1和2
[0972]
[0973][0974]
*“选定的sgrna”,即,被测向导rna的子集
[0975]
2.2.原代人肝细胞(phh)中sgrna的筛选、编辑和蛋白质敲低
[0976]
如在实例1中所描述的那样单独地平板接种三个phh批次(hu8296、hu8300和hu8284),并在脂质转染之前在37℃、5%co2下对其进行温育,持续24小时。在总体积为11.4μl的水中制备6.88μl的10μm sgrna向导和4.5μl的500ng/μl cas9 mrna的混合物。将在实例1中所描述的脂质转染试剂解冻到室温。将4.8μl的50mm柠檬酸钠/200mm nacl(ph 5)、4.8μl的脂质转染试剂和54μl的分子级水依次添加到向导/cas9 mrna混合物中,以使每个样品的总体积为75μl。在添加到细胞之前,将脂质转染样品与含有3%fbs或食蟹猴血清的培养基、william's e或cellartis power初级hep培养基(高田公司,目录y20020)在37℃下预温育持续10分钟。用10μl制备的含有300ng的cas9 mrna和302ng向导sgrna的脂质转染样品转染细胞。
[0977]
如在实例1中所描述的,在转染后72小时裂解细胞以进行ngs分析。
[0978]
对于用于通过elisa进行分泌蛋白分析或通过蛋白质印迹进行细胞内蛋白分析的细胞,在转染后72小时,吸出培养基并用cellartis power初级hep培养基(高田公司,目录y20020)替换。每两天吸出并更换一次培养基。对于用于测定分泌蛋白减少的样品,从孔中吸出培养基并用在收获之前温育持续24-48小时的新鲜培养基替换。收集培养基并转移到96孔pcr板上,并且在用于测定之前将其储存在-20℃下。
[0979]
表8c和图3a-3b均示出基于三个phh批次的转染的编辑百分比和分泌的klkb1蛋白水平。以phh批次对二十个向导进行比较,并确定高度相关(spearman r》0.8),如在图3c-3e中所示出的。
[0980]
表8c.phh中klkb1插入缺失频率和分泌的klkb1蛋白水平
[0981]
[0982][0983]
2.3.phh中sgrna的筛选
[0984]
如实例1所描述的,用cas9 mrna和sgrna转染原代人肝细胞(phh)。如在实例1中所描述的,在转染后72小时裂解细胞并进行ngs分析。
[0985]
对于包括表1的两个引物组的向导序列的sgrna,确定了编辑百分比。两个数据组中的每个向导的平均编辑百分比在表9a和图4a-4b中示。
[0986]
表9a.klkb1在原代人肝细胞中的编辑数据
[0987]
[0988]
[0989][0990]
*“选定的sgrna”,即,被测向导rna的子集
[0991]
2.3.1 pch中sgrna的筛选
[0992]
使用量逐渐增大的制备的脂质转染样品如在实例1中所描述的那样用cas9 mrna和sgrna转染原代食蟹猴肝细胞(pch),以测定剂量响应效应。在转染后72裂解细胞并且如在实例1中所描述的那样进行ngs分析。使用两个引物组扩增和检测插入缺失,从而确定了包括表1中向导序列的sgrna的编辑百分比。两个数据组中的每个向导的平均编辑百分比在表9b和图4c-4d中示出。
[0993]
表9b中用星号(*)标记了组1和2中选定的向导rna和对应的编辑数据。当进行比较时这些数据组被确定为高度相关(spearman r=0.987)。
[0994]
表9b.klkb1在原代食蟹猴肝细胞中的编辑数据
[0995]
[0996]
[0997][0998]
*“选定的sgrna”,即,被测向导rna的子集
[0999]
实例3:剂量响应测定
[1000]
3.1在4点剂量响应测定中交叉筛选pch和phh中的sgrna
[1001]
使用来自实例2.2中所描述的phh向导筛选的16个向导,在剂量响应测定中在phh和pch中测试靶向人klkb1和食蟹猴匹配的sgrna序列的经修饰的sgrna。如在实例2.2中所描述的,制备包含cas9 mrna和sgrna的脂质转染样品。如在实例1中所描述的,对原代人和食蟹猴肝细胞进行平板接种。在用脂质转染样品处理之前,将两种细胞系在37℃、5%co2下温育,持续48小时。将脂质转染样品在37℃下,在含有3%fbs的cellartis power初级hep培养基(高田公司,目录y20020)中温育持续10分钟。
[1002]
在4点剂量响应测定中,在温育后将脂质转染样品添加到人肝细胞或食蟹猴肝细胞中。转染后120小时裂解phh并且转染后168小时裂解pch,并对gdna进行定量pcr以进行ngs分析,如在实例1中所描述的。
[1003]
phh细胞中浓度为0.4nm、3.3nm、30nm和90nm的sgrna的插入缺失频率在表10和图5a-5b中示出。通过elisa测定的sgrna的分泌的klkb1蛋白水平在表10和图5c-5d中示出。
[1004]
表10:phh中klkb1编辑数据和分泌的klkb1蛋白水平
[1005]
[1006][1007]
pch细胞中浓度为0.4nm、10nm、30nm和90nm的sgrna的插入缺失频率在表11和图5e-5f中示出,通过elisa测定的sgrna的分泌的klkb1蛋白水平在表11和图5g-5h中示出。
[1008]
表11:pch中klkb1编辑数据和分泌的klkb1蛋白水平
[1009]
[1010][1011][1012]
插入缺失频率和分泌的klkb1蛋白水平在phh和pch两者中示出为呈负相关,如在图5i-5j中所示出的。
[1013]
3.2在7点剂量响应测定中交叉筛选phh和pch中的sgrna
[1014]
在剂量响应测定中在phh和pch中测试了靶向人klkb1 sgrna序列的sgrna的脂质纳米颗粒(lnp)调配物。
[1015]
如在实例1中所描述的,调配lnp。对最终lnp进行表征以根据上文所提供的分析方法测定包封效率、多分散指数和平均粒径。
[1016]
如在实例1中所描述的,对原代人和食蟹猴肝细胞进行平板接种。在用lnp处理之前,将两种细胞系在37℃下用5%co2温育,持续24小时。将lnp在含有3%fbs的培养基中在37℃下温育持续10分钟。在温育后,在7点3倍剂量响应曲线中,将lnp添加到人肝细胞或食蟹猴肝细胞中。转染后72小时裂解细胞,并对gdna进行定量pcr以进行ngs分析,如在实例1中所描述的。
[1017]
表12示出了浓度为0.04nm、0.13nm、0.40nm、1.19nm、3.58nm、10.75nm和32.25nm的sgrna的插入缺失频率,以及phh在图6a-b中的对应的剂量响应曲线和pch在图6c-d中的对应的剂量响应曲线。
[1018]
表12:在体外靶向klkb1的lnp的插入缺失频率和分泌的klkb1蛋白
[1019]
[1020]
[1021]
[1022][1023]
3.3在7点剂量响应测定中交叉筛选pch和phh中的引导sgrna
[1024]
在剂量响应测定中在phh和pch中测试了经修饰的sgrna的脂质纳米颗粒(lnp)调配物。
[1025]
此研究中使用了实例3.2中所描述的lnp。
[1026]
在温育后,在7点,3倍剂量响应曲线中,将lnp添加到人肝细胞或食蟹猴肝细胞中。转染后72小时裂解细胞,并对gdna进行定量pcr以进行ngs分析,如在实例1中所描述的。对于klkb1蛋白分析,在转染后第8天裂解细胞,并对全细胞提取物进行蛋白质印迹分析,如在实例1中所描述的。
[1027]
phh和pch在0.04nm、0.13nm、0.40nm、1.19nm、3.58nm、10.75nm和32.25nm浓度下的sgrna的插入缺失频率在表13中示出以及剂量响应曲线数据在图7a和7b中展示。通过elisa测定的sgrna的分泌的klkb1蛋白水平在表13和图7c(对于phh)以及在图7d(对于pch)中示出。
[1028]
表13.在体外靶向klkb1的lnp的插入缺失频率和分泌的klkb1蛋白
[1029]
[1030][1031]
如在实例1中所描述的,对于klkb1蛋白分析,用人klkb1向导g012267转染phh,并在转染后第8天裂解细胞,并对全细胞提取物进行蛋白质印迹分析。将跨7点剂量响应曲线的人klkb1蛋白水平与未经处理的对照进行比较,并归一化为gapdh,在图7e中示出。
[1032]
实例4-klkb1向导的脱靶分析
[1033]
使用实例1中所描述的生化方法测定靶向klkb1的cas9切割的潜在脱靶基因组位点。对基于上文所描述的实验结果选择的向导进行了潜在脱靶基因组切割位点的测试。评估了十六个靶向向导的klkb1在16nm浓度下针对来自hek293细胞的基因组dna的脱靶基因组切割(atcc,目录号crl-1573)。实验中包含klkb1向导g012267和具有已知脱靶曲线的对照向导(g000644靶向emx1,已检测到281个脱靶位点;g00045靶向vegfa,已检测到6602个脱靶位点);frock等人,2015,tsai等人,2015))评估了在64nm浓度下针对来自汇集的人pbmc的基因组dna的脱靶基因组切割。表14a中示出了使用来自hek 293细胞的基因组dna在生化测定中检测到的潜在脱靶位点的数量。表14b中示出了使用来自pbmc的基因组dna在生化测定中检测到的潜在脱靶位点的数量。与文献中所提到的emx1向导和vegfa向导的脱靶位点数量相比,记录了通过本文所进行的测定法检测到的脱靶位点的百分比。
[1034]
表14a.hek293细胞基因组dna的生化脱靶分析
[1035]
向导id靶向导浓度(nm)脱靶位点g012253klkb116122g012259klkb11677g012260klkb116153g012267klkb116136g012278klkb116153
g012279klkb1160g012280klkb116292g012293klkb116126g012294klkb116132g012298klkb116155g012303klkb11645g012304klkb11642g012305klkb11648g012308klkb116116g012321klkb116107g012323klkb11614
[1036]
表14b.人pbmc基因组dna的生化脱靶分析
[1037]
向导靶脱靶位点(百分比*)g012267klkb161g000644emx1242/281(86%)g000645vegfa4431/6602(67%)
[1038]
*百分比是相对于向导靶位点中的每个向导靶位点的已知脱靶位点数量。
[1039]
实例5.用于验证潜在脱靶位点的靶向测序
[1040]
基于上述实验选择klkb1向导以进行进一步评估。实例1中所描述的靶向脱靶方法用于评估与这些向导相关的潜在脱靶的靶插入缺失活性。在实验中测试的脱靶位点通过实例4中所描述的生化测定实验或实例1中所描述的生物信息学预测来鉴定。
[1041]
在此实验中,评估了3种靶向人klkb1的sgrna。如在实例1中所描述的,培养phh并用包括cas9 mrna和所关注的sgrna(例如,具有用于评估的潜在脱靶位点的sgrna)的lnp转染。如在实例1中所描述的,从phh中分离基因组dna,并进行ngs和靶向脱靶分析。
[1042]
表15a中示出了在测定中评估的潜在脱靶位点的数量,以及通过测定成功表征的脱靶位点的数量,以及通过手动检查验证的位点的数量。
[1043]
表15.靶向脱靶分析
[1044]
向导id评估的脱靶表征的脱靶验证的脱靶g0122602232065g0122671811711g0122933603474
[1045]
实例6.hu klkb1小鼠模型中人源化klkb1基因座的体内编辑
[1046]
此研究使用表达人klkb1蛋白的人源化小鼠(hu klkb1小鼠模型)。hu klkb1小鼠模型包括人源化klkb1基因座,其中小鼠klkb1从起始密码子到终止密码子的区被对应的人基因组序列替换。对动物称重并以特异于个体体重的体积给药。共有5组(n=4,2只雄性小鼠和2只雌性小鼠)。
[1047]
基于以每千克体重10ml的体积的总rna货物,通过侧尾静脉以0.3mg/kg给药含有经修饰的sgrna(g12260、g12267、g12293、g12303和g12321)和cas9 mrna的lnp。对最终lnp进行表征以根据实例1中所描述的分析方法测定包封效率、多分散指数和平均粒径。在lnp
施用后的第11天,对小鼠实施安乐死,并收集肝脏组织进行dna提取。使用zymo research公司bashing bead裂解架(zymo research bashing bead lysis rack)裂解组织,并根据制造商的方案使用zymo research公司dna提取试剂盒(zymo research dna extraction kit)提取dna。对所提取的dna进行pcr以提交测序。
[1048]
将血液收集到血清分离器管中,并使在室温下凝结持续2小时,随后离心。对在在96孔板中等分并稀释血清进行elisa。
[1049]
在经处理的小鼠中观察到的编辑在图8a和表16a中示出。
[1050]
表16a.hu klkb1小鼠模型中的体内编辑数据
[1051]
向导编辑%编辑sdng1226032.910.964g1226772.831.174g1229343.055.594g1230314.385.604g1232135.5311.114
[1052]
如在实例1所描述的,使用elisa测定法测量给药前后的血清人klkb1蛋白水平。结果示出于表16b和图8b中。
[1053]
表16b.hu klkb1小鼠模型中分泌的klkb1蛋白水平
[1054][1055][1056]
如在实例1中所描述的,使用基于电化学发光的阵列(msd)测量来自样品中的血清人klkb1蛋白水平,并且与基线水平进行比较。结果示出于表17和图8c中。
[1057]
表17.体内klkb1蛋白水平
[1058]
向导剂量(mpk)给药前sd给药后sd血清kd%ng122600.310.440.436.840.09384g122670.310.590.37blod*-97**2g122930.310.740.243.920.04644g123030.313.860.347.780.3535**4g123210.38.380.13.920.16554
[1059]
*低于检测限制;**近似值
[1060]
如在实例1中所描述的,通过定量pcr测量每个序列的klkb1 mrna水平,并且在表18和图8d中示出。如在实例1中所描述的,通过蛋白质印迹分析确认蛋白质减少。
[1061]
表18.qpcr结果
[1062]
向导变化倍数sdng122601.200.354g122670.510.414
g122930.730.224g123031.100.234g123211.180.414tss1.010.172
[1063]
实例7.人klkb1基因在hu klkb1小鼠模型中的体内编辑活性
[1064]
此研究使用实例6中所描述的人源化klkb1小鼠,并使用相同的方案制备。共有5组(n=5,2只雄性小鼠和3只雌性小鼠,反之亦然)。通过侧尾静脉以0.3mg/kg给药含有经修饰的sgrnas和编码cas9蛋白的mrna的lnp,并如在实例6中所描述的进行表征。
[1065]
在lnp施用后第13天,对小鼠实施安乐死。如在实例6中所描述的处理肝脏组织和血液以进行测序和elisa分析。
[1066]
表19和图9a-9d分别示出了klkb1编辑的水平、血清前激肽释放酶蛋白(使用检测前激肽释放酶和激肽释放酶两者的elisa检测)(ug/ml)、前激肽释放酶蛋白占经处理的小鼠中的对照tss中klkb1蛋白水平的百分比,以及肝脏编辑百分比与前激肽释放酶蛋白百分比的相关性。测试g012323和g012253向导;然而,由于ngs方法的失败,未检测到编辑。
[1067]
表19.hu-klkb1小鼠模型中某些向导的编辑百分比和血清前激肽释放酶
[1068]
[1069][1070]
实例8.hu klkb1小鼠模型中klkb1基因编辑的体内剂量响应
[1071]
此研究使用实例6中所描述的人源化小鼠,并使用相同的方案制备。共有5组(n=5,2只雄性小鼠和3只雌性小鼠,反之亦然)。以每kg体重0.3、0.1、0.03和0.01mg的给药含有g12267和编码cas9蛋白的mrna的lnp,并如在实例6中所描述的进行表征。
[1072]
在lnp施用后第13天,对小鼠实施安乐死。如在实例6中所描述的处理肝脏组织以进行dna测序。如在实例6中所描述的处理血液,并通过检测前激肽释放酶和激肽释放酶(也称为总激肽释放酶)的elisa测量分泌的人前激肽释放酶,如在实例1中所描述的。
[1073]
对于rna分析,使用zymo research公司bashing bead裂解架裂解肝脏组织,并根据制造商的方案使用凯杰公司rneasy迷你试剂盒(凯杰公司,目录74106)提取rna。使用nanodrop 8000(赛默飞世尔科技公司,目录nd-8000-gl)对rna进行定量。在使用前将rna样品储存在-20℃下。
[1074]
使用superscript iii铂一步法qrt pcr试剂盒(superscript iii platinum one-step qrt-pcr kit)(英杰公司,目录11732-088)创建pcr反应。在反应中使用了靶向hu klkb1的定量pcr探针和内部对照ms ppib。根据制造商的说明进行定量pcr测定,按缩放到适当的反应体积,并使用上文所规定的hu klkb1和ms ppib p探针。根据制造商的方案,使用steponeplus实时pcr系统(赛默飞世尔科技公司,目录4376600)进行实时pcr反应和转录物定量。
[1075]
使用标准曲线定量hu klkb1 mrna,所述标准曲线从来自媒剂对照组的20ng/ul汇集的mrna开始,五个另外的3倍稀释液以0.06ng/ul结束。ct值由steponeplus实时pcr系统确定。如在实例1中所描述的,通过elisa测定用klkb1试剂处理的细胞的总分泌的人前激肽释放酶蛋白的减少。
[1076]
表20和图10示出了编辑百分比、血清前激肽释放酶水平占tss媒剂对照处理的小鼠的百分比,以及mrna转录物水平占tss媒剂对照处理的小鼠的百分比。
[1077]
表20hu klkb1小鼠模型中的编辑百分比、klkb1 mrna(基础水平的%)和血清前激肽释放酶蛋白水平(基础水平的%)
[1078][1079]
实例9.血管渗漏研究
[1080]
进行了一项研究以评估人源化小鼠中klkb1基因编辑、总激肽释放酶蛋白表达和血管渗漏。此研究中使用了实例1中所描述的人源化小鼠。共有6组(n=5,每组2只雄性小鼠,3只雌性小鼠)。对动物称重并以特异于个体体重的体积给药。
[1081]
基于以每千克体重10ml的体积的总rna货物或媒剂对照(tss)通过侧尾静脉以0.03mg/kg、0.1mg/kg或0.3mg/kg给药含有靶向sgrna(g12267)的经修饰的klkb1和cas9 mrna的lnp。
[1082]
在血管渗漏研究前一天,如在实例6中所描述的收集并处理血液,并通过检测前激肽释放酶和激肽释放酶(也称为总激肽释放酶)的elisa测量分泌的人前激肽释放酶,如在实例1中所描述的。
[1083]
如在实例1中所描述的进行血管渗漏测定。在尸检时,收集肝脏组织并如在实例6中所描述的提取dna以测量klkb1编辑。为了在血管渗漏模型中进行染料定量,如在实例1中所描述的收集并处理结肠组织。
[1084]
百分比编辑、血清hu klkb1蛋白水平和血管渗漏的结果在表21和图11a-11b中示出。
[1085]
表21.huklkb1小鼠中的编辑百分比、klkb1蛋白水平和血管渗漏
[1086] 剂量(mg/kg)编辑%血清前激肽释放酶(ug/ml)结肠(od)tss-100.02100.000.07tss-200.0694.920.22对照0.30.192.990.30g0122670.0316.4882.970.26g0122670.140.4648.970.20g0122670.368.6613.880.09
[1087]
使用类似的方法进行了一项单独的研究以评估编辑百分比、血清前激肽释放酶水平和血管渗漏在9个月期间的持久性。基于以每千克体重10ml的体积的总rna货物通过侧尾静脉以0.1mg/kg或0.3mg/kg的剂量向小鼠给药靶向sgrna(g12267)的经修饰的klkb1和cas9 mrna的lnp或非靶向sgrna。观察到剂量响应的持久性,在研究期间维持增加的编辑、降低的蛋白质水平和降低的血管渗漏水平。
[1088]
实例10.非人类灵长类动物(nhp)中klkb1基因编辑的体内测试
[1089]
在此实例中,进行了一项研究以评估食蟹猴在施用具有cas9蛋白mrna的crispr/cas9脂质纳米颗粒(lnp)和klkb1基因的各种向导后klkb1基因编辑和总激肽释放酶蛋白表达以及总激肽释放酶活性水平。将食蟹猴在n=3的队列中进行处理。此研究使用根据实例1的lnp调配物进行。每种lnp调配物含有聚腺苷酸化cas9 mrna(包括seq id no:516)和grna(g013901,食蟹猴特异性klkb1向导rna),mrna:grna的重量比为2:1。基于总rna货物,将动物以1.5、3或6mg/kg剂量给药。通过ngs测量插入缺失形成(编辑百分比)。如在实例1中所描述的,测量总激肽释放酶活性和血清激肽释放酶蛋白水平。
[1090]
研究表明,在nhp组中,klkb1的敲除(导致缓激肽释放的生物途径的一部分)和g013901可使激肽释放酶活性降低90%或更多,这是一种超过所示出的对hae发作率产生治疗意义影响的靶活性的强大的反应(激肽释放酶活性降低60%;banerji,2017)。此项研究表明,增加的编辑率、降低的血浆激肽释放酶水平和降低的激肽释放酶活性之间存在剂量依赖性相关。在nhp中,所述反应持续了一年。循环激肽释放酶蛋白和活性水平在表22和23;和图12a-12b中有所提供。
[1091]
表22.激肽释放酶活性(基础活性的%)
[1092][1093]
表23.血浆激肽释放酶蛋白水平(基础水平的%)
[1094][1095][1096]
在比较tss缓冲液对照组和处理组时,对选定nhp血清样品的测试发现,在第10周或第15周(基于测量凝血酶原、aptt和纤维蛋白原(均在第10周)以及因子xii(第15周))时,
nhp中klkb1敲除对凝血途径生物标志物未观察到影响。
[1097]
重复nhp研究,使用包含与人klkb1完全互补的向导序列的向导g012267评估食蟹猴中klkb1总激肽释放酶蛋白表达和总激肽释放酶活性水平。g012267的向导序列与g013901相比有一个核苷酸差异,所述g013901的向导序列与食蟹猴klkb1完全互补。此研究中的实验方案和lnp调配物基本上与上述实验中所描述的相同,除了动物(n=3)基于总rna货物为3mg/kg给药。使用实施例1中所描述的方法测量总激肽释放酶活性和血清激肽释放酶蛋白水平。
[1098]
研究表明,在nhp组中,用g012267敲低klkb1可使激肽释放酶活性降低65%。在nhp中,反应持续9个月。循环激肽释放酶蛋白和活性水平在表24和25以及图13a-13b中提供。
[1099]
表24.激肽释放酶活性(基础活性的%)
[1100][1101][1102]
表25.血浆激肽释放酶蛋白水平(基础水平的%)
[1103]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1