新型细胞系的制作方法
1.本发明涉及医学、分子生物学和基因治疗领域。本发明涉及在细胞中的蛋白质生产,由此在杆状病毒载体中使用重复的不完全回文/同源重复序列。具体地,本发明涉及可以用于基因治疗中的细小病毒载体的生产,并且涉及增加细小病毒载体的生产率的病毒复制酶(rep)蛋白表达的改善。
背景技术:
2.杆状病毒表达系统因其作为真核克隆和表达载体的用途而众所周知(king,l.a.和r.d.possee,1992,“the baculovirus expression system”,chapman and hall,united kingdom;o’reilly,d.r.等人,1992.baculovirus expression vectors:alaboratory manual.newyork:w.h.freeman)。杆状病毒表达系统的优点尤其是所表达的蛋白质几乎总是可溶的、正确折叠的和生物活性的。进一步优点包括高蛋白表达水平、更快的生产、对于大蛋白表达的适合性和对于大规模生产的适合性。然而,在昆虫细胞生物反应器中使用杆状病毒系统的大规模或连续生产异源蛋白质的过程中,生产水平的不稳定性,也称为通道效应,是一个主要障碍。这种效应至少部分是由于杆状病毒dna中重复的同源序列之间的重组。
3.杆状病毒表达系统也已成功地用于产生重组腺伴随病毒(aav)载体(urabe等人,2002,hum.gene ther.13:1935
–
1943;us 6,723,551和us 20040197895)。aav可以被视为用于人基因治疗的最有前途的病毒载体之一。aav具有有效感染分裂以及非分裂人细胞的能力,且最重要的是,尽管aav存在于许多人中,但它从未与任何疾病相关。鉴于这些优点,重组腺伴随病毒(raav)正在多种基因治疗临床试验中进行评估,所述临床试验包括用于血友病b型、恶性黑色素瘤、囊性纤维化、i型高脂蛋白血症和其它疾病的试验。
4.对于aav的大规模生产,已知哺乳动物生产系统是不太适合的,特别是由于扩大将需要大量的生物反应器空间。为了克服扩大用于aav的哺乳动物生产系统的问题,urabe等人(2002,同上)开发了在昆虫细胞中的aav生产系统。为了使得能够在昆虫细胞中产生aav,一些修饰是必要的,以便实现三种aav衣壳蛋白(vp1、vp2和vp3)的正确化学计量学,其依赖于两个剪接受体位点的交替使用以及用于vp2的acg起始密码子的次优利用的组合,所述acg起始密码子不能被昆虫细胞准确地复制。为了模拟昆虫细胞中的衣壳蛋白的正确化学计量学,urabe等人(2002,同上)使用转录成单个多顺反子信使的构建体,所述单个多顺反子信使能够无需剪接而表达所有三种vp蛋白,并且其中最上游的起始密码子由次优起始密码子acg替换。wo2007/046703公开了通过进一步优化如昆虫细胞中产生的aav衣壳蛋白的化学计量学,来实现杆状病毒产生的raav载体的感染性的进一步改善。
5.对于在aav杆状病毒表达系统中的aavrep蛋白表达,如最初由urabe等人(2002,同上)开发的,使用重组杆状病毒构建体,其具有两个独立的rep表达单元(一个用于rep78,且一个用于rep52),所述表达单元各自分别处于分开的杆状病毒启动子,δie1和polh启动子的控制下。然而,kohlbrenner等人(2005,mol.ther.12:1217-25;wo 2005/072364)报道了,
如通过urabe等人使用的,用于表达两种rep蛋白的杆状病毒构建体具有固有的不稳定性的缺点。通过拆分urabe的原始载体中的两种rep基因的回文取向,并且设计两种分开的杆状病毒载体用于表达rep52和rep78,kohlbrenner等人(2005,同上)增加了载体的传代稳定性。然而,尽管在至少5代内在昆虫细胞中来自两种独立的杆状病毒-rep构建体的rep78和rep52的持续表达,但与通过urabe等人(2002,同上)设计的原始杆状病毒-rep构建体相比,raav载体产率是1/10至1/5。
6.在申请wo2007/148971中,本发明人通过使用关于rep78和rep52蛋白的单一编码序列,其中对于rep78蛋白使用次优起始密码子,其被扫描核糖体部分跳跃,以允许翻译的起始也在rep52蛋白的起始密码子的进一步下游发生,已显著改善了昆虫细胞中的raav载体产生的稳定性。在wo 2009/014445中,通过采用对于rep52和rep78分开的表达盒,其中重复的编码序列在密码子偏倚方面不同,以减少同源重组,再次进一步改善了昆虫细胞中的raav载体产生的稳定性。
7.国际专利申请wo 2007/084773公开了在昆虫细胞中的raav产生的方法,其中感染性病毒颗粒的产生通过相对于vp2和vp3补充vp1得到增加。可以通过将包含表达vp1、vp2和vp3的核苷酸序列的衣壳载体引入昆虫细胞内,并且另外将可以在相同的衣壳载体上或在不同的载体上的表达vp1的核苷酸序列引入昆虫细胞内,来实现补充。
8.在2009年,aslanidi等人(proc natlacad sci u sa.2009;106(13):5059-64)产生了基于sf9的rep-cap包装细胞系,在具有aav itr和目的转基因(trans)的杆状病毒(bac)的单次接种后,所述rep-cap包装细胞系可以产生以105个基因组拷贝(gc)/细胞的aav。该系统被称为onebac平台,被视为适合于扩大aav生产(mietzsch等人,2014;mietzsch等人,2017)。然而,mietzsch等人(2015)进一步优化了该平台,以生产具有低宿主dna错误包装的多重aav血清型。在最近的研究中,wu等人(2019)已显示了通过将cap基因连同itr-转基因-itr(cap-trans)一起在杆状病毒载体基因组内部融合,同时维持在包装rep sf9细胞内整合的可诱导的rep基因,onebac平台可以更加通用和灵活。所有这些实验都已显示了onebac平台的价值,并且同时也显示了改善的必要性和可能性。
9.因此,仍然需要细胞中的细小病毒载体的大规模(商业)生产的进一步改善,尤其是克服与工艺稳固性相关的局限性。因此,本发明的一个目的是提供允许异源细小病毒相关蛋白和载体的高产率、稳固和可扩大生产的手段和方法。
技术实现要素:
10.在第一个方面,本发明涉及昆虫细胞,其包含整合到细胞基因组内的以下:i)与编码mrna的核苷酸序列可操作地连接的第一启动子,所述mrna在细胞中的翻译产生细小病毒rep 78和68蛋白中的至少一种;ii)与编码mrna的核苷酸序列可操作地连接的第二启动子,所述mrna在细胞中的翻译产生细小病毒rep 52和40蛋白中的至少一种;以及iii)与第一启动子和第二启动子可操作地连接的至少一个增强子元件,其中所述至少一个增强子元件依赖于转录反式调节蛋白,并且其中将转录反式调节蛋白引入细胞内诱导来自第一启动子和第二启动子的转录。优选地,在本发明的昆虫细胞中,第一启动子和第二启动子是杆状病毒启动子,转录反式调节蛋白是杆状病毒立即早期蛋白(ie1)或其剪接变体(ie0),并且转录反式调节蛋白依赖性增强子元件是杆状病毒同源区(hr)增强子元件,其中优选地,所述杆
状病毒是苜蓿银纹夜蛾(autographa californica)核型多角体病毒。优选地,在本发明的昆虫细胞中,hr增强子元件是除hr2-0.9外的hr增强子元件,其中优选地hr增强子元件优选包含hr 28聚体序列ctttacgagtagaattctacgcgtaaaa(seq id no.32)的至少一个拷贝,和/或其中至少20、21、22、23、24、25、26或27个核苷酸与序列ctttacgagtagaattctacgcgtaaaa(seq id no.32)相同,且结合杆状病毒ie1蛋白的序列的至少一个拷贝,并且其中当可操作地连接到包含可操作地连接到polh启动子的报道基因的表达盒时,所述hr增强子元件a)在非诱导条件下,具有hr增强子元件的表达盒产生比包含hr2-0.9元件、在其它方面相同的表达盒更少的报道分子转录物,或者具有hr增强子元件的盒产生的报道分子转录物的量是由包含hr4b元件、在其它方面相同的表达盒产生的1/1.1、1/1.2、1/1.5、1/2、1/5或1/10;并且b)在诱导条件下,具有hr增强子元件的表达盒产生的报道分子转录物的量是由包含hr4b或hr2-0.9元件、在其它方面相同的表达盒产生的至少50、60、70、80、90或100%,更优选地,hr增强子元件选自hr1、hr3、hr4b和hr5,其中hr4b和hr5是优选的,其中hr4b是最优选的。
11.在根据本发明的昆虫细胞中,第一启动子和第二启动子优选是不同的,其中更优选地,第一启动子是延迟早期杆状病毒启动子,并且第二启动子是晚期或非常晚期杆状病毒启动子,最优选地,第一启动子是39k启动子并且第二启动子选自polh、p10、p6.9和psel120启动子。
12.在本发明的昆虫细胞的一个优选实施方案中,细小病毒rep 52和40蛋白中的至少一种以及细小病毒rep 78和68蛋白中的至少一种具有至少90%相同的共同氨基酸序列,而细小病毒rep 52和40蛋白中的至少一种的mrna中的编码共同氨基酸序列的核苷酸序列与细小病毒rep 78和68蛋白中的至少一种的mrna中的编码共同氨基酸序列的核苷酸序列具有小于95%、90%、85%、80%、75%、70%、65%或60%的序列相同性,其中优选地,与细小病毒rep 78和68蛋白中的至少一种的mrna中的编码共同氨基酸序列的核苷酸序列中的密码子使用相比,细小病毒rep 52和40蛋白中的至少一种的mrna中的编码共同氨基酸序列的核苷酸序列中的密码子使用更适应昆虫细胞的密码子使用偏倚。
13.在本发明的昆虫细胞的另一个优选实施方案中,编码细小病毒rep 78和68蛋白中的至少一种的mrna的核苷酸序列包含影响细小病毒rep 78和68蛋白中的至少一种的稳态水平减少的修饰,优选地,细小病毒rep78和68蛋白中的至少一种包含以次优翻译起始密码子开始的开放读码框,其中更优选地,次优翻译起始密码子选自acg、ctg、ttg、gtg和att,其中acg是最优选的。
14.优选地,在根据本发明的昆虫细胞中,第一启动子和第二启动子以相反的转录方向整合到细胞的基因组中,并且其中至少一个增强子元件存在于第一启动子和第二启动子之间,其中更优选地,两个增强子元件存在于第一启动子和第二启动子之间。
15.根据本发明的昆虫细胞进一步优选地包含:a)核苷酸序列,其包含用于在昆虫细胞中表达的可操作地连接到第三启动子的细小病毒衣壳蛋白编码序列;b)包含转基因的核苷酸序列,所述转基因的侧翼为至少一种细小病毒反向末端重复序列;以及c)包含用于表达转录反式调节蛋白的表达盒的核苷酸序列,其中优选地,a)和b)中的至少一种的核苷酸序列包含在杆状病毒载体中,其中更优选地,a)、b)和c)中的至少一种的核苷酸序列包含在杆状病毒载体中,所述杆状病毒载体包含用于表达转录反式调节蛋白的表达盒。在一个优选的实施方案中,第一启动子在第三启动子之前是有活性的。
16.在根据本发明的昆虫细胞的一个优选实施方案中,细小病毒rep 78和68蛋白中的至少一种,细小病毒rep 52和40蛋白中的至少一种,细小病毒vp1、vp2和vp3衣壳蛋白,以及至少一种细小病毒反向末端重复序列来自腺伴随病毒(aav)。
17.在根据本发明的昆虫细胞的一个优选实施方案中,优选的cap编码序列至少包含capaav2/5(seq id 29)或aav5(seq id 30)。
18.在第二个方面,本发明涉及用于产生重组细小病毒病毒粒子的方法,其包括以下步骤:a)培养如上文定义的昆虫细胞;b)向a)中培养的细胞提供如上文定义的核苷酸序列;并且c)回收重组细小病毒病毒粒子。优选地,在本发明的方法中,步骤c)中的回收重组细小病毒病毒粒子包括使用固定化的抗细小病毒抗体,优选单链骆驼科抗体或其片段,对病毒粒子的亲和纯化,以及在标称孔径为30-70nm的过滤器上的过滤中的至少一种。
19.在第三个方面,本发明涉及试剂盒套组(kit ofparts),其至少包含如上文定义的昆虫细胞以及如上文的杆状病毒载体和/或核苷酸序列。
具体实施方式
20.定义
21.除非另有定义,否则本文使用的技术和科学术语具有与本公开内容所属领域的普通技术人员通常理解相同的含义。本领域技术人员将认识到与本文所述的那些相似或等价的许多方法和材料,其可以用于本发明的实践中。实际上,本发明决不限于该方法。
22.在本文件及其权利要求中,动词“包含”及其变位以其非限制性意义使用,以意指包括在该词之后的项目,但不排除未具体提及的项目。另外,通过不定冠词“一个”或“一种”对元件的引用并不排除存在多于一个/种元件的可能性,除非上下文明确要求存在一个/种且仅一个/种元件。因此,不定冠词“一个”或“一种”通常意指“至少一个/种”。
23.如本文使用的,术语“和/或”指示所述情况中的一种或多种可以单独发生,或与所述情况中的至少一种组合发生,直至所有所述情况发生。
24.如本文使用的,“至少”特定值意指该特定值或更多。例如,“至少2”应理解为与“2或更多”相同,即2、3、4、5、6、7、8、9、10、11、12、13、14、15
……
等。
25.当与数值(例如约10)结合使用时,词语“约”或“大约”优选地意指该值可以是给定值(10)或者该值的多于或小于0.1%。
26.如本文使用的,“有效量”意指相对于未治疗的患者,改善疾病的症状所需的药剂的量。用于实践本发明用于治疗性治疗例如癌症的活性剂的有效量取决于施用方式,对象的年龄、体重和一般健康而变。最终,主治医生或兽医将决定适当的量和剂量方案。此类量被称为“有效”量,其可以确定为基因组拷贝数/千克(gc/kg)。因此,与在本公开内容的上下文中“有效针对”疾病或状况的药物施用结合,指示以临床上适当方式的施用导致对于至少统计学显著部分的患者的有益效应,例如症状的改善、治愈、至少一种疾病体征或症状的减轻、寿命的延长、生活质量的改善、或者一般被熟悉治疗特定类型疾病或状况的医生公认为积极的其它效应。
27.如本文件中所述,物质作为药物的用途也可以解释为所述物质在药物制造中的用途。类似地,每当物质用于治疗或用作药物时,它也可用于制造用于治疗的药物。用作本文所述药物的产物可用于治疗方法中,其中此类治疗方法包括施用用于使用的产物。
28.术语“同源性”、“序列相同性”等等在本文中可互换使用。序列相同性在本文中定义为如通过比较序列确定的,在两个或更多个氨基酸(多肽或蛋白质)序列或者两个或更多个核酸(多核苷酸)序列之间的关系。在本领域中,“相同性”还意指如通过此类序列串之间的匹配确定的,视情况而定,在氨基酸序列或核酸序列之间的序列相关程度。在两个氨基酸序列之间的“相似性”通过比较一个多肽的氨基酸序列及其保守氨基酸取代与第二个多肽的序列来确定。“相同性”和“相似性”可以通过已知方法容易地计算。
29.取决于两个序列的长度,“序列相同性”和“序列相似性”可以通过使用总体或局部比对算法比对两个肽序列或两个核苷酸序列进行确定。相似长度的序列优选使用总体比对算法(例如needleman wunsch)进行比对,所述算法在整个长度上最佳地比对序列,而基本上不同长度的序列优选使用局部比对算法(例如smith waterman)进行比对。当序列(当通过例如程序gap或bestfit使用默认参数进行最佳比对时)共享至少一定最小百分比的序列相同性(如下文定义的)时,那么序列可以被称为“基本上相同的”或“基本相似的”。gap使用needleman和wunsch总体比对算法,以在其整个长度(全长)上比对两个序列,使匹配数目达到最大并且使空位数目降到最低。当两个序列具有相似长度时,总体比对适当地用于确定序列相同性。一般地,使用gap默认参数,伴随空位产生罚分=50(核苷酸)/8(蛋白质)和空位延伸罚分=3(核苷酸)/2(蛋白质)。对于核苷酸,使用的默认评分矩阵是nwsgapdna,并且对于蛋白质,默认评分矩阵是blosum62(henikoff&henikoff,1992,pnas 89,915-919)。用于百分比序列相同性的序列比对和评分可以使用计算机程序或使用开放资源软件进行确定,所述计算机程序例如可从accelrys inc.,9685scranton road,san diego,ca 92121-3752usa获得的gcg wisconsin package,版本10.3,所述开放资源软件例如embosswin版本2.10.0中的程序“needle”(使用总体needleman wunsch算法)或“water”(使用局部smith waterman算法),使用与上文gap相同的参数,或使用默认设置(对于
‘
needle’和
‘
water’以及对于蛋白质和dna比对两者,默认的空位开放罚分是10.0,且默认空位延伸罚分是0.5;默认评分矩阵对于蛋白质是blossum62,且对于dna是dnafull)。当序列具有显著不同的总体长度时,局部比对例如使用smithwaterman算法的那些局部比对是优选的。
30.可替代地,百分比相似性或相同性可以通过搜索公共数据库,使用算法例如fasta、blast等进行确定。因此,本发明的核酸和蛋白质序列可以进一步用作“查询序列”,以进行针对公共数据库的搜索,以例如鉴定其它家庭成员或有关序列。可以使用altschul等人(1990)j.mol.biol.215:403—10的blastn和blastx程序(版本2.0)进行此类搜索。blast核苷酸搜索可以用nblast程序、评分=100、字长=12来进行,以获得与本发明的氧化还原酶核酸分子同源的核苷酸序列。blast蛋白质搜索可以用blastx程序、评分=50、字长=3来进行,以获得与本发明的蛋白质分子同源的氨基酸序列。为了获得用于比较目的的空位比对,可以利用如altschul等人,(1997)nucleic acids res.25(17):3389-3402中所述的gapped blast。当利用blast和gapped blast程序时,可以使用分别程序(例如blastx和blastn)的默认参数。参见在http://www.ncbi.nlm.nih.gov/处的美国国家生物技术信息中心(national center for biotechnology information)的主页。
31.如本文使用的,术语“选择性杂交”、“选择性地杂交”和类似术语预期描述用于杂交和洗涤的条件,在其下彼此至少66%、至少70%、至少75%、至少80%,更优选至少85%,甚至更优选至少90%,优选至少95%,更优选至少98%或更优选至少99%同源的核苷酸序
列通常保持彼此杂交。即,此类杂交序列可以共享至少45%、至少50%、至少55%、至少60%、至少65、至少70%、至少75%、至少80%,更优选至少85%,甚至更优选至少90%,更优选至少95%,更优选至少98%或更优选至少99%的序列相同性。
32.此类杂交条件的优选的非限制性实例是在约45℃下,在6x氯化钠/柠檬酸钠(ssc)中的杂交,随后为在约50℃下,优选在约55℃下,优选在约60℃下,且甚至更优选在约65℃下,在1x ssc、0.1%sds中的一次或多次洗涤。
33.高度严格的条件包括例如在约68℃下在5x ssc/5x denhardt's溶液/1.0%sds中的杂交,以及在室温下在0.2x ssc/0.1%sds中的洗涤。可替代地,洗涤可以在42℃下进行。
34.本领域技术人员将知道哪些条件适用于严格和高度严格的杂交条件。关于此类条件的另外指导是本领域可容易获得的,例如在sambrook等人,1989,molecular cloning,alaboratory manual,cold spring harbor press,n.y.;以及ausubel等人(编辑),sambrook和russell(2001)"molecular cloning:alaboratory manual(第3版),cold spring harbor laboratory,cold spring harbor laboratory press,new york 1995,current protocols in molecular biology,(john wiley&sons,n.y.)中。
35.当然,仅与多聚a序列(例如mrna的3'末端多聚(a)束)或与t(或u)残基的互补段杂交的多核苷酸,将不包括在用于与本发明核酸的一部分特异性杂交的本发明多核苷酸中,因为此类多核苷酸将与含有多聚(a)段或其互补体的任何核酸分子(例如,实际上任何双链cdna克隆)杂交。
[0036]“核酸构建体”或“核酸载体”在本文中应理解为意指起因于重组dna技术的使用的人造核酸分子。因此,术语“核酸构建体”并不包括天然存在的核酸分子,尽管核酸构建体可以包含天然存在的核酸分子的(部分)。“载体”是作用于将外源核酸序列(即dna或rna)转移到宿主细胞内的核酸构建体(通常是dna或rna)。载体优选通过自主复制和整合到宿主细胞的基因组内的至少一种而在宿主中维持。术语“表达载体”或“表达构建体”指能够实现与此类序列相容的宿主细胞或宿主生物中的基因表达的核苷酸序列。这些表达载体通常包括至少一个“表达盒”,其是能够实现编码待表达产物的序列的表达的功能单元,并且其中编码序列与适当的表达控制序列可操作地连接,所述表达控制序列至少包含合适的转录调控序列和任选的3'转录终止信号。也可能存在实现表达所必需或有帮助的另外因子,例如表达增强子元件。表达载体待引入合适的宿主细胞内,并且能够实现在宿主细胞的体外细胞培养物中的编码序列表达。优选的表达载体将适合于病毒蛋白和/或核酸,特别是重组aav蛋白和/或核酸的表达。
[0037]
如本文使用的,术语“启动子”或“转录调控序列”指这样的核酸片段,其发挥功能以控制一种或多种编码序列的转录,并且相对于编码序列的转录起始位点的转录方向定位于上游,并且通过以下的存在而在结构上进行鉴定:dna依赖性rna聚合酶的结合位点、转录起始位点和任何其它dna序列,包括但不限于转录因子结合位点、阻遏蛋白和激活蛋白结合位点、以及本领域技术人员已知直接或间接地起作用以调控来自启动子的转录量的任何其它核苷酸序列。“组成型”启动子是在大多数生理和发育条件下,在大多数组织中具有活性的启动子。“诱导型”启动子是例如通过施加化学诱导剂或生物实体,在生理上或发育上调控的启动子。
[0038]
术语“报道分子”可以与标记物互换使用,尽管它主要用于指可见标记物,例如绿
色荧光蛋白(gfp)或萤光素酶。
[0039]
术语“蛋白质”或“多肽”可互换使用,并且指由氨基酸链组成的分子,而不论特定的作用模式、大小、3维结构或起源。
[0040]
术语“基因”意指包含可操作地连接到合适的调控区(例如启动子)的一个区域(转录区域)的dna片段,所述区域在细胞中转录成rna分子(例如mrna)。基因通常包含几个可操作地连接的片段,例如启动子、5'前导序列、编码区和包含多聚腺苷酸化位点的3'非翻译序列(3'端)。“基因的表达”指这样的过程,其中与适当的调控区,特别是启动子可操作地连接的dna区转录成具有生物活性的rna,即,其能够翻译成具有生物活性的蛋白质或肽。
[0041]
当用于指示给定(重组)核酸或多肽分子和给定的宿主生物或宿主细胞之间的关系时,术语“同源的”应理解为意指在自然界中核酸或多肽分子由相同物种,优选相同品种或品系的宿主细胞或生物产生。如果与宿主细胞同源,则编码多肽的核酸序列通常(但不一定)可操作地连接到与其天然环境中不同的另一个(异源)启动子序列,以及适用时,另一个(异源)分泌信号序列和/或终止子序列。应理解,调控序列、信号序列、终止子序列等也可以与宿主细胞同源。在该上下文中,仅“同源”序列元件的使用允许构建“自我克隆的”遗传修饰的生物(gmo)(自我克隆在本文中如欧盟指令(european directive)98/81/ec附录ii中定义的)。当用于指示两个核酸序列的相关性时,术语“同源的”意指一个单链核酸序列可以与互补的单链核酸序列杂交。杂交程度可能取决于许多因素,包括序列之间的相同性量以及杂交条件例如如稍后讨论的温度和盐浓度。
[0042]
当关于核酸(dna或rna)或蛋白质使用时,术语“异源的”和“外源的”指这样的核酸或蛋白质,其不作为它存在于其中的生物、细胞、基因组或dna或rna序列的部分天然存在,或者在细胞中或者在基因组或dna或rna序列中与它在自然界中发现的不同的一个或多个定位中发现。异源和外源核酸或蛋白质对于它们引入的细胞不是内源的,而是已从另一个细胞中获得或者是合成或重组产生的。一般地,尽管不是必需的,此类核酸编码蛋白质,即外源蛋白质,其通常不由dna在其中转录或表达的细胞产生。类似地,外源rna编码在其中存在外源rna的细胞中通常不表达的蛋白质。异源/外源核酸和蛋白质也可以被称为外来核酸或蛋白质。本领域技术人员识别为对于它在其中表达的细胞是外来的任何核酸或蛋白质在本文中由术语异源或外源核酸或蛋白质涵盖。术语异源的和外源的也应用于核酸或氨基酸序列的非天然组合,即其中组合序列中的至少两个相对于彼此是外来的组合。
[0043]
如本文使用的,当提及生物使用时,术语“非天然存在的”意指该生物具有在所提及物种的天然存在的品系,包括所提及物种的野生型品系中通常未发现的至少一种遗传改变。遗传改变包括例如引入编码蛋白质或酶的可表达核酸的修饰、其它核酸添加、核酸缺失、核酸取代、或生物的遗传材料的其它功能破坏。此类修饰包括例如关于所提及物种的异源或同源多肽的编码区及其功能片段。另外的修饰包括例如其中修饰改变基因或操纵子表达的非编码调控区。对编码酶的核酸分子或其功能片段的遗传修饰可以对从其天然存在的状态改变的非天然存在的生物赋予生物化学反应能力或代谢途径能力。
[0044]
如本文使用的,术语“可操作地连接”指多核苷酸(或多肽)元件在功能关系中的键合。当核酸置于与另一个核酸序列的功能关系内时,它是“可操作地连接的”。例如,如果转录调控序列影响编码序列的转录,则它与编码序列是可操作地连接的。可操作地连接的意指被连接的dna序列通常是邻接的,并且在有必要连接两个蛋白质编码区时,是邻接的且在
读码框中。
[0045]
当表达控制序列控制且调控核苷酸序列的转录和/或翻译时,表达控制序列与核苷酸序列是“可操作地连接的”。因此,表达控制序列可以包括启动子、增强子、内部核糖体进入位点(ires)、转录终止子、在蛋白质编码基因前面的起始密码子、内含子的剪接信号和终止密码子。
[0046]
术语“表达控制序列”预期最少包括其存在设计为影响表达,并且还可以包括另外的有利组分的序列。例如,前导序列和融合配偶体序列是表达控制序列。该术语还可以包括核酸序列的设计,使得从序列中去除框内和框外的不期望的、潜在的起始密码子。它还可以包括核酸序列的设计,使得去除不期望的潜在剪接位点。它包括指导多聚a尾添加的序列或多聚腺苷酸化序列(pa),所述多聚a尾即在mrna的3'端处的一串腺嘌呤残基,被称为多聚a序列的序列。它还可以被设计为增强mrna稳定性。实现转录和翻译稳定性的表达控制序列例如启动子、以及实现翻译的序列例如kozak序列,在昆虫细胞中是已知的。表达控制序列可以具有此类性质,以便调节它与之可操作地连接的核苷酸序列,使得达到较低的表达水平或较高的表达水平。
[0047]
发明详述
[0048]
本发明人已着手开发用于产生重组细小病毒载体的改善的包装昆虫细胞系和载体系统。特别地,本发明人通过提供在非诱导条件下用于减少泄露表达同时在诱导条件下维持强表达的手段,已改善对稳定整合在昆虫细胞系中的rep基因的可诱导表达的控制。此类昆虫细胞也被称为irep细胞,或简称为irep。另外,本发明人已优化了各种细小病毒例如aav结构蛋白和非结构蛋白中的表达动力学和比率,以进一步改善来自生产平台,尤其是使用杆状病毒和昆虫细胞平台的载体输出的稳固性、产率和质量。
[0049]
载体质量与完整病毒粒子相对于空病毒粒子之间的比率强相关,其促成载体本身的效力。术语“完整病毒粒子”指包含细小病毒结构衣壳蛋白(vp1、vp2和vp3)的病毒粒子颗粒,其封装侧翼为反向末端重复(itr)序列的转基因dna。术语“空病毒粒子”指不包含细小病毒基因组材料的病毒颗粒。在本发明的一个优选实施方案中,完整病毒粒子相对于空病毒粒子的比率为至少1:50,更优选至少1:10、或至少1:5、或至少1:2,且甚至更优选至少1:1。甚至更优选地,无法检测到空病毒粒子,且最优选地不存在空病毒粒子。本领域技术人员将知道如何确定完整病毒粒子相对于空病毒粒子的比率,例如通过将基因拷贝数除以具有组装的aav衣壳数的总颗粒(或总组装的衣壳:基因组拷贝数),因为每个病毒粒子将仅存在一个基因组拷贝。熟练的技术人员将知道如何确定此类比率。例如,空病毒粒子相对于总衣壳的比率可以通过将基因组拷贝的量(即基因组拷贝数)除以总细小病毒颗粒的量(即细小病毒颗粒的数目)进行确定,其中基因组拷贝的量/ml通过定量pcr进行测量,并且总细小病毒颗粒的量/ml用例如来自progen的酶免疫测定进行测量。
[0050]
昆虫细胞
[0051]
在一个方面,提供了昆虫细胞,其包含整合到细胞基因组内的以下:i)与编码mrna的核苷酸序列可操作地连接的第一启动子,所述mrna在细胞中的翻译仅产生细小病毒rep 78和68蛋白中的至少一种;ii)与编码mrna的核苷酸序列可操作地连接的第二启动子,所述mrna在细胞中的翻译仅产生细小病毒rep 52和40蛋白中的至少一种;以及iii)与第一启动子和第二启动子可操作地连接的至少一个增强子元件,其中所述至少一个增强子元件依赖
于转录反式调节蛋白,其中优选地将转录反式调节蛋白引入细胞内诱导来自第一启动子和第二启动子的转录。
[0052]
昆虫细胞可以是适合于生产异源蛋白质的任何细胞。优选地,昆虫细胞允许杆状病毒载体的复制,并且可以在培养中得到维持。更优选地,昆虫细胞还允许重组细小病毒载体,包括raav载体的复制。例如,所使用的细胞系可以来自草地贪夜蛾(spodoptera frugiperda)、果蝇属(drosophila)细胞系或蚊子细胞系,例如白纹伊蚊(aedes albopictus)衍生的细胞系。优选的昆虫细胞或细胞系是来自对杆状病毒感染敏感的昆虫物种的细胞,包括例如s2(crl-1963,atcc)、se301、seizd2109、seucr1、sf9、sf900+、sf21、bti-tn-5b1-4、mg-1、tn368、hzam1、ha2302、hz2e5、high five(invitrogen,ca,usa)和(us 6,103,526;protein sciences corp.,ct,usa)。根据本发明的优选昆虫细胞是用于产生重组细小病毒载体的昆虫细胞。
[0053]
本领域普通技术人员知道如何将核苷酸序列稳定地引入昆虫基因组内,以及如何鉴定在基因组中具有此类核苷酸序列的细胞。例如,可以通过使用包含与昆虫基因组的区域高度同源的核苷酸序列的载体来帮助掺入基因组内。特定序列例如转座子的使用是将核苷酸序列引入基因组内的另一种方式。掺入基因组内可以通过一个或多个步骤。提及术语“整合的”对于本领域技术人员已知也意指“稳定整合的”。
[0054]
用于培养中的昆虫细胞的生长条件、以及培养中的昆虫细胞中的异源产物生产是本领域众所周知的,并且例如在上文引用的关于昆虫细胞的分子改造的参考文献中进行描述(也参见wo2007/046703)。
[0055]“昆虫细胞相容性载体”或“载体”应理解为能够生产性转化或转染昆虫或昆虫细胞的核酸分子。示例性生物载体包括质粒、线性核酸分子和重组病毒。可以采用任何载体,只要它是昆虫细胞相容的。载体可以整合到昆虫细胞基因组内,但昆虫细胞中的载体的存在无需是永久的,并且也包括瞬时附加型载体。可以通过任何已知的手段,例如通过细胞的化学处理、电穿孔或感染来引入载体。在一个优选的实施方案中,载体是杆状病毒、病毒载体或质粒。在一个更优选的实施方案中,载体是杆状病毒,即核酸构建体是杆状病毒表达载体。杆状病毒表达载体及其使用方法例如在以下中进行描述:summers和smith,1986,“a manual of methods for baculovirus vectors and insect culture procedures”,texasagricultural experimental station bull.no.7555,college station,tex.;luckow,1991,in prokop等人,“cloning and expression ofheterologous genes in insect cells with baculovirus vectors'recombinant dnatechnology andapplications”,97-152;king和possee,1992,“the baculovirus expression system”,chapman和hall,united kingdom;o'reilly,miller和luckow,1992,“baculovirus expressionvectors:alaboratory manual”,newyork;freeman和richardson,1995,“baculovirus expression protocols”,methods in molecular biology,第39卷;us 4,745,051;us2003148506;以及wo 03/074714。
[0056]
用于产生重组细小病毒(raav)载体的昆虫细胞中采用的核酸构建体的数目在本发明中不受限制。例如,按照本发明的方法,一种、两种、三种或更多种分开的构建体可以用于在昆虫细胞中产生raav。如果采用两种构建体,则一种构建体可以包括包含转基因的核苷酸序列,所述转基因的侧翼为至少一种细小病毒itr序列,然后另一种构建体可以包含分
别关于rep和cap蛋白的表达盒。如果采用三种构建体,则一种构建体可以包括包含转基因的核苷酸序列,所述转基因的侧翼为至少一种细小病毒itr序列,另一种构建体可以包含关于cap蛋白的表达盒,而另外一种构建体可以包含关于rep蛋白的一个或多个表达盒,例如两个表达盒,一个用于rep 78和52蛋白中的每一种,任选地是密码子优化的、at优化的或gc优化的,以便使重组降到最低或预防重组,如下文所述。由此应理解,至少一些核酸构建体,优选包含关于rep蛋白的一个或多个表达盒的那些核酸构建体,可以稳定地整合到昆虫细胞的基因组内。
[0057]
本发明的发明人已以两种方式进一步优化了诱导型昆虫细胞表达载体(例如,用于表达rep蛋白,例如irep)的设计。首先,通过调查替代杆状病毒启动子在调控aav基因表达中的用途。到目前为止,多面体启动子(polh)一直是bev背景下的aav生产中最广泛研究的启动子(van oers,m.m.等人,2015)。尽管替代的晚期启动子例如p10已报道与polh共享宿主因子(ghosh,s.等人,1998),但其它杆状病毒启动子已报道显示出不同的诱导强度和时间分布((dong,z.q.等人,2018;lin,c.h&jarvis,d.l.,2013;martinez-solis,m.等人,2016)。然而,它们用于昆虫细胞中的aav生产的潜在用途迄今为止从未得到报道。其次,本研究中还探索了对诱导型表达的更紧密调控。这例如对于aavrep的可诱导表达是期望的,因为rep蛋白可能对于宿主细胞是有毒的,并且因此需要表达的控制。与polh组合的杆状病毒同源区(hr)2或hr2.09增强子序列的使用已成为诱导型onebac平台的默认分子设计(aslanidi,g.等人同上)。此处,本发明人检查了与其它杆状病毒hr增强子序列组合的替代杆状病毒启动子的潜在用途。通过研究也处于不同分子构象的不同杆状病毒启动子和增强子,本发明人已优化了aav基因(cap、rep)的表达,以获得稳定和稳固的aav生产平台,得到具有高滴度的高质量aav分批。
[0058]
该方法包括采用具有相似或不同表达强度和时间分布的替代和非保守的杆状病毒启动子(p10、39k、p6.9、psel120),其有利地产生了调控野生型(wt)单盒或拆分盒aavrep、或其它aav基因表达的诱导型表达构建体。然后,这使得能够生产在重组杆状病毒反式激活后较不易于顺式:反式启动子竞争的诱导型质粒载体构建体。另外,它使得能够使用较少/不泄漏的杆状病毒hr增强子,以使得能够更紧密调控诱导型质粒载体构建体。
[0059]
本发明的另外益处包括在onebac和昆虫细胞平台上改善的aav生产产率和质量;提供诱导型启动子,其在未诱导时是真正沉默的,从而允许在
‘
关闭’时避免有毒aav基因例如rep的表达,其允许更有活力和稳定的aav包装细胞;以及将拆分盒repaav设计改编到诱导型质粒载体内。
[0060]
启动子
[0061]
如本文使用的,术语“启动子”或“转录调控序列”指这样的核酸片段,其发挥功能以控制一种或多种编码序列的转录,并且相对于编码序列的转录起始位点的转录方向定位于上游,并且通过以下的存在而在结构上进行鉴定:dna依赖性rna聚合酶的结合位点、转录起始位点和任何其它dna序列,包括但不限于转录因子结合位点、阻遏蛋白和激活蛋白结合位点、以及本领域技术人员已知直接或间接地起作用以调控来自启动子的转录量的任何其它核苷酸序列。“组成型”启动子是在大多数生理和发育条件下,在大多数组织中具有活性的启动子。“诱导型”启动子是例如通过施加化学诱导剂,在生理上或发育上调控的启动子。“组织特异性”启动子仅在特定类型的组织或细胞中具有活性。“隐性启动子”是可以被激活
的表观遗传上沉默的启动子。
[0062]
在一个优选的实施方案中,rep78相对于rep52蛋白的表达比率受下述中的一种或多种调控:(a)第二启动子强于第一启动子,如例如通过报道基因表达(例如萤光素酶或seap)、或者rna或蛋白质印迹确定的;(b)与第一表达盒相比,在第二表达盒的上游存在核苷酸间隔区或者更多和/或更强的增强子元件;(c)与编码rep78蛋白的核苷酸序列相比,编码细小病毒rep52蛋白的核苷酸序列具有更高的密码子适应指数;(d)细小病毒rep蛋白的温度优化;以及(e)与相应的野生型rep蛋白相比,具有氨基酸序列中的一种或多种改变的变体rep蛋白,并且其中所述一种或多种氨基酸改变导致rep功能的活性增加,如通过检测昆虫细胞中增加的aav产生来评价的。如通过检测昆虫细胞中增加的aav产生来评价的,用于生成、选择和/或筛选具有rep功能的活性增加的变体rep蛋白的方法,可以通过使用于获得变体rep蛋白的us20030134351中描述的方法适应昆虫细胞来获得,所述变体rep蛋白具有关于哺乳动物细胞中的aav产生增加的功能。与相应的野生型rep蛋白相比,在氨基酸序列中具有一种或多种改变的变体rep蛋白在本文中应理解为包括,与相应的野生型rep蛋白的氨基酸序列相比,在变体氨基酸序列中具有一种或多种氨基酸取代、插入和/或缺失的rep蛋白。
[0063]
第二启动子强于第一启动子意指与编码rep78蛋白的mrna分子相比,表达更多的编码rep52蛋白的mrna分子。可以使用同样强的启动子,因为与rep78蛋白的表达相比,rep52蛋白的表达将是增加的。启动子的强度可以通过在本发明的方法中使用的条件下获得的表达来确定。
[0064]
在一个实施方案中,第一启动子和第二启动子是杆状病毒启动子。在一个实施方案中,第一启动子和第二启动子是不同的。在一个实施方案中,第一启动子是延迟早期杆状病毒启动子,例如39k启动子。在一个实施方案中,第二启动子是晚期或非常晚期杆状病毒启动子,例如polh、p10、p6.9和psel120启动子。因而,在一个实施方案中,第一启动子是延迟早期杆状病毒启动子,并且第二启动子是晚期或非常晚期杆状病毒启动子。因此,在一个实施方案中,第一启动子是39k启动子,并且第二启动子选自p10、p6.9和psel120启动子。
[0065]
在一个实施方案中,第一启动子和第二启动子以相反的转录方向整合到细胞的基因组中。
[0066]
如下所述,为了产生完整的细小病毒基因治疗载体病毒粒子,细胞优选地进一步包括包含核苷酸序列的表达盒,所述核苷酸序列包含用于在昆虫细胞中表达的可操作地连接到第三启动子的细小病毒衣壳蛋白编码序列。在一个实施方案中,第一启动子、第二启动子和第三启动子是杆状病毒启动子。在一个实施方案中,第一启动子、第二启动子和第三启动子是不同的。在一个实施方案中,第一启动子是延迟早期杆状病毒启动子,例如39k启动子。在一个实施方案中,第二启动子是晚期或非常晚期杆状病毒启动子,例如polh、p10、p6.9和psel120启动子。因而,在一个实施方案中,第一启动子是延迟早期杆状病毒启动子,并且第二启动子是晚期或非常晚期杆状病毒启动子。因此,在一个实施方案中,第一启动子是39k启动子,并且第二启动子选自polh、p10、p6.9和psel120启动子。在一个实施方案中,第一启动子在第三启动子之前是有活性的。
[0067]
增强子
[0068]“增强子元件”或“增强子”意欲定义增强启动子的活性(即增加启动子下游的序列
的转录速率)的序列,与启动子相反,所述序列不具有启动子活性,并且不管其相对于启动子的定位如何(即启动子的上游或下游),其通常都可以发挥功能。增强子元件是本领域众所周知的。可以用于本发明中的增强子元件(或其部分)的非限制性实例包括杆状病毒增强子和昆虫细胞中发现的增强子元件。优选的是与在增强子元件的不存在下基因的mrna表达相比,增强子元件将启动子与其可操作地连接的基因在细胞中的mrna表达增加至少25%,更优选至少50%,甚至更优选至少100%,且最优选至少200%。mrna表达可以例如通过定量rt-pcr进行确定。
[0069]
在本文中优选使用增强子元件来增强细小病毒rep蛋白的表达。在一个优选的实施方案中,与如本文定义的(第一和/或第二)启动子可操作地连接的至少一个增强子元件是依赖于转录反式调节蛋白的增强子元件,所述启动子与编码mrna的核苷酸序列可操作地连接,所述mrna在细胞中的翻译产生细小病毒rep蛋白。转录反式调节蛋白依赖性增强子元件在本文中理解为当由反式提供的转录反式调节蛋白蛋白质结合时,激活与其可操作地连接的启动子的转录的增强子元件。
[0070]
因此,在一个进一步优选的实施方案中,转录反式调节蛋白依赖性增强子元件包含至少一种杆状病毒增强子元件和/或至少一种蜕皮激素应答元件。优选地,转录反式调节蛋白是杆状病毒立即早期蛋白(ie1)或其剪接变体(ie0),并且转录反式调节蛋白依赖性增强子元件是杆状病毒同源区(hr)增强子元件,其中优选地,所述杆状病毒是苜蓿银纹夜蛾核型多角体病毒。ie1是一种高度保守的67-kda dna结合蛋白,其反式激活杆状病毒早期基因启动子并支持质粒转染测定中的晚期基因表达(参见例如olson等人,2002,jvirol.,76:9505
–
9515)。acmnpv ie1具有促成启动子反式激活和dna结合的可分离结构域。这种582残基磷蛋白的n末端一半含有从残基8到118和168到222的转录刺激结构域。ie1与~28-bp不完全回文(28聚体)结合,所述不完全回文构成在acmnpv基因组各处分散发现的多重同源区(hr)内的重复序列。hr 28聚体是ie1介导的增强子和起源特异性复制功能所需的最小序列基序。
[0071]
在一个实施方案中,hr增强子元件是除hr2-0.9us 2012/100606 a1)外的hr增强子元件。在一个进一步的实施方案中,hr增强子元件选自hr1、hr3、hr4b和hr5,其中hr4b和hr5是优选的,其中hr4b是最优选的。在一个替代实施方案中,hr增强子元件是变体hr增强子元件,例如非天然存在的设计元件。变体hr增强子元件优选包含hr28聚体序列ctttacgagtagaattctacgcgtaaaa(seq id no.32)的至少一个拷贝,和/或其中至少18、20、21、22、23、24、25、26或27个核苷酸与序列ctttacgagtagaattctacgcgtaaaa(seq id no.32)相同,且优选结合杆状病毒ie1蛋白,更优选结合acmnpv ie1蛋白的序列的至少一个拷贝。变体hr增强子元件进一步优选地在功能上定义为当变体元件可操作地连接到包含可操作地连接到polh启动子的报道基因的表达盒时,a)在非诱导条件下,具有变体元件的盒产生比包含hr2-0.9元件代替变体元件、在其它方面相同的表达盒更少的报道分子转录物,或者具有变体元件的盒产生的报道分子转录物的量是由包含hr4b元件代替变体元件、在其它方面相同的表达盒产生的1/1.1、1/1.2、1/1.5、1/2、1/5或1/10;并且b)在诱导条件下,具有变体元件的盒产生的报道分子转录物的量是由包含hr4b或hr2-0.9元件代替变体元件、在其它方面相同的表达盒产生的至少50、60、70、80、90或100%。非诱导条件应理解为其中在其中测试盒的细胞中不存在ie1蛋白的条件,并且诱导条件应理解为其中存在足够的ie1蛋
白,以用包含hr4b或hr2-0.9元件的参考盒获得最大报道分子表达的条件。变体hr增强子元件与杆状病毒ie1蛋白的结合可以通过使用如例如由rodems和friesen(jvirol.1995;69(9):5368-75)描述的迁移率变化测定进行测定。
[0072]
在一个实施方案中,至少一个增强子元件存在于第一启动子和第二启动子之间。因而,在一个实施方案中,第一启动子和第二启动子以相反的转录方向整合到细胞的基因组内,并且至少一个增强子元件存在于第一启动子和第二启动子之间。在一个进一步的实施方案中,两个增强子元件存在于第一启动子和第二启动子之间。当使用bac polh cap trans用于诱导时,观察到相对较弱的反式激活谱,这是由于i)所使用的两种polh启动子(用于bac polh cap trans中的cap和表达质粒中的rep)之间的顺式:反式启动子竞争,以及ii)采用不泄漏但相对较弱的hr,例如hr4b。在一个实施方案中,使用了此类不泄漏的表达平台,例如使用相对较弱的hr,例如hr4b。在一个进一步的实施方案中,存在与使用bac polh cap trans的相容性。在另外一个进一步的实施方案中,hr4b增强子与p10启动子组合。可以制备此类组合,以调控具有强野生型atg起始密码子的单盒aav2 rep。
[0073]
复制酶(rep)蛋白
[0074]
细小病毒尤其是aav复制酶是由rep基因编码的非结构蛋白。在野生型细小病毒中,由于内部p19启动子,rep基因产生具有不同长度的两种重叠的信使核糖核酸(mrna)。这些mrna各自可以剪接掉或不剪接掉,以最终生成四种rep蛋白,rep78、rep68、rep52和rep40。rep78/68和rep52/40对于itr依赖性aav基因组或转基因复制和病毒颗粒组装是重要的。rep78/68充当病毒复制起始蛋白并充当病毒基因组的复制酶(chejanovsky和carter,jvirol.,1990,64:1764
–
1770;hong等人,proc natlacad sci usa,1992,89:4673
–
4677;ni.等人,jvirol.,1994,68:1128
–
1138)。rep52/40蛋白是具有3'到5'极性的dna解旋酶,并且在将病毒dna包装到空衣壳内的过程中起关键作用,在其中它们被视为包装马达复合物的部分(smith和kotin,j.virol.,1998,4874
–
4881;king等人,embo j.,2001,20:3282-3291)。为了在昆虫细胞平台中从杆状病毒载体产生aav,rep68和rep40两者的存在不是先决条件(urabe等人,2002)。
[0075]
编码细小病毒rep蛋白的核苷酸序列在本文中应理解为编码两种非结构rep蛋白rep 78和rep52中的至少一种的核苷酸序列,所述两种非结构rep蛋白一起对于昆虫细胞中的细小病毒载体产生是所需的和足够的。细小病毒核苷酸序列优选来自依赖病毒,更优选来自人或猿腺伴随病毒(aav),且最优选来自正常感染人(例如血清型1、2、3a、3b、4、5、6、8和9)或灵长类动物(例如血清型1和4)的aav。编码细小病毒rep蛋白的核苷酸序列的实例在seq id no.37(参见包括在本文中作为参考的wo 2009/104964的seq id no.5)中给出,其描绘了编码rep蛋白的aav血清型2序列基因组的部分。rep78编码序列包含核苷酸11-1876,并且rep52编码序列包含核苷酸683-1876,也在seq id no.37和39(参见包括在本文中作为参考的wo 2009/104964的seq id no.5和7)中分开描绘。应理解,rep78和rep52蛋白的确切分子量以及翻译起始密码子的确切位置在不同的细小病毒之间可能不同。然而,技术人员将知道如何从除aav-2外的其它细小病毒中鉴定核苷酸序列中的相应位置。
[0076]
根据本发明,细胞优选包含整合到其基因组内的第一核酸构建体,其包含用于表达细小病毒rep蛋白的至少第一表达盒和第二表达盒。
[0077]
第一表达盒包含与编码mrna的核苷酸序列可操作地连接的第一启动子,所述mrna
在细胞中的翻译产生细小病毒rep 78和68蛋白中的至少一种。编码mrna(其在昆虫细胞中的翻译产生细小病毒rep 78和68蛋白中的至少一种)的核苷酸序列可以定义为这样的核苷酸序列:a)其编码包含氨基酸序列的多肽,所述氨基酸序列与seq id no.40(参见包括在本文中作为参考的wo 2009/104964的seq id no.8)的氨基酸序列具有至少50、60、70、80、88、89、90、95、97、98或99%的序列相同性;b)其与seq id no.39(参见包括在本文中作为参考的wo 2009/104964的seq id no.7)的位置11
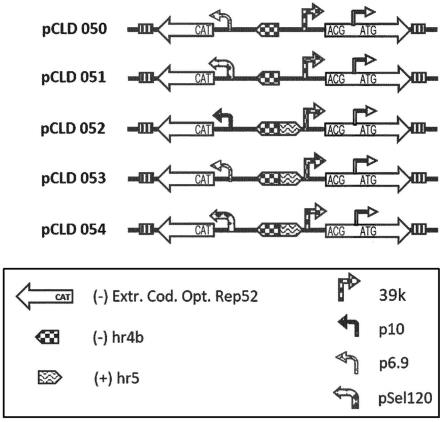
–
1876的核苷酸序列具有至少50、60、70、80、81、82、85、90、95、97、98或99%的序列相同性;c)与(a)或(b)的核酸分子序列杂交的互补链;以及d)核苷酸序列,其序列由于遗传密码的简并性而不同于(c)的核酸分子的序列。优选地,核苷酸序列编码mrna,其在昆虫细胞中的翻译仅产生细小病毒rep 78和68蛋白中的至少一种。应理解,mrna在昆虫细胞中的翻译通常仅产生至少细小病毒rep 78蛋白,而无需产生细小病毒rep 68蛋白。应进一步理解,虽然核苷酸序列编码mrna,其在昆虫细胞中的翻译仅产生细小病毒rep 78和68蛋白中的至少一种(而不是细小病毒rep 52和40蛋白),但这并不排除核苷酸序列包含在昆虫细胞中具有活性并产生另外mrna的内部内源性细小病毒p19启动子,所述mrna在昆虫细胞中的翻译产生细小病毒rep 52和40蛋白中的至少一种。在一个优选的实施方案中,编码mrna的核苷酸序列实际上包含优选是完整的或至少在昆虫细胞中具有活性的细小病毒p19启动子,所述mrna在昆虫细胞中的翻译仅产生细小病毒rep78和68蛋白中的至少一种。
[0078]
第二表达盒包含与编码mrna的核苷酸序列可操作地连接的第二启动子,所述mrna在细胞中的翻译产生细小病毒rep 52和40蛋白中的至少一种。编码mrna(其在昆虫细胞中的翻译产生细小病毒rep 52和40蛋白中的至少一种)的核苷酸序列可以定义为这样的核苷酸序列:a)其编码包含氨基酸序列的多肽,所述氨基酸序列与seq id no.38(参见包括在本文中作为参考的wo 2009/104964的seq id no.6)的氨基酸序列具有至少50、60、70、80、88、89、90、95、97、98或99%的序列相同性;b)其与seq id no.33
–
37(参见包括在本文中作为参考的wo 2009/104964的seq id no.1-5)和seq id no.15中的任何一个的核苷酸序列具有至少50、60、70、80、81、82、85、90、95、97、98或99%的序列相同性,其中seq id no.15是优选的;c)与(a)或(b)的核酸分子序列杂交的互补链;以及d)核苷酸序列,其序列由于遗传密码的简并性而不同于(c)的核酸分子的序列。优选地,核苷酸序列编码mrna,其在昆虫细胞中的翻译仅产生细小病毒rep 52和40蛋白中的至少一种。因而应理解,编码细小病毒rep 52和/或40蛋白的核苷酸序列并非也编码细小病毒rep 78和/或68蛋白的更大编码序列的部分。优选地,编码mrna(其在细胞中的翻译仅产生细小病毒rep 52和40蛋白中的至少一种)的核苷酸序列包含开放读码框,其由从细小病毒rep 52和40蛋白中的至少一种的翻译起始密码子到最c末端氨基酸的氨基酸序列组成,更优选地,所述开放读码框是包含在编码mrna的核苷酸序列中的唯一开放读码框。应进一步理解,mrna在昆虫细胞中的翻译通常仅产生至少细小病毒rep 52蛋白,而无需产生细小病毒rep 40蛋白。
[0079]
优选地,核苷酸序列编码细小病毒rep蛋白,其在以下的意义上是功能活性的:它们具有足以用于昆虫细胞中的细小病毒载体产生的病毒复制起始蛋白、病毒基因组的复制酶、dna解旋酶和如上所述将病毒dna包装到空衣壳内的所需活性。
[0080]
在一个实施方案中,除rep78和rep52翻译起始位点外,rep蛋白编码序列中可能的错误翻译起始位点被消除。在一个实施方案中,可以在昆虫细胞中识别的假定剪接位点从
rep蛋白编码序列中消除。本领域技术人员将充分理解这些位点的消除。
[0081]
在一个优选的实施方案中,细小病毒rep 78和68蛋白中的至少一种以及细小病毒rep 52和40蛋白中的至少一种包含共同氨基酸序列,其包含从细小病毒rep 52和40蛋白中的至少一种的第二个氨基酸到最c末端氨基酸的氨基酸序列,其中细小病毒rep78和68蛋白中的至少一种以及细小病毒rep 52和40蛋白中的至少一种的共同氨基酸序列是至少90、91、92、93、94、95、96、97、98、99或100%相同的,并且其中编码细小病毒rep 78和68蛋白中的至少一种的共同氨基酸序列的核苷酸序列、以及编码细小病毒rep 52和40蛋白中的至少一种的共同氨基酸序列的核苷酸序列是小于90、89、88、87、86、85、84、83、82、81、80、79、78、77、76、75、74、73、72、71、70、69、68、67、66、60%相同的。
[0082]
在一个进一步的实施方案中,与编码细小病毒rep 52和40中的至少一种的共同氨基酸序列的核苷酸序列相比,编码细小病毒rep 78和68蛋白中的至少一种的共同氨基酸序列的核苷酸序列具有关于细胞改善的密码子使用偏倚。然而,优选地,与编码细小病毒rep 78和68蛋白中的至少一种的共同氨基酸序列的核苷酸序列相比,编码细小病毒rep 52和40蛋白中的至少一种的共同氨基酸序列的核苷酸序列具有关于细胞改善的密码子使用偏倚。
[0083]
编码共同氨基酸序列的核苷酸序列对宿主细胞的密码子使用的适应性可以表示为密码子适应指数(cai)。优选地,密码子使用适于在其中表达具有共同氨基酸序列的rep蛋白的昆虫细胞。通常这将是草地贪夜蛾属(spodoptera)的细胞,更优选草地贪夜蛾(spodopterafrugiperda)细胞。因此,密码子使用优选适于草地贪夜蛾或苜蓿银纹夜蛾核型多角体病毒(acmnpv)感染的细胞。密码子适应指数在本文中定义为基因的密码子使用针对高度表达的基因的密码子使用的相对适应性的测量。每个密码子的相对适应性(w)是每个密码子的使用/对于相同氨基酸最丰富的密码子的使用的比率。cai指数定义为这些相对适应性值的几何平均值。排除非同义密码子和终止密码子(取决于遗传密码)。cai值范围从0到1,其中值越高指示最丰富密码子的比例越高(sharp和li,1987,nucleic acids research 15:1281-1295;还参见:kim等人,gene.1997,25199:293-301;zur megede等人,journal ofvirology,2000,74:2628-2635)。
[0084]
优选地,编码细小病毒rep 78和68蛋白中的至少一种以及细小病毒rep 52和40蛋白中的至少一种中的共同氨基酸序列的核苷酸序列之间的密码子适应指数差异为至少0.1、0.2、0.3、0.4、0.5、0.6、0.7或0.8,由此更优选地,编码细小病毒rep 52和40蛋白中的至少一种中的共同氨基酸序列的核苷酸序列的cai为至少0.5、0.6、0.7、0.8、0.9或1.0。
[0085]
因此,在一个替代实施方案中,细小病毒rep 78和68蛋白中的至少一种以及细小病毒rep 52和40蛋白中的至少一种包含共同氨基酸序列,其包含从细小病毒rep 52和40蛋白中的至少一种的第二个氨基酸到最c末端氨基酸的氨基酸序列,其中细小病毒rep 78和68蛋白中的至少一种以及细小病毒rep 52和40蛋白中的至少一种的共同氨基酸序列是至少90%相同的,并且其中编码细小病毒rep 78和68蛋白中的至少一种的共同氨基酸序列的核苷酸序列、以及编码细小病毒rep 52和40蛋白中的至少一种的共同氨基酸序列的核苷酸序列是小于90%相同的,并且与编码细小病毒rep 52和40中的至少一种的共同氨基酸序列的核苷酸序列相比,编码细小病毒rep 78和68蛋白中的至少一种的共同氨基酸序列的核苷酸序列具有关于细胞改善的密码子使用偏倚,或其中与编码细小病毒rep 78和68蛋白中的至少一种的共同氨基酸序列的核苷酸序列相比,编码细小病毒rep 52和40蛋白中的至少一
种的共同氨基酸序列的核苷酸序列具有关于细胞改善的密码子使用偏倚,其中优选地,编码细小病毒rep 78和68蛋白中的至少一种以及细小病毒rep 52和40蛋白中的至少一种中的共同氨基酸序列的核苷酸序列之间的密码子适应指数差异为至少0.2。在一个优选的实施方案中,对于昆虫细胞具有改善的密码子使用偏倚、编码细小病毒rep 52和40蛋白中的至少一种中的共同氨基酸序列的核苷酸序列具有这样的核苷酸序列,其中至少80、85、90、95、96、97、98、99或100%的密码子与seq id no.15中的密码子相同。
[0086]
细小病毒rep蛋白的温度优化指使用关于在其下昆虫细胞将生长并且rep发挥功能的温度的最佳条件。rep蛋白可能例如在37℃下具有最佳活性,而昆虫细胞可能在28℃下最佳生长。在其下rep蛋白具有活性并且昆虫细胞生长的温度可能是30℃。在一个优选实施方案中,优化温度大于27、28、29、30、31、32、33、34或35℃和/或小于37、36、35、34、33、32、31、30或29℃。
[0087]
在一个实施方案中,细胞中的第一表达盒和第二表达盒进行优化,以获得(昆虫)细胞中的rep78/rep52的所需摩尔比。优选地,细胞中的第一表达盒和第二表达盒的组合在(昆虫)细胞中产生在1:10至10:1、1:5至5:1、或1:3至3:1范围内的rep78/rep52的摩尔比。更优选地,第一核酸构建体产生其为至少1:2、1:3、1:5或1:10的rep78/rep52的摩尔比。rep78/rep52的摩尔比可以借助于蛋白质印迹进行确定,优选使用识别rep78和rep52两者的共同表位的单克隆抗体,或使用例如小鼠抗rep抗体(303.9,progen,德国;稀释度1:50)。
[0088]
rep78/rep52的所需摩尔比可以通过在第一表达盒和第二表达盒中分别选择启动子来获得,如上文进一步描述的。可替代地或组合地,可以通过使用减少细小病毒rep 78和68蛋白中的至少一种的稳态水平的手段,来获得rep78/rep52的所需摩尔比。
[0089]
因此,在一个实施方案中,编码细小病毒rep 78和68蛋白中的至少一种的mrna的核苷酸序列包含影响细小病毒rep 78和68蛋白中的至少一种的稳态水平减少的修饰。减少的稳态条件可以例如通过以下来达到:截断调控元件或上游启动子(urabe等人,同上,dong等人,同上),添加蛋白质降解信号肽例如pest或泛素化肽序列,将起始密码子取代为更次优的密码子,或如wo 2008/024998中所述引入人工内含子。
[0090]
在一个优选的实施方案中,编码细小病毒rep 78和68蛋白中的至少一种的核苷酸序列包含以次优翻译起始密码子开始的开放读码框。次优起始密码子优选是影响部分外显子跳跃的起始密码子。部分外显子跳跃在本文中应理解为意指至少部分核糖体并不在rep78蛋白的次优起始密码子处起始翻译,而是可以在进一步下游的起始密码子处起始,由此优选地,进一步下游的(第一)起始密码子是rep52蛋白的起始密码子。可替代地,编码细小病毒rep78和68蛋白中的至少一种的核苷酸序列包含以次优翻译起始密码子开始并且在进一步下游没有起始密码子的开放读码框。当核苷酸序列在昆虫细胞中表达时,次优起始密码子优选影响部分外显子跳跃。优选地,次优起始密码子影响昆虫细胞中的部分外显子跳跃,以便在昆虫细胞中产生在1:10至10:1、1:5至5:1、或1:3至3:1范围内的rep78/rep52的摩尔比。rep78/rep52的摩尔比可以借助于蛋白质印迹进行确定,优选使用识别rep78和rep52两者的共同表位的单克隆抗体,或使用例如小鼠抗rep抗体(303.9,progen,德国;稀释度1:50)。
[0091]
术语“次优起始密码子”在本文中不仅指三核苷酸起始密码子本身,还指其背景。因此,次优起始密码子可能由次优背景例如非kozak背景下的“最佳”atg密码子组成。然而,
更优选的是次优起始密码子,其中三核苷酸起始密码子本身是次优的,即不是atg。次优在本文中应理解为意指与正常atg密码子相比,密码子在其它方面相同的背景下的翻译起始中是更不有效的。优选地,在其它方面相同的背景下,次优密码子的效率是正常atg密码子效率的小于90、80、60、40或20%。用于比较翻译起始的相对效率的方法本身是技术人员已知的。优选的次优起始密码子可以选自acg、ttg、ctg和gtg。更优选的是acg。编码细小病毒rep蛋白的核苷酸序列在本文中应理解为编码非结构rep蛋白的核苷酸序列,所述非结构rep蛋白对于昆虫细胞中的细小病毒载体产生是所需的和足够的,例如rep78和rep52蛋白。
[0092]
衣壳蛋白
[0093]
为了产生完整的细小病毒基因治疗载体病毒粒子,细胞优选进一步包括包含核苷酸序列的进一步的(第三)表达盒,所述核苷酸序列包含用于在昆虫细胞中表达的可操作地连接到第三启动子的细小病毒衣壳蛋白编码序列。
[0094]
编码细小病毒衣壳(cap)蛋白的核苷酸序列在本文中应理解为包括编码三种细小病毒衣壳蛋白vp1、-2和-3中的一种或多种的核苷酸序列。细小病毒核苷酸序列优选来自依赖病毒,更优选来自人或猿腺伴随病毒(aav),且最优选来自正常感染人(例如血清型1、2、3a、3b、4、5、6、7、8、9、10、11、12或13)或灵长类动物(例如血清型1和4)的aav,其核苷酸序列和氨基酸序列在lubelski等人us2017356008中列出,所述专利整体引入本文作为参考。因此,根据本发明的核酸构建体可以包含如通过lubelski等人us2017356008公开的关于aav衣壳蛋白的整个开放读码框。可替代地,该序列可以是人造的,例如,该序列可以是杂合形式,或可以是例如通过acmnpv或草地贪夜蛾的密码子使用进行密码子优化的。例如,衣壳序列可以由aav1的vp2和vp3序列构成,而vp1序列的剩余部分是aav5。优选的衣壳蛋白是aav5或aav2/5杂合体,优选(本技术中分别为seq id no.30和29)或aav8,优选seq id no.41(参见lubelski等人us2017356008中的seq id no.28)。因此,在一个优选的实施方案中,aav衣壳蛋白是已根据本发明进行修饰的aav血清型5、杂合血清型2/5或aav血清型8衣壳蛋白。更优选地,aav衣壳蛋白是已根据本发明进行修饰的aav血清型5衣壳蛋白。更优选地,cap编码序列至少是capaav2/5(seq id no.29)和aav5(seq id no.30)。应理解,衣壳蛋白的准确分子量以及翻译起始密码子的准确位置在不同细小病毒之间可能不同。然而,技术人员将知道如何从除aav5外的其它细小病毒中鉴定核苷酸序列中的相应位置。可替代地,编码aav衣壳蛋白的序列是例如作为定向进化实验的结果的人造序列。这可以包括经由dna改组、易错pcr、生物信息学合理设计、位点饱和诱变的衣壳文库生成。所得到的衣壳基于现有血清型,但含有各种氨基酸或核苷酸变化,其改善此类衣壳的特征。所得到的衣壳可以是现有血清型的各种部分的组合,“改组衣壳”或含有全新的变化,即按组组构或者在基因或蛋白质的整个长度上分散的一个或多个氨基酸或核苷酸的添加、缺失或取代。参见例如,引入本文作为参考的schaffer和maheshri;proceedings ofthe 26thannual international conference ofthe ieee embs san francisco,ca,usa;september 1-5,2004,第3520-3523页;asuri等人,2012,molecular therapy 20(2):329-3389;lisowski等人,2014,nature 506(7488):382-386。
[0095]
在本发明的一个优选实施方案中,编码vpl衣壳蛋白的开放读码框以选自以下的非规范翻译起始密码子开始:acg、att、ata、aga、agg、aaa、ctg、ctt、ctc、cta、cga、cgc、ttg、tag和gtg。优选地,非规范翻译起始密码子选自gtg、ctg、acg和ttg,更优选地,非规范翻译
起始密码子是ctg。
[0096]
本发明的用于表达aav衣壳蛋白的核苷酸序列进一步优选包含编码aavvp1衣壳蛋白的核苷酸序列的至少一种修饰,所述修饰选自在vp1开放读码框的核苷酸位置12处的g、在核苷酸位置21处的a和在核苷酸位置24处的c,其中所述核苷酸位置对应于野生型核苷酸序列的核苷酸位置。“潜在的/可能的错误起始位点”或“潜在的/可能的错误翻译起始密码子”在本文中应理解为意指定位于衣壳蛋白的编码序列中的框内atg密码子。本领域技术人员将充分理解在其它血清型的vp1编码序列内的可能的错误翻译起始位点的消除,如在昆虫细胞中可能被识别的推定剪接位点的消除一样。例如,对于重组aav5不需要对在位置12处的核苷酸的修饰,因为核苷酸t并不产生错误的atg密码子。编码细小病毒衣壳蛋白的核苷酸序列的具体实例在seq id no.44、45和46中给出。编码本发明的细小病毒cap和/或rep蛋白的核苷酸序列也可以通过其在中等或优选严格杂交条件下,分别与seq id no.44、45、46和33至37的核苷酸序列杂交的能力来定义。
[0097]
衣壳蛋白编码序列可以以各种形式存在。例如,可以使用关于衣壳蛋白vp1、-2和-3各自的分开的编码序列,由此每种编码序列可操作地连接到用于在昆虫细胞中表达的表达控制序列。然而,更优选地,第三表达盒包括包含编码所有三种细小病毒(aav)vp1、vp2和vp3衣壳蛋白的单个开放读码框的核苷酸序列,其中用于vp1衣壳蛋白翻译的起始密码子是并非atg的次优起始密码子,如例如通过urabe等人(2002,同上)和wo2007/046703中描述的。关于vp1衣壳蛋白的次优起始密码子可以如上文关于rep78蛋白定义的。关于vp1衣壳蛋白的更优选的次优起始密码子可以选自acg、ttg、ctg和gtg,其中ctg和gtg是最优选的。
[0098]
在一个替代实施方案中,第二表达盒包括包含编码所有三种细小病毒(aav)vp1、vp2和vp3衣壳蛋白的单个开放读码框的核苷酸序列,其中用于vp1衣壳蛋白翻译的起始密码子是atg,并且其中如核苷酸序列中编码的编码vp1衣壳蛋白的mrna包含在vp1衣壳蛋白的开放读码框的框外的替代起始密码子(如wo2019/016349中所述)。优选地,替代起始密码子选自ctg、atg、acg、ttg、gtg、ctc和ctt,其中atg是优选的。优选地,aav衣壳蛋白是aav5血清型衣壳蛋白。优选地,在该实施方案中,核苷酸序列包含以替代起始密码子开始的替代开放读码框,所述替代起始密码子涵盖关于vp1的所述atg翻译起始密码子,由此优选地,在替代起始密码子之后的替代开放读码框编码至多20个氨基酸的肽。
[0099]
包含在用于表达衣壳蛋白的第二表达盒中的核苷酸序列可以进一步包含如wo2007/046703中所述的一种或多种修饰。vp编码区的各种进一步修饰是本领域技术人员已知的,其可以增加vp和病毒粒子的产率或具有其它所需效应,例如改变的嗜性或减少病毒粒子的抗原性。这些修饰在本发明的范围内。
[0100]
在一个实施方案中,与vp2和vp3的表达相比,vp1的表达是增加的。如wo 2007/084773中已描述的,可以通过补充vp1、通过将包含vp1的核苷酸序列的单一载体引入昆虫细胞内来增加vp1表达。
[0101]
通常,在本发明的方法中,至少一个开放读码框包含编码vp1、vp2和vp3衣壳蛋白的核苷酸序列,或至少一个开放读码框包括包含编码rep78和rep68蛋白中的至少一种的核苷酸序列的开放读码框。在一个实施方案中,vp1、vp2和vp3衣壳蛋白或包含开放读码框(其包含编码rep78和rep68蛋白中的至少一种的核苷酸序列)的至少一个开放读码框并不包含人工内含子(或衍生自人工内含子的序列)。即,至少用于编码rep或vp蛋白的开放读码框并
不包含人工内含子。人工内含子意指在腺伴随病毒rep或cap序列中并不天然存在的内含子,例如已进行改造以便允许在昆虫细胞内的功能性剪接的内含子。因此,在该上下文中的人工内含子涵盖野生型昆虫细胞内含子。本发明的表达盒可以包含天然截短的内含子序列(天然意指在腺伴随病毒中天然存在的序列)
–
此类序列并不预期落入如本文定义的人工内含子的含义内。
[0102]
在本发明中,一种可能性是包含编码vp1、vp2和vp3衣壳蛋白的核苷酸序列的开放读码框、和/或包含编码rep78和rep68蛋白中的至少一种的核苷酸序列的开放读码框并不包含人工内含子。
[0103]
优选地,本发明的编码aav衣壳蛋白的核苷酸序列可操作地连接到用于在昆虫细胞中表达的表达控制序列。这些表达控制序列将至少包括在昆虫细胞中具有活性的启动子。用于转录本发明的编码aav衣壳蛋白的核苷酸序列的合适启动子是例如多面体启动子(polh),seq id no,42的此类polh启动子及其seq id no.43的缩短版本(参见lubelski等人us2017356008中的seq id no.:53及其缩短版本seq id no.54)。然而,在昆虫细胞中具有活性并且可以根据本发明进行选择的其它启动子是本领域已知的,例如多角体蛋白(polh)启动子、p10启动子、p35启动子、4xhsp27 ecre+最小hsp70启动子、δe1启动子、e1启动子或ie-1启动子、以及上文参考文献中描述的进一步启动子。
[0104]
病毒载体
[0105]
本发明涉及细小病毒,特别是依赖病毒如感染性人或猿aav及其组分(例如细小病毒基因组),用作在哺乳动物细胞,优选人细胞中引入和/或表达核酸的载体的用途。特别地,本发明涉及当在昆虫细胞中产生时,此类细小病毒载体的生产率的改善。
[0106]“细小病毒载体”定义为重组产生的细小病毒或细小病毒颗粒,其包含待在体内、离体或在体外递送到宿主细胞内的多核苷酸。细小病毒载体的实例包括例如腺伴随病毒载体。在本文中,细小病毒载体构建体指包含病毒基因组或其部分和转基因的多核苷酸。细小病毒科(parvoviridae)的病毒是小dna病毒。细小病毒科可以分为两个亚科:感染脊椎动物的细小病毒亚科(parvovirinae)和感染无脊椎动物包括昆虫的浓病毒亚科(densovirinae)。细小病毒亚科的成员在本文中被称为细小病毒并且包括依赖病毒属(dependovirus)。如从它们的属名可以推断的,依赖病毒属的成员是独特的,因为它们通常需要与辅助病毒如腺病毒或疱疹病毒的共感染用于细胞培养物中的生产性感染。依赖病毒属包括aav,其通常感染人(例如血清型1、2、3a、3b、4、5、6、7、8、9、10、11、12和13)或灵长类动物(例如血清型1和4),以及感染其它温血动物的有关病毒(例如,牛科动物、犬科动物、马科动物和羊科动物的腺伴随病毒)。关于细小病毒和细小病毒科的其它成员的进一步信息在kenneth i.berns,"parvoviridae:the viruses andtheir replication,"fields virology中的第69章(第3版1996)中进行描述。为方便起见,本发明在本文中通过提及aav进行进一步例示且描述。然而应理解,本发明并不限于aav,而是可以同样地应用于其它细小病毒。
[0107]
所有已知aav血清型的基因组组构是非常相似的。aav的基因组是长度小于约5,000个核苷酸(nt)的线性单链dna分子。反向末端重复(itr)侧接关于非结构复制(rep)蛋白和结构病毒颗粒(vp)蛋白的独特编码核苷酸序列。vp蛋白(vp1、-2和-3)形成衣壳。末端145nt itr是自互补的,并且这样组构,使得可以形成能量上稳定的分子内双链体,其形成t
形发夹。这些发夹结构充当病毒dna复制的起点,充当细胞dna聚合酶复合物的引物。在哺乳动物细胞中的野生型(wt)aav感染之后,rep基因(即rep78和rep52)分别由p5启动子和p19启动子表达,并且两种rep蛋白在病毒基因组的复制和包装中均具有功能。rep orf中的剪接事件导致实际上四种rep蛋白(即rep78、rep68、rep52和rep40)的表达。然而,已显示了,哺乳动物细胞中的编码rep78和rep52蛋白的未剪接mrna足以用于aav载体产生。同样在昆虫细胞中,rep78和rep52蛋白足以用于aav载体产生。三种衣壳蛋白vp1、vp2和vp3由来自p40启动子的单个vp读码框表达。哺乳动物细胞中的wtaav感染依赖于两个剪接受体位点的交替使用和关于vp2的acg起始密码子的次优利用的组合的衣壳蛋白产生。
[0108]“重组细小病毒或aav载体”(或“raav载体”)在本文中指包含一种或多种目的多核苷酸序列、目的基因或“转基因”的载体,所述转基因的侧翼为至少一种细小病毒或aav反向末端重复序列(itr)。优选地,转基因的侧翼为itr,在转基因的每一侧上一个。当存在于表达aavrep和cap基因产物(即aavrep和cap蛋白)的昆虫宿主细胞中时,此类raav载体可以复制并包装到感染性病毒颗粒内。当raav载体掺入更大的核酸构建体内(例如,染色体中、或者另一种载体例如用于克隆或转染的质粒或杆状病毒中)时,那么raav载体通常被称为“原载体”,其在aav包装功能和必要的辅助功能的存在下,可以通过复制和衣壳化进行“拯救”。
[0109]
本发明涉及用于在昆虫细胞中产生重组细小病毒(raav)病毒粒子的方法,所述病毒粒子包含重组细小病毒(raav)载体。在一个实施方案中,细小病毒rep 78和68蛋白中的至少一种,细小病毒rep 52和40蛋白中的至少一种,细小病毒vp1、vp2和vp3衣壳蛋白以及至少一种细小病毒反向末端重复序列来自腺伴随病毒(aav)。优选地,核苷酸序列具有相同的血清型。更优选地,核苷酸序列彼此不同之处在于它们可以是密码子优化的、at优化的或gc优化的,以使重组降到最低或预防重组。优选地,编码细小病毒rep蛋白的共同氨基酸序列的第一核苷酸序列和第二核苷酸序列中的差异通过以下中的一种或多种达到最大(即核苷酸相同性降到最低):a)改变编码细小病毒rep共同氨基酸序列的第一核苷酸序列的密码子偏倚;b)改变编码细小病毒rep共同氨基酸序列的第二核苷酸序列的密码子偏倚;c)改变编码共同氨基酸序列的第一核苷酸序列的gc含量;以及d)改变编码共同氨基酸序列的第二核苷酸序列的gc含量。密码子优化可以基于本发明的方法中使用的昆虫细胞,优选草地夜蛾的密码子使用来进行,如可以在密码子使用数据库中找到的(参见例如http://www.kazusa.or.jp/codon/)。用于密码子优化的合适计算机程序对于技术人员是可获得的(参见例如jayaraj等人,2005,nucl.acids res.33(9):3011-3016;以及在互联网上)。可替代地,可以使用相同的密码子使用数据库手动完成优化。
[0110]
转基因
[0111]
在一个实施方案中,细胞进一步包含:a)核苷酸序列,其包含用于在昆虫细胞中表达的可操作地连接到第三启动子的细小病毒衣壳蛋白编码序列;b)包含转基因的核苷酸序列,所述转基因的侧翼为至少一种细小病毒反向末端重复序列;以及c)包含用于表达转录反式调节蛋白的表达盒的核苷酸序列。
[0112]
在一个进一步的实施方案中,a)和b)中的至少一种的核苷酸序列包含在杆状病毒载体中,其中优选地,a)、b)和c)中的至少一种的核苷酸序列包含在杆状病毒载体中,所述杆状病毒载体包含用于表达转录反式调节蛋白的表达盒。
[0113]
在本发明的上下文中,“至少一种细小病毒反向末端重复核苷酸序列”应理解为意
itr序列衍生自aav1、aav2、aav4和/或aav7。同样地,rep(rep78/68和rep52/40)编码序列优选地衍生自aav1、aav2、aav4和/或aav7。然而,编码用于本发明的上下文中的vp1、vp2和vp3衣壳蛋白的序列可以取自已知的42种血清型中的任一种,更优选取自aav1、aav2、aav3、aav4、aav5、aav6、aav7、aav8.aav9、aav10、aav11、aav12或aav13或通过例如衣壳改组技术和aav衣壳文库获得的新近开发的aav样颗粒,或者取自新近且合成设计、开发或进化的衣壳,例如anc-80衣壳。
[0117]
aavrep和itr序列在大多数血清型中是特别保守的。各种aav血清型的rep78蛋白是例如多于89%相同的,并且在aav2、aav3a、aav3b和aav6之间在基因组水平上的总核苷酸序列相同性为82%左右(bantel-schaal等人,1999,j.virol.,73(2):939-947)。此外,已知许多aav血清型的rep序列和itr在哺乳动物细胞中的aav颗粒产生方面有效地交叉互补(即功能上取代)来自其它血清型的相应序列。us2003148506报道了aavrep和itr序列还有效地交叉互补昆虫细胞中的其它aav rep和itr序列。
[0118]
已知aav衣壳蛋白(也称为vp蛋白)决定aav病毒粒子的细胞嗜性。vp蛋白编码序列的保守性明显低于不同aav血清型中的rep蛋白和基因。rep和itr序列交叉互补其它血清型的相应序列的能力允许产生假型raav颗粒,其包含一种血清型(例如aav3)的衣壳蛋白以及另一种aav血清型(例如aav2)的rep和/或itr序列。此类假型raav颗粒是本发明的部分。
[0119]
修饰的"aav"序列也可以用于本发明的上下文中,例如用于昆虫细胞中的raav载体产生。此类修饰的序列例如包括与aav1、aav2、aav3、aav4、aav5、aav6、aav7、aav8、aav9、aav10、aav11、aav12或aav13 itr、rep或vp具有至少约70%、至少约75%、至少约80%、至少约85%、至少约90%、至少约95%或更多的核苷酸和/或氨基酸序列相同性的序列(例如,具有约75-99%的核苷酸序列相同性的序列),可以用于代替野生型aavitr、rep或vp序列。
[0120]
尽管在许多方面与其它aav血清型相似,但aav5与其它人和猿aav血清型的区别大于其它已知的人和猿血清型。鉴于此,raav5的产生可以不同于昆虫细胞中的其它血清型的产生。当本发明的方法用于产生raav5时,优选的是一种或多种构建体(在多于一种构建体的情况下共同地)包括包含aav5 itr的核苷酸序列,包含aav5 rep编码序列的核苷酸序列(即核苷酸序列包含aav5 rep78)。此类itr和rep序列可以根据需要进行修饰,以获得在昆虫细胞中的raav5或假型raav5载体的高效生产。例如,可以修饰rep序列的起始密码子,可以修饰或消除vp剪接位点,和/或可以修饰vp1起始密码子和附近的核苷酸,以改善昆虫细胞中的raav5载体产生。
[0121]
在一个优选的实施方案中,本发明的昆虫细胞进一步包括包含转基因的核苷酸序列,所述转基因的侧翼为至少一种细小病毒itr序列。因此,优选地,核苷酸序列包含至少一种aav itr和编码目的基因产物的至少一种核苷酸序列(优选用于在哺乳动物细胞中表达)或靶向目的基因的核苷酸序列(优选用于在哺乳动物细胞中沉默所述目的基因),由此优选地,编码目的基因产物或靶向目的基因的至少一种核苷酸序列变得掺入昆虫细胞中产生的aav的基因组内。优选地,编码目的基因产物的至少一种核苷酸序列是用于在哺乳动物细胞中表达的序列。优选地,靶向目的基因的至少一种核苷酸序列是用于在哺乳动物细胞中沉默所述目的基因的序列。优选地,核苷酸序列包含两种aav itr核苷酸序列,并且其中编码目的基因产物或靶向目的基因的至少一种核苷酸序列定位于两种aavitr核苷酸序列之间。优选地,编码目的基因产物的核苷酸序列(用于在哺乳动物细胞中表达)或靶向目的基因的
核苷酸序列(用于在哺乳动物细胞中沉默所述目的基因)将掺入昆虫细胞中产生的aav基因组内,如果它定位于两种常规itr之间、或者定位于用两个d区改造的itr的任一侧上。因此,在一个优选的实施方案中,本发明提供了根据本发明的昆虫细胞,其中所述核苷酸序列包含两种aav itr核苷酸序列,并且其中编码目的基因产物的至少一种核苷酸序列或靶向目的基因的至少一种核苷酸序列定位于两种aavitr核苷酸序列之间。
[0122]
通常,包括itr以及启动子和多聚腺苷酸化序列的转基因长度为5,000个核苷酸(nt)或更短。在另一个实施方案中,通过使用由本发明描述的aav载体,可以在体外或体内表达过大的dna分子,即长度多于5,000nt。过大的dna在此处应理解为超过5.5kbp的最大aav包装限制的dna。因此,能够产生通常由大于5.0kb的基因组编码的重组蛋白质的aav载体的生成也是可行的。
[0123]
包含如上文定义的转基因的核苷酸序列因此可以包含编码目的基因产物的核苷酸序列(用于在哺乳动物细胞中表达)或靶向目的基因的核苷酸序列(用于在哺乳动物细胞中沉默所述目的基因),并且可以这样定位,使得它将掺入昆虫细胞中复制的重组细小病毒(raav)载体内。在本发明的上下文中,应理解,“目的基因产物”将在其中表达或沉默的特别优选的哺乳动物细胞是人细胞。可以掺入任何核苷酸序列,用于在用按照本发明产生的重组细小病毒(raav)载体转染的哺乳动物细胞中的稍后表达。核苷酸序列可以例如编码蛋白质,或者它可以表达rnai试剂,即能够进行rna干扰的rna分子,例如shrna(短发夹rna)或sirna(短干扰rna)。"sirna"意指其为短长度双链rna的小干扰rna,其在哺乳动物细胞中是无毒的(elbashir等人,2001,nature411:494-98;caplen等人,2001,proc.natl.acad.sci.usa98:9742-47)。在一个优选的实施方案中,包含转基因的核苷酸序列可以包含两种编码核苷酸序列,其各自编码用于在哺乳动物细胞中表达的一种目的基因产物。编码目的产物的两种核苷酸序列各自这样定位,使得它将掺入昆虫细胞中复制的重组细小病毒(raav)载体内。
[0124]
用于在哺乳动物细胞中表达的目的产物可以是治疗性基因产物。治疗性基因产物可以是多肽或rna分子(si/sh/mirna),或当在靶细胞中表达时提供所需疗效的其它基因产物。所需的疗效可以是例如不期望活性(例如vegf)的消除、遗传缺陷的互补、导致疾病的基因的沉默、酶促活性的缺陷的恢复或任何其它疾病缓解效应。治疗性多肽基因产物的实例包括但不限于生长因子、形成凝血级联的部分的因子、酶、脂蛋白、细胞因子、神经营养因子、激素和治疗性免疫球蛋白及其变体。治疗性rna分子产物的实例包括有效沉默疾病的mirna,所述疾病包括但不限于聚谷氨酰胺疾病、血脂异常或肌萎缩侧索硬化(als)。
[0125]
可以使用按照本发明产生的重组细小病毒(raav)载体治疗的疾病并无特别限制,除一般具有遗传原因或基础外。例如,可以用所公开的载体治疗的疾病可以包括但不限于急性间歇性卟啉病(aip)、年龄相关性黄斑变性、阿尔茨海默氏病、关节炎、巴顿病、卡纳万病、1型瓜氨酸血症、crigler najjar、充血性心力衰竭、囊性纤维化、杜兴氏肌营养不良、血脂异常、i型糖原贮积病(gsd-i)、血友病a型、血友病b型、遗传性肺气肿、纯合型家族性高胆固醇血症(hofh)、亨廷顿氏病(hd)、莱伯氏先天性黑蒙症、甲基丙二酸血症、鸟氨酸转氨甲酰酶缺乏症(otc)、帕金森氏病、苯丙酮尿症(pku)、脊髓性肌萎缩、瘫痪、威尔逊氏病、癫痫、庞贝氏病、肌萎缩侧索硬化(als)、泰-萨克斯病、高草酸尿症9ph-1)、脊髓小脑性共济失调1型(sca-1)、sca-3、u-肌营养不良蛋白、戈谢氏ii型或iii型、致心律失常性右室心肌病
(arvc)、法布里病、家族性地中海热(fmf)、丙酸血症、脆性x染色体综合征、瑞特综合征、尼曼-皮克二氏病和克拉伯病。待表达的治疗性基因产物的实例包括n-乙酰氨基葡糖苷酶、α(naglu)、treg167、treg289、epo、igf、ifn、gdnf、foxp3、因子viii、因子ix和胰岛素。
[0126]
可替代地或除作为另一种基因产物之外,包含如上文定义的转基因的核苷酸序列可以进一步包含编码多肽的核苷酸序列,所述多肽充当选择标记物蛋白质以评价细胞转化和表达。用于此目的的合适的标记物蛋白质是例如荧光蛋白gfp、以及可选择标记物基因hsv胸苷激酶(用于在hat培养基上的选择)、细菌潮霉素b磷酸转移酶(用于在潮霉素b上的选择)、tn5氨基糖苷磷酸转移酶(用于在g418上的选择)和二氢叶酸还原酶(dhfr)(用于在氨甲蝶呤上的选择)、cd20、低亲和力神经生长因子基因。用于获得这些标记物基因的来源及其使用方法在sambrook和russel,同上中提供。此外,包含如上文定义的转基因的核苷酸序列可以包含编码多肽的进一步的核苷酸序列,所述多肽可以充当故障安全机制,其允许从用本发明的重组细小病毒(raav)载体转导的细胞治愈对象,如果认为有必要的话。此类核苷酸序列,经常被称为自杀基因,编码能够将前药转换成有毒物质的蛋白质,所述有毒物质能够杀死蛋白质在其中表达的转基因细胞。此类自杀基因的合适实例包括例如大肠杆菌胞嘧啶脱氨酶基因,或者来自单纯疱疹病毒、巨细胞病毒和水痘带状疱疹病毒的胸苷激酶基因之一,在这种情况下,更昔洛韦可以用作前药以杀死对象中的转基因细胞(参见例如clair等人,1987,antimicrob.agents chemother.31:844-849)。
[0127]
用于在哺乳动物细胞中表达的包含如上文定义的转基因的核苷酸序列进一步优选包含至少一种哺乳动物细胞相容的表达控制序列,例如启动子,其与编码目的基因产物的序列可操作地连接。许多此类启动子是本领域已知的(参见sambrook和russel,2001,同上)。可以使用在许多细胞类型中广泛表达的组成型启动子,例如cmv启动子。然而,更优选的是诱导型、组织特异性、细胞类型特异性或细胞周期特异性的启动子。例如,对于肝特异性表达(如pct/ep2019/081743中公开的),启动子可以选自α1-抗胰蛋白酶启动子、甲状腺激素结合球蛋白启动子、白蛋白启动子、lps(甲状腺素结合珠蛋白)启动子、hcr-apocii杂合启动子、hcr-haat杂合启动子和载脂蛋白e启动子、lp1、hlp、最小ttr启动子、fviii启动子、超子增强子、ealb-haat。其它实例包括用于肿瘤选择性,且特别是神经细胞肿瘤选择性表达的e2f启动子(parr等人,1997,nat.med.3:1145-9),或用于在单核血细胞中使用的il-2启动子(hagenbaugh等人,1997,j exp med;185:2101-10)。
[0128]
如上定义的核苷酸序列的各种修饰,包括例如用于在昆虫细胞中的适当表达的野生型细小病毒序列通过应用众所周知的基因工程技术来实现,如例如在sambrook和russell(2001)"molecular cloning:alaboratory manual(第3版),cold spring harbor laboratory,cold spring harbor laboratory press,newyork中描述的。编码区的各种进一步修饰是技术人员已知的,其可以增加编码蛋白质的产率。这些修饰在本发明范围内。
[0129]
aav
[0130]
在本发明的重组细小病毒(raav)载体中,编码用于在哺乳动物细胞中表达的转基因或目的基因产物的至少一种核苷酸序列,优选可操作地连接到至少一种哺乳动物细胞相容的表达控制序列,例如启动子。如上文讨论的,许多此类启动子是本领域已知的。
[0131]
aav能够感染许多哺乳动物细胞。参见例如,tratschin等人(1985,mol.cell biol.5:3251-3260)和grimm等人(1999,hum.gene ther.10:2445-2450)。然而,人滑膜成纤
维细胞的aav转导比类似的鼠细胞中明显更有效,jennings等人,arthritis res,3:1(2001),并且aav的细胞嗜性在血清型中不同。参见例如,davidson等人(2000,proc.natl.acad.sci.usa,97:3428-3432),其讨论了关于哺乳动物cns细胞嗜性和转导效率,在aav2、aav4和aav5中的差异。在一个优选的实施方案中,本发明的宿主细胞是可以被细小病毒病毒粒子感染的任何哺乳动物细胞,例如但不限于肌细胞、肝细胞、神经细胞、神经胶质细胞和上皮细胞。在一个优选的实施方案中,本发明的宿主细胞是人细胞。
[0132]
方法
[0133]
在一个进一步方面,本发明提供了用于产生重组细小病毒病毒粒子的方法。该方法优选包括以下步骤:a)培养如本文定义的昆虫细胞;b)向a)中培养的细胞提供如本文定义的核苷酸序列;并且c)回收重组细小病毒病毒粒子。在一个实施方案中,a)中的细胞培养物用如本文定义的核苷酸序列进行转染,也称为感染。
[0134]
回收优选包括使用抗aav抗体,优选固定化抗体亲和纯化重组细小病毒(raav)载体(包含其的病毒粒子)的步骤。抗aav抗体优选是单克隆抗体。特别合适的抗体是如例如可从骆驼或美洲驼获得的单链骆驼科抗体或其片段(参见例如,muyldermans,2001,biotechnol.74:277-302)。用于raav的亲和纯化的抗体优选是特异性结合aav衣壳蛋白上的表位的抗体,由此优选地,所述表位是存在于多于一种aav血清型的衣壳蛋白上的表位。例如,可以基于与aav2衣壳的特异性结合来产生或选择抗体,但同时它也可以与aav1、aav3和aav5衣壳特异性结合。
[0135]
在一个进一步的实施方案中,其中步骤c)中的回收重组细小病毒病毒粒子包括使用固定化的抗细小病毒抗体,优选单链骆驼科抗体或其片段,对病毒粒子的亲和纯化,以及在标称孔径为30-70nm的过滤器上的过滤中的至少一种。
[0136]
因此,在一个实施方案中,本发明提供了用于在细胞中产生重组细小病毒病毒粒子的方法。该方法优选包括以下步骤:a)培养如本文定义的昆虫细胞;b)用如本文定义的核苷酸序列感染a)中培养的细胞;并且c)回收重组细小病毒病毒粒子,其中步骤b)中的回收重组细小病毒病毒粒子包括使用固定化的抗细小病毒抗体,优选单链骆驼科抗体或其片段,对病毒粒子的亲和纯化,或者在标称孔径为30-70nm的过滤器上的过滤中的至少一种。
[0137]
在一个进一步方面,本发明涉及在本发明的上述方法中产生的细小病毒病毒粒子分批。“细小病毒病毒粒子分批”在本文中定义为任选地每个昆虫细胞容器,在同一轮生产中产生的所有细小病毒病毒粒子。在一个优选的实施方案中,本发明的细小病毒病毒粒子分批包含如上所述的完整病毒粒子:总病毒粒子比率和/或如上所述的完整病毒粒子:空比率。
[0138]
试剂盒
[0139]
在一个进一步方面,本发明提供了试剂盒套组,其至少包含如本文定义的昆虫细胞以及如本文定义的杆状病毒载体和/或核苷酸序列。
附图说明
[0140]
图1.(a)涉及报道分子或pcld表达构建体的瞬时转染和杆状病毒反式激活研究的示意性表示。测量萤光素酶活性用于纳米萤光素酶报道分子研究,并且进行蛋白质印迹以确定来自pcld构建体的rep表达。gsg-p2a是一种自切割肽(wang等人,2015)。(b)在感染后
48小时,在不同杆状病毒反式激活的影响下,来自指示的pcld的aav rep蛋白的表达谱,所述pcld具有指示的调控元件。t:bac trans。ct:bac polh cap trans。c:bac polh cap。(c)在指示的杆状病毒反式激活后,由指示的启动子调控的报道基因表达(纳米萤光素酶)的动力学和强度。相对萤光素酶单位(rlu)(发光的量度)从30μl样品体积中进行测量。模拟(圆圈):通过等体积的新鲜培养基接种的。bac trans(正方形):仅具有aav itr-转基因-itr的重组杆状病毒。bac polh cap trans(三角形):具有polh调控的aav cap基因和itr-转基因-itr的重组杆状病毒。bac polh cap:仅具有polh调控的aav2 cap基因的重组杆状病毒。每个数据点代表一个独立的实验重复。
[0141]
图2.(a)用于比较昆虫细胞中的不同同源重复(hr)元件的增强子活性的报道构建体的分子设计。选择polh启动子作为代表性启动子。(b)杆状病毒基因组中的所有hr序列的核苷酸相似性百分比。(c和d)在指示的杆状病毒反式激活后,由指示的hr增强子调控的报道基因表达的动力学和强度。在30μl样品体积中测量相对萤光素酶单位(rlu)。每个点代表一个独立的实验重复。(e)pcld的分子设计,以比较不同hr对aavrep表达的增强子活性。(f)在感染后48小时,在不同hr增强子的影响下,aavrep蛋白的表达谱。t:bac trans。
[0142]
图3.(a)诱导型单rep盒质粒载体的替代分子设计,以使在bac polh cap trans反式激活后观察到的顺式:反式启动子竞争降到最低。(b)在指示的杆状病毒反式激活后48小时,在与更少泄漏的hr4b增强子和更强的atg起始密码子组合的所示启动子的控制下,aavrep蛋白的表达谱。t:bac trans。ct:bac polh cap trans。
[0143]
图4.(a)在指示的杆状病毒反式激活后,由替代杆状病毒启动子调控的报道基因表达的动力学和强度。(b)用于表征用于39k启动子的替代或次优起始密码子的报道构建体的分子设计。选择hr2.09增强子作为代表增强子。(c)由指示的杆状病毒反式激活诱导的具有替代起始密码子的报道基因表达的动力学和强度。(d)pcld构建体的分子设计,以观察在39k启动子和acg起始密码子的调控下、或(e)在人工内含子内的另外启动子元件下的aavrep表达谱。在指示的杆状病毒反式激活后,来自指示的单rep盒pcld的aavrep蛋白的蛋白质印迹。相对萤光素酶单位(rlu)从30μl样品体积中进行测量。每个数据点代表一个独立的实验重复。
[0144]
图5.(a)密码子优化的aav2 rep的核苷酸相似性百分比。(b)具有指示的调控元件的诱导型拆分rep盒质粒载体的分子设计。(c)在指示的杆状病毒反式激活后,来自拆分rep盒质粒载体的aavrep蛋白的表达谱。((+)和右箭头):正向取向。((-)和左箭头):反向互补取向。t:bac trans。ct:bac polh cap trans。
[0145]
图6.(a)瞬时aav生产实验设置的示意性表示。(b和c)使用指示的pcld转染和杆状病毒反式激活,在瞬时aav生产后3天收获的粗制裂解物缓冲液(clb)中的核酸酶抗性aav颗粒的基因组拷贝滴度(gc/ml)。bac cap5 fix(圆圈):具有polh调控的aavcap5基因和itr-fix-itr的重组杆状病毒。bac cap2/5纳米萤光素酶(三角形):具有polh调控的aav cap2/5(aav2/5)基因和itr-分泌的-nano-luc-itr的重组杆状病毒。(d和e)来自瞬时aav生产实验的aavrep动力学和表达谱。每个符号代表aav分批生产的一个独立重复。
[0146]
图7.(a)avb纯化的aav2/5纳米萤光素酶的vp1:2:3谱。(b)在huh7细胞中建立的aav效力测定的示意性表示。由瞬时aav生产产生的avb纯化的aav2/5颗粒进行标准化,并且用于以105或104gc/细胞的剂量接种huh7细胞。在感染后3天(d.p.i),aav2/5颗粒转导的效
力通过定量分泌到上清液内的纳米萤光素酶活性(相对萤光素酶单位/rlu)进行确定。(c)使用指示的诱导型rep质粒载体(pcld),由瞬时aav生产产生的纯化aav的效力比较。bac rep183:bev衍生的aav材料。每个符号代表aav分批生产的一个独立重复。
[0147]
图8.(a)在变性甲醛琼脂糖凝胶上,从由指示的pcld瞬时转染实验产生的aav分批中提取的aavdna载体基因组的分子分析。关于fix和纳米萤光素酶载体基因组的整个itr-转基因-itr大小分别为2.5kb和2kb。黑色箭头:fix或纳米萤光素酶载体基因组的二聚体重复形式。白色箭头:单体重复形式。m:智能dna梯。高/低exp:凝胶暴露持续时间。(b)基于总组装的aav5衣壳/gc滴度法的假设的aav总:完整比率(tf)。通过对avb纯化的aav颗粒进行elisa分析来确定总组装衣壳的数目。gc滴度也由相同的avb纯化的颗粒获得。
[0148]
图9.(a)新型稳定的irep expressf+细胞系的生成的示意性表示。(b)使用指示的irep细胞系和杆状病毒反式激活,在瞬时aav生产后3天收获的粗制裂解物缓冲液(clb)中的核酸酶抗性aav颗粒的基因组拷贝滴度(gc/ml)和生产率(gc/输入细胞)。每个符号代表aav分批生产的一个独立重复。(c)来自瞬时aav生产实验的aavrep动力学和表达谱。
[0149]
图10.(a)由如指示的irep细胞系产生的avb纯化的aav2/5snano-luc的vp1:2:3谱。(b)纯化的aav颗粒在huh7细胞中的效力比较。3-ple bac:由三重bac生产平台产生的aav材料,并且bac rep:由野生型expressf+细胞中的bac cap trans和bac rep组合生产的aav材料。
[0150]
图11.(a)用于颗粒质量研究和寻源(sourcing)方法的aav5 fix纯化材料列表。irep细胞系替换了野生型expressf+细胞和bac rep的使用,以产生aav材料。(b)在变性甲醛琼脂糖凝胶上,从aav材料中提取的aav dna载体基因组的分子分析。关于fix载体基因组的整个itr-转基因-itr大小为2.5kb。黑色和白色箭头:fix的二聚体单体重复形式。(c)基于总组装的aav5衣壳/gc滴度法的假设的aav总:完整比率(tf)。通过对纯化的aav颗粒进行基于hplc的分析来确定总组装的衣壳。gc滴度也由相同的颗粒获得。(d)纯化的aav材料中的残留bac dna污染的定量。结果显示为每1x 10
13
aav gc的bac dna比率。
[0151]
图12.本研究中使用的质粒的物理图谱:a)pcld 046;b)pcld 050;c)pcld 051;d)pcld 052;e)pcld 053;以及f)pcld 054)。
[0152]
图13.所有杆状病毒hr序列,包括合成的hr序列的核苷酸比对和大小。线显示了指示的hr序列。
[0153]
图14.a)至r):野生型rep52的编码序列、rep183 rep52(如wo2009/014445中所述)和极端密码子优化的rep52编码序列(seq id no:15)的核苷酸比对。
[0154]
图15.(a)用于验证irep稳定细胞库的实验设置方案。黄色指示1l摇瓶中的预培养传代(第0-3代)。绿色指示2l str中的种子训练(seed train)生产(第4-9代)。红色指示使用来自2l str处于第5、7和9代的irep稳定细胞库,通过用杆状病毒bac cap5 fix第5代的转染,在1l摇瓶中的aav生产事件。(b)关于irep稳定库的验证的时间线。括号中的数字指示用于转染的irep稳定库细胞的生成。(c)在用bac cap5fix(p5)转染后的48和72小时,处于第5、7和9代的irep稳定库细胞中的rep 78和rep 52表达。(d)作为用bac cap5 fix(p5)转染后72小时的结果,在fclb中的转基因fix的基因组拷贝。moi指示用于转染irep稳定库细胞的bac cap5 fix p5的体积比。括号中的数字指示用于转染的irep稳定库细胞的传代数。
[0155]
实施例
[0156]
材料和方法
[0157]
细胞培养
[0158]
huh7细胞在37℃、5%co2下,在补充有10%(v/v)胎牛血清(fbs)的达尔贝科改良伊格尔培养基(dmem,invitrogen)中得到维持。sf9和expressf+细胞在28℃、135rpm下,在摇瓶中的sf-900 ii sfm(gibco)中得到维持。在sf9细胞的情况下,培养的细胞补充有10%fbs(gibco)。
[0159]
诱导型表达质粒和重组杆状病毒构建
[0160]
所有诱导型表达质粒系列(pcld)和纳米萤光素酶报道构建体都使用geneart基因合成服务(thermofisher)来产生。为了生成仅包含itr-转基因-itr(bac trans)或仅包含aavcap表达盒(bac polh cap2/5;urabe,m.等人,2006)、或aav cap表达盒和itr-转基因两者(bac polh cap5-人因子ix或bac polh cap2/5-分泌的纳米萤光素酶[纳米萤光素酶])的重组杆状病毒,通过使用cellfectine ii试剂,用pvd-itr-转基因-itr(seap转基因)(seq id no.01)或pvd-polh-cap(polh cap2)(seq id no.02)或pvd-polh-cap-itr-转基因-itr(polh cap trans)(cap5 fix:seq id no.03,cap2/5纳米萤光素酶:seq id no.29)和线性化的杆状病毒基因组转染细胞。然后,将阳性细胞噬斑转移到贴壁培养的sf9细胞内。在转染后72小时,来自sf9细胞的感染上清液在expressf+细胞中进行进一步传代且扩增,直到达到第4代(p4)。在分析重组事件和基因组稳定性后,来自所选重组杆状病毒的p4材料作为等分试样贮存于液氮中,并且在表征实验之前仅新鲜扩增为p5工作种子病毒。表达aav2 rep(bac rep183)(seq id no.04)的杆状病毒如先前说明的(urabe,m.等人,2006)生成。这种bac rep183也被称为拆分盒aavrep或拆分rep。
[0161]
aav载体生产
[0162]
通过用包含指示的aavcap和转基因的新鲜扩增的重组杆状病毒原种(p4
→
p5)感染瞬时转染的expressf+昆虫细胞来生成aav变体(urabe,m.等人,2002)。在28℃下的72小时温育后,细胞用1%triton x-100裂解1小时。基因组dna在37℃下经由benzonase(merck)处理消化1小时,并且通过以1900
×
g离心15分钟去除细胞碎片。澄清的裂解物贮存于4℃下直至纯化开始,并且使用具有针对指示转基因的启动子区的引物和探针的定量聚合酶链反应(qpcr),来确定dna酶抗性的aav颗粒滴度(参见表1)。为了纯化aav载体,使用avb sepharose(ge healthcare)纯化澄清的裂解物。然后通过qpcr确定纯化的病毒滴度。
[0163]
表1.用于qpcr的引物和探针序列。
[0164][0165]
瞬时转染和表达分析
[0166]
为了分析蛋白质表达,expressf+细胞进行贴壁接种,并且用1pg编码诱导型纳米萤光素酶报道分子或rep基因的质粒dna进行转染。cellfectin ii reagent(invitrogen)用于转染。在转染一天后,接种以1%(v/v)最终浓度的指示的p5杆状病毒。
[0167]
sds-page和蛋白质印迹
[0168]
在转染后48小时,用细胞裂解物进行蛋白质印迹分析,所述细胞裂解物来自用ripa缓冲液(sigmaaldrich)+蛋白酶抑制剂混合物(roche)裂解的转染细胞。将细胞裂解物以等体积加载到mini-protean预制4
–
12%bis
–
tris聚丙烯酰胺凝胶(biorad)内。然后使用trans-blot turbo转印系统(biorad),将凝胶印迹到即用型pvdf膜内。然后使膜与α-aav2-rep(progen,德国)一起温育,随后与偶联至辣根过氧化物酶(hrp)(sigma-aldrich)的二抗一起温育。结合的抗体用ecl检测系统(thermo pierce)进行检测,并且经由chemidoc成像仪(biorad)进行成像。对于vp蛋白成像,纯化的aav颗粒的蛋白质组成通过在mini-protean预制4
–
12%bis
–
tris聚丙烯酰胺凝胶(biorad)上的电泳进行确定。然后将凝胶放入chemidoc成像仪内,并且用图像实验室软件(biorad)分析图像。
[0169]
体外效力
[0170]
huh7细胞用aav变体以不同的moi(以gc/细胞计)进行感染,所述aav变体表达作为转基因的分泌的纳米萤光素酶。进行与野生型腺病毒(moi 30)的共感染,以刺激第二链合成。在感染开始后48小时,使用测定试剂盒和glomax光度计(promega)以1秒的积分时间,在上清液中测量分泌的纳米萤光素酶表达。
[0171]
用基因组aavdna的甲醛凝胶电泳
[0172]
用pcr纯化nucleospin试剂盒(machery nagel),从纯化的aav分批中分离基因组aavdna。在电泳之前,使500ng的aav基因组dna在95℃下在甲醛加样缓冲液(1ml 20x mops、3.6ml 37%甲醛、在67%蔗糖中的2ml 5mg/ml orange g,用mq至10ml)中变性10分钟,并且立即放在冰上。接下来,使样品在1%琼脂糖凝胶上运行,所述琼脂糖凝胶在补充有6.6%甲醛的1x mops缓冲液(40mm mops、10mmnaac、1mm edta,ph=8.0)中制备。然后使样品在1x mops缓冲液中在100伏特下运行2小时,所述缓冲液补充有6.6%甲醛运行缓冲液。在运行后,用sybr gold(thermofisher)对dna进行染色,并且在chemidoc触摸成像仪(biorad)上显现条带。
[0173]
假设的总:完整比率测量
[0174]
通过将组装衣壳的总量除以分别的avb纯化的aav材料的gc量(通过qpcr测量的),来计算关于生产的假设的总/完整比率(t/f)。为了测量总衣壳或总颗粒,进行基于elisa或hplc的分析。aav titration elisa试剂盒(progen,德国)用于定量aav5的完整病毒粒子和组装的空衣壳。捕获抗体检测未组装或各个衣壳vp蛋白上不存在的构象表位。avb纯化的aav材料在试剂盒的检测缓冲液中稀释1000-2000倍。实验根据试剂盒的方案进行。
[0175]
尺寸排阻层析也用于确定总aav5颗粒含量。该方法使用具有biobasic sec-1000柱的hplc系统,所述柱因其分离较大颗粒如aav的能力进行选择。在214nm的吸光度处检测aav颗粒。工作标准(ws),具有已知的总颗粒含量(针对初始参考标准进行验证)的基于aav5的产物,用于生成校准曲线(总颗粒浓度相对于峰面积)。使用chemstation软件对峰进行积分且定量。aav5样品针对该校准曲线进行定量。
[0176]
残留的杆状病毒dna定量
[0177]
残留的杆状病毒dna作为aav原料药和药物产品制剂中的工艺相关杂质存在。残留的杆状病毒dna水平通过qpcr使用对于杆状病毒基因组中的代表性区域(接近于hr3增强子区)特异性的引物组进行评价。
[0178]
具有aav2rep的诱导型表达的expressf+稳定细胞(irepsf+细胞)的生成
[0179]
具有所有细胞的亲本expressf+细胞在质粒dna转染前1天进行传代。在转染当天,用新鲜的预热sf-900 ii培养基将亲本细胞稀释成1.5
×
106个细胞/ml的密度,然后放回振荡培养箱内直至细胞接种。制备在1ml盐水溶液中的dna(1pg dna/细胞):脂质体(cellfectine ii)复合物的转染混合物。在等待复合物形成的同时,将稀释的细胞取出,并且在每个指定的125ml摇瓶中以5ml体积稀释为7.5
×
106个细胞。dna:脂质体复合物混合物通过以下进行添加:将整体1ml复合物体积缓慢滴到125ml摇瓶中的细胞之上,随后为轻轻旋转以使复合物均质化,以及在280c、135rpm下的振荡培养箱中且不含co2的5小时温育。在5小时后,加入另外9ml的新鲜sf-900 ii培养基,并且进一步温育转染的细胞。三天后,通过离心将细胞向下旋转,通过倾析弃去旧培养基,并且用新鲜的sf-900 ii培养基替换,以将整个细胞沉淀物稀释成5
×
105个细胞/ml的最终细胞密度。将杀稻瘟菌素抗生素选择压力以25μg/ml的最终浓度加入细胞悬浮液内。在细胞活力已达到高于90%(
±
3周内)后,稳定转染的细胞进行正常传代,但具有杀稻瘟菌素选择压力的持续存在。一旦细胞活力》95%且倍增时间为
±
24-26小时或更少,就用每个稳定细胞库至少30个冷冻管进行细胞库存储。
[0180]
用于序贯分批反应器(sbr)研究的irep稳定库预培养设置
[0181]
irep 052(irep)稳定库细胞的预培养物(p0-p3)照例在摇瓶中产生。将1.5l新鲜的sf900ⅱ培养基(thermo fisher scientific)加入2l str内,并且将温度平衡至28.0℃。用预热培养基重新校准生物反应器的do传感器和细胞密度探针(incytearc,hamilton)。合并来自摇瓶的p4预培养物,并且根据gen-sop-0031
–
bucleocounter nc-100的操作,使用nucleocounter nc-100测量活细胞密度(vcd)。将计算体积的合并p3培养物和计算体积的另外的新鲜sf900ⅱ培养基(thermo fisher scientific)以0.5e6vc/ml的最终活细胞密度与2l的最终工作体积转移到2l生物反应器(su,sartorius)。培养在28℃的温度下进行,所述温度通过反应器皿周围的热垫得到维持。压缩空气以每分钟5立方厘米(ccm)的流速和每分钟0.30升(lpm)的空气覆盖率向反应器连续充气。通过内置的电化学传感器接口在线测量溶解氧浓度和ph。通过向反应器充氧的级联控制与搅拌器的级联控制组合,将反应器的氧供应维持在溶解氧的30%饱和度下(表2)。用于温度和氧控制器的2l生物反应器的比例、积分和微分(pid)设置的增益在(表3)上得到指示。在培养过程中通过细胞密度探针在线测量培养物的细胞密度。
[0182]
在48
–
72小时培养后,并且根据p4预培养物的vcd,从生物反应器的底部排出计算体积的预培养物p4,并且随后通过流出泵将计算体积的新鲜sf900ⅱ培养基(thermo fisher scientific)加入生物反应器内,直至在2l的最终工作体积下0.5e6vc/ml的最终活细胞密度。sbr的此填充和抽取循环重复至传代数高达9的细胞培养。
[0183]
表2.对于2l str在2l工作体积下的级联控制设置。
[0184]
输出%在微型喷洒器处的氧气流(ccm)搅拌器(rpm)002002002754003356003358035335
10075335
[0185]
表3.关于在2l str上的氧和温度控制器的pid设置
[0186]
设置氧控制器温度控制器xp(%)15015ti(秒)400999td(秒)075min(%)00max(%)10040deadb(c)00
[0187]
结果
[0188]
实施例1:在诱导型质粒载体中替代的晚期杆状病毒p10启动子的使用改善了由重组杆状病毒中的polh启动子掺入引起的顺式:反式竞争
[0189]
使用晚期启动子,尤其是polh(seq id no.25),作为重组启动子已成为调控bev系统中的重组基因表达的保守策略。因此,同样的策略也常用于使用bev系统的aav生产并且对其进行优化(urabe,m.等人,2002)。在第一代稳定和可诱导的aav包装细胞的生成中也已实施了类似的策略(aslanidi,g.等人,2009,同上)。为了生成这些稳定的细胞,使用由hr2.09和晚期polh启动子调控的aav单盒rep和cap表达质粒,并且稳定地整合到宿主昆虫细胞基因组内。有趣的是,wu等人(同上)最近通过使aav cap表达由重组杆状病毒而不是包装宿主细胞驱动,已显示了具有增加灵活性的下一代aav包装细胞(wu,y.等人2019)。尽管如此,尚不清楚在重组杆状病毒基因组内使用保守晚期启动子,尤其是polh,是否在反式激活过程中与整合的表达质粒中的相同启动子相互作用,或甚至干扰其。为了阐明这一点,设计了诱导型表达质粒载体(pcld 002)(seq id no.05),其具有与含有减弱的acg起始密码子的全长aav2 rep组合的上游hr2.09增强子(seq id no.18)(hermens,w.t.j.m.c.等人,2009)。这种pcld 002瞬时转染到expressf+细胞内(图1a),随后为经由接种不同的重组杆状病毒的反式激活。有趣的是,仅当使用bac trans完成反式激活后,才能观察到aav2 rep78的表达(图1b)。其它杆状病毒,bac polh cap和bac polh cap trans两者,只能诱导aav2 rep52的表达,提示了rep78和rep52的表达在单个aavrep盒设计中受到不同的调控。为了确认这一发现,纳米萤光素酶报道构建体设计为具有与保守的晚期启动子(polh或p10(seq id no.22))组合的上游hr2.09增强子,并且进行如先前所述的类似实验(图1a)。使用这种方法,我们通过接种含有(bac polh cap trans)或不含(bac trans)重组保守晚期启动子的不同重组杆状病毒,阐明了在反式激活后的报道分子诱导谱(图1a)。为了显示在重组杆状病毒之间的感染性方面不存在差异,还测试了天然aav2启动子(p5、p19和p40)。当样品用bac trans或bac polh cap trans(图1c,正方形相对于三角形)进行接种时,在三种aav启动子的诱导谱中并未观察到显著差异,指示了在这些重组杆状病毒之间存在相似的感染性。有趣的是,我们注意到当纳米萤光素酶受polh和p10调控时,早在感染后24小时,在bac trans反式激活后的报道分子表达的更强诱导。在同一时间点,与bac trans相比,通过bac polh cap trans的反式激活显示出
±
1/10(polh)和
±
1/5(p10)的报道基因表达(图1c)。在稍后的时间点,bac polh cap trans或bac trans之间的诱导差异变得更小。此外,与bac polh cap trans反式激活后的polh相比,p10启动子报道分子显示了略微更强的上
调(
±
2倍)(图1c)。来自pcld 002和报道构建体研究的结果指示了,在反式激活过程中,在表达质粒载体和重组杆状病毒中的polh启动子之间存在相互作用或竞争。值得注意的是,在表达质粒载体中插入替代的晚期p10启动子可以改善反式激活竞争。
[0190]
实施例2:替代的杆状病毒hr增强子的使用减少了杆状病毒反式激活质粒载体中的基础基因表达并传递严格的调控
[0191]
各种杆状病毒hr序列已显示具有转录增强子活性((bleckmann,m.等人2016;rodems,s.m.&friesen,p.d.,1993;venkaiah,b.等人,2004)。连同各种杆状病毒启动子一起,这种hr功能已用于在昆虫细胞中产生重组表达质粒。类似的策略也已用于生成杆状病毒反式激活aav基因表达质粒载体。hr2或更准确地说hr2.09的使用已显示在用重组杆状病毒反式激活后,强烈增强来自质粒载体的aav rep和cap表达(aslanidi,g.等人,2009,同上)。在hr序列的不存在下观察到基因表达的完全丧失,指示了其存在对反式激活的必要性。已知在hr内的ie-1dna结合位点序列(cnngtagaattctacnng)的存在负责其增强子功能(olson,v.a.等人,2003)。在该实施例中,作为参考启动子的与polh组合的hr2/hr2.09(具有7x ie-1dna结合位点)及其它(即hr1[seq id no 26]、hr3[seq id no 27]、hr4b[4x ie-1dna结合位点、seq id no.19]和hr5[6x ie-1dna结合位点,seq id no.20])的增强子能力,在用不同的重组杆状病毒反式激活后,使用纳米萤光素酶报道构建体进行概况分析(图1a和2a)。尽管ie-1dna结合位点的间歇性存在,但这些hr增强子在彼此中具有显著的核苷酸差异(图2b)。我们可以看到不管其方向性如何,所有hr序列在用杆状病毒反式激活后实际上的确增强了启动子活性,尽管活性程度中的差异(图2c)。有趣的是,改造为具有8个ie-1dna结合位点的合成hr,连同hr3一起未能增强启动子表达超出仅具有7个位点的hr2.09。这证明了结合位点的量与如先前假定的增强子强度无关(aslanidi等人,2009,同上)。通过这个实验,仍然观察到hr2.09显示出最高的增强功能,随后为hr4b,其是最短的hr序列之一,具有最少的ie-1结合元件(图2b和13)。然而,与其它hr序列相比,从模拟处理的hr2.09样品也可以观察到一定程度的泄漏表达(图2c和d)。对于hr2.09观察到的这种泄露表达可能造成问题,尤其是当它用于调控毒性很大的蛋白质例如aav rep时。为了比较这些不同的hr增强子对aav rep表达的作用,制备了几种质粒载体(pcld),并且对于杆状病毒反式激活后的表达调控进行测试(图1a和2e)。事实上,根据蛋白质印迹结果(图2f),所有hr增强子都可以用于增强对aav2 rep上调的polh功能。有趣的是,其中hr2.09》hr4b》hr5的不同表达强度只能对aav2 rep78显著观察到,但对较小的rep52表达则没有观察到。这可以指示在单个aavrep盒内存在不同的调控系统,其中天然内源性aavp19启动子在任何hr的存在下都是有功能的,并且不管杆状病毒添加如何都是可诱导的。当测量萤光素酶活性时观察到的hr2.09的泄露表达,通过使用已经显著减毒的acg-rep78版本的蛋白质印迹并未观察到,因为与纳米萤光素酶报道分子测定相比,这种方法的灵敏度可以是产生正确观察结果的主要问题。因此,替代hr增强子,尤其是相对较弱的hrs如hr4b和hr5的使用,可以用于克服使用hr2.09的诱导型aav基因表达质粒载体的泄漏表达问题。
[0192]
实施例3:不泄漏的hr增强子、晚期启动子p10和强atg起始密码子的使用传递通过具有重组polh启动子的杆状病毒可诱导的最佳单盒rep设计
[0193]
如通过先前的实施例显示的,与减毒的acg起始密码子组合的polh启动子的使用可以在用bac trans反式激活后带来看似正常的aav2 rep表达比率(低rep78和高rep52)
(urabe等人,2006;hermens等人,2007)。然而,当使用bac polh cap trans用于诱导时,观察到由于以下相对较弱的反式激活谱:i)所使用的两种polh启动子(用于bac polh cap trans中的cap和表达质粒中的rep)之间的顺式:反式启动子竞争,以及ii)采用不泄漏但相对较弱的hr,例如hr4b。为了产生仍与bac polh cap trans的使用相容的不泄漏的表达平台,将hr4b增强子与p10启动子组合,以调控具有强野生型atg起始密码子的单盒aav2 rep(图3a和9)(seq id no.06、seq id no.17)。为了比较且确认通过重组杆状病毒接种在反式激活过程中的顺式:反式启动子竞争减少,产生了具有保守polh启动子的质粒载体(图3a,pcld 047)(seq id no.07)。遵循先前的实验设计,这些表达质粒进行转染且反式激活(图1a)。如根据pcld 015(seq id no.08)蛋白质印迹结果可以看出的,p10和内源性aavp19启动子两者均显示了在其反式激活期间需要hr增强子的存在。这些构建体(pcld 046和047两者)连同bac trans反式激活一起的使用产生了次优的aavrep表达率(太高的rep78),很可能是由于强atg起始密码子的采用。然而,在bac polh cap trans反式激活后,使用p10启动子可以达到rep78的适当表达和整个rep比率,但用polh则未达到。有趣的是,不管用于反式激活的杆状病毒如何,在rep52的表达中都不存在差异,确认了在单盒aavrep内的上游启动子相对于内源性aavp19启动子之间的不同调控,这与先前报道的结果一致(图1b)。
[0194]
实施例4:使用与替代杆状病毒启动子组合的不泄漏的hr增强子以可诱导地调控拆分盒aavrep设计
[0195]
如通过先前的实施例显示的,由于顺式:反式启动子竞争,在杆状病毒基因组内使用重组启动子(即bac polh cap trans)引发了报道基因的不同表达谱。这将是成问题的,尤其是使aav2拆分rep盒适应诱导型表达质粒设计时,因为这必需使用两种polh启动子。在bev拆分盒rep(bac rep183)内,rep78和rep52的表达分别处于截短的立即早期ie-1启动子(δie-1)和晚期polh启动子的调控下(urabe,m.等人,2002;hermens等人,2007;hermens等人,2009)。先前已尝试使这种设计适应杆状病毒反式激活质粒载体的努力,具有不成功的结果,很可能是由于δie-1启动子的构成性质和polh启动子在测试设计中的顺式:反式竞争(aslanidi,g.等人,2009)。拆分盒rep已成为bev平台中的基本aavrep盒设计,因为它可以产生的优良的aav质量(urabe,m.等人,2002;hermens,w.t.j.m.c.,2009)。拆分盒rep的优点也很可能是由于这种设计提供的可能的表达强度和时间控制。相比之下,单盒rep设计更加严格,并且已知小rep52在反式激活后的表达受到内源性aavp19启动子的偏向调控(图2e和3b),将其时间表达局限在感染期间的早期时间点(图1c)。此外,仔细检查启动子报道分子研究(图1c),发现aavp19启动子是相对泄漏的,导致rep52的组成性低表达,从长远观点看来,其导致对于宿主细胞的毒性。尽管采用了较少泄漏的hr增强子,但这使得单盒rep质粒载体不太理想。
[0196]
在这项研究中,为了克服δie-1启动子的组成型表达谱的挑战,延迟早期39k启动子(seq id no.21)(dong,z.q.等人,2018;lin,c.h.&jarvis,d.l.,2013)用作用于调控rep78表达的替代物。观察到39k启动子的表达谱早在杆状病毒反式激活后3
–
6小时具有活性,使得其成为用作δie-1时间模拟的有吸引力的替代物(图4a)。然而,由于与δie-1相比,尤其是在更晚的时间点,来自39k启动子调控的表达强度是相对更高的(图4a),我们进行了另一种萤光素酶报道分子测定(图4b),以筛选替代方案,例如使用次优起始密码子用于39k调控的基因表达,以模拟δie-1调控的表达水平。如从图4c可以看出的,用次优的acg
密码子替换atg起始密码子将39k启动子强度调低到与δie-1相对相似的水平。使用这种次优的acg密码子,设计了指示的pcld(图4d),以测试在全长aav2 rep上的39k启动子-acg组合的强度和表达谱。在指示的杆状病毒反式激活后(图4d),aav2 rep78的表达只能对于其中hr2.09仍存在的pcld 020(seq id no.09)检测到,指示了39k启动子仍是hr增强子依赖性启动子。然而,rep78的表达水平仍太高,并且rep78:rep52之间的比率远不理想。怀疑相对强的hr2.09的掺入已导致观察到的结果。
[0197]
为了避免这一点,通过将增强子变成相对较弱的hr4b来减轻rep78的表达,同时通过用人工内含子内部的另外的强晚期启动子调控其来增强rep52,如先前已显示的(chen,2008)。测试了与polh启动子具有最少顺式:反式竞争的几种晚期启动子(图4e)。有趣的是,尽管存在强hr2.09增强子,但当通过bac polh cap trans反式激活后,将polh作为内含子启动子未能触发rep52表达。rep52表达只能通过用p10或p6.9替换内含子启动子得到恢复(图4e)。这一结果确认了在某些杆状病毒启动子中存在顺式:反式启动子竞争,并且转换启动子可以减轻这个问题。然而,rep52的水平仍然相对较弱,如很可能通过较弱的hr4b增强子的共享使用引起的。
[0198]
为了解决这一点,通过掺入替代的较弱但不泄露的hr增强子以进一步减少rep78表达,设计并克隆了几种拆分盒aav2 rep构建体(pcld 050
–
054,图12)(seq id no.10-14)。由于已知增强子活性是双向的(图2c),我们测试了单一hr4b的能力,并且将其与hr4b-hr5组合进行比较(图5b)。最后,在杆状病毒晚期启动子的调控下,密码子优化的rep52基因(seq id no.15)的另一个拷贝(图5a和11)顺式添加,以加强rep52表达(图5b)。在杆状病毒反式激活后,几种非保守杆状病毒晚期启动子例如p6.9(seq id no.23)和psel120(seq id no.24)(lin,c.h.&jarvis,d.l.,2013;martinez-solis,m.等人,2016)的表达动力学和强度,使用萤光素酶报道分子测定进行概况分析,以察看其作为调控rep52的额外拷贝的晚期启动子的可用性。有趣的是,所有这些非保守的杆状病毒启动子都可以通过bac trans和bac polh cap trans以几乎相似的效力进行反式激活(图4a)。最大差异只能用p6.9启动子的bac polh cap trans反式激活观察到,在48h.p.i.下
±
1/4左右的效力,其仍比早期的p10启动子更有力(图4a和1c)。发现psel120用bac polh cap trans的反式激活在非常晚的时间点(72h.p.i)具有最高表达。无/更少顺式:反式竞争的启动子(p10、p6.9或psel120)的掺入使诱导型拆分rep盒的几种设计替代方案成为可能(图5b)。为了测试这些构建体,转染了这些新型质粒(p cld 050
–
054)中的每一种,并且通过蛋白质印迹确定了在指示的杆状病毒反式激活后的aav2 rep表达(图5c)。如预计的,不管hr增强子和/或重组杆状病毒的选择如何,39k启动子的使用导致可诱导的rep78表达(图5c)。尽管来自所有这些构建体的rep52也可以通过任何杆状病毒进行反式激活,但不管晚期启动子如何,在bac trans和polh cap trans的使用之间可以观察到不同的一般表达强度(图5c),尤其是对于p10调控的构建体(pcld 052),其与图1b和3b中描绘的先前结果一致。替代的晚期p6.9和psel120启动子的使用可以进一步改善在通过bac polh cap trans的rep52反式激活后的顺式:反式启动子竞争问题。总体而言,这些结果已显示了在诱导型aav拆分rep设计内的替代杆状病毒启动子的潜在用途,用于以正确的时机和强度两者表达aav基因。此外,所呈现的实施例提供了通过具有与表达质粒相同的启动子的重组杆状病毒,克服在反式激活过程中观察到的顺式:反式启动子竞争的可能解决方案。
[0199]
实施例5:与具有重组polh启动子的杆状病毒的单次接种组合的新型诱导型拆分rep盒可以用于产生高质量aav颗粒
[0200]
为了察看新型诱导型质粒载体pcld 046和pcld 050-054是否可以用于产生完整的aav颗粒,在expressf+细胞中进行了小型瞬时aav生产实验(图6a)。使用编码不同aav cap血清型和转基因的不同bac polh cap trans病毒作为反式激活剂(在图6a中指示的)。作为基准,pcld 011遵循aslanidi等人(同上)设计(图4a,pcld 011(seq id no.16)进行制备。这种构建体已报道为与bac cap trans设计相容,然而,仍存在泄露但强的hr2.09增强子(wu,y.等人,2019)。总体而言,使用诱导型单(pcld 046)和拆分盒rep(pcld 050
–
054)质粒载体两者的瞬时aav生产可以一致地产生来自几个生产分批的dna酶抗性aav颗粒的显著输出,所述几个生产分批在粗制裂解物缓冲液(clb)中具有
±
5x 1010gc/ml的平均基因组拷贝(gc)滴度。这个滴度与基准构建体pcld 011的滴度相当(图6b和c)。有趣的是,aavrep的表达谱,尤其是rep78的时间表达,在基准pcld 011之间不同(图6d和e)。
[0201]
为了察看aav颗粒的质量参数,进行使用来自小型生产的材料的avb纯化(图4d)并进行分析。有趣的是,来自纯化的aav材料的衣壳比率(vp1:2:3比率)也是彼此可比较的(图7a)。最后,遵循所述方案(图7b),aav颗粒转导靶细胞(huh7)的效力针对使用具有拆分盒aavrep的bev(bac rep183)产生的aav颗粒进行比较。根据结果,可以观察到在不同来源的aav颗粒中的效力差异(图7c)。有趣的是,由诱导型拆分盒rep质粒载体,尤其是pcld 052和053构建体产生的aav颗粒,显示了比单rep盒rep(pcld 011和046)衍生的材料更高的效力。效力甚至可以达到与较不稳固的bev生产的材料相似的水平。
[0202]
为了进一步研究这种新型诱导型质粒载体对aav颗粒质量的影响,使用甲醛琼脂糖凝胶分析,进行了关于具有最佳效力测定结果的aav颗粒的aav载体dna分析。已知特别是使用split-rep盒产生的aav bev衍生的aav,显示出更快的起效和更高的效力,很可能是由于载体dna的多聚体形式的高包装率(urabe,m.等人,2006)。这种多聚体形式将模拟双链dna(dsdna)形式,在基因表达之前绕过限速单链(ssdna)至dsdna形成(mccarty,d.m.,2008)。在本研究中,aav5 fix和aav2/5纳米萤光素酶载体基因组的预计大小分别为2.5kb和2kb。如从图8a可以看出的,大多数pcld 046或单盒rep产生的aav载体基因组是单链单体。然而,除2或2.5-kb的单链载体基因组之外,从使用pcld 052和053产生的aav颗粒中提取的dna含有另外的多聚体基因组,其截断大小恰好在4.7kb的最大aav包装容量下(图8a)。这些结果进一步证明了,pcld 052和053在包装多聚体载体基因组方面可以准确地模拟具有拆分盒rep的bev的性能,其与体外效力测定结果相关联。最后,为了证明拆分rep盒优于单rep盒,我们对使用所示pcld生产的纯化aav材料进行了头对头的假设t/f比较(图8b)。在此处,我们可以看到,拆分rep盒设计事实上具有产生具有较低t/f值的aav的倾向,指示了完整颗粒的更高含量以及设计的优越性(pcld 052和053)。
[0203]
一般而言,可以实施替代和不泄漏的hr增强子连同具有较少顺式:反式竞争的替代杆状病毒启动子(39k、p10、p6.9和psel120)一起的组合,以生成新型诱导型拆分rep盒质粒载体,其可以通过bac polh cap trans进行反式激活。这些载体,尤其是pcld 052和053,对于生成下一代稳定的包装昆虫细胞系是非常有用的。
[0204]
实施例6:新型稳定的raav包装细胞的生成
[0205]
为了察看我们是否可以生成仅需要单次杆状病毒接种用于产生aav的稳定细胞
系/库,我们用瞬时转染研究中使用的所选诱导型aav-rep质粒(pcld 046、052和053)进行了稳定的细胞系生成,如作为材料和方法节段或图9a中概括的详细步骤可以察看的。所生成的新型细胞系接下来将被称为昆虫诱导型rep细胞系或irep细胞系(irep 046、irep 052和irep 053)。为了调查是否可以从稳定的irep细胞系产生aav,细胞照常进行扩增,与野生型expressf+细胞类似,并且被bac polh cap trans(bac cap5 fix或bac cap2/5snano-luc)感染,并且收获clb,以测量dna酶抗性aav颗粒gc浓度。如可以观察到的,不管诱导型rep设计如何,irep细胞系都可以产生相对丰富的aav颗粒,取决于aav的类型,达到
±
1x10
11
gc/ml滴度或高于1x105gc生产率/细胞(图9b)。有趣的是,来自稳定的irep细胞系的aavrep表达谱也与瞬时转染结果中可见的谱一致(图6e和9c)。为了进一步检查aav颗粒的功能性和质量,进行avb纯化并进行分析。有趣的是,与瞬时转染结果类似,来自纯化的代表性aav2/5材料的衣壳比率(vp1:2:3比率)也是彼此可比较的(图10a)。最后,遵循所述方案(图7b),aav颗粒转导靶细胞(huh7)的效力针对使用具有拆分盒aavrep的bev(bac rep183)产生的aav颗粒进行比较。根据结果,可以观察到在不同来源的aav颗粒中的效力差异(图10b),具有确认瞬时转染结果的相似偏差(图7c)。
[0206]
为了进一步分析颗粒质量,由新型irep细胞系生产的avb纯化材料(bbne)与其它方法进行比较,所述其它方法包括二重或双重bac接种方法(图11a)。与瞬时转染结果类似(图8a),包装的aavdna的单体-二聚体模式只能在由irep 052和053细胞系而不是irep 046产生的材料中看到,不管bac接种方法如何(图11b)。然而,来自假设的t/f和杆状病毒基因组dna污染分析的进一步结果显示了,仅irep 052细胞系用具有衣壳和转基因的bac的单次接种可以以最一致的方式产生具有相对极佳质量的aav颗粒(图11c和d)。
[0207]
实施例7:使用所选irep052细胞系的序贯分批反应器(sbr)研究
[0208]
作为针对生成具有整合的rep基因的新生产细胞系的中间步骤,有必要通过用携带aavrep盒的dna质粒pcld-052转染亲本细胞系,来生成irep express sf+的多克隆培养物。为了评估该稳定细胞库中的整合rep基因的稳定性和表达,我们在序贯分批反应器(sbr)中扩大了细胞培养物,并且在1l摇瓶中检查了在不同细胞传代下的rep基因表达。sbr是重复分批工艺,其中填充和取出在生物反应器中序贯发生。我们使用在摇瓶中的sbr系统而不是手动每日转移,以允许培养条件标准化(例如氧供应),其给出更好的重现性和更一致的结果,并且模拟细胞在生产条件下将经历的条件。
[0209]
我们首先在1l摇瓶中(图15a)从细胞解冻(p0)到细胞第3代(p3)培养稳定的细胞库,然后经由sbr系统在2l生物反应器中将细胞库从细胞第4代(p4)传代到第9代(p9)(图15a)。种子训练生产需要总共5周(图15b)。我们将处于第5、7和9代的稳定库用于通过用杆状病毒bac cap5 fix转染的aav产生,其具有关于aav cap基因以及侧翼为aav-itrr的因子ix(fix)转基因的表达盒(图15a)。处于第5、7和9代的稳定库等价于在500l、2000l和高于10000l工艺中的种子训练生产。本文件的目的是描述2l工艺,以验证irep express sf+稳定细胞库中的整合rep基因的表达和稳定性,其中我们还测量了在用bac cap5 fix转染后72小时,来自过滤的粗制裂解主体(fclb)的转基因的基因组拷贝。
[0210]
为了验证其为多克隆培养物的irep稳定库的稳定性,我们通过蛋白质印迹检查了处于第5、7和9代的培养物的整合rep基因表达(图15c)。由于irep稳定库中的整合rep基因(rep78和rep52)的表达受hr2.09和杆状病毒bac cap5 fix的启动子调控,我们用杆状病毒
bac cap5 fix(第5代)在1l摇瓶中分别转染处于第5、7和9代的irep稳定库培养物,以激活irep稳定库中的整合rep基因的表达。在用杆状病毒bac cap5 fix(p5)转染后48和72小时,从摇瓶中取出细胞裂解物样品。如图15中所示,我们确认了处于细胞第5、7和9代的irep稳定库细胞中的rep78和rep52表达,其中从细胞裂解物的每种蛋白质提取物样品中观察到不同的蛋白质产物rep78和rep 52(虚线框,图15c)。在20代(第9代)后,整合rep基因的表达保持稳定。根据所有蛋白质提取物,来自蛋白质rep52的免疫信号的强度高于蛋白质rep 72。rep78和rep52的这种表达比率与正常的aav2 rep表达(低rep78和高rep52)相称。
[0211]
为了进一步确认用单一杆状病毒转染的irep稳定库的aav生产(unobac平台),我们还测量了来自用处于第5、7和9代的irep稳定库细胞转染杆状病毒bac cap5 fix(p5)的fclb中的因子ix(fix)的基因组拷贝(gc)(图15d)。fix已用于血友病b型的替代治疗中,并且包含在杆状病毒bac cap5 fix的重组cap-trans盒中。irep稳定库中的整合rep78和rep52的表达分别通过bac cap5 fix中的cap-trans盒的早期和晚期polh启动子进行反式激活。随着cap和转基因(在这种情况下fix)的级联表达,在转染期间,irep稳定库生成aav2封装的fix。如图15d中所示,所有fclb样品的平均gc滴度都高于1e11 gc/ml。处于不同传代的gc滴度(fix)保持稳定,并且这确认了irep稳定库中的整合rep基因盒的稳定性。这也赋予了使用irep细胞系通过unobac系统扩大aav生产的潜力。
[0212]
参考文献
[0213]
burnett,j.r.&hooper,a.j.alipogene tiparvovec,an adeno-associatedvirus encoding the ser(447)x variant ofthe human lipoprotein lipase gene for the treatment ofpatients with lipoprotein lipase deficiency.curr opin mol ther 11,681-691(2009).
[0214]
yla-herttuala,s.endgame:glybera finally recommended for approval as the first gene therapy drug in the european union.mol ther 20,1831-1832,doi:10.1038/mt.2012.194(2012).
[0215]
cheng,x.h.,hillman,c.c.,zhang,c.x.&cheng,x.w.reduction ofpolyhedrin mrna andprotein expression levels in sf9 and hi5 cell lines,but not in sf21 cells,infected with autographa californica multiple nucleopolyhedrovirus fp25k mutants.j gen virol 94,166-176,doi:10.1099/vir.0.045583-0(2013).
[0216]
garretson,t.a.,shang,h.,schulz,a.k.,donohue,b.v.&cheng,x.w.expression-and genomic-level changes during passage of four baculoviruses derived from bacmids in permissive insect cell lines.virus res 256,117-124,doi:10.1016/j.virusres.2018.08.009(2018).
[0217]
aslanidi,g.,lamb,k.&zolotukhin,s.an inducible system for highly efficient production ofrecombinant adeno-associated virus(raav)vectors in insect sf9 cells.proc natlacadsci usa 106,5059-5064,doi:10.1073/pnas.0810614106(2009).
[0218]
mietzsch,m.等人onebac:platform for scalable and high-titer production of adeno-associated virus serotype 1-12vectors for gene therapy.hum gene ther 25,212-222,doi:10.1089/hum.2013.184(2014).
[0219]
mietzsch,m.等人onebac 2.0:sf9 cell lines for production ofaav1,aav2,and aav8 vectors with minimal encapsidation offoreign dna.hum gene thermethods 28,15-22,doi:10.1089/hgtb.2016.164(2017).
[0220]
mietzsch,m.,casteleyn,v.,weger,s.,zolotukhin,s.&heilbronn,r.onebac 2.0:sf9 cell lines for production ofaav5 vectors with enhanced infectivity and minimal encapsidation offoreign dna.hum gene ther 26,688-697,doi:10.1089/hum.2015.050(2015).
[0221]
wu,y.等人development ofversatile and flexible sf9 packaging cell line-dependent onebac system for large-scale recombinant adeno-associated virus production.hum gene thermethods 30,172-183,doi:10.1089/hgtb.2019.123(2019).
[0222]
van oers,m.m.,pijlman,g.p.&vlak,j.m.thirty years ofbaculovirus-insect cell protein expression:from dark horse to mainstream technology.j gen virol 96,6-23,doi:10.1099/vir.0.067108-0(2015).
[0223]
ghosh,s.,jain,a.,mukherjee,b.,habib,s.&hasnain,s.e.the host factor polyhedrin promoterbinding protein(ppbp)is involved in transcription from the baculovirus polyhedrin gene promoter.j virol 72,7484-7493(1998).
[0224]
dong,z.q.等人construction and characterization ofa synthetic baculovirus-inducible39kpromoter.jbioleng 12,30,doi:10.1186/s13036-018-0121-8(2018).
[0225]
lin,c.h.&jarvis,d.l.utility of temporally distinct baculovirus promoters for constitutive and baculovirus-inducible transgene expression in transformed insect cells.j biotechnol 165,11-17,doi:10.1016/j.jbiotec.2013.02.007(2013).
[0226]
martinez-solis,m.,gomez-sebastian,s.,escribano,j.m.,jakubowska,a.k.&herrero,s.a novel baculovirus-derived promoter with high activity in the baculovirus expression system.peerj4,e2183,doi:10.7717/peerj.2183(2016).
[0227]
urabe,m.等人scalable generation of high-titer recombinant adeno-associated virus type 5in insect cells.j virol 80,1874-1885,doi:10.1128/jvi.80.4.1874-1885.2006(2006).
[0228]
urabe,m.,ding,c.&kotin,r.m.insect cells as a factory to produce adeno-associated virus type 2vectors.hum gene ther 13,1935-1943,doi:10.1089/10430340260355347(2002).
[0229]
hermens,w.t.j.m.c.,haast,s.j.p.,biesmans,d.j.等人vectors with modified initiation codon for the translation of aav-rep78 useful for production of aav.wo2009/014445(2009).
[0230]
bleckmann,m.等人identification of essential genetic baculoviral elements for recombinant protein expression by transactivation in sf21 insect cells.plos one 11,e0149424,doi:10.1371/journal.pone.0149424(2016).
[0231]
rodems,s.m.&friesen,p.d.the hr5 transcriptional enhancer stimulates early expression from the autographa californica nuclear polyhedrosis virus genome but is not required for virus replication.j virol 67,5776-5785(1993).
[0232]
venkaiah,b.,viswanathan,p.,habib,s.&hasnain,s.e.an additional copy ofthe homologous region(hr1)sequence in the autographa californica multinucleocapsid polyhedrosis virus genome promotes hyperexpression of foreign genes.biochemistry 43,8143-8151,doi:10.1021/bi049953q(2004).
[0233]
olson,v.a.,wetter,j.a.&friesen,p.d.the highly conservedbasic domain i of baculovirus ie1 is required for hr enhancer dna binding and hr-dependent transactivation.j virol 77,5668-5677,doi:10.1128/jvi.77.10.5668-5677.2003(2003).
[0234]
hermens,w.t.j.m.c.等人baculoviral vectors comprising repeated coding sequences with differential codon biases.wo2009/014445(2009).
[0235]
mccarty,d.m.self-complementary aav vectors;advances and applications.mol ther 16,1648-1656,doi:10.1038/mt.2008.171(2008).
[0236]
chen,h.intron splicing-mediated expression of aav rep and cap genes and production ofaav vectors in insect cells.mol ther 16,924-930,doi:10.1038/mt.2008.35(2008).
[0237]
wang,y.,wang,f.,wang,r.,zhao,p.&xia,q.2a self-cleavingpeptide-based multi-gene expression system in the silkworm bombyx mori.sci rep 5,16273,doi:10.1038/srep16273(2015).
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1