用于尿液样品分析的装置和方法与流程
1.本公开一般涉及用于样品分析的电泳领域,并且更具体地涉及通过用于加速电泳(epitachophoresis)的装置和方法选择性分离、检测、提取、分离、纯化和/或(预)浓缩样品(诸如,例如,包含核酸的尿液样品)进行的尿液样品分析或其他包含高盐的生物学样品的分析。
背景技术:
2.近年来,“液体活检”的概念受到了广泛关注。液体活检不是从实体组织中采集样品,而是捕获生物标志物,诸如细胞、细胞外小泡(诸如外泌体)和/或无细胞分子(诸如dna、rna或蛋白质)。这些生物标志物可以收集在诸如血液(或血浆或血清)、尿液、痰液等生物流体中。这些生物标志物的存在可以与例如癌症、肿瘤、自身免疫疾病、心血管事件、病毒、细菌或病原体感染相关,或与药物应答相关。这些分子通常与诸如外泌体等细胞外体相关,或者在液体中可能是“无细胞”的。
3.液体活检可以使用几种生物流体中的任何一种进行,并且可以是微创的(例如,通过放血采集血液)或无创的(尿液采集)。因此,液体活检具有吸引力,因为它易于采集、易于重复采集用于患者监测、患者默许的可能性更高、对患者来说样品采集的熟悉感以及无需太专业的采集地点。
4.液体活检的一个缺点是生物标志物(例如核酸)的浓度可能相对较低,因此需要大体积才能获得的足够的材料用于下游分析。在核酸的情况下,使用核酸捕获试剂盒和装置的常规技术一般设计用于小样品体积,其通常在0.2-1ml范围内。尽管就其本身而言,是一种富含生物标志物的资源,但迄今为止已证明从尿液中有效分离和纯化生物标志物具有挑战性。此外,用于从尿液中提取、分离和/或纯化生物标志物的常规技术通常耗时,产出低质量产品,并且不太适合自动化。因此,需要进一步开发用于分析尿液样品,诸如用于检测一种或多种生物标志物的装置和方法。
技术实现要素:
5.一种系统可以对尿液样品进行浓缩以形成浓缩的尿液样品。浓缩的尿液样品可以具有的一种或多种靶分析物的浓度是尿液样品中一种或多种靶分析物的初始浓度的至少10倍。该系统可以将浓缩的尿液样品添加到第一电解质中以形成第一混合物。该系统可以在第一电极和第二电极之间施加电压差。第一电极设置在第一混合物中。第二电极设置在第二电解质中。第一电解质可以与第二电解质不同。该系统可以利用电压差将一个或多个聚焦区中的一种或多种靶分析物流到第二电极。该系统可以通过收集包含一个或多个聚焦区的第二混合物来收集一种或多种靶分析物。第二混合物中一种或多种靶分析物中的任何一种的浓度高于浓缩的尿液样品中相应靶分析物的浓度。在进一步分析之前,可能不需要靶分析物的进一步提取。
6.在实施例中,系统可以包括加速电泳(“etp”)装置。该装置可以包括圆形第一电
极,其设置在圆形通道的外边缘处。该装置还可以包括样品收集池,其位于圆形通道中心。该系统可以进一步包括第二电极。相比于圆形第一电极与样品收集池电连通,第二电极被配置成与样品收集池更紧密地电连通。此外,该装置可以包括电源,其被配置成在圆形第一电极和第二电极之间提供电压差。该系统还可以包括样品浓缩装置,该装置被配置成将样品中一种或多种靶分析物的浓度提高到至少10倍。
7.本公开一般涉及一种从尿液或其他包含高盐诸如钠盐或钾盐的生物学样品中分离和/或纯化一种或多种靶分析物的方法,其样品潜在地包含一种或多种靶分析物,其中所述方法包括:a.提供用于实施加速电泳的装置;b.提供包含所述一种或多种靶分析物的样品;c.通过使用所述装置实施etp来进行一次或多次加速电泳运行以将所述一种或多种靶分析物聚焦到一个或多个聚焦区;d.通过收集包含所述一种或多种靶分析物的所述一个或多个聚焦区来收集所述一种或多种靶分析物;从而获得一种或多种分离和/或纯化的靶分析物,任选地其中所述靶分析物包括一种或多种核酸。在一些实施例中,在步骤c.之前,可以通过对所述尿液或其他包含高盐的生物学样品实施一个或多个样品预处理步骤来制备样品溶液。在一些实施例中,样品可以包括尿液样品。在一些实施例中,样品预处理可以包括真空过滤、脱盐、缓冲液更换、细胞外小泡富集、外泌体富集、细胞裂解、蛋白质降解、基于离心的细胞去除和/或浓缩步骤中的一者或多者。在一些实施例中,所述脱盐、缓冲液更换、细胞外小泡富集、外泌体富集步骤和/或浓缩步骤可以是基于离心的。
8.在一些实施例中,一种或多种靶分析物可以包括以下中的任何一种或多种:一种或多种核酸;一种或多种蛋白质;一个或多个细胞;一个或多个细胞外小泡;一种或多种一种或多种外泌体、微泡和/或凋亡小体,任选地一种或多种尿外泌体;和/或一种或多种生物标志物。在一些实施例中,一种或多种靶分析物可以包括dna和/或rna。在一些实施例中,一种或多种靶分析物可以包括一种或多种循环核酸。在一些实施例中,分离和/或纯化的靶分析物可以包括dna和/或rna。在一些实施例中,如通过基于荧光计的方法测量的,与使用基于柱或基于珠的方案获得的核酸的量相比,经分离和/或纯化的核酸的量可能更大。在一些实施例中,如通过基于qpcr的质量控制方法测量的,与使用基于柱或基于珠的方案获得的核酸的质量相比,经分离和/或纯化的核酸的质量可能更高。在一些实施例中,与使用基于柱或基于珠的方案获得的核酸的量相比,可收集1.25倍或更多、1.5倍或更多、1.75倍或更多、2.0倍或更多、2.25倍或更多、2.5倍或更多、2.75倍或更多、3倍或更多、4倍或更多、5倍或更多、10倍或更多、100倍或更多或1000倍或更多的核酸。在一些实施例中,所述方法可使得包含在原始样品中的一种或多种核酸中的1%或更少、1%或更多、5%或更多、10%或更多、15%或更多、20%或更多、25%或更多、30%或更多、35%或更多、40%或更多、45%或更多、50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、85%或更多、90%或更多、95%或更多或者99%或更多被分离和/或纯化并收集。在一些实施例中,所述方法可产生1%或更低、1%或更高、5%或更高、10%或更高、15%或更高、20%或更高、25%或更高、30%或更高、35%或更高、40%或更高、45%或更高、50%或更高、55%或更高、60%或更高、65%或更高、70%或更高、85%或更高、90%或更高、95%或更高或者99%或更高分离和/或纯度的所述一种或多种核酸,诸如通过分析技术所测量,以确定包含一种或多种核酸的分离/纯化的样品的组成。在一些实施例中,所述分离和/或纯化的核酸的质量可通过质量控制qpcr来确定。在一些实施例中,分离和/或纯化的核酸可以为任何期望中的大小。在一些
实施例中,分离和/或纯化的核酸的大小可以是5nt或更小、10nt或更小、20nt或更小、30nt或更小、50nt或更小、100nt或更小、1000nt或更小、10,000nt或更小、100,000nt或更小、1,000,000nt或更小或者1,000,000nt或更大。在一些实施例中,加载到etp装置中,用于基于etp的分离/纯化的样品的样品体积可以是0.25ml或更小、0.25ml或更大、0.5ml或更大、0.75ml或更大、1.0ml或更大、2.5ml或更大、5.0ml或更大、7.5ml或更大、10.0ml或更大、12.5ml或更大、15.0ml或更大、20.0ml或更大、25.0ml或更大、30.0ml或更大、40.0ml或更大或者50ml或更大。在一些实施例中,样品体积可以是从约1ml至约50ml。
9.此外,本公开一般涉及一种从尿液样品中分离和/或纯化一种或多种靶分析物、任选地一种或多种核酸的方法,其中所述方法包括:a.提供用于实施加速电泳(etp)的装置;b.提供包含一种或多种靶分析物的尿液样品;c.通过对所述尿液样品实施一个或多个预处理步骤来制备尿液样品溶液;d.通过使用所述装置实施etp来进行一次或多次加速电泳运行以将所述一种或多种靶分析物聚焦到一个或多个聚焦区中,例如作为一个或多个etp带;以及e.通过收集包括所述一种或多种靶分析物的所述一个或多个聚焦区来收集所述一种或多种靶分析物;从而获得一种或多种分离和/或纯化的靶分析物,任选地其中所述靶分析物包括核酸、无细胞核酸、循环肿瘤核酸、生物标志物、蛋白质和/或细胞外小泡中的任何一种或多种。
10.此外,本公开一般涉及一种从尿液样品中分离和/或纯化一种或多种靶分析物、任选地一种或多种核酸的方法,其中所述方法包括:a.提供用于实施加速电泳(etp)的装置;b.提供包含一种或多种靶分析物的尿液样品;c.通过对所述尿液样品实施一个或多个预处理步骤来制备尿液样品溶液,其中所述预处理步骤包括真空过滤、脱盐、缓冲液更换、细胞外小泡富集、外泌体富集、细胞裂解、蛋白质降解、基于离心的细胞去除和/或浓缩步骤中的一种或多种;d.通过使用所述装置实施etp来进行一次或多次加速电泳运行以将所述一种或多种靶分析物聚焦到一个或多个聚焦区中,例如作为一个或多个etp带;以及e.通过收集包括所述一种或多种靶分析物的所述一个或多个聚焦区来收集所述一种或多种靶分析物;从而获得一种或多种分离和/或纯化的靶分析物,任选地其中所述靶分析物包括核酸、无细胞核酸、循环肿瘤核酸、生物标志物、蛋白质和/或细胞外小泡中的任何一种或多种。
11.此外,本公开一般涉及一种从尿液样品中分离和/或纯化一种或多种核酸、任选地一种或多种循环核酸的方法,其中所述方法包括:a.提供用于实施加速电泳(etp)的装置;b.提供包含一种或多种靶分析物的尿液样品;c.通过对所述尿液样品实施一个或多个预处理步骤来制备尿液样品溶液,其中所述预处理步骤包括真空过滤、脱盐、缓冲液更换、细胞外小泡富集、外泌体富集、细胞裂解、蛋白质降解、基于离心的细胞去除和/或浓缩步骤中的一种或多种;d.通过使用所述装置实施etp来进行一次或多次加速电泳运行以将所述一种或多种靶分析物聚焦到一个或多个聚焦区中,例如作为一个或多个etp带;以及e.通过收集包括所述一种或多种靶分析物的所述一个或多个聚焦区来收集所述一种或多种靶分析物;从而获得一种或多种分离和/或纯化的核酸。
12.在本文所述方法的一些实施例中,对所述分离和/或纯化的一种或多种靶分析物进行一种或多种体外诊断(“ivd”)测定。
附图说明
13.图1提供了用于实施加速电泳的示例性装置的示意图。
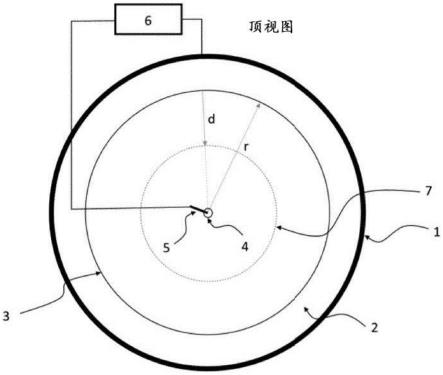
14.图2a提供了用于实施加速电泳的示例性装置的顶视图的示意图。在图2a中,数字1-7是指以下内容:1.外圆形电极;2.终止电解质池;3.前导电解质,任选地包含在凝胶内或以其他方式与终止电解质以流体动力学方式分离;4.前导电解质电极/收集池;5.中心电极;6.电源;和7.前导电解质与终止电解质之间的边界,样品离子聚焦在两者之间;并且符号r和d分别用于表示前导电解质池半径和由le/te边界迁移的距离。
15.图2b提供了用于实施加速电泳的示例性装置的侧视图的示意图。在图2b中,数字1-8是指以下内容:1.外圆形电极;2.终止电解质池;3.前导电解质,任选地包含在凝胶内或以其他方式与终止电解质以流体动力学方式分离;4.前导电解质电极/收集池;5.中心电极;6.电源;7.前导电解质与终止电解质之间的边界,样品离子聚焦在两者之间;和8.底部支持物;并且符号r和d分别表示前导电解质池的半径和le/te边界迁移的距离。
16.图3提供了用于实施加速电泳的示例性装置的示意图。
17.图4提供了用于实施加速电泳的示例性装置的示意图。在图4中,数字1-10是指以下内容:1.外圆形电极;2.终止电解质池;3.前导电解质,任选地包含在凝胶内或以其他方式与终止电解质以流体动力学方式分离;4.通向前导电解质/收集池的开口;5.中心电极;6.电源;7.前导电解质与终止电解质之间的边界,样品离子聚焦在两者之间;8.底部支持物;9.连接到前导电解质池的管连接装置;10.前导电解质池。
18.图5提供了用于实施加速电泳的示例性装置的示意图,其中在加载前导电解质和终止电解质之间加载样品。
19.图6a提供了用于实施加速电泳的装置的示意图。
20.图6b提供了表示当使用恒定电流操作用于加速电泳的示例性装置(图6a)时,以cm为单位的行进距离d相对于在距离d处的相对速度的图。对于图6b中呈现的实例,使用半径值5和起始速度值1。
21.图7提供了用于浓缩样品的加速电泳装置的图像。
22.图8a提供了用于加速电泳的示例性装置的图像。
23.图8b提供了用于用来将样品聚焦到聚焦区的加速电泳的示例性装置的图像。
24.图8c提供了用于用来将样品聚焦到聚焦区的加速电泳的示例性装置的图像。
25.图9a提供了用于加速电泳的示例性装置的图像。
26.图9b提供了用于使用的加速电泳的示例性装置的示意图。在图9b中,数字是指以毫米为单位的尺寸。
27.图9c提供了用于用来将样品聚焦到聚焦区的加速电泳的示例性装置的图像。
28.图9d提供了用于用来将样品聚焦到聚焦区的加速电泳的示例性装置的图像。
29.图10提供了用于用来将样品聚焦到聚焦区的加速电泳的示例性装置的图像。
30.图11提供了用于用来分离两个不同的样品并且将其聚焦到聚焦区的加速电泳的示例性装置的图像。
31.图12提供了用于加速电泳的示例性装置的图像。
32.图13a提供了示例性加速电泳装置的图像。
33.图13b提供了示例性加速电泳装置的示意图。“a”对应于中心收集井,而“b”对应于
前导电解质池。
34.图14a提供了用于加速电泳装置中的示例性电导率测量探针的图像。
35.图14b提供了显示图14a中所示的电导率测量探针的更近视图的图像。
36.图15a提供了具有电导率探针的示例性加速电泳装置的图像。
37.图15b提供了针对示例性加速电泳装置的运行的电导率轨迹。
38.图16a提供了具有置于半透膜下方的电导率检测探针的示例性加速电泳装置的图像。
39.图16b提供了示例性底部基板的图像,该底部基板合并有通过位于中心柱内的专用通道连接的两个电导率检测探针。
40.图17a提供了示例性加速电泳装置的图像,展示了荧光素标记的dna梯状条带样品的聚焦。
41.图17b提供了轨迹,其示出针对示例性加速电泳装置的运行由表面电导池监测的le/te过渡的电阻率变化。
42.图17c提供了在加速电泳运行之前和之后,原始样品和针对dna梯状条带样品收集的级分的吸收光谱。
43.图17d提供了在加速电泳运行之前和之后,如通过生物分析仪分离测量的针对dna梯状条带样品的电泳图。
44.图18提供了用于三个独立etp运行的电压分布。
45.图19a提供了在etp运行期间etp装置的图像。
46.图19b提供了在etp运行期间拍摄的etp装置的基于荧光的图像。
47.图19c提供了在etp运行期间拍摄的etp装置的图像。
48.图19d提供了针对分析的聚焦和收集的etp样品的电泳图。
49.图20a提供了在etp运行期间使用基于红外的热成像相机捕获的图像。
50.图20b提供了在etp运行期间捕获的基于荧光的图像。
51.图20c呈现在etp运行期间与随时间推移电压变化和温度变化有关的数据。
52.图21提供了etp装置和附件的图像。a.表示etp装置;b.表示etp装置的矩形盖;c.表示etp装置的圆形盖;并且d.表示用于调整etp装置的移动中心活塞的位置的聚四氟乙烯棒。
53.图22提供了etp实验设置的图像。
54.图23提供了从1ml血浆中分离/纯化cfdna的延时图像。
55.图24提供了通过基于etp的分离/纯化和随后基于珠的清理来分离/纯化的cfdna浓度的(基于qubit的)测量值。还呈现了通过离心柱或基于珠的方法分离/纯化的cfdna浓度的测量值。
56.图25提供了来自通过基于etp的分离/纯化从添加有dna阶梯的血浆样品中分离/纯化的cfdna和dna阶梯的基于大小的分析的数据。
57.图26提供了来自通过基于etp的分离/纯化从血浆样品中分离/纯化的cfdna的基于大小的分析的数据。
58.图27提供了来自通过基于etp的分离/纯化分离/纯化的cfdna的基于大小的分析的数据。
59.图28提供了通过基于etp的分离/纯化和随后基于珠的清理来分离/纯化的ctdna浓度的测量值。还呈现了通过基于离心柱的方法分离/纯化的ctdna浓度的测量值。
60.图29提供了来自通过用三种限制酶消化载体生成的etp上位标记物的基于电泳的分析的数据。
61.图30示出针对根据本发明的实施例从尿液样品中分离和/或纯化一种或多种靶分析物的过程。
62.图31示出针对根据本发明的实施例从尿液样品中分离和/或纯化一种或多种靶分析物的系统。
63.图32示出可以在本文提及的任何计算机系统中使用的子系统的实例。
64.术语
65.如本文所使用的,除非另有说明,否则单数形式“一”、“(a/an)”及“该/所述”包括复数个参考物。除非另有明确说明,否则本文所用的所有科学技术术语的含义与本发明所属领域普通技术人员通常理解的含义相同。
66.如本文所用,术语“等速电泳”一般是指通过使用电场在材料之间(例如,在带电颗粒与溶液中的其他材料之间)产生边界或界面来分离带电颗粒。itp一般使用多种电解质,其中样品离子的电泳迁移率小于前导电解质(le)的电泳迁移率,而大于放置用于itp的装置中的尾随电解质(te)的电泳迁移率。前导电解质(le)一般包含相对高迁移率的离子,而尾随电解质(te)一般包含相对低迁移率的离子。选择的te和le离子具有分别低于和高于目标靶分析物离子的有效迁移率。也就是说,分析物离子的有效迁移率高于te但低于le。这些靶分析物与le和te离子(即共离子)具有相同的电荷符号。施加的电场使le离子移动远离te离子,而te离子尾随在后。在相邻和连续的te和le区域之间形成移动的界面。这会创建电场梯度区域(通常从le的低电场到te的高电场)。te中的分析物离子会超过te离子,但不能超过le离子并在te和le之间的界面处积聚(“聚焦”或形成“聚焦区”)。替代地,le中的靶离子被le离子取代;并也在界面处积累。通过明智地选择le和te化学,itp相当普遍适用,可以用最初溶解在te和le电解质中的一种或两种中的样品来完成,并且可以不需要非常低电导率的背景电解质。
67.如本文所用,术语“加速电泳”一般是指使用圆形或球体和/或同心装置和/或圆形和/或同心电极布置执行的电泳分离方法,诸如通过使用圆形/同心和/或本文所述的多边形装置。由于在加速电泳期间使用的圆形/同心或另一种多边形排列;与常规的等速电泳装置不同的是,横截面积在离子和区域的迁移期间会发生变化,并且由于横截面积的变化,区域移动的速度在时间上不是恒定的。因此,加速电泳布置并不严格遵循常规的等速电泳原理,其中区域以恒定速度迁移。尽管有如本文所示的这些显著差异,但通过使用电场在可能具有不同电泳迁移率的材料之间(例如,在带电颗粒和溶液中的其他材料之间)创建边界或界面,可以使用加速电泳来有效地分离和聚焦带电颗粒。le和te,如与itp一起使用所描述的,也可用于加速电泳。在一些实施例中,可以使用恒定电流、恒定电压和/或恒定功率来实施加速电泳。在一些实施例中,可以使用变化的电流、变化的电压和/或变化的功率来实施加速电泳。在一些实施例中,可以在装置和/或电极布置的背景下实施加速电泳,该装置和/或电极布置的形状通常可以描述为圆形或球体,从而可以如本文所述实施加速电泳的基本原理。在一些实施例中,可以在装置和/或电极布置的背景下实施加速电泳,该装置和/或电
极布置的形状通常可以描述为多边形,从而可以如本文所述实施加速电泳的基本原理。在一些实施例中,加速电泳可以通过任何非线性的、连续的电极布置来实施,例如以圆形形状布置的电极和/或以多边形形状布置的电极来实施。
68.如本文所用,术语“体外诊断应用(ivd应用)”、“体外诊断方法(ivd方法)”、“体外诊断测定”等,一般是指可评估用于诊断和/或监测目的的样品的任何应用和/或方法和/或装置,该目的诸如鉴定受试者,任选地鉴定人类受试者的疾病。在一些实施例中,所述样品可以包括来自受试者和/或来自样品的核酸和/或靶核酸,任选地进一步,其中所述核酸源自尿液样品。在一些实施例中,加速电泳装置可用作体外诊断装置。在一些实施例中,已经通过加速电泳浓缩/富集/分离/纯化的靶分析物可用于下游体外诊断测定。在一些实施例中,体外诊断测定可包括核酸测序,例如dna测序,例如rna测序。在一些实施例中,ivd测定可包括基因表达谱分析。在一些实施例中,体外诊断方法可以是但不限于以下中的任何一种或多种:染色、免疫组织化学染色、流式细胞术、facs、荧光活化液滴分选、图像分析、杂交、dash、分子信标、引物延伸、微阵列、cish、fish、纤维fish、定量fish、流式fish、比较基因组杂交、印迹、蛋白质印迹、southern印迹、eastern印迹、far-蛋白质印迹、southwestern-蛋白质印迹、northwestern-蛋白质印迹和northern印迹、酶测定、elisa、配体结合测定、免疫沉淀、chip、chip-seq、chip-chip、放射免疫测定、荧光偏振、fret、表面等离子体共振、过滤结合测定、亲和色谱、免疫细胞化学、基因表达谱分析、dna谱分析和pcr、dna微阵列、基因表达序列分析、实时聚合酶链反应、差异显示pcr、rna-seq、质谱测量、dna甲基化检测、声能、基于脂质组学的分析、免疫细胞的定量、癌症相关标志物的检测、特定细胞类型的亲和纯化、dna测序、下一代测序、癌症相关融合蛋白的检测、以及化疗耐药性相关标志物的检测。
69.如本文所用,术语“前导电解质”和“前导离子”一般是指与目标样品离子和/或在itp和/或加速电泳期间使用的尾随电解质相比具有更高有效电泳迁移率的离子。在一些实施例中,用于阳离子加速电泳的前导电解质可以包括但不限于包括氯化物、硫酸根和/或甲酸根,用合适的碱例如组氨酸、tris、肌酐等缓冲到所希望的ph。在一些实施例中,用于阴离子加速电泳的前导电解质可以包括但不限于包括钾、铵和/或钠以及乙酸根或甲酸根。在一些实施例中,对于给定的施加电压,前导电解质浓度的增加可导致样品区的成比例增加和电流(功率)的对应增加。典型的浓度一般可以在10-100mm范围内;然而,也可以使用更高的浓度。
70.如本文所用,术语“尾随电解质”、“尾随离子”、“终止电解质”和“终止离子”一般是指与目标样品离子和/或在itp和/或加速电泳期间使用的前导电解质相比具有更低有效电泳迁移率的离子。在一些实施例中,用于阳离子加速电泳的尾随电解质可包括但不限于包括mes、mops、乙酸根、谷氨酸根和其他弱酸阴离子和低迁移率阴离子。在一些实施例中,用于阴离子加速电泳的尾随电解质可以包括但不限于包括在由任何弱酸在加速电泳期间形成的移动边界处的反应水合氢离子。
71.如本文所用,术语“聚焦区”一般是指包含由于进行加速电泳而被浓缩(“聚焦”)的组分的溶液体积。可从装置收集或移除聚焦区,并且所述聚焦区可包含富集和/或浓缩量的所希望的样品,例如靶分析物,例如靶核酸。在本文所述的加速电泳方法中,靶分析物一般变为聚焦在装置例如圆形或球体或其他多边形装置的中心。
72.如本文所用,术语“带”和“etp带”一般是指在电泳(例如等速电泳或加速电泳)迁移期间与其他离子、分析物或样品独立行进的离子、分析物或样品的区(例如聚焦区)。加速电泳装置内的聚焦区可替代地称为“etp带”。在一些实施例中,etp带可包括一种或多种类型的离子、分析物和/或样品。在一些情况下,etp带可包含单一类型的分析物,希望该分析物与样品中存在的其他材料分离,例如将靶核酸与细胞碎片分离。在一些情况下,etp带可以包含多于一种靶分析物,例如序列高度相似的多肽或核酸序列,例如等位基因变体。在一些情况下,etp带可包含相似大小或电泳迁移率的不同分析物。在此类情况下,可以通过进一步的etp运行来分离一种以上靶分析物,例如,在促进所述多于一种分析物分离的不同条件下,和/或可以通过本领域已知的用于分离分析物的其他技术(诸如本文所述的那些)分离所述多于一种分析物。在一些实施例中,在一次或多次基于etp的分离/纯化和收集之后,可以收集etp带并且任选地进行进一步分析。在一些实施例中,etp带可包括一种或多种正在经历或已经经历基于etp的分离/纯化且任选地经历收集的靶分析物,该分离/纯化和收集例如作为etp运行的一部分。
73.如本文所用,术语“靶核酸”旨在表示待检测、测量、扩增、分离、纯化和/或进行进一步测定和分析的任何核酸。靶核酸可以包括任何单链和/或双链核酸。靶核酸可以作为分离的核酸片段或者是更大核酸片段的一部分存在。靶核酸可以源自或分离自基本上任何来源,诸如培养的微生物、未培养的微生物、复杂的生物学混合物,样品包括生物学样品、尿液样品、组织、血清、古老或保存的组织或样品、环境分离物等。进一步地,靶核酸包括或源自cdna、rna、基因组dna、克隆的基因组dna、基因组dna文库、酶促片段化的dna或rna、化学片段化的dna或rna、物理片段化的dna或rna等。在一些实施例中,靶核酸可包含全基因组。在一些实施例中,靶核酸可以包括样品和/或生物学样品(例如尿液样品)的全部核酸含量。靶核酸可以以多种不同形式出现,包括例如简单或复杂的混合物,或以基本上纯化的形式出现。例如,靶核酸可以是含有其他成分的样品的一部分,也可以是样品的唯一或主要成分。靶核酸也可具有已知或未知的序列。
74.如本文所用,术语“靶微生物”旨在表示在血液、血浆、其他体液、样品诸如生物学样品和/或组织中发现的任何单细胞或多细胞微生物,例如与感染性病症或疾病相关联的微生物。其实例包括细菌、古细菌、真核生物、病毒、酵母、真菌、原生动物、变形虫和/或寄生虫。此外,术语“微生物”一般是指可能引起疾病的微生物,无论是指疾病还是指致病微生物。
75.如本文所用,术语“生物标志物”或“目标生物标志物”是指在组织、血液、血浆、尿液、和/或其他体液中发现的生物学分子,其作为正常或异常过程或病症或疾病(诸如癌症)的标志。生物标志物可用于观察身体对疾病或病症的治疗的应答。在癌症的情况下,生物标志物是指指示体内癌症存在的生物学物质。生物标志物可以是由肿瘤分泌的分子或身体对癌症存在的特异性应答。遗传学、表观遗传学、蛋白质组学、糖组学和影像学生物标志物可用于癌症的诊断、预后和流行病学。可以在无创性收集的生物流体(例如血液、血清和/或尿液)中测定此类生物标志物。生物标志物可用作诊断(例如,鉴定早期癌症)和/或预后(例如,预想癌症的侵袭性和/或预测受试者对特定治疗的应答程度和/或癌症复发的可能性)。
76.如本文所用,术语“样品”包括或被假定包括一个或多个靶分析物的样品或培养物(例如微生物学培养物)。术语“样品”还意为包括生物学、环境和化学样品,以及希望对其进
行分析的任何样品。样品可包括合成来源的样本。样品可以包括来自可以衍生一种或多种微生物的任何来源的一种或多种微生物。“样品”可以包括但不限于全血、皮肤、血清、血浆、脐带血、绒毛膜绒毛、羊水、脑脊液、脊髓液、灌洗液(例如,支气管肺泡、胃、腹膜、导管、耳朵、关节镜)、组织样品、活检样品、尿液、粪便、痰液、唾液、鼻粘液、前列腺液、精液、淋巴液、胆汁、器官、骨髓、眼泪、汗液、母乳、乳房液、胚胎细胞和胎儿细胞。在一些情况下,样品可以是尿液样品。
77.如本文所用,术语“靶分析物”旨在表示待检测、测量、扩增、分离、纯化和/或进行进一步测定和分析的任何分析物。在一些实施例中,所述分析物可以是但不限于任何离子、分子、核酸、生物标志物、蛋白质、细胞或细胞群,例如期望的细胞等,期望对其进行检测、测量、分离、浓缩和/或用于进一步的分析。在一些实施例中,靶分析物可以源自本文描述的任何样品,例如尿液样品。
78.出于本公开的目的,应当理解,当给定部件诸如层、区域、液体或基底在本文中被称为设置或形成在另一部件“上”、“中”或“处”时,该给定部件可以直接位于另一部件上,或者替代性地,也可以存在中间部件(例如,一个或多个缓冲层、夹层、电极或触点)。还应进一步理解,术语“设置在”和“形成在”可互换使用以描述给定部件如何相对于另一部件定位或定点。因此,术语“设置在”和“形成在”并非旨在引入与材料传输、设置或制造的特定方法相关的任何限制。
79.术语“连通”在本文中用于指示两个或多个部件或元件之间的结构、功能、机械、电、光学、热或流体关系,或其任意组合。因此,一个部件被称为与第二部件连通的事实并不旨在排除附加部件可能存在于第一和第二部件之间和/或可操作地关联或接合第一和第二部件的可能性。
80.如本文所用,“受试者”是指待治疗和/或从其获得样品的哺乳动物受试者(诸如人、啮齿动物、非人灵长类动物、犬科动物、牛科动物、羊亚科动物、马科动物、猫科动物等)。
81.在加速电泳装置、系统或机器的上下文中,“检测”样品可以包括在整个装置中的一个、几个或许多点处检测其位置。检测一般可以通过不干扰希望的装置、系统或机器功能以及使用所述装置、系统或机器进行的方法的任何一种或多种方式发生。在一些实施例中,检测包括任何电检测手段,例如通过检测电导率、电阻率、电压、电流等。此外,在一些实施例中,检测可包括以下任何一种或多种:电检测、热检测、光学检测、光谱检测、光化学检测、生化检测、免疫化学检测和/或化学检测。在一些实施例中,在基于etp的分离/纯化和任选地收集一种或多种靶分析物期间可以检测所述一种或多种靶分析物。此外,在etp装置的上下文和etp方法中的样品检测在美国序列号62/585,219和62/744,984;以及pct编号pct/ep2018/081049和pct/ep2019/077714中有进一步描述,其公开内容通过引用整体并入本文。
82.在样品分析装置或系统中,术语“样品收集体积”是指在分析期间或之后预期用于收集的样品体积,例如由机器人液体处理机收集。在用于实施加速电泳的装置或包括这种装置的系统中,样品收集体积是预期用于在加速电泳期间或之后包括样品的收集体积。在一些实施例中,样品收集体积可位于本文所述的装置或系统的中心井中。在一些实施例中,样品收集体积可位于允许收集所希望的样品的任何地方。在一些实施例中,样品收集体积可以在样品加载区域和前导电解质电极/收集池之间的任何位置。样品收集体积可由装置
或系统的任何合适的区域、容器、井或空间构成。在一些实施例中,样品收集体积由井、膜、区室、小瓶、移液器等构成。在一些实施例中,样品收集体积可以由装置或系统的部件内或部件之间的空间形成,例如,两个凝胶之间的空间或凝胶中的孔。
83.如本文所用,术语“etp装置”、“用于实施etp的装置”、“用于etp的装置”等可互换使用以指代可进行或可在其上进行etp和/或包括etp的方法的装置。
84.如本文所用,术语“基于etp的分离/纯化”一般是指包含etp的装置和方法,例如可以在其上实施etp的装置,例如包括实施etp的方法,其中etp将一种或多种靶分析物聚焦在一个或多个聚焦区(例如,一个或多个etp带)内,从而将一种或多种靶分析物与初始样品包含的其他材料分离/纯化。需注意“分离”和“纯化”可互换使用。此外,基于etp的分离/纯化一般允许包含所述一种或多种靶分析物的一个或多个聚焦区(一个或多个etp带)的后续收集。通过一次或多次基于etp的分离/纯化实施的一种或多种靶分析物的分离/纯化程度可以是一种或多种靶分析物的与其他材料分离/纯化的任何程度或量。在一些实施例中,基于etp的从样品中分离/纯化靶分析物法可产生1%或更低、1%或更高、5%或更高、10%或更高、15%或更高、20%或更高、25%或更高、30%或更高、35%或更高、40%或更高、45%或更高、50%或更高、55%或更高、60%或更高、65%或更高、70%或更高、85%或更高、90%或更高、95%或更高或者99%或更高纯度的所述靶分析物,例如,如通过分析技术所测量,以确定包含一种或多种靶分析物的etp分离/纯化的样品的组成。在一些实施例中,基于etp的从样品中分离/纯化靶分析物法可使得从原始样品回收1%或更少、1%或更多、5%或更多、10%或更多、15%或更多、20%或更多、25%或更多、30%或更多、35%或更多、40%或更多、45%或更多、50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、85%或更多、90%或更多、95%或更多或者99%或更多的靶分析物。在一些实施例中,可以进行一次或多次基于etp的分离/纯化以分离/纯化一种或多种靶分析物,例如一种或多种核酸。例如,在一些情况下,可以对包含一种或多种靶分析物的样品进行基于etp的分离/纯化,以将一种或多种靶分析物聚焦到一个聚焦区(etp带)中,这基本上将一种或多种靶分析物与原始样品中包含的其他材料分离。样品可以在etp分离/纯化之后收集,并且分离/收集的样品可以进一步经历另一次基于etp的分离/纯化。任选地,第二次基于etp的分离-纯化可以在一定条件下进行,以便在多于一种靶分析物的情况下,将一种或多种靶分析物中的每一种分离到单独的聚焦区中,每个聚焦区可以任选地单独收集,从而(如果希望)将靶分析物彼此分离。
85.如本文所用,术语“混合样品”一般是指包含来自多于一种来源的材料的样品。
86.如本文所用,术语“样品预处理”、“经预处理的样品”等一般是指在将样品加载到etp装置上之前对所述样品执行的任何程序。例如,在一些情况下,可以通过浓缩、缓冲液更换和/或脱盐所述样品,诸如通过使用本领域已知的基于离心的方法来预处理尿液样品或其他包含高盐的生物学样品。例如,可以使用超离心过滤器对任何体积(例如从1ml至50ml)的尿液样品进行浓缩、脱盐和缓冲液更换。在一些情况下,脱盐和/或缓冲液更换可以通过使用基于透析的方法来完成。作为此类程序的结果,完成一种或多种靶分析物(诸如cfna、蛋白质和/或细胞外小泡、例如尿外泌体)的初始富集,任选地作为程序的结果在期望的缓冲液中和/或低盐溶液中。此外,在一些情况下,样品预处理可以包括过滤步骤,诸如真空过滤步骤,可以进行该过滤步骤以去除不需要的材料,诸如,例如不需要的细胞
和/或不需要的细胞碎片。此类过滤步骤可以通过使用基于离心的过滤和/或基于真空的过滤来完成,该过滤使用选择的过滤器尺寸来去除不需要的材料,诸如0.22um过滤膜来去除所述不需要的材料。此外,在一些情况下,在样品浓缩、脱盐和/或缓冲液更换之后,样品经受细胞外小泡富集步骤,诸如外泌体富集步骤。在将样品引入etp装置之前,此类富集步骤可以从小泡中释放循环核酸,例如dna和/或rna。在任何期望的程度的样品预处理(包括本文上述程序以及本领域公知的其他样品预处理程序中的任何、所有或无一)之后,可以将样品加载到etp装置中用于一次或多次etp运行以实施样品分析。在一些情况下,在样品浓缩和缓冲液更换之后,在将样品引入etp装置之前,可以进行裂解和/或蛋白质消化步骤。此类步骤可以至少部分地基于靶核酸和/或期望的用于分离/纯化的靶核酸的来源来实施。在尿液中发现的核酸来源包括,例如从尿道脱落的上皮细胞、自由循环的cfdna和外泌体。在一些情况下,如果期望总核酸回收,可以使用合适的试剂进行裂解步骤和/或蛋白质消化步骤。例如,蛋白酶k可以用于影响蛋白质消化。此外,此类裂解和蛋白质消化步骤可以允许在基于etp的分离/纯化之前从例如细胞、外泌体和组蛋白(在cfdna的情况下)释放所有核酸。在一些情况下,希望不包括源自从尿道脱落的上皮细胞的核酸的核酸回收,可以进行离心步骤以在裂解和/或蛋白质消化步骤之前实施这些上皮细胞的去除。离心后,可以收集上清液,而可以丢弃推测含有上皮细胞的沉淀。随后可以通过etp分离/纯化的靶核酸包括cfdna以及封装在外泌体中的核酸。在某些情况下,当需要靶向cfdna的核酸回收时,可以在将样品引入etp装置之前,诸如使用蛋白酶k进行蛋白质消化步骤。不进行裂解步骤,此外避免任何无意裂解的来源,以防止核酸从可能存在于尿液样品中的细胞中释放。
87.如本文所用,术语“包含高盐的生物学样品”一般是指相比于其他生物学样品的盐浓度,被认为包含更高的盐浓度的生物学样品。例如,包含高盐的生物学样品包括尿液样品。在一些情况下,人尿液样品可以包含约10meq/升的尿钠。在一些情况下,包含高盐的生物学样品包括钠和/或钾和/或钙盐。
88.如本文所用,术语“尿液样品溶液”一般是指在被装入用于实施etp以分离/纯化尿液样品中包含的一种或多种核酸的装置之前已经经受样品预处理的尿液样品。
89.如本文所用,术语“无细胞核酸”(“cfna”)一般是指可以在生物体的尿液和/或血流中发现的非封装核酸。在一些情况下,cfna可以从尿液、血液、血浆和/或血清样品等中分离。在一些情况下,无细胞核酸可以是无细胞dna(cfdna)。在一些情况下,无细胞核酸可以是无细胞rna(cfrna)。在一些情况下,无细胞核酸可以是无细胞dna(cfdna)和无细胞rna(cfrna)的混合物。在一些情况下,cfna可包含胎儿dna和/或母体dna。在一些情况下,来自孕妇的尿液样品可以包含cfna。在一些情况下,cfna可包含循环肿瘤核酸(ctna)。在一些情况下,cfna可包含长度为约1000bp或更长、1000bp或更短、900bp或更短、800bp或更短、700bp或更短、600bp或更短、500bp或更短、400bp或更短、300bp或更短、250bp或更短、200bp或更短、150bp或更短,例如,约180bp或更短的dna和/或rna片段。在一些情况下,可以使用本文所述的基于etp的装置和方法分离/纯化和任选地收集cfna。在一些实施例中,在基于etp的分离/纯化之后,可以收集分离的/纯化的cfna并且可以对其进行本文所述进一步的分析技术的任何一种或多种,例如测序,例如一种或多种ivd测定。
90.如本文所用,术语“循环肿瘤核酸na”(ctna)是指源自癌性细胞例如肿瘤细胞的cfna。在一些情况下,ctdna可能会在癌性细胞凋亡或坏死期间进入血流。在一些情况下,这
种ctdna可能会通过肾脏进入尿液。在一些情况下,肿瘤核酸可以是循环肿瘤rna(ctrna)。在一些情况下,循环肿瘤核酸可以是循环肿瘤dna(ctdna)。ctna可以是ctdna和ctrna的混合物。在一些实施例中,ctna可以使用本文所述的基于etp的装置和方法来分离/纯化和任选地收集。在一些实施例中,在基于etp的分离/纯化之后,可以收集分离的/纯化的ctna并且可以对其进行本文所述的进一步分析技术的任何一种或多种,例如测序,例如一种或多种ivd测定。在一些情况下,ctna可包含长度为约1000bp或更长、1000bp或更短、900bp或更短、800bp或更短、700bp或更短、600bp或更短、500bp或更短、400bp或更短、300bp或更短、250bp或更短、200bp或更短、150bp或更短,例如,长度为约150bp或更短的dna片段和/或rna片段。
91.如本文所用,术语“etp上位标记物”一般是指与靶核酸相比大小更大和/或长度更长的化合物或分子,使得在基于etp的靶分析物分离/纯化和随后的收集期间,etp上位标记物表示可以停止收集靶分析物的截止点。例如,荧光标记的或以其他方式可检测地标记的etp上位标记物可以产生为大小大于在基于etp的分离/纯化期间待分离/纯化和收集的靶dna。通过在整个etp运行过程中监控标记物,使用者或自动化机器能够在标记物落入收集管之前停止运行,从而允许捕获小于标记物的dna,同时由于较大的污染dna定位在上位标记物后面而将其留在管外。此外,etp上位标记物本身不会被收集并因此可以大量使用并与各种可以检测标记一起使用,因为它不会干扰下游测定,例如一种或多种ivd测定。在一些情况下,etp上位标记物可用于基于etp的分离/纯化方法,因为它有助于从一种或多种靶分析物的分离/纯化和收集的样品中排除基因组dna。
92.如本文所用,术语“细胞外小泡”一般是指存在于生物学流体例如尿液中的细胞衍生的小泡(膜封闭体)。细胞外小泡的实例包括外泌体、微小泡和凋亡小体。细胞外小泡可以从细胞中,例如直接从质膜中释放出来,或者在多泡体与质膜融合时形成。细胞外小泡通常包括来自其起源细胞的成分,诸如核酸和/或蛋白质。外泌体的直径通常为40-120nm,微泡的直径通常为50-1000nm,以及凋亡小体的直径通常为500-2000nm。
具体实施方式
93.如上所述,从尿液样品中提取、分离和/或纯化核酸的当前方法具有许多缺点。例如,一个此类缺点是生物标志物(例如核酸)的浓度可能相对较低,因此需要大体积来获得足够的材料用于下游分析。在核酸的情况下,使用核酸捕获试剂盒和装置的常规技术一般设计用于小样品体积,其通常在0.2-1ml范围内。尽管就其本身而言,是一种富含生物标志物的资源,但迄今为止已证明从尿液中有效分离和纯化生物标志物具有挑战性。此外,与从尿液中提取、分离和/或纯化生物标志物的常规技术相关的其他缺点包括通常程序耗时,产出低质量产品,并且缺乏自动化适用性。常规技术可能包括一系列亲和柱,以从尿液样品中提取某些级分。然后可以在送去用于进一步分析之前合并这些级分。这种基于柱的技术不是高通量的。例如,10ml的尿液可能需要经过多次(例如10次)柱清理。
94.为了解决此类问题,本公开一般描述了用于样品分析的装置和方法,例如,尿液样品的分析,该样品包含一种或多种靶分析物,其中所述装置和方法包括实施加速电泳以从所述样品中分离和/或纯化所述靶分析物,其中对分离的和/或纯化的核酸任选地可以进行进一步的下游测定,诸如体外诊断(“ivd”)测定。此外,值得注意的是,通过使用本文描述的
装置和方法获得的靶核酸的高效提取有助于下游体外诊断(ivd)方法,在该方法中,靶核酸(例如dna和/或rna)的量与可以在所述下游ivd测定中实现的灵敏度直接相关,这是相对于当前方法的显著优势。例如,常规上可以使用在其表面上结合核酸的旋转柱或磁性玻璃颗粒来实施核酸的提取。与此类常规方法相比,本文描述的装置和方法可以赋予以下任何一个或多个优点:与基于柱或珠的提取方法相比更高的提取产率(损失可能更少);与台式仪器的较大占地面积相比,装置设置更简单;与应用于类似用途的其他装置相比,样品周转潜在地更快并且具有高并行性;易于与其他用于分离的/纯化的靶分析物例如生物标志物、例如核酸的下游处理的基于微流体的系统集成。在一些实施例中,通过样品(例如,尿液样品)的基于etp的分离/纯化获得的靶分析物可以包含所述样品的总核酸含量,例如来自所述样品的dna和rna两者。在一些情况下,包括基于etp的分离/纯化的方法可包括同时收集包含dna和rna的核酸,并且收集的核酸可经受用于分离dna和rna的方法以进行进一步的下游测定,例如通过本领域已知的任何方式,分离dna和rna。
95.此外,本公开一般涉及一种从样品诸如尿液或包括其他高盐例如钠盐和/或钾盐的生物学样品中分离和/或纯化一种或多种靶分析物的方法,其中所述方法包括:a.提供用于实施加速电泳(etp)的装置;b.提供潜在地包含一种或多种靶分析物、任选地一种或多种靶核酸的样品;c.通过使用所述装置实施etp来进行一次或多次加速电泳运行以将所述一种或多种靶分析物聚焦到一个或多个聚焦区中,例如作为一个或多个etp带;以及d.通过收集包括所述一种或多种靶分析物的所述一个或多个聚焦区来收集所述一种或多种靶分析物;从而获得一种或多种分离和/或纯化的靶分析物,任选地其中所述样品包括核酸,进一步任选地其中样品包括尿液样品并且在步骤c.之前,尿液样品经历一种或多种预处理。例如,在一些情况下,可以通过浓缩、缓冲交换和/或脱盐所述尿液样品,诸如通过使用本领域已知的基于离心的方法来预处理尿液样品。
96.由于etp用于浓缩样品,本领域技术人员不会期望在etp之前对尿液样品或其他样品进行进一步的浓缩步骤。通过etp运行非浓缩的尿液样品不会产生浓缩的分析物。尿液样品中的某些成分(例如盐)与etp不相容。此外,本领域技术人员可以考虑用亲和柱浓缩尿液样品。如果此类柱用于一定量的浓缩,本领域技术人员将不会有动力将etp与亲和柱结合使用,因为亲和柱会限制通量并且可能会限制etp的优势。因此,人员不会有动力在etp之前浓缩样品。此外,可能不期望使用本文所述的技术(例如,离心)和系统浓缩尿液样品。
97.例如,可以使用超离心过滤器(例如,下文实例9)对任何体积(例如从1ml至50ml)的尿液样品进行浓缩、脱盐和缓冲液更换。在一些情况下,脱盐和/或缓冲液更换可以通过使用基于透析的方法来完成。作为此类程序的结果,完成一种或多种靶分析物(诸如cfna、蛋白质和/或细胞外小泡、例如尿外泌体)的初始富集,任选地作为程序的结果在期望的缓冲液中和/或低盐溶液中。此外,在一些情况下,样品预处理可以包括过滤步骤,诸如真空过滤步骤,可以进行该过滤步骤以去除不需要的材料,诸如,例如不需要的细胞和/或不需要的细胞碎片。此类过滤步骤可以通过使用基于离心的过滤和/或基于真空的过滤来完成,该过滤使用选择的过滤器尺寸来去除不需要的材料,诸如0.22um过滤膜来去除所述不需要的材料。此外,在一些情况下,在样品浓缩、脱盐和/或缓冲液更换之后,样品经受细胞外小泡富集步骤,诸如外泌体富集步骤。在将样品引入etp装置之前,此类富集步骤可以从小泡中释放循环核酸,例如dna和/或rna。在一些情况下,在样品浓缩和缓冲液更换
之后,在将样品引入etp装置之前,可以进行裂解和/或蛋白质消化步骤。此类步骤可以至少部分地基于靶核酸和/或期望的用于分离/纯化的靶核酸的来源来实施。在尿液中发现的核酸来源包括,例如从尿道脱落的上皮细胞、自由循环的cfdna和外泌体。在一些情况下,如果期望总核酸回收,可以使用合适的试剂进行裂解步骤和/或蛋白质消化步骤。例如,蛋白酶k可以用于影响蛋白质消化。此外,此类裂解和蛋白质消化步骤可以允许在基于etp的分离/纯化之前从例如细胞、外泌体和组蛋白(在cfdna的情况下)释放所有核酸。在一些情况下,希望不包括源自从尿道脱落的上皮细胞的核酸的核酸回收,可以进行离心步骤以在裂解和/或蛋白质消化步骤之前实施这些上皮细胞的去除。
98.离心后,可以收集上清液,而可以丢弃推测含有上皮细胞的沉淀。随后可以通过etp分离/纯化的靶核酸包括cfdna以及封装在外泌体中的核酸。在某些情况下,当需要靶向cfdna的核酸回收时,可以在将样品引入etp装置之前,诸如使用蛋白酶k进行蛋白质消化步骤。不进行裂解步骤,此外避免任何无意裂解的来源,以防止核酸从可能存在于尿液样品中的细胞中释放。在任何期望的程度的样品预处理(包括本文上述程序以及本领域公知的其他样品预处理程序中的任何、所有或无一)之后,可以将样品加载到etp装置中用于一次或多次etp运行以实施样品分析。
99.在一些实施例中,从样品诸如尿液或其他包括高盐例如钠盐或钾盐的生物学样品中分离和/或纯化一种或多种靶分析物例如核酸的方法包括:a.提供用于实施加速电泳(etp)的装置;b.提供包含高盐、潜在地包含一种或多种靶分析物的生物学样品,任选地尿液样品;c.对所述尿液样品实施一个或多个预处理步骤;d.通过使用所述装置实施etp来进行一次或多次加速电泳运行以将所述一种或多种靶分析物聚焦到一个或多个聚焦区中,例如作为一个或多个etp带;以及e.通过收集包括所述一种或多种核酸的所述一个或多个聚焦区来收集所述一种或多种靶分析物;从而获得一种或多种分离和/或纯化的靶分析物。在一些情况下,靶分析物可以包括一种或多种核酸,例如一种或多种cfna。
100.在一些实施例中,用于一种或多种靶分析物的基于etp的分离和/纯化的所述方法可以是自动化的,例如,通过使用自动化etp系统。例如,参见2018年11月13日提交的美国专利公开号us 2020/0282392;2018年10月12日提交的美国申请序列号62/744,984;2019年5月14日提交的美国申请序列号62/847,678;2018年11月13日提交的pct专利公开号wo 2019/092269;2019年10月14日提交的pct专利公开号wo 2020/074742,其公开内容通过引用的方式全部并入本文。
101.在一些实施例中,用于与本文所述的方法一起使用的etp装置可以包括如在以下专利中所描述的一种etp装置:2018年11月13日提交的美国专利公开号us 2020/0282392;2018年10月12日提交的美国申请序列号62/744,984;2019年5月14日提交的美国申请序列号62/847,678;2018年11月13日提交的pct专利公开号wo 2019/092269;2019年10月14日提交的pct专利公开号wo 2020/074742,其公开内容通过引用的方式全部并入本文。
102.在一些实施例中,所述方法可以包括从一个或多个尿液样品中基于etp的分离和/或纯化一种或多种核酸,其中所述核酸包括cfna,例如cfdna和/或cfrna。在一些情况下,所述方法可导致在单次etp运行期间分离和/或纯化在一个或多个etp带和/或聚焦区中的dna和rna两者。在一些情况下,在基于etp的分离和/或纯化之后,rna和dna可彼此分离,并且rna和/或dna可进行进一步的下游测定,诸如一次或多次ivd测定、测序和/或基因表达谱分
析。在一些实施例中,所述尿液样品可以包括尿液样品溶液,该尿液样品溶液由尿液样品的一种或多种预处理产生。
103.在一些实施例中,所述方法可以包括从一个或多个尿液样品中基于etp分离和/或纯化一种或多种核酸,其中所述核酸源自一种或多种细胞,诸如上皮细胞、白细胞、恶性细胞和/或可能存在于尿液中的任何其他细胞,例如那些自发释放到尿液中的细胞。
104.在一些实施例中,所述方法可以包括从一个或多个尿液样品中基于etp分离和/或纯化一种或多种生物标志物,其中所述生物标志物可以包括核酸、cfna、蛋白质和/或细胞外小泡中的任何一种或多种。在一些情况下,所述方法可以导致在单次etp运行期间分离和/或纯化在一个或多个etp带和/或聚焦区中的一种或多种生物标志物的任何一种。在一些情况下,在基于etp的分离和/或纯化之后,一种或多种生物标志物可以在进一步下游测定(诸如一种或多种ivd测定、测序和/或基因表达谱)之前彼此分离。在一些实施例中,所述尿液样品可以包括尿液样品溶液,该尿液样品溶液由尿液样品的一种或多种预处理产生。
105.在一些实施例中,用于加速电泳的装置和/或方法可以聚焦并允许在允许发生希望的聚焦和收集的任何希望的时间量内收集靶分析物。在一些实施例中,所述方法可以包括实施etp 120分钟或更长、120分钟或更少、100分钟或更少、80分钟或更少、60分钟或更少、50分钟或更少或40分钟或更少。
106.在一些实施例中,与使用常规技术(诸如上文描述的那些,例如,基于珠和/或基于柱的方法)从尿液样品中获得的靶分析物相比,通过从尿液样品进行基于etp的核酸分离/纯化而获得的靶分析物例如核酸可以具有更高的产率和/或更高的质量。在一些实施例中,通过从一个或多个尿液样品中进行基于etp的核酸分离/纯化而获得的靶分析物可以具有如通过基于一种应用技术诸如qpcr的分析所测量的相同或更高的质量,例如,从所述基于qpcr的分析中获得的q评分,诸如质量控制(qc)qpcr。应注意,q评分在从0(低质量)至1(高质量)的范围内,并且优选更高质量的样品用于下游ivd应用(诸如基于测序的应用)。在一些实施例中,与诸如那些包括基于珠和/或基于柱的方法的常规方法相比,使用包括从一个或多个尿液样品中基于etp的核酸的分离/纯化的方法可以获得1.25倍或更多、1.5倍或更多、1.75倍或更多、2.0倍或更多、2.25倍或更多、2.5倍或更多、2.75倍或更多、3倍或更多、4倍或更多、5倍或更多、10倍或更多、100倍或更多或1000倍或更多的靶分析物。在一些实施例中,从本文描述的方法中获得的分离和/或纯化核酸的量可以是任何量并且可以至少部分地基于所使用的样品。在一些情况下,分离和/或纯化核酸的量可以在从纳克或更少至微克或更多和/或宏克或更多的任何范围内。
107.在一些实施例中,用于样品分析的装置可以包括凝胶或可以用于稳定前导电解质的其他材料。在进一步的实施例中,用于样品分析的装置可以包括凝胶,并且所述凝胶可以帮助避免不想要的样品污染。例如,用于样品分析的装置可以用来提取ctdna,并且所述凝胶可以用来帮助避免ctdna被基因组dna和/或细胞碎片污染。为了避免所述不想要的污染,凝胶可以具有一定的组成以允许ctdna而不是基因组dna或细胞碎片迁移通过所述凝胶。这种原理可以应用于其他样品分析,其中避免目标样品/靶分析物的污染可能是有益的。在一些实施例中,网状聚合物和/或多孔材料可以与用于样品分析的装置中的凝胶类似的方式使用,诸如、例如滤纸或水凝胶。所述网状聚合物和/或多孔材料的选择可以是有助于实施希望的分离/浓缩和/或防止不希望的样品污染的材料。例如,可以选择不允许蛋白质通过/
迁移但可以允许靶核酸通过/迁移的材料。
108.在一些实施例中,用于样品分析的装置可以用于聚焦和收集肿瘤dna和/或循环肿瘤dna(ctdna)和/或循环cfdna,例如存在于孕妇尿液中的那些,和/或表达在特定条件下过表达或低表达的蛋白质的循环dna,然后可以任选地进行进一步的下游分析,诸如核酸测序和/或其他体外诊断应用。此类下游体外应用包括例如疾病检测诸如癌症诊断和/或癌症预后和/或癌症分期、感染病症的检测、亲子分析、胎儿染色体异常诸如非整倍性的检测、胎儿遗传特征的检测、妊娠相关疾病的检测、自身免疫或炎症的检测、以及无数其他潜在用途。
109.在一些实施例中,用于样品分析的方法可以包括聚焦和收集靶核酸,并且所述靶核酸可以具有任何期望的大小。例如,所述靶核酸可以是5nt或更小、10nt或更小、20nt或更小、30nt或更小、50nt或更小、100nt或更小、1000nt或更小、10,000nt或更小、100,000nt或更小、1,000,000nt或更小或者1,000,000nt或更大。
110.此外,本公开一般涉及装置和方法,其包括一种或多种靶分析物(例如一种或多种靶核酸,可以包括无细胞核酸(cfna),例如cfdna)的基于etp的分离/纯化,通过下述进行:提供用于实施etp的装置;提供包括所述一种或多种无细胞核酸的样品,例如尿液样品、例如尿液样品溶液;通过使用所述装置实施etp来进行一次或多次etp运行,其中所述etp运行将所述一种或多种cfna聚焦到一个或多个聚焦区中,例如作为一个或多个etp带;以及收集所述一种或多种cfna,从而获得一种或多种分离/纯化的cfna。
111.在一些实施例中,通过基于etp的方法和装置分离/纯化的cfna,例如,cfdna,可以进一步经历利用非多态性和多态性检测来确定混合样品例如尿液样品中的来自单一来源的来源贡献和拷贝数变异(cnv)的测定系统,诸如在通过引用全文并入本文的美国专利申请公开号2012/0034685中描述的。
112.此外,本公开一般涉及通过基于etp的装置和方法从一个或多个样品、例如尿液样品中,分离/纯化一种或多种cfna,例如一种或多种cfdna和/或一种或多种cfrna,其中所述分离/纯化的一种或多种cfna被进一步分析以检测胎儿非整倍性。例如,这种检测胎儿非整倍性的测定法一般描述于通过引用全文并入本文的美国专利申请公开号2012/0034685中,并且具体地如引用参考文献的实例7中所描述。
113.除了检测非整倍性之外,还可以使用特定的多态性来确定胎儿对母体样品、例如尿液样品的贡献百分比,其中通过本文所述的基于etp的装置和方法分离/纯化的cfna(例如cfdna)用于此类确定。用于确定这些胎儿贡献百分比的一般方法在全文以引用方式并入的2012年6月19日提交的美国专利公开号2013/0024127a1中有所描述。
114.此外,通过本文讨论的基于etp的方法和装置从样品、诸如尿液样品中分离/纯化的cfna(例如cfdna)的使用可以进一步经历cnv分析,诸如上述分析,这可以允许鉴定混合样品的cnv和感染源。
115.此外,通过基于etp的装置和方法(诸如本文所述的那些)从样品、诸如尿液样品中分离/纯化的cfna,例如cfdna,可以进一步经历cfna的肿瘤特异性改变的定量和定性检测(诸如cfdna链完整性、频率突变、微卫星异常和基因的甲基化),作为癌症患者的诊断、预后和监测标志物,并任选地与cnv检测相结合以提供一种对患有或怀疑患有恶性肿瘤的患者进行辅助临床诊断、治疗、结果预测和进展监测的方法。对于进一步的讨论,参见美国专利申请公开号2012/0034685,其通过引用整体并入本文。
116.此外,通过基于etp的装置和方法(诸如本文所述的那些)从样品、诸如尿液样品中分离/纯化的cfna(例如cfdna)可以进一步经历可以用于使用cfdna检测与snp检测的组合或者一个或多个单基因中的突变来监测移植患者的器官健康的测定系统(对于进一步讨论,参见美国专利申请公开号2012/0034685)。移植器官的基因组与受体患者的基因组不同,并且可以使用这样的测定系统检测器官健康状况。例如,已显示心脏移植受者的急性细胞排斥与来自供体基因组中的无细胞dna水平的显著增加有关。
117.在一些情况下,通过基于etp的装置和方法从样品、诸如尿液样品中分离和收集的靶分析物,例如cfna,可以经受美国专利申请公开号2012/0034685(通过引用整体并入本文)的任何一种或多种方法和/或测定,例如,除了上述方法和测定之外,在标题为“测定方法”、“检测拷贝数变异”、“与疾病或倾向相关的多态性”、“选定的扩增”、“通用扩增”、“样品内和样品之间的变异最小化”、“使用测定系统检测来自癌症患者的混合样品”、“使用测定系统检测移植患者的混合样品”、“使用测定系统检测母体样品”和“混合样品中次要来源dna含量的测定”的部分中描述的那些方法和测定。
118.此外,本公开一般进一步涵盖一种分离/纯化一种或多种靶分析物(例如一种或多种靶核酸)的方法,该方法包括所述一种或多种靶分析物的基于etp的分离/纯化,其进一步包括使用etp上位标记物。在一些实施例中,所述etp上位标记物可以包含与靶分析物相比尺寸更大和/或长度更长的化合物或分子,使得在基于etp的靶分析物分离/纯化期间,etp上位标记物表示可以停止收集靶分析物的截止点。例如,荧光标记的或以其他方式可检测地标记的etp上位标记物可以产生为大小大于在基于etp的分离/纯化期间待收集的靶dna。通过在整个etp运行过程中监控标记物,使用者或自动化机器能够在标记物落入收集管之前停止运行,从而允许捕获小于标记物的dna,同时由于较大的污染dna定位在etp上位标记物后面而将其留在管外。此外,标记物本身不会被收集并因此可以大量使用并与各种可检测标记一起使用,因为它不会干扰下游测定,例如ivd测定。在一些情况下,etp上位标记物可用于基于etp的分离/纯化方法,因为它有助于排除不想要的材料,例如,从分离/纯化的cfdna中排除基因组dna。在一些实施例中,etp上位标记物可以是约1000bp或更长的长度。
119.此外,本公开一般涵盖从样品诸如尿液样品中基于etp的ctna(例如ctdna)的分离/纯化,其中所述ctna可以进一步经历包括通过深度测序进行的癌症个性化谱分析(capp-seq)的方法,诸如其全部内容通过引用并入本文的美国专利申请公开号20160032396描述的。
120.在一些实施例中,为了在本方法和装置中引起带电颗粒的移动,在方便的时间范围内,电场强度可以为约10v至约10kv,电功率范围为约1mw至约100w。在一些实施例中,用于最快分析的最大电功率可取决于样品和电解质溶液的电阻率以及可用于构建本文所述装置的材料的冷却能力。
121.在一些实施例中,所述从一个或多个尿液样品中一种或多种核酸的所述基于etp的分离和/或纯化可以使得包含在原始样品中的一种或多种靶分析物中的1%或更少、1%或更多、5%或更多、10%或更多、15%或更多、20%或更多、25%或更多、30%或更多、35%或更多、40%或更多、45%或更多、50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、85%或更多、90%或更多、95%或更多或者99%或更多被分离并收集。在一些实施例中,所述方法可以产生1%或更低、1%或更高、5%或更高、10%或更高、15%或更高、20%
或更高、25%或更高、30%或更高、35%或更高、40%或更高、45%或更高、50%或更高、55%或更高、60%或更高、65%或更高、70%或更高、85%或更高、90%或更高、95%或更高或者99%或更高纯度的所述一种或多种分离/纯化的靶分析物,例如,如通过分析技术所测量,以确定包含一种或多种靶分析物的etp分离/纯化的样品的组成。在一些实施例中,可以改变和/或优化一种或多种缓冲液浓度例如le和/或te缓冲液浓度、包括在所述etp装置中的凝胶的百分比和/或基于etp的分离和收集运行的停止时间,以增强所述一种或多种核酸与包含在样品中的其他材料的分离。
122.在一些实施例中,通过基于etp的分离/纯化来分离/纯化的一种或多种核酸可以是任何期望的大小。在一些实施例中,核酸的大小可以是5nt或更小、10nt或更小、20nt或更小、30nt或更小、50nt或更小、100nt或更小、1000nt或更小、10,000nt或更小、100,000nt或更小、1,000,000nt或更小或者1,000,000nt或更大。在一些实施例中,所述方法可以进一步包括在所述基于etp的分离和/或纯化期间和/或之后检测所述一种或多种核酸,例如,所述检测包括光学检测,在一些情况下,其中所述光学检测包括检测与所述一种或多种核酸结合和/或相关联的嵌入染料和/或光学标签。在一些实施例中,所述检测可包括电检测,例如电压监测。在一些实施例中,检测可以包括监测染料(例如亮蓝色)的运动,并且基于所述染料的运动调整任何一个或多个etp参数,例如开始或停止样品收集。
123.在一些实施例中,任选地从一个或多个尿液样品中对一种或多种靶分析物进行基于etp的分离/纯化的方法可以是自动化方法,其中样品自动加载到所述装置中和/或从所述装置中自动收集所述一种或多种靶分析物。在一些实施例中,一种或多种分离和/或纯化的靶分析物可以经历一次或多次进一步etp运行以进一步分离和/或纯化所述一种或多种靶分析物。
124.此外,本公开一般涉及一种鉴定源自肿瘤的snv的方法,其包括(a)从患有癌症或被怀疑患有癌症的受试者获得样品,任选地其中样品是尿液样品(例如,尿液样品溶液);(b)进行基于etp的分离和/或纯化以分离和/纯化靶核酸以获得分离和/或纯化的样品;(c)对分离和/或纯化的样品进行测序反应以产生测序信息;(d)将算法施加至测序信息以产生基于来自步骤(c)的测序信息的一系列候选肿瘤等位基因,其中候选肿瘤等位基因包括非优势碱基,所述非优势碱基不是种系snp;以及(e)基于一系列候选肿瘤等位基因,鉴定源自肿瘤的snv。在一些实施例中,候选肿瘤等位基因可包含基因组区域,所述基因组区域包含候选snv。
125.此外,本公开一般涉及一种鉴定源自病毒的核酸的方法,其包括(a)从被怀疑具有病毒感染或被怀疑已经暴露于病毒的受试者获得样品(例如,尿液样品);(b)进行基于etp的分离和/或纯化来分离和/或纯化靶核酸以获得分离和/或纯化的核酸;(c)对分离和/或纯化的核酸进行测序反应以产生测序信息;以及(d)基于测序信息,确定受试者是否已经被一种或多种病毒感染。
126.此外,在进一步的示例性实施例中,如本文所述的用于样品分析的装置可以包括容纳0.25ml或更少、0.25ml或更多、0.5ml或更多、0.75ml或更多、1.0ml或更多、2.5ml或更多、5.0ml或更多、7.5ml或更多、10.0ml或更多、12.5ml或更多、或15.0ml或更多、20.0ml或更多、25.0ml或更多、30.0ml或更多、40.0ml或更多、或50ml或更多的样品体积。在一些实施例中,可以测量一种或多种分离和/或纯化的核酸的浓度。在一些实施例中,加载到etp装置
中,用于基于etp的分离/纯化的样品的样品体积可以是0.25ml或更小、0.25ml或更大、0.5ml或更大、0.75ml或更大、1.0ml或更大、2.5ml或更大、5.0ml或更大、7.5ml或更大、10.0ml或更大、12.5ml或更大、或15.0ml或更大、20.0ml或更大、25.0ml或更大、30.0ml或更大、40.0ml或更大、或50ml或更大。在一些实施例中,加载到etp装置中,用于基于etp的分离/纯化的样品的样品体积可以是0.25ml或更小、0.25ml或更大、0.5ml或更大、0.75ml或更大、1.0ml或更大、2.5ml或更大、5.0ml或更大、7.5ml或更大、10.0ml或更大、12.5ml或更大、15.0ml或更大、20.0ml或更大、25.0ml或更大、30.0ml或更大、40.0ml或更大或者50ml或更大。
127.在进一步的示例性实施例中,所述装置可用于浓缩靶分析物,例如,约2倍或更多至约1000倍或更多。在一些实施例中,所述靶分析物可包括一种或多种核酸。在进一步的实施例中,所述靶分析物可包括小的无机和有机离子、肽、蛋白质、多糖、dna或微生物诸如细菌和/或病毒。在一些实施例中,所述靶分析物可以包括细胞外小泡,例如尿外泌体。
128.在一些实施例中,通过基于etp的分离/纯化收集的所述核酸可用于一种或多种下游体外诊断应用。此外,在一些实施例中,用于样品分析的etp装置可以在线连接到其他装置,例如毛细管分析仪、色谱、pcr装置、酶反应器等,和/或可以用于实施进一步的样品分析的任何其他装置,例如与ivd应用相关联的装置。在一些实施例中,etp装置可用于具有核酸测序文库制备的工作流程中。此外,在一些实施例中,etp装置可以与液体处理机器人一起使用,该液体处理机器人可以任选地用于对可能已经从所述装置聚焦和/或收集的样品实施下游分析。
129.在一些实施例中,样品可以包括尿液样品,该尿液样品包含与一种或多种癌症类型相关的一种或多种生物标志物,例如一种或多种ctna,例如一种或多种蛋白质。在一些实施例中,癌症包括选自由以下项组成的组的癌症:急性淋巴细胞白血病(all)、急性髓性白血病(aml)、肾上腺皮质癌、艾滋病相关的癌症(例如,淋巴瘤和卡波济氏肉瘤)、肛门癌、阑尾癌、星形细胞瘤、胆管癌、肝外癌、膀胱癌、骨癌(例如尤因肉瘤、骨肉瘤、恶性纤维组织细胞瘤)、脑干胶质细胞瘤、脑肿瘤(例如星形细胞瘤、脑和脊髓肿瘤、脑干胶质瘤、中枢神经系统非典型畸胎样、横纹肌样肿瘤、中枢神经系统胚胎肿瘤、中枢神经系统生殖细胞肿瘤、颅咽管瘤、室管膜瘤、乳腺癌、支气管肿瘤、伯基特淋巴瘤、乳腺癌、支气管肿瘤、伯基特淋巴瘤、类癌瘤(例如幼儿期,胃肠道病症)、心脏肿瘤、子宫颈癌、脊索瘤、慢性淋巴细胞性白血病(cll)、慢性骨髓性白血病(cml)、慢性骨髓增生性疾病、结肠癌、结直肠癌、颅咽管瘤、皮肤t细胞淋巴瘤、导管癌(例如胆汁,肝外)、肝外导管原位癌(dcis)、胚胎肿瘤、子宫内膜癌、室管膜瘤、食管癌、嗅神经母细胞瘤、颅外生殖细胞瘤、性腺外生殖细胞瘤、肝外胆管癌、眼癌(例如眼内黑素瘤、视网膜母细胞瘤)、骨纤维组织细胞瘤、恶性和骨肉瘤、胆囊癌、胃癌、胃肠道类癌、胃肠道间质瘤(gist)、生殖细胞肿瘤(例如卵巢癌、睾丸癌、颅外癌、性腺外癌、中枢神经系统)、妊娠滋养细胞肿瘤、脑干癌、毛细胞白血病、头颈癌、心脏癌、肝癌细胞、组织细胞增生症、郎格汉斯细胞癌、霍奇金淋巴瘤、下咽癌、眼内黑色素瘤、胰岛细胞瘤、胰腺神经内分泌肿瘤、卡波西肉瘤、肾癌(例如肾细胞、肾母细胞瘤和其他肾肿瘤)、朗格汉斯细胞组织细胞增生症、喉癌、白血病、急性淋巴细胞性白血病(all)、急性髓性白血病(aml)、慢性淋巴细胞性白血病(cll)、慢性粒细胞白血病(cml)、毛细胞癌、唇癌和口腔癌、肝癌(原发性)、小叶原位癌(lcis)、肺癌(例如幼儿期,非小细胞、小细胞)、淋巴瘤(例如与艾滋病相关
的)、伯基特(例如,非霍奇金淋巴瘤)、皮肤t细胞(例如蕈样肉芽肿、sezary综合征)、霍奇金、非霍奇金、原发性中枢神经系统(cns))、巨球蛋白血症、瓦尔登斯特伦、男性乳腺癌、骨恶性纤维组织细胞瘤和骨肉瘤、黑色素瘤(例如,儿童期、眼内(眼))、梅克尔细胞癌、间皮瘤、转移性鳞状颈癌、中线束癌、口腔癌、多内分泌瘤综合征、多发性骨髓瘤/浆细胞肿瘤、蕈样肉芽肿、骨髓增生异常综合征、髓性白血病、慢性(cml)、多发性骨髓瘤、鼻腔和鼻窦癌、鼻咽癌、神经母细胞瘤、口腔癌、唇癌和口咽癌、骨肉瘤、卵巢癌、胰腺癌、胰腺神经内分泌肿瘤(胰岛细胞瘤)、乳头状瘤病、副神经节瘤、副鼻窦和鼻腔癌、甲状旁腺癌、阴茎癌、咽癌、嗜铬细胞瘤、垂体瘤、浆细胞肿瘤、胸膜肺母细胞瘤、原发性中枢神经系统(cns)淋巴瘤、前列腺癌、直肠癌、肾细胞(肾)癌、肾盂和输尿管、移行细胞癌、横纹肌肉瘤、涎腺癌、,肉瘤(例如尤文、卡波西、骨肉瘤、横纹肌肉瘤、软组织、子宫)、sezary综合征、皮肤癌(例如黑色素瘤、merkle细胞癌、基底细胞癌、非黑色素瘤)、小肠癌、鳞状细胞癌、隐匿原发性颈鳞癌、胃癌、睾丸癌、喉癌、胸腺瘤和胸腺癌、甲状腺癌、滋养细胞肿瘤、输尿管和肾盂癌、尿道癌、子宫癌、子宫内膜癌、子宫肉瘤、阴道癌、外阴癌、华氏巨球蛋白血症、威尔姆氏瘤等。
130.本文适当地示例性公开的装置和方法可以在本文未具体公开的任何元素和/或本文具体公开的任何元素的情况下实施。
131.加速电泳设备
132.用于加速电泳的装置一般使用同心或多边形盘架构,例如,如图1至图4所示。玻璃或陶瓷用于制造系统(即用于同心圆盘或多边形圆盘的材料),因为这些材料使得传热性能提高,这在装置操作期间是有益的。例如,由于与窄通道相比,加速电泳装置的扁平通道具有良好的传热能力,因此一般可以防止聚焦材料的过热(或沸腾)。电流/电压编程也适用于调节装置的焦耳热。塑料材料也用于装置制造。一般而言,装置被制造成容纳所需样品体积的尺寸,例如毫升级样品体积,例如高达15ml。
133.参考图1至图3,两个同心盘由分隔物隔开,从而形成用于加速电泳样品处理的平坦通道。电流通过多个高压连接(hv连接)和系统中心的接地连接施加(例如,参见图1和图3)。在一些情况下,样品通过装置中的开口注入装置中,该开口例如在顶部或侧面(参见例如图3)。电的施加将样品的靶分析物聚焦为一个同心环,该环迁移到盘的中心(下文进一步讨论),然后通过位于装置底部的注射器收集靶分析物(例如参见图3)。如图2a(顶视图)和图2b所示,装置设置的实例包含外圆形电极(1)、终止电解质(2)和前导电解质(3)。一般而言,外部圆形电极(1)的直径为约10-200mm,前导电解质的直径范围为约10μm至约20mm的厚度(高度)。前导电解质通过凝胶、粘性添加剂稳定,或以其他方式例如通过膜与终止电解质以流体动力学方式分离。凝胶或流体动力分离可防止前导电解质与终止电解质在装置运行期间混合。而且,在一些装置中,通过使用非常薄(<100um)的电解质层来防止混合,如下面进一步讨论的。
134.参考图2a至图2b,在前导电解质的中心是带有电极(5)的电极池(4)。电极(1,5)和电解质(2,3)的组件放置在平坦的电绝缘支撑物(8)上。电解质池(4)用于在分离过程之后移除浓缩的样品溶液,诸如通过将样品重该池移液来移除。电极池(4)也是一个样品收集池。外圆形电极(1)可以设置在圆形通道的末端,在该圆形通道中设置有前导电解质(3)和终止电解质(2)。
135.在替代性布置中(参见图4),中心电极(5)被移动到通过管(9)与浓缩器连接的前
导电解质池(10)。管(9)通过半透膜(未示出)直接连接或在一端封闭。根据所用膜的特性,这种通过阻止大分子的迁移的布置促进收集。这种布置简化了样品收集并提供了将浓缩器在线连接到其他装置的手段,该其他装置例如毛细管分析仪、色谱、pcr装置、酶促反应器等。管(9)还可以用于在没有包含前导电解质的凝胶的布置中供应前导电解质的逆流流动。
136.一般而言,用于前导电解质稳定的凝胶由任何不带电荷的材料,诸如,例如琼脂糖、聚丙烯酰胺、支链淀粉等形成。在一些装置中,顶表面是敞开的,或者在一些装置中,顶表面是封闭的,这取决于要进行的分离的特性。如果闭合,则用于覆盖装置的材料优选地是导热绝缘材料,以防止在加速电泳装置操作期间的蒸发。
137.一般而言,环(圆形)电极最好是镀金或镀铂的不锈钢环,因为这可以实现最大的耐化学性和电场均匀性。替代性地,不锈钢和石墨电极可用于一些装置,特别是一次性装置。而且,环(圆形)电极可以用提供类似功能的其他部分代替,例如,通过线电极阵列。此外,规则间隔的电极的2维阵列可以附加地或替代性地用于加速电泳装置中。圆形定向的规则间隔电极阵列也可用于加速电泳装置中。此外,也可使用其他电极配置来基于所期望的样品分离(例如,用于引导聚焦区)来实施不同的电场形状。此类配置被描述为电极的多边形布置。当分成电分离的段时,会产生一个开关电场,用于驱动电场的时间依赖性形状。在一些装置中,这种布置有利于样品收集。
138.加速电泳装置操作
139.加速电泳装置,例如具有图1至图4中呈现的设计的哪些,要么以两电解质池布置操作,其中前导电解质后面跟随着终止电解质混合的样品,或者与前导电解质混合的样品后跟随着终止电解质,要么以三电解质池布置操作,如图5所示。在这种布置中,样品可以与任何导电溶液混合。替代性地,当样品包含合适的终止离子时,终止电解质区可以被消除。参考图2a至图2b,在用样品与合适的终止电解质的混合物填充终止电解质池(2)并打开电源(6)后,离子开始朝着中心电极(5)移动并在前导电解质和终止电解质之间的边界处形成多个区(7)。迁移期间,样品区的浓度根据一般等速电泳原理进行调整[foret,f.,krivankova,l.,bocek,p.,capillary zone electrophoresis.electrophoresis library,(editor radola,b.j)vch,verlagsgessellschaft,weinheim,1993.]。因此,低浓度的样品离子被浓缩,而高浓度的样品离子被稀释。一旦样品区进入电解质池(4),分离过程就会停止,并且聚焦的物质被收集在装置的中心。实际上,迁移区的最终浓度与前导离子的浓度相当。通常,使用加速电泳法实现了2到1000或甚至更大的浓缩系数。
[0140]
在三电解质池布置中,将样品施加在前导电解质和终止电解质之间(参见,例如,图5),与两电解质池布置相比,并且此类布置使得样品浓缩和分离稍快。
[0141]
为了避免混合,前导电解质和尾随电解质通过中性(不带电)粘性介质稳定,例如琼脂糖凝胶(参见例如图2a至图2b、3,其代表前导电解质任选地包含在凝胶内或与终止电解质以流体动力学方式分离)。
[0142]
当前导离子具有比一种或多种目标样品离子更高的有效电泳迁移率时,本领域技术人员已知的用于等速电泳的所有常用电解质均可与本加速电泳装置一起使用。对于选定的终止离子,情况正好相反。
[0143]
该装置在正模式(阳离子物质的分离/浓缩)或负模式(阴离子物质的分离/浓缩)下操作。用于使用加速电泳进行阴离子分离的最常用前导电解质包括,例如,氯化物、硫酸
根或甲酸根,用合适的碱例如组氨酸、tris、肌酸酐等缓冲至所希望的ph。用于进行阴离子分离的加速电泳的前导电解质的浓度相对于前导离子在5mm-1m的范围内。终止离子则通常包括mes、mops、hepes、taps、乙酸根、谷氨酸根等弱酸阴离子和低迁移率阴离子。用于正离子模式下加速电泳的终止电解质的浓度范围为:相对于终止离子,5mm 10m。
[0144]
对于阳离子分离,用于加速电泳的常见前导离子包括,例如:钾、铵或钠,其中乙酸根或甲酸根是最常见的缓冲配对离子。反应水合氢离子移动边界则充当由任何弱酸形成的通用终止电解质。
[0145]
在正离子模式和负离子模式中,前导离子浓度的增加导致样品区的成比例增加,对于给定的施加电压,以增加的电流(功率)为代价。典型的浓度在10-100mm范围内;然而,更高的浓度也是可能的。
[0146]
此外,在只有区域电泳分离就足够的情况下,该装置可以仅使用一种背景电解质进行操作。
[0147]
电流和/或电压编程适用于调整样品的迁移速度。应注意,采用这种同心布置,横截面积在迁移期间发生变化,并且区运动的速度在时间上不是恒定的。因此,这种布置并不严格遵循等速电泳原理,其中区域以恒定速度迁移。根据电源(6)的操作模式,可以区分三种基本情况:1.以恒定电流进行的分离;2.以恒定电压进行的分离恒压分离;和3.在恒定功率下分离
[0148]
用于下述方程的变量如下:d=迁移距离(d<0;r>);e=电场强度;h=电解质(凝胶)高度;i=电流;j=电流密度;κ=电解质电导率;r=半径;s=横截面积(两电极质之间的区域);u=电泳迁移率;v=速度;x=从中心电极到加速电泳边界的长度。
[0149]
在使用由高压电源(hvps)提供的恒定电流的常见操作模式中,迁移区会随着由于电流密度的增加而向中心移动而加速。关于在以恒定电流进行并使用包含圆形架构的装置(例如,包含一个或多个圆形电极的装置)的分离中,在距离d处的相对速度仅取决于前导电解质的迁移率(电导率),如在与起始半径r的距离d处的加速电泳边界速度v的推导证明,如下所示:一般方程:
[0150]
u=ir或e=j/κ(欧姆定律)
[0151]
e=u/x(电场强度)
[0152][0153]
v=ue
[0154]
s=2πxh
[0155]
与半径为r的起点距离为d处的加速电泳边界速度v:
[0156]v(d)
=u
l
i/2π(r-d)hk
l
=常数/(r-d)
[0157]
对于在恒定电流下行进的距离(d)与在距离d处的相对速度的关系图,参见图6b。
[0158]
etp装置也可以在恒定电压或恒定功率下运行。在恒定电压和恒定功率下进行分析期间,电迁移的速度也会加快。
[0159]
使用示例性装置的加速电泳
[0160]
使用如图7所示的加速电泳装置进行将磺胺酸染料(spadns)聚焦在同心环内的加速电泳分离。施加1w恒定功率以在加速电泳装置中实施加速电泳。
[0161]
参考图7,spadns被聚焦在一个同心环状的聚焦区内,可以看成是图7中的红色区域。红色圆圈的上半部分显示该区域的高度约为5mm。随着加速电泳区从边缘向装置中心移动,最终spadns的聚焦区进入装置中心并在装置中心被收集,从而证明使用加速电泳对所希望的样品的聚焦和回收。
[0162]
使用加速电泳装置(图8a)进行加速电泳以聚焦磺胺酸(spadns)。图8a的装置具有圆形架构和直径为10.2cm的圆形金电极。hcl-组氨酸(ph 6.25)用作前导电解质并包含在10ml的0.3%琼脂糖凝胶中,该凝胶的直径为5.8cm。15ml的mes tris(ph 8.00)用作尾随电解质。该装置的注射器池含有前导电解质hcl his(ph 6.25)。在尾随电解质中制备300μl浓度为0.137mm的spadns并加载到装置中。为了实施加速电泳,使用了1w的恒定功率。
[0163]
参考图8b,spadns被聚焦在一个同心环状的聚焦区内,可以看成是图8b中的红色区域。随着加速电泳区从边缘向装置中心移动,最终spadns的聚焦区进入装置中心并在装置中心被收集,从而证明使用加速电泳对所希望的样品的聚焦和回收。
[0164]
此外,图8a的加速电泳装置用于执行加速电泳以聚焦30nt寡聚体(rox-oligo)。图8a的装置具有圆形架构和直径为10.2cm的圆形金电极。10mm hcl-组氨酸(ph 6.25)用作前导电解质,包含在10ml的0.3%琼脂糖凝胶中,该凝胶的直径为5.8cm。15ml的10mm mes tris(ph 8.00)用作尾随电解质。该装置的注射器池含有浓度为100mm的前导电解质hcl his(ph 6.25)。在尾随电解质中制备75μl浓度为100μm的rox-oligo并加载到装置中。为了实施加速电泳,使用了1w的恒定功率。
[0165]
参考图8c,rox-oligo被聚焦在一个同心环状的聚焦区内,可以看成是图8c中的蓝色区域。随着加速电泳区从边缘向装置中心移动,最终rox-oligo的聚焦区进入装置中心并在装置中心被收集,从而证明使用加速电泳对所希望的样品的聚焦和回收。
[0166]
使用加速电泳装置(图9a至图9b)进行加速电泳以聚焦磺胺酸染料(spadns),随后从所述装置收集该染料(图9c至图9d)。图9a至图9b的装置具有圆形架构和直径为11.0cm的圆形不锈钢线电极(902)。圆形不锈钢线电极902标记发生加速电泳的圆形通道的外部。电极池或样品收集池(904)位于圆形通道的中心。参考图9b,示意图的数字表示以毫米为单位的尺寸。20mm hcl-组氨酸(ph 6.20)用作前导电解质。要么5ml的10mm mes tris(ph 8.00)用作尾随电解质,且在le中具有0.3%琼脂糖凝胶,其中凝胶的直径为8.9cm(图9c)并在引入te之前形成;或者15ml的10mm mes tris(ph 8.00)用作含有0.3%凝胶的尾随电解质,该凝胶具有5.8cm的直径(图9d)并且在引入te之前形成。该装置的电极池含有浓度为100mm的前导电解质hcl his(ph 6.25)。
[0167]
参考图9c,在15ml尾随电解质中制备150μl浓度为0.137mm的spadns并加载到装置中。为了实施加速电泳,使用了2w的恒定功率。spadns被聚焦在一个同心环状的聚焦区内,可以看成是图9c中的红色区域。随着加速电泳区从边缘向装置中心移动,最终spadns的聚焦区进入装置中心并在装置中心被收集,从而证明使用加速电泳对所希望的样品的聚焦和回收。与初始15ml的含spadns样品的吸光度相比,回收的spadns的吸光度增加了40倍。
[0168]
参考图9d,在15ml尾随电解质中制备150μl浓度为0.137mm的spadns并加载到装置中。为了实施加速电泳,使用了2w的恒定功率。spadns被聚焦在一个同心环状的聚焦区内,可以看成是图9d中的红色区域。随着加速电泳区从边缘向装置中心移动,最终spadns的聚焦区进入装置中心并在装置中心被收集,从而证明使用加速电泳对所希望的样品的聚焦和
回收。与初始15ml的含spadns样品的吸光度相比,回收的spadns的吸光度增加了40倍。
[0169]
图9a至图9b的加速电泳装置还用于在不使用凝胶的装置中进行加速电泳以从生理盐水溶液中聚焦spadns。20mm hcl-组氨酸(ph 6.20)用作前导电解质。13ml的10mm mes tris(ph 8.00)用作尾随电解质,其进一步与3ml 0.9%nacl混合。该装置的电极池含有浓度为100mm的前导电解质hcl组氨酸(ph 6.25)。
[0170]
参考图10,在与3ml的0.9%nacl混合的13ml尾随电解质中制备150μl浓度为0.137mm的spadns并加载到装置中。为了实施加速电泳,使用了2w的恒定功率。spadns被聚焦在一个同心环状的聚焦区内,可以看成是图10中的红色区域。随着加速电泳区从边缘向装置中心移动,最终spadns的聚焦区进入装置中心并在装置中心被收集,从而证明使用加速电泳对所希望的样品的聚焦和回收。
[0171]
图9a至图9b的加速电泳装置还用于进行加速电泳以分离和聚焦spadns和专利蓝染料,其中乙酸作为间隔物。20mm hc1-组氨酸(ph 6.20)用作前导电解质。5ml的10mm mes tris(ph 8.00)用作尾随电解质,其进一步与150μl的10mm乙酸、150μl的0.1mm专利蓝染料和150μ1的0.137mm spadns混合。spadns、乙酸和专利蓝染料的有效迁移率值(10-9
m2/vs)分别为55、42、7和32。该装置的电极池含有浓度为100mm的前导电解质hcl his(ph 6.25)。对于该实验,该装置的通道中没有使用凝胶,然而凝胶存在于装置平台的顶部。
[0172]
参考图11,尾随电解质、spadns、乙酸和专利蓝染料的混合物被加载到装置中。为了实施加速电泳,使用了2w的恒定功率。spadns被聚焦到同心环状的聚焦区内,其可以看成是图11的红色区/内区,并且专利蓝染料也被聚焦到同心环状的聚焦区内,其可以看作是图11的蓝区/外区。随着加速电泳区从边缘向装置中心移动,最终spadns和专利蓝染料的聚焦区依次进入装置中心并可以在装置中心被独立地收集,从而证明使用加速电泳对所希望的样品的分离、聚焦和回收。
[0173]
加速电泳装置被设计为用于实施加速电泳(图12)。图12的装置具有圆形架构和直径为5.8cm的圆形铜条电极。
[0174]
用于通过基于电导率的样品检测实施加速电泳的系统
[0175]
装置结构
[0176]
根据前面的实例,具有大样品体积容量的加速电泳装置加工为具有圆形分离通道。图13a和图13b示出了装置结构的两个视图。线环电极(直径为1mm的不锈钢线;半径为55mm)连接在圆形分离室的边缘上。样品体积由环形电极和琼脂糖稳定的前导电解质盘(半径为35mm)之间的空间限定。因此,适用的样品体积为每毫米高度5.7毫升。第二电极放置在装置侧面的前导电解质池中。环形电极连接到图13a所示的上部香蕉型连接器。底部香蕉连接器连接到定位在前导电极池中的3em长、0.4mm直径的铂丝电极(图13b所示方案中的“b”)。为了防止来自电解产物的可能干扰,从前导电解质池向中心收集井(图13b所示方案中的“a”)迁移,在装置内部钻出总长度为20em的9mm id内部通道。装置钻孔后的侧开口被硅隔片堵塞。直径为9mm的中心收集井钻透装置,并通过由橡胶o形图密封的移动杆从底部封闭。
[0177]
对于每次分析,在用前导电解质填充中心收集井一直到前导电极池中之后,将带有半透膜的塑料小瓶(slide-a-lyzer
tm mini dialysis units 2000da mwco,thermo fisher scientific,usa)插入中心收集井中。为了尽量减少体积,用刀片将slide-a-lyser
切成两半,形成一个体积小于200微升的收集杯。接下来,在前导电解质中制备具有中心8mm孔的0.3%琼脂糖凝胶盘(直径70mm,厚4mm),定位在装置的中心,并由同样具有中心8mm孔的75x1mm圆形玻璃板覆盖以避免气泡堆积。尽管可以应用多种电泳分离模式(例如,区带电泳、等电聚焦或排代电泳),但我们已经使用加速电泳和包括前导(le)和终止(te)电解质的电解质系统。用注射器将处于终止电解质中的样品溶液注入凝胶盘和环形电极之间的空间内。选择电流联接的极性,使得阴离子样品组分从环形电极向装置中心的收集井迁移。聚焦的样品区进入收集杯后,关闭电流,并移液出样品待进一步使用。空的收集杯被移动杆提起并丢弃。
[0178]
电驱动分离条件
[0179]
在负离子模式下进行分离,其中cl-离子作为前导离子(有效迁移率79.1
×
10-9
m2v-1
s-1
)。前导电解质(le)含有ph 6.2的100mm hcl-组氨酸缓冲液,而终止电解质(te)含有10mm taps,经tris滴定至ph 8.30。琼脂糖稳定的前导电解质盘在20mm前导电解质(hcl-组氨酸;ph 6.25)中制备。所有缓冲液均在去离子水中制备。电源由powerpac 3000(biorad)提供,它在恒定功率模式下以2w运行(这对应于分析开始时的大约16ma和120v)。分析耗时约1小时(分析结束时约为10ma和200v)。
[0180]
样品检测
[0181]
为了检测样品,构建了表面电阻率检测槽并将其联接到商用itp仪器(villa labeco,sp.n.ves,slovakia)的电导率检测器。检测槽的制备如下:将两根铂(pt)线(300μm x 2cm长)连接到与itp仪器匹配的连接器上。pt线的两端插入1ml移液器吸头内,然后用快速固化环氧树脂填充。最后,用刀片切割1mm的内嵌有环氧树脂线的移液器吸头,露出带有两个圆形pt电极的平坦环氧树脂表面。参见图14a和图14b。检测槽安装在实验室支架上,轻轻接触靠近收集瓶的琼脂糖凝胶盘的表面,如图15a所示。采用该用于检测的系统来生成图15b和图17b的电导率轨迹。
[0182]
还构建了另一个示例性系统,用于加速电泳期间的样品检测。在该系统中,由直径为500μm的两根铂(pt)线组成的表面电阻率检测探针整合在加速电泳装置的底部基板(即底板)中,如图16a和图16b中所示。导线的尖端通过底部基板上的中心柱内的专用通道从底部靠近半透膜。导线的相反末端联接到商用itp仪器(villa labeco,sp.n.ves,slovakia)的电导率检测器。用作加速电泳装置的顶板使用磁体与底部基板组装在一起,而o形环(参见图16b)能够实施两个基板之间的完全密封以防止任何泄漏。
[0183]
化学品
[0184]
缓冲组分:l-组氨酸单盐酸盐一水合物(99%)、l-组氨酸(99%)、n-三(羟基甲基)甲基-3-氨基丙磺酸(taps;99.5%)和三(羟基甲基)氨基甲烷(tris;99.8%)购自sigma-aldrich(usa)。具有低电内渗的琼脂糖neeo超品质garose购自carl roth(germany)。乙酸和阴离子染料专利蓝v钠盐来自sigma-aldrich;红色阴离子染料spadns(1,8-二羟基-2-(4-磺基苯基偶氮)萘-3,6-二磺酸三钠盐)来自lachema,brno,czech republic。
[0185]
spadns和专利蓝的聚焦
[0186]
为了测试上述包括加速电泳和电样品检测的示例性装置,该装置用于聚焦和检测测试分析物:spadns和专利蓝色前导电解质(le):缓冲至ph 6.2的hcl-his。尾随电解质(te):缓冲至ph 8.3的taps-tris。凝胶由20ml的6%聚丙烯酰胺凝胶在20mm le中形成。将
100mm le添加到电极池中。样品溶液:15ml的10mm te+150μ l的0.1mm spadns+150μl的0.1mm专利蓝。用注射器将处于终止电解质中的样品溶液注入凝胶盘和环形电极之间的空间内。该装置在恒定功率模式下运行,p=2w。图15a提供了spadns和专利蓝的聚焦图像,显示样品收集井附近的电导率样品检测。图15b提供了该样品聚焦的电导率轨迹,并显示了由于le和te之间的过渡造成的电导率/电阻率的显著变化,包括样品的聚焦区(spadns和专利蓝)。
[0187]
dna分析
[0188]
用荧光素标记的低分子量dsdna梯状条带(从75个碱基对(bp)到1622bp的十个片段)来自bio-rad,usa。通过使用高灵敏度dsdna qubit定量测定试剂盒,使用qubit荧光计(invitrogen,carlsbad,ca,usa)评估收集的级分中的dna浓度。样品中靶分子的浓度由仅在与dna结合时发射的荧光染料报告。使用芯片cge-lif仪器agilent 2100生物分析仪(agilent,santa clara,ca,united states)进一步分析收集的级分。该分析使用高灵敏度dna试剂盒(agilent,united states)提供了收集的样品中dna片段的大小信息。
[0189]
dna聚焦
[0190]
游离溶液中50bp以上的dna片段的电泳迁移率为大约37x10-9
m2/vs,而短片段(约20-50bp)的偏差可能仅为约10%。基于这些迁移率,我们设计了一种不连续电解质系统,适用于将所有样品dna片段聚焦到单个聚焦区。不连续的电解质系统可以包括不同的凝胶结构(或凝胶的存在)、缓冲液的ph值、缓冲液的离子强度和/或离子。对于实验测试,我们选择了片段大小在75到1632bp范围的经荧光素标记的低分子范围dna梯状条带。每个dna片段只有一个荧光团的样品的荧光被2cm半径的激光束照射(图17a)。表面电阻率检测用于指示靠近收集井的le/te边界的过渡(图17b中所示的电导率轨迹)。从le到te的电阻率的整体变化被用作样品位置的指标。基于这种变化,关闭电压并停止分离。通过uv光谱法(吸光度测量值)(图17c)和基于生物分析仪的分析(图17d)分析收集的级分。图17d中的前后标志物(根据制造商的说明以相同的量添加到初始样品和最终样品中)的较低信号强度是由于收集的级分中的dna浓度较高。在这两种情况下,收集的级分中的约30x浓度增加对应于样品体积从起始15ml减少到该示例性实施例中的280μl样品收集体积。进入收集杯之前迁移dna区的体积要小得多(约3μl),并且最终级分浓度主要取决于所选收集瓶的体积。
[0191]
具有基于电压的样品检测的etp
[0192]
在本实例中,使用etp装置进行了三次独立的etp运行以从1ml血浆中聚焦和收集cfdna,并且在三次独立的etp运行中的每一次运行的时间进程中测量电压。三次etp运行中的每一次都是75分钟的长度。每次etp运行开始时的功率水平为6w。功率水平随后在30分钟时降至3w,并且然后在60分钟时降至2w。在三次独立etp运行中的每一次运行中获得的结果呈现在图18中。
[0193]
现在参考图18,在功率保持恒定的每个阶段中,电压逐渐升高。在最后阶段(2w功率,60min至75min),当包含核酸分子的聚焦区迁移到收集杯中时,电压为65v。当比较三次独立运行中的每一次时,观察到电压分布是一致的,这指出来自于电源的电压反馈可用于监测装置内核酸分子的位置。
[0194]
具有基于光学的样品检测的etp
[0195]
在本实例中,使用带有有色染料的光学检测进行etp运行,以监测etp运行期间核
酸的位置。电泳迁移率低于核酸的染色染料可用于实现核酸位置的光学跟踪。例如,此类染料包括亮蓝fcf、靛蓝胭脂红、日落黄fcf、诱惑红、固绿fcf、专利蓝v和胭脂红。在本实例中,使用亮蓝染料作为光学标志物进行两次独立的etp运行以聚焦和收集核酸分子(参见etp运行1:图19a至图19b;和etp运行2:图19c至图19d)。
[0196]
图19a呈现etp运行期间etp装置的图像,其中亮蓝染料在核酸分子的聚焦和收集期间用作光学标志物,并且其中sybr-金色染料进一步用于监测核酸分子的位置。蓝色染料的电泳迁移率低于核酸,并且诸如蓝色染料在包含核酸的聚焦区之后迁移。污染物显示为棕色的聚焦区(参见图19a)。除了图19a的摄影图像之外,在etp运行期间拍摄了基于荧光的图像(参见图19b)。图19b的基于荧光的图像证明聚焦区的带比亮蓝色染料迁移得更快,该带包含用sybr-金色标记的dna。
[0197]
图19c呈现etp运行期间etp装置的图像,其中亮蓝在核酸分子的聚焦和收集期间用作光学标志物。包含cfdna的血浆样品用于图19c和图19d的etp运行。一旦染料带到达收集井,就停止etp运行。在聚焦和收集cfdna之后,使用agilent tapestation系统对聚焦和收集的cfdna样品进行分析(参见图19d)。电泳图(参见图19d)在179bp处显示一个峰,代表在etp运行期间聚焦和收集的需要的cfdna分子,从而证明亮蓝染料用于监测核酸位置的效用。
[0198]
带有基于热的样品检测的etp
[0199]
在本实例中,进行etp运行,其中在dna梯状条带的聚焦和收集的过程中使用热成像。针对本实例的热成像,使用基于红外的热成像相机(seek thermal shotpro)。此外,使用荧光成像。在20min、40min、42min和44min的四个依次时间点处拍摄热图像和荧光图像。(参见图20a至图20b)。此外,在etp运行期间测量来自电源的电压反馈。
[0200]
图20a呈现etp运行期间在四个时间点拍摄的热图像:20min、40min、42min和44min。观察到装置中心的温度在40到44min之间增加了17℃(从38℃到55℃),在此期间,显示为图20b中的绿色荧光环的dna梯状条带移动到中央收集杯中。
[0201]
图20c呈现在本实例的etp运行期间随时间推移电压和温度变化。观察到随时间推移电压变化的趋势与随时间推移温度变化的趋势相似。因此,来自电源的电压反馈为监测装置内dna梯状条带分子的位置提供了额外的工具。
[0202]
实例1:通过etp分离/纯化无细胞核酸
[0203]
使用加速电泳装置和实验设置(参见图21-23)进行etp以实施包含无细胞dna的无细胞核酸的分离(纯化)。该装置具有圆形架构和圆形电极(参见图21和23)。
[0204]
在设置和进行etp以分离/纯化cfdna之前,制备了etp缓冲液、etp装置的琼脂糖凝胶、缩短的透析单元和一个或多个经蛋白酶k消化的血浆样品。制备了包含hcl-组氨酸ph 6.25的前导电解质(le)缓冲液,并制备了包含taps-tris ph 8.30的尾随电解质(te)缓冲液。与etp装置一起使用的琼脂糖凝胶是通过在锥形瓶中将适合所希望的琼脂糖百分比凝胶的一定量的琼脂糖与le缓冲液混合来制备的。
[0205]
经蛋白酶k消化的血浆是通过下述制备的:首先在室温下解冻血浆样品,然后混合样品,取出所希望的体积并分配到无核酸酶管中。接下来,加入蛋白酶k,将溶液充分混合,然后在37-70℃孵育,具体取决于样品。
[0206]
cfdna的基于etp的分离/纯化一般按下述进行。etp系统是通过下述制备的:首先
使用特氟龙棒(参见图21)或一对镊子将移动中心活塞(参见图21)移动到较低的位置。用le缓冲液(25ml le+1.25μl sybr金(如果用于dna带的可视化))经由etp平台的角落开口填充中心电极通道,并且在中心开口完全填充时停止填充。透析单元通过o形环固定在中心开口中(参见图21)。然后用le缓冲液(和sybr金溶液,如果希望的话)填充透析单元。将如上所述制备的琼脂糖凝胶小心地从模具转移到etp装置并固定。然后将圆形覆盖物置于凝胶上。
[0207]
制备样品混合物,一般包含15ml te缓冲液+1μl sybr金(如果用于dna带的可视化)+50bp dna阶梯(如果用作标记物)+pk预处理的血浆样品,并用移液器移入凝胶和etp装置的圆形电极之间的间隙内。最后,将第二个盖子放在装置的顶部。
[0208]
然后通过将etp装置插入电源来准备电源。电源设置在1到8w之间的恒定功率(取决于所用的血浆样品量),并且etp实施大约1-2小时。通过打开电源,etp将一种或多种靶分析物聚焦到一个或多个聚焦区(一个或多个etp带)内。
[0209]
在一些情况下,如下监测和收集样品。如果在etp运行中包含sybr金,则使用蓝色光源和适当的滤光器来监测dna聚焦区(etp带)的移动。一旦在透析单元中收集到dna,就关闭电源。如果希望选择dna/分析物的大小,则仅收集一个或多个目标dna聚焦区(一个或多个etp带),如下文进一步所述。一旦关闭电源,就将le缓冲液从etp装置的角落开口去除,然后从装置中去除te缓冲液和凝胶。接下来,收集包含在透析单元中的样品。然后将移动中心活塞移动到上部位置。在一些情况下,收集的dna溶液随后通过使用kapa纯珠的混合物进行清洗,并在30-50μl的tris.hcl溶液中洗脱。
[0210]
在一些情况下,通过使用高灵敏度dsdna qubit定量测定试剂盒,使用qubit荧光计(invitrogen,carlsbad,ca,usa)对收集的cfdna进行分析。样品中靶分子的浓度由仅在与dna结合时发射的荧光染料报告。在一些情况下,通过使用芯片cge-lif仪器agilent2100生物分析仪(agilent,santa clara,ca,united states)对收集的cfdna进行分析。该分析使用高灵敏度dna试剂盒(agilent,united states)提供了收集的样品中dna片段的大小信息。
[0211]
实例2:基于etp的cfdna分离/纯化
[0212]
在本实例中,cfdna通过基于etp的分离/纯化进行分离/纯化,如实例1中一般描述的,具有以下修改。将dna阶梯添加到血浆样品中,并使用sybr金来可视化dna区域。样品包含1ml血浆,其包含cfdna和200ng dna阶梯。
[0213]
现在参考图23,对基于etp的从1ml血浆样品中分离/纯化dna的过程拍摄延时照片,该过程分离/纯化了cfdna和dna阶梯。sybr金用于dna区的可视化(参见图23)。
[0214]
实例3:基于etp的cfdna分离/纯化
[0215]
在本实例中,如实例1中一般描述的并做以下修改,通过基于etp的分离/纯化从1ml血浆样品中分离并收集cfdna。没有使用sybr金。在cfdna的基于etp的纯化和随后的收集之后,执行单个基于kapa纯珠的清理步骤(1x spri珠)或两个基于kapa纯珠的清理步骤(2x spri珠)。还通过使用avenio试剂盒的旋转柱方法从血浆样品(1ml)中分离/纯化cfdna,然后进行单个基于kapa纯珠的清理步骤;并使用“una方法”,该方法包括使用两次基于微珠的清理(即两个净化步骤,每个清理步骤使用相同类型的微珠)去除基因组dna污染,然后进行使用avenio试剂盒的旋转柱方法。在使用上述方法分离/纯化和清理cfdna之后,使用基于qubit的分析测量cfdna的浓度,并以ng为单位记录cfdna的浓度。
[0216]
现在参考图24,结果证明了通过使用基于etp的分离和收集来提取cfdna,包括一个或两个珠清理步骤。与本实例中使用的其他方法相比,通过基于etp的分离和收集来分离和收集cfdna所产生的cfdna量约为2.5倍。值得注意的是,与包括两个基于珠的清理步骤的基于etp的cfdna分离和收集相比,执行cfdna的基于etp的分离和收集然后进行一个基于珠的清理步骤包含更高的量的cfdna。
[0217]
实例4:基于etp的cfdna分离/纯化
[0218]
在本实例中,如实例1中一般描述的并做以下修改,通过基于etp的分离/纯化从1ml血浆中分离/纯化包含cfdna和dna阶梯的dna。向1ml血浆中加入60ng dna阶梯。在分离/纯化和随后收集cfdna和dna阶梯之后,使用如实例1中一般描述的生物分析仪运行对分离/纯化并收集的dna样品进行基于大小的分析。
[0219]
现在参考图25,结果表明在分离/纯化并收集的样品中存在cfdna,如通过荧光信号和不对应于dna阶梯的带所证明的,因为cfdna表现为长度为约150至约200bp的带(参见图25)。
[0220]
实例5:基于etp的cfdna分离/纯化
[0221]
在本实例中,如实例1中一般描述的并做以下修改,通过基于etp的分离/纯化从1ml血浆样品中分离/纯化cfdna。在本实例中,没有使用sybr金或dna阶梯。在分离/纯化和随后收集cfdna之后,使用如实例1中一般描述的生物分析仪运行对分离/纯化并收集的dna样品进行基于大小的分析。
[0222]
现在参考图26,结果表明在分离/纯化并收集的样品中存在cfdna,如通过荧光信号和长度为约150至约200bp的带所证明的(参见图26)。值得注意的是,25bp和10,300bp的标记物被用作标准。
[0223]
实例6:基于etp的cfdna分离/纯化
[0224]
在本实例中,如实例1中一般描述的并做以下修改,通过基于etp的分离/纯化从1ml血浆样品中分离/纯化cfdna。在本实例中,通过改变缓冲液浓度、凝胶百分比和etp运行的停止时间,从1ml血浆样品中分离/纯化并随后收集cfdna,从而分离/纯化出各种不同大小范围的dna并随后收集,这允许增强从片段化的基因组dna中分离/纯化cfdna。
[0225]
现在参考图27,呈现了使用不同的缓冲液浓度、凝胶百分比和停止时间进行的基于etp的分离/纯化和后续收集的结果。etp运行结果的基于电泳的分析表明,通过基于etp的分离/纯化和随后的收集实现了各种dna大小截断值(参见图27)。
[0226]
实例7:循环肿瘤dna的基于etp的分离/纯化
[0227]
在本实例中,如实例1中一般描述的并做以下修改,通过基于etp的分离/纯化从1ml血浆样品中分离/纯化并随后收集循环肿瘤dna。除了基于etp的分离/纯化之外,使用avenio试剂盒的基于旋转柱的方法也用于在单独的测定中从4ml血浆样品中分离ctdna。此外,在ctdna的基于etp的分离/纯化和随后的收集之后,进行了基于kapa纯珠的清理步骤。此外,对分离/纯化并随后收集的ctdna进行了基于qubit的分析,如实例1中一般所述。
[0228]
现在参考图28,呈现了ctdna从0.5ml血浆中的基于etp的分离/纯化和随后收集的结果。值得注意的是,基于离心柱的方法的结果是从4ml样品反算到0.5ml。对每个样品取五次读数。呈现于图29中的结果表明,通过基于etp的方法分离/纯化并随后收集的ctdna的产量超过了基于离心柱的方法的产量。通过基于etp的方法得到的ctdna产量平均为约5.7ng,
最高产量为6.8ng,范围为约5.1ng至约6.8ng。
[0229]
使用etp上位标记物的基于etp的分离/纯化
[0230]
在本实例中,生成了在基于etp的分离/纯化期间使用的etp上位标记物。
[0231]
一种用于产生在etp期间使用的标记的上位标记物的方法是在一个限制性位点消化质粒,然后,随后使用适当的引物产生所希望大小的扩增子,例如1003bp扩增子,以产生大小为1003bp的扩增子。任选地,扩增子可以被荧光标记。
[0232]
替代性地,如下所述产生标记的上位标记物。使用三种不同的限制酶在三个不同的限制性位点切割载体以产生744bp、875bp和1067bp的片段。消化后,清除消化产物,随后分别荧光地标记三种载体。清理后,使用安捷伦生物分析仪分析etp上位标记物(见图29),证实产生了具有744bp、875bp和1067bp三个碎片的上位标记物。
[0233]
这种etp上位标记物可以在基于etp的方法实施期间使用并与基于etp的装置一起使用,以指示可以停止收集靶分析物(例如dna)的截止点。例如,荧光标记的或以其他方式可检测地标记的etp上位标记物可以产生为大小大于在基于etp的方法实施期间待收集的靶分析物。通过在整个etp运行过程中监控标记物,使用者或自动化机器能够在标记物落入收集管之前停止运行,从而允许捕获小于标记物的靶分析物,同时由于较大的污染分析物定位在上位标记物后面而将其留在管外。此外,etp上位标记物本身不会被收集并因此可以大量使用并与各种可检测标记一起使用,因为它不会干扰下游检测。特别地,etp上位标记物可用于cfdna分离/纯化方法,因为它有助于排除基因组dna。例如,在某些情况下,etp上位标记物可以是大约1000bp。
[0234]
从尿液中对靶分析物基于etp的分离
[0235]
在本实例中,基于etp的分离和/或纯化用于从尿液样品中分离/纯化一种或多种靶分析物。
[0236]
尿液样品一般包含各种不同的靶分析物,诸如例如核酸、cfna、生物标志物、蛋白质和/或细胞外小泡。基于etp的分离和/或纯化可以用于使用如下的一次或多次etp运行来分离和/或纯化这些靶分析物中的任何一种或多种。本发明提供任何体积(一般体积为1ml至约50ml)的尿液样品,该尿液样品包含一种或多种靶分析物。通过使用基于离心的方法(包括使用超离心过滤器)对尿液样品进行浓缩和缓冲液更换。作为缓冲液更换和浓缩程序的结果,完成一种或多种靶分析物(诸如cfna、蛋白质和/或细胞外小泡、例如尿外泌体)的初始富集,并且完成尿液样品的脱盐。
[0237]
在一些情况下,在基于离心的浓缩和缓冲液更换之前,可以进行过滤步骤(例如真空过滤步骤),以去除不需要的材料,诸如例如不需要的细胞和/或不需要的细胞碎片。此类过滤步骤可以通过使用基于离心的过滤和/或基于真空的过滤来完成,该过滤使用选择的过滤器尺寸来去除不需要的材料,诸如0.22um过滤膜来去除所述不需要的材料(包括尿液中的固体碎片)。过滤器可以具有0.10μm至0.20μm、0.20μm至0.25μm、0.25μm至0.35μm、0.35μm至0.45μm、0.45μm至0.50μm、0.50μm至1μm、1μm至10μm、10μm至25μm、25μm至30μm、30μm至45μm、45μm至55μm或大于55μm的尺寸。
[0238]
在任选的过滤步骤之后,进行基于离心的浓缩和缓冲液更换。样品通过诸如通过使用具有3k至10k截留分子量(mwco)的超离心过滤器离心来进行浓缩。浓缩后,将期望的缓冲液(诸如洗涤缓冲液)添加到浓缩的样品中,混合(如果添加的缓冲液与离心
前的缓冲液不同,有时称为“缓冲液更换”),然后进行进一步离心。洗涤和/或缓冲液更换的这个步骤可以根据需要重复多次进行。
[0239]
离心可能是针对截留分子量为1000至2000、2000至3000、3000至4000、4000至5000、5000至6000、6000至7000、7000至8000、8000至9000、9000至10000、10000至15000或15000至20000的过滤器。在一些实施例中,低于mwco的材料可以用于etp装置中。在其他实施例中,可以使用高于mwco的材料。离心机可以以3
×
g至100
×
g、100
×
g至200
×
g、200
×
g至500
×
g、500
×
g至1000
×
g、1000
×
g至3600
×
g、3600
×
g至5000
×
g或超过5000
×
g的力运行。离心的旋转半径可以是50mm至100mm、100mm至200mm、200mm至300mm、300mm至400mm、400mm至500mm或超过500mm。每分钟转数(rpm)可以是200到1000、1000到5000、5000到10000、10000到15000、15000到20000、20000到25000或超过20000。离心机可以旋转1min至5min、5min至10min、10min至15min、15min至20min、20min至25min、25min至30min、30min至60min、或大于60min。
[0240]
在一些情况下,如果需要,可以通过基于透析的方法完成缓冲液更换,然后可以通过如上所述的基于离心的方法浓缩这种缓冲液更换的样品。
[0241]
在一些情况下,在样品浓缩和缓冲液更换之后,样品用于基于etp的分离/纯化一种或多种生物标志物,诸如一种或多种核酸和/或一种或多种蛋白质。此类核酸的基于etp的分离/纯化可以通过本实例中描述的基于etp的分离/纯化程序进行,包括讨论从血浆样品中分离/纯化无细胞核酸的实例。
[0242]
在一些情况下,在样品浓缩和缓冲液更换之后,在将样品引入etp装置之前,可以进行裂解和/或蛋白质消化步骤。此类步骤可以至少部分地基于靶核酸和/或待收集的期望的靶核酸的来源来实现。在尿液中发现的核酸来源包括,例如从尿道脱落的上皮细胞、自由循环的cfdna和外泌体。
[0243]
如果期望总核酸回收,其中所有核酸无论其来源如何,都将被分离/纯化,则可以使用合适的试剂进行裂解步骤和/或蛋白质消化步骤。例如,蛋白酶k可以用于影响蛋白质消化。此外,此类裂解和蛋白质消化步骤可以允许在基于etp的分离/纯化之前从例如细胞、外泌体和组蛋白(在cfdna的情况下)释放所有核酸。
[0244]
如果期望不包括源自从尿道脱落的上皮细胞的核酸的核酸回收,则进行离心步骤以在裂解和/或蛋白质消化步骤之前实施这些上皮细胞的去除。离心后,收集上清液,同时丢弃推测含有上皮细胞的沉淀。随后可以通过etp分离/纯化的靶核酸包括cfdna以及封装在外泌体中的核酸。
[0245]
如果期望以cfdna为目标的核酸回收,则在将样品引入etp装置之前,诸如使用蛋白酶k执行蛋白质消化步骤。不进行裂解步骤,此外避免任何无意裂解的来源,以防止核酸从可能存在于尿液样品中的细胞中释放。
[0246]
在上面讨论的任何裂解和/或蛋白质降解步骤之后,可以将样品加载到etp装置上并进行基于etp的分离/纯化以通过etp-分离/纯化一种或多种靶分析物,例如核酸。本实例诸如实例8中描述的分离/纯化程序的分离/纯化程序,其讨论了从血浆样品中分离/纯化无细胞核酸。如整个本公开所讨论的,可以优化进行etp的任何一种或多种条件,诸如例如缓冲液条件、琼脂糖凝胶百分比等,以允许从分析物的混合物中分离/纯化靶分析物,诸如从核酸的混合物中分离/纯化靶核酸。
[0247]
用于etp的尿液预处理
[0248]
可以获得尿液样品。尿液样品可以是排尿的尿液。细菌和任何固体碎片可以使用0.25μm至45μm的过滤器通过过滤灭菌来去除。尿液样品可以使用具有3k至10k截留分子量的超离心过滤器以3000
×
g的力在离心机中旋转20分钟。可以使用10mm ph 8的tris hcl或10mm终止电解质缓冲液进行缓冲液更换。可以将10ml体积的缓冲液加入到试管中,然后再旋转试管20min或直到浓缩液体积为1ml。
[0249]
图30是与用于尿液样品分析的装置和方法相关联的实例过程3000的流程图。在一些实施方式中,图30的一个或多个过程框可以由系统(例如,系统3100)来进行。在一些实施方式中,图30的一个或多个过程框可以由与系统分离或包括系统的另一设备或一组设备来进行。附加地或替代性地,图30的一个或多个过程框可以由图31的系统3100的一个或多个部件,诸如etp装置3110、样品浓缩装置3120、机器人处理机3130和/或处理器3140进行。
[0250]
在框3010处,过程3000可以包括浓缩尿液样品以形成浓缩的尿液样品。浓缩的尿液样品可以具有的一种或多种靶分析物的浓度是尿液样品中一种或多种靶分析物的初始浓度的至少10倍。在一些实施例中,浓缩的尿液样品中的浓度可以是初始浓度的20倍至30倍、30倍至40倍、40倍至50倍、或50倍或更多。一种或多种靶分析物包括dna、rna或其组合。附加地或替代性地,一种或多种靶分析物可以包括无细胞核酸、循环肿瘤核酸、生物标志物、蛋白质、细胞外小泡或其组合。一种或多种靶分析物可以包括本文所述的任何分析物。
[0251]
浓缩的尿液样品可以包括真空过滤、脱盐、缓冲液更换、细胞外小泡富集、外泌体富集、细胞裂解、蛋白质降解或基于离心的细胞去除中的一者或多者。浓缩尿液样品可以包括缓冲液更换,并且浓缩的尿液样品的ph在6.0至8.5的范围内,包括约8.0。缓冲液可以是tris hcl或可以是本文所述的任何终止电解质缓冲液。该缓冲液是与etp兼容的缓冲液。
[0252]
浓缩尿液样品可以包括离心尿液样品。离心尿液样品包括以在1000
×
g至3600
×
g范围内的力或以本文所述的任何力离心。
[0253]
浓缩尿液样品可以包括按分子量过滤尿液样品。按分子量过滤尿液样品可以包括除去尿液样品中具有分子量高于或低于3000至10000范围内的截止值或本文所述的任何截止值的组分。
[0254]
在框3020处,过程3000可以包括将浓缩的尿液样品添加到第一电解质中以形成第一混合物。第一电解质可以是终止电解质。
[0255]
在框3030处,过程3000可以包括在第一电极和第二电极之间施加电压差。第一电极可以设置在第一混合物中。第二电极可以设置在第二电解质中。第二电解质可以是前导电解质。第一电解质可以与第二电解质不同。第二电解质可以包括在凝胶中。第二电解质可以与第一电解质以流体动力学方式分离。第一电解质和第二电解质可以由膜隔开。第一电极和第二电极可以是具有本文所述的etp装置的任何电极。
[0256]
在框3040处,过程3000可以包括利用电压差将第二电解质内一个或多个聚焦区中的一种或多种靶分析物流到第二电极。聚焦区可以是在第一电解质或第二电解质内的靶分析物集中的部分。特定聚焦区中的靶分析物可以包括在外加电场中具有相同或相似迁移率的离子。一个或多个聚焦区可以是本文所述的任何此类聚焦区或etp带。每个聚焦区可以包括单独的靶分析物。过程3000还可以包括在将第二电解质内一个或多个聚焦区中的一种或多种靶分析物流动之前,将第一混合物(或第一电解质)中一个或多个聚焦区中的一种或多
种靶分析物流动。该区域可以离开具有第一电解质的区域并进入具有第二电解质的区域。聚焦区可以编号1、2、3、4、5或超过5。
[0257]
在框3050处,过程3000可以包括通过收集包含一个或多个聚焦区的第二混合物来收集一种或多种靶分析物。第二混合物中一种或多种靶分析物中的任何一种的浓度高于浓缩的尿液样品中相应靶分析物的浓度。第二混合物中一种或多种靶分析物中的任何一种的浓度是浓缩的尿液样品中相应靶分析物浓度的2至5倍、5至10倍、10至50倍或超过50倍。例如,初始尿液样品可以是10ml至50ml,包括10ml至20ml、20ml至30ml、30ml至40ml或40ml至50ml。例如,浓缩的尿液样品的体积可以是0.5ml至1.0ml、1.0ml至1.5ml、1.5ml至2.0ml或2.0ml至2.5ml。过程3000可使从未浓缩的尿液样品中获得分析物的吞吐率比常规技术(例如柱)提高到至少50%或至少提高到2、3、4、5、6、7、8、9或10倍。
[0258]
过程300可以包括对第二混合物中的一种或多种靶分析物中的任何一种或全部进行本文所述的任何体外诊断测定或方法。
[0259]
过程3000可以包括附加的实现,诸如所描述的和/或结合本文别处描述的一个或多个其他过程的任何单个实现或实现的任意组合。
[0260]
图31示出用于从尿液样品中分离和/或纯化一种或多种靶分析物的系统3100。该系统可以包括加速电泳(etp)装置3110。etp装置可以包括圆形第一电极,其设置在圆形通道的外边缘处。该圆形通道可以是本文所述的任何圆形通道。etp装置还可以包括样品收集池,其位于圆形通道中心。该样品收集池可以是本文所述的任何样品收集池或电极池。该样品收集池可以是圆形通道中心内的空腔。该样品收集池可以具有通向圆形通道的圆形开口。一个或多个聚焦区中的一种或多种靶分析物可以流入样品收集池。etp装置可以进一步包括第二电极。相比于圆形第一电极与样品收集池电连通,第二电极可以被配置成与样品收集池更紧密地电连通。更紧密地电连通可以指在施加相同电压的情况下电阻更低或电流更高。此外,etp装置可以包括电源,其被配置成在圆形第一电极和第二电极之间提供电压差。
[0261]
系统3100可以包括样品浓缩装置3120,该装置被配置成将样品中一种或多种靶分析物的浓度提高到至少10倍。在一些方面,样品浓缩装置可以包括离心机。在一些实施例中,离心机可以用于细胞外小泡富集。在一些方面,样品浓缩装置包括真空过滤器。样品浓缩装置可以包括透析管,其可以被配置成进行脱盐和/或缓冲液更换。样品浓缩装置还可以包括加热块,其可以被配置成达到用于细胞裂解和/或蛋白质降解的温度。样品浓缩装置可以是本文所述的用于浓缩尿液样品的任何装置。
[0262]
系统3100可以包括机器人处理机3130。例如,机器人处理机3130可以是自动化机器人处理装置,其被配置成将来自样品浓缩装置3120的输出传送到etp装置3110。此外,机器人处理机3130可以被配置成将来自etp装置3110的输出传送到进一步的分析装置,其可以是本文所述的任何此类装置。
[0263]
系统3100可以包括处理器3140。处理器3140可以控制etp装置3110、样品浓缩装置3120和/或机器人处理机3130以执行过程3000中的任何步骤。处理器3140可以是计算机系统的一部分。
[0264]
本文提到的任何计算机系统都可以利用任何合适数量的子系统。此类子系统的实例在图32的计算机系统1200中示出。在一些实施方案中,计算机系统包括单个计算机设备,
其中子系统可以是计算机设备的组件。在其他实施方案中,计算机系统可以包括多个计算机设备,每个计算机设备是具有内部组件的子系统。计算机系统可以包括台式计算机和膝上型计算机、平板电脑、移动电话和其他移动装置。
[0265]
图32所示的子系统经由系统总线75互连。示出附加的子系统,诸如打印机74、键盘78、存储装置79、监视器76(例如显示屏,诸如led,其耦接到显示适配器82)等。耦接到i/o控制器71的外围装置和输入/输出(i/o)装置可以通过本领域已知的任何数量的装置,诸如输入/输出(i/o)端口77(例如,usb)连接至计算机系统。例如,i/o端口77或外部接口81(例如,以太网,wi-fi等)可用于将计算机系统1200连接至广域网诸如因特网、鼠标输入装置或扫描仪。经由系统总线75的互连允许中央处理器73与每个子系统通信并控制对来自系统存储器72或存储装置79(例如,固定磁盘,诸如硬盘驱动器,或光盘)的多个指令的执行,以及子系统之间的信息交换。系统存储器72和/或存储装置79可以具体表现为计算机可读介质。另一个子系统是数据收集装置85,诸如照相机、麦克风、加速度计等。本文提到的任何数据都可以从一个组件输出到另一组件,并可以输出给用户。
[0266]
计算机系统可以包括多个相同的部件或子系统,例如,通过外部接口81、通过内部接口或通过可以移动存储装置连接在一起,该可以移动存储装置可以从一个部件连接或移动至另一个部件。在一些实施方案中,计算机系统、子系统或装置可以在网络上通信。在这种情况下,一台计算机可视为客户端,另一台计算机可视为服务器,其中每台计算机可视为同一计算机系统的一部分。客户端和服务器可以各自包含多个系统、子系统或组件。
[0267]
实施例的各方面可以使用硬件电路(例如,专用集成电路或现场可以编程门阵列)和/或使用具有一般可以编程处理器的计算机软件,以控制逻辑的形式,以模块化或集成方式来实施。如本文所用,处理器可包括单核处理器、在同一集成芯片上的多核处理器、或在单电路板上或联网的多个处理单元,以及专用硬件。基于本文提供的公开内容和教导,本领域普通技术人员将知道并理解使用硬件以及硬件和软件的组合来实现本公开的实施例的其他方式和/或方法。
[0268]
可以使用任何合适的计算机语言诸如java、c、c++、c#、objective-c、swift或脚本语言诸如perl或python,使用例如常规技术或面向对象技术,将本技术中描述的任何软件组件或功能实现为由处理器执行的软件代码。可以将软件代码作为一系列指令或命令存储在计算机可读介质上,以进行存储和/或传输。合适的非暂时性计算机可以读介质可以包括随机存取存储器(ram)、只读存储器(rom)、磁性介质诸如硬盘驱动器或软盘、或者光学介质诸如光盘(cd)或dvd(数字通用光盘)或蓝光光盘、闪存等。计算机可读介质可以是此类存储装置或传输装置的任意组合。
[0269]
也可以使用载波信号对此类程序进行编码和传输,该载波信号调节为适于经由符合包括互联网在内的各种协议的有线网络、光学网络和/或无线网络进行传输。如此,计算机可读介质可以使用经这种程序编码的数据信号来创建。可以将以程序代码编码的计算机可读介质与兼容装置打包在一起,或者与其他装置分开提供(例如,经由互联网下载)。任何此类计算机可读介质可以驻留在单个计算机产品(例如,硬盘驱动器、cd或整个计算机系统)上或内部,并且可以存在于系统或网络内的不同计算机产品上或内部。计算机系统可以包括监视器、打印机或其他合适的显示器,用于向用户提供本文提到的任何结果。
[0270]
本文描述的任何方法可以由包括一个或更多个处理器的计算机系统完全或部分
地执行,该计算机系统可以被配置成执行步骤。因此,实施方案可以针对被配置成执行本文描述的任何方法的步骤的计算机系统,可能具有执行相应步骤或相应步骤组的不同组件。尽管以编号的步骤呈现,但是可以同时或在不同时间或以逻辑上可行的不同顺序执行本文所述方法的步骤。另外,这些步骤的部分可以与其他方法的其他步骤的部分一起使用。而且,步骤的全部或部分可以是可选的。另外,任何方法的任何步骤都可以用模块、单元、电路或用于执行这些步骤的系统的其他装置来执行。
[0271]
在前面的程序中,已经描述了各种步骤。然而,显而易见的是,可以对其进行各种修改和改变,并且可以实施额外的程序,而不脱离以下权利要求中提出的更广泛的程序范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1