细菌宿主菌株的制作方法
a.e.2005《生物工艺国际杂志(bioprocess intl)》3:36-44中描述了用于质粒生产的其他发酵过程,该文献通过引用以其整体并入本文。
11.wo2014/035457还公开了用于在hypergro发酵过程中产生r6k起点载体的宿主菌株。
12.schnodt等人(2016)《分子疗法-核酸(mol ther-nucleic acids)》5e355以及chadeuf等人(2005)《分子疗法(molecular therapy)》12:744-53和gray,2017.wo2017/066579教导了将aav辅助质粒抗生素抗性标记包装到病毒颗粒中,表明需要从aav辅助质粒以及aav载体中去除抗生素标记。wo2014/035457中公开的无抗生素nanoplasmid
tm
载体不存在抗生素标记转移。
13.病毒载体如aav在其末端含有回文反向末端重复(itr)dna序列。
14.回文和反向重复序列在高产量大肠杆菌生产宿主如dh1、dh5α、jm107、jm108、jm109、xl1blue等中固有地不稳定。
15.建议在多重突变sbcc敲除细胞系sure(srb的recb衍生物)或sure2中进行含有aav itr的载体的生长。
16.sure细胞系具有以下基因型:f'[proab
+
laci
q laczδm15 tn10(tetr]enda1glnv44 thi-1gyra96 rela1 lac recb recj sbcc umuc::tn5 kan
r uvrc e14-(mcra-)δ(mcrcb-hsdsmr-mrr)171,其中sure稳定突变包括sbcc与recb recj umuc uvrc-(mcra-)mcrbc-hsd-mrr的组合。
[0017]
srb细胞系具有以下基因型:f'[proab
+
laci
q laczδm15 enda1 glnv44 thi-1gyra96 rela1 lac recj sbcc umuc::tn5(kan
r uvrc e14-(mcra-)δ(mcrcb-hsdsmr-mrr)171,其中srb稳定突变包括sbcc与recj umuc uvrc-(mcra-)mcrbc-hsd-mrr的组合。
[0018]
sure2细胞系具有以下基因型:enda1 glnv44 thi-1gyra96 rela1 lac recb recj sbcc umuc::tn5 kan
r uvrc e14-δ(mcrcb-hsdsmr-mrr)171f'[proab
+
laci
q laczδm15 tn10(tetr)amy cmr],其中sure2稳定突变包括sbcc与recb recj uvrc-(mcra-)mcrbc-hsd-mrr的组合。
[0019]
sbccd是切割回文dna序列并导致大肠杆菌中的回文不稳定性的核酸酶(chalker af,leach dr,lloyd rg.1988《基因(gene)》71:201-5)。回文如shrna或aav itr在sbcc敲除菌株如sure细胞中比dh5α更稳定,如gray sj,choi,vw,asokan,a,haberman ra,mccown tj,samulski rj(2011)《当前神经科学方案(curr protoc neurosci)》,第4章:第4.17单元如下所教导的:“aav itr在大肠杆菌中不稳定,并且失去itr的质粒在转化细胞中具有复制优势。由于这些原因,含有itr质粒的细菌的生长不应超过12-14小时,并且应评估任何回收质粒的itr保留情况
……
dh10b感受态细胞(或其他类似的高效菌株)可用于转化用于含itr的质粒克隆的连接反应。在筛选itr完整性的阳性克隆后,然后应将好的克隆转化到sure或sure2细胞(agilent technologies)中,以用于生产质粒和甘油原液。将sure细胞工程化以维持不规则的dna结构,但与dh10b相比,转化效率较低。”此外,2014-12-03上传的悉尼大学论文,siew sm,2014,重组aav介导的基因治疗方法治疗进行性家族性肝内胆汁淤积3型(recombinant aav-mediated gene therapy approaches to treat progressive familial intrahepatic cholestasis type 3)教导“sure2细胞是通常用于繁殖含有回文aav itr的质粒的sbcc突变菌株。”因此,一般认为sure或sure2 sbcc突变菌株优选用于繁
殖含有回文aav itr的质粒。
[0020]
然而,对sure或sure2细胞系存在限制。例如,sure和sure2是kanr,因此它们不能用于生产cgmp制造中通常使用的卡那霉素抗性质粒(而不是氨苄青霉素抗性质粒)。此外,本领域教导回文的sbcc敲除稳定另外需要其他基因如recb recj uvrc mcra或mcrbc-hsd-mrr的突变。doherty jp,lindeman r,trent rj,graham mw,woodcock dm.1993.《基因(gene)》124:29-35报道了并非所有回文都在sure(或相关的srb细胞系)中稳定。他们如下建议需要额外的突变(recc)来稳定回文“然而,虽然含有回文的噬菌体以合理的效率在sure(recb sbcc recj umuc uvrc)和srb(sbcc recj umuc uvrc)上铺板,但从这些菌株回收的大多数噬菌体不再需要sbcc宿主进行后续铺板。这两个菌株的滴度也较低,其来自人类prader-willi染色体区域噬菌体克隆的产量低。最佳噬菌体宿主似乎是mcra
△
(mcrbc-hsd-mrr)与sbcc和recbc或recd的突变的那些组合。”[0021]
与此一致,其他sbcc宿主菌株也含有额外的突变,例如:pmc103:mcraδ(mcrbc-hsdrms-mrr)102recd sbcc,其中pmc103稳定突变包括sbcc与recd(mcra-)mcrbc-hsd-mrr的组合;和pmc107:mcraδ(mcrbc-hsdrms-mrr)102recb21 recc22 recj154 sbcb15 sbcc201,其中pmc107稳定突变包括sbcc与recb recj sbcb(mcra-)mcrbc-hsd-mrr的组合。
[0022]
因此,本领域教导回文的sbcc敲除稳定另外需要sbcb、recb、recd和recj以及在一些情况下uvrc、mcra和/或mcrbc-hsd-mrr的突变。其没有教导应用sbcc敲除来改善标准大肠杆菌质粒生产菌株如不含这些额外突变的dh1、dh5α、jm107、jm108、jm109、xl1blue中的回文稳定性。
[0023]
例如,几种标准大肠杆菌质粒生产菌株的基因型是:
[0024]
dh1:f-λ-enda1 reca1 rela1 gyra96 thi-1glnv44 hsdr17(r
k-m
k-)
[0025]
dh5α:f-δ(laczya-argf)u169 reca1 enda1 hsdr17(r
k-,mk+)gal-phoa supe44λ-thi-1gyra96 rela1
[0026]
jm107:enda1 glnv44 thi-1rela1 gyra96δ(lac-proab)[f'trad36 proab
+
laci
q laczδm15]hsdr17(r
k-m
k+
)λ-[0027]
jm108:enda1 reca1 gyra96 thi-1rela1 glnv44δ(lac-proab)hsdr17(r
k-m
k+
)
[0028]
jm109:enda1 glnv44 thi-1rela1 gyra96 reca1 mcrb
+
δ(lac-proab)e14-[f'trad36 proab
+
laci
q laczδm15]hsdr17(r
k-m
k+
)
[0029]
mg1655 k-12f-λ-ilvg-rfb-50rph-1
[0030]
xl1blue:enda1 gyra96(nalr)thi-1reca1 rela1 lac glnv44 f'[::tn10 proab
+
laciqδ(lacz)m15]hsdr17(r
k-m
k+
)
[0031]
标准大肠杆菌质粒生产菌株是enda、reca。然而,标准生产菌株不含sbcb、recb recd和recj以及在一些情况下uvrc、mcra或mcrbc-hsd-mrr中的任何所需突变,因此预计在没有这些额外突变的情况下敲除sbcc不会有效地稳定回文或反向重复序列。
[0032]
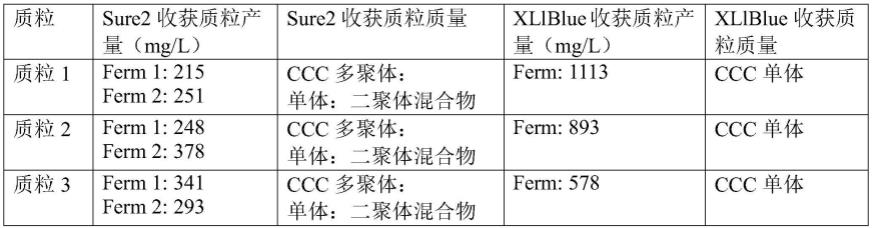
然而,在sure和sure2细胞系中存在多个突变会降低细胞系的活力及其在大肠杆菌发酵质粒生产过程中的生产力。例如,表1总结了sure2或xl1blue(高产量大肠杆菌生产宿主示例)中hypergro发酵质粒的产量和质量。所有三种质粒在sure2中均低产且易于多聚化,但在xllblue中产量高(2-4x)且质量高(低多聚化)。
[0033]
表1:使用ampr puc起点质粒的sure2与xl1blue中的hypergro发酵质粒产量
[0034][0035]
*培养方法除以下温度变化外与下述实例相同:sure2:30℃,在60od600时移至37℃,持续4小时,保持在25℃;xl1blue:30℃,在55od600时移至42℃,持续7小时,保持在25℃。
[0036]
降低的活力和生产力是多重突变“稳定宿主”的共同特征,诸如例如用于稳定含同向重复序列的载体如慢病毒载体但不含sbcc敲除的stbl2、stbl3和stbl4。stbl2、stbl3和stbl4的基因型如下所示。
[0037]
stbl2:f-enda1 glnv44 thi-1reca1 gyra96 rela1δ(lac-proab)mcraδ(mcrbc-hsdrms-mrr)λ-[0038]
stbl2稳定突变=mcraδ(mcrbc-hsdrms-mrr)(trinh,t.,jessee,j.,bloom,f.r.,和hirsch,v.(1994)《焦点(focus)》16,78.)
[0039]
stbl3:f-mcrb mrr hsds20(rb-,mb-)reca13 supe44 ara-14galk2 lacy1proa2 rpsl20(strr)xyl-5-leu mtl-1
[0040]
stbl3稳定突变=mcrbc-mrr
[0041]
stbl4:enda1 glnv44 thi-1reca1 gyra96 rela1δ(lac-proab)mcraδ(mcrbc-hsdrms-mrr)λ-gal f'[proab
+
laci
q laczδm15 tn10]
[0042]
stbl4稳定突变=mcra δ(mcrbc-hsdrms-mrr)
[0043]
因此,需要用于高产量制造无itr缺失或重排且未苦于低稳定性或低活力的含回文和反向重复序列的载体的高产量大肠杆菌生产菌株。
技术实现要素:
[0044]
本公开涉及宿主细菌菌株、制备此类宿主细菌菌株的方法和使用此类宿主细菌菌株来改善质粒生产的方法。
[0045]
在一些实施例中,提供了具有敲除sbcc、sbcd或两者但没有某些额外突变的工程化的大肠杆菌宿主细胞。
[0046]
在一些实施例中,提供了制备本公开的工程化的大肠杆菌宿主细胞的方法。
[0047]
在一些实施例中,提供了用于在本公开的工程化的大肠杆菌宿主细胞中复制载体的方法。
附图说明
[0048]
为了更完整地理解本发明及其优点,现结合附图参考以下描述。
[0049]
图1a描述了pkd4 sbccd靶向pcr片段。
[0050]
图1b描绘了sbccd基因座。
[0051]
图1c描绘了敲除sbccd的整合pkd4 pcr产物。
[0052]
图1d描绘了在frt介导的pkd4 kanr标记切除后的疤痕。
具体实施方式
[0053]
本公开提供了细菌宿主菌株,修饰细菌宿主菌株的方法,以及可以改善质粒产量和质量的制造方法。
[0054]
本公开的细菌宿主菌株和方法能够改善用于细胞疗法、基因疗法或基因替代应用的载体如非病毒转座子(转座酶载体、睡美人转座子载体、睡美人转座酶载体、piggybac转座子载体、piggybac转座酶载体、表达载体等)或非病毒基因编辑(例如同源定向修复(hdr)/crispr-cas9)载体,以及用于细胞疗法、基因疗法或基因替代应用的病毒载体(例如aav载体、aav rep cap载体、aav辅助载体、ad辅助载体、慢病毒载体、慢病毒包膜载体、慢病毒包装载体、逆转录病毒载体、逆转录病毒包膜载体、逆转录病毒包装载体等)的制造。
[0055]
与使用本领域已知的替代宿主菌株制造质粒相比,改善的质粒制造可以包括改善的质粒产量、改善的质粒稳定性(例如,减少的质粒缺失、倒位或其他重组产物)和/或改善的质粒质量(例如,减少的切口、线性或二聚化产物)和/或改善的质粒超螺旋(例如,减少的超螺旋拓扑异构体)。应当理解本文引用的所有参考通过引用以其整体并入。
[0056]
定义
[0057]
如本文所用,单数形式“一(a)”、“一个(an)”和“该(the)”包括复数指示物,除非上下文另有明确规定。
[0058]
权利要求和本公开中术语“或”用于意指“和/或”,除非明确指出仅指替代方案或替代方案是相互排斥的。
[0059]
术语“约”的使用在与数值一起使用时旨在包括+/-10%。例如但不限于,如果氨基酸的数量被确定为约200,这将包括180至220(加或减10%)。
[0060]
如本文所用,“aav载体”是指腺相关病毒载体或游离型病毒载体。例如但不限于,“aav载体”包括自互补腺相关病毒载体(scaav)和单链腺相关病毒载体(ssaav)。
[0061]
如本文所用,“amp”是指氨苄青霉素。
[0062]
如本文所用,“ampr”是指氨苄青霉素抗性基因。
[0063]
如本文所用,“细菌区域”是指在细菌宿主中繁殖和选择所需的载体区域,例如质粒。
[0064]
如本文所用,“cat
r”是指氯霉素抗性基因。
[0065]
除非在核苷酸或氨基酸序列的上下文中使用,否则如本文所用,“ccc”或“ccc”是指“共价闭合环状”。
[0066]
如本文所用,“ci”是指λ阻遏物。
[0067]
如本文所用,“cits857”指进一步掺入赋予温度敏感性的c至t(ala至thr)突变的λ阻遏物。cits857在28℃-30℃时是功能性阻遏物,但在37℃-42℃时大多是无活性的。也称为ci857或ci857ts。
[0068]
如本文所用,“cmv”或“cmv”是指巨细胞病毒。
[0069]
如本文所用,“copy cutter宿主菌株”是指r6k起点的生产菌株,其含有阿拉伯糖诱导型ci857ts基因的噬菌体附着位点染色体整合拷贝。向板或培养基中添加阿拉伯糖(例如至0.2%-0.4%终浓度)诱导para介导的ci857ts阻遏物表达,其通过ci857ts介导
的表达pl启动子的r6k rep蛋白的下调在30℃降低拷贝数[即,额外的ci857ts介导pl(ol1-g到t)启动子在30℃更有效的下调],温度转变到37℃-42℃后的拷贝数诱导不会受到损害,因为ci857ts阻遏物在这些升高的温度下失活。copy cutter宿主菌株通过减少30℃的拷贝数来增加r6k载体温度上移拷贝数诱导比。这有利于生产大的、有毒的或易于二聚化的r6k起点载体。
[0070]
如本文所用,“dcm甲基化”是指由大肠杆菌甲基转移酶进行的甲基化,该酶使在第二个胞嘧啶的c5位置处的序列cc(a/t)gg甲基化。
[0071]
如本文所用,“源自”是指细胞已经从特定细胞系遗传下来。例如,源自dh5α表示细胞由dh5α或dh5α的后代制成。因此,衍生细胞可以包括细胞系在培养时发生的多态性和其他变化。
[0072]
如本文所用,“egfp”是指增强的绿色荧光蛋白。
[0073]
如本文所用,“工程化大肠杆菌菌株”应理解为指本公开的大肠杆菌菌株,其具有人为干预产生的sbcc、sbcd或两者的基因敲除(或敲低)。
[0074]
如本文所用,“工程化突变”应理解为不是自然发生的突变,而是直接的人为干预的产物。
[0075]
如本文所用,“真核表达载体”是指使用rna聚合酶i、ii或iii启动子在靶真核生物体中表达mrna、蛋白质抗原、蛋白质治疗剂、shrna、rna或微小rna基因的载体。
[0076]
如本文所用,“真核区域”是指编码靶生物体中的真核序列和/或质粒功能所需的序列的质粒区域。这包括在靶生物体中表达一种或多种转基因所需的质粒载体区域,包括rna pol ii增强子、启动子、转基因和polya序列。这还包括使用rna pol i或rna pol iii启动子、rna pol i或rna pol iii表达转基因或rna在靶生物体中表达一种或多种转基因所需的质粒载体区域。真核区域可以任选地包括其他功能序列,例如真核转录终止子、超螺旋诱导的dna双链不稳定(sidd)结构、s/mar、边界元件等。在慢病毒或逆转录病毒载体中,真核区域含有侧翼同向重复序列ltr,在aav载体中,真核区域含有侧翼反向末端重复序列,而在转座子载体中,真核区域含有侧翼转座子反向末端重复序列或ir/dr末端(例如,睡美人)。在基因组整合载体中,真核区域可以编码同源臂以指导靶向整合。
[0077]
如本文所用,“表达载体”是指用于在靶生物体中表达mrna、蛋白质抗原、蛋白质治疗剂、shrna、rna或微小rna基因的载体。
[0078]
如本文所用,“目的基因”是指待在靶生物体中表达的基因。包括编码蛋白质或肽抗原、蛋白质或肽治疗剂的mrna基因,和编码rna治疗剂的mrna、shrna、rna或微小rna,以及编码rna疫苗的mrna、shrna、rna或微小rna等。
[0079]
如本文所用,“基因组”在涉及rep蛋白和启动子、包括rna-in调节的选择性标记的rna-in、抗生素抗性标记和λ阻遏物时是指掺入细菌宿主菌株中的核酸序列。
[0080]
如本文所用,“高产量质粒制造宿主”是指reca-、enda-细胞系,例如dh1、dh5α、jm107、jm108、jm109、mg1655和xl1blue,它们不含降低活力或产量的sbcb、recb、recd和recj以及任选的uvrc、mcra和/或mcrbc-hsd-mrr中的突变。
[0081]
如本文所用,“hypergro发酵过程”是指补料分批发酵,其中在部分补料分批阶段期间,使含质粒的大肠杆菌细胞在降低的温度下生长,在此期间限制生长速率,随后温度升高并在升高的温度下继续生长以积累质粒;限制生长速率下的温度变化改善了质粒产量和
纯度。。
[0082]
如本文所用,“反向重复序列”是指单链核苷酸序列,随后下游是其反向互补序列。初始序列和反向互补序列之间的核苷酸间插序列可以是任何长度,包括零。当插入长度为零时,复合序列是回文。应当理解反向重复序列可以出现在双链dna中并且其他反向重复序列可以出现在间插序列内。
[0083]
如本文所用,“ir/dr”是指直接重复两次的反向重复序列。例如,睡美人转座子ir/dr重复序列。
[0084]
如本文所用,“重复子”是指复制起始所需的复制起点中直接重复的dna序列。r6k起点重复子重复序列是22bp,例如wo 2019/183248的seq id no19-23(分别为aaacatgaga gcttagtacg tg、aaacatgaga gcttagtacg tt、agccatgaga gcttagtacg tt、agccatgagg gtttagttcg tt和aaacatgaga gcttagtacg ta)。
[0085]
如本文所用,“itr”是指反向末端重复序列。
[0086]
如本文所用,“kan”是指卡那霉素。
[0087]
如本文所用,“kanr”是指卡那霉素抗性基因。
[0088]
如本文所用,“敲低”是指导致基因产物表达降低和/或基因产物活性降低的基因破坏。
[0089]
如本文所用,“敲除”是指导致来自基因的基因表达清除和/或使表达的基因产物无功能的基因破坏。
[0090]
如本文所用,“kozak序列”是指紧靠atg起始密码子上游的确保有效翻译开始的优化共有dna序列gccrccatg(r=g或a)。紧靠atg起始密码子(gtcgacatg)上游的sali位点(gtcgac)是有效的kozak序列。
[0091]
如本文所用,“慢病毒载体”是指可以感染分裂细胞和非分裂细胞的整合病毒载体。也称为慢病毒转移质粒。质粒编码慢病毒ltr侧翼表达单位。转移质粒与慢病毒包膜和制造病毒颗粒所需的包装质粒一起转染到生产细胞中。
[0092]
如本文所用,“慢病毒包膜载体”是指编码包膜糖蛋白的质粒。
[0093]
如本文所用,“慢病毒包装载体”是指一种或两种表达包装慢病毒转移载体所需的gag、pol和rev基因功能的质粒。
[0094]
如本文所用,“小环”是指共价闭合的环状质粒衍生物,其中细菌区域已通过体内或体外位点特异性重组或体外限制性消化/连接从亲本质粒中去除。小环载体在细菌细胞中不能复制。
[0095]
如本文所用,“mseap”是指鼠分泌的碱性磷酸酶。
[0096]
如本文所用,“nanoplasmid
tm
载体”是指将rna选择性标记与r6k、cole2或cole2相关复制起点组合的载体。例如,在wo 2014/035457中描述的ntc9385c、ntc9685c、ntc9385r、ntc9685r载体和修饰。
[0097]
如本文所用,“突变”可以指任何类型的突变,例如取代、添加、缺失。
[0098]
如本文所用,关于sbccd复合物的“非功能性”是指不能切割回文序列的sbccd复合物。
[0099]
如本文所用,“ntc8系列”是指载体如ntc8385、ntc8485和ntc8685质粒是不含抗生素的puc起点载体,其含有短rna(rna-out)选择性标记而不是抗生素抗性标记如kanr。这些
基于rna-out的无抗生素载体的创建和应用描述于wo2008/153733中。
[0100]
如本文所用,“ntc9385r”是指在wo 2014/035457中描述的ntc9385r nanoplasmid
tm
载体,并且具有通过侧翼nhel和kpnl位点连接到真核区域的间隔区编码的nhel-trpa终止子-r6k起点rna-out-kpnl细菌区域。
[0101]
如本文所用,“od
600”是指600nm处的光密度。
[0102]
如本文所用,pcr是指“聚合酶链式反应”。
[0103]
如本文所用,“pdna”是指质粒dna。
[0104]
如本文所用,“piggyback转座子”是指通过由pb转座酶介导的简单剪切和粘贴机制将itr侧翼的pb转座子整合到基因组中的转座子体系。转座子载体通常含有在pb itr之间的被切除并整合到基因组中的启动子-转基因-polya表达盒。
[0105]
如本文所用,“pintpr pl载体”是指pint pr pl att
hk022
整合表达载体,其描述于luke等人,2011《分子生物技术(mol biotechnol)》47:43并通过引用包括在本文中。待表达的靶基因克隆到pl启动子的下游。该载体编码温度诱导型ci857阻遏物,允许热诱导型靶基因表达。
[0106]
如本文所用,“p
l
启动子”是指剩余的λ启动子。p
l
是被与ol1、ol2和ol3阻遏物结合位点结合的ci阻遏物所阻遏的强启动子。温度敏感的ci857阻遏物允许通过热诱导控制基因表达,因为在30℃时,ci857阻遏物具有功能并阻遏基因表达,但在37℃-42℃时阻遏物失活,因此继而发生基因表达。
[0107]
如本文所用,“p
l
(ol1 g到t)启动子”是指留下ol1 g到t突变的λ启动子。p
l
是被与ol1、ol2和ol3阻遏物结合位点结合的ci阻遏物所阻遏的强启动子。温度敏感的ci857阻遏物允许通过热诱导控制基因表达,因为在30℃时,ci857阻遏物具有功能并阻遏基因表达,但在37℃-42℃时阻遏物失活,因此继而发生基因表达。如wo 2014/035457中所述,与ol1结合的ci阻遏物被ol1 g到t突变减少,导致在30℃和37℃-42℃下启动子活性增加。
[0108]
如本文所用,“质粒”是指与染色体dna分离的染色体外dna分子,其能够独立于染色体dna进行复制。
[0109]
如本文所用,“质粒拷贝数”是指每个细胞的质粒拷贝数。质粒拷贝数的增加表明质粒生产产量的增加。
[0110]
如本文所用,“pol”是指聚合酶。
[0111]
如本文所用,“pol i”是指大肠杆菌dna聚合酶i。
[0112]
如本文所用,“pol iii”是指大肠杆菌dna聚合酶iii。
[0113]
如本文所用,“pol iii依赖性复制起点”是指不需要pol i的复制起点,例如rep蛋白依赖性r6kγ复制起点。许多额外的pol iii依赖性复制起点在本领域中是已知的,其中许多总结在通过引用包括在本文中的del solar等人,同上文,1998中。
[0114]
如本文所用,“polya”是指多聚腺苷酸化信号或位点。多聚腺苷酸化是向rna分子添加poly(a)尾。多腺苷酸化信号含有rna切割复合物识别的序列基序。大多数人类多聚腺苷酸化信号含有aauaaa基序和其5'和3'的保守序列。常用的polya信号源自兔β珠蛋白、牛生长激素、sv40早期或sv40晚期polya信号。
[0115]
如本文所用,“polya重复序列”是指作为同向重复序列的腺嘌呤核苷酸的连续序列。类似地,“polyg重复序列”是指作为同向重复序列的鸟嘌呤核苷酸的连续序列,“polyc
重复序列”是指作为同向重复序列的胞嘧啶核苷酸的连续序列,和“polyt重复序列”是指作为同向重复序列的胸腺嘧啶核苷酸的连续序列。“mrna载体”含有polya重复序列。
[0116]
如本文所用,“puc起点”是指pbr322衍生的复制起点,具有在升高的温度下增加拷贝数的g到a转变和rop负调节物缺失。
[0117]
如本文所用,“无puc”是指不含puc起点的质粒。
[0118]
如本文所用,“puc质粒”是指含有puc起点的质粒。
[0119]
如本文所用,“r6k质粒”是指具有r6k或r6k衍生的复制起点的质粒,例如ntc9385r、ntc9685r、ntc9385r2-o1、ntc9385r2-o2、ntc9385r2a-o1、ntc9385r2a-o2、ntc9385r2b-o1、ntc9385r2b-o2、ntc9385ra-o1、ntc9385ra-o2、ntc9385raf和ntc9385rbf载体以及在wo2014/035457和wo2019/183248中描述的含有r6k复制起点的修饰和替代载体。本领域已知的替代r6k载体包括但不限于pcor载体(gencell)、无pcpg载体(invivogen)和牛津大学无cpg载体,包括pgm169。
[0120]
如本文所用,“r6k复制起点”是指被r6k rep蛋白特异性识别以启动dna复制的区域,包括但不限于wo 2019/183248中的公开为seq id no:1、seq id no:2seq id no:4和seq id no:18(分别为seq id no:43-44、46和60)的r6kγ复制起点序列。还包括如drocourt等人的美国专利7244609中所述的无cpg版本(例如seq id no:3),该专利通过引用并入本文(seq id no:63)。
[0121]
如本文所用,“r6k复制起点-rna-out细菌起点”含有用于繁殖的r6k复制起点和rna-out选择性标记(例如,wo 2019/183248中公开的seq id no:8;seq id no:9;seq id no:10;seq id no:11;seq id no:12;seq id no:13;seq id no:14;seq id no:15;seq id no:16;seq id no:17(分别为seq id no:50-59))。
[0122]
如本文所用,“rep蛋白依赖性质粒”是指其中复制依赖于以反式提供的复制(rep)蛋白的质粒。例如,r6k复制起点、cole2-p9复制起点和cole2相关的复制起点质粒,其中rep蛋白表达自宿主菌株基因组。许多额外的rep蛋白依赖性质粒在本领域中是已知的,其中许多总结于通过引用并入本文的del solar等人,同上文,1998,《微生物学和分子生物学综述(microbiol.mol.biol.rev.)》62:44-464。
[0123]
如本文所用,“逆转录病毒载体”是指可以感染分裂细胞的整合病毒载体。也称为转移质粒。质粒编码逆转录病毒ltr侧翼表达单位。转移质粒与制造病毒颗粒所需的包膜和包装质粒一起转染到生产细胞中。
[0124]
如本文所用,“逆转录病毒包膜载体”是指编码包膜糖蛋白的质粒。
[0125]
如本文所用,“逆转录病毒包装载体”是指编码包装逆转录病毒转移载体所需的逆转录病毒gag和pol基因的质粒。
[0126]
如本文所用,“rna-in”是指插入序列10(is10)编码的rna-in,即与rna rna-out的一部分互补和反义的rna。当rna-in被克隆到mrna的非翻译前导中时,rna-in到rna-out的退火会减少基因编码的rna-in下游的翻译。
[0127]
如本文所用,“rna-in调节的选择性标记”是指基因组表达的rna-in调节的选择性标记。在存在质粒携带的rna-out反义阻遏物rna(例如wo2019/183248中公开的seq id no:6(seq id no:48))的情况下,蛋白质编码的rna-in下游(例如具有序列gccaaaaatcaataatcagacaacaagatg)的表达被阻遏。构造rna-in调节的选择性标记,使得
h,park h,park jh,lee sy.2013.《自然生物技术(nat biotechnol)》31:170-4中所述。rna选择性标记也可以是作为选择性标记的一部分的工程化阻遏物rna,其阻遏融合到如us 2015/0275221中所述的待调节的靶基因如sacb的靶rna。
[0131]
如本文所用,“sacb”是指编码枯草芽孢杆菌(bacillus subtilus)果聚糖蔗糖酶的结构基因。在存在蔗糖的情况下,革兰氏阴性菌中sacb的表达是有毒的。
[0132]
如本文所用,“seap”是指分泌的碱性磷酸酶。
[0133]
如本文所用,“选择性标记”或“选择标记”是指选择性标记,例如卡那霉素抗性基因或rna选择性标记。
[0134]
如本文所用,术语“序列同一性”是指任何给定查询序列与目标序列之间的同一性程度。例如,目标序列可以与给定的查询序列具有至少90%、至少95%、至少98%、至少99%或100%的序列同一性。为了确定序列同一性百分比,使用本领域熟知的任何合适的序列比对程序,例如允许在核酸序列的整个长度上进行核酸序列比对(全局比对)的计算机程序clustalw(版本1.83,默认参数),将查询序列(例如核酸序列)与一个或多个目标序列进行比对。chema等人,2003《核酸综述(nucleic acids res.)》,31:3497-500。在优选的方法中,序列比对程序(例如clustalw)计算查询和一个或多个目标序列之间的最佳匹配,并比对它们,使得可以确定同一性、相似点和不同点。可以将一个或多个核苷酸的缺口插入查询序列、目标序列或两者中,以最大化序列比对。对于核酸序列的快速成对比对,可以选择适合特定比对程序的合适默认参数。输出是反映序列之间关系的序列比对。为了进一步确定目标核酸序列与查询序列的同一性百分比,使用比对程序比对序列,即用比对中相同匹配的数量除以查询序列的长度,并将结果乘以100。注意百分比同一性值可以四舍五入到最接近的十分位。例如,78.11、78.12、78.13和78.14向下舍入为78.1,而78.15、78.16、78.17、78.18和78.19向上舍入为78.2。
[0135]
如本文所用,“shrna”是指短发夹rna。
[0136]
如本文所用,“s/mar”是指支架/基质附着区域,其包括介导dna附着至核基质的真核序列。
[0137]
如本文所用,“睡美人转座子”是指通过由sb转座酶介导的简单剪切和粘贴机制将ir/dr侧翼的sb转座子整合到基因组中的转座子体系。转座子载体通常含有在ir/dr之间的被切除并整合到基因组中的启动子-转基因-polya表达盒。
[0138]
如本文所用,“间隔区”是指连接真核区序列的5'和3'端的区域。真核区域5'和3'端通常由质粒载体中的细菌复制起点和细菌选择性标记(细菌区域)分开,因此许多间隔区由细菌区域组成。在本发明的pol iii依赖性复制起点载体中,该间隔区优选小于1000bp。
[0139]
如本文所用,“结构化dna序列”是指能够形成复制抑制二级结构的dna序列(mirkin和mirkin,2007.《微生物学和分子生物学综述(microbiology and molecular biology reviews)》71:13-35)。这包括但不限于反向重复序列、回文、同向重复序列、ir/dr、均聚重复序列或含有真核启动子增强子的重复序列,或含有真核复制起点的重复序列。
[0140]
如本文所用,“sv40起点”是指含有复制起点的猿猴病毒40基因组dna。
[0141]
如本文所用,“sv40增强子”是指含有72bp和任选地21bp增强子重复序列的猿猴病毒40基因组dna。
[0142]
如本文所用,“te缓冲液”是指含有大约10mm tris ph 8和1mm edta的溶液。
[0143]
如本文所用,“tetr”是指四环素抗性基因。
[0144]
如本文所用,“转录终止子”是指(1)在细菌背景中,标记基因或操纵子末端以进行转录的dna序列。这可能是内在转录终止子或rho依赖性转录终止子。对于内在终止子,例如trpa终止子,在转录物内形成破坏mrna-dna-rna聚合酶三元复合物的发夹结构。可替代地,rho依赖性转录终止子需要rho因子(rna解旋酶蛋白质复合物)来破坏新生的mrna-dna-rna聚合酶三元复合物;或(2)在真核背景中,polya信号不是“终止子”,相反,polya位点的内部切割在3'utr rna上留下未加帽的5'端以用于核酸酶消化。核酸酶追上rna pol ii并导致终止。通过引入rna pol ii暂停位点(真核转录终止子),可以在polya位点的短区域内促进终止。rna pol ii的暂停允许在polya切割后引入3'utr mrna的核酸酶在暂停位点赶上rna pol ii。本领域已知的真核转录终止子的非限制性列表包括c2x4和胃泌素终止子。真核转录终止子可以通过增强mrna的适当3'端加工来提高mrna水平。
[0145]
如本文所用,“转染”是指将核酸递送到细胞中的本领域已知并且通过引用包括在本文中的方法[例如,聚(丙交酯-乙交酯)(plga)、iscom、脂质体、囊泡、病毒体、嵌段共聚物、pluronic嵌段共聚物、壳聚糖和其他可生物降解的聚合物、微粒、微球、磷酸钙纳米粒子、纳米粒子、纳米胶囊、纳米球、泊洛沙姆纳米球、电穿孔、核转染、压电渗透、声孔效应、离子电渗疗法、超声、sqz高速细胞变形介导的膜破裂、电晕等离子体、等离子体促进递送、组织可耐受等离子体、激光微孔、冲击波能量、磁场、非接触式磁渗透、基因枪、微针、微晶换肤术、流体动力学递送、高压尾静脉注射等]。通常使用化学感受态大肠杆菌或电感受态大肠杆菌细胞,使用本领域已知并通过引用包括在本文中的标准方法,将dna转染到大肠杆菌中,这通常称为转化。
[0146]
如本文所用,“转基因”是指被克隆到载体中以用于在靶生物体中表达的目标基因。
[0147]
如本文所用,“转座酶载体”是指编码转座酶的载体。
[0148]
如本文所用,“转座子载体”是指编码转座子的载体,该转座子是转座酶介导的基因整合的底物。
[0149]
如本文所用,“ts”是指温度敏感的。
[0150]
如本文所用,“utr”是指mrna的非翻译区(编码区的5'或3')。
[0151]
如本文所用,“载体”是指基因递送媒介物,包括病毒(例如甲病毒、痘病毒、慢病毒、逆转录病毒、腺病毒、腺病毒相关病毒等)和非病毒(例如质粒、midge、转录活性pcr片段、小环、噬菌体、nanoplasmid
tm
等)载体。这些在本领域中是熟知的并且通过引用包括在本文中。
[0152]
如本文所用,“载体骨架”是指载体的没有转基因或靶抗原编码区的真核和细菌区域。
[0153]
在一些实施例中,工程化的大肠杆菌宿主细胞,其中工程化的大肠杆菌宿主细胞包含选自由sbcc和sbcd组成的群组的至少一种基因的基因敲除,并且其中工程化的大肠杆菌宿主细胞不包括在sbcb、recb、recd和recj中的任一种以及任选地uvrc、mcra、mcrbc-hsd-mrr及其组合中的至少一种中的工程化活力或产量降低突变。在一些实施例中,工程化的大肠杆菌宿主细胞不包括任何sbcb、recb、recd和recj以及任选地uvrc、mcra、mcrbc-hsd-mrr及其组合中的至少一种中的任何工程化突变。在一些实施例中,工程化的大肠杆菌
宿主细胞不包括在sbcb、recb、recd和recj中的任一种以及任选地uvrc、mcra、mcrbc-hsd-mrr及其组合中的至少一种中的任何突变。
[0154]
应当理解,工程化的大肠杆菌宿主细胞在本公开的范围内,该细胞包含选自由sbcc和sbcd组成的群组的至少一种基因的基因敲除(或敲低),其中工程化的大肠杆菌宿主细胞不包括在sbcb、recb、recd、recj、uvrc、mcra和mcrbc-hsd-mrr中的至少一种中的工程化活力或产量降低突变,或在一些实施例中的工程化突变或任何突变。还应理解,工程化的大肠杆菌宿主细胞在本公开的范围内,该细胞包含选自由sbcc和sbcd组成的群组的至少一种基因的基因敲除,其中工程化的大肠杆菌宿主细胞不包括在sbcb、recb、recd和recj中的至少一种中的工程化活力或产量降低突变,或在一些实施例中的工程化突变或任何突变。在一些实施例中,工程化的大肠杆菌宿主细胞包含选自由sbcc和sbcd组成的群组的至少一种基因的基因敲除,但不包括mcra中的活力或产量降低突变,或在一些实施例中的工程化或任何突变。在一些实施例中,工程化的大肠杆菌宿主细胞包含选自由sbcc和sbcd组成的群组的至少一种基因的基因敲除,其中工程化的大肠杆菌宿主细胞不包括在sbcb、recb、recd和recj中的任一种中的工程化活力或产量降低突变,或在一些其他实施例中的工程化或任何突变。
[0155]
在其他实施例中,工程化的大肠杆菌宿主细胞包含选自由sbcc和sbcd组成的群组的至少一种基因的基因敲除,并且不包括在sbcb、recb、recd、recj、uvrc、mcra和mcrbc-hsd-mrr中的至少一种中的任何工程化活力或产量降低突变。在其他实施例中,工程化的大肠杆菌宿主细胞包含选自由sbcc和sbcd组成的群组的至少一种基因的基因敲除,并且不包括在sbcb、recb、recd、recj、uvrc、mcra和mcrbc-hsd-mrr中的至少一种中的任何工程化突变。在其他实施例中,工程化的大肠杆菌宿主细胞包含选自由sbcc和sbcd组成的群组的至少一种基因的基因敲除,并且不包括在sbcb、recb、recd、recj、uvrc、mcra和mcrbc-hsd-mrr中的至少一种中的任何突变。在一些实施例中,工程化的大肠杆菌宿主细胞包含选自由sbcc和sbcd组成的群组的至少一种基因的基因敲除,并且不包括sbcb、recb、recd、recj和uvrc中的任何突变。在一些实施例中,工程化的大肠杆菌宿主细胞包含选自由sbcc和sbcd组成的群组的至少一种基因的基因敲除,并且不包括mcra中的任何突变。
[0156]
在一些实施例中,提供了工程化的大肠杆菌宿主细胞,其包括选自由sbcc和sbcd组成的群组的至少一种基因的基因敲除,其中工程化的大肠杆菌宿主细胞不包括sbcb、recb、recd和recj中的任一种中的工程化活力或产量降低突变。在任何前述实施例中,工程化的大肠杆菌宿主细胞不可包括在sbcb、recb、recd和recj中的任何工程化突变。在任何前述实施例中,工程化的大肠杆菌宿主细胞不可包括在sbcb、recb、recd和recj中的任一种中的任何突变。在一些实施例中,提供了工程化的大肠杆菌宿主细胞,其包括选自由sbcc和sbcd组成的群组的至少一种基因的基因敲除,并且该大肠杆菌宿主细胞与衍生其的菌株是同基因的,衍生其的菌株选自由dh5α、dh1、jm107、jm108、jm109、mg1655和xl1blue组成的群组。在一些实施例中,提供了工程化的大肠杆菌宿主细胞,其包括选自由sbcc和sbcd组成的群组的至少一种基因的基因敲除,并且该大肠杆菌宿主细胞与衍生其的菌株是同基因的,衍生其的菌株选自由dh5α(dcm-)、ntc4862、ntc4862-hf、ntc1050811、ntc1050811-hf、ntc1050811-hf(dcm-)、hb101、tg1和neb turbo组成的群组。
[0157]
在与任何前述实施例不一致的情况下,工程化的大肠杆菌宿主细胞可以进一步不
包括在uvrc、mcra、mcrbc-hsd-mrr及其组合中的至少一种中的工程化活力或产量降低突变。在任何前述实施例中,工程化的大肠杆菌宿主细胞可以进一步不包括在uvrc、mcra、mrbc-hsd-mrr及其组合中的至少一种中的任何工程化突变。在任何前述实施例中,工程化的大肠杆菌宿主细胞可以进一步不包括在uvrc、mcra、mrbc-hsd-mrr及其组合中的至少一种中的任何突变。因此,在一些实施例中,工程化的大肠杆菌宿主细胞进一步不包括uvrc中的工程化活力或产量降低突变、工程化突变或任何突变。在其他实施例中,工程化的大肠杆菌宿主细胞进一步不包括mcra中的工程化活力或产量降低突变、工程化突变或任何突变。在其他实施例中,工程化的大肠杆菌宿主细胞进一步不包括mcrbc-hsd-mrr中的工程化活力或产量降低突变、工程化突变或任何突变。在又一个实施例中,工程化的大肠杆菌宿主细胞进一步不包括mcra和mrbc-hsd-mrr中的工程化活力或产量降低突变、工程化突变或任何突变。应当理解,在本公开全文中,mrbc-hsd-mrr是指包括seq id no:16-21的序列的序列。
[0158]
在任何前述实施例中,工程化的大肠杆菌宿主细胞可以包括非功能性sbccd复合物,或者换言之,可以不包括功能性sbccd复合物。可替代地,在一些实施例中,工程化的大肠杆菌宿主细胞可以不包括sbccd复合物。
[0159]
在任何前述实施例中,工程化的大肠杆菌宿主细胞的基因敲除可以是sbcc的敲除。可替代地,在一些实施例中,工程化的大肠杆菌宿主细胞的基因敲除可以是sbcd的敲除。在任何前述实施例中,工程化的大肠杆菌宿主细胞的基因敲除可以是sbcc和sbcd两者的敲除。
[0160]
在任何前述实施例中,工程化的大肠杆菌宿主细胞可以源自选自由以下组成的群组的细胞系:dh5α、dh1、jm107、jm108、jm109、mg1655和xl1blue。在任何前述实施例中,工程化的大肠杆菌宿主细胞可以源自dh5α(dcm-)、ntc4862、ntc4862-hf、ntc1050811、ntc1050811-hf或ntc 1050811-hf(dcm-)。在一些前述实施例中,工程化的大肠杆菌宿主细胞可以源自选自由hb101、tg1和neb turbo组成的群组的细胞系。这些细胞系的基因型如下:
[0161]
dh5α(dcm-):dh5αdcm-[0162]
ntc4862:dh5αatt
λ
::p
c-rna-in-sacb,catr
[0163]
ntc4862-hf:dh5αatt
λ
.::p
c-rna-in-sacb,catr;::para-ci857tsp
c-rna-in-sacb,tetr
[0164]
ntc1050811:dh5αatt
λ
::p
c-rna-in-sacb,catr;att
hk022
::pl(ol1-g到t)p42l-p106i-f107s p113s(p3-),specr strepr;::para-ci857ts,tetr
[0165]
ntc1050811-hf:dh5αatt
λ
::p
c-rna-in-sacb,catr;att
hk022
::pl(ol1-g到t)p42l-p106i-f107s p113s(p3-),specrstrepr;::para-ci857tsp
c-rna-in-sacb,tetr
[0166]
ntc1050811-hf(dcm-):dh5αdcm-att
λ
::pc-rna-in-sacb,catr;att
hk022
::pl(ol1-g到t)p42l-p106i-f107s p113s(p3-),specr strepr;::para-ci857ts pc-rna-in-sacb,tetr
[0167]
hb101:f-mcrb mrr hsds20(r
b-m
b-)reca13 leub6 ara-14proa2 lacy1 galk2xyl-5mtl-1rpsl20(smr)glnv44λ-[0168]
tg1:k-12glnv44 thi-1δ(lac-proab)δ(mcrb-hsdsm)5(r
k-m
k-)f'[trad36proab
+
laci
q laczδm15]
[0169]
neb turbo:f'proa
+b+
laciqδlaczm15/fhua2δ(lac-proab)glnv galk16gale15 r(zgb-210::tn10)tet
s enda1 thi-1δ(hsds-mcrb)5
[0170]
在任何前述实施例中,工程化的大肠杆菌宿主细胞可以进一步包括基因组抗生素抗性标记。例如但不限于,基因组抗生素抗性标记可以是kanr,其包含与seq id no:23(kanr,795bp)具有至少90%、至少95%、至少95%、至少98%、至少99%或100%序列同一性的序列。进一步例如但不限于,基因组抗生素抗性标记可以是kanr,其包含编码与seq id no:36(kanr)具有至少90%、至少95%、至少98%、至少99%或100%序列同一性的蛋白质的序列。仍进一步例如,基因组抗生素抗性标记可以是氯霉素抗性标记、庆大霉素抗性标记、卡那霉素抗性标记、壮观霉素和链霉素抗性标记、甲氧苄啶抗性标记或四环素抗性标记。可替代地,在任何前述实施例中,大肠杆菌宿主细胞可以不包括基因组抗生素抗性标记。
[0171]
在任何前述实施例中,工程化的大肠杆菌宿主细胞可以进一步包括适于培养rep蛋白依赖性质粒的rep蛋白。例如但不限于,工程化的大肠杆菌宿主细胞可以包括基因组核酸序列,其与选自由以下组成的群组的序列具有至少90%、至少95%、至少98%、至少99%或100%序列同一性:seq id no:26(p42l-p106i-f107s-p113s,918bp)、seq id no:27(p42l-δ106-107-p113s,912bp)、seq id no:28(p42l-p106l-f107s,918bp)和seq id no:29(p42l-p113s,918bp)。进一步例如但不限于,工程化的大肠杆菌宿主细胞可以包括编码rep蛋白的基因组核酸序列,该rep蛋白与选自由以下组成的群组的氨基酸序列具有至少90%、至少95%、至少98%、至少99%或100%的同一性:seq id no:39(p42l-p106i-f107s-p113s)、seq id no:40(p42l-δ106-107-p113s)、seq id no:42(p42l-p106l-f107s)、seq id no:41(p42l-p113s)、seq id no:34(cole2野生型)、seq id no:35(cole2突变的g194d)。仍进一步例如但不限于,工程化的大肠杆菌宿主细胞可以包括rep蛋白,该rep蛋白与选自由以下组成的群组的氨基酸序列具有至少90%、至少95%、至少98%、至少99%或100%的同一性:seq id no:39(p42l-p106i-f107s-p113s)、seq id no:40(p42l-δ106-107-p113s)、seq id no:42(p42l-p106l-f107s,305aa)、seq id no:41(p42l-p113s,305aa)、seq id no:34(cole2野生型)、seq id no:35(cole2突变的g194d)。应当理解,在任何前述实施例中编码rep蛋白的核酸序列可以在p
l
启动子的控制下,并且如果在基因组中存在λ阻遏物如cits857,则此类p
l
启动子可以使rep蛋白能够进行温度敏感表达。例如但不限于,p
l
启动子可以具有与ttgacataaa taccactggc ggtgatact(p
l
启动子(-35至-10))、ttgacataaa taccactggc gtgatact(p
l
启动子ol1-g(-35至-10))或ttgacataaa taccactggc gttgatact(p
l
启动子ol1-g到t(-35至-10))具有至少95%、至少98%、至少99%或100%序列同一性的序列。应进一步理解,在rep蛋白是r6k rep蛋白如seq id no:39-42时,转染到工程化的大肠杆菌宿主细胞中的载体可以含有r6k复制起点,并且可替代地,在rep蛋白是cole2 rep蛋白时,转染到工程化的大肠杆菌宿主细胞中的载体可以含有cole2复制起点。
[0172]
在任何前述实施例中,工程化的大肠杆菌宿主细胞可以进一步包括编码基因组表达的rna-in调节的选择性标记的基因组核酸序列。例如但不限于,工程化的大肠杆菌宿主细胞可以包括基因组核酸序列(其编码选择性标记),该序列与seq id no:25(sacb,1422bp)具有至少90%、至少95%、至少98%、至少99%或100%的序列同一性。进一步例如
但不限于,工程化的大肠杆菌宿主细胞可以包括编码具有氨基酸序列的选择性标记的基因组核酸序列,该氨基酸序列与seq id no:38(sacb)具有至少90%、至少95%、至少98%、至少99%或100%的序列同一性。仍进一步例如但不限于,工程化的大肠杆菌宿主细胞可以包括具有氨基酸序列的rna-in调节的选择性标记,该氨基酸序列与seq id no:38(sacb)具有至少90%、至少95%、至少98%、至少99%或100%的序列同一性。在任何前述实施例中,rna-in调节的选择性标记可以位于具有序列gccaaaaatcaataatcagacaacaagatg的rna-in的下游;在使用该rna-in的实施例中,载体中的相应rna-out可以是wo 2019/183248的seq id no:6(seq id no:48)的rna-out。因此,对于sacb,rna-in sacb序列可以是
[0173][0173]
应当理解,可以使用任何合适的rna-in调节的选择性标记和rna-in,并且这些是本领域已知的。
[0174]
在任何前述实施例中,工程化的大肠杆菌宿主细胞可以进一步包括编码温度敏感的λ阻遏物的基因组核酸序列。例如但不限于,温度敏感的λ阻遏物可以是cits857。例如但不限于,工程化的大肠杆菌宿主细胞可以包括基因组核酸序列(其编码温度敏感的λ阻遏物),该序列与seq id no:24(cits857,714bp)具有至少90%、至少95%、至少98%、至少99%或100%的序列同一性。进一步例如但不限于,工程化的大肠杆菌宿主细胞可以进一步包括编码具有氨基酸序列的cits857的基因组核酸序列,该氨基酸序列与seq id no:37(cits857)具有至少90%、至少95%、至少98%、至少99%或100%的序列同一性。仍进一步例如但不限于,工程化的大肠杆菌宿主细胞可以进一步包括具有氨基酸序列的温度敏感的λ阻遏物,该氨基酸序列与seq id no:37(cits857)具有至少90%、至少95%、至少98%、至少99%或100%的序列同一性。在任何上述实施例中,在工程化的大肠杆菌宿主细胞进一步包括编码温度敏感的λ阻遏物的基因组核酸序列时,温度敏感的λ阻遏物可以是阿拉伯糖诱导型cits857基因的噬菌体附着位点染色体整合拷贝。例如但不限于,cits857基因可
以在pbad启动子的控制下以提供阿拉伯糖诱导性(pbad启动子,
[0175][0176]
在一些实施例中,提供了具有以下基因型的工程化的大肠杆菌宿主细胞:f-δ(laczya-argf)u169 reca1 enda1 hsdr17(r
k-,mk+)gal-phoa supe44λ-thi-1gyra96 rela1δsbcdc::kanr。
[0177]
在一些实施例中,提供了具有以下基因型的工程化的大肠杆菌宿主细胞:f-δ(laczya-argf)u169 reca1 enda1 hsdr17(r
k-,mk+)gal-phoa supe44λ-thi-1gyra96 rela1δsbcdc。
[0178]
在一些实施例中,提供了具有以下基因型的工程化的大肠杆菌宿主细胞:dh5αatt
hk022
::pl(ol1-g到t)p42l-p106i-f107s p113s(p3-),specr strepr;δsbcdc::kanr。
[0179]
在一些实施例中,提供了具有以下基因型的工程化的大肠杆菌宿主细胞:dh5αatt
hk022
::pl(ol1-g到t)p42l-p106i-f107s p113s(p3-),specr strepr;δsbcdc。
[0180]
在一些实施例中,提供了具有以下基因型的工程化的大肠杆菌宿主细胞:f-δ(laczya-argf)u169 reca1 enda1 hsdr17(r
k-,mk+)gal-phoa supe44λ-thi-1gyra96 rela1;δsbcdc::kanr。
[0181]
在一些实施例中,提供了具有以下基因型的工程化的大肠杆菌宿主细胞:dh5αdcm-;δsbcdc。
[0182]
在一些实施例中,提供了具有以下基因型的工程化的大肠杆菌宿主细胞:dh5αdcm-;δsbcdc::kanr。
[0183]
在一些实施例中,提供了具有以下基因型的工程化的大肠杆菌宿主细胞:dh5αatt
λ
::p
c-rna-in-sacb,catr;δsbcdc。
[0184]
在一些实施例中,提供了具有以下基因型的工程化的大肠杆菌宿主细胞:dh5αatt
λ
::p
c-rna-in-sacb,catr;δsbcdc::kanr。
[0185]
在一些实施例中,提供了具有以下基因型的工程化的大肠杆菌宿主细胞:dh5αatt
λ
::p
c-rna-in-sacb,catr;::para-ci857ts p
c-rna-in-sacb,tetr;δsbcdc。
[0186]
在一些实施例中,提供了具有以下基因型的工程化的大肠杆菌宿主细胞:dh5αatt
λ
::p
c-rna-in-sacb,catr;::para-ci857ts p
c-rna-in-sacb,tetr;δsbcdc::kanr。
[0187]
在一些实施例中,提供了具有以下基因型的工程化的大肠杆菌宿主细胞:dh5αatt
λ
::p
c-rna-in-sacb,catr;att
hk022
::pl(ol1-g到t)p42l-p106i-f107s p113s(p3-),specr strepr;::para-ci857ts,tetr;δsbcdc。
[0188]
在一些实施例中,提供了具有以下基因型的工程化的大肠杆菌宿主细胞:dh5αatt
λ
::p
c-rna-in-sacb,catr;att
hk022
::pl(ol1-g到t)p42l-p106i-f107s p113s(p3-),specr strepr;::para-ci857ts,tetr;δsbcdc::kanr。
[0189]
在一些实施例中,提供了具有以下基因型的工程化的大肠杆菌宿主细胞:dh5αatt
λ
::p
c-rna-in-sacb,catr;att
hk022
::pl(ol1-g到t)p42l-p106i-f107s p113s(p3-),specr strepr;::para-ci857ts p
c-rna-in-sacb,tetr;δsbcdc。
[0190]
在一些实施例中,提供了具有以下基因型的工程化的大肠杆菌宿主细胞:dh5αatt
λ
::p
c-rna-in-sacb,catr;att
hk022
::pl(ol1-g到t)p42l-p106i-f107s p113s(p3-),specr strepr;::para-ci857ts p
c-rna-in-sacb,tetr;δsbcdc::kanr。
[0191]
在一些实施例中,提供了具有以下基因型的工程化的大肠杆菌宿主细胞:dh5αdcm-att
λ
::p
c-rna-in-sacb,catr;att
hk022
::pl(ol1-g到t)p42l-p106i-f107s p113s(p3-),specr strepr;::para-ci857ts p
c-rna-in-sacb,tetr;δsbcdc。
[0192]
在一些实施例中,提供了具有以下基因型的工程化的大肠杆菌宿主细胞:dh5αdcm-att
λ
::p
c-rna-in-sacb,catr;att
hk022
::pl(ol1-g到t)p42l-p106i-f107s p113s(p3-),specr strepr;::para-ci857ts p
c-rna-in-sacb,tetr;δsbcdc::kanr。
[0193]
在任何前述实施例中,sbcc基因可以包括与seq id no:9具有至少90%、至少95%、至少98%、至少99%或100%序列同一性的序列。在任何前述实施例中,sbcd基因可以包括与seq id no:10具有至少90%、至少95%、至少98%、至少99%或100%序列同一性的序列。应当理解,这可以在基因敲除或敲低之前或之后(即在工程化的大肠杆菌宿主细胞中)应用于基因。作为参考,用于大肠杆菌k12的来自ncbi的sbcc的野生型序列(参考序列:wp 206061808.1)由以下序列给出:
[0194]
mkilslrlknlnslkgewkidftrepfasnglfaitgptgagkttlldaiclalyhetprlsnvsqsqndlmtrdtaeclaevefevkgeayrafwsqnrarnqpdgnlqvprvelarcadgkiladkvkdkleltatltgldygrftrsmllsqgqfaaflnakpkeraelleeltgteiygqisamvfeqhksarteleklqaqasgvtlltpeqvqsltaslqvltdeekqlitaqqqeqqslnwltrqdelqqeasrrqqalqqalaeeekaqpqlaalslaqparnlrphweriaehsaalahirqqieevntrlqstmalrasirhhaakqsaelqqqqqslntwlqehdrfrqwnnepagwraqfsqqtsdrehlrqwqqqlthaeqklnalaaitltltadevatalaqhaeqrplrqhlvalhgqivpqqkrlaqlqvaiqnvtqeqtqrnaalnemrqrykektqqladvkticeqeariktleaqraqlqagqpcplcgstshpaveayqalepgvnqsrllalenevkklgeegatlrgqldaitkqlqrdeneaqslrqdeqaltqqwqavtaslnitlqplddiqp
wldaqdeherqlrllsqrhelqgqiaahnqqiiqyqqqieqrqqlllttltgyaltlpqedeeeswlatrqqeaqswqqrqneltalqnriqqltpiletlpqsdelphceetvvlenwrqvheqclalhsqqqtlqqqdvlaaqslqkaqaqfdtalqasvfddqqaflaalmdeqtltqleqlkqnlenqrrqaqtlvtqtaetlaqhqqhrpddglaltvtveqiqqelaqthqklrenttsqgeirqqlkqdadnrqqqqtlmqqiaqmtqqvedwgylnsligskegdkffkfaqgltldnlvhlanqqltrlhgryllqrkasealevevvdtwqadavrdtrtlsggesflvslalalalsdlvshktridslfldegfgtldsetldtaldaldalnasgktigvishveamkeripvqikvkkinglgysklestfavk,而用于大肠杆菌k12的来自genbank(aab18122.1)的sbcd的野生型序列由以下序列给出:
[0195]
mlfrqgtvmrilhtsdwhlgqnfysksreaehqafldwlletaqthqvdaiivagdvfdtgsppsyartlynrfvvnlqqtgchlvvlagnhdsvatlnesrdimaflnttvvasaghapqilprrdgtpgavlcpipflrprdiitsqaglngiekqqhllaaitdyyqqhyadacklrgdqplpiiatghlttvgasksdavrdiyigtldafpaqnfppadyialghihraqiiggmehvrycgspiplsfdecgkskyvhlvtfsngklesvenlnvpvtqpmavlkgdlasitaqleqwrdvsqeppvwldieittdeylhdiqrkiqalteslpvevllvrrsreqrervlasqqretlselsveevfhrrlaleeldesqqqrlqhlftttlhtlagehea。应当理解,这些氨基酸序列是示例性的并且本领域技术人员可以基于同源性鉴定其他菌株和细胞系中包括复合物在内的sbcc和sbcd基因和蛋白质。
[0196]
在任何前述实施例中,sbcb基因可以包括与seq id no:11具有至少95%、至少98%、至少99%或100%序列同一性的序列。在任何前述实施例中例如,recb基因可以包括与seq id no:12具有至少95%、至少98%、至少99%或100%序列同一性的序列。在任何前述实施例中,recd基因可以包括与seq id no:13具有至少95%、至少98%、至少99%或100%序列同一性的序列。在任何前述实施例中,recj基因可以包括与seq id no:65具有至少95%、至少98%、至少99%或100%序列同一性的序列。
[0197]
在任何前述实施例中,uvrc基因可以包括与seq id no:14具有至少95%、至少98%、至少99%或100%序列同一性的序列。在任何前述实施例中,mcra基因可以包括与seq id no:15具有至少95%、至少98%、至少99%或100%序列同一性的序列。在任何前述实施例中,mcrbc-hsd-mrr基因可以包括与seq id no:16-21具有至少95%、至少98%、至少99%或100%序列同一性的序列。
[0198]
在任何前述实施例中,工程化的大肠杆菌宿主细胞可以进一步包括载体。例如但不限于,载体可以是非病毒转座子载体,例如转座酶载体、睡美人转座子载体、睡美人转座酶载体、piggybac转座子载体、piggybac转座酶载体、表达载体等、非病毒基因编辑载体如同源定向修复(hdr)/crispr-cas9载体或病毒载体如aav载体、aav rep cap载体、aav辅助载体、ad辅助载体、慢病毒载体、慢病毒包膜载体、慢病毒包装载体、逆转录病毒载体、逆转录病毒包膜载体、逆转录病毒包装载体、mrna载体等。
[0199]
在任何前述实施例中,在大肠杆菌宿主细胞进一步包括载体时,该载体可以包括具有回文的核酸序列。回文可以理解为双链dna分子中的核酸序列,其中一条链上某个方向的读数与互补链上相反方向的序列读数相匹配,使得存在沿一条链的互补部分,其中互补部分之间没有间插序列。例如,但不限于,回文的互补序列可各自包括约10至约200个碱基对、约15和至约200个碱基对、约20至约200个碱基对、约25至约200个碱基对、约30至约200个碱基对、约40至约200个碱基对、约50至约200个碱基对、约75至约200个碱基对、约100至约200个碱基对、约15至约200个碱基对、约10至约150个碱基对、约15至约150个碱基对、约
20至约150个碱基对、约25至约150个碱基对、约30至约150个碱基对、约30至约150个碱基对、约40至约150个碱基对、约50至约150个碱基对、约100至约150个碱基对、约10至约140个碱基对、约15至约140个碱基对、约20至约140个碱基对、约25至约140个碱基对、约30至约140个碱基对、约30至约140个碱基对、约40至约140个碱基对、约50至约140个碱基对、约100至约140个碱基对、约10至约100个碱基对、约15至约100个碱基对、约20至约100个碱基对、约25至约100个碱基对、约30至约100个碱基对、约40至约100个碱基对、约50至约100个碱基对,或约10、15、20、30、40、50、60、70、80、90、100、110、120、130、140、150、160、170、180、190或200个碱基对。
[0200]
在任何前述实施例中,在大肠杆菌宿主细胞进一步包括载体时,该载体可以包括具有至少一个同向重复序列的核酸序列。例如但不限于,至少一个同向重复序列可以包括约40至150个核苷酸、约60至约120个核苷酸或约90个核苷酸。进一步例如但不限于,至少一个同向重复序列可以是简单重复序列,其包括由单个碱基的多次重复组成的短dna序列,例如polya重复序列、polyt重复序列、polyc重复序列或polyg重复序列,其中简单重复序列包括相同碱基的约40至约150个连续重复序列、相同碱基的约60至约120个连续重复序列或相同碱基的约90个连续重复序列。进一步例如但不限于,polya重复序列可以包括40至150个连续腺嘌呤核苷酸、60至120个连续腺嘌呤核苷酸或约90个腺嘌呤核苷酸。
[0201]
在任何前述实施例中,在大肠杆菌宿主细胞进一步包括载体时,该载体可以包括反向重复序列、同向重复序列、均聚重复序列、真核复制起点和真核启动子增强子序列。进一步例如,载体可以包括选自由以下组成的群组的序列:polya重复序列、sv40复制起点、病毒ltr、慢病毒ltr、逆转录病毒ltr、转座子ir/dr重复序列、睡美人转座子ir/dr重复序列、aav itr、cmv增强子和sv40增强子。例如但不限于,aav载体可以含有aav itr。在一些实施例中,在大肠杆菌宿主细胞进一步包括载体时,该载体可以包括具有至少一个反向重复序列的核酸序列,该反向重复序列也可以是反向末端重复序列,诸如例如但不限于,aav itr。因此,在任何前述实施例中,载体可以包括aav itr。应当理解,反向重复序列是单链核苷酸序列,随后下游是其反向互补序列。应当进一步理解,单链序列可以是双链载体的一部分。初始序列和反向互补序列之间的核苷酸间插序列可以是任何长度,包括零。当插入长度为零时,复合序列是回文。当插入长度大于零时,复合序列是反向重复序列。在任何前述实施例中,间插序列可以是1至约2000个碱基对。例如但不限于,也可以是反向末端重复序列的反向重复序列可以被间插序列分开,该间插序列包含约1至约2000个碱基对、约5至约2000个碱基对、约10至约2000个碱基对、约25至约2000个碱基对、约50至约2000个碱基对、约100至约2000个碱基对、约250至约2000个碱基对、约500至约2000个碱基对、约750至约2000个碱基对、约1000至约2000个碱基对、约1250至约2000个碱基对、约1500至约2000个碱基对、约1750至约2000个碱基对、约1至约100个碱基对、约1至约50个碱基对、约1至约25个碱基对、约1至约20个碱基对、约1至约10个碱基对、约1至约5个碱基对,或约1、2、3、4、5、6、7、8、9、10、25、50、75、100、150、200、250、300、350、400、450、500、600、700、800、900、1000、1100、1200、1300、1400、1500、1600、1700、1800、1900或2000个碱基对。例如但不限于,反向重复序列的互补部分可以各自包括约10至约200个碱基对、约15and至约200个碱基对、约20至约200个碱基对、约25至约200个碱基对、约30至约200个碱基对、约40至约200个碱基对、约50至约200个碱基对、约75至约200个碱基对、约100至约200个碱基对、约15至约200个碱基对、
约10至约150个碱基对、约15至约150个碱基对、约20至约150个碱基对、约25至约150个碱基对、约30至约150个碱基对、约30至约150个碱基对、约40至约150个碱基对、约50至约150个碱基对、约100至约150个碱基对、约10至约140个碱基对、约15至约140个碱基对、约20至约140个碱基对、约25至约140个碱基对、约30至约140个碱基对、约30至约140个碱基对、约40至约140个碱基对、约50至约140个碱基对、约100至约140个碱基对、约10至约100个碱基对、约15至约100个碱基对、约20至约100个碱基对、约25至约100个碱基对、约30至约100个碱基对、约40至约100个碱基对、约50至约100个碱基对,或约10、15、20、30、40、50、60、70、80、90、100、110、120、130、140、150、160、170、180、190或200个碱基对。例如但不限于,至少一个反向重复序列可以包括aav itr重复序列,其包含与
[0202]
ttggccactccctctctgcgcgctcgctcgctcactgaggccgggcgaccaaaggtcgcccgacgcccgggctttgcccgggcggcctcagtgagcgagcgagcgcgcagagagggagtggccaactccatcactaggggttcct(5’aav itr)和
[0203]
aggaacccctagtgatggagttggccactccctctctgcgcgctcgctcgctcactgaggccgggcgaccaaaggtcgcccgacgcccgggctttgcccgggcggcctcagtgagcgagcgagcgcgcagagagggagtggccaa(3’aav itr)具有至少95%、至少95%、至少98%、至少99%或100%序列同一性的序列。
[0204]
可替代地,在任何前述实施例中,在大肠杆菌宿主细胞进一步包括载体时,该载体可以不包括具有回文、同向重复序列或反向重复序列的核酸序列。
[0205]
在任何前述实施例中,载体可以是aav载体。在一些实施例中,在载体是aav载体时,aav载体包含aav itr。在其他实施例中,载体可以是慢病毒载体、慢病毒包膜载体或慢病毒包装载体。在仍其他实施例中,载体可以是逆转录病毒载体、逆转录病毒包膜载体或逆转录病毒包装载体。在又其他实施例中,载体可以是转座酶载体或转座子载体。在仍进一步的实施例中,载体可以是mrna载体。例如但不限于,mrna载体可以包括如本公开中所述的polya重复序列。
[0206]
在任何前述实施例中,载体可以是质粒。在任何前述实施例中,载体可以是rep蛋白依赖性质粒。
[0207]
在任何前述实施例中,载体可以进一步包括rna选择性标记。例如但不限于,rna选择性标记可以是rna-out。进一步例如但不限于,rna-out可以与选自由wo 2019/183248的seq id no:5(gtagaattgg taaagagagt cgtgtaaaat atcgagttcg cacatcttgttgtctgatta ttgatttttg gcgaaaccat ttgatcatat gacaagatgt gtatctacct taacttaatg attttgataa aaatcatta)和seq id no:7(gtagaattgg taaagagagt tgtgtaaaat attgagttcg cacatcttgt tgtctgatta ttgatttttg gcgaaaccat ttgatcatat gacaagatgt gtatctacct taacttaatg attttgataa aaatcatta)(分别为seq id no:47和49)组成的群组的序列具有至少95%、至少98%、至少99%或100%的序列同一性。在一些实施例中,工程化的大肠杆菌宿主细胞可以包括相应的rna-in序列以允许通过rna-out调节下游标记并且rna-out序列对应于rna-in。
[0208]
在任何前述实施例中,载体可以进一步包括rna-out反义阻遏物rna。例如但不限于,rna-out反义阻遏物rna可具有与wo 2019/183248的seq id no:6(seq id no:48)具有至少90%、至少95%、至少98%、至少99%或100%序列同一性的序列。
[0209]
在任何前述实施例中,载体可以进一步包括细菌复制起点。例如但不限于,细菌复
制起点可以选自由r6k、puc和cole2组成的群组。进一步例如但不限于,细菌复制起点可以是r6kγ复制起点,其与选自由以下组成的群组的序列具有至少90%、至少95%、至少98%、至少99%或100%的序列同一性:wo 2019/183248的seq id no:1(ggcttgttgt ccacaaccgt taaaccttaa aagctttaaa agccttatat attctttttt ttcttataaa acttaaaacc ttagaggcta tttaagttgc tgatttatat taattttatt gttcaaacat gagagcttag tacgtgaaac atgagagctt agtacgttag ccatgagagc ttagtacgtt agccatgagg gtttagttcg ttaaacatga gagcttagta cgttaaacat gagagcttag tacgtactat caacaggttg aactgctgatc)、seq id no:2(ggcttgttgt ccacaaccat taaaccttaa aagctttaaa agccttatat attctttttt ttcttataaa acttaaaacc ttagaggcta tttaagttgc tgatttatat taattttatt gttcaaacat gagagcttag tacgtgaaac atgagagctt agtacattag ccatgagagc ttagtacatt agccatgagg gtttagttca ttaaacatga gagcttagta cattaaacat gagagcttag tacatactat caacaggttg aactgctgat c)、seq id no:3(aaaccttaaa acctttaaaa gccttatata ttcttttttt tcttataaaa cttaaaacct tagaggctat ttaagttgct gatttatatt aattttattg ttcaaacatg agagcttagt acatgaaaca tgagagctta gtacattagc catgagagct tagtacatta gccatgaggg tttagttcat taaacatgag agcttagtac attaaacatg agagcttagt acatactatc aacaggttga actgctgatc)、seq id no:4(tgtcagccgt taagtgttcc tgtgtcactg aaaattgctt tgagaggctc taagggcttc tcagtgcgtt acatccctgg cttgttgtcc acaaccgtta aaccttaaaa gctttaaaag ccttatatat tctttttttt cttataaaac ttaaaacctt agaggctatt taagttgctg atttatatta attttattgt tcaaacatga gagcttagta cgtgaaacat gagagcttag tacgttagcc atgagagctt agtacgttag ccatgagggt ttagttcgtt aaacatgaga gcttagtacg ttaaacatga gagcttagta cgtgaaacatgagagcttag tacgtactat caacaggttg aactgctgat cttcagatc)和seq id no:18(ggcttgttgt ccacaaccgt taaaccttaa aagctttaaa agccttatat attcttttti ttcttataaa acttaaaacc ttagaggcta tttaagttgc tgatttatat taattttatt gttcaaacat gagagcttag tacgtgaaac atgagagctt agtacgttag ccatgagagc ttagtacgtt agccatgagg gtttagttcg ttaaacatga gagcttagta cgttaaacat gagagcttag tacgttaaac atgagagctt agtacgtact atcaacaggt tgaactgctg atc)(分别为seq id no:43-46和60)、seq id no:30(cole2起点(+7),45bp)、seq id no:31(cole2起点(+7,无cpg),45bp)、seq id no:32(cole2起点(min),38bp)、seq id no:33(cole2起点(+16),60bp)和seq id no:22(puc,784bp)。
[0210]
在任何前述实施例中,工程化的大肠杆菌宿主细胞可以进一步包括真核无puc小环表达载体,该载体可以包括:(i)编码目的基因并具有5
′
和3
′
端的真核区域序列;和(ii)长度小于1000、优选小于500个碱基对的间隔区,其连接真核区序列的5
′
和3
′
端,并且包含r6k细菌复制起点和rna选择性标记。例如但不限于,r6k细菌复制起点和rna选择行标记可以具有如本公开中所述和本领域已知的序列。可替代地,在任何前述实施例中,工程化的大肠杆菌细胞可进一步包括共价闭合环状质粒,其具有包括pol iii依赖性r6k复制起点和rna-out选择性标记的骨架以及包括结构化dna序列的间插序列,其中骨架小于1000bp,优选小于500bp。例如但不限于,结构化dna序列可以包括选自由以下组成的群组的序列:反向重复序列、同向重复序列、均聚重复序列、真核复制起点和真核启动子增强子序列。进一步例如,结构化dna序列可以包括选自由以下组成的群组的序列:polya重复序列、sv40复制起
点、病毒ltr、慢病毒ltr、逆转录病毒ltr、转座子ir/dr重复序列、睡美人转座子ir/dr重复序列、aav itr、cmv增强子和sv40增强子。例如但不限于,插入序列可以是转座酶载体、aav载体或慢病毒载体。例如但不限于,pol iii依赖性r6k复制起点可以具有与选自由以下组成的群组的序列具有至少90%、至少95%、至少98%、至少99%或100%序列同一性的序列:seq id no:43、seq id no:44、seq id no:45、seq id no:46和seq id no:60(来自wo2019/183248的seq id no:1-4和18)。例如但不限于,rna-out选择性标记可以是与seq id no:47或seq id no:49(来自wo 2019/183248的seq id no:5和7)具有至少95%、至少98%、至少99%或100%序列同一性的rna-in调节rna-out功能变体。进一步例如,rna-out选择性标记可以是rna-out反义阻遏物rna。例如但不限于,rna-out反义阻遏物rna可具有与wo 2019/183248的seq id no:6(seq id no:48)具有至少90%、至少95%、至少98%、至少99%或100%序列同一性的序列。
[0211]
应当理解,活力或产量降低突变是指相对于在相同培养条件下衍生突变细胞系的细胞系,分别降低细胞系的活力或产量的突变。应当理解,此类突变可以是工程化的或天然存在的。
[0212]
如本文所公开的,用于基因敲除或敲低的方法在本领域中是熟知的,包括例如但不限于在本文的实例中公开的方法(重组工程),以及p1噬菌体转导、基因组质量转移和crispr/cas9。应当理解,基因敲除可以导致消除蛋白质的表达或非功能性蛋白质的表达。因此,sbccd复合物可能存在或可能不存在于本公开的细菌宿主菌株中,然而,如果存在,则该复合物在敲除的情况下是无功能的或在敲低的情况下具有降低的作为核酸酶的活性。应当理解,本公开的实施例可以包括sbcc、sbcd或两者的敲除或敲低。
[0213]
不受理论束缚,预计单独敲除sbcc或sbcd足以实现本发明的所需效果,因为这两种蛋白质都是sbccd核酸酶的必须亚基(connelly jc和leach dr,《基因细胞(genes cells)》1:285,1996)。大肠杆菌的sbcc和sbcd基因编码参与回文无活力和基因重组的核酸酶。(connelly jc和leach dr,《基因细胞(genes cells)》1:285,1996)。
[0214]
应当理解,在本公开内,工程化的大肠杆菌宿主细胞可以包括如本文所述的载体。载体可以包括任何合适的载体,包括在通过引用并入本文的那些参考文献中描述的那些。例如,在一些情况下,载体可以包括结构化的dna序列。在其他情况下,载体不能包括结构化的dna序列。
[0215]
在一些实施例中,工程化的大肠杆菌宿主细胞可以进一步包括如本公开所理解的载体。此类载体可以是天然存在的或工程化的。本公开的工程化的大肠杆菌宿主细胞中包括的载体可以包括本文讨论的任何特征以及通过引用并入的文件中的任何特征。本公开的工程化的大肠杆菌宿主细胞中包括的载体可以例如包括至少一个反向重复序列,例如反向末端重复序列或回文、同向重复序列或不包括前述结构化dna序列。
[0216]
生产工程化的大肠杆菌宿主细胞的方法
[0217]
在一些实施例中,提供了一种用于产生工程化的大肠杆菌宿主细胞的方法,该方法包括在起始大肠杆菌细胞中敲除至少一种选自由sbcc和sbcd组成的群组的基因以产生工程化的大肠杆菌宿主细胞的步骤,该起始大肠杆菌细胞不包括sbcb、recb、recd和recj中的任一种中的工程化的活力或产量降低突变。在一些实施例中,提供了用于产生工程化的大肠杆菌宿主细胞的方法,该方法包括在起始大肠杆菌细胞中敲除至少一种选自由sbcc和
sbcd组成的群组的基因以产生工程化的大肠杆菌宿主细胞的步骤,该起始大肠杆菌细胞不包括sbcb、recb、recd和recj中的任一种中的任何工程化突变。在一些实施例中,提供了用于产生工程化的大肠杆菌宿主细胞的方法,该方法包括在起始大肠杆菌细胞中敲除至少一种选自由sbcc和sbcd组成的群组的基因以产生工程化的大肠杆菌宿主细胞的步骤,该起始大肠杆菌细胞不包括sbcb、recb、recd和recj中的任一种中的任何突变。
[0218]
在任何前述实施例中,起始大肠杆菌细胞可以不包括在uvrc、mcra、mcrbc-hsd-mrr及其组合中的至少一种中的任何工程化的活力或产量降低突变。在任何前述实施例中,起始大肠杆菌细胞可以不包括在uvrc、mcra、mcrbc-hsd-mrr及其组合中的至少一种中的任何突变。在任何前述实施例中,起始大肠杆菌细胞可以不包括在uvrc、mcra、mcrbc-hsd-mrr及其组合中的至少一种中的任何突变。
[0219]
在任何前述实施例中,敲除至少一种基因的步骤不会导致sbcb、recb、recd和recj的任何突变。在任何前述实施例中,敲除至少一种基因的步骤不会导致uvrc、mcra、mcrbc-hsd-mrr及其组合中的至少一种中的任何突变。
[0220]
在任何前述实施例中,工程化的大肠杆菌宿主细胞可以不包括在uvrc、mcra、mcrbc-hsd-mrr及其组合中的至少一种中的工程化的活力或产量降低突变。在任何前述实施例中,工程化的大肠杆菌宿主细胞可以不包括在uvrc、mcra、mcrbc-hsd-mrr及其组合中的至少一种中的工程化突变。在任何前述实施例中,工程化的大肠杆菌宿主细胞可以不包括在uvrc、mcra、mcrbc-hsd-mrr及其组合中的至少一种中的任何突变。
[0221]
在任何前述实施例中,工程化的大肠杆菌宿主细胞可以不包括在sbcb、recb、recd和recj中的工程化的活力或产量降低突变。在任何前述实施例中,工程化的大肠杆菌宿主细胞可以不包括在sbcb、recb、recd和recj中的工程化突变。在任何前述实施例中,工程化的大肠杆菌宿主细胞可以不包括在sbcb、recb、recd和recj中的任何突变。
[0222]
在任何前述实施例中,工程化的大肠杆菌宿主细胞不包括功能性sbccd复合物。在任何前述实施例中,工程化的大肠杆菌宿主细胞不产生sbccd复合物。可替代地,在一些实施例中,工程化的大肠杆菌宿主细胞产生非功能性sbccd复合物。
[0223]
应当理解,在任何前述方法实施例中,工程化的大肠杆菌宿主细胞可以是本公开的任何大肠杆菌宿主细胞。
[0224]
在任何前述实施例中,sbcc基因可以包括与seq id no:9具有至少90%、至少95%、至少98%、至少99%或100%序列同一性的序列。在任何前述实施例中,sbcd基因可以包括与seq id no:10具有至少90%、至少95%、至少98%、至少99%或100%序列同一性的序列。应当理解,这可以在基因敲除或敲低之前或之后(即在工程化的大肠杆菌宿主细胞中)应用于基因。
[0225]
在任何前述实施例中,sbcb基因可以包括与seq id no:11具有至少95%、至少98%、至少99%或100%序列同一性的序列。在任何前述实施例中,recb基因可以包括与seq id no:12具有至少95%、至少98%、至少99%或100%序列同一性的序列。在任何前述实施例中,recd基因可以包括与seq id no:13具有至少95%、至少98%、至少99%或100%序列同一性的序列。在任何前述实施例中,recj基因可以包括与seq id no:65具有至少95%、至少98%、至少99%或100%序列同一性的序列。
[0226]
在任何前述实施例中,uvrc基因可以包括与seq id no:14具有至少95%、至少
98%、至少99%或100%序列同一性的序列。在任何前述实施例中,mcra基因可以包括与seq id no:15具有至少95%、至少98%、至少99%或100%序列同一性的序列。在任何前述实施例中,mcrbc-hsd-mrr基因可以包括与seq id no:16-21具有至少95%、至少98%、至少99%或100%序列同一性的序列。
[0227]
载体生产方法
[0228]
在一些实施例中,提供了用于改善的载体生产的方法,该方法包括用载体转染工程化的大肠杆菌宿主细胞,产生转染的宿主细胞,并在足以复制载体的条件下孵育转染的宿主细胞的步骤,其中大肠杆菌宿主细胞不包括在sbcb、recb、recd和recj中的任一种中的工程化的活力或产量降低突变。应当理解,用于转染工程化的大肠杆菌宿主细胞的载体可以是本公开所述的任何载体,包括所公开的其中本公开的工程化的大肠杆菌宿主细胞包括载体的实施例。
[0229]
在一些实施例中,提供了用于改善的载体生产的方法,该方法包括孵育转染的宿主细胞和在足以复制载体的条件下孵育转染的宿主细胞的步骤,该宿主细胞是工程化的大肠杆菌宿主细胞,其包括载体并且不包括包括载体的在sbcb、recb、recd和recj中的任一种中的工程化的活力或产量降低突变。
[0230]
在任何前述实施例中,应当理解,工程化的大肠杆菌宿主细胞可以是本公开的任何工程化的大肠杆菌宿主细胞。
[0231]
在任何前述实施例中,该方法可以进一步包括从转染的宿主细胞中分离载体。
[0232]
在任何前述实施例中,孵育转染的宿主细胞的步骤,无论是转染时还是用载体转染后孵育,都可以通过补料分批发酵进行,其中补料分批发酵包括在补料分批阶段的第一部分期间使工程化的大肠杆菌宿主细胞在降低的温度下生长,这可能处于生长限制条件下,然后在补料分批阶段的第二部分期间使温度上移到更高的温度。例如,降低的温度可以是约28℃-30℃并且更高的温度可以是约37℃-42℃。例如,第一部分可以是约12小时,并且第二部分可以是约8小时。应当理解,在使用温度升高的补料分批发酵的情况下,工程化的大肠杆菌宿主细胞可以具有λ阻遏物和在p
l
启动子控制下的rep蛋白,p
l
启动子可以由λ阻遏物调节,该调节可以是温度敏感的。
[0233]
在任何前述实施例中,在足以复制载体的条件下孵育转染的宿主细胞后的质粒产量可以高于在相同条件下处理的衍生工程化的大肠杆菌宿主细胞的细胞系的质粒产量。在任何前述实施例中,在足以复制载体的条件下孵育转染的宿主细胞后的质粒产量可以高于在相同条件下处理的sure2、sure、stbl2、stbl3或stbl4细胞的质粒产量。
[0234]
在任何前述实施例中,sbcc基因可以包括与seq id no:9具有至少90%、至少95%、至少98%、至少99%或100%序列同一性的序列。在任何前述实施例中,sbcd基因可以包括与seq id no:10具有至少90%、至少95%、至少98%、至少99%或100%序列同一性的序列。应当理解,这可以在基因敲除或敲低之前或之后(即在工程化的大肠杆菌宿主细胞中)应用于基因。
[0235]
在任何前述实施例中,sbcb基因可以包括与seq id no:11具有至少95%、至少98%、至少99%或100%序列同一性的序列。在任何前述实施例中,recb基因可以包括与seq id no:12具有至少95%、至少98%、至少99%或100%序列同一性的序列。在任何前述实施例中,recd基因可以包括与seq id no:13具有至少95%、至少98%、至少99%或100%序列
同一性的序列。在任何前述实施例中,recj基因可以包括与seq id no:65具有至少95%、至少98%、至少99%或100%序列同一性的序列。
[0236]
在任何前述实施例中,uvrc基因可以包括与seq id no:14具有至少95%、至少98%、至少99%或100%序列同一性的序列。在任何前述实施例中,mcra基因可以包括与seq id no:15具有至少95%、至少98%、至少99%或100%序列同一性的序列。在任何前述实施例中,mcrbc-hsd-mrr基因可以包括与seq id no:16-21具有至少95%、至少98%、至少99%或100%序列同一性的序列。
[0237]
应当理解,在任何前述实施例中,转染到工程化的大肠杆菌宿主细胞中的载体可以是本文所述的任何载体。
[0238]
应当理解,在任何前述实施例中,工程化的大肠杆菌宿主细胞可以包括sbcc、sbcd或两者的敲低,而不是敲除。敲低可导致sbccd复合物的表达降低和/或活性降低。该降低可以是至少10%、至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、至少90%、至少95%、至少98%、至少99%或更多。
[0239]
现在将参考以下非限制性实例描述本公开的细菌宿主菌株和方法。
[0240]
实例
[0241]
大多数治疗性质粒使用puc起点,其是pmb1起点的高拷贝衍生物(与cole1起点密切相关)。对于pmb1复制,质粒dna合成是单向的,并且不需要质粒携带的起始蛋白。puc起点是pmb1起点的复制衍生物,其删除了附属的rop(rom)蛋白,并具有使rnai/rnaii相互作用不稳定的额外温度敏感突变。将含有这些起点的培养物从30℃转移到42℃会导致质粒拷贝数增加。puc质粒可以在多种大肠杆菌细胞系中产生。
[0242]
在以下实例中,使用用于摇瓶生产的专有质粒+摇动培养基。种菌培养物自甘油原液或菌落开始,并划线到含有50μg/ml抗生素(用于ampr或kanr选择质粒)或6%蔗糖(用于rna-out选择质粒)的lb培养基琼脂板上。使板在30℃-32℃下生长;将细胞重新悬浮在培养基中并用于为500ml质粒+摇瓶提供大约2.5od
600
接种物,该烧瓶含有用于ampr或kanr选择质粒的50μg/ml抗生素或选择用于rna-out质粒的0.5%蔗糖。使烧瓶在所示的生长温度下在摇动下生长至饱和。
[0243]
在以下实例中,在所述new brunswick bioflo 110生物反应器(美国专利号7,943,377,通过引用以其整体并入本文)中使用专有的补料分批培养基(ntc3019,hypergro培养基)进行hypergro发酵。菌种培养物自甘油原液或菌落开始,并划线到含有50μg/ml抗生素(用于ampr或kanr选择质粒)或6%蔗糖(用于rna-out选择质粒)的lb培养基琼脂板上。使板在30℃-32℃下生长;将细胞重新悬浮在培养基中并用于为发酵提供大约0.1%接种物,该发酵含有用于ampr或kanr选择质粒的50μg/ml抗生素或用于rna-out质粒的0.5%蔗糖。hypergro温度变化如所示的。
[0244]
在以下实例中,在所有发酵期间的关键点和定期间隔处采集培养物样品。立即分析样品的生物量(od
600
)和质粒产量。在确定质粒产量时,通过定量获自美国专利号7,943,377中描述的qiagen spin miniprep试剂盒制剂的质粒进行分析。简而言之,将细胞碱裂解、澄清,将质粒进行柱纯化,并在定量前洗脱。质粒质量通过琼脂糖凝胶电泳分析(age)确定,并在美国专利号7,943,377中描述的0.8-1% tris/乙酸盐/edta(tae)凝胶上进行。
[0245]
以下实例中使用的菌株包括:
att
λ
::p
c-rna-in-sacb,catr;att
hk022
::pl(ol1-g到t)p42l-p106l-f107s(p3-),specr strepr。据报道,生产产量高达695mg/l。
[0254]
在williams 2019改善产量的病毒和非病毒纳米质粒载体(viral and non-viral nanoplasmid vectors with improved production)国际专利申请wo 2019/183248中创建并公开了另外的r6k起点
‘
copy cutter’宿主细胞系,包括:
[0255]
ntc940211的ntc1050811 dh5αatt
λ
::p
c-rna-in-sacb,catr;att
hk022
::pl(ol1-g到t)p42l-p106i-f107s p113s(p3-),specr strepr;::para-ci857ts,tetr=para-ci857ts衍生物。这种
‘
copy cutter’宿主菌株含有阿拉伯糖诱导型ci857ts基因的噬菌体附着位点染色体整合拷贝。向板或培养基中添加阿拉伯糖(例如,至0.2-0.4%终浓度)诱导para介导的ci857ts阻遏物表达,其通过ci857ts介导的表达pl启动子的rep蛋白的下调在30℃降低拷贝数[即,额外的ci857ts介导pl(ol1-g到t)启动子在30℃更有效的下调]。温度转变到37℃-42℃后的拷贝数诱导不会受到损害,因为ci857ts阻遏物在这些升高的温度下失活。dcm-衍生物(ntc1050811dcm-)用于不希望dcm甲基化的情况。ntc 1050811-hf是ntc 1050811细胞系的衍生物,其包括rna-in-sacb表达盒的第二个拷贝,并且不包括在sbcb、recb、recd、recj、uvrc、mcra或mcrbc-hsd-mrr中的突变。
[0256]
在每种情况下,两种菌株(ntc 1050811和ntc 1050811-hf)都含有阿拉伯糖诱导型ci857ts基因的噬菌体附着位点染色体整合拷贝。向板或培养基中添加阿拉伯糖(例如,至0.2-0.4%终浓度)诱导para介导的ci857ts阻遏物表达,其通过ci857ts介导的表达pl启动子的rep蛋白的下调在30℃降低拷贝数[即,额外的ci857ts介导pl(ol1-g到t)启动子在30℃更有效的下调],温度转变到37℃-42℃后的拷贝数诱导不会受到损害,因为ci857ts阻遏物在这些升高的温度下失活。这些“copy cutter宿主菌株”通过在30℃降低拷贝数来增加r6k载体温度上移拷贝数诱导比。这有利于生产大的、有毒的或易于二聚化的r6k起点载体。
[0257]
与wo 2014/035457中描述的三重突变体热诱导型pl(ol1-g到t)p42l-p106l-f107s(p3-)相比,wo 2019/183248中描述的四重突变体热诱导型pl(ol1-g到t)p42l-p106i-f107s p113s(p3-)改善了nanoplasmid
tm
生产产量。使用四重突变体ntc1050811细胞系(wo 2019/183248)获得了超过2g/l的nanoplasmid
tm
产量。
[0258]
使用条件性复制起点如需要专门细胞系进行繁殖的这些r6k起点增加了安全范围,因为如果转移到患者的内源性菌群中,载体将不会复制。
[0259]
修饰wo 2019/183248中描述的rna-out生产宿主以产生hf宿主。sacb(枯草芽孢杆菌果聚糖蔗糖酶)是反选择性标记,其在存在蔗糖的情况下对大肠杆菌细胞是致命的。sacb从rna-in-sacb转录物的翻译被质粒编码的rna-out抑制。这通过抑制sacb介导的致死性而有助于在存在蔗糖的情况下的质粒选择。消除sacb表达的rna-in-sacb表达盒的染色体拷贝突变是蔗糖抗性的(在不存在质粒的情况下)。rna-in-sacb表达盒的第二个拷贝的存在显著减少了蔗糖抗性(在不存在质粒的情况下)菌落的数量,因为每个单独的rna-in-sacb表达盒拷贝在不存在质粒的情况下介导蔗糖致死性,rna-in-sacb表达盒的两个染色体拷贝的非常罕见的突变对于在不存在质粒的情况下获得蔗糖抗性是必要的。
[0260]
还使用ntc1011592 stbl4 attλ::p
c-rna-in-sacb,catr(wo 2019/183248)。
[0261]
在以下实例中,未改变的生产菌株包括:dh5α、sure2、stbl2、stbl3或stbl4。
[0262]
实例1:sbccd敲除菌株的制备
[0263]
如datsenko和wanner,《美国科学院院报(pmas usa)》97:6640-6645(2000)中所述,使用red gam重组克隆产生sbccd敲除菌株。用以下引物对pkd4质粒(datsenko和wanner,2000)进行pcr扩增,以引入sbcc和sbcd靶向同源臂。
[0264]
seq id no1(sbccr-pkd4):
[0265][0266]
seq id no2(sbcdf-pkd4):
[0267][0268]
对1.6 kb pcr产物(seq id no:5,
[0269]
tctgtttgggtataatcgcgcccatgctttttcgccagggaaccgttatgtgtaggctggagctgcttcgaagttcctatactttctagagaataggaacttcggaataggaacttcaagatcccctcacgctgccgcaagcactcagggcgcaagggctgctaaaggaagcggaacacgtagaaagccagtccgcagaaacggtgctgaccccggatgaatgtcagctactgggctatctggacaagggaaaacgcaagcgcaaagagaaagcaggtagcttgcagtgggcttacatggcgatagctagactgggcggttttatggacagcaagcgaaccggaattgccagctggggcgccctctggtaaggttgggaagccctgcaaagtaaactggatggctttcttgccgccaaggatctgatggcgcaggggatcaagatctgatcaagagacaggatgaggatcgtttcgcatgattgaacaagatggattgcacgcaggttctccggccgcttgggtggagaggctattcggctatgactgggcacaacagacaatcggctgctctgatgccgccgtgttccggctgtcagcgcaggggcgcccggttctttttgtcaagaccgacctgtccggtgccctgaatgaactgcaggacgaggcagcgcggctatcgtggctggccacgacgggcgttccttgcgcagctgtgctcgacgttgtcactgaagcgggaagggactggctgctattgggcgaagtgccggggcaggatctcctgtcatctcaccttgctcctgccgagaaagtatccatcatggctgatgcaatgcggcggctgcatacgcttgatccggctacctgcccattcgaccaccaagcgaaacatcgcatcgagcgagcacgtactcggatggaagccggtcttgtcgatcaggatgatctggacgaagagcatcaggggctcgcgccagccgaactgttcgccaggctcaaggcgcgcatgcccgacggcgaggatctcgtcgtgacccatggcgatgcctgcttgccgaatatcatggtggaaaatggccgcttttctggattcatcgactgtggccggctgggtgtggcggaccgctatcaggacatagcgttggctacccgtgatattgctgaagagcttggcggcgaatgggctgaccgcttcctcgtgctttacggtatcgccgctcccgattcgcagcgcatcgccttctatcgccttcttgacgagttcttctgagcgggactctggggttcgaaatgaccgaccaagcgacgcccaacctgccatcacgagatttcgattccaccgccgccttctatgaaaggttgggcttcggaatcgttttccgggacgccggctggatgatcctccagcgcggggatctcatgctggagttcttcgcccaccccagcttcaaaagcgctctgaagttcctatactttctagagaataggaacttcggaataggaactaaggaggatattcatatgagtacgtttgcagtgaaataactattcagcaggataatgaatacagaggg)(图1a)进行纯化和dpni消化(以去除模板质粒)。用pkd46-recapa重组工程化质粒(wo2008/153731,通过引用以其整体并入本文)转化其中待敲除sbccd基因的宿主菌株,并选择用于氨苄青霉素抗性的转化子。转化细胞系的电感受态细胞通过在包括50μg/ml氨苄青霉素的lb培养基中生长来制备,od
600
约为0.05,将阿拉伯糖添加至0.2%以诱导重组工程化基因表达,使细胞生长至对数中期,并且电感受态细胞通过在1/200原始体积的10%甘油中离心和再悬浮来制备。将5μl dpni消化的、纯化的pcr产物电穿孔到25μl电感受态细胞中,然后加入1ml soc培
养基。使铺在含有20μg卡那霉素的lb琼脂板上的细胞在30℃过度生长2小时,并在37℃生长过夜。如下所述,通过使用sbcdf和sbccr引物筛选单个kanr菌落的δsbcdc::kanr。
[0270]
seq id no 3(sbcdf引物):cgtctcgccatgatttgccctg
[0271]
seq id no 4(sbccr引物):cgttatgcgccagctccgtgag
[0272]
宿主:sbcdf和sbccr引物的产物=4.8kb(图1b)(seq id no:6,
[0273]
[0274]
[0275][0276]
宿主δsbcdc::kanr:sbcdf和sbccr引物的产物=1.9kb(图1c)(seq id no:7,
[0277]
[0278][0279]
通过在37℃-42℃生长将温度敏感性pkd46-recapa质粒从细胞系中固化。还验证了单个kanr菌落的氨苄青霉素敏感性。
[0280]
对于抗生素抗性质粒的宿主菌株(例如puc复制起点;抗生素选择;r6k复制起点;抗生素选择),如所述(datsenko和wanner,同上文,2000),使用frt重组从δsbcdc::kanr去除kanr染色体标记。简而言之,δsbcdc::kanr细胞系用pcp20 frt质粒(datsenko和wanner,同上文,2000)转化,并且转化子在30℃生长并选择氨苄青霉素抗性。在lb培养基板(不含氨苄青霉素)上将单独菌落划线为单一菌落,并在43℃下生长以固化温度敏感性pcp20质粒。将43℃lb板上的单一菌落划线到lb amp和lb kan板上,以分别验证丢失ampr pcp20质粒和kanr切除。使用sbcdf和sbccr引物,通过pcr筛选单独amp和kan敏感性菌落的δsbcdc(图1d)。对于sbcdf引物和sbccr引物的pcr产物,大小为0.53kb,如图1d(seq id no:8)所示。
[0281]
对于dh5α,起始菌株具有以下基因型:f-δ(laczya-argf)u169 reca1 enda1 hsdr17(r
k-,mk+)gal-phoa supe44λ-thi-1gyra96 rela1。在敲除sbccd和kanr切除后,敲除菌株(dh5α[sbccd-])具有以下基因型:f-δ(laczya-argf)u169 reca1 enda1 hsdr17(r
k-,mk+)gal-phoa supe44λ-thi-1gyra96 rela1δsbcdc。
[0282]
如wo 2014/035457所述,通过将热诱导型r6k rep蛋白盒(att
hk022
::pl(ol1-g到t)
p42l-p106i-f107s p113s(p3-),specr strepr)整合入宿主基因组,来从dh5α[sbccd-]产生另外的菌株以产生新菌株dh5αr6k rep[sbccd-],其具有以下基因型:dh5αatt
hk022
::pl(ol1-g到t)p42l-p106i-f107s p113s(p3-),specr strepr;δsbcdc。该菌株可用于生产具有r6k细菌复制起点的质粒。
[0283]
具有rna-out选择的r6k复制起点。此外,也通过相同方法处理如wo 2019/183248中公开的具有基因型dh5αatt
λ
::p
c-rna-in-sacb,catr;att
hk022
::pl(ol1-g到t)p42l-p106i-f107s p113s(p3-),specr strepr;::para-ci857ts,tetr的ntc1050811,以敲除sbcdc,但不切除kanr,从而产生具有dh5αatt
λ
::p
c-rna-in-sacb,catr;att
hk022
::pl(ol1-g到t)p42l-p106i-f107s p113s(p3-),specr strepr;::para-ci857ts,tetrδsbcdc::kanr基因型的ntc1300441(dh5αδsbcdc)(sbccd敲除copy cutter宿主菌株衍生物)。ntc 1050811-hf是ntc 1050811的衍生物,其包括rna-in-sacb表达盒的第二个拷贝,没有在sbcb、recb、recd、recj、uvrc和mcra中的突变,ntc 1050811-hf也用于通过相同方法生成敲除菌株,从而产生未切除kanr的ntc 1050811-hf[sbccd-]。
[0284]
具有rna-out选择的puc复制起点。此外,ntc4862-hf是wo 2008/153733中公开的ntc4862的衍生物,其包括rna-in-sacb表达盒的第二个拷贝,并且不具有在sbcb、recb、recd、recj、uvrc和mcra中的突变,ntc4862-hf用于通过相同方法生成敲除菌株以产生未切除kanr的ntc4862-hf[sbccd-]。
[0285]
实例2:具有大回文载体的sbccd敲除菌株性能
[0286]
评价具有大回文载体的sbccd敲除菌株的性能,包括评价摇瓶和hypergro生产。
[0287]
用aav载体paav-gfp nanoplasmid
tm
(paav-gfp np)转化ntc1011641(基因型:stbl4 att
λ
::pc-rna-in-sacb,catr;atth
k022
::pl p42l-p106l-f107s(p3-)specr strepr,如wo 2019/183248所公开的)和ntc1300441(基因型:dh5αatt
λ
::p
c-rna-in-sacb,catr;att
hk022
::pl(ol1-g到t)p42l-p106i-f107s p113s(p3-),specr strepr;::para-ci857ts,tetrδsbcdc::kanr),该载体包括具有r6k细菌复制起点和rna-out选择的间隔区以及回文aav itr和paav-gfp迷你内含子质粒(paav-gfp mip),该质粒含有内含子r6k细菌复制起点和rna-out选择以及具有4个碱基对的间插序列的140个碱基对的反向重复序列。
[0288]
lu j,williams ja,luke j,zhang f,chu k和kay ma.2017.《人类基因疗法(human gene therapy)》28:125-34公开了无抗生素迷你内含子质粒(mip)aav载体,并建议mip内含子aav载体可以去除载体骨架以创建短骨架aav载体。尝试在具有内含子r6k起点和rna-out选择性标记的迷你内含子质粒aav载体(内含子纳米质粒载体)中创建类似小环的间隔区是有毒的,这可能是由于aav itr的此类紧密并置创建了140bp的长反向重复序列(例如,paav-gfp mip;参见表2)。相比之下,paav-gfp mip在dh5αδsbcdc宿主菌株中是可回收的,并且具有出色的摇瓶生产产量(参见表2)。对于每个aav itr,aav itr具有由43bp隔开的26bp的回文序列。
[0289]
表2:dh5αsbccd宿主菌株使140bp反向重复序列载体能够具有活力
[0290][0291][0292]
生产条件:500ml质粒+培养,30℃,12小时,移至37℃,8小时。
[0293]a具有间隔区r6k起点和rna-out选择的纳米质粒载体。
[0294]b具有内含子r6k起点和rna-out选择的纳米质粒载体。
[0295]
这种在dh5αδsbcdc宿主菌株中的活力恢复不限于nanoplasmid
tm
载体。这通过puc起点kanr选择aav辅助质粒的稳健生长和hypergro质粒生产得到证明,该辅助质粒含有85bp反向重复序列,并且在dh5αδsbcdc中具有17个碱基对的间插序列,但在dh5α中没有(表3)。
[0296]
表3:fd6反向重复序列衍生aav辅助质粒的hypergro发酵生产
[0297][0298]a30℃,在55od600移至42℃,持续9小时,保持在25℃
[0299]bfd6 ad辅助载体和衍生物含有3'腺病毒末端重复序列和相邻的5'腺病毒末端重复序列的一部分,从而形成具有短间插环的85bp反向重复序列
[0300]
实例3:具有aav itr载体的sbccd敲除菌株性能:itr稳定性和摇瓶生产
[0301]
dh5αδsbcdc宿主菌株在稳定含有aav itr的载体中的应用通过aav载体转化的细胞系和生产批次的下一代序列确认来评价。
[0302]
aav itr是使用常规测序非常困难的序列(doherty等人,同上文,1993),但可以使用下一代测序准确测序(saveliev a liu j,li m,hirata l,latshaw c,zhang j,wilson jm.2018.通过illumina下一代测序对腺相关病毒质粒进行准确快速的序列分析(accurate and rapid sequence analysis of adeno-associated virus plasmid by illumina next generation sequencing).《人类基因治疗方法(hum gene ther methods)》29:201-211)。
[0303]
为了评价dh5αδsbcdc宿主菌株对aav itr的稳定,将2.4至5.4kb的九种不同aav itr纳米质粒载体转化为ntc1050811-hf[sbccd-]。通过smai消化筛选单独菌落的完整itr,然后将单一正确克隆提交给麻省总医院(mgh)ccib dna核心(cambridge ma)以进行由下一
代测序完成的全质粒测序。结果总结在下表4中并证明转化期间的itr稳定性(26个筛选菌落中的25个通过smai消化验证正确,其中10个中的9个(9个纳米质粒载体中的每一个)通过全质粒测序验证正确。在摇瓶中生产期间保持了itr稳定性(5个制剂中的5个通过全质粒测序验证正确))。这表明dh5αδsbcdc宿主菌株在转化和生产期间稳定了aav itr。
[0304]
表4:aav itr纳米质粒载体在ntc1050811-hf[sbccd-]中的稳定性
[0305][0306]
生产条件:500ml质粒+培养,30℃,12小时,移至37℃,8小时
[0307]
然后使用具有不同细菌骨架的标准化gfp aav2 egfp转基因载体评价dh5αδsbcdc宿主菌株在改善含有aav itr的载体生产中的应用,该骨架或者为:
[0308]
puc起点-抗生素选择aav载体(表5);
[0309]
puc起点-rna-out选择aav载体(表6);或者为
[0310]
r6k起点-rna-out选择aav纳米质粒载体(表7)
[0311]
表5:paav-gfp(5.4kb)(puc起点,ampr选择)摇瓶评价
[0312]
细胞系收获od
600
质粒产量mg/l质粒质量itr整合stbl486.3差:涂抹单体带√dh5α[sbccd-]146.4ccc单体√
[0313]
生产条件:500ml质粒+摇瓶培养;30℃,12小时,移至37℃,持续8小时
[0314]
表6:paav-gfp ntc8(4.0kb)(puc起点,rna-out选择)摇瓶评价
[0315][0316]
生产条件:500ml质粒+摇瓶培养;30℃,12小时,移至37℃,持续8小时
[0317]
表7:paav-gfp纳米质粒(3.3kb)(r6k起点,rna-out选择)摇瓶评价
[0318][0319]a烧瓶a含有500ml质粒+、5ml 50%蔗糖
[0320]
烧瓶b含有500ml质粒+、5ml 50%蔗糖、5ml 20%阿拉伯糖
[0321]b生产条件:30℃,12小时,移至37℃,持续8小时
[0322]
在stbl4与dh5αsbccd np宿主中评价另外一组三个较大的4.8-5.2kb aav纳米质粒载体(表8)。观察到dh5αsbccd宿主显著改善了产量和质量。
[0323]
表8:aav纳米质粒载体摇瓶生产stbl4与sbccd np宿主的比较
[0324][0325][0326]a500ml质粒+摇瓶培养
[0327]
总结:与具有aav itr载体、尤其是具有更大的编码aav itr载体的治疗性转基因的stbl4宿主相比,dh5αsbccd宿主显示出改善的质粒产生和/或质粒质量(表8)。
[0328]
实例4:具有aav itr载体的sbccd敲除菌株性能:hypergro发酵
[0329]
然后在hypergro发酵中利用以下物质评价dh5αδsbcdc宿主菌株在改善含有aav itr的载体生产中的应用:与stbl4纳米质粒宿主相比,在dh5αδsbcdc纳米质粒宿主中的3.3kb aav2 egfp转基因r6k起点-rna-out标记纳米质粒载体paav-gfp纳米质粒(在实例3摇瓶中评价);与stbl3相比,在dh5αδsbcdc中的12kb puc起点-kanr aav载体。结果总结在
表9和10中。
[0330]
表9:paav-gfp纳米质粒(3.3kb)(r6k起点,rna-out选择)hypergro发酵评价
[0331][0332][0333]a30℃,在55od600移至42℃,持续9小时,保持在25℃
[0334]b30℃,在55od600移至42℃,持续9小时,保持在25℃;培养基中含0.2%阿拉伯糖
[0335]
表10:paav载体(12kb puc起点-kanr)hypergro发酵评价
[0336][0337]a30℃,在55od600移至42℃,持续9小时,保持在25℃
[0338]b30℃
‑‑
》37℃升温,24-36小时
[0339]c30℃,在55od600移至37℃,直至od下降或裂解,保持在25℃
[0340]d30℃,在30小时时移至37℃,直至od下降或裂解,保持在25℃
[0341]
总结:与具有aav itr载体、尤其是具有更大的编码aav itr载体的治疗性转基因的stbl3或stbl4宿主相比,dh5αsbccd宿主显示出改善的质粒生产和/或质粒质量(表10)。
[0342]
实例5:具有含非回文的载体的sbccd敲除菌株性能
[0343]
评价dh5α[sbccd-]与dh5α的标准载体(12kb p辅助载体,puc起点-kanr选择)生产产量。结果表明,dh5α[sbccd-]在生产标准质粒方面优于dh5α。
[0344]
表11:p辅助载体(12kb puc起点-kanr)hypergro发酵评价
[0345]
质粒收获od600质粒产量mg/lp辅助-kanr(dh5α)94762p辅助-kanr(dh5α[sbccd-])1111230
[0346]
生产条件:30℃,在55od600移至42℃,持续9小时,保持在25℃
[0347]
这是出乎意料的,因为虽然sbccd敲除可以稳定回文,但预计不会改善不含回文的标准质粒的产量。
[0348]
实例6:与stbl4相比,dh5α[sbccd-]中质粒polya重复序列稳定性改善
[0349]
将编码a90重复序列的puc-ampr质粒载体转化到stbl4或dh5α[sbccd-]中,并通过测序确定来自每个转化的4个单独菌落中的a90重复序列的稳定性。所有4个stbl4菌落都缺少至少20bps的a90重复序列(即所有4个菌落均《a70),而所有4个dh5α[sbccd-]菌落均》a70
且2/4具有完整的a90重复序列。这表明与本领域中的稳定宿主相比,dh5α[sbccd-]稳定了简单重复序列。这是出乎意料的,因为预计sbccd敲除不会稳定简单重复序列。
[0350]
将编码a117重复序列的质粒载体转化到dh5α[sbccd-]和ntc1050811-hf[sbccd-]中,并通过测序确定a117重复序列的稳定性。在实例4中的hypergro条件下,将细胞在30℃培养12小时并在24eft升温至37℃直到od下降或观察到裂解,然后将细胞保持在25℃。如下表12所示,所有转化的细胞系(2个dh5α[sbccd-]、2个ntc1050811-hf[sbccd-])均具有完整的a117重复序列和高产量。这是出乎意料的,因为预计sbccd敲除不会稳定简单重复序列。
[0351]
表12:工程化大肠杆菌宿主细胞中的a117重复序列稳定性和产量
[0352][0353]
对于编码a98-100和a99-100重复序列的质粒载体,在dh5α[sbccd-]、ntc4862-hf[sbccd-]和ntc1050811-hf[sbccd-]中使用相同的程序。所有转化的细胞系都具有完整的重复序列。所有转化的细胞系都具有完整的重复序列和高产量。这是出乎意料的,因为预计sbccd敲除不会稳定简单重复序列。
[0354]
表13:工程化大肠杆菌宿主细胞中的polya重复序列稳定性和产量
[0355][0356]
实例7:其他细胞系
[0357]
前述实例可以使用dh1、jm107、jm108、jm109、mg1655、xl1blue等细胞系进行重复,并且可以使用sure、sure2、stbl2、stbl3、stbl4和非sbcc、sbcd和/或sbccd敲除菌株。
[0358]
本文引用的所有参考文献,包含出版物、专利申请和专利特此以引用的方式并入本文中,其程度与每篇参考文献被单独并且具体地指明以通过引用并入并且在本文中整体阐述一样。
[0359]
除非另有说明,否则术语“包含(comprising)”、“具有(having)”、“包括(including)”和“含有(containing)”将被解释为开放式术语(即,是指“包括但不限于”)。除非本文中另有说明,否则本文中对值的范围的引述仅旨在用作个别地提及属于所述范围内的每个单独值的简写方法,并且每个单独值并入本说明书中,如同其在本文中个别地引用一样。除非本文中另外指明或明显与上下文相矛盾,否则本文所述的所有方法均可以以任何合适的顺序执行。除非另外声明,否则本文提供的任何和所有实例或示例性语言(例如,即,“如”)的使用仅旨在更好地阐明本发明,并且不对本发明的范围构成限制。说明书中的任何语言都不应被解释为指示任何未要求保护的元素对于本发明的实践是必不可少的。
[0360]
本文中描述了本发明的优选实施例,包括本发明人已知进行本发明的最佳模式。在阅读前文描述之后,那些优选实施例的变化对于本领域普通技术人员可以变得显而易见。发明人期望所属领域的技术人员视需要采用这样的变化形式,并且发明人希望本发明以不同于本文具体描述的其他方式来实施。因此,本发明包括适用法律所允许的随附权利要求书中所引述的主题的所有修改和等效物。此外,除非本文另外指示或另外明显与内容相矛盾,否则本发明涵盖上述要素以其所有可能的变化形式的任何组合。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1