用于增强丝状真菌细胞中的蛋白质产生的组合物和方法与流程
1.本公开总体上涉及分子生物学、生物化学、工业发酵、蛋白质产生、丝状真菌等领域。因此,本公开的某些实施例涉及突变型和/或经遗传修饰的丝状真菌细胞以及其用于产生目的蛋白的方法。
2.相关申请的交叉引用
3.本技术要求于2020年4月22日提交的美国临时专利申请号63/013,741的权益,将该申请通过引用以其全文并入本文。
4.序列表
5.与本文一起提交的序列表文本文件含有于2021年3月22日创建的文件“nb41754wopct_sequencelisting.txt”,该文件的大小为136千字节。本序列表符合37c.f.r.
§
1.52(e),并通过引用以其全文并入本文。
背景技术:
6.纤维素(木质纤维素植物材料的组分)是自然界中发现的最丰富的多糖。同样,本领域已知丝状真菌是植物生物质的有效降解物,并且实际上是工业上相关的木质纤维素降解酶(下文统称为“纤维素酶”的酶)的主要来源。例如,已知丝状真菌产生细胞外纤维素酶(例如,纤维二糖水解酶、内切葡聚糖酶、β-葡糖苷酶),其水解纤维素的β-(1,4)-连接的糖苷键以产生葡萄糖(即,因此赋予这些丝状真菌利用纤维素生长的能力)。特别地,已知丝状真菌里氏木霉(trichoderma reesei;t.reesei;真菌红褐肉座菌(hypocrea jecorina)的无性态)是纤维素酶的有效生产物(例如,参见pct国际申请号:wo 1998/15619、wo 2005/028636、wo 2006/074005、wo 1992/06221、wo 1992/06209、wo 1992/06183、wo 2002/12465等),因此,丝状真菌已经因为其能够产生对诸如纤维素衍生的乙醇、纺织品和服装的商品的生产有价值的酶而被用于洗涤剂、纤维、食品和饲料添加剂以及其他工业用途。
7.已知这些工业上相关的酶在木霉属(trichoderma)物种真菌细胞中的表达/产生取决于可用于生长的碳源。丝状真菌表达/产生纤维素酶是耗能的过程,因此,诱导和抑制机制都已经进化以确保这些酶的有效产生。例如,编码植物细胞壁材料降解所需酶(即,木质纤维素降解酶;例如,纤维素酶/半纤维素酶)的各种基因在“诱导”底物存在下被“激活”,并且在易于代谢的碳源(例如,d-葡萄糖)存在下被“抑制”,经由称为“碳分解代谢物抑制”(“ccr”)的机制所述易于代谢的碳源优于植物生物质。因此,纤维素酶基因被葡萄糖紧紧抑制并被纤维素和某些二糖(例如槐糖、乳糖、龙胆二糖)诱导数千倍。例如,与含有葡萄糖的培养基相比,在含有诱导碳源(诸如纤维素或槐糖)的培养基上主要纤维二糖水解酶1(cbh1)的表达水平上被“上调”数千倍(ilmen等人,1997)。
8.通常,典型地通过固体培养或浸没培养(包括分批、补料分批、和连续流动过程)进行丝状真菌(诸如木霉属)对酶/多肽的商业规模生产。例如,木霉属中工业纤维素酶生产中最成问题和最昂贵的方面之一是向木霉属物种宿主细胞提供适当的诱导物(即,诱导底物)。例如,与实验室规模实验的情况一样,商业规模上的纤维素酶(酶)生产通过在固体纤
维素(即,诱导底物)上使真菌细胞生长或通过在二糖诱导物(诸如“乳糖”(即,诱导底物))存在下培养细胞来“诱导”。
9.不幸的是,在工业规模上,两种“诱导”方法都有缺陷,导致与纤维素酶生产相关的高成本,因此,本领域对于由丝状真菌进行酶/多肽的有成本效益的商业规模生产,且不需要或不要求为这样的生产提供昂贵的诱导底物(例如,槐糖、乳糖等)仍然存在持续且未满足的需求。如本文所述和例证,本公开的突变型和/或经修饰的真菌细胞(菌株)非常适合用于工业规模发酵工艺,以在诱导底物存在或不存在下增强目的蛋白的表达/产生。
技术实现要素:
10.本公开的某些实施例涉及用于商业规模生产多肽的突变型和经遗传修饰的木霉属物种真菌细胞。更特别地,本公开的某些实施例涉及能够上调编码一种或多种木质纤维素降解酶的一种或多种基因的表达的新型变体ace3转录因子(tf)蛋白。因此,某些其他实施例针对编码本文公开的此种新型(即,变体)ace3转录因子(tf)蛋白的多核苷酸(核酸序列)。某些其他实施例涉及用于包含并表达本文公开的变体ace3转录因子(tf)蛋白的木霉属物种细胞(菌株)的构建、修饰测试、筛选、分离等的组合物和方法。
11.因此,本公开的某些实施例针对一种编码变体ace3 tf蛋白的经分离的多核苷酸,其中所述变体ace3 tf与seq id no:2的氨基酸位置1-672具有至少90%序列同一性,并且包含选自seq id no:2的位置673-689的一个或多个c末端氨基酸残基的遗传修饰。在相关实施例中,所述多核苷酸编码包含功能性n末端双核锌簇(zn2cys6)dna结合结构域的变体ace3 tf,所述dna结合结构域与seq id no:29具有至少90%序列同一性。在其他实施例中,选自seq id no:2的位置673-689的一个或多个c末端氨基酸残基的遗传修饰包含氨基酸缺失、氨基酸插入、氨基酸取代或其组合。
12.在所述多核苷酸的某些其他实施例中,一个或多个c末端氨基酸残基的所述遗传修饰包含缺失seq id no:2的至少最后七(7)个c末端氨基酸位置683-689、缺失seq id no:2的至少最后八(8)个c末端氨基酸位置682-689、缺失seq id no:2的至少最后九(9)个c末端氨基酸位置681-689、缺失seq id no:2的至少最后十(10)个c末端氨基酸位置680-689、缺失seq id no:2的至少最后十一(11)个c末端氨基酸位置679-689、缺失seq id no:2的至少最后十二(12)个c末端氨基酸位置678-689、缺失seq id no:2的至少最后十三(13)个c末端氨基酸位置677-689、缺失seq id no:2的至少最后十四(14)个c末端氨基酸位置676-689、缺失seq id no:2的至少最后十五(15)个c末端氨基酸位置675-689、缺失seq id no:2的至少最后十六(16)个c末端氨基酸位置674-689或缺失seq id no:2的至少最后十七(17)个c末端氨基酸位置673-689。
13.在某些实施例中,本公开的经分离的多核苷酸编码变体ace3 tf,所述变体ace3 tf与选自seq id no:9至seq id no:18中任一个的氨基酸序列具有至少90%序列同一性。
14.本公开的某些其他实施例涉及一种包含编码变体ace3转录因子(tf)蛋白的突变的ace3基因的经分离的木霉属物种突变型细胞,其中所述变体ace3 tf蛋白与seq id no:2的氨基酸位置1-672具有至少90%序列同一性,并且包含选自seq id no:2的位置673-689的一个或多个突变的c末端氨基酸残基。在某些实施例中,当突变型细胞在适用于产生木质纤维素降解酶的条件下发酵时,突变型细胞的变体ace3 tf蛋白在诱导底物不存在下上调
编码木质纤维素降解酶的基因的表达。
15.本公开的某些其他实施例涉及一种衍生自亲代木霉属物种细胞的经遗传修饰的木霉属物种真菌细胞,所述亲代木霉属物种细胞包含编码与seq id no:2具有至少90%序列同一性的ace3转录因子(tf)蛋白的ace3基因,其中所述经遗传修饰的细胞包含编码变体ace3 tf蛋白的经修饰的ace3基因,所述变体ace3 tf蛋白与seq id no:2的氨基酸位置1-672具有至少90%序列同一性,并且包含选自seq id no:2的位置673-689的一个或多个c末端氨基酸残基的遗传修饰。
16.本公开的某些其他实施例涉及一种衍生自亲代木霉属物种细胞的经遗传修饰的木霉属物种真菌细胞,所述亲代木霉属物种细胞包含编码与seq id no:4具有至少90%序列同一性的变体ace3转录因子(tf)蛋白的突变的ace3基因,其中seq id no:4的n末端不包含seq id no:29所示的完整的双核锌(zn2cys6)dna结合,其中所述经遗传修饰的细胞包含编码变体ace3 tf蛋白的经修饰的ace3基因,所述变体ace3tf蛋白与seq id no:2的位置1-672具有至少90%序列同一性,其中seq id no:2的n末端包含seq id no:29所示的完整的双核锌(zn2cys6)dna结合,并且所述变体ace3 tf蛋白包含选自seq id no:2的位置673-689的一个或多个c末端氨基酸残基的遗传修饰。
17.在某些其他实施例中,本公开涉及筛选变体ace3 tf蛋白的方法,所述变体ace3 tf蛋白在诱导底物不存在下诱导编码木质纤维素降解酶的基因的表达。在其他实施例中,本公开提供筛选变体ace3 tf蛋白的方法,所述变体ace3 tf蛋白在诱导底物不存在下诱导编码报告蛋白的基因的表达。在其他实施例中,本公开涉及在诱导底物不存在下在木霉属物种真菌细胞中产生木质纤维素降解酶的方法。在某些其他实施例中,本公开涉及在诱导底物不存在下在木霉属物种细胞中产生目的蛋白(poi)的方法。
附图说明
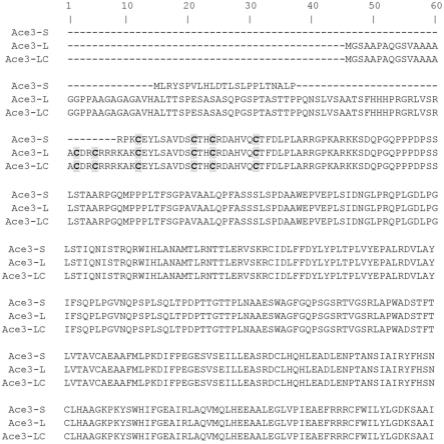
18.图1呈现了ace3-s蛋白(seq id no:4)、ace3-l蛋白(seq id no:6)和ace3-lc蛋白(seq id no:2)的氨基酸序列比对。如图1a所示,双核锌簇(zn2cys6)dna结合结构域的六(6)个n末端半胱氨酸氨基酸用灰色阴影半胱氨酸(c)表示。如图1a所呈现,ace3-s蛋白(seq id no:4)包含截短的n末端,其中锌(zn2cys6)dna结合结构域的六(6)个半胱氨酸残基中的两(2)个相对于ace3-l和ace3-lc蛋白的n末端缺少(缺失)。同样,如图1b所示,ace3-l蛋白的c末端相对于ace3-s和ace3-lc蛋白被截短,相对于ace3-l蛋白的以天冬氨酸(d)封端的截短的c末端,ace3-s和ace3-lc蛋白包含以甘氨酸(g)封端的野生型c末端。
19.图2显示了ace3-lc蛋白的氨基酸序列(图2a;seq id no:2),该氨基酸序列包含六百八十九(689)个氨基酸残基和在位置689处以甘氨酸(g)封端的野生型c末端。另外,图2显示了十六(16)种不同ace3蛋白的氨基酸序列,这些氨基酸序列包含增加的c末端截短(即,相对于野生型ace3-lc蛋白的c末端;seq id no:2)。如图2所呈现,ace3 c term-5蛋白(图2a;seq id no:7)包含六百八十四(684)个氨基酸残基和在位置684处以丝氨酸(s)封端的c末端处的五(5)个氨基酸截短(相对于wt ace3 c末端;seq id no:2),ace3 c term-6蛋白(图2a;seq id no:8)包含六百八十三(683)个氨基酸残基和在位置683处以苏氨酸(t)封端的c末端处的六(6)个氨基酸截短(相对于wt ace3 c末端;seq id no:2),ace3 c term-7蛋白(图2b;seq id no:9)包含六百八十二(682)个氨基酸残基和在位置682处以天冬酰胺(n)
封端的c末端处的七(7)个氨基酸截短(相对于wt ace3 c末端;seq id no:2),ace3 c term-8蛋白(图2b;seq id no:10)包含六百八十一(681)个氨基酸残基和在位置681处以精氨酸(r)封端的c末端处的八(8)个氨基酸截短(相对于wt ace3 c末端;seq id no:2),ace3 c term-9蛋白(图2b;seq id no:11)包含六百八十(680)个氨基酸残基和在位置680处以亮氨酸(l)封端的c末端处的九(9)个氨基酸截短(相对于wt ace3 c末端;seq id no:2),ace3 c term-10蛋白(图2c;seq id no:12)包含六百七十九(679)个氨基酸残基和在位置679处以谷氨酰胺(q)封端的c末端处的十(10)个氨基酸截短(相对于wt ace3 c末端;seq id no:2),ace3 c term-12蛋白(图2c;seq id no:13)包含六百七十七(677)个氨基酸残基和在位置677处以丝氨酸(s)封端的c末端处的十二(12)个氨基酸截短(相对于wt ace3 c末端;seq id no:2),ace3 c term-13蛋白(图2c;seq id no:14)包含六百七十六(676)个氨基酸残基和在位置676处以丙氨酸(a)封端的c末端处的十三(13)个氨基酸截短(相对于wt ace3 c末端;seq id no:2),ace3 c term-14蛋白(图2d;seq id no:15)包含六百七十五(675)个氨基酸残基和在位置675处以赖氨酸(k)封端的c末端处的十四(14)个氨基酸截短(相对于wt ace3 c末端;seq id no:2),ace3 c term-15蛋白(图2d;seq id no:16)包含六百七十四(674)个氨基酸残基和在位置674处以丝氨酸(s)封端的c末端处的十五(15)个氨基酸截短(相对于wt ace3 c末端;seq id no:2),ace3 c term-16蛋白(图2d;seq id no:17)包含六百七十三(673)个氨基酸残基和在位置673处以天冬氨酸(d)封端的c末端处的十六(16)个氨基酸截短(相对于wt ace3 c末端;seq id no:2),ace3c term-17蛋白(图2e;seq id no:18)包含六百七十二(672)个氨基酸残基和在位置672处以亮氨酸(l)封端的c末端处的十七(17)个氨基酸截短(相对于wt ace3 c末端;seq id no:2),ace3 c term-18蛋白(图2e;seq id no:19)包含六百七十一(671)个氨基酸残基和在位置671处以精氨酸(r)封端的c末端处的十八(18)个氨基酸截短(相对于wt ace3 c末端;seq id no:2),ace3 c term-19蛋白(图2e;seq id no:20)包含六百七十(670)个氨基酸残基和在位置670处以苏氨酸(t)封端的c末端处的十九(19)个氨基酸截短(相对于wt ace3 c末端;seq id no:2),ace3 c term-20蛋白(图2f;seq id no:21)包含六百六十九(669)个氨基酸残基和在位置669处以亮氨酸(l)封端的c末端处的二十(20)个氨基酸截短(相对于wt ace3 c末端;seq id no:2),并且ace3 c term-25蛋白(图2f;seq id no:22)包含六百六十四(664)个氨基酸残基和在位置664处以缬氨酸(v)封端的c末端处的二十五(25)个氨基酸截短(相对于wt ace3 c末端;seq id no:2)。
20.图3显示了ace3双核锌簇(zn2cys6)dna结合结构域的氨基酸序列(seq id no:29),该氨基酸序列包含六(6)个半胱氨酸(c)残基(以粗体和加下划线的c残基显示),其中该dna结合结构域位于ace3-lc蛋白(seq id no:2)和ace3-l(seq id no:6)蛋白的氨基酸位置73-109内。
21.图4显示了ace3-lc蛋白(例如,seq id no:2)的野生型c末端,所述野生型c末端在氨基酸位置六百八十九(689)处以甘氨酸(g)封端。如图4所呈现,以粗体文本显示的c末端氨基酸被赋予负数,其中最c末端的氨基酸位置(即,甘氨酸(g);位置689)被赋予负一(-1),位置685处的苏氨酸(t)被赋予负五(-5),位置680处的亮氨酸(l)被赋予负十(-10)等。如实例和一起的详细描述中一般描述,图4中用粗体c末端氨基酸和灰色阴影呈现的ace3蛋白的c末端氨基酸区域(即,-7(t)苏氨酸至-17(d)天冬氨酸)是特别适合遗传修饰(例如,截短、
内部缺失、插入、取代及其组合)的区域。
22.图5呈现了具有野生型c末端的ace3-lc(即,氨基酸位置641-689;seq id no:2)与ace3-lc c term-7蛋白的c末端(氨基酸位置641-682;seq id no:9)和ace3-lc c term-17蛋白(氨基酸位置641-672;seq id no:18)的比对。如图5所呈现,ace3蛋白的粗体加下划线的c末端氨基酸(dskasdqlrn)是特别适合遗传修饰(例如,截短、内部缺失、插入、取代及其组合)的区域。
23.图6是包含编码ace3蛋白的多核苷酸序列的质粒pyl72的示意图,该ace3蛋白包含以甘氨酸封端的野生型(即,全长)c末端(例如,ace3-lc蛋白;seq id no:2)。
24.图7显示了在诱导(乳糖;lac)和非诱导(葡萄糖;glu)条件下发酵的里氏木霉菌株的平均总分泌蛋白滴度。如图7所呈现,筛选的里氏木霉菌株包括对照菌株(rl-p37)、表达包含野生型c末端的ace3-lc蛋白(seq id no:2)的“c term-wt”菌株、表达包含五(5)个氨基酸c末端截短的变体ace3-lc蛋白(seq id no:7)的“c term-5”菌株、表达包含十(10)个氨基酸c末端截短的变体ace3-lc蛋白(seq id no:12)的“c term-10”菌株、表达包含十一(11)个氨基酸c末端截短的变体ace3-lc蛋白(seq id no:6)的“c term-11”菌株、表达包含十五(15)个氨基酸c末端截短的变体ace3-lc蛋白(seq id no:16)的“c term-15”菌株、表达包含二十(20)个氨基酸c末端截短的变体ace3-lc蛋白(seq id no:21)的“c term-20”菌株和表达包含二十五(25)个氨基酸c末端截短的变体ace3-lc蛋白(seq id no:22)的“c term-25”菌株。如图7所示,亲代对照菌株rl-p37只能在乳糖上(即,在诱导条件下)产生大量蛋白质,而在葡萄糖上(即,在非诱导条件下)产生最小基础水平的蛋白质。相反地,表达在c末端包含十(10)、十一(11)或十五(15)个氨基酸截短的ace3-lc变体(即,分别为seq id no:12、seq id no:6和seq id no:16)的子代菌株(细胞)展现在乳糖(诱导)和葡萄糖(非诱导)条件下蛋白质产生都增加。
25.图8显示了在诱导(乳糖;lac)和非诱导(葡萄糖;glu)条件下发酵的两(2)至四(4)个生物复制品的平均总分泌蛋白滴度和标准偏差。如图8所呈现,筛选的里氏木霉菌株包括对照菌株(rl-p37)、表达包含野生型c末端的ace3-lc蛋白(seq id no:2)的“c term-wt”菌株、表达包含五(5)个氨基酸c末端截短的变体ace3-lc蛋白(seq id no:7)的“c term-5”菌株、表达包含六(6)个氨基酸c末端截短的变体ace3-lc蛋白(seq id no:8)的“c term-6”菌株、表达包含七(7)个氨基酸c末端截短的变体ace3-lc蛋白(seq id no:9)的“c term-7”菌株、表达包含八(8)个氨基酸c末端截短的变体ace3-lc蛋白(seq id no:10)的“c term-8”菌株、表达包含九(9)个氨基酸c末端截短的变体ace3-lc蛋白(seq id no:11)的“c term-9”菌株、表达包含十(10)个氨基酸c末端截短的变体ace3-lc蛋白(seq id no:12)的“c term-10”菌株、表达包含十一(11)个氨基酸c末端截短的变体ace3-lc蛋白(seq id no:6)的“c term-11”菌株、表达包含十二(12)个氨基酸c末端截短的变体ace3-lc蛋白(seq id no:13)的“c term-12”菌株、表达包含十三(13)个氨基酸c末端截短的变体ace3-lc蛋白(seq id no:14)的“c term-13”菌株、表达包含十四(14)个氨基酸c末端截短的变体ace3-lc蛋白(seq id no:15)的“c term-14”菌株、表达包含十五(15)个氨基酸c末端截短的变体ace3-lc蛋白(seq id no:16)的“c term-15”菌株、表达包含十六(16)个氨基酸c末端截短的变体ace3-lc蛋白(seq id no:17)的“c term-16”菌株、表达包含十七(17)个氨基酸c末端截短的变体ace3-lc蛋白(seq id no:18)的“c term-17”菌株、表达包含十八(18)个氨基
酸c末端截短的变体ace3-lc蛋白(seq id no:19)的“c term-18”菌株、表达包含十九(19)个氨基酸c末端截短的变体ace3-lc蛋白(seq id no:20)的“c term-19”菌株、表达包含二十(20)个氨基酸c末端截短的变体ace3-lc蛋白(seq id no:21)的“c term-20”菌株和表达包含二十五(25)个氨基酸c末端截短的变体ace3-lc蛋白(seq id no:22)的“c term-25”菌株。
26.图9显示来自菌株t4abc(包含编码seq id no:6的ace3蛋白的ace3截短等位基因)、t4abc ace3_rev(包含编码具有野生型的ace3蛋白(全长c末端;seq id no:2)的回复ace3等位基因)和t4abc del-cbh1(包含cbh1(纤维二糖水解酶)基因的缺失)的总分泌蛋白滴度,其中在两(2)个独立的摇瓶(例如,烧瓶a和烧瓶b)中评价每种菌株。如图9所示,相对于编码ace3的截短形式的t4abc亲代菌株,当ace3突变在t4abc背景中回复以使得其编码全长ace3时,总分泌蛋白滴度降低73%。
27.图10是名为pratt346的ace3回复盒质粒的示意图。
28.图11是包含如下多核苷酸序列的质粒pa3l02的示意图,该多核苷酸序列编码在氨基酸位置673处具有突变的变体ace3-lc蛋白(seq id no:32)。
29.图12呈现了天然ace3-lc c末端(图12;ace3-lc氨基酸残基位置641至689;seq id no:2)与ace3-l(图12;ace3-l位置641至678;seq id no:6)、ace3-lc-v5(图12;ace3-lc-v5位置641至692;seq id no:67)和ace3-lc-v5(6xhis)(图12;ace3-lc-v5(6xhis)位置642-701;seq id no:69)的c末端的氨基酸序列比对。如图12所示,v5标签用粗体氨基酸残基指示,并且六(6)个组氨酸(his)标签用加下划线的h氨基酸残基表示,两者被三(3)个氨基酸“rtg”接头序列隔开。
30.图13是包含如下多核苷酸序列的质粒pyl18的示意图,该多核苷酸序列编码具有用v5表位标签进行的c末端氨基酸取代的变体ace3-lc蛋白(seq id no:67)。
31.图14显示了在诱导(glu/sop)条件和非诱导(glu)条件下发酵的里氏木霉菌株的总分泌蛋白滴度。
32.图15呈现了野生型ace3-lc蛋白(seq id no:2)的子序列,该子序列包含seq id no:30的全长(野生型)ace3-lc c末端氨基酸位置641-689。如图15(seq id no:30)所示,氨基酸位置呈现为s
641
至g
689
,其中大写字母表示氨基酸残基,并且后面的下标数字表示其位置。
33.生物序列的描述
34.seq id no:1是包含编码名为“ace3-lc”的ace3蛋白(seq id no:2)的基因的野生型里氏木霉多核苷酸序列。
35.seq id no:2是由seq id no:1编码的ace3-lc蛋白的氨基酸序列。
36.seq id no:3是包含编码名为“ace3-s”的ace3蛋白(seq id no:4)的基因的里氏木霉多核苷酸序列。
37.seq id no:4是由seq id no:3编码的ace3-s蛋白的氨基酸序列。
38.seq id no:5是包含编码名为“ace3-l”的ace3蛋白(seq id no:6)的基因的里氏木霉多核苷酸序列。
39.seq id no:6是由seq id no:5编码的ace3-l蛋白的氨基酸序列。
40.seq id no:7是名为“c-term-5”的变体ace3蛋白的氨基酸序列。
41.seq id no:8是名为“c-term-6”的变体ace3蛋白的氨基酸序列。
42.seq id no:9是名为“c-term-7”的变体ace3蛋白的氨基酸序列。
43.seq id no:10是名为“c-term-8”的变体ace3蛋白的氨基酸序列。
44.seq id no:11是名为“c-term-9”的变体ace3蛋白的氨基酸序列。
45.seq id no:12是名为“c-term-10”的变体ace3蛋白的氨基酸序列。
46.seq id no:13是名为“c-term-12”的变体ace3蛋白的氨基酸序列。
47.seq id no:14是名为“c-term-13”的变体ace3蛋白的氨基酸序列。
48.seq id no:15是名为“c-term-14”的变体ace3蛋白的氨基酸序列。
49.seq id no:16是名为“c-term-15”的变体ace3蛋白的氨基酸序列。
50.seq id no:17是名为“c-term-16”的变体ace3蛋白的氨基酸序列。
51.seq id no:18是名为“c-term-17”的变体ace3蛋白的氨基酸序列。
52.seq id no:19是名为“c-term-18”的变体ace3蛋白的氨基酸序列。
53.seq id no:20是名为“c-term-19”的变体ace3蛋白的氨基酸序列。
54.seq id no:21是名为“c-term-20”的变体ace3蛋白的氨基酸序列。
55.seq id no:22是名为“c-term-25”的变体ace3蛋白的氨基酸序列。
56.seq id no:23是核酸引物序列(tp218)。
57.seq id no:24是核酸引物序列(tp220)。
58.seq id no:25是核酸引物序列(tp125)。
59.seq id no:26是核酸引物序列(tp123)。
60.seq id no:27是核酸引物序列(tp221)。
61.seq id no:28是核酸引物序列(tp222)。
62.seq id no:29是ace3双核(zn2cys6)锌dna结合结构域的氨基酸序列。
63.seq id no:30包含定义“ace3-lc c末端”的氨基酸残基位置641至689。
64.seq id no:31是编码seq id no:30的ace3-lc c末端的多核苷酸序列。
65.seq id no:32是编码名为“ace3-lc c末端mut_673”的ace3-lc c末端变体的多核苷酸序列。
66.seq id no:33是编码名为“ace3-lc c末端mut_674”的ace3-lc c末端变体的多核苷酸序列。
67.seq id no:34是编码名为“ace3-lc c末端mut_675”的ace3-lc c末端变体的多核苷酸序列。
68.seq id no:35是编码名为“ace3-lc c末端mut_676”的ace3-lc c末端变体的多核苷酸序列。
69.seq id no:36是编码名为“ace3-lc c末端mut_677”的ace3-lc c末端变体的多核苷酸序列。
70.seq id no:37是编码名为“ace3-lc c末端mut_678”的ace3-lc c末端变体的多核苷酸序列。
71.seq id no:38是编码名为“ace3-lc c末端mut_679”的ace3-lc c末端变体的多核苷酸序列。
72.seq id no:39是编码名为“ace3-lc c末端mut_680”的ace3-lc c末端变体的多核
苷酸序列。
73.seq id no:40是编码名为“ace3-lc c末端mut_681”的ace3-lc c末端变体的多核苷酸序列。
74.seq id no:41是编码名为“ace3-lc c末端mut_682”的ace3-lc c末端变体的多核苷酸序列。
75.seq id no:42是编码名为“ace3-lc c末端mut_683”的ace3-lc c末端变体的多核苷酸序列。
76.seq id no:43是编码名为“ace3-lc c末端ins_672”的ace3-lc c末端变体的多核苷酸序列。
77.seq id no:44是编码名为“ace3-lc c末端ins_673”的ace3-lc c末端变体的多核苷酸序列。
78.seq id no:45是编码名为“ace3-lc c末端ins_674”的ace3-lc c末端变体的多核苷酸序列。
79.seq id no:46是编码名为“ace3-lc c末端ins_675”的ace3-lc c末端变体的多核苷酸序列。
80.seq id no:47是编码名为“ace3-lc c末端ins_676”的ace3-lc c末端变体的多核苷酸序列。
81.seq id no:48是编码名为“ace3-lc c末端ins_677”的ace3-lc c末端变体的多核苷酸序列。
82.seq id no:49是编码名为“ace3-lc c末端ins_678”的ace3-lc c末端变体的多核苷酸序列。
83.seq id no:50是编码名为“ace3-lc c末端ins_679”的ace3-lc c末端变体的多核苷酸序列。
84.seq id no:51是编码名为“ace3-lc c末端ins_680”的ace3-lc c末端变体的多核苷酸序列。
85.seq id no:52是编码名为“ace3-lc c末端ins_681”的ace3-lc c末端变体的多核苷酸序列。
86.seq id no:53是编码名为“ace3-lc c末端ins_682”的ace3-lc c末端变体的多核苷酸序列。
87.seq id no:54是编码名为“ace3-lc c末端ins_683”的ace3-lc c末端变体的多核苷酸序列。
88.seq id no:55是编码名为“ace3-lc c末端del_673-675”的ace3-lc c末端变体的多核苷酸序列。
89.seq id no:56是编码名为“ace3-lc c末端del_674-676”的ace3-lc c末端变体的多核苷酸序列。
90.seq id no:57是编码名为“ace3-lc c末端del_675-677”的ace3-lc c末端变体的多核苷酸序列。
91.seq id no:58是编码名为“ace3-lc c末端del_676-678”的ace3-lc c末端变体的多核苷酸序列。
92.seq id no:59是编码名为“ace3-lc c末端del_677-679”的ace3-lc c末端变体的多核苷酸序列。
93.seq id no:60是编码名为“ace3-lc c末端del_678-680”的ace3-lc c末端变体的多核苷酸序列。
94.seq id no:61是编码名为“ace3-lc c末端del_679-681”的ace3-lc c末端变体的多核苷酸序列。
95.seq id no:62是编码名为“ace3-lc c末端del_680-682”的ace3-lc c末端变体的多核苷酸序列。
96.seq id no:63是编码名为“ace3-lc c末端del_681-683”的ace3-lc c末端变体的多核苷酸序列。
97.seq id no:64是编码名为“ace3-lc c末端del_682-684”的ace3-lc c末端变体的多核苷酸序列。
98.seq id no:65是编码名为“ace3-lc c末端del_683-685”的ace3-lc c末端变体的多核苷酸序列。
99.seq id no:66是编码包含seq id no:67的氨基酸序列的ace3-lc c末端v5取代的多核苷酸序列。
100.seq id no:67是“ace3-lc c末端v5取代”变体的氨基酸序列。
101.seq id no:68是编码包含seq id no:69的氨基酸序列的ace3-lc c末端v5-(6xhis)取代的多核苷酸序列。
102.seq id no:69是“ace3-lc c末端v5-(6xhis)取代”变体的氨基酸序列。
103.seq id no:70是靶向gla1基因座的sgrna。
具体实施方式
104.i.概述
105.如本文所述,本公开的某些实施例涉及用于商业规模生产目的蛋白的突变型和/或经遗传修饰的木霉属物种真菌细胞。更特别地,本公开的某些实施例涉及能够上调编码木质纤维素降解酶的一种或多种基因的表达的新型ace3(变体)转录因子(tf)蛋白。因此,某些实施例针对编码本文公开的新型(变体)ace3 tf蛋白的多核苷酸(核酸序列)。例如,本公开的某些实施例针对一种编码变体ace3 tf蛋白的经分离的多核苷酸,其中所述变体ace3 tf与seq id no:2的氨基酸位置1-672具有至少90%序列同一性,并且包含选自seq id no:2的位置673-689的一个或多个c末端氨基酸残基的遗传修饰。
106.因此,某些实施例涉及经遗传修饰的木霉属物种细胞,这些经遗传修饰的木霉属物种细胞包含编码本公开的变体ace3 tf蛋白的ace3基因,其中这些经修饰的细胞能够在诱导底物不存在下产生目的蛋白。某些其他实施例涉及经遗传修饰的木霉属物种细胞,这些经遗传修饰的木霉属物种细胞包含编码本公开的变体ace3 tf蛋白的ace3基因,其中这些经修饰的细胞能够在诱导底物存在下产生增加量的目的蛋白(即,相对于由包含编码野生型ace3蛋白(例如,seq id no:2)的野生型ace3基因的对照木霉属物种细胞产生的相同目的蛋白的量,当这些经修饰的木霉属物种细胞和对照木霉属物种细胞在诱导底物存在下在产生poi的相同条件下培养/发酵时)。因此,本公开的某些其他实施例涉及用于包含并表
达本公开的变体ace3转录因子(tf)蛋白的经修饰的木霉属物种细胞(菌株)的构建、遗传修饰、测试、筛选、分离等的组合物和方法。
107.ii.定义
108.在进一步详细地描述本发明的组合物和方法之前,定义了以下术语和短语。未定义的术语应当符合本领域技术人员已知和使用的常规含义。
109.在本说明书中引用的所有出版物以及专利都通过引用并入本文。
110.在提供了一系列值的情况下,应理解每个中间值为到下限的十分之一单位(除非上下文清晰地另外指示),该范围的上限与下限之间以及在该陈述范围内的任何其他陈述的或中间值均被涵盖在本发明的组合物和方法之内。这些较小范围的上限和下限可以被独立地包括在较小的范围内,并且也被涵盖在本发明的组合物和方法之内,服从所陈述范围中任何特别排除的限值。在所陈述的范围包括一个或者全部两个限值的情况下,排除那些包括的限值的任一个或者全部两个的范围也包括在本发明的组合物和方法中。
111.本文提供了某些范围,其中数值前面是术语“约”。术语“约”在本文中用于为其后面的确切数字以及与该术语后面的数字接近或近似的数字提供文字支持。在确定数字是否接近或近似于特别叙述的数字时,接近或近似的未列举的数字可以是在呈现其的上下文中提供特别叙述的数字的实质性等值的数字。例如,关于数值,术语“约”是指数值的-10%至
+
10%的范围,除非术语在上下文中另有具体定义。在另一个实例中,短语“约6的ph值”是指ph值为从5.4至6.6,除非ph值另有具体定义。
112.本文提供的标题并非对本发明的组合物和方法的各个方面或实施例进行限制,这些方面或实施例可通过将说明书作为一个整体来参考而得到。因此,把说明书作为一个整体参考时,以下即将定义的术语得以更全面地定义。
113.根据此具体实施方式,以下缩写和定义适用。应当注意单数形式“一个/一种(a/an)”和“该/所述(the)”包括复数个指示物,除非上下文中另有清楚地指示。因此,例如,提及“酶”包括多种此类酶,并且提及“剂量”包括提及本领域技术人员已知的一次或多次剂量及其等效物等。
114.进一步注意的是,权利要求书可以经撰写以排除任何任选的要素。因此,此陈述旨在作为使用与权利要求要素的叙述有关的排他性术语如“单独”、“仅”、“排除”、“不包括”等或使用“否定型”限定或“条件”的前提基础。
115.还应注意,如本文所用,术语“包含”意指“包括但不限于”在术语“包含”之后的一种或多种组分。在术语“包含”之后的组分是必需的或强制性的,但是包含一种或多种组分的组合物还可以包括其他非强制性或可选择的一种或多种组分。
116.还要注意的是,如本文所用,术语“由
……
组成”意指包括且限于术语“由
……
组成之后的一种或多种组分”。因此,术语“由
……
组成”之后的一种或多种组分是必需的或强制性的,且组合物中不存在一种或多种其他组分。
117.在阅读本公开后,如将对于本领域技术人员应显而易见的,本文描述和说明的单独实施例中的每一个具有离散的组分和特征,这些组分和特征可以在不偏离本文所述的本发明组合物和方法的范围或精神的情况下容易地与其他几个实施例中的任何一个的特征分离或组合。可以按照所叙述的事件的顺序或按照逻辑上可行的任何其他顺序来进行任何叙述的方法。
118.如本文所用,术语“子囊菌真菌细胞”是指真菌界中的子囊菌门中的任何生物体。子囊菌真菌细胞的实例包括但不限于盘菌亚门的丝状真菌,诸如木霉属物种、曲霉属(aspergillus)物种、毁丝霉属(myceliophthora)物种、青霉属(penicillium)物种等。
119.如本文所用,术语“丝状真菌”是指真菌门和卵菌门的所有丝状形式。例如,丝状真菌包括但不限于枝顶孢属(acremonium)、曲霉属、翘孢霉属(emericella)、镰刀菌属(fusarium)、腐质霉属(humicola)、毛霉属(毛霉菌)、毁丝霉属、脉孢菌属(neurospora)、青霉属、柱霉属(scytalidium)、梭孢壳属(thielavia)、弯颈霉属(tolypocladium)和木霉属物种。
120.在一些实施例中,丝状真菌是木霉属物种细胞(菌株),其包括但不限于哈茨木霉(trichoderma harzianum)、康宁木霉(trichoderma koningii)、长枝木霉(trichoderma longibrachiatum)、里氏木霉或绿色木霉(trichoderma viride)。
121.在一些实施例中,丝状真菌可以是曲霉属物种细胞(菌株),诸如棘孢曲霉(aspergillus aculeatus)、泡盛曲霉(aspergillus awamori)、臭曲霉(aspergillus foetidus)、日本曲霉(aspergillus japonicus)、构巢曲霉(aspergillus nidulans)、黑曲霉(aspergillus niger)或米曲霉(aspergillus oryzae)。
122.在一些实施例中,丝状真菌是衍生自里氏木霉菌株“rut-c30”(其可作为里氏木霉atcc保藏号56765获自美国典型培养物保藏中心)的里氏木霉细胞。在其他实施例中,丝状真菌是衍生自里氏木霉菌株“rl-p37”(其可作为nrrl号15709获自美国农业部北部地区研究中心的培养物保藏中心)的里氏木霉细胞。
123.如本文所用,“突变型细胞”当用在短语诸如“突变型木霉属物种细胞”中时,术语“突变型细胞”特别地指任何天然存在的木霉属物种(突变)细胞,其包含编码本公开的突变ace3 tf的突变ace3基因。例如,木霉属物种细胞群可以根据本文所述的方法筛选,以鉴定能够在诱导底物不存在下产生目的蛋白的天然存在的突变型木霉属物种细胞。例如,在某些实施例中,如上鉴定的突变型木霉属物种细胞从木霉属物种细胞群中分离,并在适用于在诱导底物不存在下产生目的蛋白的条件下培养/发酵。
124.如本文所用,短语“一种或多种变体丝状真菌细胞”、“一种或多种经修饰的丝状真菌细胞”、“一种或多种变体真菌细胞”、“一种或多种经修饰的真菌细胞”、“一种或多种变体真菌菌株”等是指衍生自(即,获自)属于盘菌亚门的亲代丝状真菌细胞的丝状真菌细胞。因此,如本文所用的“经修饰的”或“变体”丝状真菌细胞衍生自“亲代”丝状真菌细胞,其中“经修饰的”细胞包含未在“亲代”细胞中发现的至少一种遗传修饰。例如,当比较本公开的“经修饰的细胞”与“亲代细胞”时,“亲代细胞”用作相对于包含至少一种遗传修饰的“经修饰”细胞的未修饰的“对照”细胞。
125.如本文所用,术语“修饰”和“遗传修饰”可以互换使用,并且包括:(a)引入、取代或去除基因(或其orf)中的一个或多个核苷酸,或者引入、取代或去除基因或其orf的转录或翻译所需的调控元件中的一个或多个核苷酸,(b)基因破坏,(c)基因转化,(d)基因缺失,(e)基因下调,(f)本文公开的任何一个或多个基因的特异性诱变和/或(g)随机诱变。
126.如本文所用,“基因的破坏”、“基因破坏”、“基因的灭活”和“基因灭活”可以互换使用,并且广泛地是指基本上防止宿主细胞产生功能性基因产物(例如,蛋白质)的任何遗传修饰。基因破坏的示例性方法包括基因的任何部分的完全或部分(包括多肽编码序列、启动
子、增强子或另外的调控元件)缺失、或其诱变,其中诱变涵盖取代、插入、缺失、倒位、及其任何组合和变化,所述诱变破坏/灭活一个活多个靶基因并基本上减少或阻止功能基因产物(即蛋白质)的产生。
127.如本文所用,术语基因表达的“下调”和基因表达的“上调”包括导致基因的较低(下调)或较高(上调)表达的任何方法。例如,基因的下调可以通过rna诱导的基因沉默、控制元件(诸如启动子、核糖体结合位点(rbs)/夏因-达尔加诺(shine-dalgarno)序列、非翻译区(utr))的基因修饰、密码子变化等来实现。
128.如本文所用,“靶向载体”是这样的载体,该载体包括与该靶向载体转化至其中的宿主细胞的染色体中的区同源的多核苷酸序列,并且该载体可以驱动在该区处的同源重组。例如,靶向载体可用于通过同源重组将突变引入宿主细胞的染色体中。在一些实施例中,靶向载体包含其他非同源序列,例如添加到末端(即,填充序列或侧翼序列)。末端可以闭合,使得靶向载体形成闭环,诸如像插入载体中。例如,在某些实施例中,亲代木霉属物种细胞包含编码变体ace3蛋白(例如,ace3-s;seq id no:4)的ace3基因,该ace3基因包含截短的(无功能的)n末端双核锌簇dna结合结构域。
129.因此,如本文所述和预期,在某些实施例中,编码变体ace3蛋白(例如,ace3-s;seq id no:4)的ace3基因通过向亲代细胞中引入一种或多种“靶向载体”进行遗传修饰(例如,转化),这些“靶向载体”被设计用于恢复该ace3蛋白的天然dna结合结构域。例如,天然ace3dna结合结构域包含seq id no:29所示的氨基酸序列。选择和/或构建适当的载体(例如,用于恢复ace3基因中的天然ace3 dna结合)完全在本领域技术人员的知识范围内。同样,在其他实施例中,一种或多种靶向载体被设计/构建来在ace3基因中缺失、引入(插入)和/或取代一个或多个核苷酸,使得如本文所述,编码的ace3蛋白包含经修饰的c末端。
130.如本文所用,“侧翼序列”是指正在讨论的序列的上游或下游的任何序列(例如,针对基因a-b-c,基因b以a和c基因序列为侧翼)。在某些实施例中,输入序列在每侧的侧翼为同源盒。在另一个实施例中,输入序列和同源盒包含在每侧的侧翼为填充序列的单元。在一些实施例中,侧翼序列仅存在于单侧(3'或5'),但是在优选的实施例中,它在被侧翼的序列的每侧。每个同源盒的序列与木霉属物种染色体中的序列同源。这些序列引导在木霉属物种染色体中新构建体的整合位置以及木霉属物种染色体的哪部分将被输入序列替代。在其他实施例中,选择性标记的5'和3'端的侧翼为包含灭活染色体区段的部分的多核苷酸序列。
131.如本文所用,术语“基因”与术语“等位基因”同义,是指编码和引导蛋白质或rna表达的核酸。丝状真菌的营养体形式通常是单倍体,因此指定基因的单拷贝(即单个等位基因)足以赋予指定表型。
132.如本文所用,术语“野生型”和“天然的”可以互换使用,并是指天然发现的基因、蛋白、真菌细胞或菌株。
133.如本文所用,里氏木霉“qm6a菌株”包含编码名为“ace3-s”的ace3蛋白(seq id no:4)的ace3基因。
134.如本文所用,里氏木霉“rl-p37菌株”包含编码名为“ace3-l”的ace3蛋白(seq id no:6)的ace3基因。
135.如本文所用,“ace3-lc”蛋白包含seq id no:2的氨基酸序列。如图1所示,ace3-lc
蛋白包含六百八十九(689)个氨基酸残基,其具有包含完整的双核锌簇(zn2cys6)dna结合结构域(图1a;由六(6)个粗体和灰色半胱氨酸(c)残基指示)的n末端氨基酸序列和在位置689处以甘氨酸(g)残基封端的全长(野生型;非截短的)c末端(图1b)。如本文所用,天然ace3-lc蛋白的最后四十九(49)个氨基酸残基位置(seq id no:2;即,残基位置641至689)如seq id no:30所示(例如,参见,图15)。因此,在某些实施例中,变体ace3蛋白包含经修饰的c末端,其中该经修饰的c末端相对于seq id no:30的天然ace3-lc c末端氨基酸位置641至689。
136.如本文所用,“ace3-l”蛋白包含seq id no:6的氨基酸序列。如图1所示,ace3-l蛋白包含具有完整的双核锌簇(zn2cys6)dna结合结构域(由六(6)个粗体和灰色半胱氨酸(c)残基指示;图1a)的n末端氨基酸序列,并且包含以天冬氨酸(d)残基封端的截短的c末端(图1b,例如,相对于ace3-lc蛋白c末端;seq id no:2)。
137.如本文所用,“ace3-s”蛋白包含seq id no:4的氨基酸序列。如图1a所示,ace3-s蛋白包含相对于ace3-lc(图1a;seq id no:2)和/或ace3-l(图1a;seq id no:6)较短(截短)的n末端氨基酸序列。因此,如图1a所示,ace3-s蛋白不包含完整的双核锌簇(zn2cys6)dna结合结构域(即,相对于ace3-lc和ace3-l的n末端序列)。
138.如本文所述,短语“ace3 dna结合结构域”和“ace3双核锌簇(zn2cys6)dna结构域”可以互换使用,并且指与seq id no:29的ace3 dna结合结构域具有同源性的氨基酸序列。例如,seq id no:29的ace3 dna结合结构域(图3)位于ace3-lc(seq id no:2)和ace3-l(seq id no:6)蛋白的氨基酸位置73-109内。
139.如本文所用,术语“上调”当在短语诸如“ace3 tf蛋白
‘
上调’编码木质纤维素降解酶的基因的表达”中叙述时,该术语特指能够在缺乏诱导底物的情况下上调编码木质纤维素降解酶的基因的表达的ace3 tf蛋白。例如,包含上调编码木质纤维素降解酶的基因的表达的ace3 tf蛋白的本公开的经修饰的丝状真菌细胞可以在诱导底物不存在下产生木质纤维素降解酶。相比之下,包含编码野生型ace3 tf蛋白的野生型ace3基因的丝状真菌(对照)细胞在诱导底物不存在下不会上调编码木质纤维素降解酶的基因的表达。
140.如本文所用,术语“木质纤维素降解酶”包括但不限于纤维二糖水解酶、内切葡聚糖酶和β-葡糖苷酶。如本文所用,术语“增加量”当用在短语诸如“经修饰的细胞在诱导底物存在下产生
‘
增加量’的木质纤维素降解酶”中时,木质纤维素降解酶的“增加量”当在相同诱导底物存在下在产生poi的相同条件下培养/发酵时,相对于由亲代细胞产生的相同木质纤维素降解酶的量。
141.如下文在实例部分中所示和在下文中所述,本公开的某些实施例针对衍生自亲代木霉属物种细胞(菌株)的经遗传修饰的木霉属物种真菌细胞(菌株),所述亲代木霉属物种细胞(菌株)包含编码与seq id no:2具有至少90%序列同一性的ace3转录因子(tf)蛋白的ace3基因,其中所述经遗传修饰的细胞包含编码变体ace3 tf蛋白的经修饰的ace3基因,所述变体ace3 tf蛋白与seq id no:2的氨基酸位置1-672具有至少90%序列同一性,并且包含选自seq id no:2的位置673-689的一个或多个c末端氨基酸残基的遗传修饰。例如,在某些实施例中,本公开的经修饰的木霉属物种真菌细胞包含变体ace3 tf蛋白,当编码目的蛋白(poi)的可读框(orf)可操作地连接到衍生自编码木质纤维素降解酶的基因的上游(5')启动子序列时,该蛋白能够上调该orf的表达。
ace3 c末端;seq id no:2)。
152.如本文所用,ace3“c-term-10”蛋白(图2c;seq id no:12)包含六百七十九(679)个氨基酸残基,在位置679处以谷氨酰胺(q)封端的c末端处具有十(10)个氨基酸截短(相对于wt ace3 c末端;seq id no:2)。
153.如本文所用,ace3“c-term-12”蛋白(图2c;seq id no:13)包含六百七十七(677)个氨基酸残基,在位置677处以丝氨酸(s)封端的c末端处具有十二(12)个氨基酸截短(相对于wt ace3 c末端;seq id no:2)。
154.如本文所用,ace3“c-term-13”蛋白(图2c;seq id no:14)包含六百七十六(676)个氨基酸残基,在位置676处以丙氨酸(a)封端的c末端处具有十三(13)个氨基酸截短(相对于wt ace3 c末端;seq id no:2)。
155.如本文所用,ace3“c-term-14”蛋白(图2d;seq id no:15)包含六百七十五(675)个氨基酸残基,在位置675处以赖氨酸(k)封端的c末端处具有十四(14)个氨基酸截短(相对于wt ace3 c末端;seq id no:2)。
156.如本文所用,ace3“c-term-15”蛋白(图2d;seq id no:16)包含六百七十四(674)个氨基酸残基,在位置674处以丝氨酸(s)封端的c末端处具有十五(15)个氨基酸截短(相对于wt ace3 c末端;seq id no:2)。
157.如本文所用,ace3“c-term-16”蛋白(图2d;seq id no:17)包含六百七十三(673)个氨基酸残基,在位置673处以天冬氨酸(d)封端的c末端处具有十六(16)个氨基酸截短(相对于wt ace3 c末端;seq id no:2)。
158.如本文所用,ace3“c-term-17”蛋白(图2e;seq id no:18)包含六百七十二(672)个氨基酸残基,在位置672处以亮氨酸(l)封端的c末端处具有十七(17)个氨基酸截短(相对于wt ace3 c末端;seq id no:2)。
159.如本文所用,ace3“c-term-18”蛋白(图2e;seq id no:19)包含六百七十一(671)个氨基酸残基,在位置671处以精氨酸(r)封端的c末端处具有十八(18)个氨基酸截短(相对于wt ace3 c末端;seq id no:2)。
160.如本文所用,ace3“c-term-19”蛋白(图2e;seq id no:20)包含六百七十(670)个氨基酸残基,在位置670处以苏氨酸(t)封端的c末端处具有十九(19)个氨基酸截短(相对于wt ace3 c末端;seq id no:2)。
161.如本文所用,ace3“c-term-20”蛋白(图2f;seq id no:21)包含六百六十九(669)个氨基酸残基,在位置669处以亮氨酸(l)封端的c末端处具二十(20)个氨基酸截短(相对于wt ace3 c末端;seq id no:2)。
162.如本文所用,ace3“c-term-25”蛋白(图2f;seq id no:22)包含六百六十四(664)个氨基酸残基,在位置664处以缬氨酸(v)封端的c末端处具有二十五(25)个氨基酸截短(相对于wt ace3 c末端;seq id no:2)。
163.如本文所用,短语“包含表达编码ace3
‘
c-term’蛋白的基因的遗传修饰”的经修饰或变体细胞包括但不限于引入编码本公开的ace3
‘
c-term’蛋白(例如,c-term-7;seq id no:9至c-term-17;seq id no:18)的基因(或orf)的至少一个拷贝。在某些实施例中,编码ace3 c末端蛋白的基因(或orf)可操作地连接到上游(5')异源启动子序列(即,ace3基因不连接到其天然ace3启动子序列),和/或编码ace3 c末端蛋白的基因(或orf)可操作地连接
到下游(3')异源终止子序列。
164.在某些实施例中,包含表达编码本公开的ace3
‘
c-term’蛋白(例如,c-term-7;seq id no:9至c-term-17;seq id no:18)的基因的遗传修饰的经修饰的细胞包括通过crispr/cas9编辑对内源ace3基因进行修饰,其中经crispr/cas9修饰的ace3基因编码本公开的ace3
‘
c-term’蛋白。
165.在某些实施例中,可以针对编码截短的n末端双核锌簇dna结合结构域的内源ace3基因的存在来筛选本公开的真菌细胞。例如,图3(seq id no:29)呈现了在ace3-l(seq id no:6)和ace3-lc(seq id no:2)蛋白中发现的完整的dna结合结构域。因此,在某些实施例中,筛选并鉴定为包含(内源)截短的n末端的亲代真菌细胞在本文中被遗传修饰以恢复全长(野生型)n末端(seq id no:29)。
166.同样,可以针对编码全长(野生型)ace3 c末端(例如,ace3-lc;seq id no:2)的内源ace3基因的存在来筛选本公开的真菌细胞。例如,图4呈现了ace3-lc蛋白(seq id no:2)的全长(野生型)c末端。因此,在某些实施例中,筛选并鉴定为包含编码全长(野生型)c末端的内源ace3基因的亲代真菌细胞在本文中被遗传修饰以缺失(截短)全长(野生型)c末端的至少七(7)个氨基酸并且不超过十七(17)个氨基酸。因此,如图4所呈现,以灰色阴影显示的ace3 c末端氨基酸残基位置(即,位置-7(t)至-17(d))指示ace3 c末端处允许的氨基酸缺失(截短)的最小数目(至少7个)和最大数目(不超过17个),如下文进一步描述。
167.在其他实施例中,本公开的经修饰的丝状真菌细胞将包含另外的遗传修饰。例如,在某些实施例中,此类变体丝状真菌细胞可以进一步包含一种遗传修饰,该修饰降低了编码碳分解代谢物抑制蛋白“cre1”或“ace1”抑制蛋白的基因的表达和/或活性。在其他实施例中,此类经修饰的丝状真菌细胞进一步包含引入木聚糖酶调节子1(xyr1)的至少一个拷贝的遗传修饰。
168.如本文所用,术语“宿主细胞”是指具有作为如本文所述的进入序列(即,引入细胞多核苷酸序列)的宿主或表达载体的能力的丝状真菌细胞。
[0169]“异源的”核酸构建体或序列具有不是其被表达的细胞天然的或以天然形式存在的序列的一部分。关于控制序列,异源是指在自然界中不起调节与其目前正在调节的基因的表达相同的基因的功能的控制序列(例如,启动子、增强子)。通常,异源的核酸序列对于它们存在的细胞或部分基因组不是内源的,并且已经通过感染、转染、转化、显微注射、电穿孔等添加到细胞中。“异源”核酸构建体可以含有与天然细胞中发现的控制序列/dna编码序列组合相同或不同的控制序列/dna编码序列组合。类似地,异源蛋白通常指在自然界中彼此不处于同一关系中的两个或更多个亚序列(例如,融合蛋白)。
[0170]
如本文所用,术语“启动子”是指用于引导下游基因或其可读框(orf)转录的核酸序列。通常启动子将适合于正在表达靶基因的宿主细胞。启动子与其他转录和翻译调控核酸序列(也称为“控制序列”)一起是表达给定的基因所必须的。通常,转录和翻译调控序列包括但不限于启动子序列、核糖体结合位点、转录起始和终止序列、翻译起始和终止序列、以及增强子或活化子序列。在某些实施例中,启动子是诱导型启动子。在其他实施例中,启动子是组成型启动子。
[0171]
如本文所用,“启动子序列”是出于表达目的而被特定丝状真菌识别的dna序列。“启动子”被定义为引导核酸转录的一系列核酸控制序列。如本文所用,启动子包括转录起
始位点附近的必需核酸序列,诸如,在聚合酶ii型启动子的情况下,是tata元件。“组成型”启动子是一种在大多数环境和发育条件下具有活性的启动子。“诱导型”启动子是指在特定环境调节或发育调节下具有活性的启动子。
[0172]
如本文所用,术语“可操作地连接”是指核酸表达控制序列(诸如启动子、或一系列转录因子结合位点)和第二核酸序列之间的功能性连接,其中表达控制序列引导与第二序列相应的核酸序列的转录。因此,当核酸置于与另一个核酸序列的功能关系时,该核酸与另一个核酸序列“可操作地连接”。例如,如果编码分泌性前导子(即,信号肽)的dna表达为参与多肽分泌的前蛋白,那么所述编码分泌性前导子的dna可操作地连接到编码所述多肽的dna;如果启动子或增强子影响编码序列的转录,则该启动子或增强子可操作地连接到该序列;或者如果核糖体结合位点被定位以便促进翻译,则该核糖体结合位点可操作地连接到编码序列。通常,“可操作地连接”意指被连接的dna序列是连续的,并且在分泌性前导序列的情况下,是连续的并且处于阅读相中。然而,增强子不必是连续的。通过在方便的限制位点处连接来实现连接。如果此类位点不存在,则按照常规实践使用合成的寡核苷酸衔接子或接头。在其他实施例中,通过无缝克隆方法完成连接,其中dna以不依赖序列和无瘢痕的方式连接。无缝克隆典型地用但不限于商业上可获得的系统进行,诸如gibson组装(neb)、nebuilder hifi dna组装(neb)、golden gate组装(neb)、和geneart无缝克隆和组装系统(赛默飞世尔科技公司(thermofisher scientific))。
[0173]
如本文所用,“异源启动子”或“异源启动子序列”在用于短语诸如“可操作地连接到上游(5')异源启动子序列的ace3基因(或其orf)”中时,短语“异源启动子”意在区别于天然ace3启动子序列,其中可操作地连接到ace3基因的异源启动子序列可以是在本公开的丝状真菌细胞中有功能的任何启动子序列(即,不包括天然ace3基因启动子)。
[0174]
同样,“异源启动子序列”在用于短语诸如“编码目的蛋白(poi)的目的基因(goi)可操作地连接到上游(5')异源启动子序列”中时,短语“异源启动子”,短语“异源启动子”意在区别于目的基因的天然启动子序列,其中可操作地连接到编码poi的goi的异源启动子序列可以是在本公开的丝状真菌细胞中有功能的任何启动子序列(即,不包括goi的天然启动子)。
[0175]
如本文所用,术语“dna构建体”或“表达构建体”是指核酸序列,其包含至少两种dna多核苷酸片段。dna或表达构建体可以用于将核酸序列引入真菌宿主细胞中。可以体外(例如,通过pcr)或通过任何其他合适的技术产生dna。在一些优选的实施例中,dna构建体包含目的序列(例如,编码ace3-l蛋白)。在某些实施例中,将目的多核苷酸序列可操作地连接到启动子。在一些实施例中,该dna构建体进一步包含至少一种选择性标记。在另外的实施例中,该dna构建体包含与宿主细胞染色体同源的序列。在其他实施例中,dna构建体包含与宿主细胞染色体非同源的序列。
[0176]
如本文所用,短语“木质纤维素降解”酶包括纤维二糖水解酶、内切葡聚糖酶和β-葡糖苷酶。
[0177]
如本文所用,术语“纤维素酶(cellulase)”、“纤维素分解酶”或“纤维素酶(cellulase enzyme)”意指细菌或真菌酶,诸如外切葡聚糖酶、外切纤维二糖水解酶、内切葡聚糖酶和/或β-葡糖苷酶。这些不同类型的纤维素酶协同作用来将纤维素及其衍生物转化为葡萄糖。例如,许多微生物制造水解纤维素的酶,包括木腐真菌木霉属、堆肥细菌高温
单孢菌属(thermomonospora)(现在是嗜热双岐菌属(thermobifida))、芽孢杆菌属(bacillus)和纤维单胞菌属(cellulomonas);链霉菌属(streptomyces);以及真菌腐质霉属(humicola)、曲霉属和镰刀菌属。由这些微生物制造的酶是以下有用于将纤维素转化成葡萄糖的三种作用类型的蛋白的混合物:内切葡聚糖酶(eg)、纤维二糖水解酶(cbh)、和β-葡糖苷酶(bg)。如本文所定义,术语“内切葡聚糖酶”(eg)、“纤维二糖水解酶”(cbh)和“β-葡糖苷酶”(bg)分别与它们的缩写“eg”、“cbh”和“bg”可以互换使用。
[0178]
如本文所用,术语“编码序列”是指直接指定其(所编码的)蛋白质产物的氨基酸序列的核苷酸序列。编码序列的边界一般由通常以atg起始密码子开始的可读框确定。编码序列典型地包括dna、cdna和重组核苷酸序列。
[0179]
如本文定义的,术语“可读框”(下文称为“orf”)意指包含不间断阅读框的核酸或核酸序列(无论是天然存在的、非天然存在的、或合成的),不间断可读框由以下组成:(i)起始密码子,(ii)表示氨基酸的一系列密码子,和(iii)终止密码子,该orf以5'至3'方向阅读(或翻译)。
[0180]
如本文所用,术语“基因”意指涉及产生多肽链的dna的区段,该区段可以包括或可以不包括编码区之前和之后的区域,例如,5'非翻译区(5'utr)或“前导”序列以及3'utr或“尾部”序列,以及个体编码区段(外显子)之间的插入序列(内含子)。基因可以编码商业上重要的工业蛋白或肽,诸如酶(例如,蛋白酶、甘露聚糖酶、木聚糖酶、淀粉酶、葡糖淀粉酶、纤维素酶、氧化酶和脂肪酶等)。目的基因可以是天然存在的基因、突变基因或合成基因。
[0181]
如本文所用,当涉及细胞、核酸、蛋白、或载体使用时,术语“重组体”指示该细胞、核酸、蛋白或载体已经通过引入异源核酸或蛋白,或改变天然核酸或蛋白而进行修饰,或指示该细胞是从此类修饰的细胞衍生的。因此,例如,这些重组细胞表达在细胞的天然形式(非重组)中未发现的基因或表达以其他方式异常表达的、低表达的或根本不表达的天然基因。
[0182]
术语“载体”在本文中定义为被设计用于携带待引入一种或多种细胞类型中的核酸序列的多核苷酸。载体包括克隆载体、表达载体、穿梭载体、质粒、噬菌体或病毒颗粒、dna构建体、盒等。表达载体可包括调节序列,诸如启动子、信号序列、编码序列和转录终止子。
[0183]
如本文所用,“表达载体”意指包含编码序列的dna构建体,所述编码序列与能够在合适的宿主中实现蛋白表达的合适的控制序列可操作地连接。此类控制序列可包括实现转录的启动子、控制转录的任选操纵子序列、编码mrna上适合的核糖体结合位点的序列、增强子以及控制转录和翻译终止的序列。
[0184]
如本文所用,术语“分泌信号序列”表示编码多肽(即,“分泌肽”)的dna序列,该多肽作为较大多肽的组分引导较大的多肽通过其中该较大多肽被合成的细胞的分泌路径。较大的多肽在通过分泌路径转运期间通常被切割以去除分泌肽。
[0185]
如本文所用,术语“诱导”是指响应于“诱导物”(即,诱导底物)的存在基因的转录增加,这导致以显著增加的速率在丝状真菌细胞中合成目的蛋白(poi)。为了测量编码poi的“目的基因”(goi)或“目的orf”的“诱导”,用候选诱导底物(诱导物)处理变体丝状真菌(宿主)细胞并与未用诱导底物(诱导物)处理的亲代丝状真菌(对照,未修饰的)细胞进行比较。因此,(未处理的)亲代(对照)细胞被赋予为100%的相对蛋白活性值,其中当活性值(即,相对于对照细胞)大于100%、大于105%、大于110%、大于150%,大于200%-500%
(即,相对于对照)、或更高时,实现在变体(经修饰的)宿主细胞中编码poi的goi的诱导。
[0186]
如本文所用,术语“诱导物(inducer/inducers)”、“诱导底物(inducing substrate/inducing substrates)”可以互换使用,并是指引起丝状真菌细胞产生“增加量”的多肽(例如,酶、受体、抗体等)的任何化合物,或如果不存在诱导底物时将产生的其他化合物/底物。诱导底物的实例包括但不限于槐糖、乳糖、龙胆糖和纤维素。
[0187]
如本文所用,术语“诱导进料”指被进料到丝状真菌细胞中至少包含“诱导底物”(槐糖、乳糖、龙胆二糖、纤维素)的组合物。
[0188]
如本文所用,术语“分离的”或“纯化的”是指从天然相关的至少一种组分中去除的丝状真菌细胞、核酸或多肽。
[0189]
如本文所定义,术语“目的蛋白”或“poi”是指希望在丝状真菌细胞中表达的多肽。此种蛋白可以是酶、底物结合蛋白、表面活性蛋白、结构蛋白等,可以以高水平表达,并且可以用于商业化的目的。目的蛋白可以由内源基因或异源基因编码。目的蛋白可以在细胞内表达或作为分泌的蛋白(细胞外)表达。
[0190]
在某些实施例中,编码在本公开的丝状真菌细胞中表达/产生的poi的基因(或orf)包含可操作地连接到编码poi的基因或orf的上游(5')纤维素酶基因启动子(例如,cbh1)。因此,在一种或多种本文所述的经修饰的ace3 tf蛋白存在下,在纤维素酶启动子(例如,cbh1)控制下编码poi的基因或orf的表达被上调。
[0191]
如本文所用,术语“多肽”和“蛋白质”(和/或其各自的复数形式)可互换地用来指包含通过肽键连接的氨基酸残基的任何长度的聚合物。本文中使用用于氨基酸残基的常规一字母或三字母代码。聚合物可以是线性的或支化的,它可以包含经修饰的氨基酸,并且它可以被非氨基酸中断。该术语还涵盖天然修饰的或通过干预(例如,二硫键形成、糖基化、脂化、乙酰化、磷酸化、或任何其他操作或修饰,诸如与标记组分缀合)修饰的氨基酸聚合物。该定义内还包括例如含有一种或多种氨基酸类似物(包括例如非天然氨基酸等)以及本领域已知的其他修饰的多肽。
[0192]
如本文所用,功能上和/或结构上相似的蛋白质被认为是“相关的蛋白质”。此类蛋白质可衍生自不同属和/或物种的生物、或甚至不同纲的生物(例如,细菌和真菌)。相关的蛋白质还涵盖通过一级序列分析确定的、通过二级或三级结构分析确定的、或者通过免疫交叉反应性确定的同源物。
[0193]
如本文所用,短语“基本上无活性”或相似短语意指指定活性在混合物中不可检测或以不会干扰混合物的预期目的的量存在。
[0194]
如本文所用,术语“衍生多肽”是指通过以下衍生的或可衍生的蛋白:在一个或多个n末端和c末端中的一个或两个添加一个或多个氨基酸、在氨基酸序列中一个或多个不同位点取代一个或多个氨基酸、在蛋白的一端或两端或者在氨基酸序列的一个或多个位点缺失一个或多个氨基酸、和/或在氨基酸序列中一个或多个位点插入一个或多个氨基酸。蛋白衍生物的制备可以通过修饰编码天然蛋白的dna序列、将该dna序列转化到合适的宿主中、以及表达修饰的dna序列以形成衍生蛋白来实现。
[0195]
相关的(和衍生)蛋白包括“变体蛋白”。变体蛋白通过在少量氨基酸残基处的取代、缺失和/或插入而不同于参考/亲代蛋白(例如,野生型蛋白)。变体与亲代蛋白之间的不同氨基酸残基的数量可以是一个或多个,例如,1、2、3、4、5、6、7、8、9、10、15、20、30、40、50、
或更多个氨基酸残基。变体蛋白与参考蛋白可以共有至少约70%、至少约75%、至少约80%、至少约85%、至少约90%、至少约91%、至少约92%、至少约93%、至少约94%、至少约95%、至少约96%、至少约97%、至少约98%、或甚至至少约99%、或更多氨基酸序列同一性。变体蛋白也可以与参考蛋白在选择的基序、结构域、表位、保守区域等方面不同。
[0196]
如本文所用,术语“同源蛋白”是指与参考蛋白具有相似活性和/或结构的蛋白。这并不旨在意味着同源物必定是进化上相关的。因此,其旨在表示所述术语涵盖从不同生物体获得的相同、类似或相应(即,在结构和功能方面)的一种或多种蛋白。在一些实施例中,希望鉴定与参考蛋白具有相似的四级、三级和/或一级结构的同源物。在一些实施例中,同源蛋白作为参考蛋白诱导相似的一种或多种免疫应答。在一些实施例中,同源蛋白经过工程化以产生具有一种或多种期望活性的酶。
[0197]
序列之间的同源性程度可以使用本领域已知的任何合适的方法确定(参见,例如,smith和waterman,1981;needleman和wunsch,1970;pearson和lipman,1988;威斯康星遗传学软件包(wisconsin genetics software package)(威斯康星州麦迪逊市的遗传学电脑集团(genetics computer group,madison,wi))中的程序,诸如gap、bestfit、fasta和tfasta;和devereux等人,1984)。
[0198]
如本文所用,在至少两个核酸或多肽的情况下,短语“基本上类似”和“基本上同一”典型地意指多核苷酸或多肽包含与参考(即,野生型)序列相比具有至少约70%同一性、至少约75%同一性、至少约80%同一性、至少约85%同一性、至少约90%同一性、至少约91%同一性、至少约92%同一性、至少约93%同一性、至少约94%同一性、至少约95%同一性、至少约96%同一性、至少约97%同一性、至少约98%同一性、或甚至至少约99%同一性、或更高同一性的序列。可以使用已知的程序(诸如blast、align和clustal)使用标准参数确定序列同一性。
[0199]
如本文所用,“基因缺失”是指从宿主细胞基因组中去除该基因。当基因包括与基因编码序列不紧邻的控制元件(例如,增强子元件)时,基因的缺失是指编码序列、以及任选地相邻的增强子元件(包括但不限于例如,启动子和/或终止子序列)的缺失。
[0200]
如本文所用,“基因破坏”泛指基本上阻止细胞在宿主细胞中产生功能性基因产物,例如蛋白质的任何遗传或化学操作,即突变。破坏的示例性方法包括基因的任何部分的完全或部分(包括多肽编码序列、启动子、增强子或另外的调控元件)缺失、或其诱变,其中诱变涵盖取代、插入、缺失、倒位、及其组合和变化,这些突变中的任一种基本上阻止功能基因产物的产生。也可以使用rnai、crispr/cas9或任何其他消除、减少或减轻基因表达的方法破坏基因表达。
[0201]
如本文所用,“需氧发酵”是指在氧存在下生长。
[0202]
如本文所用,术语“细胞肉汤”统称为液体/浸没培养中的培养基和细胞。
[0203]
如本文所用,术语“细胞团”是指存在于液体/浸没培养中的细胞组分(包括完整和裂解的细胞)。细胞质量可以干重或湿重表示。
[0204]
如本文所用,“功能性蛋白”是具有活性(诸如,酶活性、结合活性、表面活性特性等)的蛋白质,并且其未被诱变、截短、或以其他方式修饰以消除或降低此活性。
[0205]
如本文所用,“功能性基因”是能够被细胞组分用于产生活性基因产物(典型地是蛋白质)的基因。功能性基因是破坏的基因的对立体,这些破坏的基因被修饰使得它们不能
被细胞组分用于产生活性基因产物,或者具有降低的被细胞组分用于产生活性基因产物的能力。
[0206]
如本文所用,“目的蛋白”是期望在丝状真菌细胞的浸没培养中产生的蛋白。通常,目的蛋白对于工业、药物、动物健康、以及食品和饮料的用途具有商业重要性,使得它们需要大量生产。目的蛋白与由丝状真菌细胞表达的无数其他蛋白不同,其他蛋白通常不作为产品受关注,主要被认为是背景蛋白污染物。
[0207]
iii.纤维素酶表达活化子3(ace3)
[0208]
如hakkinen等人,(2014)一般描述,里氏木霉一个名为“纤维素酶表达活化子3”(ace3)的基因编码名为“ace3”的转录因子(tf)蛋白,该ace3 tf调节纤维素酶和半纤维素酶基因的表达。另外,申请人的pct公开号wo 2018/067599鉴定了ace3 tf蛋白的某些变体形式,这些变体形式可以在诱导底物(例如乳糖、槐糖)不存在下上调里氏木霉菌株中纤维素酶/半纤维素酶的表达/产生。例如,pct公开号wo 2018/067599描述了当相对于基于里氏木霉“rut-c30菌株”注释的ace3orf,评价hakkinen等人,(2014)中描述的克隆的ace3 orf时(即,基于ace3的里氏木霉“qm6a菌株”注释)令人惊讶和意想不到的结果。
[0209]
更特别地,wo 2018/067599公开鉴定了一种突变的ace3基因,该突变的ace3基因编码能够在诱导底物不存在下上调里氏木霉菌株中纤维素酶/半纤维素酶基因表达的变体ace3 tf。如wo 2018/067599公开中所述,里氏木霉菌株诸如rl-p37和rut-c30中的突变ace3基因包含过早终止密码子,导致变体ace3 tf的c末端处产生十一(11)个氨基酸截短(即,相对于野生型编码的ace3 tf蛋白的c末端)。例如,如本公开的图1a所示,名为“ace3-s”的变体ace3蛋白(seq id no:4)具有较短(截短)的n末端序列,该n末端序列缺少双核锌簇(zn2cys6)dna结合结构域的六(6)个半胱氨酸残基(即,如在野生型ace3 tf双核锌簇(zn2cys6)dna结合结构域中所发现;seq id no:29)中的两(2)个,并且如图1b所示,变体ace3-s tf蛋白(seq id no:4)包含以甘氨酸(g)封端的全长(野生型)c末端。另外,如wo 2018/067599公开所示,并且如本公开的图1a所示,名为“ace3-lc”的野生型ace3蛋白(seq id no:2)包含全长n末端,该全长n末端包括完整的双核锌簇(zn2cys6)dna结合结构域(seq id no:29),并且如图1b所示,野生型ace3-lc蛋白(seq id no:2)包含以甘氨酸(g)封端的全长(野生型)c末端。相比之下,如本公开的图1a所示,名为“ace3-l”的变体ace3蛋白(seq id no:6)包含全长(野生型)n末端,该全长(野生型)n末端包括完整的双核锌簇(zn2cys6)dna结合结构域(seq id no:29),并且如图1b所示,ace3-l蛋白(seq id no:6)包含以天冬氨酸(d)封端的十一(11)个氨基酸截短的c末端。zhang等人,(2019)最近的出版物进一步验证了申请人的实验观察,即具有全长锌簇(zn2cys6)dna结合结构域的ace3变体能够与dna结合。
[0210]
因此,如pct公开号wo 2018/067599中一般所示,相对于包含编码变体ace3-s蛋白(seq id no:4)或野生型ace3-lc蛋白(seq id no:2)的ace3基因(或其可读框)的木霉属物种细胞(即,当在同一条件下发酵/培养时),包含编码变体ace3-l蛋白(即,在c末端处包含11个氨基酸截短;seq id no:6)的ace3基因(或其可读框)的木霉属物种细胞能够在诱导底物不存在下产生木质纤维素降解酶。最近,chen等人,(2020)的出版物进一步验证了申请人的实验观察,在诱导条件下,相对于包含编码野生型ace3蛋白的野生型ace3基因的木霉属物种细胞,在天然ace3基因座包含编码变体ace3 tf蛋白(具有最后十一(11)个c末端氨基
酸残基截短(缺失),即,相对于全长(野生型)ace3 c末端)的突变的ace3基因的木霉属物种细胞使得此类木霉属物种细胞可以产生增加量的木质纤维素降解酶(例如,纤维素酶/半纤维素酶)。
[0211]
因此,当将本公开的结果与来自其他作者的出版物(例如,zhang等人,2019;chen等人,2020)的结果/观察结果进行比较时,申请人强调并注意到此类观察结果之间的以下差异。例如,如本文中一般描述并在以下实例部分中呈现,申请人使用在(未修饰的)亲代菌株的天然基因座处具有编码截短的ace3 tf蛋白的ace3基因的菌株,并在(经修饰的)子代菌株的异位基因座处过表达编码变体ace3 tf蛋白的变体ace3基因。因此,本公开的(经修饰的)子代细胞产生过表达的变体ace3 tf蛋白与具有截短的c末端的天然ace3 tf蛋白的混合物。相比之下,chen等人,(2020)的出版物仅介绍了ace3在其天然基因座的截短。同样,zhang等人(2019)的出版物描述了在里氏木霉菌株qm6a中在ace3基因座处进行的启动子交换策略,以在其天然ace3 tf不存在下过表达两(2)种变体ace3 tf蛋白,其中第一变体ace3 tf在n末端包含不完全的锌簇(zn2cys6)dna结合结构域并包含野生型c末端,并且第二变体ace3 tf与野生型ace3 tf类似但不同一,其在n末端包含完全/完整的锌簇(zn2cys6)dna,并包含野生型c末端。因此,上述zang等人,(2019年)和chen等人,(2020年)的两项研究总体上展现了在诱导条件下(即,当在诱导底物存在下培养/发酵时)蛋白质产生的某些改进,而两个出版物都没有展现或描述在非诱导条件下(即,当在诱导底物不存在下培养/发酵时)蛋白质产生的改进。
[0212]
在本公开中,申请人进一步相对于ace3-l tf蛋白(seq id no:6;该ace3-l蛋白不需要诱导底物来表达/产生木质纤维素降解酶)的截短的c末端评价并剖析了ace3-lc tf蛋白(seq id no:2;该野生型ace3-lc蛋白需要诱导底物来表达/产生木质纤维素降解酶)的野生型c末端。更特别地,如以下实例1中所示,申请人构建了多个ace3表达载体,这些ace3表达载体编码在c末端处包含一系列氨基酸缺失(截短)的变体ace3蛋白。
[0213]
例如,使用五(5)个氨基酸缺失增量构建第一组六(6)个载体,该组包含从零(0)个氨基酸缺失到二十五(25)个氨基酸缺失的c末端缺失(例如,参见表1;第1组)。同样,使用一(1)个氨基酸缺失增量构建第二组十二(12)个载体,该组包含从六(6)个氨基酸缺失到十九(19)个氨基酸缺失的c末端缺失(表1;第2组)。因此,实例1中构建的十八(18)种ace3 c末端变体蛋白(列于表3中)基于ace3-lc蛋白序列(seq id no:2),该ace3-lc蛋白序列包含在位置689处以甘氨酸(g)封端的全长(野生型)ace3 c末端。
[0214]
申请人随后针对在“非诱导”条件(葡萄糖)和“诱导”条件(葡萄糖/槐糖或乳糖)下的蛋白质产生测试/筛选了构建的里氏木霉菌株(表3)。例如,如图7所示,申请人评价了表达(ace3-lc)c末端变体的第一组六(6)个菌株的总蛋白质产量,其中亲代对照菌株(rl-p37)只能在乳糖存在下(即,在“诱导”条件下)产生大量蛋白质并且在葡萄糖存在下(即,在“非诱导”条件下)产生最低基础水平的蛋白质。同样,如图7所呈现,表达具有十(10)个氨基酸缺失(cterm-10)、十一(11)个氨基酸缺失(cterm-11)或十五(15)个氨基酸缺失(cterm-15)的(ace3-lc)c末端变体的子代细胞展现了在乳糖(“诱导”条件)和葡萄糖(“非诱导”条件)下蛋白质产生都增加。例如,如图7所示,相对于亲代菌株(rl-p37)在乳糖存在下产生的蛋白质水平,葡萄糖存在下的倍数变化增加约为1.8倍,并且相对于亲代菌株(rl-p37)在乳糖存在下产生的蛋白质水平,乳糖存在下的倍数变化增加约为3倍。
[0215]
相比之下,如图7所示,在乳糖和葡萄糖存在下,野生型(ace3-lc)c末端(即,包含零(0)个氨基酸缺失;seq id no:2)和包含二十(20)个氨基酸缺失(seq id no:21)或二十五(25)个氨基酸缺失(seq id no:22)的(ace3-lc)c末端变体都展现显著降低的总蛋白质产量。这些结果展现野生型(ace3-lc)c末端截短对于其上调蛋白质产生的功能是必需的,并且在ace3 c末端处允许的氨基酸截短数量有上限和下限。
[0216]
为了进一步探索野生型(ace3-lc)c末端中允许的氨基酸缺失的上限和下限,申请人使用一(1)个氨基酸缺失增量筛选了包含在六(6)个氨基酸缺失到十九(19)个氨基酸缺失范围内的c末端缺失的里氏木霉菌株(例如,参见表1,第2组;和表3)。例如,如图8所呈现,五(5)或六(6)个c末端氨基酸截短显示与亲代菌株类似的结果(即,在葡萄糖存在下具有基础蛋白质产生,以及在乳糖存在下具有较高产生)。相比之下,如图8所示,c末端至少最后七(7)个氨基酸缺失(截短)(图5)与至多并包括十七(17)个氨基酸缺失(截短)(图5)都显示在葡萄糖(非诱导)条件和乳糖(诱导)条件下产生改进。
[0217]
例如,表达(ace3-lc)c末端变体c-term-7(seq id no:9)、c-term-8(seq id no:10)、c-term-9(seq id no:11)、c-term-10(seq id no:12)、c-term-12(seq id no:13)、c-term-13(seq id no:14)、c-term-14(seq id no:15)、c-term-15(seq id no:16)、c-term-16(seq id no:17)和c-term-17(seq id no:18)的里氏木霉菌株在葡萄糖(非诱导)条件下,与乳糖存在下的亲代菌株rl-p37相比,展现总蛋白质产量增加了约2倍,并且在乳糖(诱导)条件下,与乳糖存在下的亲代菌株rl-p37相比,展现总蛋白质产量增加了约3倍。相比之下,表达野生型ace3-lc蛋白(即,包含野生型ace3 c末端;seq id no:2)的里氏木霉菌株在乳糖存在下产生的蛋白质的量比亲代菌株rl-p37在乳糖存在下产生的蛋白质的量减少,并且在葡萄糖存在下产生的蛋白质的量达最小(图8)。在葡萄糖存在下和在乳糖存在下,在相同条件下,表达在c末端处具有少于七(7)个氨基酸缺失的(ace3-lc)c末端变体的里氏木霉菌株产生与亲代菌株rl-p37相当量的蛋白质。在葡萄糖或乳糖条件下,表达在c末端处包含超过十七(17)个氨基酸缺失的(ace3-lc)c末端变体的里氏木霉菌株产生最少量的蛋白质(图8)。
[0218]
如以下实例2中所示,申请人已经在分子水平上将ace3基因座处的c末端截短点突变(即,编码ace3-l;seq id no:6)回复回以(g)甘氨酸封端的qm6a的野生型(ace3)c末端序列(即,编码ace3-lc)(图1b;seq id no:2)。更特别地,如实例2所述和图9所呈现,申请人在摇瓶发酵中评价了三(3)种菌株的蛋白质产生,这三(3)种菌株包括菌株“t4abc”(包含编码ace3-l的ace3截短等位基因;seq id no:6)、“t4abc ace3_rev”(包含编码ace3-lc的ace3全长等位基因;seq id no:2)和“t4abc del-cbh1”(包含其内源纤维二糖水解酶(cbh1)基因的缺失)。如图9所示,当ace3突变(ace3-l;seq id no:6)在t4abc背景中被回复而使得其编码野生型(全长)ace3 c末端(以甘氨酸(g)封端的ace3-lc;seq id no:2)时,总分泌蛋白滴度降低约73%。为了进行比较,编码最突出分泌蛋白(cbh1)的基因(cbh1)的缺失仅使总分泌蛋白滴度降低47%。
[0219]
除了上述天然ace3 c末端截短(缺失)外,申请人还考虑、构建、测试并验证本文所述的某些其他ace3 c末端修饰。更特别地,不希望受其任何特定情况、机制或操作模式限制,申请人预期对ace3 c末端的其他遗传修饰(例如,取代、插入、内部(c末端)缺失及其组合)同样是如本文所述的适用于改进蛋白质生产力的遗传修饰。例如,如以下实例3所示,申
请人描述了用于构建ace3 tf c末端变体文库并筛选此类文库以改进木霉属物种细胞中的蛋白质生产力的组合物和方法。通过修饰编码seq id no:2的氨基酸位置641至689的全长(野生型)ace3-lc c末端的编码序列产生ace3的c末端变体文库。例如,图15(seq id no:30)呈现了编码氨基酸位置s641至g689的全长(野生型)ace3-lc c末端。更具体地,申请人描述了三(3)种不同的ace3 c末端文库,包括位点取代文库(文库1)、扫描插入文库(文库2)和扫描缺失文库(文库3)。
[0220]
本公开的实例4描述了用v5表位标签或v5-(6xhis)串联标签对ace3-lc蛋白c末端的最后十一(11)个氨基酸残基的分子取代,其中在“非诱导”(glu)和“诱导”(glu/sop)条件下都测试了(发酵)表达具有c末端v5标签取代的ace3-lc蛋白(即,ace3-lc-v5)或表达具有c末端v5-(6xhis)串联标签取代的ace3-lc蛋白(即,ace3lc-v5-(6xhis))的木霉属物种菌株。
[0221]
例如,在诱导(glu/sop)和非诱导(glu)条件下,包含并表达包含十一(11)个氨基酸截短的变体ace3-l tf蛋白(seq id no:6)的经修饰的(子代)里氏木霉细胞都产生了大量分泌蛋白。此外,包含并表达ace3-lc-v5(即,包含十四(14)个氨基酸取代最后十一(11)个氨基酸)的经修饰的(子代)里氏木霉细胞和包含并表达ace3-lc-v5-(6xhis)(即,包含二十三(23)个氨基酸取代最后十一(11)个氨基酸)的变体(子代)里氏木霉细胞在诱导(glu/sop)和非诱导(glu)条件下也都展现高的蛋白生产力(参见图14),但比ace3-l变体低约10%。因此,这些结果展现,对ace3 c末端的遗传修饰,包括但不限于取代、插入、内部(c末端)缺失及其组合,同样是如本文所述的适用于改进蛋白质生产力的遗传修饰。
[0222]
iv.重组核酸和分子生物学
[0223]
在某些实施例中,本公开针对编码变体ace3 tf蛋白的分离的多核苷酸(核酸序列)。在某些实施例中,变体ace3 tf与seq id no:2的氨基酸位置1-672具有至少90%序列同一性,并且包含选自seq id no:2的位置673-689的一个或多个c末端氨基酸残基的遗传修饰。因此,某些其他实施例涉及经遗传修饰的木霉属物种细胞,这些经遗传修饰的木霉属物种细胞包含编码本公开的变体ace3 tf蛋白的ace3基因,其中这些经修饰的细胞能够在诱导底物不存在下产生目的蛋白(poi),和/或其中这些经修饰的细胞能够在诱导底物存在下产生增加量的poi。在某些实施例中,“修饰”或“遗传修饰”包括:(a)引入、取代或去除基因(或其orf)中的一个或多个核苷酸,或者引入、取代或去除基因或其orf的转录或翻译所需的调控元件中的一个或多个核苷酸,(b)基因破坏,(c)基因转化,(d)基因缺失,(e)基因下调,(f)本文公开的任何一个或多个基因的特异性诱变和/或(g)随机诱变。
[0224]
因此,在某些实施例中,本公开针对重组核酸,这些重组核酸包含编码本公开的ace3蛋白的基因或orf。在某些实施例中,重组核酸包含用于在丝状真菌宿主细胞中产生ace3变体蛋白的多核苷酸表达盒。在其他实施例中,多核苷酸表达盒包含在表达载体中。在某些实施例中,表达载体是质粒。
[0225]
在某些其他实施例中,重组核酸(或其多核苷酸表达盒或其表达载体)进一步包含一种或多种选择性标记。用于丝状真菌中的选择性标记包括但不限于alsl、amds、hygr、pyr2、pyr4、pyrg、suca、博来霉素抗性标记、杀稻瘟菌素抗性标记、吡啶硫胺抗性标记、氯嘧磺隆乙酯抗性标记、新霉素抗性标记、腺嘌呤路径基因、色氨酸路径基因、和胸苷激酶标记等。在一个特别实施例中,可选择性标记是pyr2,其组合物和使用方法通常阐述于pct公开
号wo 2011/153449中。因此,在某些实施例中,编码本公开的ace3变体蛋白的多核苷酸构建体包含编码与其可操作地连接的选择性标记的核酸序列。
[0226]
在另外的实施例中,重组核酸、其多核苷酸构建体、多核苷酸表达盒或表达载体包含驱动编码变体ace3蛋白的基因(或orf)的表达的异源启动子。更特别地,在某些实施例中,异源启动子是组成型或诱导型启动子。在特别的实施例中,异源启动子选自由以下组成的组:rev3启动子、bxl启动子、tkl1启动子、pid104295启动子、dld1启动子、xyn4启动子、pid72526启动子、axe1启动子、hxk1启动子、dic1启动子、opt启动子、gut1启动子、和pki1启动子。因此,在某些实施例中,重组核酸(或其多核苷酸构建体、多核苷酸表达盒或表达载体)包含启动子序列,该启动子是5'地并可操作地连接到编码变体ace3蛋白的核酸序列。
[0227]
在另外的实施例中,重组核酸(或其多核苷酸构建体、多核苷酸表达盒或表达载体)进一步包含编码天然ace3终止子序列的核酸序列。因此,在某些实施例中,重组核酸(或其多核苷酸构建体、多核苷酸表达盒或表达载体)包含异源启动子(其是5'地并可操作地连接到编码变体ace3蛋白的核酸序列),并且包含天然ace3终止子序列(其是3'地并可操作地连接到编码变体ace3蛋白的核酸序列)(例如,5'-pro-orf-term-3',其中“pro”是组成型启动子,“orf”编码ace3,并且“term”是天然ace3终止子序列)。
[0228]
调控或控制序列的实例可以是启动子序列或其功能部分(即,足以影响核酸序列表达的部分)。用于修饰的其他控制序列包括但不限于前导序列、前肽序列、信号序列、转录终止子、转录活化子等。
[0229]
在某些其他实施例中,编码目的蛋白的目的基因(或orf)被置于衍生自编码木质纤维素降解酶的基因的启动子序列的控制下。例如,在某些实施例中,编码目的蛋白的基因(或orf)被置于cbh1启动子的控制下,使得goi的表达在本公开的变体ace3 tf蛋白存在下被上调。因此,在某些实施例中,衍生自编码木质纤维素降解酶的基因的启动子序列是纤维二糖水解酶启动子序列、内切葡聚糖酶启动子序列、β-葡糖苷酶启动子序列或木聚糖酶启动子序列。
[0230]
在某些实施例中,通过使用本领域熟知的方法(例如,插入、破坏、置换、或缺失)减少或消除目的基因(goi)的表达来构建本公开的经修饰的木霉属物种细胞。待修饰或灭活的基因的部分可以是例如编码区或编码区表达所需的调控元件。
[0231]
在某些其他实施例中,通过基因缺失构建经修饰的木霉属物种细胞以消除或减少至少一种goi的表达。基因缺失技术使得能够部分或完全去除一个或多个基因,从而消除它们的表达,或者表达非功能性(或活性降低的)蛋白质产物。在此类方法中,一个或多个基因的缺失可以通过使用已构建为连续含有侧翼于该基因的5'和3'区的质粒进行同源重组来完成。
[0232]
在其他实施例中,通过在基因或者其转录或翻译所需的调控元件中引入、取代或去除一个或多个核苷酸来构建本公开的经修饰的木霉属物种细胞。例如,可以插入或去除核苷酸,以便导致终止密码子的引入、起始密码子的去除或可读框的移码。此种修饰可以根据本领域已知的方法通过定点诱变或pcr产生的诱变来完成。
[0233]
在另一个实施例中,通过基因转化工艺构建经修饰的木霉属物种细胞。例如,在基因转换方法中,将对应于一个或多个基因的核酸序列在体外诱变以产生缺陷核酸序列,然后将该缺陷核酸序列转化到亲代木霉属物种细胞中以产生缺陷基因。通过同源重组,缺陷
核酸序列替代内源基因。可能期望的是,缺陷基因或基因片段也编码可以用于选择含有缺陷基因的转化体的标记。例如,可以将缺陷基因与可选择标记缔和引入非复制或温度敏感的质粒上。通过在不允许质粒复制的条件下选择标记来实现质粒整合的选择。通过检查菌落是否丢失可选择性标记和是否获得经突变的基因来实现导致基因替代的第二重组事件的选择(perego,1993)。可替代地,缺陷核酸序列可以含有基因的一个或多个核苷酸的插入、取代或缺失,如下文所述。
[0234]
在其他实施例中,通过确立已久的反义技术使用与基因的核酸序列互补的核苷酸序列来构建经修饰的木霉属物种细胞(parish和stoker,1997)。更具体地,可以通过引入与基因的核酸序列互补的核苷酸序列来减少(下调)或消除木霉属物种细胞的基因的表达,该核苷酸序列可以在细胞中转录并且能够与细胞中产生的mrna杂交。在允许互补的反义核苷酸序列与mrna杂交的条件下,由此降低或消除了所翻译的蛋白的量。此类反义方法包括但不限于rna干扰(rnai)、小干扰rna(sirna)、微小rna(mirna)、反义寡核苷酸等,所有这些都是熟练技术人员熟知的。
[0235]
在其他实施例中,经由crispr-cas9编辑产生/构建经修饰的木霉属物种细胞。例如,可以借助核酸指导的内切核酸酶破坏(或缺失或下调)目的基因,这些核酸指导的内切核酸酶通过结合指导rna(例如,cas9)和cpf1或指导dna(例如,ngago)发现其靶dna,这将内切核酸酶募集到dna上的靶序列上,其中内切核酸酶可以在dna中产生单链或双链断裂+++。此靶向dna断裂成为dna修复的底物,并且可以与所提供的编辑模板重组以使基因破坏或缺失。例如,编码核酸指导的内切核酸酶(出于此目的,来自化脓链球菌(s.pyogenes)的cas9)的基因或编码cas9核酸酶的经密码子优化的基因可操作地连接到在木霉属物种细胞中有活性的启动子和在木霉属物种细胞中有活性的终止子,从而产生木霉cas9表达盒。同样,本领域技术人员容易地鉴定目的基因特有的一个或多个靶位点。例如,为了构造编码grna的dna构建体-指向目的基因内的靶位点,可变的靶向结构域(vt)将包含靶位点的核苷酸,所述核苷酸为(pam)前间区序列邻近基序(tgg)的5',所述核苷酸与编码化脓链球菌cas9的cas9内切核酸酶识别结构域(cer)的dna融合。将编码vt结构域的dna和编码cer结构域的dna组合,从而产生编码grna的dna。因此,通过将编码grna的dna可操作地连接到在木霉属细胞中有活性的启动子和在木霉属细胞中有活性的终止子来产生grna的木霉属物种表达盒。
[0236]
在某些实施例中,将由内切核酸酶诱导的dna断裂用输入序列修复/替代。例如,为了精确修复由上述cas9表达盒和grna表达盒产生的dna断裂,提供了核苷酸编辑模板,使得细胞的dna修复机构可以利用编辑模板。例如,靶向基因的约500bp 5'可以与靶向基因的约500bp3'融合以产生编辑模板,所述模板由木霉属宿主的机构用于修复由rna指导的内切核酸酶(rgen)产生的dna断裂。
[0237]
可以使用许多不同的方法(例如,原生质体融合、电穿孔、自然感受态或诱导感受态)将cas9表达盒、grna表达盒、和编辑模板共同递送至丝状真菌细胞。通过用正向和反向引物扩增基因座,通过pcr扩增靶基因座来筛选经转化的细胞。这些引物可以扩增野生型基因座或已由rgen编辑的经修饰的基因座。
[0238]
在又其他实施例中,使用本领域熟知的方法(包括但不限于,化学诱变和转座),通过随机或特异性诱变构建经修饰的木霉属物种细胞。可以通过使亲代细胞经受诱变并且筛
选基因表达已减少或消除的突变型细胞来进行基因的修饰。可以例如通过使用合适的物理或化学诱变剂、使用合适的寡核苷酸或使dna序列经受pcr产生的诱变来进行可以是特异性的或随机的诱变。此外,诱变可以通过使用这些诱变方法的任何组合来进行。适用于本发明目的的物理或化学诱变剂的实例包括紫外线(uv)照射、羟胺、n-甲基-n'-硝基-n-亚硝基胍(mnng)、n-甲基-n'-亚硝基胍(ntg)、邻甲基羟胺、亚硝酸、甲烷磺酸乙酯(ems)、亚硫酸氢钠、甲酸、和核苷酸类似物。当使用此类试剂时,典型地通过如下方式来进行诱变:在合适的条件下在选择的诱变剂的存在下孵育待诱变的亲代细胞,并且选择展现出基因的表达降低或无表达的突变型细胞。
[0239]
因此,在某些实施例中,转化丝状真菌和培养真菌的标准技术(本领域技术人员熟知的)用于转化本公开的真菌宿主细胞。因此,将dna构建体或载体引入真菌宿主细胞中包括如下技术如:转化、电穿孔、核显微注射、转导、转染(例如脂质介导的转染和deae-糊精介导的转染)、用磷酸钙dna沉淀孵育、用dna包被的微粒高速轰击、基因枪或生物射弹转化、原生质体融合等。一般的转化技术是本领域已知的(参见,例如,ausubel等人,1987,sambrook等人,2001和2012,以及campbell等人,1989)。异源蛋白在木霉属中的表达描述于例如美国专利号6,022,725;6,268,328;harkki等人,1991以及harkki等人,1989中。对于曲霉属菌株的转化,还参考了cao等人(2000)。
[0240]
通常,使用已经进行了渗透性处理的原生质体或细胞转化木霉属的物种,典型地以105至107/ml、特别是2
×
106/ml的密度进行。将100μl体积的在适当的溶液(例如1.2m山梨糖醇和50mm cacl2)中的这些原生质体或细胞与期望dna混合。通常,向摄取溶液中添加高浓度的聚乙二醇(peg)。也可以将添加剂诸如二甲亚砜、肝素、亚精胺、氯化钾等添加到摄取溶液中以促进转化。类似的程序可用于其他真菌宿主细胞。参见,例如美国专利号6,022,725和6,268,328,其两者都通过引用并入本文。
[0241]
在某些实施例中,本公开针对一种或多种目的蛋白的表达和产生,所述目的蛋白对于丝状真菌宿主细胞是内源的(即,由包含遗传修饰的本公开的变体真菌宿主细胞产生这些内源蛋白,该遗传修饰表达变体ace3蛋白)。在其他实施例中,本公开针对表达和产生一种或多种目的蛋白,所述目的蛋白对于丝状真菌宿主细胞是异源的。因此,本公开通常依赖于重组遗传学领域中的常规技术。公开了在本公开中使用的一般方法的基础文本包括sambrook等人,(第2版,1989);kriegler(1990)和ausubel等人,(1994)。
[0242]
因此,在某些实施例中,将编码目的蛋白的异源基因或orf引入丝状真菌(宿主)细胞中。在某些实施例中,典型地将异源基因或orf克隆到中间载体中,然后转化到丝状真菌(宿主)细胞中用于复制和/或表达。这些中间载体可以是原核载体,诸如像质粒或穿梭载体。在某些实施例中,异源基因或orf的表达处于其天然启动子的控制下。在其他实施例中,将异源基因或orf的表达置于异源启动子的控制下,该异源启动子可以是异源组成型启动子或异源诱导型启动子。
[0243]
本领域技术人员清楚的是可以通过置换、取代、添加或消除一个或多个核苷酸而不改变启动子的功能来修饰天然(自然)的启动子。本发明的实践涵盖但不受对启动子的这些改变的限制。
[0244]
表达载体/构建体典型地含有转录单元或表达盒,该转录单元或表达盒含有表达异源序列所需的所有附加元件。例如,典型的表达盒含有与编码目的蛋白的异源核酸序列
可操作地连接的5'启动子,并且还进一步包含转录物的有效聚腺苷酸化、核糖体结合位点和翻译终止所需的序列信号。该盒的附加元件可以包括增强子,并且如果使用基因组dna作为结构基因,可以包括具有功能性剪接供体和受体位点的内含子。
[0245]
除了启动子序列之外,该表达盒还可以含有结构基因的录终止区下游转以提供有效的终止。该终止区可以从与启动子序列相同的基因获得或者可以从不同基因获得。尽管任何真菌终止子均可能在本发明中起作用,但优选的终止子包括:来自木霉属cbhi基因的终止子、来自构巢曲霉trpc基因的终止子(yelton等人,1984;mullaney等人,1985)、泡盛曲霉(aspergillus awamori)或黑曲霉葡糖淀粉酶基因(nunberg等人,1984;boel等人,1984)和/或米黑毛霉(mucor miehei)羧基蛋白酶基因(epo公开号0215594)。
[0246]
用于将遗传信息运送到细胞中的特定表达载体并不特别关键。可以使用用于在真核细胞或原核细胞中表达的常规载体中的任一种。标准的细菌表达载体包括噬菌体λ和m13,以及质粒如基于pbr322的质粒,pskf,pet23d和融合表达系统诸如mbp、gst和lacz。也可以将表位标签例如c-myc添加到重组蛋白中以提供便利的分离方法。
[0247]
可以包括在表达载体中的元件还可以是复制子,编码允许选择携带重组质粒的细菌的抗生素抗性的基因,或在质粒的非必需区中的允许插入异源序列的独特限制性位点。所选择的特定抗生素抗性基因也不是决定性的,因为本领域已知的许多抗性基因中的任一种都可以是合适的。优选地选择原核序列,使得它们不干扰dna在里氏木霉中的复制或整合。
[0248]
本发明的转化的方法可以导致转化载体的全部或一部分稳定整合到丝状真菌的基因组中。然而,还考虑了导致维持自主复制的染色体外转化载体的转化。
[0249]
用于将外源核苷酸序列引入宿主细胞的任何已知程序都可以使用。这些包括使用磷酸钙转染、聚凝胺、原生质体融合、电穿孔、基因枪法、脂质体、显微注射、原生质载体、病毒载体,以及用于将克隆的基因组dna、cdna、合成dna、或其他外源遗传材料引入宿主细胞的任何其他已知方法(参见,例如,sambrook等人,同上)。还使用农杆菌(agrobacterium)介导的转染方法,诸如美国专利号6,255,115中所述的转染方法。只需要使用能够成功地将至少一个基因引入能够表达异源基因的宿主细胞中的特定遗传工程化程序。
[0250]
将表达载体引入细胞后,在有利于表达在纤维素酶基因启动子序列控制下的基因的条件下培养转染的细胞。大批转化细胞可以如本文所述进行培养。最后,使用标准技术从培养物回收产物。
[0251]
因此,本公开在此提供了表达在纤维素酶基因启动子序列控制下的所希望多肽的表达和增强的分泌,所述纤维素酶基因启动子序列包括天然存在的纤维素酶基因、融合dna序列和各种异源构建体。本发明还提供了用于表达和分泌高水平的此类所希望物的方法。
[0252]
v.目的蛋白
[0253]
如上所述,本公开的某些实施例涉及经遗传修饰的丝状真菌细胞,这些经遗传修饰的丝状真菌细胞包含表达编码本文所述的变体ace3蛋白的基因或orf的遗传修饰。更特别地,某些实施例涉及在诱导底物不存在下,在编码变体ace3蛋白的此类经修饰的真菌细胞中表达/产生目的蛋白(poi)的组合物和方法。某些其他实施例涉及用于在诱导底物存在下增加此类经修饰的真菌细胞中poi的产生的组合物和方法。
[0254]
如本文所述,目的蛋白(poi)包括但不限于半纤维素酶、过氧化物酶、蛋白酶、纤维
素酶、木聚糖酶、脂肪酶、磷脂酶、酯酶、角质酶、果胶酶、角蛋白酶、还原酶、氧化酶、酚氧化酶、脂加氧酶、木质素酶、支链淀粉酶、鞣酸酶、戊聚糖酶、甘露聚糖酶、β-葡聚糖酶、透明质酸酶、软骨素酶、漆酶、淀粉酶、葡糖淀粉酶、乙酰酯酶、氨基肽酶、淀粉酶、阿拉伯聚糖酶、阿拉伯糖苷酶、阿拉伯呋喃糖苷酶、羧肽酶、过氧化氢酶、脱氧核糖核酸酶、差向异构酶、α-半乳糖苷酶、β-半乳糖苷酶、α-葡聚糖酶、葡聚糖裂解酶、内切-β-葡聚糖酶、葡萄糖氧化酶、葡糖醛酸糖苷酶、转化酶、异构酶等。
[0255]
因此,在某些实施例中,poi选自如下酶学委员会(ec)编号,所述酶学委员会(ec)编号选自由ec 1、ec 2、ec 3、ec 4、ec 5或ec 6组成的组。
[0256]
例如,在某些实施例中,poi是包括但不限于选自以下的ec1(氧化还原酶)酶的氧化还原酶:ec 1.10.3.2(例如,漆酶)、ec 1.10.3.3(例如,l-抗坏血酸氧化酶)、ec 1.1.1.1(例如,醇脱氢酶)、ec 1.11.1.10(例如,氯化物过氧化物酶)、ec 1.11.1.17(例如,过氧化物酶)、ec 1.1.1.27(例如,l-乳酸脱氢酶)、ec 1.1.1.47(例如,葡萄糖1-脱氢酶)、ec 1.1.3.x(例如,葡萄糖氧化酶)、ec 1.1.3.10(例如,吡喃糖氧化酶)、ec 1.13.11.x(例如,加双氧酶)、ec 1.13.11.12(例如,亚油酸13s-脂氧合酶(lineolate 13s-lipozygenase))、ec 1.1.3.13(例如,醇氧化酶)、ec 1.14.14.1(例如,单加氧酶)、ec 1.14.18.1(例如,单酚单加氧酶(monophenol monooxigenase))、ec 1.15.1.1(例如,超氧化物歧化酶)、ec 1.1.5.9(先前为ec 1.1.99.10,例如,葡萄糖脱氢酶)、ec 1.1.99.18(例如,纤维二糖脱氢酶)、ec 1.1.99.29(例如,吡喃糖脱氢酶)、ec 1.2.1.x(例如,脂肪酸还原酶)、ec 1.2.1.10(例如,乙醛脱氢酶)、ec 1.5.3.x(例如,果糖基胺还原酶)、ec 1.8.l.x(例如,二硫化物还原酶)和ec 1.8.3.2(例如,硫醇氧化酶)。
[0257]
在某些实施例中,poi是包括但不限于ec 2(转移酶)酶的转移酶,所述ec 2(转移酶)酶选自ec 2.3.2.13(例如,转谷氨酰胺酶)、ec 2.4.1.x(例如,己糖基转移酶)、ec 2.4.1.40(例如,交替蔗糖酶(alternasucrase))、ec 2.4.1.18(例如,1,4α-葡聚糖分支酶)、ec 2.4.1.19(例如,环麦芽糖糊精葡聚糖转移酶)、ec 2.4.1.2(例如,糊精葡聚糖酶)、ec 2.4.1.20(例如,纤维二糖磷酸化酶)、ec 2.4.1.25(例如,4-α-葡聚糖转移酶)、ec 2.4.1.333(例如,1,2-β-低聚葡糖磷酸转移酶)、ec 2.4.1.4(例如,淀粉蔗糖酶)、ec 2.4.1.5(例如,葡聚糖蔗糖酶)、ec 2.4.1.69(例如,半乳糖苷2-α-l-岩藻糖基转移酶)、ec 2.4.1.9(例如,菊粉蔗糖酶(inulosucrase))、ec 2.7.1.17(例如,木酮糖激酶)、ec 2.7.7.89(原名ec 3.1.4.15,例如,[谷氨酰氨合成酶]-腺苷-l-酪氨酸磷酸化酶)、ec 2.7.9.4(例如,α葡聚糖激酶)和ec 2.7.9.5(例如,磷酸葡聚糖激酶)。
[0258]
在其他实施例中,poi是水解酶,该水解酶包括但不限于选自以下的ec 3(水解酶)酶:ec 3.1.x.x(例如,酯酶)、ec 3.1.1.1(例如,果胶酶)、ec 3.1.1.14(例如,叶绿素酶)、ec 3.1.1.20(例如,鞣酸酶)、ec 3.1.1.23(例如,甘油酯酰基水解酶)、ec 3.1.1.26(例如,半乳糖脂酶)、ec 3.1.1.32(例如,磷脂酶a1)、ec 3.1.1.4(例如,磷脂酶a2)、ec 3.1.1.6(例如,乙酰酯酶)、ec 3.1.1.72(例如,乙酰木聚糖酯酶)、ec 3.1.1.73(例如,阿魏酸酯酶)、ec 3.1.1.74(例如,角质酶)、ec 3.1.1.86(例如,鼠李糖半乳糖醛酸乙酰酯酶)、ec 3.1.1.87(例如,伏马菌素b1酯酶)、ec 3.1.26.5(例如,核糖核酸酶p)、ec 3.1.3.x(例如,磷酸单水解酶)、ec 3.1.30.1(例如,曲霉核酸酶s1)、ec 3.1.30.2(例如,粘质沙雷氏菌(serratia marcescens)核酸酶)、ec 3.1.3.1(例如,碱性磷酸酶)、ec 3.1.3.2(例如,酸性
磷酸酶)、ec 3.1.3.8(例如,3-植酸酶)、ec 3.1.4.1(例如,磷酸二酯酶i)、ec 3.1.4.11(例如,磷脂酰肌醇磷脂酶c)、ec 3.1.4.3(例如,磷脂酶c)、ec 3.1.4.4(例如,磷脂酶d)、ec 3.1.6.1(例如,芳基硫酸酯酶)、ec 3.1.8.2(例如,二异丙基-氟磷酸酶)、ec 3.2.1.10(例如,寡-1,6-葡糖苷酶)、ec 3.2.1.101(例如,甘露聚糖内切-1,6-α-甘露糖苷酶)、ec 3.2.1.11(例如,α-1,6-葡聚糖-6-葡聚糖水解酶)、ec 3.2.1.131(例如,木聚糖α-1,2-葡糖醛酸苷酶(glucuronosidase))、ec 3.2.1.132(例如,壳聚糖n-乙酰葡糖氨基水解酶)、ec 3.2.1.139(例如,α-葡糖醛酸酶(glucuronidase))、ec 3.2.1.14(例如,几丁质酶)、ec 3.2.1.151(例如,木葡聚糖特异性内切-β-1,4-葡聚糖酶)、ec 3.2.1.155(例如,木葡聚糖特异性外切-β-1,4-葡聚糖酶)、ec 3.2.1.164(例如,半乳聚糖内切-1,6-β-半乳糖苷酶)、ec 3.2.1.17(例如,溶菌酶)、ec 3.2.1.171(例如,鼠李半乳糖醛酸聚糖水解酶)、ec 3.2.1.174(例如,鼠李半乳糖醛酸聚糖鼠李糖水解酶)、ec 3.2.1.2(例如,β-淀粉酶)、ec 3.2.1.20(例如,α-葡糖苷酶)、ec 3.2.1.22(例如,α-半乳糖苷酶)、ec 3.2.1.25(例如,β-甘露糖苷酶)、ec 3.2.1.26(例如,β-果糖呋喃糖苷酶)、ec 3.2.1.37(例如,木聚糖1,4-β-木糖苷酶)、ec 3.2.1.39(例如,葡聚糖内切-1,3-β-d-葡糖苷酶)、ec 3.2.1.40(例如,α-l-鼠李糖苷酶)、ec 3.2.1.51(例如,α-l-岩藻糖苷酶)、ec 3.2.1.52(例如,β-n-乙酰己糖胺酶)、ec 3.2.1.55(例如,α-n-阿拉伯呋喃糖苷酶)、ec 3.2.1.58(例如,葡聚糖1,3-β-葡糖苷酶)、ec 3.2.1.59(例如,葡聚糖内切-1,3-α-葡糖苷酶)、ec 3.2.1.67(例如,半乳聚糖1,4-α-半乳糖醛酸酶)、ec 3.2.1.68(例如,异淀粉酶)、ec 3.2.1.7(例如,1-β-d-果聚糖果糖水解酶)、ec 3.2.1.74(例如,葡聚糖1,4-β-葡糖苷酶)、ec 3.2.1.75(例如,葡聚糖内切-1,6-β-葡糖苷酶)、ec 3.2.1.77(例如,甘露聚糖1,2-(1,3)-α-甘露糖苷酶)、ec 3.2.1.80(例如,果聚糖β-果糖苷酶)、ec 3.2.1.82(例如,外切-聚-α-半乳糖醛酸苷酶)、ec 3.2.1.83(例如,κ-角叉菜胶酶)、ec 3.2.1.89(例如,阿拉伯半乳聚糖内切-1,4-β-半乳糖苷酶)、ec 3.2.1.91(例如,纤维素1,4-β-纤维二糖糖苷酶)、ec 3.2.1.96(例如,甘露糖基-糖蛋白内切-β-n-乙酰葡糖氨糖苷酶)、ec 3.2.1.99(例如,阿拉伯聚糖内切-1,5-α-l-阿拉伯糖苷酶)、ec 3.4.x.x(例如,肽酶)、ec 3.4.1l.x(例如,氨肽酶)、ec 3.4.11.1(例如,亮氨酰氨肽酶)、ec 3.4.11.18(例如,甲硫氨酰氨肽酶)、ec 3.4.13.9(例如,xaa-pro二肽酶)、ec 3.4.14.5(例如,二肽基-肽酶iv)、ec 3.4.16.x(例如,丝氨酸型羧肽酶)、ec 3.4.16.5(例如,羧肽酶c)、ec 3.4.19.3(例如,焦谷氨酰肽酶i)、ec 3.4.21.x(例如,丝氨酸内肽酶)、ec 3.4.21.1(例如,胰凝乳蛋白酶)、ec 3.4.21.19(例如,谷氨酰内肽酶)、ec 3.4.21.26(例如,脯氨酰寡肽酶)、ec 3.4.21.4(例如,胰蛋白酶)、ec 3.4.21.5(例如,凝血酶)、ec 3.4.21.63(例如,蜂蜜曲霉蛋白酶)、ec 3.4.21.65(例如,热霉菌素)、ec 3.4.21.80(例如,链霉菌素a)、ec 3.4.22.x(例如,半胱氨酸内肽酶)、ec 3.4.22.14(例如,肌动蛋白)、ec 3.4.22.2(例如,木瓜蛋白酶)、ec 3.4.22.3(例如,无花果蛋白酶)、ec 3.4.22.32(例如,茎菠萝蛋白酶)、ec 3.4.22.33(例如,水果菠萝蛋白酶)、ec 3.4.22.6(例如,木瓜凝乳蛋白酶)、ec 3.4.23.1(例如,胃蛋白酶a)、ec 3.4.23.2(例如,胃蛋白酶b)、ec 3.4.23.22(例如,栗疫霉胃蛋白酶)、ec 3.4.23.23(例如,毛霉胃蛋白酶)、ec 3.4.23.3(例如,胃蛋白酶)、ec 3.4.24.x(例如,金属内肽酶)、ec 3.4.24.39(例如,氘代溶素(deuterolysin))、ec 3.4.24.40(例如,粘质沙雷氏菌酶)、ec 3.5.1.1(例如,天冬酰胺酶)、ec 3.5.1.11(例如,青霉素酰胺酶)、ec 3.5.1.14(例如,n-酰基-脂族-l-氨基酸酰胺水解酶)、ec 3.5.1.2(例
如,l-谷氨酰胺酰胺水解酶)、ec 3.5.1.28(例如,n-乙酰胞壁酰-l-丙氨酸酰胺酶)、ec 3.5.1.4(例如,酰胺酶)、ec 3.5.1.44(例如,蛋白-l-谷氨酰胺酰胺水解酶)、ec 3.5.1.5(例如,脲酶)、ec 3.5.1.52(例如,肽-n(4)-(n-乙酰基-β-葡糖氨基)天冬酰胺酰胺酶)、ec 3.5.1.81(例如,n-酰基-d-氨基酸脱酰基酶)、ec 3.5.4.6(例如,amp脱氨酶)和ec 3.5.5.1(例如,腈水解酶)。
[0259]
在其他实施例中,poi是包括但不限于选自以下的ec 4(裂解酶)酶的裂解酶:ec 4.1.2.10(例如,苯乙醇腈裂解酶)、ec 4.1.3.3(例如,n-乙酰神经氨酸裂解酶)、ec 4.2.1.1(例如,碳酸脱水酶)、ec 4.2.2.-(例如,鼠李半乳糖醛酸聚糖裂解酶)、ec 4.2.2.10(例如,果裂解酶)、ec 4.2.2.22(例如,果胶三糖-裂解酶)、ec 4.2.2.23(例如,鼠李半乳糖醛酸聚糖内切裂解酶)和ec 4.2.2.3(例如,甘露糖醛特异性海藻酸裂解酶)。
[0260]
在某些其他实施例中,poi是包括但不限于选自以下的ec 5(异构酶)酶的异构酶:ec 5.1.3.3(例如,醛糖1-差向异构酶)、ec 5.1.3.30(例如,d-阿洛酮糖3-差向异构酶)、ec 5.4.99.11(例如,异麦芽酮糖合酶)和ec 5.4.99.15(例如,(l 4)-a-d-葡聚糖1-a-d-葡糖基变位酶)。
[0261]
在又其他实施例中,poi是连接酶,包括但不限于选自以下的ec 6(连接酶)酶:ec 6.2.1.12(例如,4-香豆酸:辅酶a连接酶)和ec 6.3.2.28(例如,l-氨基酸α-连接酶)。
[0262]
用于产生蛋白的最佳条件将随宿主细胞的选择以及待表达的一种或多种蛋白的选择而变化。本领域技术人员通过常规实验和/或优化可以容易地确定这样的条件。
[0263]
目的蛋白可以在表达后被纯化或分离。目的蛋白能以本领域技术人员已知的各种方式被分离或纯化,这取决于样品中存在的其他组分。标准纯化方法包括电泳、分子、免疫和色谱技术,包括离子交换、疏水、亲和以及反相hplc色谱和色谱聚焦。例如,目的蛋白可以使用标准抗目的蛋白抗体柱进行纯化。超滤和渗滤技术联合蛋白浓缩也是有用的。所需的纯化程度将取决于目的蛋白的预期用途而变化。在某些情况下,不需要纯化蛋白。
[0264]
在某些其他实施例中,为了证实本公开的经遗传修饰的真菌细胞产生增加水平的目的蛋白,可以进行各种筛选方法。表达载体可以编码用作可检测标签的与靶蛋白的多肽融合物,或者靶蛋白本身可以用作可选择或可筛选的标记。可以经由western印迹、斑点印迹(可获自冷泉港试验方案网站(cold spring harbor protocols website)的方法)、elisa、或者(如果标记为gfp)全细胞荧光或facs来检测经标记的蛋白。例如,将包含6-组氨酸标签作为与靶蛋白的融合物,并且该标签将通过蛋白印迹检测。如果靶蛋白以足够高的水平表达,可以进行与考马斯(coomassie)/银染色组合的sds-page以检测与亲代(对照)细胞相比突变体宿主细胞表达的增加,在这种情况下不需要标记。此外,可以使用其他方法来证实目的蛋白的改进水平,诸如,检测蛋白活性或每个细胞中的量、蛋白活性或每毫升培养基中的量的增加,从而允许培养或发酵有效地继续更长时间,或通过这些方法的组合。
[0265]
比生产力的检测是评估蛋白质产生的另一种方法。比生产力(qp)可以通过以下公式确定:
[0266]
qp=gp/gdcw
·
hr
[0267]
其中“gp”是在罐中产生的蛋白的克数,“gdcw”是在罐中的干细胞重量(dcw)的克数,“hr”是从接种时间开始的几小时内的发酵时间,其包括产生时间以及生长时间。
[0268]
vi.发酵
[0269]
在某些实施例中,本公开提供了产生目的蛋白的方法,该方法包括发酵经修饰的真菌细胞,其中该变体真菌细胞分泌目的蛋白。通常,本领域熟知的发酵方法用于发酵变体真菌细胞。在一些实施例中,真菌细胞在分批或连续发酵条件下生长。经典的分批发酵是封闭的系统,其中在发酵开始时设定培养基的组成,并且该组成在发酵期间不改变。在发酵开始时,将培养基用一种或多种期望生物体接种。在这种方法中,允许发酵发生而不向系统中添加任何组分。典型地,分批发酵符合关于添加碳源的“分批”的资格,并且经常对控制因素(诸如,ph和氧浓度)进行尝试。分批系统的代谢物和生物质组成不断变化直到发酵停止时。在分批培养中,细胞通过静态停滞期进展到高生长对数期,最后进入生长速率减少或停止的稳定期。如果不经处理,处于静止期的细胞最终死亡。通常,处于对数期的细胞负责产物的大量产生。
[0270]
标准分批系统的合适的变体是“补料分批发酵”系统。在典型分批系统的这种变体中,随着发酵的进展,以增量添加底物。当分解代谢物阻遏可能抑制细胞的代谢时并且在培养基中希望具有有限量的底物的情况下,补料分批系统是有用的。在补料分批系统中实际底物浓度的测量是困难的并且因此基于可测量因素(诸如ph、溶解氧和废气(诸如co2)的分压)的变化对其进行估计。分批和补料分批发酵是常用的并且在本领域中是熟知的。
[0271]
连续发酵是开放的系统,其中将确定的发酵培养基连续添加到生物反应器中,同时去除等量的条件培养基以用于处理。连续发酵通常将培养物保持在恒定的高密度,其中细胞主要处于对数期生长。连续发酵允许对影响细胞生长和/或产物浓度的一种或多种因素进行调节。例如,在一个实施例中,将限制营养素(诸如碳源或氮源)保持在固定的速率,并且允许调控所有其他参数。在其他系统中,影响生长的许多因素可以不断改变,而通过培养基浊度测量的细胞浓度保持不变。连续系统努力保持稳态生长条件。因此,由于转移培养基而引起的细胞损失应当与发酵中的细胞生长速率相平衡。调节用于连续发酵过程的营养素和生长因子的方法以及用于最大化产物形成速率的技术是工业微生物学领域中熟知的。
[0272]
本公开的某些实施例涉及用于培养真菌的发酵程序。用于产生纤维素酶的发酵程序是本领域已知的。例如,纤维素酶可以通过固体培养或浸没培养(包括分批、补料分批和连续流程)来产生。培养通常在生长培养基中完成,该生长培养基包含含水矿物盐培养基、有机生长因子、碳源和能源材料、分子氧以及当然还有待使用的丝状真菌宿主的起始接种物。
[0273]
除了碳源和能源、氧、可同化氮和微生物的接种物外,还有必要以恰当比例供给合适量的矿质营养素来确保适当的微生物生长,使微生物转化过程中细胞对碳源和能源的同化最大化,并且在发酵培养基中获得最大细胞产量和最大细胞密度。
[0274]
含水矿质培养基的组成可在宽泛的范围内变化,这部分取决于所使用的微生物和底物,正如本领域所已知的。除了氮以外,所述矿质培养基还应该包括处于合适的可溶性可同化离子形式和化合形式的合适量的磷、镁、钙、钾、硫和钠,并且还优选应存在也处于适合的可溶性可同化形式的某些痕量元素诸如铜、锰、钼、锌、铁、硼和碘以及其他,这些全部如本领域所已知的。
[0275]
该发酵反应是一需氧过程,其中所需的分子氧通过含分子氧气体诸如空气、富氧空气或甚至基本上纯的分子氧供给,只要维持发酵容器的内容物具有可有效用于帮助微生物物种以旺盛方式生长的合适的氧分压。
[0276]
发酵温度可以稍微变化,但对于丝状真菌诸如里氏木霉,温度通常将会在约20℃至40℃的范围内,一般优选在约25℃至34℃的范围内。
[0277]
微生物还需要可同化氮源。可同化氮源可以是任何含氮化合物或能够释放适于微生物进行代谢利用的形式的氮。虽然可采用多种有机氮源化合物如蛋白水解产物,但通常可以利用廉价的含氮化合物,诸如氨、氢氧化铵、尿素和多种铵盐(诸如磷酸铵、硫酸铵、焦磷酸铵、氯化铵或多种其他氨化合物)。氨气本身便于大规模操作,并且能以合适的量通过鼓泡穿过含水发酵物(发酵培养基)而使用。同时,还可采用这种氨来帮助进行ph控制。
[0278]
含水微生物发酵物(发酵混合物)中的ph范围应该是在约2.0至8.0的示例性范围内。在丝状真菌的情况下,ph通常在约2.5至8.0的范围内;在里氏木霉的情况下,ph通常在约3.0至7.0的范围内。微生物ph范围的偏好在一定程度上取决于所采用的培养基以及特定的微生物,并因而随着培养基的变化而稍微改变,如可以通过本领域技术人员容易地确定的。
[0279]
优选地,发酵以使得含碳底物可被控制为限制性因素的方式进行,从而为细胞提供了含碳底物的良好转化并避免这些细胞被基本量的未转化底物污染。后一种情况对水溶性底物而言不是问题,因为任何剩余的痕量物质均可容易地洗掉。然而,在非水溶性底物的情况下这可能是个问题,并且需要增加的产物处理步骤诸如合适的洗涤步骤。
[0280]
如上所述,达到该水平的时间不是关键的,并且可随特定的微生物和所进行的发酵过程而变化。然而,本领域熟知如何确定发酵培养基中的碳源浓度以及期望碳源水平是否已经达到。
[0281]
发酵可以分批或连续操作进行,为了易于控制、产生均一量的产物以及最经济地使用所有设备,分批补料操作是更为优选的。
[0282]
如果需要,在将含水矿质培养基进料至发酵罐之前,可以将碳源和能源材料的部分或全部和/或可同化氮源(诸如氨)的部分添加至该含水矿质培养基。
[0283]
优选以预定的速率,或者响应可通过监测诸如碳和能量底物的浓度、ph、溶解氧、来自发酵罐的废气中的氧或二氧化碳、通过干细胞重量可测量的细胞密度、光透射比等而确定的需求来控制引入反应器的每一种料流。多种材料的进料速度可以变化以便获得与碳源和能源的有效利用相一致的尽可能快的细胞生长速率,以获得相对于底物变化尽可能高的微生物细胞产量。
[0284]
在分批操作或优选的补料分批操作中,一开始对所有的设备、反应器或发酵装置、器皿或容器、管道、附带的循环或冷却设备等进行灭菌,通常通过采用蒸汽诸如在约121℃持续至少约15分钟。然后在存在所有所需的营养素,包括氧和含碳底物的情况下,用所选微生物的培养物接种灭菌过的反应器。所用发酵罐类型并不重要。
[0285]
从发酵肉汤收集和纯化(例如,纤维素酶)酶还可以通过本领域已知的程序进行。发酵肉汤将通常含有细胞碎片,包括细胞、多种悬浮固体和其他生物质污染物(优选将它们通过本领域已知的手段从发酵肉汤去除)以及期望纤维素酶产物。
[0286]
适用于这种去除的方法包括常规的固体-液体分离技术,诸如像离心、过滤、透析、微量过滤、旋转真空过滤或其他已知的方法,以产生无细胞滤液。可以优选地使用技术诸如超滤、蒸发或沉淀在结晶之前进一步浓缩发酵肉汤或无细胞滤液。
[0287]
沉淀上清液或滤液的蛋白组分可以借助于盐(例如硫酸铵)来完成,然后通过各种
色谱程序(例如离子交换色谱、亲和色谱或类似的本领域公认的方法)进行纯化。
[0288]
vii.示例性实施例
[0289]
某些示例性实施例包括:
[0290]
1.一种编码变体ace3转录因子(tf)蛋白的经分离的多核苷酸,其中所述变体ace3 tf与seq id no:2的氨基酸位置1-672具有至少90%序列同一性,并且包含选自seq id no:2的位置673-689的一个或多个c末端氨基酸残基的遗传修饰。
[0291]
2.如实施例1所述的多核苷酸,其中变体ace3 tf包含功能性n末端双核锌簇(zn2cys6)dna结合结构域,所述dna结合结构域与seq id no:29具有至少95%序列同一性。
[0292]
3.如实施例1所述的多核苷酸,其中选自seq id no:2的位置673-689的一个或多个c末端氨基酸残基的所述遗传修饰为氨基酸缺失、氨基酸插入、氨基酸取代或其组合。
[0293]
4.如实施例3所述的多核苷酸,其中一个或多个c末端氨基酸残基的所述遗传修饰包含缺失seq id no:2的至少最后七(7)个c末端氨基酸位置683-689。
[0294]
5.如实施例3所述的多核苷酸,其中一个或多个c末端氨基酸残基的所述遗传修饰包含缺失seq id no:2的至少最后八(8)个c末端氨基酸位置682-689。
[0295]
6.如实施例3所述的多核苷酸,其中一个或多个c末端氨基酸残基的所述遗传修饰包含缺失seq id no:2的至少最后九(9)个c末端氨基酸位置681-689。
[0296]
7.如实施例3所述的多核苷酸,其中一个或多个c末端氨基酸残基的所述遗传修饰包含缺失seq id no:2的至少最后十(10)个c末端氨基酸位置680-689。
[0297]
8.如实施例3所述的多核苷酸,其中一个或多个c末端氨基酸残基的所述遗传修饰包含缺失seq id no:2的至少最后十一(11)个c末端氨基酸位置679-689。
[0298]
9.如实施例3所述的多核苷酸,其中一个或多个c末端氨基酸残基的所述遗传修饰包含缺失seq id no:2的至少最后十二(12)个c末端氨基酸位置678-689。
[0299]
10.如实施例3所述的多核苷酸,其中一个或多个c末端氨基酸残基的所述遗传修饰包含缺失seq id no:2的至少最后十三(13)个c末端氨基酸位置677-689。
[0300]
11.如实施例3所述的多核苷酸,其中一个或多个c末端氨基酸残基的所述遗传修饰包含缺失seq id no:2的至少最后十四(14)个c末端氨基酸位置676-689。
[0301]
12.如实施例3所述的多核苷酸,其中一个或多个c末端氨基酸残基的所述遗传修饰包含缺失seq id no:2的至少最后十五(15)个c末端氨基酸位置675-689。
[0302]
13.如实施例3所述的多核苷酸,其中一个或多个c末端氨基酸残基的所述遗传修饰包含缺失seq id no:2的至少最后十六(16)个c末端氨基酸位置674-689。
[0303]
14.如实施例3所述的多核苷酸,其中一个或多个c末端氨基酸残基的所述遗传修饰包含缺失seq id no:2的至少最后十七(17)个c末端氨基酸位置673-689。
[0304]
15.如实施例3所述的多核苷酸,其中所述变体ace3 tf包含选自seq id no:9至seq id no:18中任一个的氨基酸序列。
[0305]
16.如实施例3所述的多核苷酸,其中选自seq id no:2的位置673-689的一个或多个c末端氨基酸残基的所述遗传修饰为缺失选自seq id no:2的位置673-683的一个或多个氨基酸残基。
[0306]
17.如实施例3所述的多核苷酸,其中选自seq id no:2的位置673-689的一个或多个c末端氨基酸残基的所述遗传修饰为缺失选自seq id no:2的位置673-674、seq id no:2
的位置674-675、seq id no:2的位置675-676、seq id no:2的位置676-677、seq id no:2的位置677-678、seq id no:2的位置678-679、seq id no:2的位置679-680、seq id no:2的位置680-681、seq id no:2的位置681-682、seq id no:2的位置682-683和seq id no:2的位置683-684的两个连续氨基酸残基。
[0307]
18.如实施例3所述的多核苷酸,其中选自seq id no:2的位置673-689的一个或多个c末端氨基酸残基的所述遗传修饰为缺失选自seq id no:2的位置673-675、seq id no:2的位置674-676、seq id no:2的位置675-677、seq id no:2的位置676-678、seq id no:2的位置677-679、seq id no:2的位置678-680、seq id no:2的位置679-681、seq id no:2的位置680-682、seq id no:2的位置681-683、seq id no:2的位置682-684和seq id no:2的位置683-685的三个连续氨基酸残基。
[0308]
19.如实施例3所述的多核苷酸,其中所述变体ace3 tf包含取代选自seq id no:2的氨基酸位置672-683的一个或多个c末端氨基酸残基。
[0309]
20.如实施例19所述的多核苷酸,其中所述变体ace3 tf还包含缺失seq id no:2的至少最后七(7)个c末端氨基酸位置683-689。
[0310]
21.如实施例3所述的多核苷酸,其中所述变体ace3 tf包含在选自seq id no:2的氨基酸位置673-683的c末端氨基酸位置处插入一个或多个氨基酸残基。
[0311]
22.一种包含编码变体ace3转录因子(tf)蛋白的突变的ace3基因的经分离的木霉属物种突变型细胞,其中所述变体ace3 tf蛋白与seq id no:2的氨基酸位置1-672具有至少90%序列同一性,并且包含选自seq id no:2的位置673-689的一个或多个突变的c末端氨基酸残基。
[0312]
23.如实施例22所述的突变型细胞,其中当所述突变型细胞在适用于产生木质纤维素降解酶的条件下发酵时,所述变体ace3 tf蛋白在诱导底物不存在下上调编码木质纤维素降解酶的基因的表达。
[0313]
24.如实施例23所述的突变型细胞,其中所述木质纤维素降解酶选自由纤维二糖水解酶、内切葡聚糖酶和β-葡糖苷酶组成的组。
[0314]
25.如实施例22所述的突变型细胞,其中所述变体ace3 tf蛋白包含功能性n末端双核锌簇dna结合结构域,所述dna结合结构域与seq id no:29具有至少95%序列同一性。
[0315]
26.如实施例22所述的突变型细胞,所述突变型细胞包含编码目的蛋白(poi)的引入的表达盒,其中所述引入的盒包含衍生自编码木质纤维素降解酶的基因的上游(5')启动子序列,所述上游(5')启动子序列可操作地连接到编码poi的下游(3')可读框(orf)序列。
[0316]
27.如实施例22所述的突变型细胞,其中选自seq id no:2的位置673-689的所述一个或多个突变的c末端氨基酸残基包含氨基酸缺失、氨基酸插入、氨基酸取代或其组合。
[0317]
28.如实施例26所述的突变型细胞,其中当在适用于产生所述poi的条件下发酵时,在诱导底物不存在下,所述突变型细胞能够产生所述poi。
[0318]
29.一种目的蛋白(poi),其由如实施例22-28中任一项所述的突变型细胞产生。
[0319]
30.一种衍生自亲代木霉属物种细胞的经遗传修饰的木霉属物种真菌细胞,所述亲代木霉属物种细胞包含编码与seq id no:2具有至少90%序列同一性的ace3转录因子(tf)蛋白的ace3基因,其中所述经遗传修饰的细胞包含编码变体ace3 tf蛋白的经修饰的ace3基因,所述变体ace3 tf蛋白与seq id no:2的氨基酸位置1-672具有至少90%序列同
一性,并且包含选自seq id no:2的位置673-689的一个或多个c末端氨基酸残基的遗传修饰。
[0320]
31.如实施例30所述的经修饰的细胞,其中所述ace3 tf蛋白包含功能性n末端双核锌簇dna结合结构域,所述dna结合结构域与seq id no:29具有至少95%序列同一性。
[0321]
32.如实施例30所述的经修饰的细胞,其中当在适用于产生木质纤维素降解酶的条件下发酵时,在诱导底物不存在下,所述变体ace3 tf蛋白上调编码木质纤维素降解酶的基因的表达。
[0322]
33.如实施例32所述的经修饰的细胞,其中所述木质纤维素降解酶选自由纤维二糖水解酶、内切葡聚糖酶和β-葡糖苷酶组成的组。
[0323]
34.如实施例30所述的经修饰的细胞,所述经修饰的细胞包含编码目的蛋白(poi)的引入的表达盒,其中所述引入的盒包含衍生自编码木质纤维素降解酶的基因的上游(5')启动子序列,所述上游(5')启动子序列可操作地连接到编码poi的下游(3')可读框(orf)序列。
[0324]
35.如实施例30所述的经修饰的细胞,其中选自seq id no:2的位置673-689的所述一个或多个突变的c末端氨基酸残基包含氨基酸缺失、氨基酸插入、氨基酸取代或其组合。
[0325]
36.如实施例34所述的经修饰的细胞,其中当在适用于产生所述poi的条件下发酵时,在诱导底物不存在下,所述经修饰的细胞产生所述poi。
[0326]
37.如实施例34所述的经修饰的细胞,其中相对于当在产生poi的同一条件下发酵时在诱导底物存在下由所述亲代细胞产生的所述poi的量,在诱导底物存在下,所述经修饰的细胞产生增加量的所述相同poi。
[0327]
38.如实施例35所述的经修饰的细胞,其中选自seq id no:2的位置673-689的所述一个或多个突变的c末端氨基酸残基包含缺失seq id no:2的至少最后七(7)个c末端氨基酸位置683-689。
[0328]
39.如实施例35所述的经修饰的细胞,其中选自seq id no:2的位置673-689的所述一个或多个突变的c末端氨基酸残基包含缺失seq id no:2的至少最后八(8)个c末端氨基酸位置682-689。
[0329]
40.如实施例35所述的经修饰的细胞,其中选自seq id no:2的位置673-689的所述一个或多个突变的c末端氨基酸残基包含缺失seq id no:2的至少最后九(9)个c末端氨基酸位置681-689。
[0330]
41.如实施例35所述的经修饰的细胞,其中选自seq id no:2的位置673-689的所述一个或多个突变的c末端氨基酸残基包含缺失seq id no:2的至少最后十(10)个c末端氨基酸位置680-689。
[0331]
42.如实施例35所述的经修饰的细胞,其中选自seq id no:2的位置673-689的所述一个或多个突变的c末端氨基酸残基包含缺失seq id no:2的至少最后十一(11)个c末端氨基酸位置679-689。
[0332]
43.如实施例35所述的经修饰的细胞,其中选自seq id no:2的位置673-689的所述一个或多个突变的c末端氨基酸残基包含缺失seq id no:2的至少最后十二(12)个c末端氨基酸位置678-689。
[0333]
44.如实施例35所述的经修饰的细胞,其中选自seq id no:2的位置673-689的所述一个或多个突变的c末端氨基酸残基包含缺失seq id no:2的至少最后十三(13)个c末端氨基酸位置677-689。
[0334]
45.如实施例35所述的经修饰的细胞,其中选自seq id no:2的位置673-689的所述一个或多个突变的c末端氨基酸残基包含缺失seq id no:2的至少最后十四(14)个c末端氨基酸位置676-689。
[0335]
46.如实施例35所述的经修饰的细胞,其中选自seq id no:2的位置673-689的所述一个或多个突变的c末端氨基酸残基包含缺失seq id no:2的至少最后十五(15)个c末端氨基酸位置675-689。
[0336]
47.如实施例35所述的经修饰的细胞,其中选自seq id no:2的位置673-689的所述一个或多个突变的c末端氨基酸残基包含缺失seq id no:2的至少最后十六(16)个c末端氨基酸位置674-689。
[0337]
48.如实施例35所述的经修饰的细胞,其中选自seq id no:2的位置673-689的所述一个或多个突变的c末端氨基酸残基包含缺失seq id no:2的至少最后十七(17)个c末端氨基酸位置673-689。
[0338]
49.如实施例35所述的经修饰的细胞,其中所述变体ace3 tf包含选自seq id no:9至seq id no:18中任一个的氨基酸序列。
[0339]
50.如实施例35所述的经修饰的细胞,其中选自seq id no:2的位置673-689的一个或多个c末端氨基酸残基的所述遗传修饰为缺失选自seq id no:2的位置673-683的一个或多个氨基酸残基。
[0340]
51.如实施例35所述的经修饰的细胞,其中选自seq id no:2的位置673-689的一个或多个c末端氨基酸残基的所述遗传修饰为缺失选自seq id no:2的位置673-674、seq id no:2的位置674-675、seq id no:2的位置675-676、seq id no:2的位置676-677、seq id no:2的位置677-678、seq id no:2的位置678-679、seq id no:2的位置679-680、seq id no:2的位置680-681、seq id no:2的位置681-682、seq id no:2的位置682-683和seq id no:2的位置683-684的两个连续氨基酸残基。
[0341]
52.如实施例35所述的经修饰的细胞,其中选自seq id no:2的位置673-689的一个或多个c末端氨基酸残基的所述遗传修饰为缺失选自seq id no:2的位置673-675、seq id no:2的位置674-676、seq id no:2的位置675-677、seq id no:2的位置676-678、seq id no:2的位置677-679、seq id no:2的位置678-680、seq id no:2的位置679-681、seq id no:2的位置680-682、seq id no:2的位置681-683、seq id no:2的位置682-684和seq id no:2的位置683-685的三个连续氨基酸残基。
[0342]
53.如实施例35所述的经修饰的细胞,其中所述变体ace3 tf包含取代选自seq id no:2的氨基酸位置672-683的一个或多个c末端氨基酸残基。
[0343]
54.如实施例53所述的经修饰的细胞,其中所述变体ace3 tf还包含缺失seq id no:2的至少最后七(7)个c末端氨基酸位置683-689。
[0344]
55.如实施例35所述的经修饰的细胞,其中所述变体ace3 tf包含在选自seq id no:2的氨基酸位置673-683的c末端氨基酸位置处插入一个或多个氨基酸残基。
[0345]
56.如实施例32、36或37中任一项所述的经修饰的细胞,其中所述诱导底物选自乳
糖、槐糖、龙胆二糖和纤维素。
[0346]
57.一种木质纤维素降解酶,所述木质纤维素降解酶由如实施例32所述的经修饰的细胞产生。
[0347]
58.一种目的蛋白(poi),所述目的蛋白由如实施例34所述的经修饰的细胞产生。
[0348]
59.一种衍生自亲代木霉属物种细胞的经遗传修饰的木霉属物种真菌细胞,所述亲代木霉属物种细胞包含编码与seq id no:4具有至少90%序列同一性的变体ace3转录因子(tf)蛋白的突变的ace3基因,其中seq id no:4的n末端不包含seq id no:29所示的完整的双核锌(zn2cys6)dna结合,其中所述经遗传修饰的细胞包含编码变体ace3tf蛋白的经修饰的ace3基因,所述变体ace3 tf蛋白与seq id no:2的位置1-672具有至少90%序列同一性,其中seq id no:2的n末端包含seq id no:29所示的完整的双核锌(zn2cys6)dna结合,并且所述变体ace3 tf蛋白包含选自seq id no:2的位置673-689的一个或多个c末端氨基酸残基的遗传修饰。
[0349]
60.如实施例59所述的经修饰的细胞,其中当在适用于产生木质纤维素降解酶的条件下发酵时,在诱导底物不存在下,所述变体ace3 tf蛋白上调编码木质纤维素降解酶的基因的表达。
[0350]
61.如实施例59所述的经修饰的细胞,其中所述变体ace3 tf蛋白在诱导底物存在下上调编码木质纤维素降解酶的基因的表达,使得相对于当所述经修饰的细胞和亲代细胞在产生木质纤维素降解酶的相同条件下发酵时,在所述相同诱导底物存在下由所述亲代细胞产生的所述木质纤维素降解酶的量,所述经修饰的细胞产生增加量的所述相同木质纤维素降解酶。
[0351]
62.如实施例59所述的经修饰的细胞,所述经修饰的细胞包含编码目的蛋白(poi)的引入的表达盒,其中所述引入的盒包含衍生自编码木质纤维素降解酶的基因的上游(5')启动子序列,所述上游(5')启动子序列可操作地连接到编码poi的下游(3')可读框(orf)序列。
[0352]
63.如实施例62所述的经修饰的细胞,其中当在适用于产生所述poi的条件下发酵时,在诱导底物不存在下,所述经修饰的细胞产生所述poi。
[0353]
64.如实施例62所述的经修饰的细胞,其中相对于当所述经修饰的细胞和亲代细胞在产生poi的相同条件下发酵时在诱导底物存在下包含编码所述poi的引入的相同表达盒的所述亲代细胞,在诱导底物存在下,所述经修饰的细胞产生增加量的所述相同poi。
[0354]
65.如实施例59所述的经修饰的细胞,其中选自seq id no:2的位置673-689的所述一个或多个突变的c末端氨基酸残基包含氨基酸缺失、氨基酸插入、氨基酸取代或其组合。
[0355]
66.如实施例59所述的经修饰的细胞,其中选自seq id no:2的位置673-689的所述一个或多个突变的c末端氨基酸残基包含缺失seq id no:2的至少最后七(7)个c末端氨基酸位置683-689。
[0356]
67.如实施例59所述的经修饰的细胞,其中选自seq id no:2的位置673-689的所述一个或多个突变的c末端氨基酸残基包含缺失seq id no:2的至少最后八(8)个c末端氨基酸位置682-689。
[0357]
68.如实施例59所述的经修饰的细胞,其中选自seq id no:2的位置673-689的所
id no:2的位置674-676、seq id no:2的位置675-677、seq id no:2的位置676-678、seq id no:2的位置677-679、seq id no:2的位置678-680、seq id no:2的位置679-681、seq id no:2的位置680-682、seq id no:2的位置681-683、seq id no:2的位置682-684和seq id no:2的位置683-685的三个连续氨基酸残基。
[0370]
81.如实施例59所述的经修饰的细胞,其中所述变体ace3 tf包含取代选自seq id no:2的氨基酸位置672-683的一个或多个c末端氨基酸残基。
[0371]
82.如实施例81所述的经修饰的细胞,其中所述变体ace3 tf还包含缺失seq id no:2的至少最后七(7)个c末端氨基酸位置683-689。
[0372]
83.如实施例59所述的经修饰的细胞,其中所述变体ace3 tf包含在选自seq id no:2的氨基酸位置673-683的c末端氨基酸位置处插入一个或多个氨基酸残基。
[0373]
84.如权利要求61、64或65中任一项所述的经修饰的细胞,其中所述诱导底物选自乳糖、槐糖、龙胆二糖和纤维素。
[0374]
85.一种木质纤维素降解酶,所述木质纤维素降解酶由如实施例61所述的经修饰的细胞产生。
[0375]
86.一种目的蛋白(poi),所述目的蛋白由如实施例63所述的经修饰的细胞产生。
[0376]
87.一种用于筛选在诱导底物不存在下诱导编码木质纤维素降解酶的基因的表达的变体ace3 tf蛋白的方法,所述方法包括:(a)构建编码多种变体ace3 tf蛋白的dna文库,所述变体ace3 tf蛋白在选自seq id no:2的位置673-683的一个或多个c末端氨基酸位置处包含经修饰的氨基酸残基,(b)用来自步骤(a)的所述dna文库的dna序列转化多种木霉属物种细胞,以及(c)在适用于产生木质纤维素降解酶的条件下在诱导底物不存在下培养和筛选所述多种转化的木霉属物种细胞,其中筛选出的表达编码木质纤维素降解酶的基因的木霉属物种细胞鉴定其中的dna文库序列,所述dna文库序列编码在诱导底物不存在下诱导木质纤维素降解酶基因的表达的变体ace3 tf蛋白。
[0377]
88.如实施例87所述的方法,所述方法进一步包括分离包含如下dna文库序列的转化的木霉属物种细胞,所述dna文库序列编码在诱导底物不存在下诱导木质纤维素降解酶的表达的变体ace3 tf蛋白。
[0378]
89.如实施例88所述的方法,所述方法进一步包括分离编码所述变体ace3 tf蛋白的dna序列。
[0379]
90.一种筛选变体ace3 tf蛋白的方法,相对于在诱导底物存在下,由seq id no:2的具有野生型c末端的ace3 tf蛋白调节的编码木质纤维素降解酶的基因的表达,所述变体ace3 tf蛋白在所述相同诱导底物存在下上调编码所述相同木质纤维素降解酶的相同基因的表达,该方法包括:(a)构建编码多种变体ace3 tf蛋白的dna文库,所述变体ace3 tf蛋白在选自seq id no:2的位置673-683的一个或多个c末端氨基酸位置处包含经修饰的氨基酸残基,(b)用来自步骤(a)的所述dna文库的dna序列转化多种木霉属物种细胞,以及(c)在适用于产生木质纤维素降解酶的条件下在诱导底物存在下培养和筛选所述多种转化的木霉属物种细胞,其中筛选出的木霉属物种细胞鉴定其中的dna文库序列,相对于由包含编码seq id no:2的具有野生型c末端的ace3tf蛋白的基因的木霉属物种对照细胞产生的木质纤维素降解酶的量,所述筛选出的木霉属物种细胞产生增加量的所述相同木质纤维素降解酶,所述dna文库序列编码在诱导底物存在下上调木质纤维素降解酶基因的表达的变体
ace3 tf蛋白。
[0380]
91.如实施例90所述的方法,所述方法进一步包括分离包含如下dna文库序列的转化的木霉属物种细胞,所述dna文库序列编码在诱导底物存在下上调木质纤维素降解酶基因的表达的变体ace3 tf蛋白。
[0381]
92.如实施例91所述的方法,所述方法进一步包括分离编码所述变体ace3 tf蛋白的dna序列。
[0382]
93.一种筛选在诱导底物不存在下诱导编码报告蛋白的基因的表达的变体ace3 tf蛋白的方法,所述方法包括:(a)构建编码多种变体ace3tf蛋白的dna文库,所述变体ace3 tf蛋白在选自seq id no:2的位置673-683的一个或多个c末端氨基酸位置处包含经修饰的氨基酸残基,(b)用来自步骤(a)的所述dna文库的dna序列转化多种木霉属物种细胞,其中所述转化的木霉属物种细胞包含引入的表达盒,所述表达盒包含可操作地连接到编码报告蛋白的可读框(orf)的上游(5')纤维素酶启动子,以及(c)培养所述多种转化的木霉属物种细胞,并针对在诱导底物不存在下编码报告蛋白的所述orf的表达进行筛选,其中筛选出的表达编码所述报告蛋白的orf的木霉属物种细胞鉴定其中的dna文库序列,所述dna文库序列编码在诱导底物不存在下诱导编码所述报告蛋白的orf的表达的变体ace3 tf蛋白。
[0383]
94.如实施例93所述的方法,所述方法进一步包括分离包含如下dna文库序列的转化的木霉属物种细胞,所述dna文库序列编码在诱导底物不存在下诱导编码所述报告蛋白的orf的表达的变体ace3 tf蛋白。
[0384]
95.如实施例93所述的方法,所述方法进一步包括分离编码所述变体ace3 tf蛋白的dna序列。
[0385]
96.一种筛选变体ace3 tf蛋白的方法,相对于在诱导底物存在下,由seq id no:2的具有野生型c末端的ace3 tf蛋白调节的编码报告蛋白的基因的表达,所述变体ace3 tf蛋白在所述相同诱导底物存在下上调编码所述相同报告蛋白的相同基因的表达,该方法包括:(a)构建编码多种变体ace3 tf蛋白的dna文库,所述变体ace3 tf蛋白在选自seq id no:2的位置673-683的一个或多个c末端氨基酸位置处包含经修饰的氨基酸残基,(b)用来自步骤(a)的所述dna文库的dna序列转化多种木霉属物种细胞,其中所述转化的木霉属物种细胞包含引入的表达盒,所述表达盒包含可操作地连接到编码报告蛋白的可读框(orf)的上游(5')纤维素酶启动子,并且任选地包含在木霉属物种细胞中可操作的下游(3')终止子序列,以及(c)培养所述多种转化的木霉属物种细胞,并针对在诱导底物存在下编码报告蛋白的所述orf的表达进行筛选,其中筛选出的木霉属物种细胞鉴定其中的dna文库序列,相对于由包含编码seq id no:2的具有野生型c末端的ace3 tf蛋白的基因且包含步骤(b)的所述表达盒的木霉属物种对照细胞产生的所述报告蛋白的量,所述筛选出的木霉属物种细胞产生增加量的所述相同报告蛋白,所述dna文库序列编码在诱导底物存在下上调编码所述报告蛋白的orf的表达的变体ace3 tf蛋白。
[0386]
97.如实施例96所述的方法,所述方法进一步包括分离包含如下dna文库序列的转化的木霉属物种细胞,所述dna文库序列编码在诱导底物存在下上调编码所述报告蛋白的orf的表达的变体ace3 tf蛋白。
[0387]
98.如实施例97所述的方法,所述方法进一步包括分离编码所述变体ace3 tf蛋白的dna序列。
[0388]
99.如实施例87或实施例90所述的方法,其中所述木质纤维素降解酶选自由纤维二糖水解酶、内切葡聚糖酶和β-葡糖苷酶组成的组。
[0389]
100.如实施例93或实施例96所述的方法,其中所述纤维素酶启动子选自由以下组成的组:纤维二糖水解酶启动子序列、内切葡聚糖酶启动子序列、β-葡糖苷酶启动子序列和木聚糖酶启动子序列。
[0390]
101.如实施例87、90、93或96中任一项所述的方法,其中所述诱导底物选自乳糖、槐糖、龙胆二糖和纤维素。
[0391]
102.一种用于在诱导底物不存在下在木霉属物种真菌细胞中产生木质纤维素降解酶的方法,所述方法包括:(a)分离包含编码变体ace3转录因子(tf)蛋白的突变的ace3基因的突变型里氏木霉细胞,其中所述变体ace3 tf蛋白与seq id no:2的氨基酸位置1-672具有至少90%序列同一性,并且包含选自seq id no:2的位置673-689的一个或多个突变的c末端氨基酸残基,以及(b)在适用于产生木质纤维素降解酶的条件下发酵所述经分离的突变型细胞,其中所述合适的发酵条件不包括诱导底物。
[0392]
104.如实施例103所述的方法,其中所述木质纤维素降解酶选自由纤维二糖水解酶、内切葡聚糖酶和β-葡糖苷酶组成的组。
[0393]
105.一种用于在诱导底物不存在下在经遗传修饰的木霉属物种真菌细胞中产生木质纤维素降解酶的方法,所述方法包括:(a)获得包含编码野生型ace3转录因子(tf)蛋白的ace3基因的木霉属物种真菌细胞,所述野生型ace3转录因子(tf)蛋白与seq id no:2的氨基酸位置1-689具有至少90%序列同一性,
[0394]
(b)对步骤(a)的所述木霉属物种细胞的ace3基因进行遗传修饰,其中所述经修饰的ace3基因编码变体ace3 tf蛋白,所述变体ace3 tf蛋白与seq id no:2的氨基酸位置1-672具有至少90%序列同一性,并且包含选自seq id no:2的位置673-689的一个或多个突变的c末端氨基酸残基,以及(c)在适用于产生木质纤维素降解酶的条件下发酵步骤(b)的所述经修饰的木霉属物种细胞,其中所述合适的发酵条件不包括诱导底物。
[0395]
106.如实施例105所述的方法,其中所述野生型ace3 tf蛋白的c末端与seq id no:2的氨基酸位置673-689具有至少95%序列同一性。
[0396]
107.一种用于在诱导底物不存在下在经遗传修饰的木霉属物种真菌细胞中产生木质纤维素降解酶的方法,所述方法包括:(a)获得包含编码变体ace3 tf蛋白的ace3基因的木霉属物种真菌细胞,所述变体ace3tf蛋白与seq id no:4的ace3-s tf蛋白具有至少90%序列同一性,(b)对步骤(a)的所述木霉属物种细胞的ace3基因进行遗传修饰,其中所述经修饰的ace3基因编码变体ace3 tf蛋白,所述变体ace3 tf蛋白与seq id no:2的氨基酸位置1-672具有至少90%序列同一性,并且包含选自seq id no:2的位置673-689的一个或多个突变的c末端氨基酸残基,以及(c)在适用于产生木质纤维素降解酶的条件下发酵步骤(b)的所述经修饰的木霉属物种细胞,其中所述合适的发酵条件不包括诱导底物。
[0397]
108.如实施例107所述的方法,其中与seq id no:4的ace3-s tf蛋白具有至少90%序列同一性的所述变体ace3 tf蛋白不包含seq id no:29所示的完整的双核锌(zn2cys6)dna结合。
[0398]
109.如实施例107所述的方法,其中编码与seq id no:2的氨基酸位置1-672具有至少90%序列同一性的变体ace3 tf蛋白的所述经遗传修饰的ace3基因包含seq id no:29
所示的完整的双核锌(zn2cys6)dna结合。
[0399]
110.一种用于在诱导底物不存在下在经修饰的木霉属物种细胞中产生目的蛋白(poi)的方法,所述方法包括:(a)获得包含编码野生型ace3转录因子(tf)蛋白的ace3基因的木霉属物种真菌细胞,所述野生型ace3转录因子(tf)蛋白与seq id no:2的氨基酸位置1-689具有至少90%序列同一性,(b)对步骤(a)的所述木霉属物种细胞的ace3基因进行遗传修饰,其中所述经修饰的ace3基因编码变体ace3 tf蛋白,所述变体ace3 tf蛋白与seq id no:2的氨基酸位置1-672具有至少90%序列同一性,并且包含选自seq id no:2的位置673-689的一个或多个突变的c末端氨基酸残基,(c)将编码poi的表达盒引入步骤(b)的所述经修饰的木霉属物种细胞中,其中所述表达盒包含衍生自编码木质纤维素降解酶的基因的上游(5')启动子序列,所述上游(5')启动子序列可操作地连接到编码poi的下游(3')可读框(orf)序列,以及(d)在适用于产生所述poi的条件下发酵步骤(c)的所述经修饰的木霉属物种细胞,其中所述合适的发酵条件不包括诱导底物。
[0400]
111.如实施例110所述的方法,其中步骤(b)和(c)同时进行或以任何顺序进行。
[0401]
112.一种用于在诱导底物不存在下在经修饰的木霉属物种细胞中产生目的蛋白(poi)的方法,所述方法包括:(a)获得包含编码变体ace3tf蛋白的ace3基因的木霉属物种真菌细胞,所述变体ace3 tf蛋白与seq id no:4的ace3-s tf蛋白具有至少90%序列同一性,(b)对步骤(a)的所述木霉属物种细胞的ace3基因进行遗传修饰,其中所述经修饰的ace3基因编码变体ace3 tf蛋白,所述变体ace3 tf蛋白与seq id no:2的氨基酸位置1-672具有至少90%序列同一性,并且包含选自seq id no:2的位置673-689的一个或多个突变的c末端氨基酸残基,(c)将编码poi的表达盒引入步骤(b)的所述经修饰的木霉属物种细胞中,其中所述表达盒包含衍生自编码木质纤维素降解酶的基因的上游(5')启动子序列,所述上游(5')启动子序列可操作地连接到编码poi的下游(3')可读框(orf)序列,以及(d)在适用于产生所述poi的条件下发酵步骤(c)的所述经修饰的木霉属物种细胞,其中所述合适的发酵条件不包括诱导底物。
[0402]
113.如实施例110所述的方法,其中步骤(b)和(c)同时进行或以任何顺序进行。
[0403]
实例
[0404]
应理解,尽管以下实例说明了本公开的实施例,但仅是通过说明的方式给出的。从上述讨论和这些实例,本领域技术人员可以对本公开进行各种改变和修改以使其适应各种用途和条件。此类修改也旨在落入请求保护的发明的范围内。
[0405]
实例1
[0406]
包含c末端截短的ace3-l蛋白
[0407]
a.概述
[0408]
ace3是一种里氏木霉转录因子,其在诱导条件下(例如,在乳糖存在下)调节纤维素酶和半纤维素酶的产生。同样,在pct公开号wo2018/067599中已经鉴定并描述了名为“ace3l”的ace3转录因子的高度功能形式。例如,如wo 2018/067599公开中所述,表达ace3l转录因子(例如,seq id no:6)的里氏木霉菌株不仅在诱导物(例如,乳糖、槐糖)存在下显示增强的(增加的)蛋白质产生,而且在诱导物不存在下显示显著增加的蛋白质产生。
[0409]
ace3转录因子在其c末端具有两(2)种已知变体。例如,里氏木霉菌株qm6a中的ace3基因编码ace3-s蛋白(图1),该ace3-s蛋白包含由ace3基因编码的全长(野生型)c末
端,而rl-p37和rut-c30里氏木霉菌株中的相同ace3基因含有过早终止密码子,导致所编码蛋白的十一(11)个氨基酸截短(图1;seq id no:6)。另外,如图1所示,相对于ace3-s蛋白(seq id no:4),ace3l蛋白在n末端包含完整的双核锌簇(zn2cys6)dna结合结构域(图3;seq id no:6)。通过将过早终止密码子回复为谷氨酰胺密码子来产生ace3-lc变体;因此,其在n末端包含完整的双核锌簇(zn2cys6)dna结合结构域,并且在c末端具有全长(野生型)序列。
[0410]
如本文所述和例证,在诱导剂不存在和存在下,ace3蛋白的截短的c末端和ace3蛋白的完整的n末端双核锌簇(zn2cys6)dna结合结构域都是该ace3蛋白增加蛋白质产生的功能的必需特征。在本实例中,申请人通过如下所述选择性地截短c末端氨基酸来进一步评价了ace3蛋白的c末端氨基酸区域。以下实例中使用的里氏木霉亲代细胞衍生自里氏木霉菌株rl-p37(nrrl保藏号15709),其中里氏木霉pyr4基因已缺失,如sheir-neiss和montenecourt,1984中一般描述。
[0411]
b.表达载体和菌株构建
[0412]
构建了两(2)组具有ace3 c末端截短的表达载体。第一组六(6)个载体以五(5)个氨基酸的增量含有在零(0)到二十五(25)个氨基酸范围内的c末端截短(参见,表1;第1组)。第二组十二(12)个载体以一(1)个氨基酸的增量含有在六(6)到十九(19)个氨基酸范围内的c末端截短(参见,表1;第2组)。
[0413]
使用标准分子生物学程序构建了这十八(18)种ace3-lc c末端变体表达载体。这些载体被设计用于能够在里氏木霉的葡糖淀粉酶(gla1)基因座处靶向整合ace3表达盒。其具有靶向整合所需的里氏木霉gla1基因座的5'和3'侧翼。5'侧翼序列包含1.5kb同源盒,该1.5kb同源盒与对应于支架序列_1:1489226-1490662的dna序列同源。3'侧翼dna序列包含1.5kb同源盒,该1.5kb同源盒与对应于支架序列_1:1492835-1494335的dna序列同源。这些序列被设计用于靶向gla1基因(jgi蛋白质id trire2_1885),并用插入的盒序列置换5'侧翼与3'侧翼之间的基因组区域(支架序列_1:1490663至-1492834)。这些表达载体还包含异源里氏木霉dic1启动子序列(支架序列_8:1376871-1378833,例如参见pct公开号wo 2018/067599),该异源里氏木霉dic1启动子序列与天然ace3基因终止子一起可操作地连接到ace3 orf编码序列。另外,这些载体还含有用于选择里氏木霉转化体的pyr4标记以及其天然启动子和终止子。包括pyr4启动子的重复序列以使得能够在gla1基因座整合后切除pyr4基因。这些载体还含有用于在大肠杆菌(e.coli)中复制和选择的细菌cole1 ori和ampr基因,用于在酿酒酵母(s.cerevisiae)中复制和选择的酵母2μori和ura3基因。图2显示了代表性的载体图,该载体图描述了含有编码ace3-lc蛋白(seq id no:2;即,包含全长野生型c末端)的orf的载体pyl72。其他载体(例如,pyl73、pyl74等)包含编码各种c末端截短的ace3蛋白的orf序列(表1)。
[0414]
用pmei消化表1中呈现的表达载体以释放片段用于靶向整合并用琼脂糖凝胶电泳进行分离。根据制造商的方案,用凝胶提取试剂盒(凯杰公司(qiagen))从凝胶中分离出正确的片段。如pct公开号wo/2016/100568中一般所示,根据制造商的方案(synthego)体外组装cas9核酸酶和靶向gla1基因内23bp序列的合成单指导rna(sgrna)(seq id no:70)。使用约十(10)μg纯化的片段和组装的cas9-sgrna复合物来转化里氏木霉(rl-p37)菌株的pyr4-突变型的原生质体。使用聚乙二醇(peg)介导的原生质体转化方案进行转化(ouedraogo等人,2015;penttila等人,1987)。
[0415]
使转化体在vogel基本培养基琼脂板上生长,以选择由pyr4标记获得的尿苷原养型。筛选生长的克隆用于使用表2中列出的引物通过pcr正确整合。将给出预期信号的克隆纯化为单细胞克隆,并使用表2中列出的引物通过pcr针对正确整合和克隆纯度来重新筛选。通过sanger测序对pcr产物进行测序,以验证指定的ace3 c末端截短变体的存在。表3列出了纯化和序列验证的ace3 c末端截短变体。
[0416]
表1
[0417]
具有c末端截短的ace3-lc表达载体
[0418][0419]
*aa是氨基酸的缩写
[0420]
表2
[0421]
用于筛选正确的转化体的pcr引物
[0422][0423][0424]
表3
[0425]
里氏木霉菌株
[0426][0427][0428]
c.不同ace3转化体的培养
[0429]
在“非诱导”(葡萄糖)和“诱导”(葡萄糖/槐糖或乳糖)条件下都测试了上述亲代(lt338)和转化的(子代)里氏木霉细胞(表3)。例如,在“非诱导”条件下,使细胞在常规二十四(24)孔微量板(mtp)中补充有2%葡萄糖(重量/体积)的1.25ml成分确定的培养基液体肉汤中生长。在“诱导”条件下,使细胞在二十四(24)孔mtp中补充有2%乳糖或2%葡萄糖/槐糖(重量/体积)的1.25ml成分确定的培养基液体肉汤中生长,其中乳糖或槐糖作为用于纤维素酶表达的有效诱导物。
[0430]
将mtp培养物在28℃、250rpm、85%湿度下孵育五(5)天。孵育后,根据制造商的方案,收获来自所有培养物的上清液,并使用bio-rad试剂(thermo 目录号:
23236)和作为标准的牛血清白蛋白(bsa)的五(5)个稀释液在595nm下通过bradford染料结合测定测量总分泌蛋白。
[0431]
d.具有十个至十五个氨基酸c末端截短的ace3-lc变体是功能性的
[0432]
如图7所示,申请人评价了表达ace3-lc变体的第一组菌株(表1;第1组和表3)的总蛋白质产量,这些ace3-lc变体在c末端具有五(5)个、十(10)个、十五(15)个、二十(20)个和二十五(25)个氨基酸截短(例如,参见表1;第1组;表3和图7)。如图7所示,亲代对照菌株rl-p37只能在乳糖上(即,在诱导条件下)产生大量蛋白质,而在葡萄糖上(即,在非诱导条件下)产生最小基础水平的蛋白质。在乳糖(诱导)和葡萄糖(非诱导)条件下,表达具有十(10)个氨基酸截短的ace3-l(seq id no:12)或十五(15)个氨基酸截短的ace3-l(seq id no:16)的子代细胞都展现了蛋白质产生增加。因此,如图7所呈现,相对于亲代菌株(rl-p37)在乳糖存在下产生的蛋白质水平,葡萄糖存在下的倍数变化增加约为1.8倍,并且乳糖存在下的倍数变化增加约为3倍。
[0433]
例如,总蛋白质产量的此种改进类似于pct公开号wo 2018/067599中描述的对于包含十一(11)个氨基酸截短的ace3-l蛋白(seq id no:6)观察到的蛋白质产生的改进。在乳糖和葡萄糖存在下,五(5)个氨基酸截短(seq id no:7)都显示了与亲代菌株类似的蛋白质表达水平。在乳糖和葡萄糖存在下,零(0)个氨基酸(即,ace3-lc;wt c末端;seq id no:2),二十(20)个氨基酸(seq id no:21)或二十五(25)个氨基酸(seq id no:22)截短都显著降低了总蛋白质产量。这些结果展现,ace3蛋白c末端截短对于其在上调蛋白质产生中的功能是必需的。同样,如图7所示,ace3 c末端处允许的氨基酸截短数量有上限和下限。
[0434]
e.具有七个至十七个氨基酸c末端截短的ace3-lc变体是功能性的
[0435]
为了进一步探索ace3 c末端氨基酸截短允许的上限和下限,申请人构建并测试了包含c末端截短在五(5)与二十(20)个氨基酸之间的ace3-lc的里氏木霉菌株(即,使用一(1)个氨基酸截短增量;例如,参见表1、表3和图8)。例如,五(5)个或六(6)个氨基酸截短(图8)显示与亲代菌株类似的结果(即,在葡萄糖存在下具有基础蛋白质产生,以及在乳糖存在下具有高产生)。相比之下,至少七(7)个至十七(17)个氨基酸截短在葡萄糖和乳糖存在下都显示产生改进,这类似于之前对于ace3-l蛋白中十一(11)个氨基酸截短的观察结果(图8)。此外,十八(18)个或更多c末端氨基酸截短将乳糖和葡萄糖存在下的蛋白质产生都显著降低到基础水平(图8)。
[0436]
因此,如上所述,在诱导物存在和诱导物不存在下,(ace3)c末端在ace3蛋白的功能(即,调节蛋白质产生)中都起必需的作用。例如,与亲代菌株rl-p37在乳糖(诱导)条件下相比,表达具有七(7)个至十七(17)个氨基酸截短的ace3-lc蛋白的菌株在葡萄糖(非诱导)条件下显示总蛋白质产量改进约2倍,并且与亲代菌株rl-p37在乳糖(诱导)条件下相比,这些菌株还在乳糖(诱导)条件下显示总蛋白质产量改进约3倍。相比之下,与亲代菌株在乳糖(诱导)条件下相比,表达具有野生型c末端或具有五(5)个、六(6)个、十八(18)个或更多氨基酸截短的c末端的ace3-lc的菌株在葡萄糖(非诱导)条件下产生最少量的蛋白质,并且这些菌株在乳糖(诱导)条件下产生类似或减少量的蛋白质。因此,如本文所展现,包含具有至少七(7)个氨基酸截短的ace3-lc蛋白(seq id no:9)和至多十七(17)个氨基酸截短的ace3-lc蛋白(seq id no:18)的里氏木霉菌株包含增强的蛋白质产生表型(相对于测试的其他菌株),在诱导物存在和不存在诱导物的情况下都观察到该增强的蛋白质产生表型。
[0437]
实例2
[0438]
ace3截短的回复
[0439]
a.概述
[0440]
工业上重要的木霉属菌株rut-c30和rl-p37是木霉菌天然分离物qm6a的诱变衍生物(le crom等人,2009;sheir-neiss和montenecourt,1984),其中菌株ng14是最后的共同母菌株。ng14与qm6a的基因组比较鉴定了与原始菌株qm6a(pmid:19805272)之间的一百二十六(126)种单核苷酸多态性(snp)和二十二(22)个插入和缺失(indel)。
[0441]
其中之一是编码转录因子的基因中的点突变,根据当时可用的计算预测的基因结构,预测该点突变会引起十一(11)个氨基酸的c末端截短。后来,在基因敲除引起在诱导条件下(例如,在乳糖存在下;hakkinen等人,2014)纤维素酶和半纤维素酶产生显著损失后,将此转录因子命名为ace3。先前申请人已经显示,十一(11)个氨基酸截短对于ace3-l(ace3的特定变体)在过量表达时在诱导物存在和不存在下都改进蛋白质产生的功能是必需的(例如,参见pct公开号wo 2018/067599)。
[0442]
如以上实例1中所示,申请人已确定了改进蛋白质产生所需的c末端(氨基酸)截短(即,7~17个氨基酸)的精确数量。在本实例中,申请人已经在分子水平上将ace3基因座处的c末端截短点突变回复回qm6a的“野生型”(c末端)序列,该“野生型”(c末端)序列编码包含野生型n末端的全长ace3蛋白(图1a;seq id no:2)和以甘氨酸(g)封端的野生型c末端(图1b;seq id no:2)。如下所述,表达全长ace3转录因子(seq id no:2)的菌株显示蛋白质产生减少。
[0443]
b.里氏木霉宿主菌株
[0444]
如sheir-neiss和montenecourt(1984)所述,本实例中描述的里氏木霉亲代菌株衍生自里氏木霉菌株rl-p37(nrrl保藏号15709)。本文命名为“t4abc pyr2”的菌株是rl-p37的诱变衍生物,其在pyr2基因中具有显著的突变,使得该菌株需要尿苷来生长,并且具有增加总蛋白产量的nik1(m743t)突变(例如,参见,美国专利公开号2018/0037919)。
[0445]
c.表达载体和菌株构建
[0446]
木霉属ace3回复盒质粒pratt346是使用标准分子生物学程序制备的,因此本领域技术人员可以容易地从所公开的相关dna部分重建此质粒。pratt34质粒包括具有2.0kb同源盒的dna序列,所述同源盒与对应于支架序列8,422475至424516的dna序列(左侧翼)同源。此左侧翼内对应于支架序列8,424132的核苷酸是如qm6a基因组中的胞嘧啶(c),与ng14和包括t4abc的衍生物的基因组中的胸腺嘧啶(t)相反。质粒中还包括具有1.8kb同源盒的dna序列,所述同源盒与对应于支架序列8,424588至426381的dna序列(右侧翼)同源。设计这些序列以靶向ace3基因,并用插入的盒序列置换左侧翼与右侧翼之间的基因组区域(支架序列8,424517至424587)。
[0447]
这些插入的盒序列包括来自深绿木霉的pyr2选择标记,其旨在使与待转化菌株基因组中的内源里氏木霉pyr2的同源性达最小。紧邻pyr2选择标记上游的是标记3'末端的直接重复复制序列(重复序列),其有助于标记的后续缺失以及转化体/破坏物的有用pyr2突变衍生物的分离。在具有正确靶向的插入盒序列的转化体的亚组中,左侧翼中的胞嘧啶(c)核苷酸也将被掺入到基因组中,从而取代突变型胸腺嘧啶(t)核苷酸(支架序列8,424132)。本文所述的ace3回复等位基因(编码全长ace3;seq id no:2)既在支架序列8,424132处含
有核苷酸回复,又在支架序列8,424517至424587之间含有重复侧翼pyr2标记的插入。
[0448]
因此,使用peg介导的转化,用来自pratt346的ace3回复盒转化菌株t4abc pyr2,并将其铺在含有1.2m山梨糖醇的vogel基本培养基(vogel,1956)上,以基于由pyr2标记获得的尿苷原营养来选择候选株。木霉属转化是本领域中众所周知的并且已有描述(例如,参见美国专利号5,246,853)。分离出单独的转化体,并通过转移到vogel基本培养基中进行繁殖。使用本领域技术人员已知的方法按照以下指南,使用pcr分析鉴定ace3回复盒通过同源重组整合在ace3基因座处的转化体。
[0449]
仅重组细胞的亚组可以成功地利用同源侧翼正确地靶向目的基因的破坏,因此可能需要筛选许多转化体来鉴定具有所需事件的转化体。可以使用pcr来测试哪些重组细胞具有所需的靶向破坏。必须设计在每个同源盒区域内扩增的引物,其中一个引物在可选择标记内距最接近末端大于100bp的位置起始,并且其他引物在相邻基因组序列内超出同源盒区域的末端大于100bp的位置起始。可能含有正确的靶向破坏的细胞将成功建立跨越破坏盒左侧翼和右侧翼的pcr产物,而失败的转化事件将不会产生预期大小的产物。在此阶段,培养物可能是转化细胞和未转化细胞的混合物,因此可能需要纯化步骤。可以通过pcr针对跨越破坏位点的短pcr产物的缺失测试培养物的纯化。
[0450]
孢子纯化后,进行进一步pcr分析以确保正确地发生整合并且转化体是同核的。然后,将跨越回复突变的ace3基因部分进行pcr扩增和测序,以判定整合事件期间是否掺入了左侧翼中的此突变。将所产生的具有证实的ace3回复盒同源整合的菌株命名为“t4abc ace3_rev”。
[0451]
d.ace3回复转化体的发酵
[0452]
在摇瓶发酵中评价了三(3)种菌株的蛋白质产生,这三(3)种菌株包括菌株“t4abc”(含有ace3截短等位基因)、“t4abc ace3_rev”(含有ace3全长等位基因)和“t4abc del-cbh1”(含有cbh1纤维二糖水解酶基因缺失)。在两(2)个独立的摇瓶中评价每种菌株(例如,烧瓶a和烧瓶b)。
[0453]
成分确定的液体(ld)培养基(例如,参见,美国专利号8,455,631)含有以下组分:酪蛋白氨基酸,9g/l;(nh4)2so4,5g/l;mgso4·
7h2o,1g/l;kh2po4,4.5g/l;cacl2·
2h2o,1g/l,pipps,33g/l,400
×
里氏木霉微量元素,2.5ml/l;用naoh将ph调节至5.5。灭菌后,添加乳糖或葡萄糖/槐糖混合物至最终浓度为1.6w/v%。
[0454]
为了产生种子培养物,将每种菌株的孢子分别添加到250ml烧瓶中的50ml yeg(5g/l酵母提取物、22g/l葡萄糖、h2o)中。使培养物在振荡培养箱中在28℃和200rpm下生长三十六至四十八(36-48)小时。孵育后,将0.3ml种子培养物添加到带挡板的摇瓶中的50ml ld培养基中。使此生产培养物在28℃和180rpm下生长五(5)天。藉由离心使细胞成球,然后收集上清液来收获分泌的蛋白质。用等体积的三氯乙酸(tca)从上清液中沉淀出蛋白质,随后溶解在0.1n氢氧化钠(naoh)中。然后按照制造商的方案,用bca蛋白质测定(美国纽约州格兰德岛赛默飞世尔科学公司(thermofisher scientific,grand island,n.y.,usa))测量总蛋白质。将bca测定数值标准化为平行操作的t4abc培养物的平均值,以使对总蛋白质产量效率的任何周间变化的影响达最小。
[0455]
如图9所示,相对于编码ace3 c末端的截短形式(例如,seq id no:6)的t4abc亲代菌株,当ace3突变在t4abc背景中回复以使得其编码全长ace3(例如,seq id no:2)时,总分
泌蛋白滴度降低73%。通过比较,编码最突出分泌蛋白(cbh1)的基因的缺失仅使总分泌蛋白滴度降低47%。
[0456]
实例3
[0457]
ace3 c末端氨基酸变体
[0458]
如以上实例1和2中一般描述,申请人已经展现需要在ace3lc c末端具有指定数量的氨基酸截短(例如,7-17)来改进蛋白质生产力。另外,如以上详细描述中简要阐述,申请人预期ace3 c末端的其他遗传修饰(例如,取代、插入、内部(c末端)缺失、其组合等)同样是用于改进蛋白质生产力的合适的遗传修饰。
[0459]
本实例描述了用于构建ace3 c末端变体文库并筛选此类文库以改进蛋白质生产力的组合物和方法。例如,本领域技术人员可以通过置换质粒pyl72(图6)中编码seq id no:2的氨基酸641至689的ace3-lc的编码序列,并参考为每个文库提供的序列识别号(seq id no)和seq id no:32的示例性质粒pa3l02(图11)来产生ace3的c末端变体文库。因此,申请人在本文中描述了构建和筛选三(3)种不同的ace3 c末端文库的方法,这些文库包括位点取代文库(文库1)、扫描插入文库(文库2)和扫描缺失文库(文库3)。因此,本文所述的三个文库实例并不意味着是限制性的,而是例示整个方法,并且可以被熟练技术人员容易地修改以设计/构建其他ace3 c末端变体文库并对其进行筛选以改进蛋白质生产力。
[0460]
文库1是位点取代文库,其中用“nnk”密码子取代(突变)对应于seq id no:2的氨基酸位置673至683的每个氨基酸的密码子,其中“n”是任何核苷酸,并且“k”是“g”或“t”核苷酸。对应于seq id no:2的氨基酸641至689的每个编码的氨基酸位置的文库1简并dna序列分别如seq id no:32-42所示,并在下表4中呈现。为进行比较,seq id no:31与对应于seq id no:2的氨基酸641至689(例如,参见seq id no:30,包含seq id no:2的氨基酸位置641至689)的每个编码的氨基酸位置的天然dna序列相对应。
[0461]
表4
[0462]
文库1:具有c末端取代的ace3-lc表达载体
[0463]
[0464][0465]
*aa是氨基酸的缩写
[0466]
**seq id no对应于置换质粒pyl72中编码ace3-lc氨基酸641至689的核苷酸序列的变体核酸序列。
[0467]
文库2是扫描插入文库,其中三(3)个密码子序列“ndt”(密码子1)
‑“
ndt”(密码子2)
‑“
nnk”(密码子3)被插入到对应于seq id no:2的氨基酸672至683的每个密码子(3')之后,其中“n”是任何核苷酸,“d”是“a”、“g”或“t”核苷酸,并且“k”是“g”或“t”核苷酸。对应于seq id no:2的氨基酸641至689的每个编码的氨基酸位置的文库2简并dna序列分别如seq id no:43-54所示,并在下表5中呈现。
[0468]
表5
[0469]
文库2:具有c末端插入的ace3-lc表达载体
[0470]
[0471][0472]
*aa是氨基酸的缩写
[0473]
**seq id no对应于置换质粒pyl72中编码ace3-lc氨基酸641至689的核苷酸序列的变体核酸序列。
[0474]
文库3是扫描缺失文库,其中对应于seq id no:2的氨基酸位置673至683的每个密码子如下修饰:从对应于seq id no:2的氨基酸位置673的密码子开始,从ace3编码序列缺失位置673的密码子和接下来的两个相邻和下游(3')密码子(即,总共九(9)个核苷酸)。对应于seq id no:2的氨基酸641至689的每个编码的氨基酸位置的文库3简并dna序列如seq id no:55-65所公开,并在下表6中呈现。
[0475]
表6
[0476]
文库3:具有c末端内部缺失的ace3-lc表达载体
[0477]
[0478][0479]
*aa是氨基酸的缩写
[0480]
**seq id no对应于置换质粒pyl72中编码ace3-lc氨基酸641至689的核苷酸序列的变体核酸序列。
[0481]
通过汇集包含突变的氨基酸位置的简并文库质粒克隆(例如,来自文库1),本领域技术人员可以减少所需的里氏木霉转化的数量。例如,可以合理地汇集整个文库3来进行里氏木霉转化。因此,可以在对单个质粒克隆分离和测序后进行汇集,或者当有很高的把握在》90%的大肠杆菌转化体中对pyl72质粒进行正确修饰,并且池中有》100个大肠杆菌转化体时,通过在质粒提取前汇集任意的大肠杆菌转化体来进行汇集。
[0482]
因此,如以上实例1中所述但使用上述汇集的构建文库转化里氏木霉细胞(例如,rl-p37)以将ace3变体靶向到gla1基因座。对于每个转化的文库,如实例1中所述,培养》60个转化体并测定蛋白质产生。可以保留细胞培养物以实现目的转化体的分子表征。在每个二十四(24)孔板中包括至少三份整合了质粒pyl72(ace3-lc)和pyl88(ace3-lc c-term-11)的转化体,作为阴性和阳性对照。例如,根据文库1中的“nnk”简并性,预计1/32克隆将具有终止密码子,从而编码实例1中描述的截短的ace3变体之一,其中这些克隆(截短的ace3变体)用作内部阳性对照并用于验证所实施的方法。
[0483]
同样,在诱导物不存在下,相对于pyl72(ace3-lc)转化体,一些携带ace3变体的木霉属转化体(例如,诸如pyl88(ace3-lc c-term-11)转化体)将能够在发酵期间产生提高量的分泌型纤维素酶和半纤维素酶。为了确定整合在这些转化体中的gla1基因座处的ace3变体的序列,可以通过本领域已知的方法如下在分子水平上对变体进行表征。
[0484]
从单个转化体中提取基因组dna,并使用在编码seq id no:2的氨基酸位置670的密码子上游(5')约500bp处引发的正向引物(seq id no:23,表2)和在pyr4基因中和ace3变体终止密码子下游(3')约900bp处特异性引发的反向引物(seq id 24,表2),别从每个转化体pcr扩增gla1基因座处的ace3变体的c末端部分。然后,将纯化的pcr产物用其他套式引物或通过本领域技术人员已知的其他测序方法进行测序。随后,通过分析测序结果,很容易确定在诱导物不存在下展现蛋白质产生增强的ace3变体。
[0485]
如本领域技术人员所了解,在筛选时可能获得一些假阳性。因此,本领域技术人员可以产生含有所鉴定的特定ace3变体的pyl72衍生物,并如上所述评价池中具有特定ace3变体的其他转化体。
[0486]
在具有不同ace3变体的转化体显示出介于pyl72(ace3-lc)与pyl88(ace3-lc c-term-11)对照转化体之间的诱导物非依赖性表型的情况下,在实际可能的情况下,可以组合这些变体的单个突变,并如上所述类似地评价。
[0487]
同样,从上述此类筛选的文库池(例如,从文库1、文库2和/或文库3)鉴定的任何ace3变体的最佳氨基酸序列可以组合,并进一步进行后续轮次的集中文库筛选,并如上评价。例如,根据筛选的转化体的样品大小,给定位置的一些氨基酸取代可能不呈现在位点取代文库(文库1)中。可能需要分离或产生具有最有用位置的变体的单个质粒克隆的,其中可以单独评价所有可能的取代(例如,与最初用于文库1的池相反)。另外,对于从扫描插入文库(文库2)鉴定的有用的ace3变体,可能需要测试最有用位置的其他变体,例如,通过将插入长度增加到六(6)个、九(9)个或更多个氨基酸残基和/或将插入减少到两(2)个或一(1)个氨基酸残基。此外,对于从扫描缺失文库(文库3)鉴定的有用变体,可能需要产生和测试最有用位置的其他变体,例如,通过增加相邻缺失残基的数量,实际上增加到四(4)个、六(6)个、八(8)个等氨基酸残基和/或将缺失大小减少到两(2)个或一(1)个氨基酸残基。
[0488]
实例4
[0489]
具有c末端取代的ace3
[0490]
a.概述
[0491]
在本实例中,申请人用v5表位标签或v5-(6xhis)串联标签(图12)在分子水平上取代了ace3-lc(seq id no:2)c末端的最后11个氨基酸残基。如下所述,表达具有c末端v5标签取代的ace3-lc(即,ace3-lc-v5)和具有c末端v5-(6xhis)串联标签取代的ace3-lc(即,ace3-lc-v5-(6xhis))的木霉属菌株显示在诱导底物存在和不存在下蛋白质产生都增加。
[0492]
b.宿主菌株、表达载体和菌株构建。
[0493]
将里氏木霉菌株t4abc(例如,以上实例2中所述)用作本实例中的亲代菌株。木霉属ace3 c末端取代盒质粒pyl18(ace3-lc-v5)和pyl19(ace3-lc-v5-(6xhis))使用标准分子生物学程序制备,因此本领域技术人员可以容易地从所公开的相关dna部分重建此质粒。更特别地,在对应于seq id no:2的氨基酸残基641的密码子处开始的ace3 c末端取代变体的编码序列的dna序列,对于ace3-lc-v5如seq id no:67所示,并且对于ace3-lc-v5-(6xhis)如seq id no:69所示。
[0494]
这些表达载体包含载体骨架,该载体骨架具有用于在大肠杆菌中复制和选择的细菌cole1 ori和ampr基因,和用于在酿酒酵母(saccharomyces cerevisiae)中复制和选择的2μori和ura3基因。另外,还存在里氏木霉端粒序列(“trtel”)、里氏木霉pyr2选择标记、基因dic1的里氏木霉启动子序列、和具有其天然终止子序列的ace3-lc变体。图13显示了描述含有ace3-lc变体的载体pyl18的代表性载体图,该ace3-lc变体的最后十一(11)个氨基酸被十四(14)个氨基酸的v5标签序列取代。
[0495]
通过聚乙二醇(peg)介导的原生质体转化将表达载体插入(转化)到里氏木霉亲代宿主菌株(包含非功能性pyr2基因)中(ouedraogo等人,2015;penttila等人,1987)。使转化体在vogel基本培养基琼脂板上生长,以选择由pyr2标记获得的尿苷原养型。通过在vogel琼脂板上连续两轮转移、然后在非选择性pda板上连续两轮生长、以及在vogel琼脂板上一轮生长来获得稳定的转化体,之后通过将稀释孢子悬浮液铺板获得单菌落。
[0496]
c.ace3 c末端取代转化体的发酵
[0497]
如以上实例1中所述,在“非诱导”和“诱导”条件下测试以上描述的亲代和转化的(子代)里氏木霉宿主细胞。例如,如图14所呈现,亲代里氏木霉细胞仅在槐糖诱导物存在下产生高水平的分泌蛋白。相比之下,在诱导(glu/sop)和非诱导(glu)条件下,包含并表达
ace3-l(即,包含十一(11)个氨基酸截短)的变体(子代)里氏木霉细胞都产生了大量分泌蛋白。此外,包含并表达ace3-lc-v5标签(即,包含十四(14)个氨基酸取代最后十一(11)个氨基酸)的变体(子代)里氏木霉细胞和包含并表达ace3-lc-v5-(6xhis)双重标签(即,包含二十三(23)个氨基酸取代最后十一(11)个氨基酸)的里氏木霉细胞在诱导(glu/sop)和非诱导(glu)条件下也都展现高的蛋白生产力(图14),但比ace3-l变体低约10%。
[0498]
基于前述内容,这些结果展现,对ace3 c末端的其他遗传修饰,包括但不限于取代、插入、内部(c末端)缺失及其组合,同样是用于在诱导(glu/sop)和非诱导(glu)底物条件下改进木霉属物种细胞中蛋白质生产力的合适的遗传修饰。
[0499]
参考文献
[0500]
pct international publication no.wo 1992/06183
[0501]
pct international publication no.wo 1992/06209
[0502]
pct international publication no.wo 1992/06221
[0503]
pct international publication no.wo 1992/10581
[0504]
pct international publication no.wo 1998/15619
[0505]
pct international publication no.wo 2002/12465
[0506]
pct international publication no.wo 2005/028636
[0507]
pct international publication no.wo 2006/074005
[0508]
pct international publication no.wo 2006/74005
[0509]
pct international publication no.wo 2016/100568
[0510]
u.s.patent no.6,022,725
[0511]
u.s.patent no.6,268,328
[0512]
boel et al.,embo j.3:1581-1585,1984.
[0513]
cao et al.,science,9:991-1001,2000.
[0514]
campbell et al.,curr.genet.,16:53-56,1989.
[0515]
chen et al.,“engineering of trichoderma reesei for enhanced degradation of lignocellulosic biomass by truncation of the cellulase activator ace3”,biotechnol biofuels 13:62,2020.
[0516]
colot et al.,pnas 103(27):10352-10357,2006.
[0517]
devereux et al.,nucleic acids res.12:387-395,1984.
[0518]
hakkinen,m.,valkonen,m.j.,westerholm-parvinen,a.,aro,n.,arvas,m.,vitikainen,m.,penttila,m.,saloheimo,m.,and pakula,t.m.,“screening of candidate regulators for cellulase and hemicellulase production in trichoderma reesei and identification of a factor essential for cellulase production”,biotechnol biofuels 7,14,2014.
[0519]
harkki et al.,biotechnol.,7:596-603,1989.
[0520]
harkki et al.,enzyme microb.technol.,13:227-233,1991.
[0521]
ilmen et al.,“regulation of cellulase gene expression in the filamentous fungus trichoderma reesei”,applied and environmental microbiology,63(4)-1298-1306,1997.
[0522]
kriegler,gene transfer and expression:a laboratory manual,1990.
[0523]
le crom et al.,“tracking the roots of cellulase hyperproduction by the fungus trichoderma reesei using massively parallel dna sequencing”,pnas 106(38):16151-16156,2009.
[0524]
mullaney et al.,mgg 199:37-45,1985.
[0525]
needleman and wunsch,j.mol.biol.,48:443,1970.
[0526]
nunberg et al.,mol.cell biol.4:2306,1984.
[0527]
ouedraogo,j.p.,arentshorst,m.,nikolaev,i.,barends,s.,and ram,a.f.,“i-scei-mediated double-strand dna breaks stimulate efficient gene targeting in the industrial fungus trichoderma reesei”applied microbiology and biotechnology 99,10083-10095,2015.
[0528]
pearson and lipman,proc.natl.acad.sci.usa 85:2444,1988.
[0529]
penttila,m.,nevalainen,h.,ratto,m.,salminen,e.,and knowles,j.,“a versatile transformation system for the cellulolytic filamentous fungus trichoderma reesei”,gene 61,155-164,1987.
[0530]
sambrook et al.,molecular cloning,a laboratory manual,2
nd edition,cold spring harbor laboratory press,cold spring,new york,1989.
[0531]
sambrook et al.,molecular cloning,a laboratory manual,4
th edition,cold spring harbor laboratory press,cold spring,new york,2012.
[0532]
sheir-neiss and montenecourt,"characterization of the secreted cellulases of trichoderma reesei wild type and mutants during controlled fermentations",applied microbiology and biotechnology,20(1):46-53,1984.
[0533]
smith and waterman,adv.appl.math.2:482,1981.
[0534]
yelton et al.,pnas usa 81:1470-1474,1984.
[0535]
zhang et al.,“the transcription factor ace3 controls cellulase activities and lactose metabolism via two additional regulators in the fungus trichoderma reesei”,j.biol.chem.,294(48):18435-18450,2019.
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1