包含TLR9激动剂的带状疱疹疫苗的制作方法
包含tlr9激动剂的带状疱疹疫苗
相关申请的交叉引用
1.本技术要求2020年3月9日提交的美国临时申请号62/987,243的优先权和权益,将其公开内容通过引用以其整体特此并入。ascii文本文件序列表的提交
2.将以下提交的ascii文本文件的内容通过引用以其整体并入本文:序列表的计算机可读形式(crf)(文件名称:377882007140seqlist.txt,记录日期:2021年3月9日,大小:10kb)。
技术领域
3.本公开文本涉及免疫原性组合物,所述免疫原性组合物包含水痘带状疱疹病毒表面(vzv)糖蛋白e抗原和toll样受体9(tlr9)激动剂,所述toll样受体9(tlr9)激动剂如包含未甲基化胞苷-磷酸-鸟苷(cpg)基序的寡核苷酸。所述免疫原性组合物适于刺激有需要的个体的针对vzv的免疫应答。
背景技术:
4.带状疱疹(shingles,herpes zoster)是一种病毒疾病,其特征在于在身体或脸部的一侧感到灼热、刺痛和瘙痒,然后出现疼痛性皮疹和水疱。根据疾病控制与预防中心(cdc)的说法,约10%-13%的患有带状疱疹的老年人经历了长期神经疼痛(带状疱疹后遗神经痛)并发症。另外,眼睛或耳朵附近的带状疱疹皮疹可能导致视力丧失或导致脸部肌肉瘫痪(拉姆齐
·
亨特综合征(ramsay hunt syndrome))。
5.带状疱疹如水痘是由水痘带状疱疹病毒(vzv)感染引起的。在因初始vzv感染而曾患水痘的个体中,带状疱疹是因潜在vzv的重新激活引起的。在1995年美国食品和药物管理局(fda)批准一种水痘疫苗之前,美国大多数儿童感染过水痘,并且因此现在作为成人面临感染带状疱疹的风险。
6.有两种疫苗可用于预防50岁或以上的个体的带状疱疹。是一种由merck&co.,inc.(新泽西州怀特豪斯站)市售的活减毒疫苗。是一种由glaxosmithkline(北卡罗来纳州三角研究园)市售的重组含佐剂的亚单位疫苗。尽管未进行头对头临床试验,但是根据针对疱疹和带状疱疹后遗神经痛的改善功效的估计,美国免疫接种实践咨询委员会在2017年以微弱的差距投票推荐优先使用而非(dooling等人,mmwr,67:103-108,2018)。含有作为抗原的重组vzv糖蛋白e(ge)与作为佐剂的as01b组合。as01b由在脂质体配制品中组合的来自明尼苏达沙门氏菌(salmonella minnesota)的3-o-脱酰基-4'-单磷酰脂质a(mpl)和qs-21(从南美皂皮树(quillaja saponaria molina)的提取物中纯化的皂苷)构成。有利于的微弱投票优势(8比7)与对反应原性的担忧相关。的iii期研究报告,16.5%的疫苗接受者患上3级不良事件(对比3.1%的安慰剂接受者),并且10.8%的疫苗接受者患
上3级全身性事件(肌痛、疲劳、头痛、寒战、发热和胃肠道症状)(对比2.4%的安慰剂接受者)(lal等人,n eng j med,372:2087-2096,2015;和cunningham等人,n eng j med,375:1019-1032,2016)。疫苗接种后相对高水平的严重副作用被认为有可能对患者的第二剂依从性水平产生负面影响(bharucha等人,human vaccines&immunotherapeutics,13:1789
–
1797,2017),并且鉴于患者需要接受两剂以针对带状疱疹提供保护,这是一个持续性的问题。
7.蛋白质亚单位疫苗(如)的反应原性可能受到多种因素的影响,其中最主要的是包括在内以改善免疫原性的佐剂的性质。通过对健康的人类受试者的免疫接种,比较了与模型蛋白抗原组合的不同的佐剂系统(as)佐剂。发现与比较佐剂(as01e、as03a、as04和alum)相比,as01b佐剂诱导更高水平的局部和全身反应原性(leroux-roels等人,clin immunol,169:16-27,2016)。这表明as01b对人们担心的shingrix的反应原性特征有显著贡献。
8.因此,需要改善的带状疱疹疫苗,其具有优越的安全性特征,但是就vzv ge免疫原性而言不亚于
技术实现要素:
9.本公开文本涉及免疫原性组合物,所述免疫原性组合物包含水痘带状疱疹病毒表面(vzv)糖蛋白e抗原和toll样受体9(tlr9)激动剂,所述toll样受体9(tlr9)激动剂如包含未甲基化胞苷-磷酸-鸟苷(cpg)基序的寡核苷酸。所述免疫原性组合物适于刺激有需要的个体的针对vzv的免疫应答。
附图说明
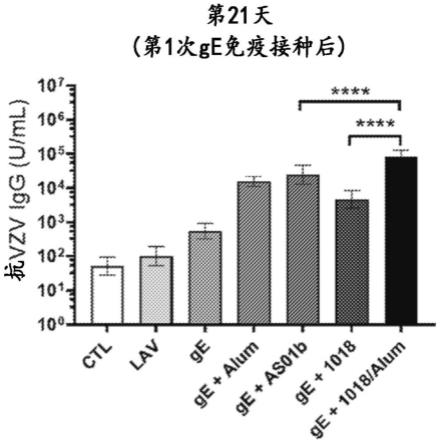
10.图1a示出了第一剂(初免)带状疱疹疫苗的接受者和对照接受者(ctl和lav)的血清中的抗vzv ge反应性igg的水平。图1b示出了第一剂(初免)和第二剂(加强)带状疱疹疫苗的接受者和对照接受者(ctl和lav)的血清中的抗vzv ge反应性igg的水平。
11.图2a-图2c示出了第一剂(初免)和第二剂(加强)带状疱疹疫苗的接受者和对照接受者(ctl和lav)的ge抗原诱导的分泌il-2和/或ifn-γ的cd4+t细胞。
12.图3a-图3b示出了第一剂(初免)和第二剂(加强)带状疱疹疫苗的接受者和对照接受者(ctl和lav)的ge抗原诱导的分泌il-2或ifn-γ的cd154+,cd4+t细胞。通用技术和定义
13.除非另有指示,否则本公开文本的实践将采用分子生物学(包括重组技术)、微生物学、细胞生物学、生物化学和免疫学的常规技术,所述技术都在本领域的技术范围内。
14.除非另有说明,否则如本文和所附权利要求中所用,单数形式“一个/一种(a)”、“一个/一种(an)”和“所述(the)”包括复数指代物。例如,“一种”赋形剂包括一种或多种赋形剂。
15.本文使用的短语“包含”是开放性的,表明此类实施方案可以包括另外的要素。相比之下,短语“由
……
组成”是封闭性的,表明此类实施方案不包括另外的要素(除了痕量杂质以外)。短语“基本上由
……
组成”是部分封闭性的,表明此类实施方案可以进一步包括不会实质性改变此类实施方案的基础特征的要素。
ge抗原的信号肽、跨膜结构域和胞质结构域的截短型重组蛋白。所述免疫原性组合物适于刺激有需要的个体的针对水痘带状疱疹病毒的免疫应答。i.免疫原性组合物和试剂盒
28.本公开文本涉及用于刺激针对水痘带状疱疹病毒(vzv)的免疫应答的免疫原性组合物,所述免疫原性组合物包含vzv糖蛋白e(ge)抗原和toll样受体9(tlr9)激动剂,其中所述tlr9激动剂是包含未甲基化胞苷-磷酸-鸟苷(也称为cpg或胞嘧啶-磷酸-鸟苷)基序的长度为从8至35个核苷酸的寡核苷酸,并且所述ge抗原和所述寡核苷酸以有效刺激哺乳动物受试者(如人类受试者)的针对所述ge抗原的免疫应答的量存在于所述免疫原性组合物中。在一些实施方案中,所述免疫原性组合物进一步包含所述vzv ge抗原吸附在其上的铝盐佐剂。a.toll样受体9(tlr9)激动剂
29.toll样受体(tlr)在树突细胞和其他先天免疫细胞中或其上表达,并且属于刺激对入侵病原体的存在的应答的最重要受体。人具有多种类型的tlr,它们在结构上相似,但是识别病毒或细菌的不同部分。通过激活特定的tlr,可能刺激和控制可以用于增强适应性应答的特定类型的先天免疫应答。
30.tlr9(cd289)识别在微生物dna中发现的未甲基化胞苷-磷酸-鸟苷(cpg)基序,所述基序可以使用合成的含有cpg的寡脱氧核苷酸(cpg-odn)来模拟。已知cpg-odn增强抗体产生并且刺激t辅助子1(th1)细胞应答(coffman等人,immunity,33:492-503,2010)。基于结构和生物学功能,已经将cpg-odn分为三个一般类别:cpg-a、cpg-b和cpg-c(campbell,methods mol biol,1494:15-27,2017)。b细胞激活的程度在类别之间有所不同,cpg-a odn是弱b细胞激活剂,cpg-c odn是良好b细胞激活剂,并且cpg-b odn是强b细胞激活剂。本公开文本的寡核苷酸tlr9激动剂优选是良好b细胞激活剂(cpg-c odn)或更优选强(cpg-b odn)b细胞激活剂。
31.最佳的寡核苷酸tlr9激动剂通常含有遵循以下通式的回文序列:5'-嘌呤-嘌呤-cg-嘧啶-嘧啶-3'或5'-嘌呤-嘌呤-cg-嘧啶-嘧啶-cg-3'(美国专利号6,589,940)。使用某些非回文富含cpg的硫代磷酸酯寡核苷酸也观察到tlr9激动作用,但是可能会受到核苷酸序列中的变化的影响。另外,通过cpg二核苷酸内的胞嘧啶的甲基化来消除tlr9激动作用。因此,在一些实施方案中,tlr9激动剂是包含序列5'-aacgttcg-3'的长度为从8至35个核苷酸的寡核苷酸。在一些实施方案中,所述寡核苷酸的长度大于8、9、10、11、12、13、14、15、16、17、18、19或20个核苷酸,并且所述寡核苷酸的长度小于35、34、33、32、31、30、29、28、27、26、25或24个核苷酸。在一些实施方案中,所述tlr9激动剂是包含序列5'-aacgttcgag-3'(seq id no:3)的长度为从10至35个核苷酸的寡核苷酸。在一些实施方案中,所述寡核苷酸的长度大于10、11、12、13、14、15、16、17、18、19或20个核苷酸,并且所述寡核苷酸的长度小于35、34、33、32、31、30、29、28、27、26、25或24个核苷酸。
32.dynavax technologies corporation(加利福尼亚州埃默里维尔)的研究员鉴定了一种22聚体硫代磷酸酯连接的寡脱氧核苷酸cpg 1018,其含有可以跨物种显著增强对共施用的抗原的免疫应答的特定序列(campbell,methods mol biol,1494:15-27,2017)。cpg 1018(5'-tgactgtgaa cgttcgagat ga-3',如seq id no:1所示)是在针对体外和体内免疫刺激活性筛选众多种寡核苷酸后选择的。cpg 1018是在小鼠、兔、狗、狒狒、食蟹猴和人中有
活性的cpg-b odn。因此,在一些优选的实施方案中,tlr9激动剂是包含seq id no:1的序列的寡核苷酸。
33.尽管示例性寡核苷酸tlr9激动剂cpg 1018是cpg-odn,但是本公开文本不限于全dna分子。也就是说,在一些实施方案中,tlr9激动剂是dna/rna嵌合分子,其中一个或多个cpg和回文序列是脱氧核糖核酸,并且这些区域以外的一个或多个核酸是核糖核酸。在一些实施方案中,所述cpg寡核苷酸是线性的。在其他实施方案中,所述cpg寡核苷酸是环状的或包括一个或多个发夹环。所述cpg寡核苷酸可以是单链的或双链的。
34.在一些实施方案中,所述cpg寡核苷酸可以含有修饰。修饰包括但不限于3'oh或5'oh基团的修饰、核苷酸碱基的修饰、糖组分的修饰和磷酸基团的修饰。可以将经修饰的碱基包括在cpg寡核苷酸的回文序列中,只要一个或多个经修饰的碱基通过watson-crick碱基配对维持对其天然互补体的相同特异性即可(例如,回文部分仍然是自我互补的)。在一些实施方案中,所述cpg寡核苷酸包含非规范碱基。在一些实施方案中,所述cpg寡核苷酸包含经修饰的核苷。在一些实施方案中,所述经修饰的核苷选自2'-脱氧-7-脱氮鸟苷、2'-脱氧-6-硫代鸟苷、阿糖鸟苷、2'-脱氧-2'取代的-阿糖鸟苷和2'-o-取代的-阿糖鸟苷。在一些实施方案中,所述tlr9激动剂是包含序列5'-tcg1aacg1ttcg
1-3'(seq id no:2)的寡核苷酸,其中g1是2'-脱氧-7-脱氮鸟苷。在一些实施方案中,所述寡核苷酸包含序列5'-tcg1aacg1ttcg
1-x-g1cttg1caag1ct-5',并且其中g1是2'-脱氧-7-脱氮鸟苷并且x是甘油(5'-seq id no:2-3'-x-3'-seq id no:2-5')。
35.所述cpg寡核苷酸可以含有磷酸基团的修饰。例如,除磷酸二酯键外,磷酸修饰包括但不限于甲基膦酸酯、硫代磷酸酯、氨基磷酸酯(桥接或非桥接)、磷酸三酯和二硫代磷酸酯,并且可以以任何组合来使用。还可以使用其他非磷酸酯键。在一些实施方案中,所述寡核苷酸仅包含硫代磷酸酯骨架。在一些实施方案中,所述寡核苷酸仅包含磷酸二酯骨架。在一些实施方案中,所述寡核苷酸在磷酸骨架中包含磷酸酯键的组合,如磷酸二酯键和硫代磷酸酯键的组合。具有硫代磷酸酯骨架的寡核苷酸可以比具有磷酸二酯骨架的那些更具有免疫原性,并且似乎在注射到宿主后对降解更具有抗性(braun等人,j immunol,141:2084-2089,1988;和latimer等人,mol immunol,32:1057-1064,1995)。本公开文本的cpg寡核苷酸包括至少一个、两个或三个核苷酸间硫代磷酸酯键。在一些实施方案中,当多种cpg寡核苷酸分子存在于包含至少一种赋形剂的药物组合物中时,硫代磷酸酯键的两种立体异构体均存在于所述多种cpg寡核苷酸分子中。在一些实施方案中,cpg寡核苷酸的所有核苷间键都是硫代磷酸酯键,或者也就是说,所述cpg寡核苷酸具有硫代磷酸酯骨架。
36.单位剂量的免疫原性组合物(典型地是0.5ml剂量)可以包含从约375μg至约6000μg的cpg寡核苷酸,优选从约750μg至约3000μg的cpg寡核苷酸。在一些实施方案中,0.5ml剂量的免疫原性组合物包含大于约250、500、750、1000或1250μg的cpg寡核苷酸,并且小于约6000、5000、4000、3000或2000μg的cpg寡核苷酸。在一些实施方案中,0.5ml剂量的免疫原性组合物包含约375、750、1500、3000或6000μg的cpg寡核苷酸。在一些实施方案中,0.5ml剂量的所述免疫原性组合物包含约750μg的cpg寡核苷酸。在一些实施方案中,0.5ml剂量的所述免疫原性组合物包含约1500μg的cpg寡核苷酸。在一些实施方案中,0.5ml剂量的所述免疫原性组合物包含约3000μg的cpg寡核苷酸。
37.除非另有指示,否则本文所述的cpg寡核苷酸呈其药学上可接受的盐形式。示例性
碱性盐包括铵盐、碱金属盐(如钠盐、锂盐和钾盐)、碱土金属盐(如钙盐和镁盐)、锌盐、与有机碱(例如,有机胺)(如n-me-d-葡糖胺、n-[1-(2,3-二油酰基氧基)丙基]-n,n,n-三甲基氯化铵、胆碱、氨丁三醇、二环己胺、叔丁胺)形成的盐和与氨基酸(如精氨酸、赖氨酸)形成的盐等。在一些实施方案中,所述cpg寡核苷酸呈铵盐、钠盐、锂盐或钾盐形式。在一个优选的实施方案中,所述cpg寡核苷酸呈钠盐形式。b.水痘带状疱疹病毒(vzv)糖蛋白e(ge)抗原
[0038]
本公开文本的免疫原性组合物的vzv ge抗原包含ge或其片段。在优选的实施方案中,所述ge抗原被vzv反应性抗体识别和/或ge的肽片段被vzv反应性t细胞识别。在一些实施方案中,所述ge抗原是重组蛋白,而在其他实施方案中,所述ge抗原是从vzv病毒粒子中纯化的。在一些优选的实施方案中,所述ge抗原是分离的抗原。在一些实施方案中,所述vzv ge抗原是缺乏全长vzv ge抗原的信号肽、跨膜结构域和胞质结构域的截短型重组蛋白。代表性ge的氨基酸序列如genbank编号aqt34120.1所示。在一些实施方案中,所述ge抗原包含genbank编号aqt34120.1的残基39-585的氨基酸序列,或与其至少90%、95%、96%、97%、98%或99%相同的氨基酸序列。
[0039]
在一些实施方案中,所述ge的氨基酸序列如seq id no:4所示:no:4所示:在一些实施方案中,所述ge抗原包含seq id no:4的氨基酸残基,或与seq id no:4至少90%、95%、96%、97%、98%或99%相同的氨基酸序列。
[0040]
在一些实施方案中,所述ge的氨基酸序列如seq id no:5所示:no:5所示:在一些实施方案中,所述ge抗原包含seq id no:5的氨基酸残基,或与seq id no:5至少90%、95%、96%、97%、98%或99%相同的氨基酸序列。
[0041]
单位剂量的免疫原性组合物(典型地是0.5ml剂量)可以包含从约10μg至约100μg
的ge抗原、优选从约25μg至约75μg的ge抗原、优选约40至约60μg的ge抗原、或约50μg的ge抗原。c.另外的组分
[0042]
本公开文本的免疫原性组合物可以包括一种或多种另外的组分,如一种或多种赋形剂、另一种佐剂和/或另外的抗原。1.赋形剂
[0043]
本公开文本的药学上可接受的赋形剂包括例如溶剂、填充剂、缓冲剂、张力调节剂和防腐剂(pramanick等人,pharma times,45:65-77,2013)。在一些实施方案中,免疫原性组合物可以包含赋形剂,其用作溶剂、填充剂、缓冲剂和张力调节剂中的一种或多种(例如,盐水中的氯化钠可以充当水性媒介物和张力调节剂)。
[0044]
在一些实施方案中,免疫原性组合物包含水性媒介物作为溶剂。合适的媒介物包括例如无菌水、盐水溶液、磷酸盐缓冲盐水和林格氏溶液。在一些实施方案中,组合物是等渗的。
[0045]
免疫原性组合物可以包含缓冲剂。缓冲剂控制ph以在加工、储存和任选的重构期间抑制活性剂的降解。合适的缓冲液包括例如盐,包括乙酸盐、柠檬酸盐、磷酸盐或硫酸盐。其他合适的缓冲液包括例如氨基酸,如精氨酸、甘氨酸、组氨酸和赖氨酸。缓冲剂可以进一步包含盐酸或氢氧化钠。在一些实施方案中,缓冲剂将组合物的ph维持在6至9的范围内。在一些实施方案中,ph大于(下限)6、7或8。在一些实施方案中,ph小于(上限)9、8或7。也就是说,ph在从约6至9的范围内,其中下限小于上限。
[0046]
免疫原性组合物可以包含张力调节剂。合适的张力调节剂包括例如右旋糖、甘油、氯化钠、甘油和甘露醇。
[0047]
免疫原性组合物可以包含填充剂。当要在施用前冻干药物组合物时,填充剂特别有用。在一些实施方案中,填充剂是一种保护剂,其在冷冻或喷雾干燥期间和/或在储存期间帮助稳定活性剂并预防活性剂的降解。合适的填充剂是糖(单糖、二糖和多糖),如蔗糖、乳糖、海藻糖、甘露醇、山梨醇、葡萄糖和棉子糖。
[0048]
免疫原性组合物可以包含防腐剂。合适的防腐剂包括例如抗氧化剂和抗微生物剂。然而,在优选的实施方案中,免疫原性组合物在无菌条件下制备并且存放于一次性容器中,因此不需要包含防腐剂。2.另外的佐剂
[0049]
佐剂在本领域中是已知的,并且包括但不限于alum(铝盐)、水包油乳液、油包水乳液、脂质体和微粒如聚(丙交酯-共-乙交酯)微粒(shah等人,methods mol biol,1494:1-14,2017)。在一些实施方案中,所述免疫原性组合物进一步包含所述ge抗原吸附在其上的铝盐佐剂。在一些实施方案中,所述铝盐佐剂包含由以下组成的组中的一种或多种:无定型羟基磷酸铝硫酸盐、氢氧化铝、磷酸铝和硫酸铝钾。在一些实施方案中,所述铝盐佐剂包含氢氧化铝和磷酸铝中的一种或两种。在一些实施方案中,所述铝盐佐剂由氢氧化铝组成。在一些实施方案中,单位剂量(例如,约0.5ml)的免疫原性组合物包含从约0.25至约0.50mg al
3+
,优选从约0.30至约0.40mg al
3+
。
[0050]
在其他实施方案中,免疫原性组合物进一步包含另外的佐剂。另外的合适的佐剂包括但不限于水包角鲨烯乳液(例如mf59或as03)、tlr3激动剂(例如,聚ic或聚iclc)、tlr4
激动剂(例如,皂苷,如quil a或qs-21,如在as01或as02中)、tlr5激动剂(细菌鞭毛蛋白)以及tlr7和/或tlr8激动剂(咪唑并喹啉衍生物,如咪喹莫特和瑞喹莫德)(coffman等人,immunity,33:492-503,2010)。对于兽用和对于在非人动物中生产抗体,可以使用弗氏佐剂(freund's adjuvant)(完全和不完全两者)的促有丝分裂组分。d.试剂盒
[0051]
本公开文本还提供了包含以下的试剂盒:i)含有vzv ge抗原和诸如cpg寡核苷酸的toll样受体9(tlr9)激动剂的免疫原性组合物;和ii)用于施用所述免疫原性组合物以刺激有需要的哺乳动物受试者(如人类受试者)的针对所述ge抗原的免疫应答的一组说明书。此外,本公开文本提供了包含以下的试剂盒:i)含有vzv ge抗原的第一组合物;ii)含有诸如cpg寡核苷酸的tlr9激动剂的第二组合物;iii)用于将所述第一组合物与所述第二组合物混合以制备免疫原性组合物的说明书;以及任选地iv)用于施用所述免疫原性组合物以刺激有需要的哺乳动物(如人类受试者)的针对所述ge抗原的免疫应答的另一组说明书。在一些实施方案中,所述cpg寡核苷酸包含序列5'-aacgttcg-3'。在一些实施方案中,所述cpg寡核苷酸包含序列5'-aacgttcgag-3'(seq id no:3)。在一些优选的实施方案中,所述cpg寡核苷酸包含序列5'-tgactgtgaa cgttcgagat ga-3'(seq id no:1)。
[0052]
所述试剂盒可以包含适当包装的免疫原性组合物。例如,如果所述免疫原性组合物是冻干粉末,则通常使用具有弹性塞子的小瓶,使得可以通过穿过弹性塞子注入流体(例如,无菌水、盐水等)容易地将所述粉末重悬。在一些实施方案中,所述试剂盒包含用于施用的装置(例如,注射器和针)。与免疫原性组合物的使用有关的说明书通常包括关于预期使用方法的施用剂量、时间表和途径的信息。在一些实施方案中,所述免疫原性组合物用于刺激针对vzv的免疫应答。ii.使用方法
[0053]
本公开文本涉及用于刺激针对vzv的免疫应答的方法,所述方法包括:向哺乳动物受试者施用包含vzv糖蛋白e(ge)抗原和诸如cpg寡核苷酸的toll样受体9(tlr9)激动剂的免疫原性组合物,以便刺激所述哺乳动物受试者的针对所述ge抗原的免疫应答。在优选的实施方案中,所述免疫原性组合物要通过肌内注射来施用,任选地以约0.5ml(例如,单位剂量)的体积。在一些实施方案中,所述肌内注射是注射至有需要的受试者的上臂的三角肌中。
[0054]
刺激免疫应答意指增加免疫应答,其可以通过引发从头免疫应答(例如,作为初始疫苗接种方案的结果)或增强现有免疫应答(例如,作为加强疫苗接种方案的结果)而产生。在一些实施方案中,刺激免疫应答包括但不限于由以下组成的组中的一种或多种:刺激细胞因子产生;刺激b淋巴细胞增殖;刺激抗体产生;刺激干扰素途径相关基因表达;刺激化学引诱物相关基因表达;以及刺激浆细胞样树突细胞成熟。在一些优选的实施方案中,刺激免疫应答包括增加受试者的抗原特异性抗体反应。列举的实施方案1.一种用于刺激针对水痘带状疱疹病毒(vzv)的免疫应答的免疫原性组合物,所述免疫原性组合物包含vzv糖蛋白e(ge)抗原和toll样受体9(tlr9)激动剂,其中所述tlr9激动剂是包含未甲基化胞苷-磷酸-鸟苷(cpg)基序的长度为从10至35个核苷酸的寡核苷酸,并且所述ge抗原和所述寡核苷酸以有效刺激哺乳动物受试者的针对所述ge抗原的免疫
应答的量存在于所述免疫原性组合物中。2.根据实施方案1所述的组合物,其中所述寡核苷酸包含序列5'-aacgttcgag-3'(seq id no:3)。3.根据实施方案1所述的组合物,其中所述寡核苷酸包含序列5'-tgactgtgaa cgttcgagat ga-3'(seq id no:1)。4.根据实施方案1-3中任一项所述的组合物,其中所述寡核苷酸包含经修饰的核苷,任选地其中所述经修饰的核苷选自2'-脱氧-7-脱氮鸟苷、2'-脱氧-6-硫代鸟苷、阿糖鸟苷、2'-脱氧-2'取代的-阿糖鸟苷和2'-o-取代的-阿糖鸟苷。5.根据实施方案4所述的组合物,其中所述寡核苷酸包含序列5'-tcg1aacg1ttcg
1-3'(seq id no:2),其中g1是2'-脱氧-7-脱氮鸟苷,任选地其中所述寡核苷酸包含序列5'-tcg1aacg1ttcg
1-x-g1cttg1caag1ct-5',并且其中g1是2'-脱氧-7-脱氮鸟苷并且x是甘油(5'-seq id no:2-3'-x-3'-seq id no:2-5')。6.根据实施方案1-5中任一项所述的组合物,其中所述寡核苷酸包含至少一个硫代磷酸酯键,任选地其中所有的核苷酸键均是硫代磷酸酯键。7.根据实施方案1-6中任一项所述的组合物,其中所述寡核苷酸是单链寡脱氧核苷酸。8.根据实施方案1-7中任一项所述的组合物,其中0.5ml剂量的所述免疫原性组合物包含从约375μg至约6000μg的所述寡核苷酸或从约750μg至约3000μg的所述寡核苷酸,任选地其中0.5ml剂量的所述免疫原性组合物包含约375μg、约750μg、约1500μg、约3000μg或约6000μg的所述寡核苷酸。9.根据实施方案1-8中任一项所述的组合物,其中所述vzv ge抗原是缺乏全长vzv ge抗原的信号肽、跨膜结构域和胞质结构域的截短型重组蛋白,任选地其中所述vzv ge抗原包含:(i)genbank编号aqt34120.1的残基39-585的氨基酸序列,或与其至少90%、95%、96%、97%、98%或99%相同的氨基酸序列;或(ii)seq id no:4的氨基酸残基,或与seq id no:4至少90%、95%、96%、97%、98%或99%相同的氨基酸序列;或(iii)seq id no:5的氨基酸残基,或与seq id no:5至少90%、95%、96%、97%、98%或99%相同的氨基酸序列。10.根据实施方案1-9中任一项所述的组合物,其中0.5ml剂量的所述免疫原性组合物包含从约25至约75μg的所述ge抗原,任选地其中所述免疫原性组合物包含从约40至约60μg的所述ge抗原或约50μg的所述ge抗原。11.根据实施方案1-10中任一项所述的组合物,所述组合物进一步包含铝盐佐剂。12.根据实施方案11所述的组合物,其中所述铝盐佐剂包含由以下组成的组中的一种或多种:无定型羟基磷酸铝硫酸盐、氢氧化铝、磷酸铝和硫酸铝钾。13.根据实施方案11所述的组合物,其中所述铝盐佐剂包含氢氧化铝。14.根据实施方案11-13中任一项所述的组合物,其中0.5ml剂量的所述免疫原性组合物包含从约0.25至约0.50mg al
3+
,任选地其中0.5ml剂量的所述免疫原性组合物包含从约0.30至约0.40mg al
3+
。
15.根据实施方案1-14中任一项所述的组合物,其中所述哺乳动物受试者是人类受试者。16.一种试剂盒,所述试剂盒包含:i)根据实施方案1-15中任一项所述的免疫原性组合物,和ii)用于施用所述组合物以刺激所述哺乳动物受试者的针对所述ge抗原的免疫应答的说明书。17.一种试剂盒,所述试剂盒包含:i)含有水痘带状疱疹病毒的糖蛋白e(ge)抗原的第一组合物;ii)含有tlr9激动剂的第二组合物;以及iii)用于将所述第一组合物与所述第二组合物混合以制备免疫原性组合物的说明书。18.根据实施方案17所述的试剂盒,所述试剂盒进一步包含:iv)用于施用所述免疫原性组合物以刺激哺乳动物受试者的针对所述ge抗原的免疫应答的另一组说明书。19.根据实施方案16-18中任一项所述的试剂盒,所述试剂盒进一步包含用于所述免疫原性组合物的肌内注射的注射器和针。20.一种用于刺激哺乳动物受试者的针对水痘带状疱疹病毒(vzv)的免疫应答的方法,所述方法包括向哺乳动物受试者施用根据实施方案1-15中任一项所述的免疫原性组合物以刺激所述哺乳动物受试者的针对所述ge抗原的免疫应答。21.根据实施方案20所述的方法,其中通过肌内注射施用所述免疫原性组合物。实施例
[0055]
缩写:cpg(未甲基化胞苷-磷酸-鸟苷);ctrl(对照);ge(vzv糖蛋白e);lav(活减毒病毒);mcg(微克);mcl(微升);mpl(单磷酰脂质a);tlr9(toll样受体9);和vzv(水痘带状疱疹病毒)。实施例1含cpg佐剂的带状疱疹疫苗在小鼠中的免疫原性
[0056]
此实施例提供了一项临床前研究的描述,所述研究评估带状疱疹疫苗在用活减毒水痘带状疱疹病毒(vzv)毒株(以下称为lav)感染的小鼠中的免疫原性。
[0057]
抗原:重组vzv糖蛋白e(ge)是通过基因工程化的中国仓鼠卵巢宿主细胞的细胞培养获得的,所述中国仓鼠卵巢宿主细胞表达缺乏跨膜锚和羧基末端结构域的ge的截短形式,并且所述重组vzv糖蛋白e因此被分泌到上清液中。所述细胞培养由含有氨基酸但不含白蛋白、抗生素或动物来源的蛋白质的培养基支持。将ge通过色谱法纯化并且冻干用于将来使用,如所述(haumont等人,virus res,40:199-204,1996)。对于最初的临床前研究,vzv ge是商购获得的。
[0058]
使用前通过将ge与佐剂配制品或药学上可接受的缓冲液或正常盐水合并来制备疫苗。具体地,在注射前将ge吸附至alum(氢氧化铝)30分钟,并且紧接在注射前将as01b和cpg 1018佐剂各自与ge混合。
[0059]
实验设计:在免疫接种时间表开始前35天(第-35天),在用活减毒vzv疫苗初免(通过皮下途径施用在500mcl中的104个噬斑形成单位的lav)的c57bl/6小鼠(n=4-8只/组)中
评估cpg 1018的佐剂活性。使用的lav是由merck&co.,inc.(新泽西州怀特豪斯站)销售的活水痘病毒疫苗。由于小鼠不支持vzv的足够复制,因此完成此实验以模拟人体中的现有vzv感染。在第0天和第28天,将小鼠用50mcl的疫苗配制品或盐水对照通过肌内途径进行免疫。组、给药量和取样列于表1-1中。表1-1.用于评价ge免疫原性的疫苗接种组1.用于评价ge免疫原性的疫苗接种组
[0060]
vzv ge含有b细胞表位和t细胞表位两者。因此,在施用1剂(第21天)或2剂(第56天)疫苗之后,使用vzv ge抗原包被的微量滴定板用商购获得的elisa测量针对ge的血清抗体反应。在用跨越ge抗原长度的重叠肽在体外重新刺激脾细胞培养物后,通过流式细胞术测量cd3
+
cd4
+
t细胞的细胞因子反应(il-2和ifn-γ)。每组测试了三个脾细胞子池(每个池3个、3个或2个小鼠脾脏)。将t细胞应答评价为cd4
+
t细胞的百分比或评价为cd154
+
cd4
+
t细胞的百分比,其中cd154是在抗原刺激的细胞中瞬时上调的分子,并且因此用作抗原反应性cd4
+
t细胞(即离体响应ge肽刺激的细胞)的特定标记物。监测小鼠的健康参数,包括注射部位反应和总体外观。
[0061]
在初免和加强疫苗接种后,所有测试的佐剂组均诱导高水平的抗vzv igg反应。在第1次ge免疫接种(初免)后第21天,与在未免疫的小鼠和进行了lav初免但未进一步免疫的小鼠中观察到的背景水平相比,抗vzv igg反应升高。与单独用ge抗原的免疫接种相比,添加单独的佐剂氢氧化铝(alum)或单独的cpg 1018增加了抗vzv igg反应。在用cpg-1018+alum免疫的小鼠中观察到第1次免疫接种后最高的抗vzv igg反应(图1a)。在ge+cpg 1018+alum免疫组中的反应显著高于用ge与单独的cpg-1018组合免疫的小鼠或用ge+as01b免疫的小鼠中的反应。在所有ge
±
佐剂组中,在第56天的第2次免疫接种(加强)后观察到抗vzv igg反应升高约一个对数(图1b),此时在ge+as01b和ge+cpg 1018+alum组中观察到相当的反应,并且在ge+as01b免疫的小鼠中的反应显著高于用ge+cpg 1018免疫的小鼠中的反应
(anova和tukey多重比较检验,***p《0.001,****p《0.0001)。
[0062]
对ge肽刺激的脾细胞中的离体细胞内细胞因子表达反应进行定量,作为免疫接种方案对ge抗原特异性cd4
+
t细胞应答的影响的量度。ge刺激的细胞因子表达被测量为所有cd4
+
t细胞的百分比并且被测量为抗原反应性群体(cd154
+
cd4
+
t细胞)的百分比。在来自对照(ctl)、仅lav初免、仅ge和含alum佐剂组的cd4
+
t细胞中,il-2和ifn-γ的表达不存在或水平非常低。相比之下,使用as01b或cpg 1018作为佐剂诱导相当地升高的表达il-2(图2a)和表达ifn-γ(图2b)的t细胞,如在离体重新刺激后所测量的。在来自ge+cpg 1018+alum免疫组的重新刺激的cd4
+
t细胞中,il-2和ifn-γ表达趋势较低。共表达il-2和ifn-γ的cd4+t细胞在来自含as01b佐剂的小鼠的细胞中最高,其次是来自含cpg 1018佐剂和含cpg 1018+alum佐剂的小鼠的细胞(图2c)。在抗原反应性(cd154
+
)cd4
+
t细胞群体内,反应模式是相似的,且在来自含as01b佐剂和含cpg 1018佐剂的小鼠的ge肽重新刺激的t细胞中,细胞因子表达是相当的(图3a-图3b)。与来自含as01b佐剂的小鼠的t细胞相比,在来自含cpg 1018佐剂的小鼠的抗原特异性t细胞中,ifn-γ表达趋势较高,并且在使用cpg 1018+alum作为ge反应的佐剂的小鼠中,细胞内il-2和ifn-γ表达两者均较低。
[0063]
总之,所有测试的佐剂均在c57bl/6小鼠中诱导高水平的抗vzv igg反应,其中最高的抗体反应在第一次免疫接种后的ge+cpg 1018+alum免疫的小鼠中以及在加强免疫接种后的ge+as01b免疫的小鼠中,但是在cpg 1018+alum中诱导的水平是相当的。在离体ge肽重新刺激后评价cd4
+
t细胞对ge免疫接种的反应,并且当测量为抗原反应性群体的所有cd4
+
细胞的百分比时,在含cpg 1018佐剂和含as01b佐剂的组中观察到最高反应,如通过cd154的表达鉴定的。数据表明,在免疫小鼠中,cpg 1018与alum的组合或作为独立佐剂的cpg 1018分别诱导与as01b相当的抗体反应和t细胞应答。由于认为t细胞应答主要负责控制带状疱疹暴发,因此数据支持使用cpg 1018作为基于ge的疫苗中的佐剂。与as01b相比,考虑了单独的或与alum组合的cpg 1018产生有利的反应原性特征。
[0064]
尽管为了清楚和理解的目的,已经通过说明和实施例详细地描述了前述公开文本,但是对于本领域技术人员清楚的是,可以实施某些改变和修改。因此,实施例不应被解释为限制本公开文本的范围,本公开文本的范围由所附权利要求限定。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1