自然杀手细胞的放大方法与流程
自然杀手细胞的放大方法
1.交叉引用
2.本技术主张2020年3月2日提出的美国临时申请第62/984/060号的优先权,所述临时申请的全部内容通过引用并入本文。
背景技术:
3.自然杀手(nk)细胞(包含10-15%的周边血淋巴细胞)在免疫监视中扮演重要角色,得益于其无需预先致敏就具有杀死癌症及受病毒感染细胞的先天能力。请参见:abel等人,front.immunol.9,1869(2018);cerwenka及lanier,nat.rev.immunol.16,112-123(2016);adams等人,j.immunol.197,2963-2970(2016);及chiossone等人,nat.rev.immunol.18,671-688(2018)。nk细胞通过其表面表达cd56及不存在t细胞标记cd3来鉴定。nk细胞的亚群表达fcγriii蛋白质,即cd16,其通过辅助抗体依赖性细胞毒性(adcc)来增强nk细胞的细胞毒性功能。请参见:cerwenka及lanier,nat.rev.immunol.16,112-123(2016);adams等人,j.immunol.197,2963-2970(2016);及freud等人,immunity 47,820-833(2017)。
4.nk细胞功能主要由细胞表面活化及抑制受体的家族控制。活化信号通过活化受体(诸如nkg2d)传递,所述受体会识别包括应力诱发蛋白质mica的配体。抑制受体会识别在正常细胞上普遍表达且在癌细胞中频繁下调的分子,诸如mhc i类。通过监视活化受体及抑制受体之间的平衡,nk细胞能够识别并杀死受压细胞,诸如受感染细胞或癌细胞。请参见:cerwenka及lanier,nat.rev.immunol.16,112-123(2016);chiossone等人,nat.rev.immunol.18,671-688(2018);及fujisaki等人,cancer res.69,4010-4017(2009)。
5.nk细胞涉及基于许多小鼠模型及人体研究的肿瘤免疫监测。由于其强大的抗肿瘤活性,使用nk细胞的过继细胞疗法是有吸引力的抗癌治疗方法。请参见:cerwenka及lanier,nat.rev.immunol.16,112-123(2016);fujisaki等人,cancer res.69,4010-4017(2009);cheung等人,nat.rev.cancer 13,397-411(2013);及brodeur等人,nat.rev.cancer 3,203-216(2003)。
6.因此,需要建立一种放大系统以获得大量用于临床应用的高潜能nk细胞。
技术实现要素:
7.一个或多个具体实施例的细节阐述在附图及以下描述中。具体实施例的其他特征、目的及优点将从描述及附图以及权利要求书中显而易见。
8.在一方面,本文描述一放大自然杀手细胞的方法。所述方法包括:提供一内部胶体细胞群,其中每个胶体细胞包括一胶体内部及含有一个或多个膜结合蛋白的一流体细胞膜,所述一个或多个膜结合蛋白中的每个或集体能够刺激自然杀手(nk)细胞的放大;及在允许nk细胞放大的条件下与所述内部胶体细胞群培养含有nk细胞的一细胞群,所述nk细胞能够对所述一个或多个膜结合蛋白作出反应。
9.在一些具体实施方案中,所述细胞群选自由以下组成的群组:周边血单核细胞(pbmc)、富集的nk细胞、ipsc衍生nk细胞、胚胎干细胞衍生nk细胞、组织驻留nk细胞、脾细胞、脐带血细胞及造血干细胞衍生nk细胞。
10.在一些具体实施方案中,一个或多个膜结合蛋白选自由以下组成的群组:41bbl、il-15、il-21、b7-h6、bat3、hla-dp、hla-e、hla-c2、hla-a、hla-c、hla-g、hla-f、hla-c、mica/micb、ulbp-1、ulbp-2、ulbp-3、ulbp-4、ulbp-5、ulbp-6、aicl、cd48、ntb-a、2b4、cd2、cd58、cd11a、icam1、cracc、ox40l、cd137l、nectin-1、nectin-2、nectin-3、nectin-4、necl-1、necl-2、necl-3、necl-4、necl-5、pcna、aicl、igg、cd27l、cd72、ceacam-1、ceacam-5、ocil、n-钙黏蛋白、e-钙黏蛋白、r-钙黏蛋白、唾液酸、il-1、il-2、il-4、il-7、il-9、il-12、il-18、il-27、il-33、il-6、il-11、cntf、lif、osm、ct-1、clc、ifn-a、inf-b、ccl-5、以下的促效剂:tlr-1、tlr-2、tlr-3、tlr-5、tlr-6、tlr-9、nod-1、nod-2、nod-3或nlrp3促效剂。举例来说,一个或多个膜结合蛋白可包括41bbl及il-15。
11.在一些具体实施方案中,培养步骤在il-21或il-2的存在下进行。
12.在一些具体实施方案中,nk细胞数对胶体细胞数之比例为1:0.5-20(例如1:1、1:2、1:3、1:4、1:5、1:6、1:7、1:8、1:9、1:10、1:12、1:15、或1:20)。
13.在一些具体实施方案中,内部胶体细胞群是通过包括以下的步骤产生:提供一表达一个或多个膜结合蛋白的抗原呈现细胞群;悬浮抗原呈现细胞群在含有蛋白酶抑制剂混合物的无酚红的dmem中,以产生一第一细胞悬浮液;添加胶体溶液到第一细胞悬浮液以产生一第二细胞悬浮液,其中胶体溶液能够增加抗原呈现细胞的膜渗透性且含有一光反应性交联剂及一任选光起始剂;在室温下以一段充足的时间培养第二细胞悬浮液,以使光反应性交联剂及所述任选光起始剂进入抗原呈现细胞;离心第二细胞悬浮液以产生一细胞沉淀物:重新悬浮所述细胞沉淀物在无酚红的dmem中以产生一第三细胞悬浮液;以一段充足的时间对所述第三细胞悬浮液施加一光,以使光反应性交联剂交联,从而产生内部胶体细胞群;及收集并洗涤内部胶体细胞群。
14.在一些具体实施方案中,制备胶体溶液使得所述第二细胞悬浮液的渗透浓度为320mosmol至290mosmol、大于320mosmol或小于290mosmol。
15.在一些具体实施方案中,胶体溶液含有二甲基亚砜(dmso),使得所述第二细胞悬浮液含有0.1至5wt%的dmso。
16.在一些具体实施方案中,所述第二细胞悬浮液中的光反应性交联剂的浓度为5wt%至50wt%。
17.在一些具体实施方案中,光反应性交联剂为聚(乙二醇)-二丙烯酸酯(peg-da),光起始剂为2-羟基-4
’‑
(2-羟基乙氧基)-2-甲基苯丙酮,且光为365nm的蓝光。举例来说,在胶体溶液中,2-羟基-4
’‑
(2-羟基乙氧基)-2-甲基苯丙酮的范围可为0.01至1wt%,且在胶体溶液中,peg-da的平均分子量在200da至5000da之间、范围为2至80wt%。
18.在一些具体实施方案中,胶体溶液的制备是通过溶解2-羟基-4
’‑
(2-羟基乙氧基)-2-甲基苯丙酮在dmso中以产生一溶液,并混合所述溶液与平均分子量为700da的peg-da。
19.在一些具体实施方案中,所述第二细胞悬浮液中的peg-da的浓度为10wt%至40wt%。
20.在一些具体实施方案中,抗原呈现细胞群为人工抗原呈现细胞。举例来说,人工抗原呈现细胞可为以下或改造自以下:k562细胞、pbmc、ebv转化的lcl、721.221细胞、8866细胞、jurkat细胞、jurkat/kl-1细胞、u937细胞、bjab细胞、nb4细胞、293t细胞、mcf7细胞、jeg3细胞、hela细胞、a549细胞、1106mel细胞或cem细胞。
21.在一些具体实施方案中,本方法进一步包括施予经放大的nk细胞在有需要的受试者,例如患有癌症、感染、自体免疫疾病、nk细胞缺陷病症或不需要的细胞的受试者。
22.在一方面,本文描述一种治疗疾病的方法,其包括施予由本文所述的胶体细胞产生的经放大的nk细胞在有需要的受试者。在一些具体实施例中,疾病为癌症、感染、自体免疫性疾病或nk细胞缺陷性病症,诸如典型nk缺陷及功能性nk缺陷,或具有不需要的细胞的病症。
23.在另一方面,本文描述一种产生内部胶体细胞群的方法。所述方法包括:提供一表达一个或多个膜结合蛋白的前驱细胞群;悬浮前驱细胞群在含有蛋白酶抑制剂混合物的无酚红的dmem中,以产生一第一细胞悬浮液;添加胶体溶液到所述第一细胞悬浮液以产生一第二细胞悬浮液,其中所述胶体溶液能够增加所述前驱细胞的膜渗透性且含有一光反应性交联剂及一任选光起始剂;在室温下以一段充足的时间培养所述第二细胞悬浮液,以使光反应性交联剂及任选光起始剂进入所述前驱细胞;离心所述第二细胞悬浮液以产生一细胞沉淀物;重新悬浮所述细胞沉淀物在无酚红的dmem中以产生一第三细胞悬浮液;以一段充足的时间对所述第三细胞悬浮液施加一光,以使光反应性交联剂交联,从而产生所述内部胶体细胞群;及收集并洗涤内部胶体细胞群;其中每个内部胶体细胞包括一胶体内部及含有一个或多个膜结合蛋白的一流体细胞膜。
24.在一些具体实施方案中,制备胶体溶液使得所述第二细胞悬浮液的渗透浓度为320mosmol至290mosmol、大于320mosmol或小于290mosmol。
25.在一些具体实施例中,胶体溶液含有dmso,使得所述第二细胞悬浮液含有0.1至5wt%的dmso。
26.在一些具体实施方案中,第二细胞悬浮液中的所述光反应性交联剂的浓度为5wt%至50wt%。
27.在一些具体实施方案中,光反应性交联剂为聚(乙二醇)-二丙烯酸酯(peg-da),光起始剂为2-羟基-4
’‑
(2-羟基乙氧基)-2-甲基苯丙酮,且光为365nm的蓝光。举例来说,在胶体溶液中,2-羟基-4
’‑
(2-羟基乙氧基)-2-甲基苯丙酮的范围可为0.01至1wt%,且在胶体溶液中,peg-da的平均分子量可在200da至5000da之间、范围为2至80wt%。
28.在一些具体实施方案中,所述胶体溶液的制备是通过溶解2-羟基-4
’‑
(2-羟基乙氧基)-2-甲基苯丙酮在dmso中以产生溶液,并混合溶液与平均分子量为700da的peg-da。
29.在一些具体实施方案中,所述第二细胞悬浮液中的peg-da的浓度为10wt%至40wt%。
30.在一些具体实施方案中,所述前驱细胞群为人工抗原呈现细胞。举例来说,人工抗原呈现细胞可为以下或改造自以下:k562细胞、pbmc、ebv转化的lcl、721.221细胞、8866细胞、jurkat细胞、jurkat/kl-1细胞、u937细胞、bjab细胞、nb4细胞、293t细胞、mcf7细胞、jeg3细胞、hela细胞、a549细胞、1106mel细胞或cem细胞。
31.在一些具体实施方案中,所述一个或多个膜结合蛋白中的每个或集体能够刺激自
然杀手(nk)细胞的放大。
32.在一些具体实施方案中,一个或多个膜结合蛋白选自由以下组成的群组:41bbl、il-15、il-21、b7-h6、bat3、hla-dp、hla-e、hla-c2、hla-a、hla-c、hla-g、hla-f、hla-c、mica/micb、ulbp-1、ulbp-2、ulbp-3、ulbp-4、ulbp-5、ulbp-6、aicl、cd48、ntb-a、2b4、cd2、cd58、cd11a、icam1、cracc、ox40l、cd137l、nectin-1、nectin-2、nectin-3、nectin-4、necl-1、necl-2、necl-3、necl-4、necl-5、pcna、aicl、igg、cd27l、cd72、ceacam-1、ceacam-5、ocil、n-钙黏蛋白、e-钙黏蛋白、r-钙黏蛋白、唾液酸、il-1、il-2、il-4、il-7、il-9、il-12、il-18、il-27、il-33、il-6、il-11、cntf、lif、osm、ct-1、clc、ifn-a、inf-b、ccl-5、以下的促效剂:tlr-1、tlr-2、tlr-3、tlr-5、tlr-6、tlr-9、nod-1、nod-2、nod-3或nlrp3促效剂。
33.在仍另一方面,本文描述一种内部胶体细胞群,其通过本文所述的方法产生,其中每个细胞包含一胶体内部及含有一个或多个膜结合蛋白的一流体细胞膜。
34.在一方面,本文描述一种组合物,其包含内部胶体细胞群。
35.在另一方面,本文提供一种在受试者中诱导免疫反应的方法,其包含向所述受试者施予所述的组合物。
附图说明
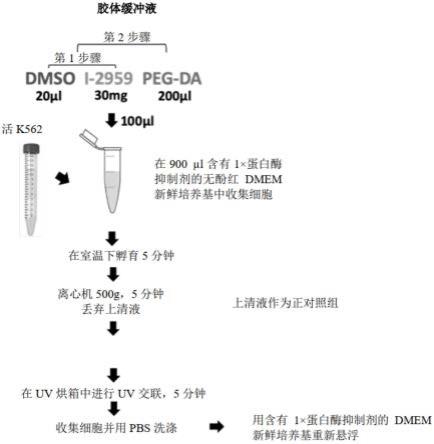
36.图1为制备胶体细胞的示例性方法的示意图。
37.图2为一组显示活k562细胞及胶体k562细胞的图像。在进一步实验之前,目视确认活k562细胞(左)及胶体k562细胞(右)具有相似的细胞形态。
38.图3为一组显示通过新颖饲养细胞系统以放大nk细胞的图。pbmc与辐射照射过的k526-41bbl-mb15细胞(gm)及由k526-41bbl-mb15细胞(gc)制备的胶体细胞,在il-21(100ng/ml)存在或不存在下共同培养。在第0、7及14天(n=3)测定细胞群(a)、nk细胞数(b)及放大倍数(c)。误差杠代表平均值
±
sd。
39.图4为一组显示nk细胞在通过gc放大后表现出增加的细胞毒性的图。pbmc与gm或gc,在il-21存在或不存在下,以及在抗cd137抗体存在(b)或不存在(a)下共同培养。通过杀伤分析(killing assay)来评估放大的nk细胞的细胞毒性。e:t比例为1:1、0.5:1及0.25:1(n=2)。误差杠代表平均值
±
sd。
40.图5为一组显示gc增加nk细胞的细胞溶解活性的图。(a)测定gm及gc放大系统的总细胞数(左)、nk群(中)及nk细胞数(右)。(b)在放大7天后测定gm放大的nk细胞及gc放大的nk细胞的放大倍数。(c)在放大7天后测定nk细胞的细胞溶解活性。(d)在nk放大期间测定系统中的gm及gc群。
41.图6为一组显示使gc放大系统条件优化的图。(a)nk细胞通过具有不同硬度(stiffness)的不同gc放大。放大7天后测定总nk细胞数。(b)放大7天后测定从gc放大的nk细胞的细胞溶解活性。
42.图7为一组显示使从pbmc富集的nk细胞的放大条件优化的图。使用不同比例的细胞(nk:饲养细胞=1:10、1:5、1:2及1:0.5)与10iu/ml il-12(a至c)或100iu/ml il-2(d至f)放大pbmc富集的nk细胞。(a)(d)在第0天及第7天评估在不同细胞比例下,放大的nk细胞的总细胞数(左)、nk群(中)及nk细胞数(右)。(b)(e)在放大7天后测定在不同细胞比例下的放大倍数。(c)(f)在放大7天后测定在不同细胞比例下放大的nk细胞的细胞溶解活性。
具体实施方式
43.结果表明,细胞内水胶体技术可保持细胞质膜完整性,同时获得非凡的稳定性。请参见:lin等人,nat.commun.10,1057(2019)。通过使用此技术来制备人工抗原呈现细胞(apc)作为nk细胞的饲养细胞,可观察到与标准饲养细胞系统相比,放大系统可诱导相似的nk细胞增殖量。令人惊讶的是,此放大系统不仅增加nk活化受体的表达量,且还增强nk细胞对肿瘤的细胞毒性。
44.因此,本文描述一种放大nk细胞的方法。所述方法包括:提供一内部胶体细胞群,所述其中每个内部胶体细胞包括一胶体内部及含有一个或多个膜结合蛋白的一流体细胞膜,一个或多个膜结合蛋白中的每个或集体能够刺激nk细胞的放大;及在允许nk细胞放大的条件下与内部胶体细胞群培养含有nk细胞的一细胞群,所述nk细胞能够对一个或多个膜结合蛋白作出反应。换句话说,所述内部胶体细胞用作饲养细胞。
45.nk细胞群可选自由以下所组成的群组:周边血单核细胞(pbmc)、从pbmc或其他来源富集的nk细胞、ipsc衍生nk细胞、胚胎干细胞衍生nk细胞、组织驻留nk细胞、脾细胞、脐带血细胞及造血干细胞衍生nk细胞。
46.一个或多个膜结合蛋白可选自由以下组成的群组:41bbl、il-15、il-21、b7-h6、bat3、hla-dp、hla-e、hla-c2、hla-a、hla-c、hla-g、hla-f、hla-c、mica/micb、ulbp-1、ulbp-2、ulbp-3、ulbp-4、ulbp-5、ulbp-6、aicl、cd48、ntb-a、2b4、cd2、cd58、cd11a、icam1、cracc、ox40l、cd137l、nectin-1、nectin-2、nectin-3、nectin-4、necl-1、necl-2、necl-3、necl-4、necl-5、pcna、aicl、igg、cd27l、cd72、ceacam-1、ceacam-5、ocil、n-钙黏蛋白、e-钙黏蛋白、r-钙黏蛋白、唾液酸、il-1、il-2、il-4、il-7、il-9、il-12、il-18、il-27、il-33、il-6、il-11、cntf、lif、osm、ct-1、clc、ifn-a、inf-b、ccl-5、以下的促效剂:tlr-1、tlr-2、tlr-3、tlr-5、tlr-6、tlr-9、nod-1、nod-2、nod-3或nlrp3促效剂。举例来说,一个或多个膜结合蛋白可包括41bbl及il-15。
47.培养步骤可在il-21(例如50至200ng/ml)或il-2(例如5至200iu/ml)存在下在适合用于培养及放大nk细胞的培养基中进行。
48.在一些具体实施例中,nk细胞及内部胶体细胞可在il-21或il-2存在下,以nk细胞对胶体细胞比例为1:0.5-20(例如1:1、1:2、1:3、1:4、1:5、1:10或1:15)来共同培养。
49.可通过包括瞬时渗透(transiently permeabilizing)前驱细胞群的脂质膜以使无活性但可活化的交联剂引入细胞的步骤来产生内部胶体细胞群。交联剂进入渗透的细胞后,就得使细胞恢复到其非渗透状态,从而使交联剂密封在细胞内部。接着例如通过洗涤细胞,去除任何剩余的囊泡外交联剂。随后活化内部交联剂以实现细胞的内部胶体而不会干扰膜。渗透步骤可在交联剂的存在下进行。另请参见wo2018/026644。
50.所得的内部胶体细胞保留其天生外观,且不易受到环境压力的影响。膜脂质及蛋白质在内部凝胶化时仍保持其流动性。通过此方法产生的内部胶体细胞具有被脂质膜包围的固定或胶体内部,所述脂质膜与其前驱细胞的脂质膜实质上相同。前驱细胞的性质,例如对表面活性剂的敏感性、膜流动性、膜蛋白质迁移率、膜渗透性、膜含量、表面电荷、及膜生物学功能,可保留在胶体细胞中。
51.可应用本领域已知的各种技术来诱导前驱细胞中的瞬时膜穿孔(transient membrane poration)或渗透性。此等技术包括但不限于冻融处理、渗透压冲击、超音波穿
孔、电穿孔、雷射诱导膜穿孔、剪切诱导膜穿孔、及其他基于机械手段的技术。举例来说,当紧邻脂质膜处发生空化事件(cavitation events)时,会发生超音波穿孔。微泡与膜之间的相互作用通过穿刺脂质膜的声微流、气泡振荡、冲击波及微射流形成而产生瞬时孔。熟练人员能够决定如何应用技术以在膜中产生临时孔而不会永久地破坏膜。通常,在停止使用瞬时膜渗透技术后,产生的孔会自发地关闭。
52.能够进入渗透的脂质膜并在细胞内被活化以形成胶体内部的任何交联剂均可用于产生内部胶体细胞。在一些具体实施例中,交联剂为可被活化以交联形成凝胶的单体或聚合物。热感应水凝胶交联、光感应水凝胶交联、ph敏感水凝胶交联、化学感应水凝胶交联、及溶胶-凝胶二氧化硅交联为示例性的可活化交联技术。
53.可使用光聚合或光反应性交联。光聚合为聚合物在暴露于光(通常在电磁光谱的紫外线或可见光区域)后性质发生变化的交联,从而导致材料固化及硬化。此方法可在光起始剂存在或不存在的情况下进行。光起始剂的实例包括但不限于阳离子光起始剂(例如,鎓盐、有机金属盐及吡啶鎓盐)及自由基光起始剂(例如,二苯基酮、氧杂蒽酮、醌、安息香醚、苯乙酮、苯甲酰肟及酰基膦)。光反应性交联剂的实例包括但不限于任何分子量的环氧化物、胺基甲酸酯、聚醚及聚酯。光反应性交联剂通常用丙烯酸酯官能化以进行交联。举例来说,分子量为700的聚乙二醇二丙烯酸酯(pegda)可与(2-羟基-4
’‑
(2-羟基乙氧基)-2-甲基苯丙酮(i-2959)一同使用作为光起始剂。
54.热感应聚合物通常含有疏水基团或在临界温度下易于链聚集的基团。在特定温度(即非反应性温度)下可使热感应聚合物引入渗透的细胞,接着通过使温度改变为临界温度而交联。适用于本文所述的内部胶体方法的热敏感聚合物的实例包括但不限于含有疏水侧基的聚丙烯酰胺衍生物、peg-plga-peg三嵌段共聚物、甲基丙烯酸羟乙酯-甲基丙烯酸甲酯(hema-mma)、聚丙烯腈-聚氯乙烯(pan-pvc)、聚(n-异丙基丙烯酰胺)(polynipam)、聚(n-乙烯基己内酰胺)、纤维素衍生物,环氧乙烷-丙烯、及基质胶(matrigel)。
55.在本文所述的任何方法中,可通过提供表达一个或多个膜结合蛋白的前驱细胞群来产生内部胶体细胞。接着悬浮前驱细胞群在含有蛋白酶抑制剂混合物(protease inhibitor cocktail)的无酚红的dmem中,以产生第一细胞悬浮液。添加胶体溶液到第一细胞悬浮液中以产生第二细胞悬浮液。含有光反应性交联剂及任选光起始剂的胶体溶液能够增加前驱细胞的膜渗透性。在室温下以一段充足的时间培养第二细胞悬浮液,以使光反应性交联剂及光起始剂进入前驱细胞。接着离心第二细胞悬浮液以产生细胞沉淀物,所述沉淀物经重新悬浮在无酚红的dmem中以产生第三细胞悬浮液。以一段充足的时间对第三细胞悬浮液施加光,以使光反应性交联剂交联,从而产生内部胶体细胞群。收集并洗涤内部胶体细胞。如此产生的每个内部胶体细胞包括胶体内部及含有由前驱细胞表达的一个或多个膜结合蛋白的流体细胞膜。
56.可通过溶解光起始剂(例如,i-2959)在二甲基亚砜(dmso)中以产生溶液并混合所述溶液与光反应性交联剂(例如,peg-da)来制备胶体溶液。在一些具体实施例中,在胶体溶液中,i-2959的范围可为0.01至1wt%,且peg-da的平均分子量可在200da至5000da之间、范围为2至80wt%。举例来说,可首先通过溶解20μl 750mg/ml的i-2959在dmso中,接着混合所得溶液与200μl peg-da来制备胶体溶液。
57.在一些情况下,制备胶体溶液并使其添加到第一细胞悬浮液中,使得第二细胞悬
浮液的渗透浓度为290mosmol至320mosmol、大于320mosmol或小于290mosmol。
58.可制备胶体溶液并使其添加到第一细胞悬浮液中,使得第二细胞悬浮液含有0.1至5wt%的dmso。
59.可通过调节第二细胞悬浮液中交联剂的浓度来改变胶体细胞的硬度。举例来说,可使胶体溶液添加到第一细胞悬浮液中,使得第二细胞悬浮液中光反应性交联剂的浓度为5wt%至50wt%(例如5wt%、10wt%、15wt%、20wt%、25wt%、30wt%、35wt%、及40wt%)。
60.通过本文所述的方法产生的放大的nk细胞可施予在有需要的受试者。放大的nk细胞可源自从受试者或另一供体受试者获得的细胞群(例如,pbmc)。放大的nk细胞可用于治疗癌症、感染、自体免疫性疾病或nk细胞缺陷性病症,诸如典型nk缺陷及功能性nk缺陷,或根除不需要的细胞。
61.本文所述的内部胶体细胞保留抗原呈现细胞的抗原呈现能力,但缺乏增殖活性。因此,胶体细胞保留其调节免疫反应的能力,而无致瘤性风险。因此,可施予胶体细胞在有需要其的受试者以治疗病症或诱导免疫反应。在某些情况下,胶体细胞用作疫苗。
62.胶体细胞可配制成适合各种施予途径的医药组合物,例如静脉内、关节内、结膜、颅内、腹膜内、胸膜内、肌内、鞘内、或皮下施予途径。其可含有医药上可接受的载体,例如缓冲液或赋形剂,或佐剂。
63.下面的具体实施例应解释为仅是示例性的,且无论如何不以任何方式限制本揭示的其余部分。
64.在无进一步阐述的情况下,相信本领域熟练人员可基于本文描述最大程度地利用本揭示。本文引用的所有刊物均通过引用全文并入本文。
65.实施例1:胶体人工抗原呈现细胞支持nk细胞体外增殖。
66.对已建立的基因工程人工抗原呈现细胞(aapc)进行细胞内水胶体以用于nk放大。慢病毒转导k562细胞以表达41bbl及膜结合il15(k562-41bbl-mb15饲养细胞)。请参见:fujisaki等人,cancer res.69,4010-4017(2009)。
67.来自健康供体的周边血单核细胞(pbmc)与辐射照射过的k562-41bbl-mb15饲养细胞(gm)或胶体k562-41bbl-mb15饲养细胞(gc)共同培养,以选择性支持nk细胞放大。考虑到il-21在nk细胞成熟及增殖中的关键角色,而比较il-21存在或不存在时对gc及gm递归刺激(recursive stimulation)反应后nk细胞的放大。如图3(a)所示,在所有条件下与aapc共同培养14天后,观察到cd3-cd56
+
nk细胞高度富集(gm、il-21+gm为83.5%
±
10.10%、89.2%
±
2.35%,gc、il-21+gc为69.0%
±
22.76%、93.0%
±
4.55%)。到第7天,与以gm放大5.4倍相比,当与gc共同培养时,观察到nk细胞平均放大13.1倍。令人惊讶的是,尽管当与gc共同培养时nk细胞数较少,但添加il-21到gc共同培养物中却显示放大有显著增加(il-21+gc为12.6倍)。到第14天,观察到aapc对nk放大的相似趋势(gm、il-21+gm为66.7
±
13.0、75.8
±
33.5倍,gc、il-21+gc为39.7
±
9.5、75.3
±
6.7倍),这表明胶体aapc保持支持nk细胞体外增殖的能力,并促进放大的nk细胞的选择性富集。请参见图3(c)。
68.实施例2:胶体aapc支持的nk细胞放大导致nk细胞受体的不同表现方式。
69.由于gc及gm源自相同的基因工程aapc,可因此预料以gc或gm放大的nk细胞会经由相同的信号传递途径被活化,并应产生相似的免疫表型。为了阐明这个问题,固定cd3-cd56
+
nk细胞以评估主要nk细胞受体在通过cytof放大之前或之后的表面表达。出乎意料的是,如
在非监督式层级聚类分析(unsupervised hierarchical clustering analysis)中所示,未放大的、gc放大的及gm放大的三个不同的组被聚在一起(数据未显示)。值得注意的是,尽管两组都比未放大的nk细胞表现出更高程度的活化受体,但与gm放大的nk细胞相比,gc放大的nk细胞显示活化受体的表达增加,包括nkp30、cd137、cracc及nkg2d以及穿孔素(数据未显示)。这些结果表明,与gc共同培养可能会提供持续的活化信号给nk细胞,并导致活化受体及穿孔素的更高表达量。
70.实施例3:胶体aapc放大的nk细胞显示对肿瘤细胞株增强的细胞毒性。
71.随着活化受体及穿孔素的高表达,以gc放大的nk细胞可能对肿瘤靶标具有更高的细胞毒性。为了解决这个问题,通过杀伤分析来评估放大的nk细胞的细胞毒性。实际上,已发现在il-21存在或不存在下,以gc放大的nk细胞比gm放大的nk细胞对靶肿瘤细胞株k562的特异性杀伤作用大得多。请参见图4(a)。另外,由于cd137在gc放大的nk细胞中的更高表达,可因此通过应用抗cd137促效剂抗体来进一步活化gc放大的nk细胞。如图4(b)所示,在抗cd137促效剂抗体存在下,与gm组相比,gc放大的nk细胞对k562靶细胞的细胞毒性进一步增强,这表明结合抗cd137促效剂与gc放大的nk细胞作为治疗策略的可能性。
72.实施例4:胶体aapc具有更高的持久性,并产生具有更高细胞溶解活性的放大的nk细胞
73.为了进一步评估由胶体饲养细胞放大的nk细胞,而从k562-41bbl-mb15细胞产生胶体细胞。pbmc与gm或gc共同培养。在第0天、第4天及第7天测定总细胞数、nk群及nk细胞数。请参见图5(a)。放大7天后,富集nk细胞并分析其细胞溶解活性。请参见图5(c)。尽管两组的nk细胞群在第7天相似,但gm可比gc组放大更多的nk细胞。请参见图5(a)及图5(b)。另一方面,gc放大的nk细胞表现出比gm放大的细胞更高的细胞溶解活性,这表明gc比gm有更高潜力以促进nk活性。请参见图5(c)。还观察到gc比gm具有更高的持久性。请参见图5(d)。因此,gc能够刺激nk细胞更长的时间,并诱导nk细胞中更高的细胞溶解活性。
74.实施例5:修饰的胶体细胞及培养条件改善nk细胞放大及细胞溶解活性
75.为了提高gc放大nk细胞的能力,而修饰gc性质以使效率优化。
76.先前的研究表明,刺激表面的硬度可调节nk细胞的活化。请参见:mordechay等人,《自然杀手细胞的细胞溶解活性的机械调控(mechanical regulation of the cytotoxic activity of natural killer cells)》(2020),biorxiv.org,doi:10.1101/2020.03.02.972984。调节gc的硬度以评估其对nk细胞活化的作用。测试具有不同硬度程度的gc,包括4%、10%、20%及40%。请参见图6(a)及图6(b)。数据显示,gc硬度与nk放大效率的相关性呈钟形曲线,这与先前的研究一致。10%的硬度显示最大的放大效率。请参见图6(a)。另一方面,不同gc组之间的细胞溶解活性并无显著差异。请参见图6(b)。
77.nk细胞与其他免疫细胞(诸如t细胞)之间的相互作用可促进nk活化及增殖。请参见:malhotra及shanker,《nk细胞:免疫交互作用及治疗意义(nk cells:immune cross-talk and therapeutic implications)》37(2012);及lee等人,sci rep 7,11075(2017)。然而,这些相互作用可能会影响来自不同放大批次的nk细胞的质量。为了消除这种差异,在放大前先从pbmc中富集nk细胞。富集的nk细胞在10iu/ml或100iu/ml的人il-2存在下,以nk细胞对饲养细胞的不同比例(1:10、1:5、1:2及1:0.5)来共同培养。请参见图7。数据显示,以100iu/ml的il-2放大的nk细胞比以10iu/ml的il-2放大的细胞显示更高的放大效率。请参
见图7(a)、图7(b)、图7(d)及图7(e)。另外,在100iu/ml的il-2存在下,放大的nk细胞表现出更高的细胞溶解活性。请参见图7(c)及图7(f)。根据这些数据,以gc放大具有10%硬度、nk细胞对饲养细胞的比例为1:5、且在100iu/ml的il-2的存在下,nk细胞显示良好的放大效率及细胞溶解活性。请参见图7。另外,在gm放大的细胞及gc放大的细胞之间,在1:10的比例下以100iu/ml的il-2在放大效率及nk细胞溶解活性方面均存在显著差异。请参见图7(d)至图7(f)。
78.实施例6:材料及方法
79.细胞株
80.k562-41bbl-mb15细胞赠送自ntuh的chang博士。所有细胞均在补充有胎牛血清(hyclone)、青霉素(100u/ml)、链霉素(100ug/ml)的rpmi 1640培养基(gibco)中培养。
81.胶体细胞
82.首先溶解20μl 750mg/ml的2-羟基-4
’‑
(2-羟基乙氧基)-2-甲基苯丙酮(irgacure d-2959;sigma-aldrich)在二甲基亚砜(dmso)中,并再混合200μl聚(乙二醇)-二丙烯酸酯(peg-da;mn=700da;sigma-aldrich)来制备胶体缓冲液。收集5
×
106个k562细胞或基因修饰的k562细胞,并使其悬浮在1ml含有1
×
蛋白酶抑制剂的无酚红dmem(dulbecco's modified eagle medium)(ca21063-029;thermofisher scientific)中。以1:10的体积比例添加胶体缓冲液到细胞悬浮液中,使细胞悬浮液中的peg-da浓度达到10wt%。在室温下培养5分钟后,使细胞沉淀并重新悬浮于无胶体缓冲液的500μl无酚红dmem中,并在uv烘箱中进行365nm蓝光轰击5分钟。以pbs洗涤所得的胶体细胞(gc)一次,并在进一步实验之前进行目测评估。请参见图2。
83.从pbmc放大nk细胞
84.在补充有5%人类血清(gemini bio)的x-vivo培养基(lonza)中,在il-21(100ng/ml)存在或不存在或在il-2(10iu/ml或100iu/ml)存在或不存在下,共同培养周边血单核细胞(pbmc)与辐射照射过的k562-41bbl-mb15细胞(gm)或gc。为了评估放大效率,在放大7天后评估nk群及细胞数。另外,以多聚甲醛固定放大的nk细胞,并通过cytof测定nk活化及抑制标记。通过细胞毒性分析评估nk活性。
85.nk群及细胞数测定
86.pbmc或放大的细胞分别以apc-抗-cd3(biolegend)及pe-抗-cd56(biolegend)染色,并通过流式细胞仪验证nk群(cd3-cd56
+
)的比例。另外,通过血球计测定总细胞数。nk细胞数计算如下:总细胞数
×
nk群比例。
87.细胞毒性分析
88.通过测量亮度来评估nk细胞的细胞毒性功能。标靶细胞k562-luc
+-gfp
+
稳定表现荧光素酶标记。使nk细胞与标靶细胞以指定比例三重复共同培养4小时。使细胞裂解,并通过荧光素酶分析系统(promega)在96孔白盘中测定亮度。细胞裂解百分比计算如下:(单独标靶细胞的亮度-nk-标靶共同培养物的亮度)/(单独标靶细胞的亮度-空白)
×
100%
89.单细胞质谱流式细胞仪(cytof)
90.样品在室温下以1.5%多聚甲醛固定10分钟,接着以含有0.5%bsa的pbs洗涤两次。一同培养甲醛固定的细胞样品与针对表面标记的金属共轭抗体1小时,以含有0.5%bsa的pbs洗涤一次,在冰上以甲醇渗透10分钟,以含有0.5%bsa的pbs洗涤两次,接着与针对细
胞内分子的金属共轭抗体一同孵育1小时。细胞内染色后,细胞以含有0.5%bsa的pbs洗涤一次,接着在含有1.5%多聚甲醛的pbs中与含铱dna嵌入剂(fluidigm)在室温下一同孵育10分钟。嵌入/固定后,细胞样品以含有0.5%bsa的pbs洗涤一次,并以水洗涤两次,接着在cytof质谱流式细胞仪(fluidigm)上进行测量。如先前所述执行检测器灵敏度的标准化。经过测量及标准化后,首先根据细胞长度、dna含量及顺铂染色,圈选出双联体、碎片及死细胞来分析各个文件。热点图、直方图及visne图以cytobank.org上提供的软件工具产生。
91.gc持久性测试
92.为了监视nk放大系统中gm及gc的持久性,使用高含量成像系统监视gm及gc数量的变化。更具体地说,分别以celltracker深红(thermo fisher scientific)及cfse(thermo fisher scientific)标记pbmc及饲养细胞(gm及gc)。pbmc及饲养细胞与10iu/ml人il-2在补充有5%人类血清(gemini bio)的x-vivo培养基(lonza)中共同培养3天。通过imagexpress microsystem(molecular devices,sunnyvale,ca)每3小时获取一次图像,其中物镜为20
×
,设置fitc及cy7过滤器,每个孔9个视野。通过imagej分析图像数据以评估细胞数。
93.gc硬度
94.通过调节含有胶体缓冲液的细胞悬浮液中的peg-da浓度(即4wt%、10wt%、20wt%及40wt%),产生具有不同硬度的gc,包括4%、10%、20%及40%。pbmc及gc与10iu/ml人il-2在补充有5%人类血清(geminibio)的x-vivo培养基(lonza)中共同培养。在第3天及第5天更新培养基。在第7天评估总细胞数及nk细胞溶解功能。
95.富集的nk放大测试
96.通过nk分离套组(miltenyi biotec)从pbmc富集nk细胞。接着,在补充有5%人类血清(gemini bio)的x-vivo培养基(lonza)中,以10或100iu/ml人il-2,共同培养nk细胞与不同比例的nk细胞对饲养细胞(gm或gc)。在第3天及第5天更新培养基。在第7天评估nk细胞数、群及nk细胞溶解功能。
97.其他具体实施例
98.本说明书中揭示的所有特征可以任何组合方式组合。本说明书中揭示的每个特征可由具有相同、等同或相似目的的替代特征代替。因此,除非另有明确说明,否则所揭示的每个特征仅是一系列等同或相似特征的实例。
99.根据以上描述,本领域熟练人员可容易地确定所描述的具体实施例的基本特征,且在不脱离其精神及范围的情况下,可对具体实施例进行各种改变及修饰以使其适应各种用途及条件。因此,其他具体实施例也在权利要求书的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1