含有纤维蛋白原片段和层粘连蛋白片段的嵌合蛋白及其利用的制作方法
1.本发明涉及含有纤维蛋白原片段和层粘连蛋白片段的嵌合蛋白及其利用。
背景技术:
2.在培养从各种器官中取出的细胞时,不能粘附于培养器而确保立足点的细胞不能增殖,引发程序性细胞死亡而自发死亡。该现象是任一器官细胞均适用的普遍属性,称为“细胞立足点依赖性”。在生物体内作为细胞立足点的是在细胞周围构建的被称为胞外基质的结构物。已知构成胞外基质的蛋白质有300种以上,对于每种细胞而言,作为立足点使用的胞外基质的分子组成不同。为了培养从生物体取出的细胞、特别是干细胞,需要考虑该细胞在生物体内以何种分子组成的胞外基质作为立足点并选择培养基材。
3.胞外基质根据其形状和在生物体内的存在部位而分为基底膜和间质。基底膜是形成于上皮与结缔组织的边界的厚度约100nm的片状的胞外基质,发挥作为维持各种器官的实质细胞和其干细胞的稳定性和增殖能力所必需的立足点的作用。因此,在培养从器官中取出的细胞、特别是干细胞时,期望使用模拟了在生物体内作为该干细胞的立足点的基底膜的培养基材来作为立足点。
4.到目前为止,已知有局部存在于基底膜的40种以上的蛋白质(非专利文献1)。其中,iv型胶原蛋白、层粘连蛋白及串珠蛋白聚糖等硫酸乙酰肝素蛋白聚糖是不论细胞、器官的类型如何都包含在基底膜中的组成型(constitutive)成分,在基底膜的构建和功能表达中承担着不可或缺的作用。这些组成型基底膜分子已确认在所有调查过的后生动物中均存在,是进化上非常保守的蛋白质。
5.iv型胶原蛋白为局部存在于基底膜的代表性胶原蛋白,自我缔合而形成网眼状结构。层粘连蛋白为承担基底膜的立足点活性的粘附蛋白,承担与细胞表面的整联蛋白结合而介导细胞向基底膜的粘附的作用。串珠蛋白聚糖为基底膜中包含的代表性硫酸乙酰肝素蛋白聚糖,承担借助其d1结构域所附加的硫酸乙酰肝素链结合各种生长因子、控制生长因子的作用的职责。硫酸乙酰肝素是与肝素在结构和功能上均相似的酸性糖链分子,已知与碱性成纤维细胞生长因子(basic fibroblast growth factor,bfgf)、激活素a、骨形成蛋白(bone morphogenetic protein,bmp)、wnt等各种生长因子结合。为了制造模拟基底膜的培养基材,关键在于不仅要组合承担基底膜的粘附活性的层粘连蛋白、而且要组合承担基底膜的结构特性或功能特性的其它基底膜构成分子。本发明人们制作了将层粘连蛋白的整联蛋白结合部位与串珠蛋白聚糖的d1结构域连接而成的嵌合蛋白(专利文献1),发现其作为多能干细胞的分化诱导用基材有用。
6.以往,作为模拟基底膜的培养基材,广泛使用小鼠engelbreth-holm-swarm(ehs)肉瘤的粗提取物。已知ehs肉瘤是过量产生基底膜构成分子的特殊肿瘤,源自小鼠早期胚的腔壁内胚层(parietal endoderm)。ehs肉瘤的提取物已经以matrigel(商标)的名称产品化,作为模拟基底膜的生理活性的培养基材一直被用于各种细胞的培养中。matrigel的约60%为层粘连蛋白-111(α1β1γ1),其余为iv型胶原蛋白、串珠蛋白聚糖、巢蛋白
(nidogen)。matrigel还含有微量的转化生长因子β(transforming growth factor(tgf)-β)、胰岛素样生长因子1(insulin-like growth factor(igf)-1)、血小板衍生生长因子(platelet-derived growth factor,pdgf)等生长因子。
7.matrigel在22℃~35℃下加温时会发生凝胶化,因此包埋细胞而进行培养,从而可以适合作为三维培养基材使用。在细胞的三维培养中也利用胶原蛋白凝胶、纤维蛋白凝胶,但是报道了很多在培养从生物体取出的器官干细胞、由多能干细胞分化诱导而成的器官干细胞时使用matrigel作为三维培养基材的例子。特别是将多种细胞组合而制作被称为类器官的三维器官模型时,几乎都使用matrigel来作为三维培养基材。
8.matrigel虽然作为从生物体取出的干细胞的三维培养基材是非常有用的,但是将培养出的细胞、细胞块进行医疗应用的情况下,存在以下所述的问题。第一,matrigel为小鼠肿瘤的粗提取物,使用其培养出的细胞中不可避免地会混入小鼠来源的蛋白质。第二,已知matrigel的化学组成在批次间存在偏差,难以使化学组成标准化。第三,matrigel中所含的层粘连蛋白异形体被限定为层粘连蛋白-111。层粘连蛋白存在12种以上异形体,作为立足点有效的层粘连蛋白根据细胞而不同。据报道,在将人ips细胞分化诱导为肝干细胞时,层粘连蛋白-111为有效的立足点(专利文献2),但是在分化诱导为血管内皮细胞时层粘连蛋白-411有效(专利文献3),在分化诱导为角膜上皮细胞时,层粘连蛋白-332有效(非专利文献2)。但是,技术上难以任意地改变matrigel中所含的层粘连蛋白异形体。
9.鉴于这样的技术背景,在利用器官干细胞的医疗、药物创制领域中强烈要求开发出代替matrigel的三维凝胶基材。
10.现有技术文献
11.专利文献
12.专利文献1:wo2012/137970
13.专利文献2:wo2014/168157
14.专利文献3:日本特开2019-141086
15.非专利文献
16.非专利文献1:manabe r,et al.transcriptome-based systematic identification of extracellular matrix proteins.proc.natl.acad.sci.usa105:12849-12854,2008
17.非专利文献2:shibata s,et al.cell-type-specific adhesiveness and proliferation propensity on laminin isoforms enable purification of ipsc-derived corneal epithelium.stem cell reports,14:663-676,2020
技术实现要素:
18.发明所要解决的问题
19.本发明的课题在于,提供具备基底膜的活性的能够医疗应用的凝胶基材。
20.用于解决问题的方法
21.为了解决上述课题,本发明包括以下的各发明。
22.[1]一种嵌合蛋白,其含有能够通过凝血酶处理与纤维蛋白原结合的纤维蛋白原片段和具有整联蛋白结合活性的层粘连蛋白片段。
[0023]
[2]根据前述[1]所述的嵌合蛋白,其还含有具有生长因子结合活性的蛋白质。
[0024]
[3]根据前述[2]所述的嵌合蛋白,其中,具有生长因子结合活性的蛋白质为硫酸乙酰肝素蛋白聚糖。
[0025]
[4]一种凝胶,其由前述[1]~[3]中任一项所述的嵌合蛋白的凝血酶处理分子和纤维蛋白形成。
[0026]
[5]前述[4]所述的凝胶的制造方法,其包括制备前述[1]~[3]中任一项所述的嵌合蛋白、纤维蛋白原和凝血酶的混合物的步骤。
[0027]
[6]根据前述[5]所述的制造方法,其中,前述混合物中的嵌合蛋白与纤维蛋白原的摩尔比为1:5~1:20000。
[0028]
[7]一种凝胶制备用组合物,其含有前述[1]~[3]所述的嵌合蛋白和纤维蛋白原。
[0029]
[8]一种用于制备前述[4]所述的凝胶的试剂盒,其包含前述[1]~[3]中任一项所述的嵌合蛋白、纤维蛋白原及凝血酶。
[0030]
[9]一种细胞或组织片的三维培养方法,其使用前述[4]所述的凝胶。
[0031]
[10]一种制造用于移植医疗的细胞或类器官的方法,其使用前述[9]所述的三维培养方法来制造用于移植医疗的细胞或类器官。
[0032]
发明效果
[0033]
根据本发明,可以提供具备基底膜的活性的能够医疗应用的凝胶基材。本发明的凝胶基材可以用于细胞、组织片的三维培养,可以代替matrigel。
附图说明
[0034]
图1(a)为示出人层粘连蛋白α5β1γ1e8(lm511e8)的分子结构的图,(b)为示出人纤维蛋白原(fibrinogen)的分子结构的图,(c)为示出人纤维蛋白原与人层粘连蛋白α5β1γ1的整联蛋白结合区域的嵌合蛋白(嵌合体-511(chimera-511))的分子结构的图。
[0035]
图2为示出将经纯化的lm511e8及嵌合体-511供于sds-page进行分析的结果的图,左侧为非还原条件下的结果,右侧为还原条件下的结果。
[0036]
图3为示出lm511e8及嵌合体-511的整联蛋白结合分析的结果的图。
[0037]
图4为示出经凝血酶处理的lm511e8及嵌合体-511的纤维蛋白原结合分析的结果的图。
[0038]
图5为示出在使用整合有嵌合体-511的纤维蛋白凝胶的人ips细胞的包埋培养中向培养基中添加氨甲环酸时(上段)和不添加氨甲环酸(下段)的比较结果的图,为示出培养第7天的代表性孔的观察图像的图。
[0039]
图6为示出在使用整合有嵌合体-511的纤维蛋白凝胶的人ips细胞的包埋培养中研究嵌合体-511的添加浓度依赖性的结果的图,为示出各浓度的培养第7天的代表性孔的观察图像的图。
[0040]
图7为示出在使用整合有嵌合体-511的纤维蛋白凝胶的人ips细胞的包埋培养中研究嵌合体-511的添加浓度依赖性的结果的图,为示出培养第8天从各孔回收的总细胞数、活细胞数、死细胞数及存活率的图。
[0041]
图8为示出在使用整合有嵌合体-511的纤维蛋白凝胶的人ips细胞的包埋培养中,将嵌合体-511的终浓度设为50nm并观察至培养第8天为止的经时变化的结果的图,为示出
各观察日的代表性孔的观察图像的图(上段)。下段为示出使用不添加嵌合体-511的纤维蛋白凝胶培养人ips细胞的结果的图。
[0042]
图9为示出在使用纤维蛋白凝胶的人ips细胞的包埋培养中,使用添加了终浓度50nm的嵌合体-511的纤维蛋白凝胶的情况(a)与使用添加了终浓度100nm的lm511e8的纤维蛋白凝胶的情况(b)的比较结果的图,为示出两组的培养第8天的代表性孔的观察图像的图。
[0043]
图10为示出对使用整合有嵌合体-511的纤维蛋白凝胶的细胞培养后的人ips细胞的未分化性进行研究的结果的图,为回收培养第7天的细胞并且将未分化标志物用抗体染色、进行流式细胞术分析的结果,(a)为ssea4的结果,(b)为oct3/4的结果,(c)为rbc2lcn的结果,各上段为用作对照的经二维维持培养的人ips细胞的结果,各下段为使用纤维蛋白凝胶进行三维包埋培养的人ips细胞的结果。
[0044]
图11为示出嵌合体-511p的整联蛋白结合分析的结果的图。
[0045]
图12为示出经凝血酶处理的嵌合体-511p的纤维蛋白原结合分析的结果的图。
[0046]
图13为示出在使用纤维蛋白凝胶的人ips细胞的包埋培养中,对(a)使用无添加的纤维蛋白凝胶(fibrin only)培养细胞的情况与(b)使用添加了终浓度50nm的嵌合体-511p的纤维蛋白凝胶培养细胞的情况进行比较的结果的图,为示出培养第8天的代表性孔的观察图像的图。左侧为孔的图像、右侧为左侧的框内的放大图像。
[0047]
图14为示出通过非还原条件的sds-page和使用his标签抗体的蛋白免疫印迹分析培养上清中的嵌合蛋白的表达的结果的图。
[0048]
图15为示出将经纯化的(a)嵌合体-111、(b)嵌合体-221、(c)嵌合体-332、(d)嵌合体-411、(e)嵌合体-421分别供于sds-page进行分析而得的结果的图,左侧为非还原条件下的结果,右侧为还原条件下的结果。
[0049]
图16为示出经凝血酶处理的(a)嵌合体-111、(b)嵌合体-221、(c)嵌合体-332、(d)嵌合体-421的纤维蛋白原结合分析的结果的图。
[0050]
图17为示出使经凝血酶处理的(a)嵌合体-111、(b)嵌合体-221、(c)嵌合体-332、(d)嵌合体-421与纤维蛋白原结合、对于结合后的各嵌合蛋白进行整联蛋白结合分析的结果的图。
[0051]
图18为示出通过非还原条件的sds-page和使用了his标签抗体的蛋白免疫印迹分析培养上清中的串珠蛋白聚糖附加型的嵌合蛋白的表达而得到的结果的图。
[0052]
图19为示出将经纯化的(a)嵌合体-111p、(b)嵌合体-221p、(c)嵌合体-332p、(d)嵌合体-421p、(e)嵌合体-511p分别供于sds-page进行分析而得到的结果的图,左侧为非还原条件下的结果,右侧为还原条件下的结果。
[0053]
图20为示出使经凝血酶处理的(a)嵌合体-111p、(b)嵌合体-221p、(c)嵌合体-332p、(d)嵌合体-421p与纤维蛋白原结合、对于结合后的各嵌合蛋白进行整联蛋白结合分析的结果的图。
[0054]
图21为示出经纯化的(a)嵌合体-111p、(b)嵌合体-221p、(c)嵌合体-332p、(d)嵌合体-421p、(e)嵌合体-511p的激活蛋白原(pro-activin)a的结合分析的结果的图。
[0055]
图22为示出通过非还原条件的sds-page和使用his标签抗体的蛋白免疫印迹分析培养上清中的嵌合蛋白(组合(combination)-1、组合-2、组合-3)的表达而得的结果的图。
具体实施方式
[0056]
[嵌合蛋白]
[0057]
本发明提供含有纤维蛋白原片段与层粘连蛋白片段的嵌合蛋白(以下记作“本发明的嵌合蛋白”)。纤维蛋白原片段只要为能够通过凝血酶处理与纤维蛋白原结合的纤维蛋白原片段即可,层粘连蛋白片段只要为具有整联蛋白结合活性的层粘连蛋白片段即可。即,本发明的嵌合蛋白为兼具能够通过凝血酶处理与纤维蛋白原结合的能力和整联蛋白结合活性的嵌合蛋白。本发明的嵌合蛋白可以为还包含其它蛋白质或其它蛋白质的功能结构域的嵌合蛋白。作为其它蛋白质,可以为含有具有生长因子结合活性的蛋白质的嵌合蛋白。
[0058]
纤维蛋白原在血液凝固反应的最终阶段利用凝血酶的作用转变为纤维蛋白,为参与血液凝固、止血、血栓形成、创伤愈合、炎症、血管新生、细胞与胞外基质间的相互作用等的糖蛋白。纤维蛋白原的基本结构为:aα链、bβ链及γ链这3条亚单元链以卷曲螺旋结构缔合成异三聚体分子,该异三聚体2分子在n末端侧缔合成六聚体(aα-bβ-γ)2。aα链、bβ链、γ链的质量数分别为67kda、56kda、47.5kda,六聚体(aα-bβ-γ)2的质量数为340kda。纤维蛋白原的aα链的arg16与gly17之间以及bβ链的arg14与gly15间被凝血酶切断,分别生成a杵(a knob)及b杵(b knob),转化为纤维蛋白单体。a杵及b杵分别与纤维蛋白原(纤维蛋白)的γ链c末端区域的a臼(a-hole)及β链c末端区域的b臼(b-hole)结合。因此,能够通过凝血酶处理与纤维蛋白原结合的纤维蛋白原片段为包含纤维蛋白原的n末端的a杵及b杵、且形成aα-bβ-γ的异三聚体的片段。
[0059]
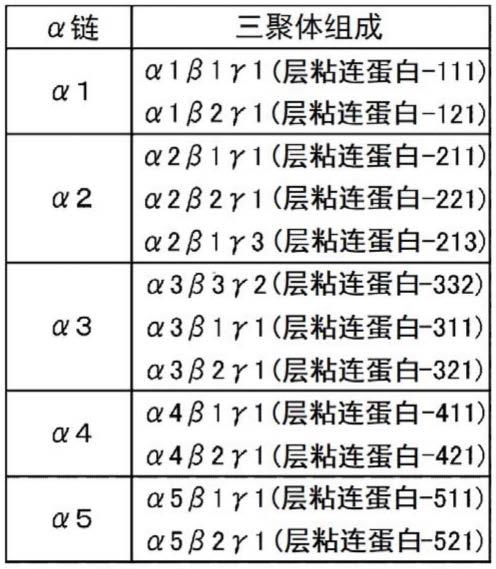
层粘连蛋白为基底膜的主要的细胞粘附分子,为由α链、β链及γ链这3条亚单元链形成的异三聚体,是分子量约80万的巨大的糖蛋白。3条亚单元链以c末端侧缔合而形成卷曲螺旋结构,形成通过二硫键而稳定化的异三聚体分子。已知α链为α1~α5这5种、β链为β1~β3这3种、γ链为γ1~γ3这3种,通过它们的组合而存在至少12种以上的异形体(参照表1)。构成本发明的嵌合蛋白的层粘连蛋白片段可以为任一异形体。即,构成本发明的嵌合蛋白的层粘连蛋白可以由选自α1~α5中的1种α链、选自β1~β3中的1种β链、选自γ1~γ3中的1种γ链构成。具体而言,可以适宜使用表1中记载的12种及这些以外的所有的异形体。
[0060]
[表1]
[0061][0062]
本发明人们已经阐明,至少α链c末端侧的3个球状结构域(lg1-3)和γ链c末端区域参与层粘连蛋白的整联蛋白结合活性的表现。因此,具有整联蛋白结合活性的层粘连蛋白片段优选为:包含层粘连蛋白的α链c末端侧的lg1-3和γ链c末端区域、并且这些与β链的c末端区域一起形成异三聚体的层粘连蛋白片段。
[0063]
本发明的嵌合蛋白可以含有具有生长因子结合活性的蛋白质。具有生长因子结合活性的蛋白质只要为能够与参与细胞增殖的生长因子结合的蛋白质即可,没有特别限定。作为具有生长因子结合活性的蛋白质,可列举例如硫酸乙酰肝素蛋白聚糖。作为硫酸乙酰肝素蛋白聚糖,可列举例如串珠蛋白聚糖、突触蛋白聚糖、xviii型胶原蛋白、黏结蛋白聚糖1~4、磷脂酰肌醇蛋白聚糖1~6等。另外,作为硫酸乙酰肝素蛋白聚糖以外的生长因子结合分子,可列举例如潜在tgf-β结合蛋白(latent tgf-βbinding protein)1~4等。这些分子可以是其全长,也可以是具有生长因子结合活性的片段。作为硫酸乙酰肝素蛋白聚糖的具有生长因子结合活性的片段,可列举例如串珠蛋白聚糖的结构域1、突触蛋白聚糖的含有卵泡抑制素结构域的第1位至第8位的区域等。
[0064]
构成本发明的嵌合蛋白的各蛋白质(纤维蛋白原片段、层粘连蛋白片段及具有生长因子结合活性的蛋白质,以下有时记作“嵌合构成蛋白”)可以是任意生物的蛋白质,没有特别限定。嵌合构成蛋白可以为哺乳动物的蛋白质。作为哺乳动物,可列举例如人、小鼠、大鼠、牛、猪等,没有限定。嵌合构成蛋白可以为将不同生物的蛋白质组合而成的嵌合蛋白,但优选为将相同生物的蛋白质组合而成的嵌合蛋白。另外,将本发明的嵌合蛋白用于人类的医疗时,嵌合构成蛋白优选为人的蛋白质。另外,嵌合构成蛋白可以为天然型,也可以为以维持必要的生物学活性的状态对1个或1个以上氨基酸残基进行了修饰的修饰型。
[0065]
本发明的嵌合蛋白可以是各嵌合构成蛋白直接连接的形态,也可以是借助间隔肽、接头连接的形态。本发明的嵌合蛋白除了各构成蛋白以外还可以含有例如his标签、ha标签、flag标签等亲和标签。另外,本发明的嵌合蛋白可以用公知的蛋白标记物质进行了标
记。
[0066]
本发明的嵌合蛋白可以通过适当使用公知的基因重组技术以重组嵌合蛋白形式来制造。主要的编码哺乳动物的纤维蛋白原的基因的碱基序列信息及氨基酸序列信息、主要的编码哺乳动物的层粘连蛋白的基因的碱基序列信息及氨基酸序列信息、以及主要的编码哺乳动物的具有生长因子结合活性的蛋白质的基因的碱基序列信息及氨基酸序列信息可以由ncbi等公知的数据库取得。表2示出编码构成人层粘连蛋白的各链的基因的碱基序列及氨基酸序列的登录号,表3示出编码构成人纤维蛋白原的各链的基因的碱基序列及氨基酸序列的登录号,表4示出编码人的具有生长因子结合活性的蛋白质的基因的碱基序列及氨基酸序列的登录号。
[0067]
[表2]
[0068] 氨基酸序列碱基序列人层粘连蛋白α1链np_005550nm_005559人层粘连蛋白α2链np_000417nm_000426人层粘连蛋白α3链np_000218nm_000227人层粘连蛋白α4链np_002281nm_002290人层粘连蛋白α5链np_005551nm_005560人层粘连蛋白β1链np_002282nm_002291人层粘连蛋白β2链np_002283nm_002292人层粘连蛋白β3链np_000219nm_000228人层粘连蛋白γ1链np_002284nm_002293人层粘连蛋白γ2链np_005553nm_005562人层粘连蛋白γ3链np_006050nm_006059
[0069]
[表3]
[0070] 氨基酸序列碱基序列人纤维蛋白原α链np_068657nm_021871人纤维蛋白原β链np_005132nm_005141人纤维蛋白原γ链np_000500nm_000509
[0071]
[表4]
[0072] 氨基酸序列碱基序列人串珠蛋白聚糖np_005520nm_005529人突触蛋白聚糖np_940978nm_198576人xviii型胶原蛋白α1链np_085059nm_030582人黏结蛋白聚糖1np_001006947nm_001006946人黏结蛋白聚糖2np_002989nm_002998人黏结蛋白聚糖3np_055469nm_014654人黏结蛋白聚糖4np_002990nm_002999人磷脂酰肌醇蛋白聚糖1np_002072nm_002081人磷脂酰肌醇蛋白聚糖2np_689955nm_152742
人磷脂酰肌醇蛋白聚糖3np_001158089nm_001164617人磷脂酰肌醇蛋白聚糖4np_001439nm_001448人磷脂酰肌醇蛋白聚糖5np_004457nm_004466人磷脂酰肌醇蛋白聚糖6np_005699nm_005708人潜在tgf-β结合蛋白1np_996826nm_206943人潜在tgf-β结合蛋白2np_000419nm_000428人潜在tgf-β结合蛋白3np_001123616nm_001130144人潜在tgf-β结合蛋白4np_001036009nm_001042544
[0073]
纤维蛋白原片段与层粘连蛋白片段的嵌合蛋白可以以使包含纤维蛋白原的n末端而形成异三聚体的片段与包含层粘连蛋白的c末端而形成异三聚体的层粘连蛋白片段连接的方式来制造。嵌合蛋白只要兼具能够通过凝血酶处理与纤维蛋白原结合的能力和整联蛋白结合活性,则包含纤维蛋白原的n末端而形成异三聚体的片段与包含层粘连蛋白的c末端而形成异三聚体的层粘连蛋白片段可以为任意连接的状态。具体而言,纤维蛋白原的aα链、bβ链及γ链与层粘连蛋白的α链、β链及γ链可以以任意组合进行连接。优选将纤维蛋白原的aα链与层粘连蛋白的β链、纤维蛋白原的bβ链与层粘连蛋白的α链、纤维蛋白原的γ链与层粘连蛋白的γ链连接的形态;将纤维蛋白原的aα链与层粘连蛋白的γ链、纤维蛋白原的bβ链与层粘连蛋白的β链、纤维蛋白原的γ链与层粘连蛋白的α链连接的形态;将纤维蛋白原的aα链与层粘连蛋白的α链、纤维蛋白原的bβ链与层粘连蛋白的γ链、纤维蛋白原的γ链与层粘连蛋白的β链连接的形态。对于嵌合蛋白的各链的全长、各链中的纤维蛋白原链与层粘连蛋白链的长度比率等也没有特别限定,可以在能够表现上述2种功能的范围内任意设定。
[0074]
纤维蛋白原片段与层粘连蛋白片段的重组嵌合蛋白例如可以按照以下方式制造。即,将编码纤维蛋白原的1条链的dna的一部分与编码和其进行连接的层粘连蛋白的1条链的dna的一部分连接,制作3种嵌合dna。然后,将这3种嵌合dna分别插入到适当的表达载体中,制作3种表达载体。将这3种表达载体共导入到适当的宿主细胞中并使其表达,用公知的方法对形成了三聚体的蛋白质进行纯化,由此可以进行制造。
[0075]
还含有具有生长因子结合活性的蛋白质的嵌合蛋白可以通过使具有生长因子结合活性的蛋白质与层粘连蛋白片段中的至少任意1条链的c末端连接的形态来制造。例如使具有生长因子结合活性的蛋白质与层粘连蛋白片段的α链的c末端连接时,通过将编码还具有生长因子结合活性的蛋白质的dna与前述的3种嵌合dna中含有编码层粘连蛋白α链的dna的嵌合dna连接,从而制作纤维蛋白原的1条链与层粘连蛋白的1条链与具有生长因子结合活性的蛋白质的嵌合dna。将该嵌合dna插入到适当的表达载体中,与其余2种表达载体一起共导入到适当的宿主细胞中并使其表达,用公知的方法对形成了三聚体的蛋白质进行纯化,由此可以进行制造。
[0076]
[凝胶、凝胶的制造方法、凝胶制备用组合物、凝胶制备用试剂盒]
[0077]
本发明提供由上述本发明的嵌合蛋白的凝血酶处理分子和纤维蛋白形成的凝胶(以下记作“本发明的凝胶”)。另外,本发明提供本发明的凝胶的制造方法(以下记作“本发明的制造方法”)。本发明的制造方法只要包括制备本发明的嵌合蛋白、纤维蛋白原和凝血酶的混合物的步骤即可。如上所述,使凝血酶作用于本发明的嵌合蛋白及纤维蛋白原时,纤维蛋白原的aα链及bβ链的n末端被切断,分别生成a杵及b杵,与纤维蛋白原的γ链c末端区
域的a臼及β链c末端区域的b臼结合,由此形成整合有本发明的嵌合蛋白的纤维蛋白凝胶。
[0078]
纤维蛋白原可以是由任何生物得到的,优选由与构成本发明的嵌合蛋白的各蛋白质相同的生物得到。凝血酶也可以是由任何生物得到的,优选由与构成本发明的嵌合蛋白的各蛋白质及纤维蛋白原相同的生物得到。嵌合蛋白和纤维蛋白原和凝血酶均优选由人得到。另外,本发明的嵌合蛋白优选为含有具有生长因子结合活性的蛋白质的嵌合蛋白。
[0079]
具体而言,本发明的制造方法可以通过制备本发明的嵌合蛋白溶液、纤维蛋白原溶液及凝血酶溶液的混合物来实施。可以分别以各自的溶液(3种溶液)形式制备混合物,也可以由嵌合蛋白与纤维蛋白原的混合溶液和凝血酶溶液这两种溶液来制备混合物,也可以由嵌合蛋白与凝血酶的混合溶液和纤维蛋白原溶液这两种溶液来制备混合物。溶剂优选使用生理溶液,例如可以适宜地使用生理盐水、生理缓冲液、细胞培养用培养基等。嵌合蛋白、纤维蛋白原与凝血酶的混合物中可以含有第xiii因子、抑肽酶、血清白蛋白、甘氨酸、l-精氨酸盐酸盐、l-异亮氨酸、l-谷氨酸钠、d-甘露醇、柠檬酸钠水合物、氯化钠等。
[0080]
本发明的凝胶中优选含有作为纤维蛋白稳定剂的氨甲环酸、ε-氨基己酸等赖氨酸类似物。因此,本发明的制造方法可以包括制备本发明的嵌合蛋白、纤维蛋白原、凝血酶及赖氨酸类似物(氨甲环酸或ε-氨基己酸)的混合物的步骤。另外,在本发明的凝胶中培养细胞或组织片时,优选进一步添加细胞悬浮液或组织片悬浮液而制备混合物。
[0081]
本发明的制造方法中,混合物中的嵌合蛋白与纤维蛋白原的摩尔比优选为1:5~1:20000。混合物中的嵌合蛋白的浓度没有特别限定,可以为0.5nm~1000nm。混合物中的嵌合蛋白的浓度可以为1nm以上、1.5nm以上、2nm以上、3nm以上、5nm以上、10nm以上、20nm以上、30nm以上、50nm以上、70nm以上、100nm以上,可以为900nm以下、800nm以下、700nm以下、600nm以下、500nm以下、400nm以下。
[0082]
混合物中的纤维蛋白原浓度没有特别限定,可以为0.1mg/ml~50mg/ml。混合物中的纤维蛋白原浓度可以为0.5mg/ml以上、1.0mg/ml以上、1.5mg/ml以上、2mg/ml以上、2.5mg/ml以上、3mg/ml以上、5mg/ml以上、7mg/ml以上、10mg/ml以上、15mg/ml以上、20mg/ml以上、25mg/ml以上,可以为45mg/ml以下、40mg/ml以下、35mg/ml以下、30mg/ml以下。通过调整混合物中的纤维蛋白原浓度,可以调整凝胶的柔软性。即,若提高混合物中的纤维蛋白原浓度则可以制备硬的凝胶,若降低混合物中的纤维蛋白原浓度则可以制备柔软的凝胶。因此,优选根据使用目的调整凝胶的柔软性。
[0083]
混合物中的凝血酶浓度没有特别限定,可以根据纤维蛋白原浓度适当选择。例如,混合物中的凝血酶浓度可以为0.01nih单位/ml~250nih单位/ml。混合物中的凝血酶浓度可以为0.05nih单位/ml以上、0.1nih单位/ml以上、0.5nih单位/ml以上、1nih单位/ml以上、2nih单位/ml以上、3nih单位/ml以上、5nih单位/ml以上、7nih单位/ml以上、10nih单位/ml以上,可以为200nih单位/ml以下、150nih单位/ml以下、125nih单位/ml以下、100nih单位/ml以下、70nih单位/ml以下、50nih单位/ml以下。
[0084]
本发明的凝胶可以在凝胶形成后进行冷冻干燥、从而以冷冻干燥凝胶形式实施。冷冻干燥凝胶可以在使用时用生理溶液、细胞培养液溶胀后使用。另外,使用时,可以在悬浮有细胞或组织片的培养液中溶胀。另外,本发明的凝胶可以以与其它培养用凝胶基材的混合凝胶形式实施。
[0085]
本发明提供含有本发明的嵌合蛋白和纤维蛋白原的凝胶制备用组合物(以下记作“本发明的组合物”)。本发明的组合物可以以溶液或将溶液冷冻干燥而得到的冷冻干燥物的方式实施。本发明的组合物中可以含有第xiii因子、抑肽酶、氨甲环酸、ε-氨基己酸、血清白蛋白、甘氨酸、l-精氨酸盐酸盐、l-异亮氨酸、l-谷氨酸钠、d-甘露醇、柠檬酸钠水合物、氯化钠等。本发明的组合物中的嵌合蛋白与纤维蛋白原的优选摩尔比、优选浓度如本发明的制造方法的说明所记载。
[0086]
通过向本发明的组合物溶液中添加凝血酶溶液并进行混合,可以制造本发明的凝胶。因此,本发明的组合物可以以本发明的凝胶制备用的制品形式实施。
[0087]
本发明提供用于制备本发明的凝胶的试剂盒(以下记作“本发明的试剂盒”)。本发明的试剂盒只要含有本发明的嵌合蛋白、纤维蛋白原及凝血酶即可。具体而言,可以以含有嵌合蛋白、纤维蛋白原及凝血酶的各溶液、或各溶液的冷冻干燥物的试剂盒形式实施。嵌合蛋白、纤维蛋白原及凝血酶的各溶液可以以3溶液形式实施,也可以以2溶液形式实施。作为本发明的试剂盒的构成品,可以适宜地使用上述本发明的组合物。本发明的试剂盒以冷冻干燥物形式含有嵌合蛋白、纤维蛋白原及凝血酶的各溶液时,优选含有各冷冻干燥物的溶解液。进而,本发明的试剂盒可以含有凝胶制备用管、使用说明书等。
[0088]
[本发明的凝胶的用途]
[0089]
本发明的凝胶可以用于细胞或组织片的三维培养。即,本发明提供使用上述本发明的凝胶的、细胞或组织片的三维培养方法(以下记作“本发明的三维培养方法”)。本发明的三维培养方法只要是能够使用本发明的凝胶来三维培养细胞或组织片的方式,则可以使用任何培养容器、培养条件来实施。本发明的三维培养方法例如可以如下实施:向细胞培养板的孔内添加含有细胞或组织片的凝胶,进而添加细胞培养液,在常规培养条件下进行培养。另外,本发明的三维培养方法例如可以通过向细胞培养板的孔内的凝胶上添加悬浮于培养液的细胞或组织片并在常规培养条件下进行培养。
[0090]
三维培养中使用的细胞或组织片没有特别限定,只要能够使用本发明的凝胶进行三维培养,则可以为任何生物的细胞或组织片。优选为哺乳动物的细胞或组织片。作为哺乳动物,可列举人、小鼠、大鼠、牛、猪等。其中,优选为人。
[0091]
细胞可以为原代细胞,也可以为株化细胞。另外,细胞可以为体细胞,也可以为干细胞。干细胞包括体性干细胞、多能干细胞等。作为体性干细胞,可列举神经干细胞、间充质干细胞、造血干细胞、心脏干细胞、肝脏干细胞、小肠干细胞等。作为多能干细胞,可列举胚胎干细胞(es细胞)、诱导多能干细胞(ips细胞)、通过核移植得到的克隆胚来源的胚胎干细胞(ntes细胞)、精子干细胞(gs细胞)、胚胎生殖细胞(eg细胞)、源自培养成纤维细胞或骨髓干细胞的多能性细胞(muse细胞)等。
[0092]
组织片可以是源自正常组织,也可以源自肿瘤组织。特别是利用本发明的凝胶培养从人肿瘤组织片分离出的肿瘤细胞而得的肿瘤类器官,认为高度反映了人活体内的癌细胞的性质,在进行癌细胞对化学疗法、免疫疗法、放射线疗法等癌症治疗方法的敏感性的预测、抗癌剂的筛选、其它癌症研究中有用。
[0093]
本发明的三维培养方法中,构成本发明的嵌合蛋白的层粘连蛋白的异形体优选根据要培养的细胞或组织片选择最佳的异形体。关于细胞的种类与层粘连蛋白异形体的适合性,可以从现有技术文献中容易地找到(masashi yamada and kiyotoshi sekiguchi,molecular basis of laminin-integrin interactions,current topics in membranes,
76:197-229,2015;lynn yap,et al.laminins in cellular differentiation,trends in cell biology,29:987-1000,2019)。另外,关于凝胶的软硬度,也优选根据细胞或组织片而选择最佳的软硬度。
[0094]
使用本发明的三维培养方法得到的细胞或类器官可以用于移植医疗用途。即,本发明提供使用上述本发明的三维培养方法制造用于移植医疗的细胞或类器官的方法。特别是使用利用由人蛋白质构成的本发明的嵌合蛋白、人纤维蛋白原、人凝血酶制造的本发明的凝胶的本发明的三维培养方法满足从培养系统排除了异源成分的无异源物质(xeno-free)条件,因此在该条件下培养人细胞而得到的细胞或类器官可以适宜地用于人的移植医疗用途。
[0095]
作为移植医疗中使用的三维培养细胞,可列举心肌细胞、血管内皮细胞、脂肪细胞、成纤维细胞、成肌细胞、肝脏细胞、胰腺细胞、肠上皮细胞、肺泡上皮细胞、气道上皮细胞、肾脏细胞、造血细胞、免疫细胞、神经细胞、眼组织细胞、表皮细胞等。这些移植医疗用细胞可以是使用本发明的凝胶由干细胞诱导得到的细胞。
[0096]
作为移植医疗中使用的类器官,可列举例如肾脏、肝脏、消化管(胃、肠、食道等)、肺/气管、大脑、血管等器官。例如,肾脏可以通过在记载于takasato等(nat protoc 11:1681-1692,2016)中的制造方法中将三维凝胶基材变更为本发明的凝胶来实施。例如,肝脏和肠可以通过在分别记载于takebe等(cell rep 21:2661-2670,2017)和sato等(nature 459:262-265,2009)中的制造方法中将三维凝胶基材变更为本发明的凝胶来实施。例如,肺和气道可以通过在分别记载于yamamoto等(nature methods 14:1097-1109,2017)和rock等(proc natl acad sci usa 106:12771-12775,2009)中的制造方法中将三维凝胶基材变更为本发明的凝胶来实施。
[0097]
在对细胞、组织、类器官等进行生物体移植时,可以使用本发明的凝胶来保护移植部位。例如可以将要移植的细胞、组织、类器官等用本发明的凝胶包埋并埋入移植部位,也可以在移植细胞、组织、类器官等之后在移植部位的周边重叠本发明的凝胶。
[0098]
实施例
[0099]
以下通过实施例详细说明本发明,但是本发明不受这些限定。
[0100]
[实施例1:人纤维蛋白原-人层粘连蛋白511嵌合分子的制作、纯化及活性评价]
[0101]
(1)人层粘连蛋白511e8片段的表达载体的构建
[0102]
首先,以pcdna3.4-topo(thermo fisher scientific)为模板,按照泷泽等的方法(mamoru takizawa et al.,sci.adv.,2017;3:e1701497)构建插入了源自psectag2b的多克隆位点的表达载体(以下记作“pcdna3.4+mcs”)。将分别编码人层粘连蛋白α5e8(ala
2534-ala
3327
、从n末端侧起依次含有小鼠ig-κ链v-j2-c信号肽和6
×
his标签)、人层粘连蛋白β1e8(leu
1561-leu
1786
、从n末端侧起依次含有小鼠ig-κ链v-j2-c信号肽和ha标签)、人层粘连蛋白γ1e8(asn
1362-pro
1609
、从n末端侧起依次含有小鼠ig-κ链v-j2-c信号肽和flag标签)的dna片段用限制酶nhei和noti切出并插入到pcdna3.4+mcs的该限制酶位点,由此构建人层粘连蛋白α5链片段lmα5(ala
2534-ala
3327
)、人层粘连蛋白β1链片段lmβ1(leu
1561-leu
1786
)及人层粘连蛋白γ1链片段lmγ1(asn
1362-pro
1609
)的各表达载体。
[0103]
(2)人纤维蛋白原上连接有人层粘连蛋白511的整联蛋白结合区域的嵌合蛋白表达载体的构建
[0104]
作为人纤维蛋白原上连接有人层粘连蛋白511的整联蛋白结合区域的嵌合蛋白(以下记作“嵌合体-511”),构建插入了编码人纤维蛋白原α链(以下记作“fbgα(met
1-pro
644
)”)、人纤维蛋白原β链(以下记作“fbgβ(met
1-gln
491
)”)及人纤维蛋白原γ链(以下记作“fbgγ(met
1-val
437
)”)的dna片段的表达载体后,构建小鼠ig-κ链v-j2-c信号肽/fbgβ(gln
31-asn
194
)/lmα5(ile
2716-ala
3310
)(以下记作“嵌合体-α5”)、小鼠ig-κ链v-j2-c信号肽/fbgα(ala
20-his
151
)/lmβ1(leu
1761-leu
1786
)(以下记作“嵌合体-β1”)及小鼠ig-κ链v-j2-c信号肽/fbgγ(tyr
27-ser
132
)/lmγ1(ile
1579-pro
1609
)(以下记作“嵌合体-γ1”)。
[0105]
(2-1)人纤维蛋白原表达载体的构建
[0106]
首先,以人肝脏总rna(clontech、636531)为模板,使用第一链cdna合成试剂盒revertra ace-α-(东洋纺、fsk-101)按照附带的规程如下所述地制备人肝脏来源cdna文库。将19μl的预混液(master mix)(无rnase的h2o 10μl、5
×
rt缓冲液4μl、10mm dntp混合物2μl、10u/μl rnase抑制剂1μl、10pmol/μl寡聚(dt)20 1μl、revertra ace 1μl)和1μg/μl人肝脏总rna 1μl混合,进行逆转录反应(在42℃下孵育20分钟后,在99℃下孵育5分钟)。
[0107]
然后,以人肝脏来源cdna文库为模板,使用以下引物组进行pcr,扩增分别编码fbgα(met
1-pro
644
)、fbgβ(met
1-gln
491
)及fbgγ(met
1-val
437
)的dna片段。将扩增出的各dna片段用限制酶nhei和noti消化并分别插入到pcdna3.4+mcs的该限制酶位点,由此构建fbgα(met
1-pro
644
)、fbgβ(met
1-gln
491
)及fbgγ(met
1-val
437
)的各表达载体。
[0108]
(i)fbgα(met
1-pro
644
)扩增用引物组
[0109]5’‑
gggagacccaagctggctagccaccatgttttccatgaggatcgtctgcc-3’(正向、序列号1)
[0110]5’‑
tcctcgagcggccgccgatctagggggacagggaagg-3’(反向、序列号2)
[0111]
(ii)fbgβ(met
1-gln
491
)扩增用引物组
[0112]5’‑
tagggagacccaagctggctagccaccatgaaaaggatggtttcttggagcttcc-3’(正向、序列号3)
[0113]5’‑
cctcctcgagcggccgcgatctattgctgtgggaagaagg-3’(反向、序列号4)
[0114]
(iii)fbgγ(met
1-val
437
)扩增用引物组
[0115]5’‑
acccaagctggctagccaccatgagttggtccttgcacccccg-3’(正向、序列号5)
[0116]5’‑
ccctcctcgagcggccgcgatttaaacgtctccagcctgtttgg-3’(反向、序列号6)
[0117]
(2-2)在c末端添加了10
×
his标签的lmα5(ala
2534-ala
3310
)的表达载体的构建
[0118]
以lmα5(ala
2534-ala
3327
)的表达载体为模板,使用以下引物组进行pcr,扩增5’侧片段和3’侧片段。需要说明的是,在(iv)的反向引物的5’侧和(v)的正向引物的5’侧添加了用于延伸pcr的序列。
[0119]
(iv)5’侧片段扩增用引物组
[0120]5’‑
agcctgcgatggctcttccccaccggaggctcag-3’(正向、序列号7)
[0121]5’‑
gtgatggtgatggtgatggtgatggtgatgggcctgcagtc-3’(反向、序列号8)
[0122]
(v)3’侧片段扩增用引物组
[0123]5’‑
aggcccatcaccatcaccatcaccatcaccatcactagatccagcac-3’(正向、序列号9)
[0124]5’‑
gatcgaacccttgatggctggcaactagaaggcacagtcgaggctg-3’(反向、序列号10)
[0125]
对于得到的2种dna片段,通过使用以下引物组的延伸pcr进行连接、扩增。将扩增
出的dna片段用限制酶asci和noti消化并插入到lmα5(ala
2534-ala
3327
)的表达载体的该限制酶位点,由此构建在c末端部添加了10
×
his标签的lmα5(ala
2534-ala
3310
)(以下记作“lmα5(ala
2534-ala
3310
)/10
×
his”)的表达载体。
[0126]
(vi)lmα5(ala
2534-ala
3310
)/10
×
his连接
·
扩增用引物组
[0127]5’‑
agcctgcgatggctcttccccaccggaggctcag-3’(正向、序列号7)
[0128]5’‑
gatcgaacccttgatggctggcaactagaaggcacagtcgaggctg-3’(反向、序列号10)
[0129]
(2-3)嵌合体-α5、嵌合体-β1及嵌合体-γ1表达载体的构建
[0130]
以人纤维蛋白原各链的表达载体为模板,使用以下引物组进行pcr,扩增编码fbgα(met
1-his
151
)、fbgβ(met
1-asn
194
)或fbgγ(met
1-ser
132
)的dna片段。需要说明的是,在各引物组的反向引物的5’侧添加了用于延伸pcr的序列。
[0131]
(vii)fbgα(met
1-his
151
)扩增用引物组
[0132]5’‑
agctcgtttagtgaaccgtcagatcgcctggagacgc-3’(正向、序列号11)
[0133]5’‑
gaacggacttctccttccagtcttgctaaatgctgtactttttctatgactttgcgc-3’(反向、序列号12)
[0134]
(viii)fbgβ(met
1-asn
194
)侧扩增用引物组
[0135]5’‑
agctcgtttagtgaaccgtcagatcgcctggagacgc-3’(正向、序列号11)
[0136]5’‑
gctctcgcacgcggccaatgttagttgggatattgctattc-3’(反向、序列号13)
[0137]
(ix)fbgγ(met
1-ser
132
)扩增用引物组
[0138]5’‑
agctcgtttagtgaaccgtcagatcgcctggagacgc-3’(正向、序列号11)
[0139]5’‑
gcgaatgtccttcatgatctcctcgatacttgagtcatgtgttaaaatcgatg-3’(反向、序列号14)
[0140]
然后,以lmα5(ala
2534-ala
3310
)/10
×
his、lmβ1(leu
1561-leu
1786
)及lmγ1(asn
1362-pro
1609
)的表达载体为模板,使用以下引物组进行pcr,扩增编码lmα5(ile
2716-ala
3310
)/10
×
his、lmβ1(leu
1761-leu
1786
)或lmγ1(ile
1579-pro
1609
)的dna片段。需要说明的是,在各引物组的正向引物的5’侧添加了用于延伸pcr的序列。
[0141]
(x)lmα5(ile
2716-ala
3310
)/10
×
his扩增用引物组
[0142]5’‑
gaatagcaatatcccaactaacattggccgcgtgcgagagc-3’(正向、序列号15)
[0143]5’‑
ccttgatggctggcaactagaaggcacagtcgaggc-3’(反向、序列号16)
[0144]
(xi)lmβ1(leu
1761-leu
1786
)扩增用引物组
[0145]5’‑
gcgcaaagtcatagaaaaagtacagcatttagcaagactggaaggagaagtccgttc-3’(正向、序列号17)
[0146]5’‑
ccttgatggctggcaactagaaggcacagtcgaggc-3’(反向、序列号16)
[0147]
(xii)lmγ1(ile
1579-pro
1609
)扩增用引物组
[0148]5’‑
catcgattttaacacatgactcaagtatcgaggagatcatgaaggacattcgc-3’(正向、序列号18)
[0149]5’‑
ccttgatggctggcaactagaaggcacagtcgaggc-3’(反向、序列号16)
[0150]
使用以下引物组进行延伸pcr,将得到的6种片段与编码fbgα(met
1-his
151
)/lmβ1(leu
1761-leu
1786
)、fbgβ(met
1-asn
194
)/lmα5(ile
2716-ala
3310
)/10
×
his、或fbgγ(met
1-ser
132
)/lmγ1(ile
1579-pro
1609
)的dna片段连接、扩增。将扩增出的dna片段用限制酶nhei和
noti消化并插入到pcdna3.4+mcs的该限制酶位点。
[0151]
(xiii)各链连接
·
扩增用引物组
[0152]5’‑
agctcgtttagtgaaccgtcagatcgcctggagacgc-3’(正向、序列号11)
[0153]5’‑
ccttgatggctggcaactagaaggcacagtcgaggc-3’(反向、序列号16)
[0154]
接着,为了导入小鼠ig-κ链v-j2-c信号肽,以lmα5(ala
2534-ala
3327
)的表达载体为模板,使用以下引物进行pcr,扩增编码小鼠ig-κ链v-j2-c信号肽的dna片段。需要说明的是,在各引物组的反向引物的5’侧添加了用于延伸pcr的序列。
[0155]
(xiv)小鼠ig-κ链v-j2-c信号肽扩增用引物组(嵌合体-α5用)
[0156]5’‑
ctatataagcagagctcgtttagtgaaccgtcagatcgcctggagacgc-3’(正向、序列号19)
[0157]5’‑
cattgtcgttgacaccttggtcaccagtggaacctgg-3’(反向、序列号20)
[0158]
(xv)小鼠ig-κ链v-j2-c信号肽扩增用引物组(嵌合体-β1用)
[0159]5’‑
ctatataagcagagctcgtttagtgaaccgtcagatcgcctggagacgc-3’(正向、序列号19)
[0160]5’‑
caccttcaccactatctgcgtcaccagtggaacctgga-3’(反向、序列号21)
[0161]
(xvi)小鼠ig-κ链v-j2-c信号肽扩增用引物组(嵌合体-γ1用)
[0162]5’‑
ctatataagcagagctcgtttagtgaaccgtcagatcgcctggagacgc-3’(正向、序列号19)
[0163]5’‑
cagttgtctctggtagcaacatagtcaccagtggaacctggaaccc-3’(反向、序列号22)
[0164]
然后,以fbgα(met
1-his
151
)/lmβ1(leu
1761-leu
1786
)、fbgβ(met
1-asn
194
)/lmα5(ile
2716-ala
3310
)/10
×
his及fbgγ(met
1-ser
132
)/lmγ1(ile
1579-pro
1609
)的表达载体为模板,使用以下引物组进行pcr,扩增编码fbgβ(gln
31-asn
194
)/lmα5(ile
2716-ala
3310
)/10
×
his、fbgα(ala
20-his
151
)/lmβ1(leu
1761-leu
1786
)及fbgγ(tyr
27-ser
132
)/lmγ1(ile
1579-pro
1609
)的dna片段。需要说明的是,在各引物组的正向引物的5’侧添加了用于延伸pcr的序列。
[0165]
(xvii)fbgβ(gln
31-asn
194
)/lmα5(ile
2716-ala
3310
)/10
×
his扩增用引物组
[0166]5’‑
ccaggttccactggtgaccaaggtgtcaacgacaatg-3’(正向、序列号23)
[0167]5’‑
ccggtagggatcgaacccttgatggctggcaactagaag-3’(反向、序列号24)
[0168]
(xviii)fbgα(ala
20-his
151
)/lmβ1(leu
1761-leu
1786
)扩增用引物组
[0169]5’‑
tccaggttccactggtgacgcagatagtggtgaaggtg-3’(正向、序列号25)
[0170]5’‑
ccggtagggatcgaacccttgatggctggcaactagaag-3’(反向、序列号24)
[0171]
(xix)fbgγ(tyr
27-ser
132
)/lmγ1(ile
1579-pro
1609
)扩增用引物组
[0172]5’‑
gggttccaggttccactggtgactatgttgctaccagagacaactg-3’(正向、序列号26)
[0173]5’‑
ccggtagggatcgaacccttgatggctggcaactagaag-3’(反向、序列号24)
[0174]
对于用上述(xiv)~(xix)的引物组扩增出的6种dna片段,使用以下引物组进行延伸pcr而分别进行连接、扩增。将扩增出的dna片段用限制酶nhei和noti消化并插入到pcdna3.4+mcs的该限制酶位点,由此构建了嵌合体-α5、嵌合体-β1及嵌合体-γ1的各表达载体。
[0175]
(xx)各链连接
·
扩增用引物组
[0176]5’‑
ctatataagcagagctcgtttagtgaaccgtcagatcgcctggagacgc-3’(正向、序列号19)
[0177]5’‑
ccggtagggatcgaacccttgatggctggcaactagaag-3’(反向、序列号24)
[0178]
(3)人层粘连蛋白511e8片段及嵌合体-511的表达及纯化
[0179]
将构建的各链的表达载体导入到freestyle 293-f细胞(thermofisher scientific、以下记作“293-f细胞”)中,使其表达人层粘连蛋白511e8(以下记作“lm511e8”)及嵌合体-511。即,在lm511e8的情况下,将lmα5(ala
2534-ala
3327
)、lmβ1(leu
1561-leu
1786
)及lmγ1(asn
1362-pro
1609
)的各表达载体导入到293-f细胞中,在嵌合体-511的情况下,将嵌合体-α5、嵌合体-β1及嵌合体-γ1的各表达载体导入到293-f细胞中。使用转染试剂293fectin(thermo fisher scientific)及opti-mem(thermo fisher scientific),将各链表达载体各400μg同时转染于1.0
×
109个293-f细胞(1.0
×
106个细胞/ml),培养72小时后回收培养液。
[0180]
将回收的培养液以1000
×
g离心分离10分钟,将其上清进一步以15000
×
g离心分离30分钟,除去细胞及不溶物。向培养上清中添加10ml的complete his-tag纯化树脂(roche),孵育一夜使目标蛋白吸附。回收complete his-tag纯化树脂,用调节至ph 8.0的hepes缓冲盐水(含有20mm hepes及137mm nacl的缓冲生理盐水、以下记作“hbs”)清洗后,用含有250mm咪唑的hbs(ph 8.0)洗脱。洗脱级分利用a280的吸光度测定进行确认。
[0181]
将含有目标蛋白的洗脱级分用amicon ultra-15离心过滤装置(merck millipore)浓缩后,供于利用superose 6increase 10/300gl(ge healthcare)的凝胶过滤层析,使用hbs(ph 7.4)以流速0.5ml/分钟进行洗脱。洗脱级分中的目标蛋白量利用a280的吸光度及sds-page进行确认。将凝胶过滤层析后的纯化物用0.22μm的盘式针头过滤器(merck millipore、slgv033rs)灭菌后,在-80℃下保存。
[0182]
(4)lm511e8及嵌合体-511的sds-page分析
[0183]
将经纯化的lm511e8(参照图1(a))及嵌合体-511(参照图1(c))分别供于sds-page,比较电泳图案。在具有5%-20%的浓度梯度的聚丙烯酰胺凝胶(atto、#2331830)中,将lm511e8及嵌合体-511分别以1.2μg/孔上样,以20ma进行75分钟电泳。电泳按照laemmli法使用包含25mm tris、192mm甘氨酸、0.1%十二烷基硫酸钠的缓冲液在还原及非还原条件下进行。蛋白质的染色使用了quick-cbb(富士胶片和光纯药、#299-50101)。
[0184]
将结果示于图2。在非还原条件下,从lm511e8中出现了lmα5e8和lmβ1e8-lmγ1e8二聚体的2条条带,从嵌合体-511中仅出现了嵌合体-511六聚体的1条条带。在还原条件下,从lm511e8中出现了lmα5e8和lmγ1e8和lmβ1e8的3条条带,从嵌合体-511中出现了嵌合体-α5的条带以及嵌合体-β1及嵌合体-γ1的条带在相同位置重叠的1条条带。由该结果可以确认,得到了目标lm511e8和嵌合体-511。
[0185]
(5)整联蛋白结合分析
[0186]
(5-1)向板的涂布
[0187]
用hbs(ph 7.4)以终浓度为10nm的方式将lm511e8及嵌合体-511稀释后,以50μl/孔加入到96孔板(thermo fisher scientific、#442404)中,在4℃下一边缓慢振荡一晚一边进行涂布。
[0188]
(5-2)整联蛋白结合分析
[0189]
整联蛋白结合分析按照井户等的方法(hiroyuki ido et al.,j.biol.chem.,282,11144-11154,2007)实施。即,向如上所述地分别涂布了lm511e8及嵌合体-511的96孔板中,以200μl/孔加入向含有0.02%吐温20(富士胶片和光纯药、#167-11515)及137mm nacl的20mm tris缓冲液、ph7.4(以下记作“tbst”)中添加0.1%牛血清白蛋白(bsa;sigma-aldrich a7906)而成的溶液(以下记作“0.1% bsa/tbst”),清洗板。然后,以200μl/孔加入添加了1% bsa的tbst,一边在摇床(b.braun biotech international certomat mt)上振荡一边在室温下进行1小时封闭。用200μl/孔的0.1% bsa/tbst清洗1次。用含有1mm mncl2、或10mm edta的0.1% bsa/tbst稀释α6β1整联蛋白,以终浓度为0.001nm、0.003nm、0.01nm、0.03nm、0.1nm、0.3nm、1nm、3nm、10nm、30nm、100nm的方式制备α6β1整联蛋白溶液。向板中以50μl/孔加入α6β1整联蛋白溶液,在室温下一边在摇床上振荡一边反应3小时。
[0190]
用200μl/孔的1mm mncl2/0.1% bsa/tbst、或10mm edta/0.1%bsa/tbst清洗3次后,以50μl/孔加入用1mm mncl2/0.1% bsa/tbst稀释的1.5μg/ml的生物素标记velcro抗体(按照takagi,j.,erickson,h.p.and springer,t.a.(2001)nat.struct.biol.8,412-416的记载制作),在室温下一边在摇床上振荡一边反应30分钟。用200μl/孔的1mm mncl2/0.1% bsa/tbst清洗3次后,以50μl/孔加入用1mm mncl2/0.1%bsa/tbst稀释的0.53μg/ml的链霉亲和素-辣根过氧化物酶(thermo fisher scientific,#21126),在室温下一边在摇床上振荡一边反应15分钟。用200μl/孔的1mm mncl2/0.1% bsa/tbst清洗3次后,以50μl/孔加入用含有0.04% h2o2的25mm柠檬酸/50mm na2hpo4缓冲液以终浓度为0.4mg/ml方式溶解的邻苯二胺(opd;富士胶片和光纯药#615-28-1),反应2分30秒。用2.5m h2so4停止反应后,使用酶标仪(molecular devices emax)测定490nm下的显色基质的吸光度。
[0191]
将结果示于图3。显示出嵌合体-511对α6β1整联蛋白的结合活性与lm511e8对α6β1整联蛋白的结合活性为同等。根据图3的结果,利用西内等的方法(ryoko nishiuchi et al.matrix biology,25,189-197,2006)求出的α6β1整联蛋白相对于lm511e8的解离常数为0.59nm,α6β1整联蛋白相对于嵌合体-511的解离常数为0.58nm。
[0192]
(6)纤维蛋白原结合分析
[0193]
(6-1)向板的涂布
[0194]
用hbs(ph 7.4)以终浓度为100nm的方式将人纤维蛋白原稀释后,以50μl/孔加入到96孔板,一边在室温缓慢振荡一晚一边进行涂布。
[0195]
(6-2)基于凝血酶添加的、嵌合体-511与纤维蛋白原的结合
[0196]
向涂布了人纤维蛋白原的96孔板中,以200μl/孔加入含有1%脱脂乳(skim milk)(
ナカライテスク
、#31149-75)、0.1%吐温20、137mm nacl的20mm tris缓冲液、ph7.4(以下记作“1% skim/tbst”),清洗板。接着,以200μl/孔加入1% skim/tbst,一边在摇床上振荡一边在室温下进行1小时封闭。向用tbst清洗1次的板中,以25μl/孔加入0.5nih单位/ml凝血酶溶液后,以25μl/孔加入用hbs(7.4)以终浓度为0.3125nm、0.625nm、1.25nm、2.5nm、5nm、10nm的方式对lm511e8和嵌合体-511进行了稀释的溶液,在室温下一边在摇床上振荡一边反应1小时。作为对照,在以25μl/孔加入pbs(-)代替凝血酶溶液后,以25μl/孔加入对lm511e8和嵌合体-511进行了连续稀释的溶液,同样地一边在室温下振荡一边反应1小时。
[0197]
(6-3)发生了结合的嵌合体-511量的测定
[0198]
使用抗层粘连蛋白α5链抗体4c7(merck millipore,mab1924)对与纤维蛋白原结
ak02n,在添加氨甲环酸的培养基组用的孔的纤维蛋白凝胶上以1ml/孔加入10μm y-27632/1mm氨甲环酸/stemfit ak02n,在37℃/0.5%co2条件下静置一晚。
[0207]
(2-2)上层凝胶的制作及hips细胞的培养
[0208]
对于维持培养第7天的hips细胞,通过与上述相同的步骤进行剥离、分散成单个细胞及细胞数测定。制备含有4
×
104个细胞/ml的细胞、1nih单位/ml的凝血酶和100nm嵌合体-511的2
×
细胞悬浮液。向加入有250μl的2
×
纤维蛋白原溶液的1.7ml管中添加250μl的2
×
细胞悬浮液。进行吹打及翻转搅拌后,向形成有下层凝胶的孔中添加混合液250μl,在37℃下静置10分钟,使其凝胶化。向不添加氨甲环酸的培养基组用的孔的纤维蛋白凝胶上以1ml/孔加入10μm y-27632/stemfit ak02n,向添加氨甲环酸的培养基组用的孔的纤维蛋白凝胶上以1ml/孔加入10μm y-27632/1mm氨甲环酸/stemfit ak02n,在37℃/0.5%co2条件下开始包埋培养。在培养开始的次日、培养第4天、培养第5天、培养第6天,使用1mm氨甲环酸/stemfit ak02n进行培养基交换。
[0209]
将培养第7天的结果示于图5。上段为添加氨甲环酸的培养基组的代表性孔的观察图像,下段为不添加氨甲环酸的培养基组的代表性孔的观察图像。左侧为明视场图像,右侧为相位差图像。不添加氨甲环酸的培养基组中,从包埋培养开始第4天起凝胶的溶解变得显著,在培养基交换时,偶然可见一部分细胞随着凝胶而脱落的现象。另一方面,添加氨甲环酸的培养基组中,直至观察结束时为止未确认到凝胶的溶解,细胞形成近似正球形的块而进行增殖。认为添加氨甲环酸的培养基组中凝胶未发生溶解是由于氨甲环酸的抗纤溶酶作用。
[0210]
[实施例3:使用整合有嵌合体-511的纤维蛋白凝胶的细胞培养中的嵌合体-511的浓度依赖性的研究]
[0211]
在实施例2中以嵌合体-511的终浓度为0.15nm、0.5nm、1.5nm、5nm、15nm、50nm或150nm的方式向2
×
细胞悬浮液中添加嵌合体-511,除此以外通过与实施例2相同的步骤对hips细胞进行包埋培养。作为阴性对照,使用未添加嵌合体-511的纤维蛋白凝胶对hips细胞进行包埋培养。使用一体化荧光显微镜(基恩士、bz-x710)对包埋次日、培养第4天、培养第5天、培养第6天、培养第7天的细胞块进行拍摄,观察细胞块形成中的嵌合体-511的添加浓度依赖性。
[0212]
在培养第8天,按照以下步骤回收细胞,测定细胞数。吸除细胞培养液,用pbs(-)清洗。以1ml/孔加入纤维蛋白凝胶溶解液[含有2.5mg/ml胰蛋白酶(thermo fisher scientific,#15090046)、5mm edta、10μm y-27632的pbs(-)],在37℃下在摇床上对纤维蛋白凝胶进行30分钟消化。通过反复吹打分散成单个细胞后,离心分离(300
×
g)5分钟,除去上清,再悬浮于纤维蛋白凝胶溶解液。将细胞悬浮液10μl和0.4%台盼蓝(thermo fisher scientific,t10282)10μl混合,使用countess自动细胞计数器(thermo fisher scientific)测定细胞数。测定总细胞数及被台盼蓝染色的细胞数,计算存活率。
[0213]
将培养第7天的观察结果示于图6。观察到嵌合体-511的浓度依赖性的细胞块数的增加。
[0214]
将培养第8天的细胞数及存活率的结果示于图7。图7的数据以3次独立实验的平均值及标准偏差来示出。细胞数及存活率依赖于嵌合体-511的浓度而增加。
[0215]
[实施例4:使用整合有嵌合体-511的纤维蛋白凝胶的细胞培养中的经时变化的研
488小鼠igg1同种型对照的细胞悬浮液中添加0.2%np-40,与抗体反应并行地进行透过处理。作为rbc2lcn-fitc的阴性对照,准备未添加的细胞悬浮液。除去抗体反应液后,用含有1.5%fbs的pbs(-)清洗1次,再悬浮于d-pbs。将该细胞悬浮液在冰上保存,用bd facscelesta流式细胞仪检测未分化标志物。
[0230]
作为对照,使用利用6孔板(康宁、#353046)进行二维维持培养的hips细胞。向维持培养第7天的hips细胞中添加细胞剥离液,在37℃下孵育5分钟,吸除细胞剥离液,用pbs(-)清洗后,以1ml/孔添加含有10μm y-27632的stemfit ak02n,用细胞刮刀回收hips细胞。通过反复吹打分散成单个细胞后,将细胞悬浮液10μl和0.4%台盼蓝10μl混合,用countess自动细胞计数器测定细胞数。用10μm y-27632/pbs(-)清洗2次后,以用pbs(-)稀释的3.7%多聚甲醛悬浮,在室温下固定10分钟。之后通过与上述的使用纤维蛋白凝胶三维包埋培养的hips细胞时的步骤相同的步骤进行抗体处理及未分化标志物检测。
[0231]
将结果示于图10。(a)为ssea4的检测结果,(b)为oct3/4的检测结果,(c)为rbc2lcn的检测结果。各上段为二维维持培养的hips细胞的结果,下段使用纤维蛋白凝胶三维包埋培养的hips细胞的结果。表明使用纤维蛋白凝胶三维包埋培养的hips细胞与二维维持培养的hips细胞同样地维持了未分化性。
[0232]
[实施例7:串珠蛋白聚糖附加型嵌合体-511的制作、纯化及活性评价]
[0233]
(1)连接了人串珠蛋白聚糖结构域1的嵌合体-α5的表达载体的构建
[0234]
串珠蛋白聚糖为基底膜的主要的硫酸乙酰肝素蛋白聚糖。具有生长因子结合活性的硫酸乙酰肝素链与其结构域1结合。为了制作具有生长因子结合活性的嵌合体-511,如下所述地制作使人串珠蛋白聚糖的结构域1融合于嵌合体-α5的c末端的嵌合蛋白(以下记作“嵌合体-α5(+p)”)。首先,以按照wo2014/199754a1中记载的步骤构建的人串珠蛋白聚糖的结构域1与lmα5e8片段的嵌合蛋白(以下记作“lmα5e8(+p)”)的表达载体为模板,将编码包含串珠蛋白聚糖d1结构域的lmα5e8(+p)的c末端区域的dna片段用限制酶clai和noti切出。将其插入到嵌合体-α5的表达载体的该限制酶位点,从而构建嵌合体-α5(+p)的表达载体。
[0235]
(2)串珠蛋白聚糖附加型嵌合体-511(以下记作“嵌合体-511p”)的表达及纯化
[0236]
嵌合体-511p的表达通过将构建的各链的表达载体导入到293-f细胞中来进行。即,将嵌合体-α5(+p)、嵌合体-β1及嵌合体-γ1的表达载体导入到293-f细胞中。使用转染试剂293fectin及opti-mem,将各链表达载体各400μg同时转染于1.0
×
109个293-f细胞(1.0
×
106个细胞/ml),培养72小时后,回收培养液。将回收的培养液以1000
×
g离心分离10分钟,将其上清进一步以15000
×
g离心分离30分钟,除去细胞及不溶物。向培养上清中添加10ml的complete his-tag纯化树脂(roche),孵育一夜,使目标蛋白吸附。回收complete his-tag纯化树脂,用hbs(ph8.0)清洗后,用溶解有250mm咪唑的hbs(ph 8.0)洗脱。洗脱级分利用a280的吸光度测定进行确认。
[0237]
将含有目标蛋白的洗脱级分用amicon ultra-15离心过滤装置(merck millipore)浓缩后,供于利用superose 6increase 10/300gl(ge healthcare)的凝胶过滤层析,使用hbs(ph 7.4)以流速0.5ml/分钟进行洗脱。洗脱级分中的目标蛋白量利用a280的吸光度及sds-page进行确认。将凝胶过滤层析后的纯化物用0.22μm的盘式针头过滤器(merck millipore、slgv033rs)灭菌后,在-80℃下保存。
[0238]
(3)整联蛋白结合分析
[0239]
使用实施例1(5)中记载的方法,测定嵌合体-511p对α6β1整联蛋白的结合活性。
[0240]
将整联蛋白结合分析的结果示于图11。α6β1整联蛋白用量依赖性地与嵌合体-511p结合,其表观解离常数为0.90nm。根据该结果,认为嵌合体-511p保持了与嵌合体-511、lm511e8大致同等的对α6β1整联蛋白的结合活性。
[0241]
(4)纤维蛋白原结合分析
[0242]
(4-1)向板的涂布
[0243]
用hbs(ph 7.4)以终浓度100nm的方式稀释人纤维蛋白原后,以50μl/孔加入到96孔板中,在室温下一边缓慢振荡一晚一边进行涂布。
[0244]
(4-2)基于凝血酶添加的、嵌合体-511p与纤维蛋白原的结合
[0245]
向涂布有人纤维蛋白原的96孔板中,以200μl/孔加入1%skim/tbst,清洗板。接着,以200μl/孔加入1% skim/tbst,一边在摇床上振荡一边在室温下进行1小时封闭。向用tbst清洗1次的板中,以25μl/孔加入0.5nih单位/ml凝血酶溶液后,以25μl/孔加入用hbs(7.4)以终浓度为0.3125nm、0.625nm、1.25nm、2.5nm、5nm、10nm的方式稀释嵌合体-511p而成的溶液,在室温下一边在摇床上振荡一边反应1小时。作为对照,以25μl/孔加入pbs(-)代替凝血酶溶液后,以25μl/孔加入对嵌合体-511p进行了连续稀释的溶液,同样地一边在室温下振荡一边反应1小时。
[0246]
(4-3)发生了结合的嵌合体-511p量的测定
[0247]
使用抗层粘连蛋白α5链抗体4c7(merck millipore,mab1924)对与纤维蛋白原结合的嵌合体-511p进行定量。以50μl/孔加入用tbst稀释3000倍的抗层粘连蛋白α5链抗体4c7,在室温下在摇床上反应1小时。用200μl/孔的tbst清洗3次后,以50μl/孔加入用tbst稀释的10nm驴抗小鼠igg/hrp(jackson immunoresearch laboratories,#715-035-150),在室温下在摇床上反应1小时。用200μl/孔的tbst清洗3次后,以50μl/孔加入用含有0.04% h2o2的25mm柠檬酸/50mm na2hpo4缓冲液以终浓度0.4mg/ml的方式溶解的邻苯二胺,反应2分钟。用2.5m h2so4停止反应后,使用酶标仪测定490nm下的显色基质的吸光度。
[0248]
将结果示于图12。嵌合体-511p在凝血酶存在下用量依赖性地与纤维蛋白原结合,但是在凝血酶不存在下时不结合。该结果表明,与嵌合体-511同样地,嵌合体-511p在凝血酶作用下在嵌合体-α5链(+p)和嵌合体-β1链的n末端区域被切断,由此露出的a杵和b杵与涂布在板上的纤维蛋白原的a臼和b臼结合。
[0249]
[实施例8:使用整合有嵌合体-511p的纤维蛋白凝胶的细胞培养]
[0250]
通过与实施例2相同的步骤,将嵌合体-511p的终浓度设为50nm而对hips细胞进行包埋培养。作为阴性对照,使用未添加嵌合体-511p的纤维蛋白凝胶对hips细胞进行包埋培养。
[0251]
将用一体化荧光显微镜观察培养第7天的hips细胞的结果示于图13。(a)为阴性对照(仅纤维蛋白)的结果,(b)为用添加了50nm嵌合体-511p的纤维蛋白凝胶进行培养的结果。左侧为孔整体的图像,右侧为左侧的框内的放大图像。(a)阴性对照的情况下,在培养第7天未观察到细胞块。另一方面,(b)用含有50nm嵌合体-511p的纤维蛋白凝胶内进行培养的情况下,观察到多个增殖的hips细胞的细胞块。
[0252]
[实施例9:层粘连蛋白511以外的层粘连蛋白异形体与纤维蛋白原的嵌合分子的制作、纯化及活性评价]
[0253]
(1)观察在人纤维蛋白原上连接有层粘连蛋白111、层粘连蛋白121、层粘连蛋白211、层粘连蛋白221、层粘连蛋白311、层粘连蛋白321、层粘连蛋白332、层粘连蛋白411、层粘连蛋白421、层粘连蛋白521的整联蛋白结合区域的嵌合蛋白表达载体的构建
[0254]
在c末端添加了10
×
his标签的人层粘连蛋白α1链的嵌合蛋白嵌合体-α1(小鼠ig-κ链v-j2-c信号肽/fbgβ(gln
31-asn
194
)/lmα1(leu
2099-pro
2683
)/10
×
his)的表达载体按照实施例1(2)中记载的方法以人层粘连蛋白α1e8片段的表达载体(hiroyuki ido et al.j biol chem 283:28149-28157,2008)为模板而制作。同样地,分别以人层粘连蛋白α2e8片段(hiroyuki ido et al.j biol chem283:28149-28157,2008)、人层粘连蛋白α3e8片段(takamichi miyamzaki et al.nature commun 3:1236,2012)、人层粘连蛋白α4e8片段(ryo ohta et al.sci rep 6:35680,2016)的表达载体为模板,制作人层粘连蛋白α2链的嵌合蛋白嵌合体-α2(小鼠ig-κ链v-j2-c信号肽/fbgβ(gln
31-asn
194
)/lmα2(ile
2127-asp
2720
)/10
×
his)、人层粘连蛋白α3链的嵌合蛋白嵌合体-α3(小鼠ig-κ链v-j2-c信号肽/fbgβ(gln
31-asn
194
)/lmα3(met
2370-leu
2937
)/10
×
his)、人层粘连蛋白α4链的嵌合蛋白嵌合体-α4(小鼠ig-κ链v-j2-c信号肽/fbgβ(gln
31-asn
194
)/lmα4(ile
815-leu
1412
)/10
×
his)的表达载体。需要说明的是,关于嵌合体-α1及嵌合体-α2,为了在人纤维蛋白原β链(“fbgβ(met
1-gln
491
)”)与人层粘连蛋白α1链或α2链的连接部产生n型糖链附加序列(asn-xaa-ser),分别制作了将人纤维蛋白原β链asn194置换为谷氨酰胺(gln)的嵌合蛋白的表达载体。
[0255]
人层粘连蛋白β2链的嵌合蛋白嵌合体-β2(小鼠ig-κ链v-j2-c信号肽/fbgα(ala
20-his
151
)/lmβ2(leu
1773-gln
1798
)按照实施例1中记载的方法以人层粘连蛋白β2e8片段的表达载体(yukimasa taniguchi et al.j biol chem 284:7820-7831,2009)为模板而制作。同样地,以人层粘连蛋白β3e8片段的表达载体(takamichi miyamzaki et al.nature commun3:1236,2012)和人层粘连蛋白γ2e8片段的表达载体(takamichi miyamzaki et al.nature commun 3:1236,2012)为模板,制作了人层粘连蛋白β3链的嵌合蛋白嵌合体-β3(小鼠ig-κ链v-j2-c信号肽/fbgα(ala
20-his
151
)/lmβ3(leu
1147-lys 1172
)的表达载体和人层粘连蛋白γ2链的嵌合蛋白嵌合体-γ2(小鼠ig-κ链v-j2-c信号肽/fbgα(ala
20-his
151
)/lmγ2(ile
1163-gln
1193
)的表达载体。
[0256]
(2)人纤维蛋白原上连接有层粘连蛋白111、层粘连蛋白121、层粘连蛋白211、层粘连蛋白221、层粘连蛋白311、层粘连蛋白321、层粘连蛋白332、层粘连蛋白411、层粘连蛋白421、层粘连蛋白521的整联蛋白结合区域的嵌合蛋白(嵌合体-111、嵌合体-121、嵌合体-211、嵌合体-221、嵌合体-311、嵌合体-321、嵌合体-332、嵌合体-411、嵌合体-421、嵌合体-521)的表达及纯化
[0257]
按照实施例1(3)中记载的方法将嵌合体-α1、嵌合体-β1、嵌合体-γ1的表达载体导入到293-f细胞中,表达嵌合体-111。同样地,将嵌合体-α1、嵌合体-α2、嵌合体-α3、嵌合体-α4、嵌合体-α5、嵌合体-β1、嵌合体-β2、嵌合体-β3、嵌合体-γ1、嵌合体-γ2的各表达载体按照各层粘连蛋白亚单元链的组成进行组合并导入到293-f细胞中,表达嵌合体-121、嵌合体-211、嵌合体-221、嵌合体-311、嵌合体-321、嵌合体-332、嵌合体-411、嵌合体-421、嵌合体-511、嵌合体-521。
[0258]
培养开始起72小时后,回收培养液,通过离心操作回收培养上清。按照实施例1(3)
中记载的方法,将利用了嵌合体-α链的c末端所添加的10
×
his标签的亲和层析与使用superose 6increase 10/300gl(ge healthcare)的凝胶过滤层析组合,从培养上清中纯化嵌合蛋白。经纯化的嵌合蛋白用0.22μm的盘式针头过滤器(merck millipore、slgv033rs)灭菌后,在-80℃下保存。
[0259]
(3)嵌合体-111、嵌合体-121、嵌合体-211、嵌合体-221、嵌合体-311、嵌合体-321、嵌合体-332、嵌合体-411、嵌合体-421、嵌合体-521的sds-page分析
[0260]
(3-1)嵌合蛋白的表达确认
[0261]
培养开始起72小时后回收导入了各嵌合蛋白的表达载体的293-f细胞的培养液,通过sds-page确认培养上清中表达了目标嵌合蛋白。向培养上清5μl中加入5
×
sds样品处理缓冲液1.3μl,在95℃下处理5分钟后,上样到具有5%-20%的浓度梯度的聚丙烯酰胺凝胶(atto、#2331830),以15ma进行115分钟电泳。电泳按照laemmli法使用包含25mm tris、192mm甘氨酸、0.1%十二烷基硫酸钠的缓冲液在非还原条件下进行。电泳后,将分离出的蛋白质转印到聚偏二氟乙烯膜上。使用针对嵌合体-α1、嵌合体-α2、嵌合体-α3、嵌合体-α4、嵌合体-α5的c末端所添加的10
×
his标签的抗体(penta-hishrp偶联物;qiagen#34460),检测转印到膜上的嵌合蛋白。
[0262]
将结果示于图14。从任一嵌合蛋白的培养上清中均在高于250kda的分子量标志物的高分子量侧检测到六聚体的条带。另外,在100kda的分子量标志物的位置检测到少量的嵌合体-α1/嵌合体-α2/嵌合体-α3/嵌合体-α4/嵌合体-α5的条带。由这些结果确认,与嵌合体-511同样地,各嵌合蛋白以六聚体形式表达。
[0263]
(3-2)经纯化的嵌合蛋白的纯度检验
[0264]
将经纯化的嵌合体-111、嵌合体-221、嵌合体-332、嵌合体-411、嵌合体-421分别以1.2μg/孔上样到具有5%-20%的浓度梯度的聚丙烯酰胺凝胶(atto、#2331830)中,以20ma电泳75分钟。电泳后,使用quick-cbb(富士胶片和光纯药、#299-50101)对凝胶进行染色,使分离出的蛋白质可视化。
[0265]
将结果示于图15。在非还原条件下,任一嵌合蛋白均在高于250kda的分子量标志物的高分子量侧检测到1条六聚体的条带。在还原条件下,在100kda的分子量标志物的位置检测到嵌合体-α1/嵌合体-α2/嵌合体-α3/嵌合体-α4的条带,在稍稍高于15kda的分子量标志物的高分子量侧的位置检测到嵌合体-β1/嵌合体-β2/嵌合体-β3/嵌合体-γ1/嵌合体-γ2的条带。由这些结果确认,各嵌合蛋白能够以高纯度被纯化。
[0266]
(4)嵌合体-111、嵌合体-221、嵌合体-332、嵌合体-421的纤维蛋白原结合活性及整联蛋白结合活性的测定
[0267]
(4-1)纤维蛋白原结合活性
[0268]
按照实施例1(6)中记载的方法测定经纯化的嵌合体-111、嵌合体-221、嵌合体-332、嵌合体-421的纤维蛋白原结合活性。向96孔板中,以50μl/孔加入用hbs(ph 7.4)以终浓度为100nm的方式稀释的人纤维蛋白原,在室温下一边缓慢振荡一晚一边进行涂布。涂布后,以200μl/孔加入1% skim/tbst,清洗板。接着,以200μl/孔加入1% skim/tbst,一边在摇床上振荡一边在室温下封闭1小时。向用tbst清洗1次的板中,以25μl/孔加入0.5nih单位/ml凝血酶溶液后,以25μl/孔加入用hbs(ph 7.4)以终浓度为0.3125nm、0.625nm、1.25nm、2.5nm、5nm、10nm的方式稀释各嵌合蛋白而成的溶液,在室温下一边在摇床上振荡
一边反应1小时。对照组中,以25μl/孔加入hbs(ph 7.4)来代替凝血酶溶液。
[0269]
使用与嵌合体-α链的c末端所添加的10
×
his标签结合的抗体(penta-hishrp偶联物;qiagen#34460;以下记作“his标签抗体”),对发生了结合的嵌合蛋白进行定量。用200μl/孔的tbst将板清洗3次后,以50μl/孔加入用1% skim/tbst稀释3000倍的his标签抗体,在室温下在摇床上反应1小时。用200μl/孔的tbst清洗3次后,以50μl/孔加入用含有0.04% h2o2的25mm柠檬酸/50mm na2hpo4缓冲液以终浓度0.4mg/ml的方式溶解的邻苯二胺,反应2分钟。用2.5m h2so4停止反应后,使用酶标仪测定490nm下的显色基质的吸光度。
[0270]
将结果示于图16。各嵌合蛋白在凝血酶存在下用量依赖性地与纤维蛋白原结合。在凝血酶不存在时不结合。该结果表明,与嵌合体-511同样地,各嵌合蛋白保持了凝血酶依赖性地与纤维蛋白原结合的活性。
[0271]
(4-2)整联蛋白结合活性
[0272]
各嵌合蛋白含有层粘连蛋白的整联蛋白结合区域,因此能够利用其整联蛋白结合活性来定量与涂布于96孔板的纤维蛋白原呈凝血酶依赖性地结合的嵌合蛋白。即,可以使用层粘连蛋白结合性整联蛋白代替his标签抗体来定量发生了结合的嵌合蛋白。层粘连蛋白结合性整联蛋白中,层粘连蛋白-111和层粘连蛋白-221与α7x2β1整联蛋白强烈结合,层粘连蛋白-332、层粘连蛋白-421与α6β1整联蛋白强烈结合(yukimasa taniguchi et al.j biol chem 284:7820-7831,2009;ryoko nishiuchi et al.matrix biol 25:189-197,2006;taichi ishikawa et al.matrix biol 38:69-83,2014)。因此,使用α7x2β1整联蛋白来定量与纤维蛋白原结合的嵌合体-111和嵌合体-221,使用α6β1整联蛋白来定量与纤维蛋白原结合的嵌合体-332、嵌合体421。
[0273]
α7x2β1整联蛋白和α6β1整联蛋白通过ido等的方法(hiroyuki ido et al.j biol chem 282(15):11144-11154,2007)来制作。按照上述(4-1)中记载的方法使经纯化的嵌合体-111、嵌合体-221、嵌合体-332、嵌合体-421分别与涂布于96孔板的纤维蛋白原结合。按照实施例1(5-2)中记载的方法定量发生了结合的整联蛋白。具体而言,用含有1mm mncl2或10mm edta的0.1% bsa/tbst以终浓度为30nm的方式进行稀释而制备整联蛋白溶液,将其以50μl/孔加入到板中,在室温下一边在摇床上振荡一边反应1小时。用200μl/孔的1mm mncl2/0.1% bsa/tbst、或10mm edta/0.1% bsa/tbst清洗3次后,以50μl/孔加入用1mm mncl2/0.1%bsa/tbst稀释的1.5μg/ml的生物素标记velcro抗体(按照takagi,j.,erickson,h.p.and springer,t.a.(2001)nat.struct.biol.8,412-416的记载制作),在室温下一边在摇床上振荡一边反应30分钟。用200μl/孔的1mm mncl2/0.1% bsa/tbst清洗3次后,以50μl/孔加入用1mm mncl2/0.1% bsa/tbst稀释的0.53μg/ml的链霉亲和素-辣根过氧化物酶(thermo fisher scientific,#21126),在室温下一边在摇床上振荡一边反应15分钟。用200μl/孔的1mm mncl2/0.1% bsa/tbst清洗3次后,以50μl/孔加入用含有0.04% h2o2的25mm柠檬酸/50mm na2hpo4缓冲液以终浓度为0.4mg/ml的方式溶解的邻苯二胺(opd;富士胶片和光纯药#615-28-1),反应2分钟~5分钟。用2.5m h2so4停止反应后,使用酶标仪(molecular devices emax)测定490nm下的显色基质的吸光度。
[0274]
将结果示于图17。任意嵌合蛋白在1mm mncl2存在下均与整联蛋白强烈结合,在10mm edta存在下不结合。另一方面,在凝血酶不共存下使嵌合蛋白与涂布于96孔板的纤维蛋白原结合时,与检测中使用his标签抗体的情况同样地,未检测到整联蛋白的结合。该结
果确认,不管与纤维蛋白原嵌合化的层粘连蛋白异形体的类型的差异如何,嵌合蛋白都能够呈凝血酶依赖性地与纤维蛋白原结合,并且表明在与纤维蛋白原结合的情况下也保持了整联蛋白结合活性。
[0275]
[实施例10:层粘连蛋白511以外的层粘连蛋白异形体与纤维蛋白原的串珠蛋白聚糖附加型嵌合分子的制作、纯化、及活性评价]
[0276]
(1)连接有人串珠蛋白聚糖结构域1的嵌合体-α1、嵌合体-α2、嵌合体-α3、嵌合体-α4的表达载体的构建
[0277]
使人串珠蛋白聚糖的结构域1融合于嵌合体-α1的c末端的嵌合蛋白(以下记作“嵌合体-α1(+p)”)的表达载体如下构建:制作将按照wo2014/199754a1中记载的步骤构建的人串珠蛋白聚糖的结构域1附加于层粘连蛋白α1e8片段的c末端的嵌合蛋白的表达载体(w02018/088501a1),将其作为模板,按照实施例7(1)中记载的方法进行构建。同样地,以在c末端附加有人串珠蛋白聚糖的结构域1的层粘连蛋白α2e8片段、层粘连蛋白α3e8片段、层粘连蛋白α4e8片段的表达载体(wo2018/088501a1)为模板,构建使人串珠蛋白聚糖的结构域1融合于嵌合体-α2、嵌合体-α3、嵌合体-α4的c末端的嵌合蛋白(以下分别记作“嵌合体-α2(+p)”、“嵌合体-α3(+p)”、“嵌合体-α4(+p)”)的表达载体。
[0278]
(2)串珠蛋白聚糖附加型的嵌合体-111、嵌合体-121、嵌合体-211、嵌合体-221、嵌合体-311、嵌合体-321、嵌合体-332、嵌合体-411、嵌合体-421、嵌合体-521的表达及纯化
[0279]
按照实施例7(2)中记载的方法将嵌合体-α1(+p)、嵌合体-β1、嵌合体-γ1的表达载体导入到293-f细胞中,表达串珠蛋白聚糖附加型嵌合体-111(以下记作“嵌合体-111p”)。同样地,对于串珠蛋白聚糖附加型的嵌合体-121、嵌合体-211、嵌合体-221、嵌合体-311、嵌合体-321、嵌合体-332、嵌合体-411、嵌合体-421、嵌合体-521(以下分别记作“嵌合体-121p”、“嵌合体-211p”、“嵌合体-221p”、“嵌合体-311p”、“嵌合体-321p”、“嵌合体-332p”、“嵌合体-411p”、“嵌合体-421p”、“嵌合体-521p”)而言,将嵌合体-α1(+p)、嵌合体-α2(+p)、嵌合体-α3(+p)、嵌合体-α4(+p)、嵌合体-α5(+p)、嵌合体-β1、嵌合体-β2、嵌合体-β3、嵌合体-γ1、嵌合体-γ2的各表达载体按照各层粘连蛋白亚单元链的组成组合,使用实施例7(2)中记载的方法导入到293-f细胞中,表达各嵌合蛋白。培养开始起72小时后,回收培养液,通过离心操作回收培养上清。
[0280]
与串珠蛋白聚糖d1结构域结合的硫酸乙酰肝素链与具有季铵基的阴离子交换体强烈结合。利用该性质,能够在不使用利用了10
×
his标签的亲和层析和凝胶过滤层析的情况下仅通过阴离子交换层析来进行纯化。具体而言,将回收的培养液300ml以500
×
g离心分离10分钟,将其上清进一步以10000
×
g离心分离30分钟,除去细胞及不溶物。将2根hitrap q fast flow(5ml)(cytiva、17515601)连接于akta avant 25,使上清以2.5ml/分钟流入柱。使含有2mm nacl的20mm tris-hcl(ph8.0)100ml以5ml/分钟流入,清洗柱后,利用20mm tris-hcl(ph 8.0)和含有1m nacl的20mm tris-hcl(ph 8.0)洗脱所吸附的蛋白质。通过sds-page分析确定含有目标蛋白的洗脱级分后,将该级分合并成1个,用20mm tris-hcl(ph 8.0)将nacl浓度调整到大约500mm。然后,将1根hitrapr q hp(5ml)(cytiva、17115401)连接于akta avant 25,使上述级分池以2.5ml/分钟流入柱。使含有450-500mm nacl的20mm tris-hcl(ph 8.0)50ml以2.5ml/分钟流入而清洗柱后,利用含有2m nacl的20mm tris-hcl(ph 8.0)洗脱所吸附的蛋白质。通过sds-page分析确定含有目标蛋白的洗脱级分后,将该
级分合并成1个,用hbs(-)(ph 7.4)透析。将透析后的纯化物用0.22μm的盘式针头过滤器(merck millipore、slgvj13sl)灭菌后,用pierce bca蛋白分析试剂盒(thermofisher scientific、23227)确定蛋白质浓度,在-80℃下保存。
[0281]
(3)嵌合体-111p、嵌合体-121p、嵌合体-211p、嵌合体-221p、嵌合体-311p、嵌合体-321p、嵌合体-332p、嵌合体-411p、嵌合体-421p、嵌合体-521p的sds-page分析
[0282]
(3-1)串珠蛋白聚糖附加型嵌合蛋白的表达确认
[0283]
培养开始起72小时后,回收导入了各嵌合蛋白的表达载体的293-f细胞的培养液,通过非还原条件下的sds-page确认培养上清中表达了目标嵌合蛋白。向培养上清16μl中加入5
×
sds样品处理缓冲液4μl,以95℃处理5分钟后,上样于具有5%-20%的浓度梯度的聚丙烯酰胺凝胶(atto、#2331830),以20ma电泳75分钟。电泳后,将分离出的蛋白质转印于聚偏二氟乙烯膜上。使用针对嵌合体-α1p、嵌合体-α2p、嵌合体-α3p、嵌合体-α4p、嵌合体-α5p的c末端所添加的10
×
his标签的抗体(penta-hishrp偶联物;qiagen#34460),来检测转印到膜上的嵌合蛋白。
[0284]
将结果示于图18。在非还原条件下,从任一串珠蛋白聚糖附加型嵌合蛋白的培养上清中,均在高于250kda的分子量标志物的高分子量侧检测到稍宽的1条条带,确认各嵌合蛋白以符合设计的6聚体形式表达。串珠蛋白聚糖附加型嵌合蛋白的表达量根据层粘连蛋白异形体的类型而不同,观察到包含层粘连蛋白α1链、层粘连蛋白α2链、层粘连蛋白α4链的嵌合蛋白(嵌合体-111p、嵌合体-121p、嵌合体-211p、嵌合体-221p、嵌合体-411p、嵌合体-421p)与包含层粘连蛋白α3链和层粘连蛋白α5链的嵌合蛋白(嵌合体-311p、嵌合体-321p、嵌合体-332p、嵌合体-511p、嵌合体-521p)相比表达量多的倾向。
[0285]
(3-2)经纯化的嵌合蛋白的纯度检验
[0286]
将经纯化的嵌合体-111p、嵌合体-221p、嵌合体-332p、嵌合体-421p、嵌合体-511p分别以1.2μg/孔上样到具有5%-20%的浓度梯度的聚丙烯酰胺凝胶(atto、#2331830),以20ma电泳75分钟。电泳后,使用quick-cbb(富士胶片和光纯药、#299-50101)对凝胶进行染色,使分离出的蛋白质可视化。
[0287]
将结果示于图19。在非还原条件下,任一嵌合蛋白均在高于250kda的分子量标志物的高分子量侧检测到六聚体的条带,在还原条件下,在从分子量150kda至高于250kda的高分子量侧的区域检测到扩散性的嵌合体-α1(+p)/嵌合体-α2(+p)/嵌合体-α3(+p)/嵌合体-α4(+p)/嵌合体-α5(+p)的条带。已知含有硫酸乙酰肝素链的蛋白质(硫酸乙酰肝素链蛋白聚糖)会由于硫酸乙酰肝素链的链长及硫酸化度的不均匀性而在sds-page分析中形成扩散的宽条带(shaoliang li et al.j biol chem285:36645-36655,2010)。在还原条件下的sds-page中在从分子量150kda至超过250kda的区域出现扩散性的条带表明在嵌合体-α1(+p)/嵌合体-α2(+p)/嵌合体-α3(+p)/嵌合体-α4(+p)/嵌合体-α5(+p)的串珠蛋白聚糖d1结构域附加有足够量的硫酸乙酰肝素链。在还原条件下,在稍微高于分子量15kda的高分子量侧的位置也检测到嵌合体-β1/嵌合体-β2/嵌合体-β3/嵌合体-γ1/嵌合体-γ2。需要说明的是,在还原条件下在分子量100kda的区域检测到的尖锐条带是切掉了串珠蛋白聚糖d1结构域而成的嵌合体-α(+p)链的条带,这一点已通过使用特异性识别串珠蛋白聚糖d1结构域的抗体的蛋白免疫印迹进行了确认。
[0288]
(4)嵌合体-111p、嵌合体-221p、嵌合体-332p、嵌合体-421的纤维蛋白原结合活性
及整联蛋白结合活性的测定
[0289]
按照实施例1(6)中记载的方法测定了经纯化的嵌合体-111p、嵌合体-221p、嵌合体-332p、嵌合体-421p的纤维蛋白原结合活性及整联蛋白结合活性。向96孔板中,以50μl/孔加入用hbs(ph 7.4)以终浓度为100nm的方式稀释的人纤维蛋白原,在室温下一边缓慢振荡一晚一边进行涂布。涂布后,以200μl/孔加入1% skim/tbst,清洗板。接着,以200μl/孔加入1% skim/tbst,一边在摇床上振荡一边在室温下封闭1小时。向用tbst清洗1次的板中,以25μl/孔加入0.5nih单位/ml凝血酶溶液后,以25μl/孔加入用hbs(7.4)以终浓度为0.3125nm、0.625nm、1.25nm、2.5nm、5nm、10nm的方式稀释各嵌合蛋白而成的溶液,在室温下一边在摇床上振荡一边反应1小时。对照组中,以25μl/孔加入hbs来代替凝血酶溶液。
[0290]
串珠蛋白聚糖附加型嵌合蛋白含有层粘连蛋白的整联蛋白结合区域,因此以其整联蛋白结合活性为指标测定发生了结合的嵌合蛋白。具体而言,通过实施例9(4-2)中记载的方法,使用α7x2β1整联蛋白定量与纤维蛋白原结合的嵌合体-111p及嵌合体-221p,使用α6β1整联蛋白定量与纤维蛋白原结合的嵌合体-332p及嵌合体-421p。
[0291]
将结果示于图20。任一串珠蛋白聚糖附加型嵌合蛋白均在1mm mncl2存在下与整联蛋白强烈结合,在10mm edta存在下不结合。另一方面,在凝血酶不共存下结合串珠蛋白聚糖附加型嵌合蛋白的情况下,未检测到整联蛋白的结合。这些结果表明,不管与纤维蛋白原进行嵌合化的层粘连蛋白异形体的类型的差异如何,串珠蛋白聚糖附加型嵌合蛋白都保持了呈凝血酶依赖性地与纤维蛋白原结合的活性,并且表明在与纤维蛋白原结合的状况下也保持了整联蛋白结合活性。
[0292]
(5)嵌合体-111p、嵌合体-221p、嵌合体-332p、嵌合体-421的生长因子结合活性的测定
[0293]
已知串珠蛋白聚糖借助其硫酸乙酰肝素链捕捉各种生长因子(shaoliang li et al.j biol chem 285:36645-36655,2010)。为了确认串珠蛋白聚糖附加型的嵌合蛋白保持了生长因子结合活性这一点,测定了已报道与硫酸乙酰肝素链结合的激活蛋白原a与经纯化的串珠蛋白聚糖附加型嵌合蛋白的结合活性。
[0294]
(5-1)激活蛋白原a的表达及纯化
[0295]
将在n末端侧添加了6
×
his标签的全长人激活蛋白原表达载体导入到293-f细胞中,使其表达激活蛋白原a。使用转染试剂293fectin及opti-mem,向3
×
108个293-f细胞(1.0
×
106个细胞/ml)中转染表达载体360μg,培养72小时后回收培养液。
[0296]
将回收的培养液以500
×
g离心分离10分钟,将其上清进一步以12000
×
g离心分离30分钟,除去细胞及不溶物。向培养上清中添加终浓度为5mm的咪唑、1mm的pefabloc sc plus(roche、#11873628001)、0.02%(重量/体积)的叠氮化钠,通过搅拌而混合。将1根预先包装的complete his-tag纯化柱(1ml)(roche、#6781535001)连接于akta avant 25,使上清以流速1ml/分钟流入柱。使含有200mm nacl的50mm tris-hcl(ph 8.0)10ml以流速1ml/分钟流入而清洗柱后,利用含有250mm咪唑和200mm nacl的50mm tris-hcl(ph 8.0)洗脱所吸附的蛋白质。通过sds-page分析确定含有目标蛋白的洗脱级分后,将该级分合并成1个,用25mm tris-hcl(ph 8.0)稀释至10倍。然后,将1根resource q(1ml)(cytiva、17117701)连接于akta avant 25,使上述的级分池以流速2ml/分钟流入柱。使25mm tris-hcl(ph 8.0)10ml以流速4ml/分钟流入而清洗柱后,利用含有1m nacl的25mm tris-hcl(ph 8.0)洗
ala
3310
)/10
×
his构成的嵌合体-α5、由小鼠ig-κ链v-j2-c信号肽/fbgγ(tyr
27-ser
132
)/lmβ1(leu
1761-leu
1786
)构成的嵌合体-β1、由小鼠ig-κ链v-j2-c信号肽/fbgβ(gln
31-asn
194
)/lmγ1(ile
1579-pro
1609
)构成的嵌合体-γ1的表达载体。即,以实施例1中记载的小鼠ig-κ链v-j2-c信号肽/lmα5(ile
2716-ala
3310
)/10
×
his、小鼠ig-κ链v-j2-c信号肽/lmβ1(leu
1761-leu
1786
)、小鼠ig-κ链v-j2-c信号肽/lmγ1(ile
1579-pro
1609
)、小鼠ig-κ链v-j2-c信号肽/fbgβ(gln
31-asn
194
)/lmα5(ile
2716-ala
3310
)/10
×
his、小鼠ig-κ链v-j2-c信号肽/fbgα(ala
20-his
151
)/lmβ1(leu
1761-leu
1786
)、小鼠ig-κ链v-j2-c信号肽/fbgγ(tyr
27-ser
132
)/lmγ1(ile
1579-pro
1609
)的表达载体为模板,使用以下引物组进行pcr,扩增小鼠ig-κ链v-j2-c信号肽/fbgα(ala
20-his
151
)、lmα5(ile
2716-ala
3310
)/10
×
his、小鼠ig-κ链v-j2-c信号肽/fbgγ(tyr
27-ser
132
)、lmβ1(leu
1761-leu
1786
)、小鼠ig-κ链v-j2-c信号肽/fbgβ(gln
31-asn
194
)、lmγ1(ile
1579-pro
1609
)的dna片段。需要说明的是,在各引物组的反向引物的5’侧添加了用于延伸pcr的序列。
[0311]
(xxi)小鼠ig-κ链v-j2-c信号肽/fbgα(ala
20-his
151
)扩增用引物组
[0312]5’‑
cgggactttccaaaatgtcgtaacaactccgccccattgac-3’(正向、序列号27)
[0313]5’‑
caatgagctctcgcacgcggccaatatgctgtactttttctatgactttg-3’(反向、序列号28)
[0314]
(xxii)lmα5(ile
2716-ala
3310
)扩增用引物组
[0315]5’‑
caaagtcatagaaaaagtacagcatattggccgcgtgcgagagctcattg-3’(正向、序列号29)
[0316]5’‑
cccttgatggctggcaactagaaggcacagtcgaggc-3’(反向、序列号30)
[0317]
(xxiii)小鼠ig-κ链v-j2-c信号肽/fbgγ(tyr
27-ser
132
)扩增用引物组
[0318]5’‑
cgggactttccaaaatgtcgtaacaactccgccccattgac-3’(正向、序列号27)
[0319]5’‑
gagtgaacggacttctccttccagtcttgctaaacttgagtcatgtgttaaaatcgatgc-3’(反向、序列号31)
[0320]
(xxiv)lmβ1(leu
1761-leu
1786
)扩增用引物组
[0321]5’‑
gcatcgattttaacacatgactcaagtttagcaagactggaaggagaagtccgttcactc-3’(正向、序列号32)
[0322]5’‑
cccttgatggctggcaactagaaggcacagtcgaggc-3’(反向、序列号30)
[0323]
(xxv)小鼠ig-κ链v-j2-c信号肽/fbgβ(gln
31-asn
194
)扩增用引物组
[0324]5’‑
cgggactttccaaaatgtcgtaacaactccgccccattgac-3’(正向、序列号27)
[0325]5’‑
gcgaatgtccttcatgatctcctcgatgttagttgggatattgctattcacagtctcatc-3’(反向、序列号33)
[0326]
(xxvi)lmγ1(ile
1579-pro
1609
)扩增用引物组
[0327]5’‑
gatgagactgtgaatagcaatatcccaactaacatcgaggagatcatgaaggacattcgc-3’(正向、序列号34)
[0328]5’‑
cccttgatggctggcaactagaaggcacagtcgaggc-3’(反向、序列号30)
[0329]
对于得到的6种片段,使用以下引物组进行延伸pcr,从而分别连接、扩增。将扩增出的dna片段用限制酶nhei和noti消化并插入到pcdna3.4+mcs的该限制酶位点,由此构建了相当于组合1的嵌合体-α5、嵌合体-β1及嵌合体-γ1的各表达载体。
[0330]
(xxvii)各链连接
·
扩增用引物组
[0331]5’‑
cgggactttccaaaatgtcgtaacaactccgccccattgac-3’(正向、序列号27)
[0332]5’‑
cccttgatggctggcaactagaaggcacagtcgaggc-3’(反向、序列号30)
[0333]
《组合-2的表达载体的构建》
[0334]
如下所述地构建了由小鼠ig-κ链v-j2-c信号肽/fbgγ(tyr
27-ser
132
)/lmα5(ile
2716-ala
3310
)/10
×
his构成的嵌合体-α5、由小鼠ig-κ链v-j2-c信号肽/fbgβ(gln
31-asn
194
)/lmβ1(leu
1761-leu
1786
)构成的嵌合体-β1、由小鼠ig-κ链v-j2-c信号肽/fbgα(ala
20-his
151
)/lmγ1(ile
1579-pro
1609
)构成的嵌合体-γ1的表达载体。即,以[实施例1]中记载的小鼠ig-κ链v-j2-c信号肽/lmα5(ile
2716-ala
3310
)/10
×
his、小鼠ig-κ链v-j2-c信号肽/lmβ1(leu
1761-leu
1786
)、小鼠ig-κ链v-j2-c信号肽/lmγ1(ile
1579-pro
1609
)、小鼠ig-κ链v-j2-c信号肽/fbgβ(gln
31-asn
194
)/lmα5(ile
2716-ala
3310
)/10
×
his、小鼠ig-κ链v-j2-c信号肽/fbgα(ala
20-his
151
)/lmβ1(leu
1761-leu
1786
)、小鼠ig-κ链v-j2-c信号肽/fbgγ(tyr
27-ser
132
)/lmγ1(ile
1579-pro
1609
)的表达载体为模板,使用以下引物组进行pcr,从而扩增小鼠ig-κ链v-j2-c信号肽/fbgγ(tyr
27-ser
132
)、lmα5(ile
2716-ala
3310
)/10
×
his、小鼠ig-κ链v-j2-c信号肽/fbgβ(gln
31-asn
194
)、lmβ1(leu
1761-leu
1786
)、小鼠ig-κ链v-j2-c信号肽/fbgα(ala
20-his
151
)、lmγ1(ile
1579-pro
1609
)的dna片段。需要说明的是,在各引物组的反向引物的5’侧添加了用于延伸pcr的序列。
[0335]
(xxviii)小鼠ig-κ链v-j2-c信号肽/fbgγ(tyr
27-ser
132
)扩增用引物组
[0336]5’‑
cgggactttccaaaatgtcgtaacaactccgccccattgac-3’(正向、序列号27)
[0337]5’‑
gagctctcgcacgcggccaatacttgagtcatgtgttaaaatcg-3’(反向、序列号35)
[0338]
(xxix)lmα5(ile
2716-ala
3310
)/10
×
his扩增用引物组
[0339]5’‑
cgattttaacacatgactcaagtattggccgcgtgcgagagctc-3’(正向、序列号36)
[0340]5’‑
cccttgatggctggcaactagaaggcacagtcgaggc-3’(反向、序列号30)
[0341]
(xxx)小鼠ig-κ链v-j2-c信号肽/fbgβ(gln
31-asn
194
)扩增用引物组
[0342]5’‑
cgggactttccaaaatgtcgtaacaactccgccccattgac-3’(正向、序列号27)
[0343]5’‑
ggagtgaacggacttctccttccagtcttgctaagttagttgggatattgctattcacagtctcatc-3’(反向、序列号37)
[0344]
(xxxi)lmβ1(leu
1761-leu
1786
)扩增用引物组
[0345]5’‑
gatgagactgtgaatagcaatatcccaactaacttagcaagactggaaggagaagtccgttcactcc-3’(正向、序列号38)
[0346]5’‑
cccttgatggctggcaactagaaggcacagtcgaggc-3’(反向、序列号30)
[0347]
(xxxii)小鼠ig-κ链v-j2-c信号肽/fbgα(ala
20-his
151
)扩增用引物组
[0348]5’‑
cgggactttccaaaatgtcgtaacaactccgccccattgac-3’(正向、序列号27)
[0349]5’‑
gcgaatgtccttcatgatctcctcgatatgctgtactttttctatgactttgcgcttc-3’(反向、序列号39)
[0350]
(xxxiii)lmγ1(ile
1579-pro
1609
)扩增用引物组
[0351]5’‑
gaagcgcaaagtcatagaaaaagtacagcatatcgaggagatcatgaaggacattcgc-3’(正向、序列号40)
[0352]5’‑
cccttgatggctggcaactagaaggcacagtcgaggc-3’(反向、序列号30)
[0353]
(2)人纤维蛋白原aα链、bβ链、γ链与人层粘连蛋白α5链、β1链、γ1链的组合不同的嵌合蛋白的表达的确认
[0354]
按照组合-1、组合-2及组合-3的组合将表达载体导入到293-f细胞中。在培养开始起72小时后回收培养液,利用非还原条件下的sds-page确认在培养上清中表达了各嵌合蛋白。向培养上清5μl中加入5
×
sds样品处理缓冲液1.3μl,以95℃处理5分钟后,上样到具有5%-20%的浓度梯度的聚丙烯酰胺凝胶(atto、#2331830)中,以15ma电泳115分钟。电泳后,将分离出的蛋白质转印于聚偏二氟乙烯膜上。使用针对各组合的嵌合体-α5的c末端所添加的10
×
his标签的抗体(penta-hishrp偶联物;qiagen#34460)检测转印到膜上的嵌合蛋白。
[0355]
将结果示于图22。纤维蛋白原与层粘连蛋白的构成亚单元链的组合在组合-3的情况下嵌合蛋白的表达量最多,在预期的六聚体的分子量的位置检测到主要条带。组合-1及组合-2的构成亚单元链的组合中,虽然表达量也低于组合-3,但在预期的六聚体的分子量的位置检测到主要条带。这些结果表明,只要保持了纤维蛋白原与层粘连蛋白各自的三聚体结构,则嵌合蛋白的构成链的组合(纤维蛋白原的aα链、bβ链、γ链与层粘连蛋白的α链、β链、1链的组合)不限于特定的组合。
[0356]
需要说明的是,本发明不限于上述的各实施方式及实施例,可在权利要求书所示的范围内进行各种变更,将不同实施方式中分别公开的技术手段适当组合而得到的实施方式也包括在本发明的技术范围内。另外,本说明书中记载的学术文献及专利文献全部作为参考而援引于本说明书中。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1