从反应混合物中去除过量寡核苷酸的制作方法
1.本发明涉及核酸领域。更具体地,本发明涉及包括核酸的体外反应的领域。
背景技术:
2.利用短链核酸(“寡核苷酸”)的反应通常以反应混合物中残留过量的寡核苷酸而结束。这些寡核苷酸可能通过彼此之间的相互作用或与脱靶样品核酸之间的相互作用而阻碍下游过程。此类相互作用耗尽必需的试剂并且阻碍所需的反应。
3.过量寡核苷酸包括引物、探针和衔接子。例如,扩增反应(包括聚合酶链式反应(polymerase chain reaction,pcr)和连接链式反应(ligation chain reaction,lcr))利用寡核苷酸引物和探针。在下游处理之前,需要去除未掺入扩增产物中的过量引物和探针。
4.单分子大规模平行测序涉及通过将具有通用引发结合位点和其他必需的特征的寡核苷酸衔接子附接至文库中的每个核酸的末端来形成核酸文库。形成文库后,需要去除未掺入文库核酸中的过量衔接子。
5.在单细胞分析领域,美国专利10,144,950描述了一种称为量子条形码编码(qbc)的新型单细胞分析方法,其中每个细胞都用独特的组合条形码标记。组合条形码由子码寡核苷酸组装而成。在代码组装过程结束时,需要去除过量子码。
6.通常,去除涉及多步过程,包括沉淀、离心或珠粒捕获。这些步骤耗费时间和试剂,并且导致与过量寡核苷酸分离的靶标核酸产生损失。因此,需要一种实用而经济的方法从反应混合物中去除过量寡核苷酸。
技术实现要素:
7.本发明是一种通过用双发夹核酸捕获和隔离反应混合物中的过量寡核苷酸以将其去除的方法。将过量寡核苷酸连接至双发夹结构,形成拓扑环状闭合核酸链,其不干扰下游应用。
8.在一些实施例中,本发明是一种从反应混合物中去除不需要的寡核苷酸的方法,该方法包括:使反应混合物与包含单核酸链的双发夹核酸接触,该单核酸链具有:在5
′
端的第一发夹;在3
′
端的第二发夹;以及在5
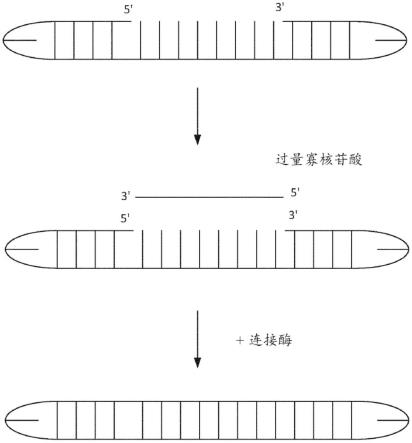
′
端与3
′
端之间的单链区,其中单链区包含能够与待去除的寡核苷酸杂交的序列;使待去除的寡核苷酸与双发夹核酸退火;将待去除的寡核苷酸连接至双发夹核酸的末端,从而从反应混合物中去除不需要的寡核苷酸。该方法进一步包括使反应混合物与连接酶接触。在其他实施例中,反应混合物已经包含连接酶。在一些实施例中,双发夹含有5
′‑
磷酸基团。
9.在一些实施例中,双发夹寡核苷酸的单链区包含与待去除的寡核苷酸互补的两个区,这两个区侧接单个中间区。该中间区可以是非核苷酸间隔物或包含肌苷核苷酸的区。在一些实施例中,待去除的寡核苷酸包含多个寡核苷酸,所述多个寡核苷酸具有两个恒定区,这两个恒定区侧接在所述多个寡核苷酸中变化的单个条形码区。
10.在一些实施例中,本发明是一种用于从反应混合物中捕获寡核苷酸的双发夹核
酸,该双发夹包含单核酸链,该单核酸链具有:在5
′
端的第一发夹;在3
′
端的第二发夹;以及在5
′
端与3
′
端之间的单链区,其中单链区包含能够与待去除的寡核苷酸杂交的序列。寡核苷酸可以由rna或dna构成。在一些实施例中,单链区包含与待去除的寡核苷酸互补的两个区,这两个区侧接单个中间区。该中间区可以是非核苷酸间隔物或由肌苷核苷酸构成。
11.在一些实施例中,本发明是一种检测反应混合物中多个细胞中的多个靶标的方法,该方法包括:使用多种独特的结合试剂与多个细胞中的靶标结合,所述多种独特的结合试剂各自对靶标中的一者具有特异性;在连续多轮裂池合成期间,以有序的方式将多个子码寡核苷酸加入到所述多个细胞中的结合的试剂中的每一者中,其中每个轮次中的子码寡核苷酸经由退火区与来自前一轮次的子码寡核苷酸相邻退火,并且将相邻退火的子码寡核苷酸彼此共价连接以在每个细胞中形成独特的细胞来源的核苷酸密码;通过使反应混合物与包含单核酸链的双发夹核酸接触来去除过量子码寡核苷酸,该单核酸链具有:在5
′
端的第一发夹;在3
′
端的第二发夹;以及在5
′
端与3
′
端之间的单链区,该单链区能够与子码寡核苷酸杂交。其中,该方法可以进一步包括使样品与多核苷酸激酶接触。在一些实施例中,子码寡核苷酸包含由两个退火区侧接的条形码区,并且双发夹核酸的单链区包含长度与条形码区相等的间隔物,该间隔物由两个序列侧接,这两个序列能够与子码寡核苷酸中的退火区杂交。该间隔物可以是碳接头或者可以包含含肌苷的核苷酸。
12.在一些实施例中,本发明是一种制备不含过量扩增引物的扩增的靶标核酸的溶液的方法,该方法包括:在支持核酸合成的试剂存在下,使含有靶标核酸的反应混合物与正向扩增引物和反向扩增引物以及热稳定的核酸聚合酶接触;使反应混合物经受适合于退火和延伸正向引物和反向引物的热循环曲线处理;完成热循环曲线后,使反应混合物与核酸连接酶和双发夹核酸接触,该双发夹核酸由单核酸链组成,该单核酸链具有:在5
′
端的第一发夹;在3
′
端的第二发夹;以及在5
′
端与3
′
端之间的单链区,其中单链区能够与正向引物或与反向引物杂交;将正向引物和反向引物连接至相应的双发夹核酸,从而从扩增的靶标核酸的溶液中去除正向引物和反向引物。该方法可以进一步包括使样品与多核苷酸激酶接触。
13.在一些实施例中,本发明是一种制备不含过量扩增引物的扩增的靶标核酸的溶液的方法,该方法包括:在支持连接的试剂存在下,使含有靶标核酸的反应混合物与能够与靶标核酸相邻杂交的第一探针和第二探针以及热稳定的连接酶接触;使反应混合物经受适合于退火并且将第一探针和第二探针彼此连接的热循环曲线处理;完成热循环曲线后,使反应混合物与双发夹核酸接触,该双发夹核酸由单核酸链组成,该单核酸链具有:在5
′
端的第一发夹;在3
′
端的第二发夹;以及在5
′
端与3
′
端之间的单链区,其中单链区能够与第一探针或与第二探针杂交;将第一探针和第二探针连接至相应的双发夹核酸,从而从扩增的靶标核酸的溶液中去除第一探针和第二探针。该方法可以进一步包括使样品与多核苷酸激酶接触。
14.在一些实施例中,本发明是一种形成不含过量衔接子分子的核酸文库的方法,该方法包括:使包含核酸的反应混合物与衔接子分子和连接酶接触;将衔接子分子连接至核酸的末端;使反应混合物与由单核酸链组成的双发夹核酸接触,该单核酸链具有:在5
′
端的第一发夹;在3
′
端的第二发夹;以及在5
′
端与3
′
端之间的单链区,其中单链区能够与衔接子杂交;将衔接子连接至双发夹核酸,从而从扩增的靶标核酸的溶液中去除衔接子。在一些实施例中,衔接子由在至少一个双链区形成的两个寡核苷酸组成。在一些实施例中,反应混合
物经受足以将衔接子分离为单链的升高的温度的处理。在一些实施例中,双发夹核酸包含两种双发夹核酸的混合物,这两种双发夹核酸各自具有与衔接子的一条链互补的单链区。
附图说明
15.图1为双发夹结构和使用方法的示意图。
具体实施方式
16.术语“核酸”是指核苷酸聚合物,并且除非另有限制,否则其还包括能够与天然存在的核苷酸以类似方式起作用(例如,杂交)的已知的天然核苷酸类似物。
17.术语“核苷酸序列”与“核酸”可互换使用。它们是指任何长度的聚合形式的核苷酸,为脱氧核糖核苷酸或核糖核苷酸或其类似物。多核苷酸可具有任何三维结构,并且可以执行任何已知或未知的功能。多核苷酸的非限制性实例如下:基因或基因片段的编码区或非编码区;基因间dna;由键结分析所界定的基因座;外显子;内含子;信使rna (mrna);转移rna;核糖体rna;短干扰rna(sirna);短发夹rna(shrna);微小rna(mirna);小核仁rna;核酶;互补dna(cdna),其为mrna的dna表现形式,通常通过信使rna(mrna)的逆转录或通过扩增获得;合成或通过扩增产生的dna分子;基因组dna;重组多核苷酸;分支多核苷酸;质粒;载体;任何序列的分离的dna;任何序列的分离的rna;核酸探针;以及引物。多核苷酸可包含修饰的核苷酸,诸如甲基化核苷酸和核苷酸类似物。如果存在的话,可以在聚合物组装之前或之后对核苷酸结构进行修饰。核苷酸的序列可以被非核苷酸组分中断。多核苷酸可在聚合后进一步修饰,诸如通过与标记组分缀合来修饰。除非另有说明,否则多核苷酸序列在提供时按5
′
至3
′
的方向列出。术语“寡核苷酸”是指较短的核酸,尽管更长的核酸也可以称为寡核苷酸,但其长度通常不超过100个核苷酸。
18.核酸“探针”是一种寡核苷酸,其能够通过一种或多种类型的化学键与互补序列的靶标核酸结合,通常通过互补碱基配对,通常通过氢键形成,从而形成双链体结构。探针与“探针结合位点”结合或杂交。探针可以用可检测标记进行标记,以允许对探针进行简单的检测,特别是当探针与其互补靶标杂交时。但是,替代性地,探针可以不带标记,但可以通过与标记的配体直接或间接地特异性结合来检测。
19.术语“表位”与“靶分子”在本文中可互换使用,是指通过本文所述的方法被检测和/或定量的目的分子(蛋白质或核酸)。
20.术语“靶标寡核苷酸”是指通过本文所公开的新方法从反应混合物中去除或耗尽的寡核苷酸。靶标寡核苷酸可能与上文所定义的靶分子共享相似性(例如,共享一些核酸序列),但是靶向靶标寡核苷酸仅指根据本文所公开的方法从反应混合物中去除靶标寡核苷酸。靶标寡核苷酸可互换地称为“过量寡核苷酸”、“不需要的寡核苷酸”、“待耗尽的寡核苷酸”和“待去除的寡核苷酸”。
21.与核酸相关的术语“发夹”是指由核酸的单链形成的二级结构,其至少具有彼此互补并且能够相互退火的部分。发夹包括在两个互补区之间的短中间区,使得在退火时,核酸链急剧弯曲。具有较长中间区的发夹不形成急弯,而是形成环,并且该结构可以称为“茎环”结构。在发夹与茎环之间没有确切的界限。具有较小的环的茎环结构有时称为发夹。
22.本发明是一种改善的从反应混合物中去除过量寡核苷酸或不需要的寡核苷酸的
方法,其不含任何纯化步骤。该方法能够轻松去除或灭活寡核苷酸,只需极少的操作时间或无需操作时间,并且不损失所需的产物。
23.在涉及寡核苷酸混合物的反应中,控制和消除副产物与过量试剂非常重要,因为它们可能作为棘手的副反应中的底物。副反应诸如引物-引物或探针-探针相互作用、脱靶引发和脱靶探针结合通过隔离反应物或消耗反应组分而影响预期反应的动力学。本文所公开的本发明包括使特定的寡核苷酸序列对副反应和脱靶碱基配对呈惰性的方法和组合物。
24.在一些实施例中,本发明包含短寡核苷酸(dna或rna),在此称为“双发夹”(图1)。在涉及要去除未使用的过量寡核苷酸的反应完成后,将双发夹加入反应混合物中。该双发夹寡核苷酸的序列被设计为使得它:1)在其每个末端形成发夹,以及2)在发夹之间具有中间部分,该中间部分与待去除或呈现惰性的寡核苷酸(“靶标寡核苷酸”)结合。当双发夹寡核苷酸加入含有靶标寡核苷酸的混合物中时,靶标寡核苷酸将与双发夹的中间部分退火。一经退火,使用连接酶在双发夹寡核苷酸的5
′
端和3
′
端与靶标寡核苷酸的5
′
端和3
′
端之间均形成共价键,从而形成拓扑环状惰性产物。
25.该环状产物以多种方式使靶标寡核苷酸呈惰性。首先,该连接阻断靶标寡核苷酸的3
′
端在任何引物延伸反应(包括指数扩增反应)中用作引物。其次,碱基与双发夹寡核苷酸配对,防止靶标寡核苷酸与反应混合物中的其他核酸发生碱基配对。
26.本发明涉及一种操作样品的核酸的方法。在一些实施例中,样品获自受试者或患者。在一些实施例中,样品可包括例如通过活检而获自该受试者或患者的固体组织或实体肿瘤的片段。样品还可包括可能含有核酸的体液(例如尿液、痰、血清、血浆或淋巴、唾液、痰、汗液、泪液、脑脊液、羊水、滑液、心包液、腹膜液、胸膜液、囊液、胆汁、胃液、肠液或粪便样品)。样品可包括全血或其中可能存在核酸的血液级分。在其他实施例中,样品为培养样品,例如,含有可以从中分离出核酸的细胞的组织培养物。在一些实施例中,样品中的目的核酸来自感染原,诸如病毒、细菌、原生动物或真菌。在一些实施例中,在涉及待去除的靶标寡核苷酸的程序中使用样品细胞。在其他实施例中,使用从样品中分离出的核酸。
27.在一些实施例中,需要从样品中分离出核酸。dna提取方法在本领域中是已知的。参见j.sambrook等人,molecular cloning:a laboratory manual,1989,第2版,cold spring harbor laboratory press:new york,n.y.。可商购获得各种试剂盒以用于从生物样品中提取核酸(dna或rna)(例如,bd biosciences clontech(palo alto,cal.);epicentre technologies(madison,wisc.);gentra systems,inc.(minneapolis,minn.);以及qiagen,inc.(valencia,cal.);ambion,inc.(austin,tex.);biorad laboratories(hercules,cal.);等等)。
28.在一些实施例中,通过亲和结合进行纯化。在该实施例的变型中,亲和力针对特定靶序列(序列捕获)。在其他实施例中,引物包含亲和标签。可使用本领域已知的任何亲和标签,诸如生物素、抗体或存在特定抗体的抗原。亲和标签的亲和配偶体可以存在于溶液中,例如存在于固相固体支持物(诸如悬浮颗粒或珠粒)上,或与固相支持物结合。
29.在一些实施例中,使用体积排阻色谱、电泳或加速电泳按大小分离核酸并且将纯化。
30.核酸、蛋白质或其他目的标志物可以存在于细胞或反应混合物中,并且可以为检测或定量程序的靶标。如本文所公开,通过去除过量寡核苷酸,检测或定量程序得到改善。
31.每个核酸靶标的特征在于其核酸序列。每个蛋白质靶标的特征在于其氨基酸序列及其由特异性抗体识别的表位。在一些实施例中,靶标核酸含有遗传性变体的基因座,例加,多态性,包括单核苷酸多态性或变型(snv的snp),或导致例如基因融合的基因重排。在一些实施例中,蛋白质生物标志物含有导致形成独特的表位的氨基酸变化。在一些实施例中,靶标核酸或靶蛋白包含生物标志物,即基因或蛋白质抗原,该基因或蛋白质抗原的变体与疾病或病症相关。例如,靶标核酸或靶蛋白可选自于2015年9月10日提交的美国专利申请序列号14/774,518中描述的疾病相关标志物组合。此类组合可作为avenio ctdna分析试剂盒(roche sequencing solutions,pleasanton,cal,)提供。在其他实施例中,靶标核酸或靶蛋白具有特定生物体的特征并有助于识别生物体,或者具有病原生物体的特征,例如药物敏感性或耐药性。在其他实施例中,靶标核酸或靶蛋白具有人受试者的独特特征,例如,界定该受试者的独特hla或kir基因型的hla或kir序列的组合。在其他实施例中,靶标核酸为体细胞序列,例如代表免疫球蛋白(包括igg、igm和iga免疫球蛋白)或t细胞受体序列(tcr)的重排免疫序列。在又一应用中,靶标为存在于母体血液中的胎儿序列,包括胎儿疾病或病症或与妊娠相关的母体病症的特征的胎儿序列。例如,靶标可为zhang等人((2019)non-invasive prenatal sequencing for multiple mendelian monogenic disorders using circulating cell-free fetal dna,nature med.25(3):439)描述的一种或多种常染色体或x连锁疾病。
32.在一些实施例中,靶标为核酸(包括mrna、microrna、病毒rna、细胞dna或包括循环肿瘤dna(ctdna)的无细胞dna(cfdna))。
33.在一些实施例中,靶标为细胞中表达的蛋白质。例如,蛋白质靶标可以为细胞表面蛋白。在一些实施例中,细胞表面蛋白为淋巴细胞表面蛋白,其选自抑制性受体(诸如pdcd1、havrcr2、lag3、cd244、entpd1、cd38、cd101、tigit、ctla4)、细胞表面受体(诸如tnfrsf9、tnfrsf4、klrg1、cd28、icos、il2rb、il7r)或细胞因子受体(诸如cx3cr1、ccl5、ccl4、ccl3、csf1、cxcr5、ccr7、xcl1和cxcl10)。在一些实施例中,蛋白质选自cd4、cd8、cd1l、cd16、cd19、cd20、cd45、cd56和cd279。
34.参考图1,本发明包括一种新颖的组合物,其包含用于从反应混合物中捕获不需要的寡核苷酸的双发夹寡核苷酸(也称为双发夹核酸)。该寡核苷酸包含三部分:在5
′
端的第一发夹;在3
′
端的第二发夹;以及在5
′
端发夹与3
′
端发夹之间的单链区,其中单链区域能够与待去除的寡核苷酸(“靶标寡核苷酸”)杂交。
35.每个发夹由寡核苷酸内的两个序列形成,这两个序列能够彼此形成稳定的杂交体并且在杂交序列之间形成dna(或rna)弯曲。在一些实施例中,一个或两个发夹由彼此完全互补的区形成。在其他实施例中,一个或两个发夹仅由部分互补的序列形成,然而,其形成稳定的发夹。
36.在一些实施例中,双发夹寡核苷酸的发夹区中的一个或两个包含一个或多个修饰的核苷酸,以提高发夹结构的热稳定性(解链温度,tm)。例如,一个或两个发夹部分包括5-甲基胞嘧啶、2,6-二氨基嘌呤、5-羟基丁炔-2
′‑
脱氧尿苷、8-氮杂-7-脱氮鸟苷酸、核糖核苷酸、2
′
o-甲基核糖核苷酸或锁核酸中的一者或多者。
37.在一些实施例中,发夹形成序列为人工序列,任选地为计算机设计的核酸序列。在其他实施例中,发夹形成序列为天然存在的发夹形成序列,其综述于以下文献中:bikard等
人(2010)folded dna in action:hairpin formation and biological functions in prokaryotes,microbiol.mol.biol.review 74(4):570-588;或brazda等人(2011)cruciform structures are a common dna feature important for regulating biological process,bmc mol.biol.12:33。
38.发夹的单链部分被设计成与靶标寡核苷酸形成稳定的杂交体,以使靶标寡核苷酸能够与双发夹寡核苷酸的两个末端连接。本领域的技术人员将理解,稳定的杂交体可以由彼此完全互补以及不完全互补的核酸链形成。在一些实施例中,双发夹寡核苷酸的单链区与靶标寡核苷酸部分互补。在一些实施例中,双发夹寡核苷酸的单链区与靶标寡核苷酸完全互补。在一些实施例中,双发夹寡核苷酸的单链区的一部分与靶标寡核苷酸完全互补。在一些实施例中,单链区的5
′
端相邻部分和3
′
端相邻部分与靶标寡核苷酸的3
′
端相邻部分和5
′
端相邻部分完全互补,而单链区的中间部分与靶标寡核苷酸的中间部分不互补或仅部分互补。
39.在一些实施例中,未折叠的双发夹寡核苷酸的长度在约40个至约200个核苷酸之间。发夹形成序列的长度在约9个至约40个核苷酸之间。虽然两个发夹区中的任一者均不存在规定的长度,但希望这两个发夹区的长度足以确保发夹在反应混合物中的稳定性。本领域的技术人员可利用各种工具来预测核酸双链体在各种温度和盐条件下的稳定性(解链温度,tm)。单链区为适应靶标寡核苷酸而经过定制。寡核苷酸包括引物、探针和衔接子,其长度通常在10个至100个核苷酸之间,大多数长度在20个至50个核苷酸之间。因此,双发夹寡核苷酸的单链区的长度在约10个至约100个核苷酸的范围内,其长度最常在20个至50个核苷酸之间。
40.在一些实施例中,本发明是一种从反应混合物中去除过量寡核苷酸或不需要的寡核苷酸(“靶标寡核苷酸”)的方法。该方法包括使含有靶标寡核苷酸的反应混合物与包含单核酸链的双发夹核酸接触,该单核酸链具有:在5
′
端的第一发夹;在3
′
端的第二发夹;以及在5
′
端与3
′
端之间的单链区。单链区包含能够与靶标寡核苷酸杂交的序列。
41.加入双发夹寡核苷酸,其浓度经计算超过待去除的靶标寡核苷酸的浓度,以确保有利的杂交动力学。本领域的技术人员将理解,在一些情况下,双发夹寡核苷酸的最佳摩尔浓度可预先计算得出,而在其他情况下,双发夹寡核苷酸的最佳摩尔浓度通过滴定双发夹寡核苷酸由实验确定。本发明的一个明显的优势是,双发夹寡核苷酸被设计成与靶标寡核苷酸相互作用,而不与反应混合物中的任何其他核酸相互作用。
42.在一些实施例中,将反应混合物置于在靶标寡核苷酸与双发夹寡核苷酸之间形成杂交体的最佳温度下孵育。在一些实施例中,退火温度在40℃至72℃的范围内。在一些实施例中,杂交步骤和连接步骤中的一者或两者发生在环境温度下。
43.在一些实施例中,在靶标寡核苷酸与双发夹寡核苷酸之间形成杂交体所需的时间内孵育反应。在一些实施例中,该时间为5至15分钟。
44.在一些实施例中,去除单个靶标寡核苷酸并且加入单个双发夹寡核苷酸。在其他实施例中,去除多个靶标寡核苷酸并且加入多个双发夹寡核苷酸的混合物。
45.在靶标寡核苷酸与双发夹寡核苷酸的单链区退火后,使反应混合物与连接酶接触。存在连接酶以用于同时连接dna和rna,并且将适应dna和rna双发夹寡核苷酸以及靶标寡核苷酸两者。使用适合于双发夹寡核苷酸和靶标寡核苷酸中的核酸类型的连接酶。将靶
标寡核苷酸的两个末端均连接至双发夹寡核苷酸(图1)。
46.在一些实施例中,连接酶和连接酶辅因子以及底物(例如,atp)由于上游过程已经发生而存在于反应混合物中。在此类实施例中,不加入额外的连接酶或连接酶辅因子以去除靶标寡核苷酸。在其他实施例中,加入连接酶和连接酶辅因子。
47.在一些实施例中,靶标寡核苷酸和双发夹寡核苷酸两者均含有5
′‑
磷酸基团。在其他实施例中,靶标寡核苷酸和双发夹寡核苷酸中的一者或两者缺乏5
′‑
磷酸基团。在此类实施例中,使反应混合物与多核苷酸激酶(pnk)和任何必要的辅因子(例如,atp)接触,并且将5
′
端磷酸化以使连接能够发生。
48.在一些实施例中,在涉及反应混合物耗尽靶标寡核苷酸的下游步骤之前,将酶(例如,连接酶和多核苷酸激酶)去除或灭活(例如,热灭活)。
49.本领域的技术人员将理解,关于靶标寡核苷酸的术语“去除”包括靶标寡核苷酸的所有形式的灭活。如果靶标寡核苷酸不再能够与反应混合物中的任何核酸杂交,并且不再能够引发核酸合成,则寡核苷酸从反应混合物中被有效地去除。因此,将靶标寡核苷酸隔离在由双发夹寡核苷酸和靶标寡核苷酸形成的双链共价闭合拓扑环状核酸内(图1,底部)构成从反应混合物中去除靶标寡核苷酸。
50.在一些实施例中,本发明是一种改善的通过聚合酶链式反应(pcr)进行核酸扩增的方法。如美国专利号4,683,195中详细描述的,聚合酶链式反应(pcr)涉及使包含核酸的样品溶液与正向引物、反向引物、核酸聚合酶(优选为热稳定的聚合酶)和核酸前体(诸如能够通过核酸聚合酶掺入的dntp或dntp类似物)接触。反应混合物经受热循环曲线处理,其包括多个循环,包括dna变性步骤(90℃或更高)、任选的引物退火步骤(45℃至72℃)和聚合酶延伸步骤(65℃至72℃)。在一些实施例中,pcr为实时pcr,包括荧光标记的检测探针,如美国专利5,804,375中所述。在现有技术方案中,在扩增反应已经完成后,反应混合物经受纯化步骤(诸如spri珠粒净化)处理,以去除过量引物。本发明省去了纯化步骤。
51.在一些实施例中,在扩增反应完成后,使反应混合物与本文所述的新型双发夹寡核苷酸接触。在一些实施例中,靶标寡核苷酸为正向引物与反向引物的混合物。在一些实施例中,靶标寡核苷酸混合物还包括检测探针。双发夹寡核苷酸为两种或三种寡核苷酸的组合。第一双发夹寡核苷酸包括与正向扩增引物互补的中间区。第二双发夹寡核苷酸包括与反向扩增引物互补的中间区。还可以存在靶向检测探针的第三双发夹寡核苷酸。第三双发夹寡核苷酸包括与检测探针互补的中间区。将过量引物和探针(如果存在)连接至相应的双发夹寡核苷酸以形成闭合环状结构。
52.在一些实施例中,在连接之前,使反应混合物与多核苷酸激酶(pnk)和任何必要的辅因子和底物(例如,atp)接触,将正向引物和反向引物以及(如果存在)探针的5
′
端磷酸化,以使连接能够发生。
53.在一些实施例中,双发夹寡核苷酸用于所有三种靶标寡核苷酸:正向引物、反向引物和探针。在其他实施例中,双发夹寡核苷酸仅用于三种靶标寡核苷酸中的一种或两种。
54.在将过量引物以及(如果存在)过量探针隔离在闭合环状结构中之后,可立即进行下游步骤。
55.在一些实施例中,本发明是一种改善的通过连接酶链式反应(lcr)进行核酸扩增的方法。如美国专利号6,312,892中详细描述的,连接酶链式反应(lcr)涉及使包含核酸的
样品溶液与包含第一寡核苷酸探针和第二寡核苷酸探针的探针组(能够与核酸模板相邻杂交的探针)以及连接酶(优选为热稳定的连接酶)接触。反应混合物经受热循环曲线处理,其包括多个循环,包括dna变性步骤(90℃或更高)、任选的探针退火步骤(45℃至65℃)和连接步骤(65℃或更低)。在现有技术方案中,在扩增反应已经完成后,反应混合物经受纯化步骤(例如spri珠粒净化)处理,以去除过量探针。本发明省去了纯化步骤。
56.在一些实施例中,在扩增反应完成后,使反应混合物与本文所述的新型双发夹寡核苷酸接触。在一些实施例中,靶标寡核苷酸为第一探针与第二探针的混合物。双发夹寡核苷酸为两种寡核苷酸的组合。第一双发夹寡核苷酸包括与第一探针互补的中间区。第二双发夹寡核苷酸包括与第二探针互补的中间区。方便地,连接酶和所有必要的辅因子已经存在于反应混合物中。将过量探针连接至相应的双发夹寡核苷酸以形成闭合环状结构。
57.在一些实施例中,在连接之前,使反应混合物与多核苷酸激酶(pnk)和任何必要的辅因子和底物(例如,atp)接触,将探针的5
′
端磷酸化,以使连接能够发生。
58.在一些实施例中,双发夹寡核苷酸用于两个探针。在其他实施例中,双发夹寡核苷酸仅用于两个探针中的一者。
59.在将过量引物以及(如果存在)探针隔离在闭合环状结构中之后,可立即进行下游步骤。
60.在一些实施例中,本发明是一种改善的执行量子条形码编码(qbc)(一种检测多个单细胞中的多个靶标的方法,如美国专利10,144,950所述)的方法。该方法包括制备细胞悬液。接下来,使细胞与独特的结合试剂(例如,dna探针或rna探针(包括适体)或抗体)接触。探针或抗体包含至少一个与靶标特异性相互作用的部分或元件以及允许组装组合核酸条形码的元件。在一些实施例中,测定为多重测定,其中使用相同或不同种类的多个不同的结合试剂(例如,多个不同的核酸探针,或多个不同的抗体,或核酸探针和抗体的组合)检测单一反应混合物中多个细胞中的多种靶分子。如果独特的结合试剂在抗体中,则该抗体可以包含有利于组装条形码的接头寡核苷酸。将核酸附接至抗体的方法是已知的,例如:gullberg等人,pnas 101(22),第228420-8424页(2004);boozer等人,analytical chemistry,76(23),第6967-6972页(2004);或kozlov等人,biopolymers 5:73(5),第621-630页(2004)。如果独特的结合试剂为核酸探针,则可以将条形码直接附接至探针。
61.在独特的结合试剂与其靶标结合后,具有结合探针或抗体的细胞经受裂池条形码组装(如美国专利10,144,950所详述,其通过引用并入本文)。将独特的细胞来源的代码组装到其中已结合独特的结合试剂的每个细胞上。独特的细胞条形码是通过逐步加入亚基而由亚基组装的模块化结构。每个亚基包含条形码和附接区,该附接区用于将亚基连接至不断增长的独特的细胞条形码。亚基通过附接区(例如,互补核酸序列)彼此连接或连接至通用主链。该附接区可包含与主链杂交或与相邻亚基杂交以及与相邻亚基连接中的一者或两者。在独特的细胞条形码已经组装后,将它们从细胞中分离出来并且进行检测。例如,对独特的细胞条形码进行扩增和测序。
62.在本发明的一个实施例中,在扩增步骤之前,使含有独特条形码的反应混合物与本文所述的新型双发夹寡核苷酸接触。靶标寡核苷酸为多个条形码亚基的混合物。双发夹寡核苷酸被设计成结合混合物中的一个或多个(包括所有)条形码亚基。在一些实施例中,双发夹寡核苷酸的单链部分包括两个能够与条形码亚基的退火区域杂交的区,这两个区侧
接具有条形码亚基中包含的子码的长度的单个中间区。由于子码在条形码亚基中变化,因此双发夹寡核苷酸的中间区被设计成适应该多样性。在一些实施例中,双发夹寡核苷酸的中间区为长度对应于子码的长度的非核苷酸间隔物,或为含有核酸的肌苷(肌苷核苷酸的数量对应于子码中的核苷酸数量)。
63.在一些实施例中,条形码亚基寡核苷酸能够被连接成独特的条形码,即已经方便地包含5
′‑
磷酸酯。此外,在此类实施例中,活性连接酶已经方便地存在于反应混合物中。在此类实施例中,反应混合物仅与双发夹寡核苷酸接触。
64.在其他实施例中,利用不同于连接的方法将条形码亚基加入到独特的条形码中(参见例如,其中通过聚合酶复制条形码的实施例,参见于2019年1月19日提交的美国专利申请序列号16/250,974)。在此类实施例中,使反应混合物与双发夹寡核苷酸接触并且进一步与连接酶接触。如果条形码亚基缺乏5
′‑
磷酸酯,则使反应混合物进一步接触多核苷酸激酶(pnk)。在一些实施例中,使反应混合物与atp(激酶和连接酶所必需的辅因子)接触。
65.将过量条形码亚基连接至双发夹寡核苷酸,以形成闭合环状结构。在将过量条形码亚基寡核苷酸隔离在闭合环状结构后,可立即进行扩增。条形码寡核苷酸不再能够例如通过用作扩增引物来干扰核酸扩增。
66.尤其有利的是,借助本发明,在扩增之前无需纯化步骤。量子条形码编码(qbc)是一种单细胞分析方法,其中每个独特的细胞条形码代表单个细胞。因此,单个独特细胞条形码分子的丢失代表有价值的数据点的丢失。借助本文所述的方法,在去除过量条形码亚基后,可立即进行下游分析步骤。
67.在一些实施例中,本发明是一种改善的形成用于核酸测序的文库的方法。在该实施例中,将样品中的核酸连接至衔接子,并且在下游处理文库之前去除过量衔接子。
68.在一些实施例中,该方法包括在连接衔接子之前处理样品中的核酸。样品核酸可能已经是平端的或可以通过酶处理(例如,“端修复”)而被赋予平端。在其他实施例中,平端dna经历a加尾,其中单个a核苷酸被加入到一个或两个平端的3
′
端。衔接子可以是双链或部分双链短核酸,其具有一个钝端,单个t核苷酸从该钝端延伸,以促进样品核酸与衔接子之间的连接。用于进行端修复、a加尾和衔接子连接的可商购获得的试剂盒包括avenio ctdna文库制备试剂盒或kapa hyperprep和hyperplus试剂盒(roche sequencing solutions,pleasanton,cal.)。
69.在一些实施例中,本发明包括一种新颖的步骤,该步骤通过将过量衔接子隔离在通过连接至本文所述的双发夹寡核苷酸所形成的闭合环状结构内,从文库形成反应中去除过量衔接子。靶标寡核苷酸包括衔接子的两条链。双发夹是两种双发夹寡核苷酸的组合。第一双发夹寡核苷酸包含与衔接子的第一链互补的中间区,而第二双发夹寡核苷酸包含与衔接子的第二链互补的中间区。
70.在一些实施例中,该方法进一步包括以下步骤:在足以分离衔接子的链但不足以分离文库核酸或双发夹寡核苷酸中的发夹结构的升高的温度下孵育包含文库和过量衔接子的反应混合物。为促进该方法的这一步骤,双发夹寡核苷酸可包含提高发夹的解链温度(tm)的经修饰的核苷酸。例如,一个或两个发夹部分包括5-甲基胞嘧啶、2,6-二氨基嘌呤、5-羟基丁炔-2
′‑
脱氧尿苷、8-氮杂-7-脱氮鸟苷酸、核糖核苷酸、2
′
o-甲基核糖核苷酸或锁核酸中的一者或多者。
71.在一些实施例中,还使反应混合物与多核苷酸激酶接触,将衔接子的5
′
端磷酸化。
72.本发明的方法接下来包括将衔接子链连接至双发夹寡核苷酸的步骤。该方法可进一步包括扩增文库或使文库经受靶标捕获的步骤。在下游扩增或靶标捕获步骤之前,无需纯化步骤。
73.本发明的过量寡核苷酸去除方法不限于上文具体所述的示例性应用,而是可用于任何涉及使用寡核苷酸并且其中需要去除过量寡核苷酸的诊断、预后、治疗、患者分层、药物开发、治疗选择和筛选过程中。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1