用于防治无脊椎动物害虫的杂环化合物的制作方法
烷基、c
1-c3卤代烷基、c
1-c4烷氧基、c
1-c3卤代烷氧基、s(o)
m-c
1-c6烷基、s(o)
m-c
3-c6环烷基、s(o)
m-c
1-c3卤代烷基、s(o)
m-苯基、nr
12r13
、nr
12
co-c
1-c4烷基、nhco-苯基、co
2-c
1-c4烷基、conr
12r13
、conr
12
(c
3-c6环烷基)、c(=no-c
1-c4烷基)r
12
;苯基和5-6员杂芳基,其中芳环未被取代或者被1-2个卤素和/或cn取代;r5基团未被取代或者被r
11
部分或完全取代;
19.存在于同一碳原子上的两个r5可以一起形成基团=o、=s、=nh、=n(c
1-c6烷基)、=no(c
1-c6烷基)、=nn(h)(c
1-c6烷基)或=nn(c
1-c6烷基)2。
20.本发明还提供了一种农业组合物,包含至少一种式i化合物、其立体异构体和/或其可农用盐以及至少一种液体和/或固体载体,尤其是至少一种惰性液体和/或固体可农用载体。
21.本发明还提供了一种兽用组合物,包含至少一种式i化合物、其立体异构体和/或其可兽用盐以及至少一种液体和/或固体载体,尤其是至少一种惰性液体和/或固体可兽用载体。
22.本发明还提供了一种防治无脊椎动物害虫的方法,该方法包括用杀害虫有效量的如本文所定义的式i化合物或其盐处理害虫、其食物供应源、其栖息地或其繁殖地或者其中害虫生长或可能生长的栽培植物、植物繁殖材料(如种子)、土壤、区域、材料或环境或者待保护以防害虫侵袭或侵染的材料、栽培植物、植物繁殖材料(如种子)、土壤、表面或空间。
23.本发明还涉及包含至少一种式i化合物和/或其可农用盐的植物繁殖材料,尤其是种子。
24.本发明进一步涉及一种处理或保护动物以防寄生虫侵染或感染的方法,包括使动物与杀寄生虫有效量的式i化合物或其可兽用盐接触。使动物与化合物i、其盐或本发明兽用组合物接触是指将其施用或给药于动物。
25.wo2017/192385、wo2019/197468、wo2019/202077、wo2019/201835、wo2019/206799、wo2020/002563和wo2020/212235描述了结构紧密相关的活性化合物。提到这些化合物可以用于防除无脊椎动物害虫。
26.然而,仍然需要对于防除无脊椎动物害虫高度有效和多功能试剂。因此,本发明的目的是要提供对大量不同的无脊椎动物害虫,尤其是对难以防治的害虫如昆虫具有良好杀害虫活性且显示出宽活性谱的化合物。
27.已经发现这些目的可以由如下所示和所定义的式i化合物及其立体异构体、盐、互变异构体和n-氧化物,尤其是其可农用盐实现。
28.化合物i可以通过化合物ii用合适的烷基化剂iii(例如卤代烷)烷基化来获得。在式iii中,r1具有如式i中的含义,并且x是亲核离去基团,例如卤化物,优选br或cl。烷基化可以在文献已知的标准条件下进行。
[0029][0030]
这种转变通常在-10℃至+110℃,优选0-25℃的温度下,在惰性溶剂中,在碱的存在下进行[参见wo2002100846]。
[0031]
起始材料通常以等摩尔量相互反应。就产量而言,使用基于ii的过量iii可能是有
利的。
[0032]
化合物ii可以通过还原式iv的亚胺获得。还原可以在文献已知的标准条件下进行。
[0033][0034]
这种转变通常在-20℃至120℃,优选0-60℃的温度下,在惰性溶剂中,在还原剂存在下进行[参见wo2016/201096]
[0035]
合适的还原剂是例如碱金属硼氢化物如nabh4、nabh(oac)3、nabh3cn等。合适的溶剂是醇类如甲醇、乙醇、正丙醇、异丙醇、正丁醇和叔丁醇;或芳烃如甲苯,邻、间和对二甲苯;或卤代烃如二氯甲烷、1,2-二氯乙烷、氯仿和氯苯;或醚类如1,4-二烷和四氢呋喃(thf),也可以使用上述溶剂的混合物。还原剂通常以等摩尔量使用。就产率而言,使用基于iv的过量还原剂可能是有利的。
[0036]
式iv化合物可以通过酮v与式vi的胺在文献已知的条件下反应获得。
[0037][0038]
这种转变通常在25-220℃,优选60-150℃的温度下,在惰性溶剂中,在酸“hj”的存在下进行[参见wo2016/201096]。
[0039]
合适的溶剂是例如芳烃如甲苯,邻、间和对二甲苯;或醇类如甲醇、乙醇、正丙醇、异丙醇、正丁醇和叔丁醇;或腈类如乙腈和丙腈;或醚类如1,4-二烷和thf;或卤代烃类如二氯甲烷、氯仿和氯苯。也可以使用上述溶剂的混合物。合适的酸和酸性催化剂通常是有机酸,例如羧酸如甲酸、乙酸、丙酸、草酸和三氟乙酸;或磺酸如甲磺酸、甲苯磺酸、苯磺酸、樟脑磺酸和三氟甲磺酸;或路易斯酸如乙醇钛(iv)、异丙醇钛(iv)、氯化钛(iv)、三氟化硼和氯化锌(ii);或无机酸如硫酸和盐酸。酸通常以催化量使用;然而,它们也可以等摩尔量、过量使用,或者合适的话用作溶剂。本领域技术人员还应理解,在反应过程中形成的水可以通过迪安-斯达克分水器或干燥剂如例如mgso4或分子筛连续除去。起始材料通常以等摩尔量相互反应。就产率而言,使用基于v的过量胺vi可能是有利的。
[0040]
式v化合物可以在文献已知的条件下通过咪唑或三唑衍生物vi与碱反应,然后与式vii的酰化剂r
2-c(=o)y反应获得,其中y是合适的离去基团,例如卤素、n(ch3)2、nch3(och3)、烷氧基等。
[0041][0042]
这种转变通常在-100℃至80℃,优选-78℃至40℃的温度下,在惰性溶剂中,在碱的存在下进行[参见wo2014/100163,chemical communications,2016,第52卷,第10183-10186页]。
[0043]
合适的溶剂是脂肪烃如戊烷、己烷、环己烷和石油醚;或芳烃如甲苯,邻、间和对二甲苯;或醚类如乙醚、二异丙醚、叔丁基甲基醚(mtbe)和thf;或卤代烃如二氯甲烷、氯仿和氯苯;或腈类如乙腈和丙腈。也可以使用上述溶剂的混合物。合适的碱通常是有机碱,例如碱金属烷基碱,例如n-buli;或碱金属和碱土金属酰胺,例如二异丙基氨基锂、双(三甲基甲硅烷基)氨基锂、四甲基哌啶锂和ipr2nmgcl
·
licl;或叔胺,例如三甲胺、三乙胺、二异丙基乙胺和n-甲基哌啶、吡啶、取代的吡啶如可力丁、卢剔啶和4-二甲氨基吡啶,以及双环胺。碱通常以等摩尔量使用;然而,它们也可以过量使用,或者合适的话用作溶剂。起始材料通常以等摩尔量相互反应。就产量而言,使用基于vi过量的vii可能是有利的。式vi化合物可市购,或可如文献中所述或类似于合成实施例制备。
[0044]
或者,酮v可由化合物viii获得,其中x
#
是离去基团如卤素,通过将其与亚砜如二甲亚砜(dmso)反应;或合适的n-氧化物,例如三甲胺n-氧化物或吡啶n-氧化物,在文献已知条件下的kornblum氧化中。
[0045][0046]
这种转变通常在25-220℃,优选25-120℃的温度下,在惰性溶剂中,在碱的存在下进行[参见jp2019/34892、wo2006/110804]。
[0047]
合适的溶剂是dmso、二甲基甲酰胺(dmf)和二甲基乙酰胺(dma);或腈类如乙腈和丙腈;或醚类如1,4-二烷和thf;或卤代烃如二氯甲烷和氯仿;或水。也可以使用上述溶剂的混合物。合适的碱一般是无机化合物,例如碱金属和碱土金属碳酸盐,例如li2co3、k2co3、cs2co3和caco3;或碱金属碳酸氢盐,例如碳酸氢钠;或有机碱,例如叔胺,例如三甲胺、三乙胺、二异丙基乙胺和n-甲基哌啶、吡啶、取代的吡啶如三甲基吡啶、二甲基吡啶,以及双环胺。亚砜或n-氧化物通常过量使用;然而,合适的话它也可以用作溶剂。
[0048]
式viii化合物可以如文献[参见wo2017/192385、wo2019/197468、wo2019/202077、wo2019/201835、wo2019/206799、wo2020/002563]中所述制备。
[0049]
或者,化合物i可以通过还原中间形成的亚胺化合物ix直接获得,而后者又可以通过与式x的胺q-nhr1反应由酮v获得。反应条件类似于上述分别将化合物v转化为式iv化合物,然后转化为ii的反应条件。j-是所用酸hj的阴离子。
[0050][0051]
此外,化合物i也可以通过亲核芳族取代或布赫瓦尔德-哈特维希反应由式xi的胺与卤化物xii获得,其中x
*
是离去基团如卤素或三氟甲磺酸根。
[0052][0053]
亲核芳族取代反应通常在-20℃至180℃,优选25-100℃的温度下,在惰性溶剂中,
并在碱存在下进行[参见wo2010/100189]。
[0054]
合适的溶剂是例如dmso、dmf和dma;或腈类如乙腈和丙腈;或醚类如1,4-二烷和thf;或芳烃如甲苯,邻、间和对二甲苯;或醇类如甲醇、乙醇、正丙醇、异丙醇、正丁醇和叔丁醇;或水。合适的碱通常是无机化合物,例如碱金属和碱土金属碳酸盐,例如li2co3、k2co3、cs2co3和caco3;或碱金属和碱土金属氢化物,例如lih、nah、kh和cah2;或有机碱,例如叔胺,例如三甲胺、三乙胺、二异丙基乙胺和n-甲基哌啶、吡啶、取代的吡啶如可力丁、卢剔啶和4-二甲氨基吡啶,以及双环胺;或碱金属醇盐如叔丁醇钾。碱通常以等摩尔量使用;然而,它们也可以过量使用,或者合适的话用作溶剂。起始材料通常以等摩尔量相互反应。就产率而言,基于xi使用过量的xii可能是有利的。
[0055]
布赫瓦尔德-哈特维希反应通常在25-220℃,优选50-150℃的温度下,在惰性溶剂中,在钯催化剂和碱的存在下进行[参见wo2016/168059]。
[0056]
合适的溶剂是例如芳烃如甲苯,邻、间和对二甲苯;或醚类如1,4-二烷和thf;或腈类如乙腈和丙腈;或极性非质子溶剂如dmso、dmf、dma和n-甲基-2-吡咯烷酮(nmp)。
[0057]
合适的钯催化剂是例如pd(oac)2/pph3、pd(oac)
2/
2,2'-双(二苯基膦)-1,1'-联萘(binap)、pd(oac)2/4,5-双(二苯基膦)-9,9-二甲基呫吨(xantphos)、二氯[9,9-二甲基-4,5-双(二苯基膦基)呫吨]钯(ii)、[1,1'-双(二苯基膦基)二茂铁]二氯钯(ii)、(1,3-双(二苯基膦基)丙烷)氯化钯(ii)、反式-双(乙酰)双[邻-(二-邻-甲苯基膦基)苄基]二钯(ii)等。
[0058]
合适的碱通常是无机化合物,例如碱金属和碱土金属碳酸盐如li2co3、k2co3、cs2co3和caco3;或碱金属磷酸盐如k3po4;或有机碱如叔胺,例如三乙胺、二异丙基乙胺、n-甲基哌啶、n-甲基-n,n-二环己胺和1,4-二氮杂-双环[2.2.2]辛烷;或脒类如1,8-二氮杂双环[5.4.0]十一碳-7-烯;或碱金属醇化物如叔丁醇钠;或碱金属氨基化物如双(三甲基甲硅烷基)氨基锂(lihmds)。碱通常以等摩尔量使用;然而,它们也可以过量使用,或者合适的话用作溶剂。
[0059]
起始材料通常以等摩尔量相互反应。就产率而言,使用基于xii的过量xi可能是有利的。
[0060]
式xi的胺可以如[参见wo2017/192385、wo2019/197468、wo2019/202077、wo2019/201835、wo2019/206799和wo2020/002563]所述制备。式xii的卤化物可市购,可以如文献中所述或与合成实施例类似的方法制备。
[0061]
反应混合物以常规方式后处理,例如通过与水混合、分离各相并且合适的话通过层析提纯粗产物。一些中间体和终产物以无色或浅棕色粘稠油形式得到,将它们在减压和温和升高的温度下提纯或除去挥发性组分。若中间体和终产物以固体得到,则可以通过重结晶或蒸煮进行提纯。
[0062]
如果单个化合物i不能通过上述途径获得,它们可以通过衍生其他化合物i来制备。
[0063]
然而,若合成得到异构体混合物,则通常不一定要求分离,因为在某些情况下各异构体可能在为了应用的后处理过程中或在施用过程中(例如在光、酸或碱的作用下)相互转化。该类转化也可以在使用后发生,例如在植物处理的情况下在被处理的植物中,或者在待
防治害虫中。
[0064]
在各变量的上述定义中提到的有机结构部分基团像术语卤素一样为各基团成员的各次列举的集合性术语。前缀c
n-cm在每种情况下表示该基团中可能的碳原子数。
[0065]
术语被基团“部分或完全取代”是指通常该基团被相同或不同的基团取代。
[0066]
术语“卤素”在每种情况下表示氟、溴、氯或碘,尤其是氟、氯或溴。
[0067]
本文以及在烷基氨基、烷基羰基、烷硫基、烷基亚磺酰基、烷基磺酰基和烷氧基烷基的烷基结构部分中所用术语“烷基”在每种情况下表示通常具有1-10个碳原子,常常是1-6个碳原子,优选1-4个碳原子,更优选1-3个碳原子的直链或支化烷基。烷基的实例是甲基(me)、乙基(et)、正丙基(n-pr)、异丙基、正丁基、2-丁基、异丁基、叔丁基、正戊基、1-甲基丁基、2-甲基丁基、3-甲基丁基、2,2-二甲基丙基、1-乙基丙基、正己基、1,1-二甲基丙基、1,2-二甲基丙基、1-甲基戊基、2-甲基戊基、3-甲基戊基、4-甲基戊基、1,1-二甲基丁基、1,2-二甲基丁基、1,3-二甲基丁基、2,2-二甲基丁基、2,3-二甲基丁基、3,3-二甲基丁基、1-乙基丁基、2-乙基丁基、1,1,2-三甲基丙基、1,2,2-三甲基丙基、1-乙基-1-甲基丙基和1-乙基-2-甲基丙基。
[0068]
本文以及在卤代烷基羰基、卤代烷氧羰基、卤代烷硫基、卤代烷基磺酰基、卤代烷基亚磺酰基、卤代烷氧基和卤代烷氧基烷基的卤代烷基结构部分中所用术语“卤代烷基”在每种情况下表示通常具有1-10个碳原子,常常是1-6个碳原子,优选1-4个碳原子的直链或支化烷基,其中该基团的氢原子部分或全部被卤原子替代。优选的卤代烷基结构部分选自c
1-c4卤代烷基,更优选c
1-c3卤代烷基或c
1-c2卤代烷基,尤其是c
1-c2氟烷基如氟甲基、二氟甲基、三氟甲基、1-氟乙基、2-氟乙基、2,2-二氟乙基、2,2,2-三氟乙基、五氟乙基等。
[0069]
本文所用术语“烷氧基”在每种情况下表示经由氧原子键合且通常具有1-10个碳原子,常常是1-6个碳原子,优选1-4个碳原子的直链或支化烷基。烷氧基的实例是甲氧基、乙氧基、正丙氧基、异丙氧基、正丁氧基、2-丁氧基、异丁氧基、叔丁氧基等。
[0070]
本文所用术语“烷氧基烷基”涉及通常包含1-10个,常常是1-4个,优选1-2个碳原子的烷基,其中1个碳原子带有如上所定义的通常包含1-4个,优选1或2个碳原子的烷氧基。实例是ch2och3、ch
2-oc2h5、2-甲氧基乙基和2-乙氧基乙基。
[0071]
本文所用术语“卤代烷氧基”在每种情况下表示具有1-10个碳原子,常常是1-6个碳原子,优选1-4个碳原子的直链或支化烷氧基,其中该基团的氢原子部分或完全被卤原子,尤其是氟原子替代。优选的卤代烷氧基结构部分包括c
1-c4卤代烷氧基,尤其是c
1-c2氟烷氧基,如氟甲氧基、二氟甲氧基、三氟甲氧基、1-氟乙氧基、2-氟乙氧基、2,2-二氟乙氧基、2,2,2-三氟乙氧基、2-氯-2-氟乙氧基、2-氯-2,2-二氟乙氧基、2,2-二氯-2-氟乙氧基、2,2,2-三氯乙氧基、五氟乙氧基等。
[0072]
本文所用术语“烷硫基”(烷基硫基:烷基-s-)涉及经由硫原子连接的具有1-10个碳原子,优选1-4个碳原子(=c
1-c4烷硫基),更优选1-3个碳原子的直链或支化饱和烷基。
[0073]
本文所用术语“卤代烷硫基”涉及如上所述的烷硫基,其中氢原子部分或完全被氟、氯、溴和/或碘替代。
[0074]
本文所用术语“烷基亚磺酰基”(烷基亚硫酰基:c
1-c6烷基-s(=o)-)涉及通过亚磺酰基的硫原子在烷基中的任意位置键合的具有1-10个碳原子,优选1-4个碳原子(=c
1-c4烷基亚磺酰基),更优选1-3个碳原子的直链或支化饱和烷基(如上所述)。
[0075]
本文所用术语“卤代烷基亚磺酰基”涉及如上所述的烷基亚磺酰基,其中氢原子部分或完全被氟、氯、溴和/或碘替代。
[0076]
本文所用术语“烷基磺酰基”(烷基-s(=o)
2-)涉及通过磺酰基的硫原子在烷基中的任意位置键合的具有1-10个碳原子,优选1-4个碳原子(=c
1-c4烷基磺酰基),优选1-3个碳原子的直链或支化饱和烷基。
[0077]
本文所用术语“卤代烷基磺酰基”涉及如上所述的烷基磺酰基,其中氢原子部分或完全被氟、氯、溴和/或碘替代。
[0078]
术语“烷基羰基”涉及如上所定义的烷基,其经由羰基(c=o)的碳原子与该分子的其余部分键合。
[0079]
术语“卤代烷基羰基”涉及如上所述的烷基羰基,其中氢原子部分或完全被氟、氯、溴和/或碘替代。
[0080]
术语“烷氧羰基”涉及如上所定义的烷基羰基,其经由氧原子与该分子的其余部分键合。
[0081]
术语“卤代烷氧羰基”涉及如上所述的烷氧羰基,其中氢原子部分或完全被氟、氯、溴和/或碘替代。
[0082]
本文所用术语“链烯基”在每种情况下表示通常具有2-10个,常常是2-6个,优选2-4个碳原子的单不饱和烃基,例如乙烯基、烯丙基(2-丙烯-1-基)、1-丙烯-1-基、2-丙烯-2-基、甲代烯丙基(2-甲基丙-2-烯-1-基)、2-丁烯-1-基、3-丁烯-1-基、2-戊烯-1-基、3-戊烯-1-基、4-戊烯-1-基、1-甲基丁-2-烯-1-基、2-乙基丙-2-烯-1-基等。
[0083]
本文所用术语“卤代链烯基”涉及如上所定义的链烯基,其中氢原子部分或完全被卤原子替代。
[0084]
本文所用术语“炔基”在每种情况下表示通常具有2-10个,常常是2-6个,优选2-4个碳原子的单不饱和烃基,例如乙炔基、炔丙基(2-丙炔-1-基)、1-丙炔-1-基、1-甲基丙-2-炔-1-基、2-丁炔-1-基、3-丁炔-1-基、1-戊炔-1-基、3-戊炔-1-基、4-戊炔-1-基、1-甲基丁-2-炔-1-基、1-乙基丙-2-炔-1-基等。
[0085]
本文所用术语“卤代炔基”涉及如上所定义的炔基,其中氢原子部分或完全被卤原子替代。
[0086]
本文以及在环烷氧基和环烷硫基的环烷基结构部分中所用术语“环烷基”在每种情况下表示通常具有3-10个或3-6个碳原子的单环脂环族基团,如环丙基(c-c3h5)、环丁基、环戊基、环己基、环庚基、环辛基、环壬基和环癸基,或环丙基、环丁基、环戊基和环己基。
[0087]
本文以及在卤代环烷氧基和卤代环烷硫基的卤代环烷基结构部分中所用术语“卤代环烷基”在每种情况下表示通常具有3-10个碳原子或3-6个碳原子的单环脂环族基团,其中至少一个,例如1、2、3、4或5个氢原子被卤素,尤其是被氟或氯替代。实例是1-和2-氟环丙基,1,2-、2,2-和2,3-二氟环丙基,1,2,2-三氟环丙基,2,2,3,3-四氟环丙基,1-和2-氯环丙基,1,2-、2,2-和2,3-二氯环丙基,1,2,2-三氯环丙基,2,2,3,3-四氯环丙基,1-、2-和3-氟环戊基,1,2-、2,2-、2,3-、3,3-、3,4-、2,5-二氟环戊基,1-、2-和3-氯环戊基,1,2-、2,2-、2,3-、3,3-、3,4-、2,5-二氯环戊基等。
[0088]
本文以及在卤代环烯氧基和卤代环烯硫基的卤代环烯基结构部分中所用术语“卤代环烯基”在每种情况下表示通常具有3-10个,例如3或4个或者5-10个碳原子,优选3-8个
碳原子的单环单不饱和非芳族基团,其中至少一个,例如1、2、3、4或5个氢原子被卤素,尤其是被氟或氯替代。实例是3,3-二氟环丙烯-1-基和3,3-二氯环丙烯-1-基。
[0089]
术语“环烯基烷基”涉及经由烷基,如c
1-c5烷基或c
1-c4烷基,尤其是甲基(=环烯基甲基)与该分子的其余部分键合的如上所定义的环烯基。
[0090]
术语“碳环”或“碳环基”通常包括包含3-12个,优选3-8个或5-8个,更优选5或6个碳原子的3-12员,优选3-8员或5-8员,更优选5或6员单环非芳族环。优选术语“碳环”覆盖如上所定义的环烷基和环烯基。
[0091]
术语“杂环”或“杂环基”通常包括3-12员,优选3-6员,尤其是6员单环杂环非芳族基团。非芳族杂环基团通常包含1、2、3、4或5个,优选1、2或3个选自n、o和s的杂原子作为环成员,其中作为环成员的s原子可以作为s、so或so2存在。5或6员杂环基团的实例包括饱和或不饱和非芳族杂环,如环氧乙烷基、氧杂环丁烷基、硫杂环丁烷基,硫杂环丁烷基-s-氧化物(s-氧代硫杂环丁烷基)、硫杂环丁烷基-s-二氧化物(s-二氧代硫杂环丁烷基)、吡咯烷基、吡咯啉基、吡唑啉基、四氢呋喃基、二氢呋喃基、1,3-二氧戊环基、四氢噻吩基、s-氧代四氢噻吩基、s-二氧代四氢噻吩基、二氢噻吩基、s-氧代二氢噻吩基、s-二氧代二氢噻吩基、唑烷基、唑啉基、噻唑啉基、氧杂四氢噻吩基、哌啶基、哌嗪基、吡喃基、二氢吡喃基、四氢吡喃基、1,3-和1,4-二烷基、噻喃基、s-氧代噻喃基、s-二氧代噻喃基、二氢噻喃基、s-氧代二氢噻喃基、s-二氧代二氢噻喃基、四氢噻喃基、s-氧代四氢噻喃基、s-二氧代四氢噻喃基、吗啉基、硫吗啉基、s-氧代硫吗啉基、s-二氧代硫吗啉基、噻嗪基等。还包含1或2个羰基作为环成员的杂环的实例包括吡咯烷-2-酮基、吡咯烷-2,5-二酮基、咪唑烷-2-酮基、唑烷-2-酮基、噻唑烷-2-酮基等。
[0092]
术语“杂芳基”包括包含1、2、3或4个选自n、o和s的杂原子作为环成员的5或6员单环杂芳族基团。5或6员杂芳族基团的实例包括吡啶基,即2-、3-或4-吡啶基,嘧啶基,即2-、4-或5-嘧啶基,吡嗪基,哒嗪基,即3-或4-哒嗪基,噻吩基,即2-或3-噻吩基,呋喃基,即2-或3-呋喃基,吡咯基,即2-或3-吡咯基,唑基,即2-、3-或5-唑基,异唑基,即3-、4-或5-异唑基,噻唑基,即2-、3-或5-噻唑基,异噻唑基,即3-、4-或5-异噻唑基,吡唑基,即1-、3-、4-或5-吡唑基,即1-、2-、4-或5-咪唑基,二唑基,例如2-或5-[1,3,4]二唑基、4-或5-(1,2,3-二唑)基、3-或5-(1,2,4-二唑)基,2-或5-(1,3,4-噻二唑)基,噻二唑基,例如2-或5-(1,3,4-噻二唑)基、4-或5-(1,2,3-噻二唑)基、3-或5-(1,2,4-噻二唑)基,三唑基,例如1h-、2h-或3h-1,2,3-三唑-4-基、2h-三唑-3-基、1h-、2h-或4h-1,2,4-三唑基以及四唑基,即1h-或2h-四唑基。术语“杂芳基”还包括包含1、2或3个选自n、o和s的杂原子作为环成员的双环8-10员杂芳族基团,其中5或6员杂芳族环与苯基环或5或6员杂芳族基团稠合。与苯基环或5或6员杂芳族基团稠合的5或6员杂芳族环的实例包括苯并呋喃基、苯并噻吩基、吲哚基、吲唑基、苯并咪唑基、苯并氧杂噻唑基、苯并二唑基、苯并噻二唑基、苯并嗪基、喹啉基、异喹啉基、嘌呤基、1,8-二氮杂萘基、蝶啶基、吡啶并[3,2-d]嘧啶基或吡啶并咪唑基等。这些稠合杂芳基可以经由5或6员杂芳族环的任何环原子或者经由该稠合
苯基结构部分的碳原子键合于该分子的其余部分。
[0093]
术语“杂环烷基”和“杂芳基烷基”分别涉及经由c
1-c5烷基或c
1-c4烷基,尤其是甲基(分别=杂环基甲基或杂芳基甲基)与该分子的其余部分键合的如上所定义的杂环基或杂芳基。
[0094]
术语“芳基烷基”和“苯基烷基”分别涉及经由c
1-c5烷基或c
1-c4烷基,尤其是甲基(分别=芳基甲基或苯基甲基)与该分子的其余部分键合的如上所定义的芳基和苯基,实例包括苄基、1-苯乙基、2-苯乙基、2-苯氧基乙基等。
[0095]
术语“亚烷基”、“亚环烷基”、“杂环亚烷基”、“亚链烯基”、“亚环烯基”、“亚杂环烯基”和“亚炔基”分别涉及如上所定义的烷基、环烷基、杂环烷基、链烯基、环烯基、杂环烯基和炔基,它们经由相应基团的两个原子,优选经由相应基团的两个碳原子与该分子的其余部分键合,因而它们表示该分子的两个结构部分之间的连接基。
[0096]
在特定实施方案中,式i化合物的各变量具有下列含义,这些含义本身并且相互组合地均为式i化合物的特定实施方案。
[0097]
用于杀害虫方法和杀虫应用目的的本发明实施方案和优选化合物如下列段落所述。
[0098]
对于各变量,中间体的特别优选实施方案对应于式i化合物的那些。
[0099]
在优选实施方案中,化合物i以化合物i.a和i.b的混合物形式存在,其中具有与氮相邻的碳原子的s-构型的化合物i.a基于化合物i.a和i.b的总重量以大于50重量%,特别是至少70重量%,更特别是至少85重量%,具体为至少90重量%的量存在。
[0100][0101]
在本发明的一个特别优选实施方案中,该方法包括使植物、其部分、其繁殖材料、害虫、其食物供应源、栖息地或繁殖地与杀害虫有效量的式i.a化合物接触的步骤。
[0102]
优选地,r1是h、oh、c
1-c4烷氧基-c
1-c2烷基、c(=o)r
11a
,其中r
11a
是c-c3h5ch2、c
1-c4烷氧基、c
1-c4烷基、c
1-c4卤代烷基、c
3-c6环烷基、c
3-c4环烷基-c
1-c2烷基和or
14
。
[0103]
特别地,r1是h、c
1-c4烷氧基-c
1-c2烷基或c(=o)r
11a
,其中r
11a
是c
1-c4烷基、c
1-c4卤代烷基、c
3-c6环烷基、c
3-c4环烷基-c
1-c2烷基或or
14
。最优选r1为h的化合物。
[0104]
在优选的实施方案中,w是n。该类化合物对应于式i.n。
[0105]
在另一实施方案中,w是cr4。该类化合物对应于式i.c.
[0106]
在公式i.n和i.c中,变量分别如公式i所定义和优选。
[0107][0108]
r2优选为h、ch3、c≡ch或cn,特别是ch3。
[0109]
优选地,r3是被(r
11
)n取代的嘧啶-2,该类化合物对应于式i.1:
[0110][0111]
优选在该类化合物中n为0;如果n不为0,基团r
11
优选在间位和/或更优选在对位。
[0112]
在另一实施方案中,r3是吡啶-2,其被(r
11
)n取代,该类化合物对应于式i.2:
[0113][0114]
优选在该类化合物中n为0;如果n不为0,基团r
11
优选在间位和/或更优选在对位。
[0115]
通常,特别是化合物i.1和i.2中的r
11
优选选自卤素、cn、卤代甲氧基和卤代甲基,例如cn、cl、f、br、cf3、ocf3和ochf2。
[0116]
r4优选是h、卤素或ch3,特别是h。
[0117]
q优选为含n的5-10员杂芳基,其包含至少一个n原子和1-3个选自n、o和s的可被氧化的杂原子作为环成员,该杂芳基环未被取代或者被独立地选自r5的基团部分或完全取代。
[0118]
q更优选为含n的5-10员杂芳基,其包含至少一个n原子和1或2个选自结构qn的可被氧化的n、o和s的杂原子作为环成员。
[0119][0120]
在一个实施方案中,q是具有2或3个选自n、o和s的杂原子作为环成员的双环9员杂芳基。该类化合物优选对应于式i.x:
[0121][0122]
其中
[0123]
t是可以被氧化的ch、cr5、n、o或s;
[0124]
v是c或n;
[0125]
z是c或n;
[0126]
q’是ch、cr5或n;和
[0127]
q”是ch、cr5或n;
[0128]
条件是t、v、z、q’和q”中的2个或3个是杂原子。
[0129]
式i.x中优选的杂芳基是苯并唑、咪唑、1,2-苯并噻唑、异唑并[5,4-b]吡啶、1λ5,7,8-三氮杂双环[4.3.0]壬-1(6),2,4,8-四烯。
[0130]
在特别优选的式i.x化合物中,r3是2-嘧啶,其未被取代或在对位被r
11a
取代,w是n且v是c。r
11a
是h或r
11
。该类化合物对应于式i.x
*
:
[0131][0132]
在另一实施方案中,q是包含至少一个n作为环成员的5员杂芳基,该杂芳基未被取代或被独立地选自r5的基团部分或完全取代。这种5员杂芳基优选吡唑、异唑、异噻唑、咪唑、三唑;优选5-吡唑、3-异唑、3-异噻唑、5-异唑、5-异噻唑、4-咪唑或1,4-二氢-1,2,4-三唑-5-酮。
[0133]
在另一实施方案中,q是噻吩。
[0134]
在另一实施方案中,q是包含至少一个n作为环成员的6员杂芳基,该杂芳基未被取代或被独立地选自r5的基团部分或完全取代。这种5员杂芳基优选为吡啶、嘧啶或哒嗪,优选2-吡啶、2-嘧啶或3-哒嗪。
[0135]
特别优选的实施方案是选自q1-q18的q:
[0136][0137]
其中r
51
、r
52
、r
53
相互独立地为h或r5;和
[0138]
#是与分子其余部分的键
[0139]
其他优选实施方案是q选自q19和q20,其中r
51
和r
52
相互独立地为h或r5;#是与分子其余部分的键
[0140][0141]
r5优选为卤素、cn、c
1-c4烷基、c
1-c2卤代烷基、c
1-c2卤代烷氧基、s(o)
m-c
1-c4烷基、
s(o)
m-c
1-c4卤代烷基、s(o)
m-c
3-c4环烷基、s(o)
m-c
3-c4卤代环烷基、c
3-c4环烷基、c
3-c4环烷基,其被cn、卤素或c
1-c2卤代烷基取代;更优选r5是cl、s(o)ch3、s(o)2ch3、s(o)cf3、s(o)2cf3、c-c3h5、c-c3h
4-cf3、c-c3h
4-cn或卤代甲基如cf3。
[0142]
在特定实施方案中,式i化合物的各变量具有下列含义,这些含义本身并且相互组合地均为式i化合物的特定实施方案。
[0143][0144]
表1.
[0145]
式i*化合物,其中r1为h、r
11a
为h且q、r
51
、r
52
和r
53
组合对于化合物而言在每种情况下对应于表a的一行
[0146]
表2.
[0147]
式i*化合物,其中r1为c-c3h5ch2、r
11a
为h且r
11a
、q、r
51
、r
52
和r
53
组合对于化合物而言在每种情况下对应于表a的一行
[0148]
表3.
[0149]
式i*化合物,其中r1为c2h5och2、r
11a
为h且r
11a
、q、r
51
、r
52
和r
53
组合对于化合物而言在每种情况下对应于表a的一行
[0150]
表4.
[0151]
式i*化合物,其中r1为c(=o)och
2-c-c3h5、r
11a
为h且r
11a
、q、r
51
、r
52
和r
53
组合对于化合物而言在每种情况下对应于表a的一行
[0152]
表5.
[0153]
式i*化合物,其中r1为c(=o)ch
2-c-c3h5、r
11a
为h且r
11a
、q、r
51
、r
52
和r
53
组合对于化合物而言在每种情况下对应于表a的一行
[0154]
表6.
[0155]
式i*化合物,其中r1为oh、r
11a
为h且r
11a
、q、r
51
、r
52
和r
53
组合对于化合物而言在每种情况下对应于表a的一行
[0156]
表7.
[0157]
式i*化合物,其中r1为h、r
11a
为br且q、r
51
、r
52
和r
53
组合对于化合物而言在每种情况下对应于表a的一行
[0158]
表8.
[0159]
式i*化合物,其中r1为c-c3h5ch2、r
11a
为br且r
11a
、q、r
51
、r
52
和r
53
组合对于化合物而言在每种情况下对应于表a的一行
[0160]
表9.
[0161]
式i*化合物,其中r1为c2h5och2、r
11a
为br且r
11a
、q、r
51
、r
52
和r
53
组合对于化合物而言在每种情况下对应于表a的一行
[0162]
表10.
[0163]
式i*化合物,其中r1为c(=o)och
2-c-c3h5、r
11a
为br且r
11a
、q、r
51
、r
52
和r
53
组合对于
化合物而言在每种情况下对应于表a的一行
[0164]
表11.
[0165]
式i*化合物,其中r1为c(=o)ch
2-c-c3h5、r
11a
为br且r
11a
、q、r
51
、r
52
和r
53
组合对于化合物而言在每种情况下对应于表a的一行
[0166]
表12.
[0167]
式i*化合物,其中r1为oh、r
11a
为br且r
11a
、q、r
51
、r
52
和r
53
组合对于化合物而言在每种情况下对应于表a的一行
[0168]
表13.
[0169]
式i*化合物,其中r1为h、r
11a
为cl且q、r
51
、r
52
和r
53
组合对于化合物而言在每种情况下对应于表a的一行
[0170]
表14.
[0171]
式i*化合物,其中r1为c-c3h5ch2、r
11a
为cl且r
11a
、q、r
51
、r
52
和r
53
组合对于化合物而言在每种情况下对应于表a的一行
[0172]
表15.
[0173]
式i*化合物,其中r1为c2h5och2、r
11a
为cl且r
11a
、q、r
51
、r
52
和r
53
组合对于化合物而言在每种情况下对应于表a的一行
[0174]
表16.
[0175]
式i*化合物,其中r1为c(=o)och
2-c-c3h5、r
11a
为cl且r
11a
、q、r
51
、r
52
和r
53
组合对于化合物而言在每种情况下对应于表a的一行
[0176]
表17.
[0177]
式i*化合物,其中r1为c(=o)ch
2-c-c3h5、r
11a
为cl且r
11a
、q、r
51
、r
52
和r
53
组合对于化合物而言在每种情况下对应于表a的一行
[0178]
表18.
[0179]
式i*化合物,其中r1为oh、r
11a
为cl且r
11a
、q、r
51
、r
52
和r
53
组合对于化合物而言在每种情况下对应于表a的一行
[0180]
表19.
[0181]
式i*化合物,其中r1为h、r
11a
为f且q、r
51
、r
52
和r
53
组合对于化合物而言在每种情况下对应于表a的一行
[0182]
表20.
[0183]
式i*化合物,其中r1为c-c3h5ch2、r
11a
为f且r
11a
、q、r
51
、r
52
和r
53
组合对于化合物而言在每种情况下对应于表a的一行
[0184]
表21.
[0185]
式i*化合物,其中r1为c2h5och2、r
11a
为f且r
11a
、q、r
51
、r
52
和r
53
组合对于化合物而言在每种情况下对应于表a的一行
[0186]
表22.
[0187]
式i*化合物,其中r1为c(=o)och
2-c-c3h5、r
11a
为f且r
11a
、q、r
51
、r
52
和r
53
组合对于化合物而言在每种情况下对应于表a的一行
[0188]
表23.
[0189]
式i*化合物,其中r1为c(=o)ch
2-c-c3h5、r
11a
为f且r
11a
、q、r
51
、r
52
和r
53
组合对于化
合物而言在每种情况下对应于表a的一行
[0190]
表24.
[0191]
式i*化合物,其中r1为oh、r
11a
为f且r
11a
、q、r
51
、r
52
和r
53
组合对于化合物而言在每种情况下对应于表a的一行
[0192]
表25.
[0193]
式i*化合物,其中r1为h、r
11a
为cf3且q、r
51
、r
52
和r
53
组合对于化合物而言在每种情况下对应于表a的一行
[0194]
表26.
[0195]
式i*化合物,其中r1为c-c3h5ch2、r
11a
为cf3且r
11a
、q、r
51
、r
52
和r
53
组合对于化合物而言在每种情况下对应于表a的一行
[0196]
表27.
[0197]
式i*化合物,其中r1为c2h5och2、r
11a
为cf3且r
11a
、q、r
51
、r
52
和r
53
组合对于化合物而言在每种情况下对应于表a的一行
[0198]
表28.
[0199]
式i*化合物,其中r1为c(=o)och
2-c-c3h5、r
11a
为cf3且r
11a
、q、r
51
、r
52
和r
53
组合对于化合物而言在每种情况下对应于表a的一行
[0200]
表29.
[0201]
式i*化合物,其中r1为c(=o)ch
2-c-c3h5、r
11a
为cf3且r
11a
、q、r
51
、r
52
和r
53
组合对于化合物而言在每种情况下对应于表a的一行
[0202]
表30.
[0203]
式i*化合物,其中r1为oh、r
11a
为cf3且r
11a
、q、r
51
、r
52
和r
53
组合对于化合物而言在每种情况下对应于表a的一行
[0204]
表31.
[0205]
式i*化合物,其中r1为h、r
11a
为cn且q、r
51
、r
52
和r
53
组合对于化合物而言在每种情况下对应于表a的一行
[0206]
表32.
[0207]
式i*化合物,其中r1为c-c3h5ch2、r
11a
为cn且r
11a
、q、r
51
、r
52
和r
53
组合对于化合物而言在每种情况下对应于表a的一行
[0208]
表33.
[0209]
式i*化合物,其中r1为c2h5och2、r
11a
为cn且r
11a
、q、r
51
、r
52
和r
53
组合对于化合物而言在每种情况下对应于表a的一行
[0210]
表34.
[0211]
式i*化合物,其中r1为c(=o)och
2-c-c3h5、r
11a
为cn且r
11a
、q、r
51
、r
52
和r
53
组合对于化合物而言在每种情况下对应于表a的一行
[0212]
表35.
[0213]
式i*化合物,其中r1为c(=o)ch
2-c-c3h5、r
11a
为cn且r
11a
、q、r
51
、r
52
和r
53
组合对于化合物而言在每种情况下对应于表a的一行
[0214]
表36.
[0215]
式i*化合物,其中r1为oh、r
11a
为cn且r
11a
、q、r
51
、r
52
和r
53
组合对于化合物而言在每
种情况下对应于表a的一行
[0216]
表a
[0217]
[0218]
[0219][0220]
术语“本发明化合物”是指式i化合物或“化合物i”且包括其盐、互变异构体、立体异构体和n-氧化物。
[0221]
本发明还涉及包含助剂和至少一种化合物i的农业化学组合物。
[0222]
农业化学组合物包含杀害虫有效量的化合物i。
[0223]
化合物i可以转化成农业化学组合物常用的类型,例如溶液、乳液、悬浮液、粉剂、
粉末、糊、颗粒、模压品、胶囊及其混合物。组合物类型的实例是悬浮液(例如sc、od、fs),可乳化浓缩物(例如ec),乳液(例如ew、eo、es、me),胶囊(例如cs、zc),糊,锭剂,可湿性粉末或粉剂(例如wp、sp、ws、dp、ds),模压品(例如br、tb、dt),颗粒(例如wg、sg、gr、fg、gg、mg),杀虫制品(例如ln)以及处理植物繁殖材料如种子的凝胶配制剂(例如gf)。这些和其他组合物类型在“catalogue of pesticide formulation types and international coding system”,technical monograph,第2期,2008年5月第6版,croplife international中有定义。
[0224]
组合物如mollet和grubemann,formulation technology,wiley vch,weinheim,2001;或knowles,new developments in crop protection product formulation,agrow reports ds243,t&f informa,london,2005所述以已知方式制备。
[0225]
合适的助剂是溶剂,液体载体,固体载体或填料,表面活性剂,分散剂,乳化剂,润湿剂,辅助剂,加溶剂,渗透促进剂,保护性胶体,粘附剂,增稠剂,保湿剂,驱除剂,引诱剂,进食刺激剂,相容剂,杀菌剂,防冻剂,消泡剂,着色剂,增粘剂和粘合剂。
[0226]
合适的溶剂和液体载体是水和有机溶剂。合适的固体载体或填料是矿土。
[0227]
合适的表面活性剂是表面活性化合物,如阴离子、阳离子、非离子和两性表面活性剂,嵌段聚合物,聚电解质。该类表面活性剂可以用作乳化剂、分散剂、加溶剂、润湿剂、渗透促进剂、保护性胶体或辅助剂。表面活性剂列于mccutcheon’s,第1卷:emulsifiers&detergents,mccutcheon’s directories,glen rock,usa,2008(international或north american ed.)中。合适的阴离子表面活性剂是磺酸、硫酸、磷酸、羧酸的碱金属、碱土金属或铵盐。合适的非离子表面活性剂是烷氧基化物,n-取代的脂肪酸酰胺,胺氧化物,酯类,糖基表面活性剂,聚合物表面活性剂。合适的阳离子表面活性剂是季型表面活性剂。
[0228]
农业化学组合物通常包含0.01-95重量%,优选0.1-90重量%,尤其是0.5-75重量%活性物质。活性物质以90-100%,优选95-100%的纯度使用。
[0229]
可以向活性物质或包含它们的组合物中作为预混物加入或者合适的话在紧临使用前加入(桶混合)各种类型的油、润湿剂、辅助剂或肥料。这些试剂可以以1:100-100:1的重量比与本发明组合物混合。
[0230]
用户通常将本发明组合物用于前剂量装置、小背包喷雾器、喷雾罐、喷雾飞机或灌溉系统。通常将该农业化学组合物用水、缓冲剂和/或其他助剂配制至所需施用浓度,由此得到即用喷雾液或本发明农业化学组合物。每公顷农业利用区通常施用20-2000升即用喷雾液。
[0231]
化合物i适合用于保护作物、植物、植物繁殖材料如种子或其中植物生长的土壤或水体以防动物害虫侵袭或侵染。因此,本发明还涉及一种植物保护方法,包括使要保护以防止动物害虫侵袭或侵染的作物、植物、植物繁殖材料如种子或其中植物生长的土壤或水体与杀害虫有效量的化合物i接触。
[0232]
化合物i还适合用于防治或防除动物害虫。因此,本发明还涉及一种防治或防除动物害虫的方法,包括使动物害虫、其栖息地、繁殖地或食物供应源或作物、植物、植物繁殖材料如种子或土壤或者其中动物害虫生长或可能生长的区域、材料或环境与杀害虫有效量的化合物i化合物i接触。
[0233]
化合物i通过接触和摄取二者而对于任何和所有发育阶段,如卵、幼虫、蛹和成虫
有效。
[0234]
化合物i可以直接或者以包含它们的组合物形式施用。
[0235]
施用在作物、植物、植物繁殖材料被害虫侵染之前和之后均可以进行。
[0236]
术语“接触”包括直接接触(将化合物/组合物直接施用于动物害虫或植物上)和间接接触(将化合物/组合物施用于场所)二者。
[0237]
术语“动物害虫”包括节肢动物、腹足动物和线虫。根据本发明优选的动物害虫是节肢动物,优选昆虫和蜘蛛,尤其是昆虫。
[0238]
术语“植物”包括禾谷类,例如硬粒小麦和其他小麦,黑麦,大麦,小黑麦,燕麦,稻或玉米(青饲玉米和甜玉蜀黍/甜玉米以及大田玉米);甜菜,例如糖用甜菜或饲料甜菜;水果,如仁果、核果或浆果,例如苹果、梨、李、桃、油桃、杏仁、樱桃、木瓜、草莓、悬钩子、黑莓或鹅莓;豆科植物,如菜豆、扁豆、豌豆、苜蓿或大豆;油料植物,例如油菜(油籽油菜)、白菜型油菜、芥菜、橄榄、向日葵、椰子、可可豆、蓖麻油植物、油棕、花生或大豆;葫芦科植物,例如笋瓜、南瓜、黄瓜或甜瓜;纤维植物,例如棉花、亚麻、大麻或黄麻;柑桔类水果,例如橙子、柠檬、葡萄柚或橘;蔬菜,例如茄子、菠菜、莴苣(例如卷心莴苣)、菊苣、卷心菜、芦笋、卷心菜、胡萝卜、洋葱、大蒜、韭葱、西红柿、土豆、葫芦或柿子椒;月桂类植物,例如鳄梨、肉桂或樟脑;能量和原料植物,例如玉米、大豆、油菜籽、甘蔗或油棕;烟草;坚果,例如核桃;开心果;咖啡;茶;香蕉;葡萄藤;啤酒花;甜叶菊(甜菊(stevia));天然橡胶植物或观赏和森林植物,灌木,阔叶树或常绿树;桉树;草皮;草坪;禾草。优选的植物包括土豆、糖用甜菜、烟草、小麦、黑麦、大麦、燕麦、稻、玉米、棉花、大豆、油菜籽、豆科植物、向日葵、咖啡或甘蔗;水果;葡萄藤;观赏植物;或蔬菜,如黄瓜、西红柿、菜豆或笋瓜。
[0239]
术语“种子”包括种子和植物繁殖体,包括真正的种子、种子切片(seed piece)、吸枝、球茎、鳞茎、果实、块茎、谷粒、插条、伐条(cut shoot),并且优选指真正的种子。
[0240]“杀害虫有效量”是指对生长获得可观察到的效果所需的活性成分的量,所述效果包括坏死、死亡、阻滞、预防和去除效果,破坏效果或减少目标生物体的出现和活动的效果。对于在本发明中使用的各种化合物/组合物,杀害虫有效量可以变化。组合物的杀害虫有效量也会根据主要条件如所需杀害虫效果及持续时间、气候、目标物种、场所、施用方式而变化。
[0241]
为了用于例如通过叶面施用处理农作物,本发明活性成分的施用率可以为0.0001-4000g/ha,例如1-2kg/ha或1-750g/ha,理想的是1-100g/ha。
[0242]
化合物i还适合用于对抗非作物虫害。为了用于对抗所述非作物虫害,可以将化合物i用作诱饵组合物、凝胶、通用昆虫喷雾剂、气雾剂、超低容量施用和蚊帐(浸渍的或表面施用的)。
[0243]
术语“非作物虫害”是指对于非作物目标特别相关的害虫,如蚂蚁、白蚁、黄蜂、蝇、蜱、蚊、臭虫、蟋蟀或蟑螂,例如埃及伊蚊(aedes aegypti)、家蝇(musca domestica)、拟谷盗属(tribolium spp.);白蚁,例如黄肢散白蚁(reticulitermes fiavipes)、coptotermes formosanus;蟑螂,例如德国小蠊(blattella germanica)、美洲蟑螂(periplaneta americana);蚂蚁,例如红火蚁(solenopsis invicta)、阿根廷蚁(linepithema humile)和camponotus pennsylvanicus。
[0244]
诱饵可以是液体、固体或半固体制剂(例如凝胶)。
[0245]
为了用于诱饵组合物中,活性成分的典型含量为0.001-15重量%,理想的是0.001-5重量%活性化合物。
[0246]
化合物i及其组合物可以用于保护木质材料如树木、护栏、枕木、框架、艺术作品等,以及建筑物,还有建筑材料、家具、皮革、纤维、乙烯基制品、电线和电缆等以防蚂蚁、白蚁和/或破坏木材或纺织品的甲虫,并防止蚂蚁和白蚁损害作物或人类(例如当害虫侵入房子和公共设施或在庭院、果园或公园里筑巢时)。
[0247]
材料保护中的常规施用率例如为0.001-2000g或0.01-1000g活性化合物/m2被处理材料,理想的是0.1-50g活性化合物/m2被处理材料。
[0248]
用于浸渍材料的杀虫组合物通常含有0.001-95重量%,优选0.1-45重量%,更优选1-25重量%至少一种驱除剂和/或杀虫剂。
[0249]
本发明化合物尤其适合有效防除动物害虫如节肢动物和线虫,包括:
[0250]
选自头喙亚目(auchenorrhyncha),例如小绿叶蝉(amrasca biguttula),小绿叶蝉属物种(empoasca spp.),黑尾叶蝉(nephotettix virescens),白背飞虱(sogatellafurcifera),沫蝉属物种(mahanarva spp.),灰飞虱(laodelphax striatellus),褐飞虱(nilaparvata lugens),柑桔木虱(diaphorina citri)的昆虫;
[0251]
鳞翅目(lepidoptera),例如棉铃虫属物种(helicoverpa spp.),烟芽夜蛾(heliothis virescens),葡萄浆果小卷蛾(lobesia botrana),玉米螟(ostrinia nubilalis),小菜蛾(plutella xylostella),大豆夜蛾(pseudoplusia includens),正三化螟(scirpophaga incertulas),灰翅夜蛾属物种(spodoptera spp.),粉纹夜蛾trichoplusia ni),番茄潜麦蛾(tuta absoluta),稻纵卷叶螟(cnaphalocrocis medialis),苹果蠹蛾(cydia pomonella),二化螟(chilosuppressalis),黎豆夜蛾(anticarsia gemmatalis),小地老虎(agrotis ipsilon),大豆尺蠖(chrysodeixis includens);
[0252]
蝽象,例如草盲蝽属物种(lygus spp.),椿象如美洲蝽属物种(euschistus spp.),茶翅蝽(halyomorpha halys),稻绿蝽(nezara viridula),piezodorus guildinii,dichelops furcatus;
[0253]
蓟马,例如花蓟马属物种(frankliniella spp.),蓟马属物种(thrips spp.),兰花蓟马(dichromothrips corbettii);
[0254]
蚜虫,例如豌豆蚜(acyrthosiphon pisum),蚜属物种(aphis spp.),桃蚜(myzus persicae),缢管蚜属物种(rhopalosiphum spp.),麦二叉蚜(schizaphis graminum),巢莱修尾蚜(megoura viciae);
[0255]
粉虱,例如温室粉虱(trialeurodes vaporariorum),粉虱属物种(bemisia spp.);
[0256]
鞘翅目(coleoptera),例如条跳甲属物种(phyllotreta spp.),梳爪叩头虫属物种(melanotus spp.),油菜露尾甲(meligethes aeneus),马铃薯叶甲(leptinotarsa decimlineata),龟象属物种(ceutorhynchus spp.),叶甲属物种(diabrotica spp.),棉铃象甲(anthonomus grandis),atomaria linearia,叩甲属物种(agriotes spp.),食植瓢虫属物种(epilachna spp.);
[0257]
蝇类,例如地种蝇属物种(delia spp.),地中海实蝇(ceratitis capitate),果实
蝇属物种(bactrocera spp.),斑潜蝇属物种(liriomyza spp.);
[0258]
蚧总科(coccoidea),例如aonidiella aurantia,ferrisia virgate;
[0259]
蜘蛛纲(arachnida)节肢动物(螨类),例如麦圆叶爪螨(penthaleus major),始叶螨属物种(tetranychus spp.);
[0260]
线虫,例如大豆胞囊线虫(heterodera glycines),根结线虫属物种(meloidogyne spp.),短体线虫属物种(pratylenchus spp.),秀丽隐杆线虫(caenorhabditis elegans)。
[0261]
化合物i适合用于处理或保护动物以防寄生虫侵染或感染。因此,本发明还涉及本发明化合物在在制造用于处理或保护动物以防寄生虫侵染或感染的药物中的用途。此外,本发明涉及一种处理或保护动物以防寄生虫侵染和感染的方法,包括对动物口服、局部或胃肠外给予或施用杀寄生虫有效量的化合物i。
[0262]
本发明还涉及本发明化合物在处理或保护动物以防寄生虫侵染和感染中的非治疗用途。此外,本发明涉及一种处理或保护动物以防寄生虫侵染和感染的非治疗方法,包括对场所施用杀寄生虫有效量的化合物i。
[0263]
本发明化合物进一步适合用于在动物中和动物上防除或防治寄生虫。此外,本发明涉及一种在动物中和动物上防除或防治寄生虫的方法,包括使寄生虫与杀寄生虫有效量的化合物i接触。
[0264]
本发明还涉及化合物i在防治或防除寄生虫中的非治疗用途。此外,本发明涉及一种防除或防治寄生虫的非治疗方法,包括对场所施用杀寄生虫有效量的化合物i。
[0265]
化合物i可以通过接触(经由土壤、玻璃、墙壁、蚊帐、地毯、毛毯或动物部分)和摄取(例如诱饵)二者而有效。此外,化合物i可以施用于任何和所有发育阶段。
[0266]
化合物i可以直接或者以包含它们的组合物形式施用。
[0267]
术语“场所”是指栖息地,食物供应源,繁殖地,其中寄生虫在动物之外生长或可能生长的区域、材料或环境。
[0268]
本文所用术语“寄生虫”包括体内和体外寄生虫。在本发明的一些实施方案中,可能优选体内寄生虫。在其他实施方案中,可能优选体外寄生虫。在温血动物和鱼类中的侵染包括虱、咬虱、蜱、羊鼻蝇蛆、羊蜱蝇、螯蝇、家蝇、蝇、蛆蝇幼虫、恙螨、蚋、蚊和蚤。
[0269]
本发明化合物尤其可以用于分别防除下列寄生虫:温带臭虫(cimex lectularius)、rhipicephalus sanguineus和猫蚤(ctenocephalides felis)。
[0270]
本文所用术语“动物”包括温血动物(包括人类)和鱼类。优选哺乳动物,如牛、绵羊、猪、骆驼、鹿、马、小猪、家禽、兔、山羊、狗和猫,水牛、驴、黇鹿和驯鹿,以及还有产皮动物如貂、毛丝鼠和浣熊,禽类如母鸡、鹅、火鸡和鸭以及鱼类如淡水鱼和咸水鱼如鲑鱼、鲤鱼和鳗鱼。特别优选家养动物,如狗或猫。
[0271]
可以0.5-100mg/kg/天,优选1-50mg/kg/天的总量施用化合物i。
[0272]
为了对温血动物口服给药,可以将化合物i配制成动物饲料、动物饲料预混物、动物饲料浓缩物、丸剂、溶液、糊、悬浮液、浸液、凝胶、片剂、大丸剂和胶囊。对于口服给药,所选择的剂型应为动物提供0.01-100mg/kg动物体重/天,优选0.5-100mg/kg动物体重/天的化合物i。
[0273]
或者,化合物i可以肠胃外给药于动物,例如通过腔内、肌内、静脉内或皮下注射。化合物i可以分散或溶于对于皮下注射而言生理上可接受的载体中。或者,化合物i可配制
成皮下给药用植入物。此外,化合物i可以透皮给药于动物。对于肠胃外给药,所选剂型应为动物提供0.01-100mg/kg动物体重/天的化合物i。
[0274]
化合物i还可以浸液、粉剂、粉末、套环、挂牌(medallions)、喷雾剂、香波、滴施(spot-on)和喷淋(pour-on)配制剂形式以及以软膏或水包油或油包水乳液局部给药于动物。对于局部施用,浸液和喷雾剂通常含有0.5-5,000ppm,优选1-3,000ppm化合物i。此外,化合物i可以配制成动物,特别是四足动物如牛和绵羊用耳贴。
[0275]
口服溶液直接给药。
[0276]
用于皮肤上的溶液滴施、涂施、擦施、洒施或喷施。
[0277]
将凝胶施加或涂敷在皮肤上或引入体腔中。
[0278]
将喷淋配制剂倒在或喷雾在限定的皮肤区域,活性化合物渗透进皮肤并内吸起作用。喷淋配制剂通过将活性化合物在合适的皮肤相容性溶剂或溶剂混合物中溶解、悬浮或乳化而制备。
[0279]
乳液可以口服、经皮给药或作为注射液给药。
[0280]
悬浮液可以口服或局部/经皮给药。
[0281]
半固体制剂可以口服或局部/经皮给药。
[0282]
为了生产固体制剂,将活性化合物与合适的赋形剂混合,合适的话加入助剂,并且制成所需剂型。
[0283]
可以用于本发明的组合物通常可以包含约0.001-95%化合物i。
[0284]
即用制剂以10重量ppm-80重量%,优选0.1-65重量%,更优选1-50重量%,最优选5-40重量%的浓度含有对寄生虫,优选体外寄生虫起作用的化合物。
[0285]
在使用前稀释的制剂以0.5-90重量%,优选1-50重量%的浓度含有对体外寄生虫起作用的化合物。
[0286]
此外,制剂以10重量ppm-2重量%,优选0.05-0.9重量%,非常特别优选0.005-0.25重量%的浓度包含对抗体内寄生虫的式i化合物。
[0287]
可施用在三周内以10-300mg/kg,优选20-200mg/kg,最优选25-160mg/kg被处理动物体重的总量释放本发明化合物的固体配制剂。
[0288]
a.制备实施例:
[0289]
适当改变原料,使用合成说明中所给程序得到其他化合物i。以此方式得到的化合物与物理数据一起列于下表中。
[0290]
下面所示产物通过熔点测定、通过nmr光谱法或者由通过hplc-ms或hplc光谱法测定的质量([m/z])或保留时间(rt;[min.])表征。
[0291]
hplc-ms=与高效液相色谱法联用的质谱法;
[0292]
hplc方法a:shimadzu nexera uhplc+shimadzu lcms 20-20,esi;柱:phenomenex kinetex 1.7μm xb-c18 100a;50
×
2.1mm;移动相:a:水+0.1% tfa;b:acn;温度:60℃;梯度:在1.50分钟内5% b至100% b;100% b 0.25分钟;流速:在1.51分钟内0.8-1.0ml/min;ms方法:esi正性;质量范围(m/z):100-700。
[0293]
实施例1:n-[1-(2-嘧啶-2-基-1,2,4-三唑-3-基)乙基]-5,7-双(三氟甲基)-1,2-苯并唑-3-胺[i-1]的制备:
[0294]
步骤1:在0℃下在5min内将2-氯-3,5-双(三氟甲基)苯胺(10g,0.038mol)在mecn
(60ml)中的溶液缓慢加入h2so4(60ml)和h2o(60ml)的溶液中,并在该温度下再搅拌10min。在5min内将h2o(40ml)中nano2(4.6g,0.133mol)滴加到上述混合物中,此时内部温度达到10℃,并在该温度下搅拌10min。在0℃下滴加ki(22g,66.5mmol)在h2o(60ml)中的溶液并搅拌2h。然后tlc分析(pe,rf=0.6)显示完全反应。分离有机相,水相用mtbe(2
×
50ml)萃取。将合并的有机相用nahco3溶液(2
×
100ml,饱和水溶液)、na2s2o3溶液(2
×
100ml饱和水溶液)洗涤,用na2so4干燥,过滤并减压浓缩。通过柱层析(pe)提纯,得到2-氯-1-碘-3,5-双(三氟甲基)苯(13g,93%%),为浅棕色油。1h-nmr(cdcl3,400mhz,rt):δppm 8.32(s,1h)7.95(s,1h)。
[0295]
步骤2:在n2气氛和25℃下向2-氯-1-碘-3,5-双(三氟甲基)苯(12g,32mmol)在nmp(50ml)的溶液中加入cucn(4.2g,48mmol)),并将所得混合物在120℃下加热16h。然后tlc分析(pe/etoac=10:1,rf=0.2)显示完全反应。将反应混合物用h2o(200ml)淬灭,用etoac(3
×
200ml)萃取,合并的有机萃取物用na2so4干燥,过滤并减压浓缩。通过柱层析(pe/etoac=50:1,rf=0.3)提纯,得到2-氯-3,5-双(三氟甲基)苄腈(7.0g,80%),为黄色固体。1h-nmr(cdcl3,400mhz,rt):δppm 8.16(br d,j=9.3hz,2h)。
[0296]
步骤3:在25℃和n2气氛下向2-氯-3,5-双(三氟甲基)苄腈(3.50g,12.8mmol)在thf(100ml)中的溶液中加入t-buok(1.70g,15.3mmol),并将所得混合物在该温度下搅拌30min。将thf(20ml)中丙烷-2-酮肟(cas号127-06-0;1.12g,15.3mmol)加入上述混合物中并在25℃下搅拌2h。然后tlc分析(pe/etoac=10:1,rf=0.5)显示完全反应。将反应混合物用nh4cl溶液(100ml,饱和水溶液)淬灭,用etoac(2
×
100ml)萃取,合并的有机萃取物用na2so4干燥,过滤并减压浓缩,得到粗品2-(异亚丙基氨基)氧基-3,5-双(三氟甲基)苄腈(3.0g),为棕色油,不经进一步提纯直接用于下一步。
[0297]
步骤4:在25℃和n2气氛下向粗制2-(异亚丙基氨基)氧基-3,5-双(三氟甲基)苄腈(3.0g,9.7mmol)在meoh(10ml)中的溶液中加入hcl/meoh(150ml)和socl2(11.2g,9.49mol),并将反应混合物在该温度下搅拌72h。然后tlc分析(pe/etoac=5:1,rf=0.4)显示完全反应。浓缩反应混合物,残余物用nahco3溶液(200ml,饱和水溶液)淬灭以将ph调节至7。水相用etoac(2
×
100ml)萃取,将合并的有机萃取物用na2so4干燥,过滤,减压浓缩。通过柱层析(pe/etoac=10:1,rf=0.5)提纯,得到5,7-双(三氟甲基)-1,2-苯并唑-3-胺(2.0g,77%),为红色固体。1h-nmr(400mhz,dmso-d6,rt):δppm 8.70(s,1h),8.23(s,1h),6.95(s,2h)。
[0298]
步骤5:在25℃和n2气氛下向5,7-双(三氟甲基)-1,2-苯并唑-3-胺(800mg,2.96mmol)在甲苯(10ml)的溶液中加入ti(oipr)4(2.50g,8.88mmol)和1-(2-嘧啶-2-基-1,2,4-三唑-3-基)乙酮(672mg,3.55mmol,实施例8),然后将混合物在100℃下加热16h。然后lcms显示完全反应。然后,该溶液不经进一步提纯直接用于下一步。
[0299]
步骤6:向步骤5中获得的溶液(约10ml,在甲苯中)中加入etoh(20ml)并将溶液冷却至0℃。缓慢加入nabh(oac)3(1.25g,3.92mmol)和na(cn)bh3(372mg,3.92mmol),将反应混合物在50℃下加热16h。然后lcms显示反应完成。将反应用h2o(100ml)淬灭,过滤并用etoac(2
×
50ml)洗涤滤饼。水相用etoac(2
×
50ml)萃取,合并的有机相用na2so4干燥,过滤,减压浓缩。通过制备型hplc提纯得到n-[1-(2-嘧啶-2-基-1,2,4-三唑-3-基)乙基]-5,7-双(三
3-基)甲基]-5,7-双(三氟甲基)-1,2-苯并唑-3-胺[i-2](194mg,49%),为黄色固体。
[0309]1h-nmr(400mhz,cdcl3,rt):δppm 8.94(d,j=4.8hz,2h),8.18(s,1h),8.12(s,1h),8.00(s,1h),7.43(t,j=4.8hz,1h),6.14(br t,j=5.0hz,1h),5.31(d,j=5.1hz,2h)。
[0310]
实施例3:n-[1-(2-嘧啶-2-基-1,2,4-三唑-3-基)乙基]-5-(三氟甲基)异唑并[5,4-b]吡啶-3-胺[i-3]的制备:
[0311]
步骤1:向2-氯-5-(三氟甲基)吡啶-3-羧酸(2.26g,10mmol)在thf(20ml)中的溶液中加入boc2o(4.4g,20mmol)、nh4hco3(1.6g,20mmol)、吡啶(1.6g,20mmol)并将混合物在20℃下搅拌24h。然后浓缩所得反应混合物,用etoac(40ml)稀释,有机相用h2o(50ml)、nacl溶液(50ml,饱和水溶液)洗涤,用na2so4干燥,过滤,减压浓缩,得到2-氯-5-(三氟甲基)吡啶-3-甲酰胺(2g,粗品),为黄色固体,不经进一步提纯直接用于下一步。
[0312]
步骤2:在0℃下向2-氯-5-(三氟甲基)吡啶-3-甲酰胺(1.95g,8.7mmol)在ch2cl2(40ml)中的溶液中滴加et3n(3.6g,34.8mmol)和三氟乙酸酐(3.6g,17.4mmol,cas号407-25-0),然后将混合物温热至20℃并在该温度下搅拌4h。将所得混合物倒入冰水(100ml)中,水相用ch2cl2(2
×
50ml)萃取。合并的有机萃取物用nacl溶液(2
×
50ml)洗涤,用na2so4干燥,过滤,减压浓缩。通过柱层析(pe/etoac=10:1)提纯,得到2-氯-5-(三氟甲基)吡啶-3-甲腈(1.1g,53%,经2步),为黄色固体。
[0313]1h-nmr(400mhz,cdcl3,rt)δppm 8.88(d,j=1.6hz,1h),8.25(d,j=2.4hz,1h)。
[0314]
步骤3:在20℃下将2-氯-5-(三氟甲基)吡啶-3-甲腈(1g,5mmol)、乙烷异羟肟酸(0.45g,6mmol)和k2co3(1.4g,10mmol)溶解在h2o(30ml)中,并将混合物在60℃下加热6h。然后过滤所得溶液并收集滤饼,得到5-(三氟甲基)异唑并[5,4-b]吡啶-3-胺(0.8g,80%),为白色固体。
[0315]1h-nmr(dmso-d6,400mhz,rt):δppm 8.95(d,j=1.6hz,1h),8.80(d,j=1.9hz,1h),6.90(s,2h)。
[0316]
步骤4:在20℃下向5-(三氟甲基)异唑并[5,4-b]吡啶-3-胺(0.8g,4.0mmol)和1-(2-嘧啶-2-基-1,2,4-三唑-3-基)乙酮(0.91g,4.8mmol,根据实施例1制备)在甲苯(10ml)中的溶液中加入ti(oipr)4(2.25g,8mol),并将混合物在100℃下加热16h。然后将反应温度降至50℃,加入meoh(3ml)和nabh3(cn)(0.51g,8.0mmol),在该温度下继续搅拌16h。通过与冰水(30ml)和etoac(30ml)混合来淬灭反应混合物,然后在20℃下再搅拌1h。淬灭的反应混合物通过硅藻土垫过滤,用etoac(30ml)洗脱,水相用etoac(30ml)萃取。合并的有机萃取物用nacl溶液(30ml,饱和水溶液)洗涤,用na2so4干燥,过滤,减压浓缩。通过制备型hplc提纯得到n-[1-(2-嘧啶-2-基-1,2,4-三唑-3-基)乙基]-5-(三氟甲基)异唑并[5,4-b]吡啶-3-胺[i-3](0.13g,9%),为黄色固体。
[0317]1h-nmr(400mhz,cdcl3,rt):δppm 8.94(d,j=4.8hz,2h),8.80(d,j=1.5hz,1h),8.27(d,j=1.6hz,1h),8.07(s,1h),7.43(t,j=4.8hz,1h),6.32-6.20(m,1h),6.03(br d,j=8.9hz,1h),1.79(d,j=6.6hz,3h)。
[0318]
实施例4:1-甲基-n-[1-(2-嘧啶-2-基-1,2,4-三唑-3-基)乙基]-5-(三氟甲基)吲唑-3-胺[i-4]的制备:
[0319]
步骤1:在高压釜中,在25℃下将naoac(3.5g,42.3mmol)加入甲基肼(6g,42.3mmol)在n-buoh(5ml)中的溶液中,在该温度下搅拌所得混合物30min。然后,加入2-氟-5-(三氟甲基)苄腈(4g,21.1mmol),并将混合物在130℃下加热72h。然后tlc(pe/etoac=3:1,rf=0.2)显示反应完成。将反应混合物用h2o(50ml)淬灭,水相用etoac(3
×
50ml)萃取,合并的有机萃取物用na2so4干燥,过滤并减压浓缩。用mtbe(100ml)研磨,然后过滤并收集滤饼,得到1-甲基-5-(三氟甲基)吲唑-3-胺(3g,67%),为白色油。
[0320]1h-nmr(cdcl3,400mhz,rt):δppm 7.85(s,1h),7.55(dd,j=8.8,0.9hz,1h),7.28(d,j=7.9hz,1h),4.00-4.28(m,2h),3.89(s,3h)。
[0321]
步骤2:在环境温度(rt,20-25℃)和n2气氛下向1-甲基-5-(三氟甲基)吲唑-3-胺(400mg,1.86mmol)在甲苯(10ml)中的溶液中加入ti(o-ipr)4(1.5g,3.58mmol),然后是1-(2-嘧啶-2-基-1,2,4-三唑-3-基)乙酮(422mg,2.83mmol,根据制备实施例1),并将混合物加热至100℃下保持16h。然后lcms显示反应完成,并且混合物在下一步中用作甲苯溶液而无需任何进一步提纯。步骤3:将上述甲苯溶液(约10ml)用etoh(10ml)稀释,冷却至0℃,缓慢加入nabh(oac)3(788mg,3.7mmol)和na(cn)bh3(233mg,3.7mmol),然后将反应混合物在50℃下加热16h。然后lcms指示反应完成。将反应混合物在h2o(100ml)中淬灭,过滤并用etoac(2
×
50ml)洗涤滤饼。水相用etoac(2
×
50ml)萃取,合并的有机萃取物用na2so4干燥,过滤并减压浓缩。通过制备型hplc提纯得到1-甲基-n-[1-(2-嘧啶-2-基-1,2,4-三唑-3-基)乙基]-5-(三氟甲基)吲唑-3-胺(200mg,37%)为白色固体。
[0322]1h-nmr(dmso-d6,400mhz,rt):δppm 9.03(d,j=4.9hz,2h),8.25(s,1h),8.07(s,1h),7.67(t,j=4.9hz,1h),7.46-7.52(m,1h),7.38-7.44(m,1h),7.08(d,j=8.9hz,1h),5.74-5.83(m,1h),3.47(s,3h),1.69(d,j=6.9hz,3h)。
[0323]
实施例5:5,7-二氯-n-[1-(2-嘧啶-2-基-1,2,4-三唑-3-基)乙基]-1,2-苯并噻唑-3-胺[i-5]的制备:
[0324]
步骤1:在0℃下向2-氨基-3,5-二氯苄腈(200mg,1.07mmol)在mecn(7ml)中的溶液中加入亚硝酸叔丁酯(220mg,2.14mmol)和cucl2(172mg,2.14mmol)在mecn(2ml)中的溶液。使所得反应混合物升温至25℃并在该温度下搅拌16h。然后tlc(pe/etoac=5:1,rf=0.5)显示反应完成。将反应混合物用h2o(20ml)淬灭,水相用etoac(2
×
20ml)萃取,合并的有机萃取物用nacl溶液(20ml,饱和水溶液)洗涤,用na2so4干燥,过滤和减压浓缩。通过制备型tlc提纯得到2,3,5-三氯苄腈(176mg,88%),为白色固体。
[0325]1h-nmr(cdcl3,400mhz,rt):δppm 7.72(d,j=2.4hz,1h),7.60(d,j=2.4hz,1h)。
[0326]
步骤2:在25℃下向2,3,5-三氯苄腈(600mg,2.9mmol)在dmf(12ml)中的溶液中加入na2s(336mg,4.36mmol),并在该温度下搅拌所得混合物8h。然后tlc(pe/etoac=5:1,rf=0.5)显示反应完成。将反应混合物在h2o(20ml)中淬灭,用2mhcl(10ml)将ph调节至3-4,水相用etoac(2
×
20ml)萃取,合并的有机萃取物用na2so4干燥,过滤并减压浓缩。通过柱层析(pe/etoac=5:1,rf=0.3)提纯,得到3,5-二氯-2-硫烷基-苄腈(700mg),为黄色油。
[0327]1h-nmr(dmso-d6,400mhz,rt):δppm 7.29(d,j=2.4hz,1h),7.71(d,j=2.4hz,1h)。
[0328]
步骤3:在0℃下向3,5-二氯-2-硫烷基-苄腈(2g,9.8mmol)在nh3·
h2o(60ml)的溶液中加入naoh溶液(约3%,在h2o中,20ml)和naocl溶液(约7%,在h2o中,6ml)。使所得反应
混合物升温至20℃并在该温度下搅拌16h。然后tlc(pe/etoac=5:1,rf=0.2)显示反应完成。将反应混合物在水(100ml)中淬灭,用etoac(2
×
50ml)萃取,合并的有机萃取物用na2so4干燥,过滤并减压浓缩。通过柱层析(pe/etoac=5:1,rf=0.3)提纯得到5,7-二氯-1,2-苯并噻唑-3-胺(1.5g,75%),为黄色固体。
[0329]1h-nmr(dmso-d6,400mhz,rt):δppm 8.27(d,j=2.0hz,1h),7.88(d,j=2.0hz,1h),7.20(d,j=2.0hz,2h)。
[0330]
步骤4:在25℃和n2气氛下向5,7-二氯-1,2-苯并噻唑-3-胺(500mg,2.3mmol)在甲苯(10ml)中的溶液中加入ti(o-ipr)4(1.3g,4.6mmol),然后是1-(2-嘧啶-2-基-1,2,4-三唑-3-基)乙酮(520mg,2.7mmol,根据实施例1制备),并将混合物在100℃下加热16h。然后lcms显示反应完成。反应混合物在下一步中用作甲苯溶液而无需任何提纯。
[0331]
步骤5:将上述甲苯溶液(约10ml)用etoh(20ml)稀释,冷却至0℃,缓慢加入nabh(oac)3(970mg,4.6mmol)和na(cn)bh3(285mg,4.6mmol),并将反应混合物在50℃下加热16h。然后lcms显示反应完成。将反应在h2o(100ml)中淬灭,过滤并用etoac(2
×
50ml)洗涤滤饼。水相用etoac(2
×
50ml)萃取,合并的有机萃取物用na2so4干燥,过滤并减压浓缩。通过制备型hplc提纯得到5,7-二氯-n-[1-(2-嘧啶-2-基-1,2,4-三唑-3-基)乙基]-1,2-苯并噻唑-3-胺[i-5](220mg,44%),为白色固体。
[0332]1h-nmr(dmso-d6,400mhz,rt):δppm 8.98(d,j=4.8hz,2h),8.41(d,j=1.7hz,1h),8.26(d,j=8.0hz,1h),8.11(s,1h),7.82(d,j=1.7hz,1h),7.63(t,j=4.9hz,1h),5.99(quin,j=7.1hz,1h),1.70(d,j=6.9hz,3h)。实施例6:8-氯-n-(环丙基甲基)-n-[1-(2-嘧啶-2-基-1,2,4-三唑-3-基)乙基]-6-(三氟甲基)-[1,2,4]三唑并[4,3-a]吡啶-3-胺[i-6]的制备:
[0333]
步骤1:向2,3-二氯-5-(三氟甲基)吡啶(5.00g,23.2mmol)在etoh(50ml)中的溶液中加入n2h4·
h2o(2.36g,46.3mmol)并将反应混合物在90℃下搅拌6h。然后tlc分析(pe/etoac=1:1)显示反应完成。浓缩反应混合物,用etoac(3
×
50ml)萃取残余物,用nacl溶液(30ml,饱和水溶液)洗涤合并的有机萃取物,用na2so4干燥,过滤并减压浓缩,得到[3-氯-5-(三氟甲基)-2-吡啶基]肼(4.6g,94%),为白色固体。
[0334]1h-nmr(dmso-d6,400mhz,rt):δppm 4.47(s,2h),7.91(d,j=2.0hz,1h),8.36(d,j=0.86hz,1h),8.52(s,1h)。
[0335]
步骤2:向[3-氯-5-(三氟甲基)-2-吡啶基]肼(3.85g,18.3mmol)在etoh/h2o(77ml/15.4ml)中的溶液中滴加etoh/h2o(5.8ml/1.2ml)中brcn(2.9g,27.4mmol),在20℃下搅拌混合物6h。然后tlc(pe/etoac=1:1)显示反应完成。将反应混合物浓缩,残余物用h2o(20ml)淬灭,水相用etoac(2
×
30ml)萃取,合并的有机相用nacl溶液(30ml,饱和水溶液)洗涤,用na2so4干燥,减压浓缩。通过硅胶柱层析(pe/etoac=100:0-45:55,梯度)提纯,得到8-氯-6-(三氟甲基)-[1,2,4]三唑并[4,3-a]吡啶-3-胺(2.2g,51%),为黄色固体。1h-nmr(dmso-d6,400mhz,rt):δppm 6.84-6.90(m,2h),7.50-7.54(m,1h),8.77-8.80(m,1h)。
[0336]
步骤3:向8-氯-6-(三氟甲基)-[1,2,4]三唑并[4,3-a]吡啶-3-胺(1g,4.2mmol)和1-(2-嘧啶-2-基-1,2,4-三唑-3-基)乙酮(800mg,4.2mmol,根据实施例1制备)在甲苯(20ml)中的溶液中加入ti(oipr)4(0.91g,3.2mmol))并将混合物在110℃下加热4h。然后tlc分析(pe/etoac=1:1)显示反应完成。将混合物冷却至20-25℃,加入etoh(10ml)和
nabh3cn(2.7g,42mmol),将所得混合物在40℃下搅拌16h,然后tlc分析(dcm/meoh=10:1)显示反应完成。将反应混合物用h2o(15ml)淬灭,过滤,滤液用etoac(3
×
10ml)萃取,合并的有机相用nacl溶液(20ml,饱和水溶液)洗涤,用na2so4干燥,并减压浓缩。通过硅胶柱层析(dcm/meoh=100:0-12:88,梯度)提纯得到8-氯-n-[1-(2-嘧啶-2-基-1,2,4-三唑-3)-基)乙基]-6-(三氟甲基)-[1,2,4]三唑并[4,3-a]吡啶-3-胺(1.3g,75%)。
[0337]1h-nmr(cdcl3,400mhz,rt):δppm 1.81(d,j=6.8hz,3h),6.32(d,j=9.4hz,1h),6.44(dd,j=9.38,6.8hz,1h),7.20(d,j=1.0hz,1h),7.40(t,j=4.9hz,1h),8.01(s,1h),8.18(s,1h)8.90(d,j=4.8hz,2h)。
[0338]
步骤4:在0℃下向8-氯-n-[1-(2-嘧啶-2-基-1,2,4-三唑-3-基)乙基]-6-(三氟甲基)-[1,2,4]三唑并[4,3-a]吡啶-3-胺(1.3g,3.2mmol),在dmf(13ml)中的溶液中分批加入nah(4.8g,4.8mmol),将混合物在该温度下搅拌0.5h。加入(溴甲基)环丙烷(0.8ml,6.4mmol),使所得混合物经4h缓慢升温至环境温度。然后tlc分析(dcm/meoh=10:1)显示反应完成。将反应混合物用nh4cl溶液(8ml,饱和水溶液)淬灭,用etoac(3
×
10ml)萃取,合并的有机萃取物用nacl溶液(15ml,饱和水溶液)洗涤,用na2so4干燥,过滤,减压浓缩。通过制备型hplc提纯得到标题8-氯-n-(环丙基甲基)-n-[1-(2-嘧啶-2-基-1,2,4-三唑-3-基)乙基]-6-(三氟甲基)-[1,2,4]三唑并[4,3-a]吡啶-3-胺[i-6](210mg,14%),为黄色固体。
[0339]1h-nmr(cdcl3,400mhz,rt):δppm 8.52(br s,1h),8.36(br d,j=4.4hz,2h),7.94(s,1h),7.43(s,1h),6.81(t,j=4.8hz,1h),6.34-6.50(m,1h),3.82(br d,j=7.0hz,2h),1.89(br d,j=7.1hz,3h),1.11(br dd,j=5.9,2.2hz,1h),0.47-0.69(m,2h),0.25(br d,j=3.6hz,2h)。
[0340]
实施例7:2-甲基-5-(1,1,2,2,2-五氟乙基)-n-[1-(2-嘧啶-2-基-1,2,4-三唑-3-基)乙基]-4-(三氟甲基)吡唑-3-胺[i-7]的制备:
[0341]
步骤1:在环境温度下向5-氟-1-甲基-3-(1,1,2,2,2-五氟乙基)-4-(三氟甲基)吡唑(75.2mg,0.263mmol,cas号104315-28-8)和1-(2-嘧啶-2-基-1,2,4-三唑-3-基)乙胺(50.0mg,0.263mmol,根据wo2017/192385制备)在mecn(3.0ml)中的溶液中加入cs2co3(171mg,0.525mmol),并将所得反应混合物在65℃下加热10h。然后将反应混合物减压浓缩并通过柱层析(cyh/etoac 100:0-0:100,梯度)提纯残余物,得到标题2-甲基-5-(1,1,2,2,2-五氟乙基)-n-[1-(2-嘧啶-2-基-1,2,4-三唑-3-基)乙基]-4-(三氟甲基)吡唑-3-胺[i-7](28.0mg,22%),为淡黄色油。
[0342]1h-nmr(cdcl3,400mhz,rt):δppm 8.30(s,1h),8.29(s,2h),6.58(t,j=4.8hz,1h),5.90(d,j=8.2hz,1h),5.49(dq,j=8.3,6.9hz,1h),3.78(s,3h),1.70(d,j=6.9hz,3h)。
[0343]
实施例8:1-(2-嘧啶-2-基-1,2,4-三唑-3-基)乙烯酮的制备
[0344]
步骤1:在25℃和n2气氛下向2-羟基丙酰胺(7g,79mmol)在ch2cl2(100ml)中的溶液中加入二甲基甲酰胺二甲基缩醛(24g,200mmol,cas号4637-24-5),并将反应混合物在50℃下加热2h。然后tlc分析(etoac,rf=0.1)显示反应完全,将所得溶液浓缩,得到粗制n-(二甲氨基亚甲基)-2-羟基-丙酰胺(12g),为黄色油,将其用于下一步而无需进一步提纯。
[0345]
步骤2:在90℃下向n-(二甲氨基亚甲基)-2-羟基-丙酰胺(7g,63mmol)在1,4-二烷(90ml)和acoh(90ml)的混合物中的溶液中滴加嘧啶-2-基肼(12g,85mmol)在1,4-二
烷(90ml)中的溶液,在90℃下继续搅拌2h。然后tlc(pe/etoac=3:1,rf=0.4)显示反应完成。减压浓缩所得反应混合物,并用nahco3溶液(200ml,饱和水溶液)淬灭残余物。水相用ch2cl2/i-proh(3:1,3
×
100ml)萃取,合并的有机萃取物用na2so4干燥,过滤,减压浓缩。通过柱层析(etoh/etoac=1:3,rf=0.3)得到1-(2-嘧啶-2-基-1,2,4-三唑-3-基)乙醇(5.2g,35%),为黄色固体。
[0346]1h-nmr(cdcl3,400mhz,rt):δppm 8.92(d,j=4.9hz,2h),8.05(s,1h),7.44(t,j=4.9hz,1h),5.24-5.37(m,1h),5.18(d,j=5.1hz,1h),1.76(d,j=6.7hz,3h)。
[0347]
步骤3:在0℃和n2下向1-(2-嘧啶-2-基-1,2,4-三唑-3-基)乙醇(5.2g,27.2mmol)在ch2cl2(200ml)中的溶液中缓慢加入戴斯-马丁-高碘烷(cas号87413-09-0;17g,42.8mmol),然后将反应混合物温热至25℃下并在该温度下搅拌16h。然后tlc分析(etoac,rf=0.4)显示反应完成。将所得溶液在h2o(100ml)中淬灭,用dcm(3
×
100ml)萃取,合并的有机萃取物用nahco3溶液(2
×
200ml)洗涤,用na2so4干燥,过滤并减压浓缩。通过柱层析(pe/etoac=1:1,rf=0.23)提纯得到1-(2-嘧啶-2-基-1,2,4-三唑-3-基)乙烯酮(3.5g,69%产率),为黄色固体。
[0348]1h-nmr(cdcl3,400mhz,rt):δppm 8.85(d,j=4.9hz,2h),8.13(s,1h),7.45(t,j=4.9hz,1h),2.76(s,3h)。
[0349]
实施例9:5,7-二氯-1-氧代-n-[1-(2-嘧啶-2-基-1,2,4-三唑-3-基)乙基]-1,2-苯并噻唑-3-胺[i-8]和5,7-二氯-1,1-二氧代-n-[1-(2-嘧啶-2-基-1,2,4-三唑-3-基)乙基]-1,2-苯并噻唑-3-胺[i-9]的制备
[0350]
步骤1:在环境温度下向5,7-二氯-n-[1-(2-嘧啶-2-基-1,2,4-三唑-3-基)乙基]-1,2-苯并噻唑-3-胺[i-5](900mg,2.6mmol)在ch2cl2(10ml)中的溶液中加入间氯过氧苯甲酸(660mg,3.9mmol)并在该温度下继续搅拌20h。之后,反应混合物用h2o(100ml)淬灭,水相用dcm/i-proh 3:1(3
×
100ml)萃取,合并的有机萃取物用na2so4干燥,过滤,浓缩。
[0351]
通过制备型hplc提纯得到5,7-二氯-1,1-二氧代-n-[1-(2-嘧啶-2-基-1,2,4-三唑-3-基)乙基]-1,2-苯并噻唑-3-胺[i-9](116mg,11%),为黄色固体,和5,7-二氯-1-氧代-n-[1-(2-嘧啶-2-基-1,2,4-三唑-3-基)乙基]-1,2-苯并噻唑-3-胺[i-8](65mg,6.1%),为黄色固体。
[0352]
[i-9]:1h-nmr(400mhz,dmso-d6,rt):δppm 8.92(d,j=4.8hz,2h),8.23(s,1h),8.18(br s,1h),8.06(d,j=1.2hz,1h),7.59(t,j=4.8hz,1h),6.04(q,j=6.9hz,1h),1.69(d,j=6.8hz,3h)。
[0353]
[i-8]:1h-nmr(400mhz,dmso-d6,rt):δppm 9.58-9.45(m,1h),9.02-8.93(m,2h),8.42-8.34(m,1h),8.25-8.18(m,1h),7.98(d,j=1.3hz,1h),7.67-7.58(m,1h),6.26-6.10(m,1h),1.78-1.67(m,3h)。
[0354]
实施例10:2-[[5,7-双(三氟甲基)-1,2-苯并唑-3-基]-甲氧羰基-氨基]丙酸叔丁酯
[0355]
步骤1:在-60℃和n2气氛下向2-[[5,7-双(三氟甲基)-1,2-苯并唑-3-基]-甲氧羰基-氨基]-乙酸叔丁酯(550mg,1.24mmol,参见实施例15)在ch2cl2(16ml)中的溶液中加入双(三甲基甲硅烷基)氨基钾(1.86ml,1.86mmol),然后在0.5h后滴加meotf(408mg,
2.49mmol)。将所得反应混合物在-60℃至0℃之间搅拌12h,然后tlc分析(pe/etoac=5:1)显示反应完成。将反应混合物倒入冰冷的nh4cl溶液(100ml,饱和水溶液)中,水相用ch2cl2(3
×
50ml)萃取,合并的有机萃取物用nacl溶液(饱和水溶液)洗涤,用na2so4干燥,过滤并减压浓缩。通过硅胶柱层析(etoac/pe0:100-7:93,梯度)提纯得到2-[[5,7-双(三氟甲基)-1,2-苯并唑-3-基]-甲氧羰基氨基]丙酸叔丁酯(450mg),被起始材料污染。
[0356]1h-nmr(400mhz,cdcl3,rt):δppm 8.33(s,1h),8.05(s,1h),4.99(q,j=7.15hz,1h),3.87(s,3h),1.63(d,j=7.28hz,3h),1.42(s,9h)。
[0357]
上述的2-[[5,7-双(三氟甲基)-1,2-苯并唑-3-基]-甲氧羰基-氨基]丙酸叔丁酯可以在酸性boc裂解后进一步细化为例如类似于实施例11中所述的化合物i-36。
[0358]
实施例11:n-[1-(2-嘧啶-2-基-1,2,4-三唑-3-基)丙基]-5,7-双(三氟甲基)-1,2-苯并唑-3-胺[i-28]的制备
[0359]
步骤1:在环境温度下向5,7-双(三氟甲基)-1,2-苯并唑-3-胺(270mg,1.00mmol;参见实施例1)和2-氧代丁酸乙酯(195mg,1.50mmol)在1,2-二氯乙烷(3.0ml)中的溶液中加入et3sih(349mg,3.00mmol)和f3cco2h(342mg,11.1mmol),然后将反应混合物加热至80℃并在该温度下搅拌36h。然后tlc分析(pe/etoac=5:1,rf=0.6)显示反应完成。将混合物倒入h2o(10ml)中,水相用ch2cl2(3
×
5ml)萃取,合并的有机萃取物用nacl溶液(5ml,饱和水溶液)洗涤,用na2so4干燥,过滤并减压浓缩。通过硅胶柱(pe中etoac=7%)提纯得到2-[[5,7-双(三氟甲基)-1,2-苯并唑-3-基]氨基]丁酸乙酯(300mg,86%),为白色固体。
[0360]1h-nmr(400mhz,cdcl3,rt):δppm 8.06(s,1h),7.96(s,1h),5.40(br d,j=7.6hz,1h),4.60-4.42(m,1h),4.39-4.21(m,2h),2.21-2.08(m,1h),1.93(qd,j=7.2,14.0hz,1h),1.36(t,j=7.1hz,3h),1.03(t,j=7.4hz,3h)。
[0361]
步骤2:在0℃下向2-[[5,7-双(三氟甲基)-1,2-苯并唑-3-基]氨基]丁酸乙酯(1.5g,3.91mmol)在thf(20ml)中的溶液中加入h2o(10ml)中lioh
·
h2o(328mg,7.80mmol),然后将反应混合物温热至环境温度并在该温度下搅拌3h。然后tlc分析(pe/etoac=1:1,rf=0.5)显示反应完成。将混合物倒入h2o(20ml)中,水相用etoac(3
×
30ml)萃取,合并的有机萃取物用nacl溶液(10ml,饱和水溶液)洗涤,用na2so4干燥,过滤并减压浓缩。通过硅胶柱层析(pe/etoh=3:1)提纯得到2-[[5,7-双(三氟甲基)-1,2-苯并唑-3-基]氨基]丁酸(1.2g,86%),为黄色固体。
[0362]1h-nmr(400mhz,dmso-d6,rt):δppm 8.96(s,1h),8.32-8.19(m,1h),7.95(s,1h),7.71(br d,j=8.0hz,1h),4.09-3.94(m,1h),2.01-1.70(m,2h),0.99(t,j=7.4hz,3h)。
[0363]
步骤3:在环境温度下向2-[[5,7-双(三氟甲基)-1,2-苯并唑-3-基]氨基]丁酸(1.20g,3.40mmol)在thf(10ml)中的溶液中加入boc2o(1.46g,6.80mmol)、吡啶(529mg,6.80mmol)和nh4hco3(529.3mg,6.8mmol),将反应混合物在该温度下搅拌16h。然后tlc分析(pe/etoac=1:1,rf=0.4)显示反应完成。将混合物减压浓缩并通过硅胶柱层析(pe中etoac=70%)提纯得到2-[[5,7-双(三氟甲基)-1,2-苯并唑-3-基]氨基]丁酰胺(1.0g,83%),为黄色固体。
[0364]1h-nmr(400mhz,dmso-d6,rt):δppm 8.93(s,1h),8.30-8.18(m,1h),7.65-7.55(m,
2h),7.11(s,1h),4.37(t,j=5.1hz,1h),1.92-1.67(m,2h),1.17(t,j=7.1hz,3h)。
[0365]
步骤4:在环境温度下向2-[[5,7-双(三氟甲基)-1,2-苯并唑-3-基]氨基]丁酰胺(1.0g,2.8mmol)在ch2cl2(10ml)中的溶液中加入n,n-二甲基甲酰胺二甲基乙缩醛(672mg,5.64mmol),然后将所得反应混合物加热至50℃并在该温度下搅拌2h。然后tlc分析(etoac,rf=0.6)显示反应完成。减压浓缩混合物,得到2-[[5,7-双(三氟甲基)-1,2-苯并唑-3-基]氨基]-n-(二甲氨基亚甲基)丁酰胺(1.2g,粗品),为黄色油,不经进一步提纯直接用于下一步。
[0366]
步骤5:在环境温度下向2-[[5,7-双(三氟甲基)-1,2-苯并唑-3-基]氨基]-n-(二甲氨基亚甲基)丁酰胺(1.2g,2.9mmol)在1,4-二烷(4.0ml)中的溶液中加入嘧啶-2-基肼(321mg,2.92mmol),再搅拌5min后,加入acoh(4ml),然后将反应混合物加热至80℃并在该温度下搅拌1.5h。然后将混合物减压浓缩,用nahco3(饱和水溶液)调节ph=7,用etoac(3
×
30ml)萃取水相,并用nacl溶液(10ml)洗涤合并的有机萃取物,用na2so4干燥,过滤并浓缩。通过制备型hplc(tfa)提纯得到n-[1-(2-嘧啶-2-基-1,2,4-三唑-3-基)丙基]-5,7-双(三氟甲基)-1,2-苯并唑-3-胺[i-28](441mg,33%),为白色固体。
[0367]1h-nmr(400mhz,cdcl3,rt):δppm 8.97(d,j=4.9hz,2h),8.14(s,2h),7.93(s,1h),7.49(t,j=4.8hz,1h),6.68(br d,j=9.7hz,1h),6.23(dt,j=4.9,8.8hz,1h),2.32-2.21(m,1h),2.11(quint,j=7.4,14.6hz,1h),1.17(t,j=7.4hz,3h)。
[0368]
实施例12:2-[[5,7-双(三氟甲基)-1,2-苯并唑-3-基]-[1-(2-嘧啶-2-基-1,2,4-三唑-3)-基)乙基]氨基]苯甲酸乙酯[i-39]的制备2-[1-(2-嘧啶-2-基-1,2,4-三唑-3-基)乙基氨基]乙基苯甲酸酯的制备:
[0369]
步骤1:在0℃和n2气氛中向ch2cl2(1.0l)中(2,2-二甲基-1,3-二氧戊环-4-基)甲醇(100g,0.76mol)和et3n(76g,0.76mol)中滴加phc(o)cl(106g,0.76mol),移去冷却浴,将反应混合物在环境温度下搅拌6h。然后有机相用h2o(1l)和nacl溶液(1l,饱和水溶液)洗涤,用na2so4干燥,过滤并减压浓缩。将残余物重新溶解在meoh(1l)中,在环境温度下加入amberlyst-15(100g),并将所得混合物在该温度下搅拌16h。tlc分析(pe/etoac=1:1,rf=0.4)显示反应完成。过滤反应混合物,浓缩滤液,得到苯甲酸2,3-二羟丙酯(110g,粗品),为无色油,无需进一步提纯即可用于下一步。
[0370]1h-nmr(400mhz,cdcl3,rt):δppm 8.11-8.00(m,2h),7.62-7.52(m,1h),7.50-7.40(m,2h),4.51-4.33(m,2h),4.12-4.05(m,1h),3.86-3.64(m,2h)。
[0371]
步骤2:在环境温度下向ch2cl2(600ml)中2,3-苯甲酸二羟丙酯(65g,0.33mol)和naio4(141g,0.66mol)的混合物中加入nahco3(30ml,饱和水溶液),将所得反应混合物在该温度下搅拌6h。然后tlc分析(pe/etoac=1:1,rf=0.4)显示反应完成。将混合物用na2so4干燥并浓缩,得到苯甲酸2-氧代乙酯(55g,粗品),为无色油,其无需进一步提纯即可直接用于下一步。
[0372]
步骤3:在环境温度下向1-(2-嘧啶-2-基-1,2,4-三唑-3-基)乙胺(45g,0.20mol,如wo2017/192385中所述制备)在meoh(500ml)中的溶液中加入et3n(20g,0.20mol)、苯甲酸2-氧代乙酯(49g,0.30mol)和4a ms(100g)。10min后,分小份加入nacnbh3(37g,0.6mol)并在该温度下继续搅拌16h。然后tlc分析(etoac/etoh=3:1,rf=0.5)显示反应完成。过滤混
合物,减压浓缩滤液。通过柱层析(etoh/etoac=30%)和制备型hplc(nh4hco3)提纯得到2-[1-(2-嘧啶-2-基-1,2,4-三唑-3-基)乙基氨基]乙基苯甲酸酯(21g,31%)为无色油。
[0373]1h-nmr(400mhz,dmso-d6,rt):δppm 8.95(d,j=4.9hz,2h),8.15(s,1h),7.91-7.84(m,2h),7.66-7.55(m,2h),7.53-7.42(m,2h),4.74(q,j=6.6hz,1h),4.25-4.11(m,2h),2.84-2.65(m,2h),2.59(br s,1h),1.43(d,j=6.8hz,3h)。
[0374]
2-[[5,7-双(三氟甲基)-1,2-苯并唑-3-基]-[1-(2-嘧啶-2-基-1,2,4-三唑-3-基)乙基]氨基]乙基苯甲酸酯[i-39]的制备:
[0375]
步骤1:在co气氛(气体,50psi)下向2-氯-1-碘-3,5-双(三氟甲基)苯(50g,0.13mol)、et3n(27g,0.27mol)、pd(oac)2(1.0g,cat.)和1,1'-双(二苯基膦基)二茂铁(1.0g,cat.)在meoh(300ml)/mecn(1.2l)中的混合物加热至50℃下并在该温度下搅拌12h。然后tlc分析(pe,rf=0.4)显示反应完成。将混合物减压浓缩并通过柱层析(pe)提纯,得到2-氯-3,5-双(三氟甲基)苯甲酸甲酯(37g,89%),为黄色油。1h-nmr(400mhz,dmso-d6,rt):δppm8.47(s,1h),8.35(s,1h),3.93(s,3h)。
[0376]
步骤2:在环境温度和n2气氛下向2-氯-3,5-双(三氟甲基)苯甲酸甲酯(110g,0.36mmol)在thf(1.0l)中的溶液中一次加入naome(29g,0.54mol),并将所得反应混合物在该温度下搅拌16h。然后tlc分析(pe/etoac=10:1,rf=0.6)显示反应完成。浓缩混合物,残余物用nh4cl溶液(1l,饱和水溶液)稀释,水相用etoac(2
×
500ml)萃取,合并的有机萃取物用nacl溶液(1l,饱和水溶液)洗涤,用na2so4干燥,过滤并减压浓缩。通过柱层析(etoac/pe 5:95)提纯,得到2-甲氧基-3,5-双(三氟甲基)苯甲酸甲酯(100g,92%),为无色油。
[0377]1h-nmr(400mhz,cdcl3,rt):δppm 8.30(d,j=2.1hz,1h),8.01(d,j=2.3hz,1h),4.00(s,3h),3.99(s,3h)。
[0378]
步骤3:在室温和n2气氛下向2-甲氧基-3,5-双(三氟甲基)苯甲酸甲酯(100g,0.33mmol)在ch2cl2(1.0l)中的溶液中滴加bbr3(124g,0.50mol)并将所得反应混合物在该温度下搅拌2h。然后tlc分析(etoac/pe 10:90,rf=0.4)显示反应完成。将混合物倒入冰水(1.5l)中,水相用ch2cl2(2
×
500ml)萃取,合并的有机萃取物用nacl溶液(1l,饱和水溶液)洗涤,用na2so4干燥,过滤,并减压浓缩。通过柱层析(etoac/pe 10:90)提纯得到2-羟基-3,5-双(三氟甲基)苯甲酸甲酯(67g,70%),为白色固体。
[0379]1h-nmr(400mhz,cdcl3,rt):δppm 11.9(s,1h),8.33(s,1h),8.01(s,1h),4.08-4.03(m,3h)。
[0380]
步骤4:在环境温度下向2-羟基-3,5-双(三氟甲基)苯甲酸甲酯(26g,90mmol)在thf(300ml)中的溶液中分批加入nabh4(10g,270mmol),然后将反应混合物加热至60℃并在该温度下搅拌16h。然后tlc分析(pe/etoac 10:1,rf=0.2)显示反应完成。将混合物倒入nh4cl溶液(500ml,饱和水溶液)中,水相用etoac(500ml)萃取,有机萃取物用nacl溶液(500ml,饱和水溶液)洗涤,用na2so4干燥,过滤,并减压浓缩。通过柱层析(etoac/pe 30:70)提纯得到2-(羟甲基)-4,6-双(三氟甲基)苯酚(15.5g,66%),为白色固体。
[0381]
步骤5:在0℃下向2-(羟甲基)-4,6-双(三氟甲基)苯酚(31g,0.12mol)在ch2cl2(300ml)中的混合物中分批加入dmp(101g,0.24mol;cas号87413-09-0),然后移去冷却浴并将反应混合物在环境温度下搅拌4h。然后tlc分析(pe/etoac=10:1,rf=0.5)显示反应完成。将混合物倒入na2so3(1.5l,饱和水溶液)中,水相用ch2cl2(2
×
500ml)萃取,合并的有机
萃取液用nacl溶液(500ml,饱和水溶液)洗涤,用na2so4干燥,过滤,并减压浓缩。通过柱层析(etoac/pe 20:80)提纯,得到2-羟基-3,5-双(三氟甲基)苯甲醛(14g,46%),为黄色油。
[0382]1h-nmr(400mhz,cdcl3,rt):δppm 12.1(s,1h),10.0(s,1h),8.07(s,2h)。
[0383]
步骤6:在环境温度下向2-羟基-3,5-双(三氟甲基)苯甲醛(14g,54mmol)和honh2·
hcl(4.5g,65mmol)在etoh(14ml)中的混合物中加入naoac(6.6g,81mmol)并将所得反应混合物在该温度下搅拌2h。然后tlc分析(pe/etoac=10:1,rf=0.4)显示反应完成。将混合物减压浓缩,残余物用h2o(200ml)稀释,水相用etoac(2
×
100ml)萃取,合并的有机萃取物用nacl溶液(1l,饱和水溶液)洗涤,用na2so4干燥,过滤并浓缩。通过柱层析(etoac/pe25:75)提纯得到2-羟基-3,5-双(三氟甲基)苯甲醛肟(7.0g,47%),为黄色固体。
[0384]1h-nmr(400mhz,dmso-d6,rt):δppm 12.2(br s,1h),12.0(br s,1h),8.60(s,1h),8.16(d,j=1.3hz,1h),7.88(s,1h)。
[0385]
步骤7:在15℃和n2气氛下向2-羟基-3,5-双(三氟甲基)苯甲醛肟(273mg,1.0mmol)在dmf(3.0ml)中的溶液中加入n-氯代琥珀酰亚胺(266mg,2.0mmol)并将所得反应混合物在该温度下搅拌2h,然后在35℃下再加热0.5h。然后tlc分析(pe/etoac=10:1)显示反应完成。将混合物倒入h2o(10ml)中,水相用ch2cl2(10ml)萃取,有机萃取物用hcl溶液(10ml,0.5n,在h2o中)和nacl溶液(10ml,饱和水溶液)洗涤,用na2so4干燥,并过滤。减压浓缩得到2-二羟基-3,5-双(三氟甲基)苯甲酰亚胺氯(308mg,粗品),为黄色油,省略任何中间储存,直接用于下一步骤。
[0386]
步骤8:在0℃和n2气氛下向2-二羟基-3,5-双(三氟甲基)苯甲酰亚胺氯(308mg,1.0mmol)在ch2cl2(10ml)中的溶液中加入2-[1-(2-嘧啶-2-基-1,2,4-三唑-3-基)乙基氨基]苯甲酸乙酯(338mg,1.0mmol)和ipr2net(142mg,1.1mmol)的溶液,将所得反应混合物在0-15℃下搅拌12h。然后将混合物倒入h2o(20ml)中,水相用ch2cl2(2
×
20ml)萃取,合并的有机萃取物用hcl溶液(20ml,0.5n,在h2o中)和nacl溶液(20ml,饱和水溶液),用na2so4干燥,过滤,并减压浓缩,得到2-[[n-羟基-c-[2-羟基-3,5-双(三氟甲基)苯基]碳亚胺酰基]-[1-(2-嘧啶-2-基-1,2,4-三唑-3-基)乙基]氨基]苯甲酸乙酯(400mg,粗品),为黄色油。
[0387]
步骤9:在n2气氛和15℃下向2-[[n-羟基-c-[2-羟基-3,5-双(三氟甲基)苯基]碳亚胺酰基]-[1-(2-嘧啶-2-基-1,2,4-三唑-3-基)乙基]氨基]苯甲酸乙酯(400mg,0.657mmol)在thf(10ml)中的溶液中加入1,1'-羰基二咪唑(213mg,1.31mmol),并将所得反应混合物在该温度下搅拌12h。将混合物倒入h2o(20ml)中,水相用etoac(2
×
20ml)萃取,合并的有机萃取物用nacl溶液(20ml)洗涤,用na2so4干燥,过滤并浓缩。通过硅胶柱层析提纯(thf/pe=0:100-50:50,梯度)得到2-[[5,7-双(三氟甲基)-1,2-苯并唑-3-基]-[1-(2-嘧啶-2-基-1,2,4-三唑-3-基)乙基]氨基]苯甲酸乙酯[i-39](80mg,20%),为黄色固体。
[0388]1h-nmr(400mhz,cdcl3,rt):δppm 8.71(br d,j=4.63hz,2h),8.06(s,1h),7.89-7.93(m,2h),7.66(s,1h),7.49-7.55(m,2h),7.34-7.39(m,2h),7.30(t,j=4.82hz,1h),6.75(q,j=7.09hz,1h),4.53(t,j=5.88hz,2h),4.06-4.16(m,2h),1.91(d,j=7.13hz,3h)。
[0389]
实施例13:2-[[5,7-双(三氟甲基)-1,2-苯并唑-3-基]-[1-(2-嘧啶-2-基-1,2,4-三唑-3-基)乙基]氨基]乙醇[i-40]的制备
[0390]
步骤1:在15℃下向2-[[5,7-双(三氟甲基)-1,2-苯并唑-3-基]-[1-(2-嘧啶-2-基-1,2,4-三唑-3-基)乙基]氨基]乙基苯甲酸酯[i-39](110mg,0.186mmol;参见实施例12)在meoh(5ml)中的溶液中加入k2co3(51mg,0.372mmol),并将所得反应混合物在该温度下搅拌3h。然后将混合物倒入nh4cl溶液(10ml,饱和水溶液)中,水相用etoac(2
×
15ml)萃取,合并的有机萃取物用nacl溶液(20ml,饱和水溶液)洗涤,用na2so4干燥,过滤,并减压浓缩。将残余物通过制备型hplc(中性,mecn-h2o)提纯,得到2-[[5,7-双(三氟甲基)-1,2-苯并唑-3-基]-[1-(2-嘧啶-2-基-1,2,4-三唑-3-基)乙基]氨基]乙醇[i-40](80mg,44%),为黄色固体。
[0391]1h-nmr(400mhz,cdcl3,rt):δppm 8.91(d,j=4.88hz,1h),8.88-8.93(m,1h),8.20(br s,1h),8.06(s,1h),7.75(d,j=1.38hz,1h),7.42(t,j=4.88hz,1h),7.36(s,1h),6.70(q,j=7.13hz,1h),4.60(t,j=7.94hz,2h),3.84-4.18(m,2h),1.72(d,j=7.13hz,3h)。
[0392]
实施例14:n-(2-甲氧基乙基)-n-[1-(2-嘧啶-2-基-1,2,4-三唑-3-基)乙基]-5,7-双(三氟甲基)-1,2-苯并唑-3-胺[i-41]的制备
[0393]
步骤1:在15℃下向2-[[5,7-双(三氟甲基)-1,2-苯并唑-3-基]-[1-(2-嘧啶-2-基-1,2,4-三唑-3-基)乙基]氨基]乙醇[i-40](100mg,0.205mmol,参见实施例13)在mecn(1.5ml)中的溶液中加入ag2o(118mg,0.512mmol)和mei(58mg,0.41mmol),并将所得反应混合物在该温度下搅拌12h。然后过滤混合物,将滤液浓缩并通过制备型tlc(etoac=100%)提纯,得到n-(2-甲氧基乙基)-n-[1-(2-嘧啶-2-基-1,2,4-三唑-3-基)乙基]-5,7-双(三氟甲基)-1,2-苯并唑-3-胺[i-41](60mg,58%),为黄色固体。
[0394]1h-nmr(400mhz,cdcl3,rt):δppm 8.85(d,j=4.88hz,2h),8.05(s,1h),7.32-7.39(m,3h),6.48(q,j=7.09hz,1h),4.42(t,j=7.69hz,2h),4.07(q,j=8.17hz,1h),3.80(q,j=7.42hz,1h),3.59(s,3h),1.79(d,j=7.13hz,3h)。
[0395]
实施例15:2-[[5,7-双(三氟甲基)-1,2-苯并唑-3-基]-甲氧羰基-氨基]乙酸叔丁酯
[0396]
步骤1:在n2气氛和0℃下向5,7-双(三氟甲基)-1,2-苯并唑-3-胺(1.50g,5.55mmol)在thf(15ml)中的溶液中加入双(三甲基甲硅烷基)氨基钾(1.0m,在thf中,11.1ml,11.1mmol),然后在0.5h后滴加氯甲酸甲酯(1.57g,16.7mmol),将所得反应混合物在0-25℃下搅拌12h。然后tlc分析(pe/etoac=5:1)显示反应完成。将反应混合物倒入h2o(50ml)中,水相用etoac(2
×
50ml)萃取,合并的有机萃取物用nacl溶液(饱和水溶液)洗涤,用na2so4干燥,过滤,并浓缩减压。通过硅胶柱层析(etoac/pe=0:100-15:85,梯度)提纯得到n-[5,7-双(三氟甲基)-1,2-苯并唑-3-基]-n-甲氧羰基-氨基甲酸甲酯(1.4g,65%),为黄色固体。
[0397]1h-nmr(400mhz,cdcl3,rt):δppm 8.91(s,1h),8.12(s,1h),8.08(s,1h),8.06(s,1h),7.70(br s,1h),3.94(s,3h),3.87(s,6h)。
[0398]
步骤2:在环境温度和n2气氛下向n-[5,7-双(三氟甲基)-1,2-苯并唑-3-基]-n-甲氧羰基-氨基甲酸甲酯(1.0g,2.6mmol)在mecn(30ml)中的溶液中加入2-溴乙酸叔丁酯
(1.52g,7.77mmol)和k2co3(1.07g,7.77mmol),然后将混合物加热至80℃并在该温度下搅拌16h。然后tlc(pe/etoac=5:1)显示反应完成。将反应混合物倒入h2o(50ml)中,水相用etoac(2
×
30ml)萃取,合并的有机萃取物用nacl溶液(饱和水溶液)洗涤,用na2so4干燥,过滤并减压浓缩。通过硅胶柱层析(etoac/pe 0:100-10:90,梯度)提纯得到2-[[5,7-双(三氟甲基)-1,2-苯并唑-3-基]甲氧羰基-氨基]乙酸叔丁酯(1.2g),为白色固体。
[0399]1h-nmr(400mhz,cdcl3,rt):δppm 8.52(br s,1h),8.04(s,1h),4.61(s,2h),3.94(s,3h),1.48(s,9h)。
[0400]
上述2-[[5,7-双(三氟甲基)-1,2-苯并唑-3-基]-甲氧羰基-氨基]乙酸叔丁酯可在酸性boc-裂解后进一步加工成例如与上述实施例11中所述类似的化合物i-35。
[0401][0402]
表i(r3中的虚线表示与式i*的核结构的键)
[0403]
[0404]
[0405][0406]
生物学实施例
[0407]
若无相反说明,则按如下制备测试溶液:将活性化合物以所需浓度溶于1:1(体积比)的蒸馏水:丙酮混合物中。测试溶液在使用当天制备。b.1.作用于埃及伊蚊(aedes aegypti)
[0408]
为了评价对埃及伊蚊的防治,测试单元由含有每孔200μl自来水和5-15只新鲜孵化的埃及伊蚊幼虫的96孔微滴定板构成。
[0409]
使用含有75体积%水和25体积%dmso的溶液配制活性化合物。使用定制微雾化器将不同浓度的配制化合物或混合物以2.5μl喷雾于昆虫膳食上,重复两次。
[0410]
在施用之后,将微滴定板在28+1℃、80+5% rh下温育2天。然后肉眼评价幼虫死亡率。
[0411]
在该测试中,与未处理对照相比,化合物i-1、i-2、i-4、i-5、i-10、i-12、i-13、i-15、i-16、i-17、i-18、i-22、i-23、i-24、i-25、i-26、i-27、i-30、i-32、i-33、i-35、i-36、i-37和i-38分别在2500ppm下显示出至少50%的死亡率。
[0412]
b.2.墨西哥棉铃象(anthonomus grandis)
[0413]
为了评价对墨西哥棉铃象的防治,测试单元由含有昆虫膳食和5-10只墨西哥棉铃象卵的96孔微滴定板构成。
[0414]
使用含有75体积%水和25体积%dmso的溶液配制化合物。使用定制微雾化器将不同浓度的配制化合物以5μl喷雾于昆虫膳食上,重复两次。
[0415]
在施用之后,将微滴定板在约25
±
1℃和约75
±
5%相对湿度下温育5天。然后肉眼评价卵和幼虫死亡率。
[0416]
在该测试中,与未处理对照相比,化合物i-1、i-2、i-3、i-4、i-5、i-8、i-9、i-10、i-12、i-13、i-15、i-16、i-17、i-18、i-19、i 21、i-22、i-23、i-24、i-25、i-26、i-27、i-28、i-29、i-30、i-31、i-32、i-33、i-34、i-36、i-37和i-38分别在2500ppm下显示出至少50%的死亡率。
[0417]
b.3.烟芽夜蛾(heliothis virescens)
[0418]
为了评价对烟芽夜蛾的防治,测试单元由含有昆虫膳食和15-25只烟芽夜蛾卵的96孔微滴定板构成。
[0419]
使用含有75体积%水和25体积%dmso的溶液配制化合物。使用定制微雾化器将不同浓度的配制化合物以10μl喷雾于昆虫膳食上,重复两次。
[0420]
在施用之后,将微滴定板在约28
±
1℃和约80
±
5%相对湿度下温育5天。然后肉眼评价卵和幼虫死亡率。
[0421]
在该测试中,与未处理对照相比,化合物i-1、i-4、i-5、i-7、i-10、i-15、i-17、i-18、i-21、i-22、i-23、i-25、i-26、i-28、i-29、i-30、i-31、i-32、i-33、i-34、i-36、i-37和i-38分别在2500ppm下显示出至少50%的死亡率。
[0422]
b.4.绿桃蚜(myzus persicae)
[0423]
为了通过内吸方式评价对绿桃蚜的防治,测试单元由在人造膜下含有液体人工膳食的96孔微滴定板构成。
[0424]
使用含有75体积%水和25体积%dmso的溶液配制化合物。使用定制吸移管将不同浓度的配制化合物吸移于蚜虫膳食上,重复两次。
[0425]
在施用之后,将5-8只蚜虫成虫放在微滴定板孔内的人造膜上。然后使蚜虫在被处理蚜虫膳食上吸食并在约23
±
1℃和约50
±
5%相对湿度下温育3天。然后肉眼评价蚜虫死亡率和繁殖力。
[0426]
在该测试中,与未处理对照相比,化合物i-1、i-3、i-5、i-6、i-8、i-9、i-10、i-12、i-13、i-15、i-18、i-19、i-25、i-28、i-36、i-37和i-38分别在2500ppm下显示出至少50%的死亡率。
[0427]
b.5.豇豆蚜(豆蚜(aphis craccivora))
[0428]
将活性化合物以所需浓度溶于1:1(体积比)的蒸馏水:丙酮混合物中。以0.01体积%的比例加入表面活性剂(kinetic)。在使用当天制备测试溶液。
[0429]
通过在施用前24小时手动转移被蚜虫侵染的叶子而使盆栽豇豆植株上定居大约30-50只各龄蚜虫。在检查有害物种群之后使用手动喷雾器以20-30psi(≈1.38-2.07巴)用测试溶液喷雾植株。将被处理植株在轻质车上维持在约25-26℃下。72小时后评价死亡百分数。
[0430]
在该测试中,与未处理对照相比,化合物i-12、i-13i-15、i-18、i-27、i-36、i-37、i-38分别在300ppm下显示出至少50%的死亡率。
[0431]
b.6.小菜蛾(plutella xylostella)
[0432]
将活性化合物以所需浓度溶于1:1(体积比)的蒸馏水:丙酮混合物中。以0.01体积%的比例加入表面活性剂(kinetic)。在使用当天制备测试溶液。将卷心菜的叶子(直径60mm)浸入测试溶液中并风干。将被处理叶子放入衬有湿滤纸的陪替氏皿中并接种10只三龄幼虫。处理后72小时记录死亡率。还使用0-100%的评分记录进食损害。
[0433]
在该测试中,与未处理对照相比,化合物i-2、i-7、i-10、i-15、i-17、i-18、i-22、i-23、i-25、i-28、i-29、i-30、i-31、i-33、i-34、i-35、i-36、i-37和i-38分别在300ppm下显示出至少50%的死亡率。
[0434]
b.7.兰花蓟马(dichromothrips corbetti)
[0435]
用于生物分析的兰花蓟马成虫得自持续维持在实验室条件下的种群。为了测试目的,将测试化合物在加有0.01体积%kinetic的丙酮:水的1:1混合物(体积比)中稀释。
[0436]
各化合物的蓟马防除效力通过使用花浸技术评价。将各兰花花瓣浸入处理溶液中并在陪替氏皿中干燥。被处理花瓣与约20只蓟马成虫一起放入各可再密封塑料容器中。所有测试场所在分析持续期间维持在暗条件和约28℃的温度下。处理后72小时记录死亡百分数。
[0437]
在该测试中,与未处理对照相比,化合物i-2、i-7、i-8、i-12、i-13、i-17、i-18、i-28、i-36、i-37和i-38分别在300ppm下显示出至少50%的死亡率。
[0438]
b.8.稻绿蝽(nezara viridula)
[0439]
将活性化合物以所需浓度溶于1:1(体积比)蒸馏水:丙酮的混合物中。以0.01体积%的比例加入表面活性剂(kinetic)。在使用当天制备测试溶液。将大豆豆荚置于衬有湿润滤纸的90x 50mm玻璃陪替氏皿中并用10只晚期三龄稻绿蝽接种。使用手动雾化器将约2ml溶液喷入各陪替氏皿中。测试场所保持在约25-26℃和约65-70%的相对湿度下。5天后记录死亡百分数。
[0440]
在该测试中,与未处理对照相比,化合物i-12、i-15、i-17、i-18、i-37和i-38分别在300ppm下显示出至少50%的死亡率。
[0441]
b.9.二点黑尾叶蝉(nephotettix virescens)
[0442]
在喷雾前24小时将4-5周龄的具有切割的叶上部的稻秧苗清洁并洗涤。将活性化合物在1:1丙酮:水(体积比)中配制并加入0.01体积%表面活性剂(kinetic)。将盆栽稻秧苗用5-6ml测试溶液喷雾,风干,用mylar笼覆盖并用10只成虫接种。将被处理稻植株保持在约28-29℃和约50-60%的相对湿度下。72小时后记录死亡率百分数。
[0443]
在该测试中,与未处理对照相比,化合物i-8、i-13、i-18、i-37在300ppm下显示出至少50%的死亡率。
[0444]
b.10.亚热带粘虫(spodoptera eridania)二龄幼虫
[0445]
活性化合物通过tecan液体处理器在100%环己酮中配制成在管中提供的10
′
000ppm溶液。将该10
′
000ppm溶液在100%环己酮中连续地稀释以制备过渡溶液。这些用作储备溶液,由其通过tecan在50%丙酮:50%水(体积比)中在10或20ml玻璃瓶中制备最终稀释液。非离子表面活性剂以0.01%(体积比)的体积包含在溶液中。然后将各瓶插入装配有雾化喷嘴的自动化静电喷雾器中以施用于植物/昆虫。
[0446]
使利马豆植株(栽培品种sieva)以每盆2株生长并在第一真叶阶段选取用于处理。通过装备有雾化喷嘴的自动化静电植株喷雾器将测试溶液喷雾于叶面上。在喷雾器通风橱中干燥各植株,然后从喷雾器中取出。将各盆放入带有拉链密闭的穿孔塑料袋中。将10-11只亚热带粘虫幼虫放入袋中并拉链密封该袋。将测试植株在生长室中于约25℃和约20-40%相对湿度下保持4天,避免直接暴露于荧光(14:10光:暗光照期)以防止在袋内截热。在处理4天后评价与未处理对照植株相比的死亡率和进食减退。
[0447]
在该测试中,与未处理对照相比,化合物i-5、i-12、i-13、i-16、i-17、i-18、i-22、i-23、i-24、i-25、i-26、i-30、i-33、i-34、i-36和i-37分别在300ppm下显示出至少50%的死亡率。
相关技术
网友询问留言
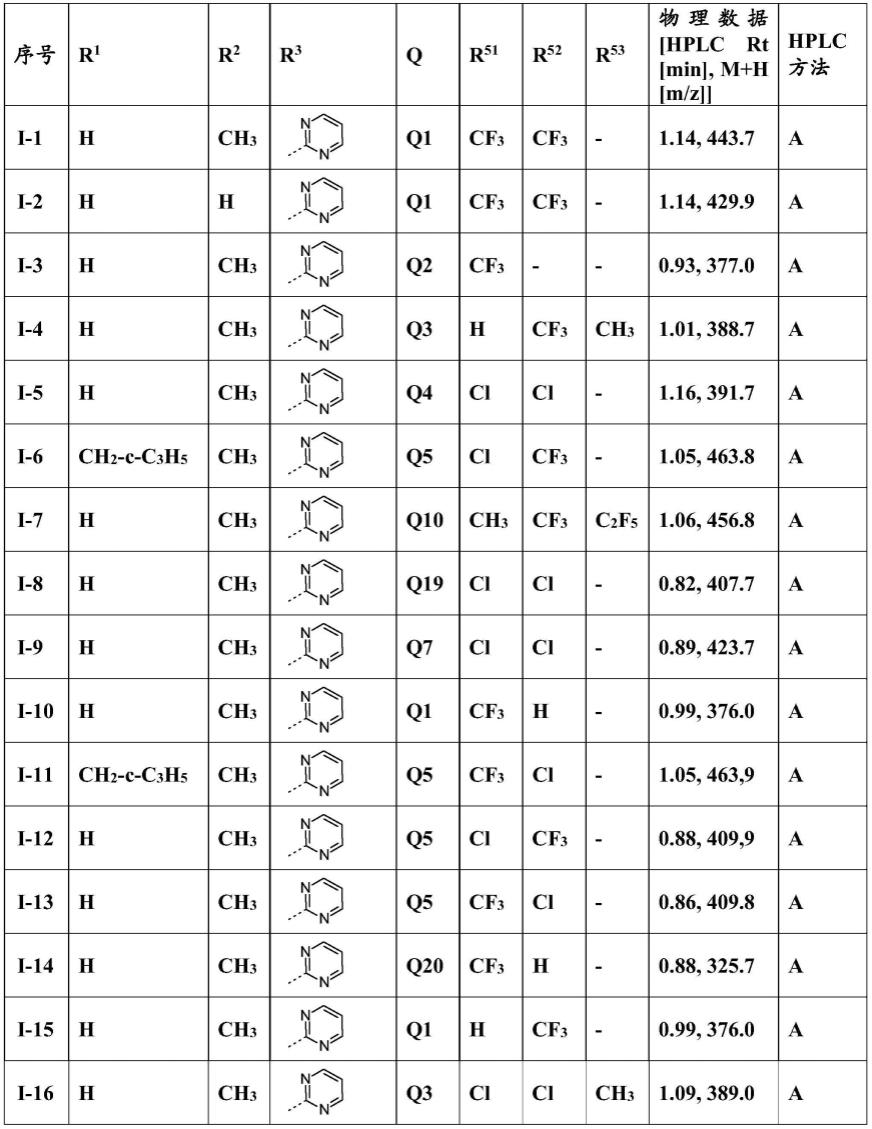
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1