含氟嘧啶化合物和含氟嘧啶酮化合物的制作方法
1.本发明涉及含氟嘧啶化合物和含氟嘧啶酮化合物。
背景技术:
2.据报道,含氟嘧啶化合物具有各种生物活性。其中,对于在嘧啶环的2位具有吡啶环、在5位具有三氟甲基的化合物,有望在医药/农药领域中使用。
3.更具体而言,专利文献1和6报道了2-(4-吡啶基)-5-三氟甲基嘧啶衍生物具有人黑色素聚集激素抑制活性和乙酰coa羧化酶2抑制活性。在专利文献2、4、5和7中,报道了2-(3-吡啶基)-5-三氟甲基嘧啶衍生物具有杀菌活性、杀虫活性、食欲素受体抑制活性、粘着斑激酶抑制活性和乙酰coa羧化酶2抑制活性。在专利文献2和3中,报道了2-(2-吡啶基)-5-三氟甲基嘧啶衍生物具有杀菌活性、杀虫活性和除草活性。从这样的观点出发,期待进一步的活性提高,对向嘧啶环的4位和6位导入取代基感兴趣。
4.此外,报道了吡啶基嘧啶衍生物具有杀菌活性。例如,专利文献8中报道了具有各种取代基的吡啶基嘧啶衍生物针对稻瘟病、小麦眼纹病、苹果黑星病等多种植物病害在预防或治疗上显示出防除效果。
5.在先技术文献
6.专利文献
7.专利文献1:国际公开第2009/089482号;
8.专利文献2:国际公开第2015/016372号;
9.专利文献3:国际公开第1999/028301号;
10.专利文献4:国际公开第2010/063663号;
11.专利文献5:国际公开第2013/004332号;
12.专利文献6:国际公开第2015/056782号;
13.专利文献7:国际公开第2016/030229号;
14.专利文献8:日本特开平7-118235号公报。
技术实现要素:
15.发明要解决的问题
16.然而,以往,从反应性、选择性的方面出发,难以制造在嘧啶环的5位具有含氟取代基、在2位具有杂环作为取代基、在4位和6位具有取代基的含氟嘧啶化合物,没有报告这样的含氟嘧啶化合物。期待该含氟嘧啶化合物具有各种生物活性,期望在嘧啶环的4位和6位具有取代基、在2位具有杂环作为取代基的新型含氟嘧啶化合物。
17.本发明提供以往未知的新型的含氟嘧啶化合物和含氟嘧啶酮化合物,其在嘧啶环的4位和6位具有取代基、在2位具有吡啶环结构作为取代基。
18.解决问题的手段
19.本发明的实施方式所涉及的含氟嘧啶化合物由下述通式(1)、(2)或(3)所示。
20.[化学式1]
[0021][0022]
上述通式(1)~(3)中,
[0023]
w和x各自独立地表示氢原子、卤素原子、碳原子数为1~10的烃基、-c
nf2n+1
(n为1~10的整数)、硝基、-oa1、-soma1(m为1~3的整数)、-sa1、-na1a2、-b(oa1)(oa2)、-coa1、-cooa1、或-cona1a2,
[0024]
y表示卤素原子、碳原子数为1~10的烃基、-c
nf2n+1
(n为1~10的整数)、氰基、硝基、-oa1、-soma1(m为1~3的整数)、-sa1、-na1a2、-b(oa1)(oa2)、-coa1、-cooa1、或-cona1a2,
[0025]
z表示卤素原子或-oa3,
[0026]
a1和a2各自独立地表示氢原子、或碳原子数为1~10的烃基,
[0027]
a3表示碳原子数为1~12的烃基。
[0028]
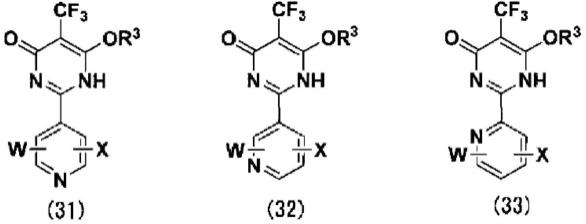
本发明的实施方式所涉及的含氟嘧啶酮化合物由下述通式(31)、(32)或(33)所示。
[0029]
[化学式2]
[0030][0031]
上述通式(31)~(33)中,
[0032]
r3表示氢原子、或碳原子数为1~12的烃基,
[0033]
w和x各自独立地表示氢原子、卤素原子、碳原子数为1~10的烃基、-c
nf2n+1
(n为1~10的整数)、硝基、-oa1、-soma1(m为1~3的整数)、-sa1、-na1a2、-b(oa1)(oa2)、-coa1、-cooa1、或-cona1a2,
[0034]
a1和a2各自独立地表示氢原子、或碳原子数为1~10的烃基。
[0035]
在本发明的一个实施方式中,所述w和x为氢原子。
[0036]
发明效果
[0037]
根据本发明,可以提供在嘧啶环的4位和6位具有取代基、在2位具有吡啶环结构作为取代基的新型的含氟嘧啶化合物和含氟嘧啶酮化合物。
具体实施方式
[0038]
(含氟嘧啶化合物)
[0039]
本实施方式的含氟嘧啶化合物由下述通式(1)、(2)或(3)所示。
[0040]
[化学式3]
[0041][0042]
上述通式(1)~(3)中,
[0043]
w和x各自独立地表示氢原子、卤素原子、碳原子数为1~10的烃基、-c
nf2n+1
(n为1~10的整数)、硝基、-oa1、-soma1(m为1~3的整数)、-sa1、-na1a2、-b(oa1)(oa2)、-coa1、-cooa1、或-cona1a2,
[0044]
y表示卤素原子、碳原子数为1~10的烃基、-c
nf2n+1
(n为1~10的整数)、氰基、硝基、-oa1、-soma1(m为1~3的整数)、-sa1、-na1a2、-b(oa1)(oa2)、-coa1、-cooa1、或-cona1a2,
[0045]
z表示卤素原子或-oa3,
[0046]
a1和a2各自独立地表示氢原子、或碳原子数为1~10的烃基,
[0047]
a3表示碳原子数为1~12的烃基。
[0048]
z为卤素原子时,卤素原子为f、cl、br或i,优选为f或cl。
[0049]
z为-oa3时,a3表示碳原子数为1~12的烃基,只要是碳原子数为1~12的由碳原子和氢原子构成的烃基就不受到特别限定,可以举出链状烃基、芳香族烃基、脂环式烃基等。链状烃基只要总碳原子数为1~12就不受到特别限定,可以是直链状烃基,也可以是分支的链状烃基。芳香族烃基只要总碳原子数为6~12就不受到特别限定,可以为具有取代基的芳香族烃基,也可以为不具有取代基的芳香族烃基。另外,芳香族烃基可以具有稠合多环结构。脂环式烃基只要总碳原子数为3~12就不受到特别限定,可以为具有取代基的脂环式烃基,也可以为不具有取代基的脂环式烃基。另外,脂环式烃基可以具有桥环结构。
[0050]
作为链状烃基,可以举出:甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、戊基、己基、庚基、辛基、壬基、癸基、十一烷基、十二烷基等烷基;
[0051]
乙烯基、丙烯基、丁烯基、戊烯基、己烯基、庚烯基、辛烯基、壬烯基、癸烯基、十一碳烯基、十二碳烯基等烯基;
[0052]
乙炔基、丙炔基、丁炔基、戊炔基、己炔基、庚炔基、辛炔基、壬炔基、癸炔基、十一炔基、十二炔基等炔基等。
[0053]
作为芳香族烃基,可以举出苯基、苄基、甲苯基、萘基。甲苯基可以是邻甲苯基、间甲苯基和对甲苯基中的任一种,优选为对甲苯基。
[0054]
作为脂环式烃基,举出饱和或不饱和的环状烃基,作为环状烃基的例子,可以举出环丙基、环丁基、环己基、环戊基、金刚烷基、降冰片基等。
[0055]
w和x各自独立地表示氢原子、卤素原子、碳原子数为1~10的烃基、-c
nf2n+1
(n为1~10的整数)、硝基、硼酸基、-oa1、-soma1(m为1~3的整数)、-sa1、-na1a2、-cooa1、或-cona1a2,优选表示氢原子、卤素原子、或碳原子数1~10的烃基,特别优选表示氢原子。w和x可以彼此相同或不同。
[0056]
w和x中,卤素原子为f、cl、br或i,优选为f或cl。
[0057]
w和x中,碳原子数为1~10的烃基只要是由碳原子和氢原子构成的烃基就不受到特别限定,例如,可以为上述a3中举出的烃基中碳原子数为1~10的烃基。
[0058]
w和x中,-c
nf2n+1
只要是由碳原子和氟原子构成的全氟烷基就不受到特别限定,可以为直链状,也可以为支链状。另外,n为1~10的整数,优选为1~3的整数。
[0059]
w和x中,-oa1、-soma1、-sa1、-coa1、-cooa1中包含的a1表示氢原子、或碳原子数为1~10的烃基。a1表示碳原子数为1~10的烃基时,例如可以设为上述a3中举出的烃基中碳原子数为1~10的烃基。另外,m为1~3的整数,优选为1。
[0060]
w和x中,-na1a2中所含的a1和a2各自独立地表示氢原子、或碳原子数为1~10的烃基。a1和a2可以彼此相同或不同。a1和a2表示碳原子数为1~10的烃基时,例如可以为上述a3中举出的烃基中碳原子数为1~10的烃基。
[0061]
w和x中,-b(oa1)(oa2)中所含的a1和a2各自独立地表示氢原子、或碳原子数为1~10的烃基。a1和a2可以彼此相同或不同。a1和a2表示碳原子数为1~10的烃基时,例如可以为上述a3中举出的烃基中碳原子数为1~10的烃基。
[0062]
w和x中,在-cona1a2中所含的a1和a2各自独立地表示氢原子、或碳原子数为1~10的烃基。a1和a2可以彼此相同或不同。a1和a2表示碳原子数为1~10的烃基时,例如可以为上述a3中举出的烃基中碳原子数为1~10的烃基。
[0063]
y表示卤素原子、碳原子数为1~10的烃基、-c
nf2n+1
(n为1~10的整数)、氰基、硝基、-oa1、-soma1(m为1~3的整数)、-sa1、-na1a2、-b(oa1)(oa2)、-coa1、-cooa1、或-cona1a2,优选表示卤素原子、-oa1、-soma1(m为1~3的整数)、-sa1、或-na1a2。
[0064]
y中,卤素原子为f、cl、br或i,优选为f或cl。
[0065]
y中,碳原子数为1~10的烃基只要是由碳原子和氢原子构成的烃基就不受到特别限定,例如可以为上述a3中举出的烃基中碳原子数为1~10的烃基。
[0066]
y中,-c
nf2n+1
只要是由碳原子和氟原子构成的全氟烷基就不受到特别限定,可以为直链状,也可以为支链状。另外,n为1~10的整数,优选为1~3的整数。
[0067]
y中,-oa1、-soma1、-sa1、-coa1、-cooa1中所含的a1表示氢原子、或碳原子数为1~10的烃基。a1表示碳原子数为1~10的烃基时,例如可以为上述a3中举出的烃基中碳原子数为1~10的烃基。另外,m为1~3的整数,优选为1或2。
[0068]
y中,-na1a2中所含的a1和a2各自独立地表示氢原子、或碳原子数为1~10的烃基。a1和a2可以彼此相同或不同。a1和a2表示碳原子数为1~10的烃基时,例如可以为上述a3中举出的烃基中碳原子数为1~10的烃基。
[0069]
y中、-b(oa1)(oa2)中所含的a1和a2各自独立地表示氢原子、或碳原子数为1~10的烃基。a1和a2可以彼此相同或不同。a1和a2表示碳原子数为1~10的烃基时,例如可以为上述a3中举出的烃基中碳原子数为1~10的烃基。
[0070]
y中,在-cona1a2中所含的a1和a2各自独立地表示氢原子、或碳原子数为1~10的烃
基。a1和a2可以彼此相同或不同。a1和a2表示碳原子数为1~10的烃基时,例如可以为上述a3中举出的烃基中碳原子数为1~10的烃基。
[0071]
本实施方式中的含氟嘧啶化合物由于在嘧啶环的2位具有特定的取代基(吡啶基)、在嘧啶环的6位和5位上具有特定的取代基(z、-cf3),因此从结构扩展性的观点出发能够具有优异的效果。特别是,本实施方式中的含氟嘧啶化合物能够期待期望的生物活性(例如,激素和酶的抑制活性、杀菌活性、杀虫活性、除草活性),例如可以作为具有药理活性的化合物或其中间体使用,可以期待作为针对多种植物病害、特别是黄瓜白粉病等病原菌在预防或治疗上显示防除效果的杀菌剂或其中间体。具体而言,含有本发明中的含氟嘧啶化合物的杀菌剂作为针对黄瓜白粉病的病原菌显示除菌效果的物质是有用的。另外,位于嘧啶环的2位上的吡啶环结构可以进一步具有取代基,也可以不具有取代基。在吡啶环结构具有取代基的情况下,对本实施方式中的含氟嘧啶化合物赋予进一步的特性。本实施方式中的含氟嘧啶化合物例如在有机半导体、液晶等电子材料的领域中是有用的。
[0072]
(含氟嘧啶化合物的制造方法)
[0073]
本实施方式中的含氟嘧啶化合物的制造方法例如可以通过适当改良并组合使用“综合有机转换:功能性小组的筹备工作指南,第3版”(comprehensive organic transformation:a guide to functional group preparations,3
rd edition(richard c.larock,john wiley&sons inc.,2018))等参考文献中记载的已知方法或后述的实施例中所示的方法等来制造。以下,举例示出本实施方式中含氟嘧啶化合物的制造方法的一部分。
[0074]
作为本实施方式中的含氟嘧啶化合物的制造方法的具体例,例如可列举出以下的反应。
[0075]
《亲核取代反应或亲电加成反应》
[0076]
(a)含有4-吡啶基的嘧啶化合物
[0077]
(a-1)
[0078]
通过使下述通式(4)所示的吡啶基嘧啶衍生物与亲核试剂反应,得到下述通式(5)的含氟嘧啶化合物(工序(a-1))。
[0079]
[化学式4]
[0080][0081]
(a-2)
[0082]
通式(5)中,y1为-sa1时,任意地,通过下述通式(6)所示的含氟嘧啶化合物与作为亲电试剂的过氧化氢的进一步反应使s氧化,得到下述通式(7)的含氟嘧啶化合物(工序(a-2))。
[0083]
[化学式5]
[0084][0085]
上述通式(7)中,y3为-soma1,m为1~3的整数。
[0086]
(a-3)
[0087]
通式(5)中,y1为卤素原子时,任意地,通过下述通式(5-1)所示的含氟嘧啶化合物与作为亲核试剂的胺、醇盐、硫醇盐、有机金属试剂或不同于y
1a
的卤素原子的进一步反应,使y
1a
的卤素原子取代,得到下述通式(7-1)的含氟嘧啶化合物(工序(a-3))。
[0088]
[化学式6]
[0089][0090]
上述通式(5-1)中,y
1a
为卤素原子,
[0091]
上述通式(7-1)中,y
3a
为-na1a2、oa1、sa1、碳原子数为1~10的烃基或不同于y
1a
的卤素原子,a1和a2各自独立地表示氢原子、或碳原子数为1~10的烃基。
[0092]
(a-4)
[0093]
通式(5)中,y1和z分别为-oa3时,任意地,使下述通式(5-2)所示的含氟嘧啶化合物的烷氧基脱烷基化,进而使作为亲核试剂的卤素原子反应,由此使y
1b
和za的-oa3分别取代,得到下述通式(7-2)的含氟嘧啶化合物(工序(a-4))。
[0094]
[化学式7]
[0095][0096]
上述通式(5-2)中,y
1b
和za分别为-oa3,上述通式(7-2)中,y
3b
和zb各自表示卤素原子。
[0097]
(a-5)
[0098]
任意地,通过上述通式(7-2)所示的含氟嘧啶化合物与作为亲核试剂的胺、氢氧根离子、醇盐或硫醇盐的进一步反应,使y
3b
的卤素原子取代,并且任意地使zb的卤素原子取代,得到下述通式(7-3)的含氟嘧啶化合物(工序(a-5))。
[0099]
[化学式8]
[0100][0101]
上述通式(7-3)中,y
3c
表示-na1a2、oa1或sa1,zb表示卤素原子或oa1。a1和a2各自独立地表示氢原子、或碳原子数为1~10的烃基。
[0102]
(b)含有3-吡啶基的嘧啶化合物
[0103]
(b-1)
[0104]
通过使下述通式(8)所示的吡啶基嘧啶衍生物与亲核试剂反应,得到下述通式(9)的含氟嘧啶化合物(工序(b-1))。
[0105]
[化学式9]
[0106][0107]
(b-2)
[0108]
通式(9)中,y1为-sa1时,任意地,通过下述通式(10)所示的含氟嘧啶化合物与作为亲电试剂的过氧化氢等氧化剂的进一步反应使s氧化,得到下述通式(11)的含氟嘧啶化合物(工序(b-2))。
[0109]
[化学式10]
[0110][0111]
上述通式(11)中,y3为-soma1,m为1~3的整数。
[0112]
(b-3)
[0113]
通式(9)中,在y1为卤素原子的情况下,任意地,通过由下述通式(9-1)所示的含氟嘧啶化合物与作为亲核试剂的胺、醇盐、硫醇盐、有机金属试剂或不同于y
1a
的卤素原子的进一步反应,使y
1a
的卤素原子取代,得到下述通式(11-1)所示的含氟嘧啶化合物(工序(b-3))。
[0114]
[化学式11]
[0115][0116]
上述通式(9-1)中,y
1a
为卤素原子,
[0117]
上述通式(11-1)中,y
3a
为-na1a2、oa1、sa1、碳原子数为1~10的烃基或不同于y
1a
的
卤素原子,a1和a2各自独立地表示氢原子、或碳原子数为1~10的烃基。
[0118]
(b-4)
[0119]
通式(9)中,y1和z分别为-oa3时,任意地,将下述通式(9-2)所示的含氟嘧啶化合物的烷氧基脱烷基化,进而使作为亲核试剂的卤素原子反应,由此分别取代y
1b
和za的-oa3,得到下述通式(11-2)的含氟嘧啶化合物(工序(b-4))。
[0120]
[化学式12]
[0121][0122]
上述通式(9-2)中,y
1b
和za分别为-oa3,上述通式(11-2)中,y
3b
和zb分别表示卤素原子。
[0123]
(b-5)
[0124]
任意地,通过上述通式(11-2)所示的含氟嘧啶化合物与作为亲核试剂的胺、氢氧根离子、醇盐或硫醇盐的进一步反应,使y
3b
的卤素原子取代,并且任意地使zb的卤素原子取代,得到下述通式(11-3)的含氟嘧啶化合物(工序(b-5))。
[0125]
[化学式13]
[0126][0127]
上述通式(11-3)中,y
3c
表示-na1a2、oa1或sa1,zb表示卤素原子或oa1。a1和a2各自独立地表示氢原子、或碳原子数为1~10的烃基。
[0128]
(c)含有2-吡啶基的嘧啶化合物
[0129]
(c-1)
[0130]
通过使下述通式(12)所示的吡啶基嘧啶衍生物与亲核试剂反应,得到下述通式(13)的含氟嘧啶化合物(工序(c-1))。
[0131]
[化学式14]
[0132][0133]
(c-2)
[0134]
通式(13)中,y1为-sa1时,任意地,通过下述通式(14)所示的含氟嘧啶化合物与作为亲电试剂的过氧化氢等氧化剂的进一步反应使s氧化,得到下述通式(15)的含氟嘧啶化合物(工序(c-2))。
[0135]
[化学式15]
[0136][0137]
上述通式(15)中,y3为-soma1,m为1~3的整数。
[0138]
(c-3)
[0139]
通式(13)中,y1为卤素原子时,任意地,通过下述通式(13-1)所示的含氟嘧啶化合物与作为亲核试剂的胺、醇盐、硫醇盐、有机金属试剂或不同于y
1a
的卤素原子的进一步反应,使y
1a
的卤素原子取代,得到下述通式(15-1)的含氟嘧啶化合物(工序(c-3))。
[0140]
[化学式16]
[0141][0142]
上述通式(13-1)中,y
1a
为卤素原子,
[0143]
上述通式(15-1)中,y
3a
为-na1a2、oa1、sa1、碳原子数为1~10的烃基或不同于y
1a
的
卤原子,a1和a2各自独立地表示氢原子、或碳原子数为1~10的烃基。
[0144]
(c-4)
[0145]
通式(13)中,y1和z分别为-oa3时,任意地,使下述通式(13-2)所示的含氟嘧啶化合物的烷氧基脱烷基化,进而使作为亲核试剂的卤素原子反应,由此使y
1b
和za的-oa3分别取代,得到下述通式(15-2)的含氟嘧啶化合物(工序(c-4))。
[0146]
[化学式17]
[0147][0148]
上述通式(13-2)中,y
1b
和za分别为-oa3,上述通式(15-2)中,y
3b
和zb分别表示卤素原子。
[0149]
(c-5)
[0150]
任意地,通过上述通式(15-2)所示的含氟嘧啶化合物与作为亲核试剂的胺、氢氧根离子、醇盐、硫醇盐的进一步反应,使y
3b
的卤素原子取代,并且使zb的卤素原子任意地取代,得到下述通式(15-3)的含氟嘧啶化合物(工序(c-5))。
[0151]
[化学式18]
[0152][0153]
上述通式(15-3)中,y
3c
为-na1a2、oa1或sa1,zb表示卤素原子或oa1。a1和a2各自独立地表示氢原子、或碳原子数为1~10的烃基。
[0154]
《水解反应和卤化的2阶段工序>
[0155]
(d)含有4-吡啶基的嘧啶化合物
[0156]
(d-1)
[0157]
通过将下述通式(4)所示的吡啶基嘧啶衍生物水解,得到下述通式(16)的吡啶基嘧啶酮衍生物(工序(d-1))。
[0158]
[化学式19]
[0159][0160]
(d-2)
[0161]
通过将得到的通式(16)所示的吡啶基嘧啶酮衍生物卤化,得到下述通式(19)的含氟嘧啶化合物(工序(d-2))。
[0162]
[化学式20]
[0163][0164]
上述通式(19)中,y2表示卤素原子。
[0165]
(e)含有3-吡啶基的嘧啶化合物
[0166]
(e-1)
[0167]
通过将下述通式(8)所示的吡啶基嘧啶衍生物水解,得到下述通式(17)的吡啶基嘧啶酮衍生物(工序(e-1))。
[0168]
[化学式21]
[0169][0170]
(e-2)
[0171]
通过将得到的通式(17)所示的吡啶基嘧啶酮衍生物卤化,得到下述通式(20)的含氟嘧啶化合物(工序(e-2))。
[0172]
[化学式22]
[0173][0174]
上述通式(20)中,y2表示卤素原子。
[0175]
(f)含有2-吡啶基的嘧啶化合物
[0176]
(f-1)
[0177]
通过将下述通式(12)所示的吡啶基嘧啶衍生物水解,得到下述通式(18)的吡啶基嘧啶酮衍生物(工序(f-1))。
[0178]
[化学式23]
[0179][0180]
(f-2)
[0181]
通过将得到的通式(18)所示的吡啶基嘧啶酮衍生物卤化,得到下述通式(21)的含氟嘧啶化合物(工序(f-2))。
[0182]
[化学式24]
[0183][0184]
上述通式(21)中,y2表示卤素原子。
[0185]
(g)含有4-吡啶基的嘧啶化合物
[0186]
(g-1)
[0187]
通过将下述通式(22)所示的吡啶基嘧啶衍生物脱烷基化,得到下述通式(23)的吡啶基嘧啶酮衍生物(工序(g-1))。
[0188]
[化学式25]
[0189][0190]
(g-2)
[0191]
通过将得到的通式(23)所示的吡啶基嘧啶酮衍生物卤化,得到下述通式(24)的含氟嘧啶化合物(工序(g-2))。
[0192]
[化学式26]
[0193][0194]
上述通式(24)中,y2表示卤素原子。
[0195]
(g-3)
[0196]
通式(24)中,y2为卤素原子时,任意地,通过通式(24-1)所示的含氟嘧啶化合物与作为亲核试剂的胺、氢氧根离子、醇盐、硫醇盐或不同于y
2a
的卤素原子的进一步反应,使y
2a
的卤素原子取代,得到下述通式(24-2)的含氟嘧啶化合物(工序(g-3))。
[0197]
[化学式27]
[0198][0199]
上述通式(24-1)中,y
2a
为卤素原子,
[0200]
上述通式(24-2)中,y
2b
为-na1a2、oa1、sa1或不同于y
2a
的卤素原子,a1和a2各自独立地表示氢原子、或碳原子数为1~10的烃基。
[0201]
(h)含有3-吡啶基的嘧啶化合物
[0202]
(h-1)
[0203]
通过将下述通式(25)所示的吡啶基嘧啶衍生物水解,得到下述通式(26)的吡啶基嘧啶酮衍生物(工序(h-1))。
[0204]
[化学式28]
[0205][0206]
(h-2)
[0207]
通过将得到的通式(26)所示的吡啶基嘧啶酮衍生物卤化,得到下述通式(27)的含氟嘧啶化合物(工序(h-2))。
[0208]
[化学式29]
[0209][0210]
上述通式(27)中,y2表示卤素原子。
[0211]
(h-3)
[0212]
通式(27)中,y2为卤素原子时,任意地,通过通式(27-1)所示的含氟嘧啶化合物与作为亲核试剂的胺、氢氧根离子、醇盐、硫醇盐或不同于y
2a
的卤素原子的进一步反应,使y
2a
的卤素原子取代,得到下述通式(27-2)的含氟嘧啶化合物(工序(h-3))。
[0213]
[化学式30]
[0214][0215]
上述通式(27-1)中,y
2a
为卤素原子,
[0216]
上述通式(27-2)中,y
2b
为-na1a2、oa1、sa1或不同于y
2a
的卤素原子,a1和a2各自独立地表示氢原子、或碳原子数为1~10的烃基。
[0217]
(i)含有2-吡啶基的嘧啶化合物
[0218]
(i-1)
[0219]
通过将下述通式(28)所示的吡啶基嘧啶衍生物水解,得到下述通式(29)的吡啶基嘧啶酮衍生物(工序(i-1))。
[0220]
[化学式31]
[0221][0222]
(i-2)
[0223]
通过将得到的通式(29)所示的吡啶基嘧啶酮衍生物卤化,得到下述通式(30)的含氟嘧啶化合物(工序(i-2))。
[0224]
[化学式32]
[0225]
[0226]
上述通式(30)中,y2表示卤素原子。
[0227]
(i-3)
[0228]
通式(30)中,y2为卤素原子时,任意地,通过通式(30-1)所示的含氟嘧啶化合物与作为亲核试剂的胺、氢氧根离子、醇盐、硫醇盐或不同于y
2a
的卤素原子的进一步反应,使y
2a
的卤素原子取代,得到下述通式(30-2)的含氟嘧啶化合物(工序(i-3))。
[0229]
[化学式33]
[0230][0231]
上述通式(30-1)中,y
2a
为卤素原子,
[0232]
上述通式(30-2)中,y
2b
是-na1a2、oa1、sa1或不同于y
2a
的卤素原子,a1和a2各自独立地表示氢原子、或碳原子数为1~10的烃基。
[0233]
在上述各工序所示的各通式中,除了特别限制的情况以外,
[0234]
r和r1表示碳原子数为1~12的烃基,
[0235]
r2表示氢原子、或碳原子数为1~12的烃基,
[0236]
w和x各自独立地表示氢原子、卤素原子、碳原子数为1~10的烃基、-c
nf2n+1
(n为1~10的整数)、硝基、-oa1、-soma1(m为1~3的整数)、-sa1、-na1a2、-b(oa1)(oa2)、-coa1、-cooa1、或-cona1a2,
[0237]
y1表示碳原子数为1~10的烃基、-c
nf2n+1
(n为1~10的整数)、氰基、硝基、-oa1、-soma1(m为1~3的整数)、-sa1、-na1a2、-b(oa1)(oa2)、-coa1、-cooa1、或-cona1a2,
[0238]
y2表示卤素原子,
[0239]
z表示卤素原子或-oa3,
[0240]
z2表示卤素原子、-oh或-oa3,
[0241]
a1和a2各自独立地表示氢原子、或碳原子数为1~10的烃基,且,
[0242]
a3表示碳原子数为1~12的烃基。
[0243]
(含氟嘧啶酮化合物)
[0244]
在上述(d)~(i)中,通过2阶段的工序得到含氟嘧啶化合物,在其第一阶段的工序中,作为中间产物得到吡啶基嘧啶酮衍生物。这样的吡啶基嘧啶酮衍生物相当于下述通式(31)、(32)或(33)所示的含氟嘧啶酮化合物。本发明中的含氟嘧啶酮化合物是上述本发明中的含氟嘧啶化合物的中间产物,因此作为显示出本实施方式中的含氟嘧啶化合物所具有的期望的生物活性的物质的中间体而有用。
[0245]
[化学式34]
[0246][0247]
上述通式(31)~(33)中,
[0248]
r3表示氢原子、或碳原子数为1~12的烃基,
[0249]
w和x各自独立地表示氢原子、卤素原子、碳原子数为1~10的烃基、-c
nf2n+1
(n为1~10的整数)、硝基、-oa1、-soma1(m为1~3的整数)、-sa1、-na1a2、-b(oa1)(oa2)、-coa1、-cooa1、或-cona1a2,
[0250]
a1和a2各自独立地表示氢原子、或碳原子数为1~10的烃基。
[0251]
使用卤化剂将上述通式(16)、(17)、(18)、(23)、(26)或(29)所示的含氟嘧啶酮化合物卤化,由此分别生成上述通式(31)、(32)或(33)所示的含氟嘧啶酮化合物。
[0252]
上述各通式中,w和x分别与上述通式(1)~(3)所示的含氟嘧啶化合物中定义的相同。w和x可以彼此相同或不同。另外,在具有z或z2的上述各通式中,z和z2各自与上述通式(1)~(3)所示的含氟嘧啶化合物中定义的z相同,z或z2的定义中规定的卤素原子和-oa3与上述通式(1)~(3)所示的含氟嘧啶化合物中定义的基团相同。另外,在具有y1的上述各通式中,y1与上述通式(1)~(3)所示的含氟嘧啶化合物中的由y定义的基团(其中,卤素原子除外)相同,在具有y2的上述各通式中,y2的定义中规定的卤素原子与上述通式(1)~(3)所示的含氟嘧啶化合物中定义的基团相同。进而,在具有r和/或r1的上述各通式中,r和r1与上述通式(1)~(3)所示的含氟嘧啶中由a3定义的基团相同,在具有r2的上述各通式中,r2分别与上述通式(31)~(33)所示的含氟嘧啶酮化合物中定义的基团相同,r3的定义中规定的碳原子数为1~12的烃基与上述通式(1)~(3)所示的含氟嘧啶中定义的基团相同。
[0253]
在上述各通式中,r、r1、r2和r3优选表示碳原子数为1~10的烷基。另外,上述通式(4)~(33)中,w和x优选表示氢原子、卤素原子、或碳原子数为1~10的烃基,特别优选表示氢原子。这样的烃基例如可以为上述通式(1)~(3)所示的含氟嘧啶化合物中由a3举出的烃基之中碳原子数为1~10的烷基。
[0254]
使用上述亲核试剂的亲核取代反应例如通过在有机溶剂(四氢呋喃、二甲基甲酰胺、二甲基亚砜、环丁砜、丙酮、二乙醚等)中,在亲核试剂(用甲醇钠、乙醇钠、叔丁醇钾、氰化钠、氰化钾、氟化钾或氢化钠等碱处理过的醇、胺、硫醇等)的存在下,在0~100℃下使其反应来进行。
[0255]
使用上述亲电试剂的亲电加成反应例如通过在有机溶剂(乙酸、氯仿、二氯甲烷、二甲基甲酰胺、乙腈等)中,在亲电试剂(过氧化氢、过乙酸、间氯过氧苯甲酸、高锰酸钾等)的存在下,在0~65℃下使其反应来进行。
[0256]
上述水解反应可以在酸或碱的存在下,按照一般的有机合成化学中考虑的方法进行。本反应通常可以使用酸或碱以及溶剂。酸和碱只要是进行水解反应的酸和碱就不受到特别限定,例如可以从盐酸、硫酸等无机酸;乙酸、三氟乙酸等有机酸;氢氧化锂、氢氧化钠、氢氧化钾等碱金属氢氧化物;氢氧化钙、氢氧化钡等碱土金属氢氧化物;碳酸钠、碳酸钾、碳
酸铯等碱金属碳酸盐;碳酸钙、碳酸钡等碱土金属碳酸盐等中适当选择一种或两种以上来混合使用。溶剂只要是进行水解反应的溶剂就不受到特别限定,可以使用对反应呈惰性的任何溶剂。作为这样的溶剂,例如可以从甲醇、乙醇、异丙醇等醇类;乙腈、n,n-二甲基甲酰胺、二甲基亚砜、二甲基乙酰胺、环丁砜等非质子性极性溶剂;二氯甲烷等非极性溶剂;二乙醚、叔丁基甲基醚、1,4-二氧六环、四氢呋喃、1,2-二甲氧基乙烷等醚类;水等中适当选择一种或两种以上来混合使用。反应温度通常为0~150℃,反应时间通常为0.5~72小时。
[0257]
作为上述卤化剂,例如举出亚硫酰氯、碳酰氯、磷酰氯(phosphorus oxychloride)、五氯化磷、氧溴化磷、三溴化磷等。在与卤化剂的反应中,标准而言,反应温度为50~150℃,反应时间为1~10小时,供于该反应的卤化剂(试剂)的量相对于吡啶基嘧啶衍生物(含氟嘧啶酮化合物)1当量通常为1~10当量。在与卤化剂的反应中未必需要溶剂,但通常在溶剂的存在下进行。作为可使用的溶剂,可举出苯、甲苯等芳香族烃类、氯苯等卤代烃类等。
[0258]
以上,对本发明的实施方式进行了说明,但本发明并不限定于上述实施方式,包括本发明的概念以及权利要求书所包含的所有方式,能够在本发明的范围内进行各种改变。
[0259]
实施例
[0260]
以下,对本发明的实施例进行说明,但本发明只要不超出其主旨,则并不限定于这些例子。另外,只要没有特别说明,室温为20℃
±
5℃的范围内。
[0261]
(实施例1)
[0262]
《4,6-二甲氧基-2-(4-吡啶基)-5-三氟甲基嘧啶的制造》
[0263]
将4-氟-6-甲氧基-2-(4-吡啶基)-5-三氟甲基嘧啶0.11g(0.40mmol)溶解于甲醇1.0ml中,加入28%甲醇钠甲醇溶液1.0ml,在室温下搅拌1天。接着,在反应液中加入水,用乙酸乙酯萃取,用硫酸钠干燥有机相。将干燥的有机相过滤,将滤液浓缩,由此得到具有下述结构式的4,6-二甲氧基-2-(4-吡啶基)-5-三氟甲基嘧啶0.11g(0.38mmol)。收率为93%。
[0264]
[化学式35]
[0265][0266]
分析结果如下所述。
[0267]1h nmr(400mhz,cdcl3)δppm:8.79(dd,j=4.4,1.6hz,2h),8.26(dd,j=4.8,1.6hz,2h),4.18(s,6h)
[0268]
apci-ms(m/z):286.8[m+h]
+
[0269]
(实施例2)
[0270]
《6-甲氧基-4-苯氧基-2-(4-吡啶基)-5-三氟甲基嘧啶的制造》
[0271]
将苯酚0.04g(0.46mmol)溶解于四氢呋喃(thf)1.5ml中,加入叔丁醇钾0.05g(0.47mmol)和4-氟-6-甲氧基-2-(4-吡啶基)-5-三氟甲基嘧啶0.11g(0.39mmol),在室温下
搅拌1天。在反应液中加入水,用乙酸乙酯萃取,用硫酸钠干燥有机相。将干燥的有机相过滤,将滤液浓缩,由此得到具有下述结构式的6-甲氧基-4-苯氧基-2-(4-吡啶基)-5-三氟甲基嘧啶0.07g(0.19mmol)。收率为48%。
[0272]
[化学式36]
[0273][0274]
分析结果如下所述。
[0275]1h nmr(400mhz,cdcl3)δppm:8.77(dd,j=4.8,1.6hz,2h),7.96(dd,j=4.8,1.6hz,2h),7.44-7.49(m,2h),7.30-7.34(m,1h),7.18-7.24(m,2h),4.22(s,3h)
[0276]
apci-ms(m/z):349.0[m+h]
+
[0277]
(实施例3)
[0278]
《6-甲氧基-4-(苯基甲氧基)-2-(4-吡啶基)-5-三氟甲基嘧啶的制造》
[0279]
将苯甲醇0.05g(0.35mmol)溶解于二甲基甲酰胺(dmf)3.0ml中,加入氢化钠0.01g(0.35mmol),在室温下搅拌1小时。然后,加入4-氟-6-甲氧基-2-(4-吡啶基)-5-三氟甲基嘧啶0.10g(0.35mmol),在室温下16.7小时、在70℃下16小时搅拌后,在100℃下搅拌10.5小时。空气冷却至室温后,在反应液中加入水,用乙酸乙酯萃取,用硫酸钠干燥有机相。将干燥的有机相过滤,将滤液浓缩后,进行柱纯化,得到具有下述结构式的6-甲氧基-4-(苯基甲氧基)-2-(4-吡啶基)-5-三氟甲基嘧啶0.05g(0.13mmol)。收率为31%。
[0280]
[化学式37]
[0281][0282]
分析结果如下。
[0283]1h nmr(400mhz,cdcl3)δppm:8.78-8.80(m,2h),8.19-8.23(m,2h),7.30-7.48(m,5h),5.65(s,3h),4.16(s,2h)
[0284]
apci-ms(m/z):361.7[m+h]
+
[0285]
(实施例4)
[0286]
《6-甲氧基-n-丙基-2-(4-吡啶基)-5-(三氟甲基)-4-嘧啶胺的制造》
[0287]
将正丙胺0.03g(0.35mmol)溶解于dmf 5.0ml中,加入氢化钠0.02g(0.53mmol),在室温下搅拌50分钟。然后,加入4-氟-6-甲氧基-2-(4-吡啶基)-5-三氟甲基嘧啶0.10g
(0.35mmol),在室温下16.7小时、在70℃下8小时搅拌。空气冷却至室温后,在反应液中加入水,用乙酸乙酯萃取,用硫酸钠干燥有机相。将干燥的有机相过滤,将滤液浓缩后,进行柱纯化,得到具有下述结构式的6-甲氧基-n-丙基-2-(4-吡啶基)-5-(三氟甲基)-4-嘧啶胺0.09g(0.29mmol)。收率为79%。
[0288]
[化学式38]
[0289][0290]
分析结果如下。
[0291]1h nmr(400mhz,cdcl3)δppm:8.75(dd,j=4.8,1.6hz,2h),8.22(d,j=4.4,1.6hz,2h),5.67(br,1h),4.11(s,3h),3.61(dt,j=6.4,6.8hz,2h),1.71(tq,j=7.6,7.2hz,2h),1.02(t,j=7.6hz,3h)
[0292]
apci-ms(m/z):313.9[m+h]
+
[0293]
(实施例5)
[0294]
《n,n-二乙基-6-甲氧基-2-(4-吡啶基)-5-(三氟甲基)-4-嘧啶胺的制造》
[0295]
将二乙胺0.04g(0.52mmol)溶解于dmf 5.0ml中,加入氢化钠0.02g(0.58mmol),在室温下搅拌1小时。然后,加入4-氟-6-甲氧基-2-(4-吡啶基)-5-三氟甲基嘧啶0.10g(0.37mmol),在室温下16.7小时、在70℃下16小时搅拌。空气冷却至室温后,在反应液中加入水,用乙酸乙酯萃取,用硫酸钠干燥有机相。将干燥的有机相过滤,将滤液浓缩后,进行柱纯化,得到具有下述结构式的n,n-二乙基-6-甲氧基-2-(4-吡啶基)-5-(三氟甲基)-4-嘧啶胺0.03g(0.09mmol)。收率为25%。
[0296]
[化学式39]
[0297][0298]
分析结果如下。
[0299]1h nmr(400mhz,cdcl3)δppm:8.74(dd,j=4.4,1.2hz,2h),8.20(dd,j=4.4,1.6hz,2h),4.12(s,3h),3.59(q,j=7.2hz,4h),1.26(t,j=7.2hz,6h)
[0300]
apci-ms(m/z):326.8[m+h]
+
[0301]
(实施例6)
[0302]
《6-甲氧基-n-苯基-2-(4-吡啶基)-5-(三氟甲基)-4-嘧啶胺的制造》
[0303]
将苯胺0.04g(0.39mmol)溶解于dmf 5.0ml中,加入氢化钠0.02g(0.58mmol),在室温下搅拌1小时。然后,加入4-氟-6-甲氧基-2-(4-吡啶基)-5-三氟甲基嘧啶0.10g(0.37mmol),在室温下16.7小时、在70℃下8小时搅拌,进而在室温下16小时搅拌后,在70℃下8小时、在100℃下10.5小时搅拌。空气冷却至室温后,在反应液中加入水,用乙酸乙酯萃取,用硫酸钠干燥有机相。将干燥的有机相过滤,将滤液浓缩后,进行柱纯化,得到具有下述结构式的6-甲氧基-n-苯基-2-(4-吡啶基)-5-(三氟甲基)-4-嘧啶胺0.03g(0.08mmol)。收率为22%。
[0304]
[化学式40]
[0305][0306]
分析结果如下。
[0307]1h nmr(400mhz,cdcl3)δppm:8.73(m,2h),8.14(dd,j=4.8,1.6hz,2h),7.41-7.55(m,4h),7.21-7.25(m,1h),4.16(s,3h)
[0308]
apci-ms(m/z):346.6[m+h]
+
[0309]
(实施例7)
[0310]
《6-甲氧基-2-(3-吡啶基)-5-(三氟甲基)-4(3h)-嘧啶酮的制造》
[0311]
将4-氟-6-甲氧基-2-(3-吡啶基)-5-三氟甲基嘧啶0.11g(0.39mmol)溶解于dmf 1.0ml、水1.0ml中,加入5滴三乙胺,在70℃下7小时、在80℃下16小时搅拌。空气冷却至室温后,在反应液中加入水和乙酸,用乙酸乙酯萃取,用硫酸钠干燥有机相。将干燥的有机相过滤,将滤液浓缩后,进行柱纯化,得到具有下述结构式的6-甲氧基-2-(3-吡啶基)-5-(三氟甲基)-4(3h)-嘧啶酮0.01g(0.05mmol)。收率为12%。
[0312]
[化学式41]
[0313][0314]
分析结果如下。
[0315]1h nmr(400mhz,cdcl3)δppm:9.61(dd,j=2.4,0.8hz,1h),8.72(dd,j=4.8,1.6,
1h),8.61(ddd,j=8.0,2.0,2.0hz,1h),7.39(ddd,j=7.6,4.8,0.8hz,1h),5.50(br,1h),4.12(s,3h)
[0316]
apci-ms(m/z):270.1[m+h]
+
[0317]
(实施例8)
[0318]
《6-甲氧基-4-(1-甲基乙氧基)-2-(4-吡啶基)-5-三氟甲基嘧啶和4,6-双(1-甲基乙氧基)-2-(4-吡啶基)-5-三氟甲基嘧啶的制造》
[0319]
将4-氟-6-甲氧基-2-(4-吡啶基)-5-三氟甲基嘧啶0.10g(0.34mmol)溶解于thf 1.0ml中,加入异丙醇1.0ml和氢化钠0.01g(0.35mmol),在室温下搅拌3小时。进一步地,加入氢化钠0.02g(0.48mmol),在50℃下搅拌7小时。空气冷却至室温后,在反应液中加入水,用乙酸乙酯萃取,用硫酸钠干燥有机相。将干燥的有机相过滤,将滤液浓缩后,进行柱纯化,得到6-甲氧基-4-(1-甲基乙氧基)-2-(4-吡啶基)-5-三氟甲基嘧啶0.01g(0.03mmol)。收率为9.6%。
[0320]
[化学式42]
[0321][0322]
6-甲氧基-4-(1-甲基乙氧基)-2-(4-吡啶基)-5-三氟甲基嘧啶的分析结果如下。
[0323]1h nmr(400mhz,cdcl3)δppm:8.78(dd,j=4.8,2.0hz,2h),8.22(dd,j=4.4,1.6hz,2h),5.61(hept,j=6.0hz,1h),4.16(s,3h),1.45(d,j=6.0hz,6h)
[0324]
apci-ms(m/z):313.5[m+h]
+
[0325]
同时,还得到4,6-双(1-甲基乙氧基)-2-(4-吡啶基)-5-三氟甲基嘧啶0.02g(收率19%)。
[0326]
[化学式43]
[0327][0328]
4,6-双(1-甲基乙氧基)-2-(4-吡啶基)-5-三氟甲基嘧啶的分析结果如下。
[0329]1h nmr(400mhz,cdcl3)δppm:8.77(dd,j=4.8,2.0hz,2h),8.20(dd,j=4.4,1.6hz,2h),5.60(hept,j=6.0hz,2h),1.44(d,j=6.0hz,12h)
[0330]
apci-ms(m/z):341.5[m+h]
+
[0331]
(实施例9)
[0332]
《4-(1,1-二甲基乙氧基)-6-甲氧基-2-(4-吡啶基)-5-三氟甲基嘧啶和4,6-双(1,1-二甲基乙氧基)-2-(4-吡啶基)-5-三氟甲基嘧啶的制造》
[0333]
将4-氟-6-甲氧基-2-(4-吡啶基)-5-三氟甲基嘧啶0.50g(1.83mmol)溶解于thf 6.0ml中,加入叔丁醇钾0.043g(3.85mmol),在室温下搅拌1天。浓缩反应液后,进行柱纯化,得到4-(1,1-二甲基乙氧基)-6-甲氧基-2-(4-吡啶基)-5-三氟甲基嘧啶0.37g(1.14mmol)。收率为62%。
[0334]
[化学式44]
[0335][0336]
4-(1,1-二甲基乙氧基)-6-甲氧基-2-(4-吡啶基)-5-三氟甲基嘧啶的分析结果如下。
[0337]1h nmr(400mhz,cdcl3)δppm:8.79(dd,j=4.8,1.6hz,2h),8.20(dd,j=4.4,1.6hz,2h),4.15(s,3h),1.71(s,9h)
[0338]
apci-ms(m/z):327.5[m+h]
+
[0339]
同时,还得到4,6-双(1,1-二甲基乙氧基)-2-(4-吡啶基)-5-三氟甲基嘧啶0.04g(收率5%)。
[0340]
[化学式45]
[0341][0342]
4,6-双(1,1-二甲基乙氧基)-2-(4-吡啶基)-5-三氟甲基嘧啶的分析结果如下。
[0343]1h nmr(400mhz,cdcl3)δppm:8.79(dd,j=4.4,1.6hz,2h),8.14(dd,j=4.8,1.6hz,2h),1.70(s,18h)
[0344]
apci-ms(m/z):369.3[m+h]
+
[0345]
(实施例10)
[0346]
《4-氯-6-甲氧基-2-(4-吡啶基)-5-三氟甲基嘧啶的制造》
[0347]
·
工序1)6-甲氧基-2-(4-吡啶基)-5-(三氟甲基)-4(3h)-嘧啶酮的制造
[0348]
将4-(1,1-二甲基乙氧基)-6-甲氧基-2-(4-吡啶基)-5-三氟甲基嘧啶0.10g(0.31mmol)溶解于甲醇2.0ml中,加入浓盐酸4滴,在室温下搅拌23小时后,进一步在50℃下搅拌4小时。空气冷却至室温后,将反应液浓缩,接着用乙酸乙酯进行洗涤过滤,得到具有下
述结构式的6-甲氧基-2-(4-吡啶基)-5-(三氟甲基)-4(3h)-嘧啶酮0.07g。收率为87%。
[0349]
[化学式46]
[0350][0351]
分析结果如下。
[0352]1h nmr(400mhz,cd3od)δppm:9.01(dd,j=5.6,1.2hz,2h),8.88(d,j=6.4hz,2h),4.21(s,3h)
[0353]
apci-ms(m/z):271.0[m+h]
+
[0354]
·
工序2)4-氯-6-甲氧基-2-(4-吡啶基)-5-三氟甲基嘧啶的制造
[0355]
将工序1)得到的6-甲氧基-2-(4-吡啶基)-5-(三氟甲基)-4(3h)-嘧啶酮的粗产物0.105g溶解于pocl
3 1.0ml中,在60℃下搅拌4小时,在100℃下搅拌1个半小时,在110℃下搅拌17个半小时。空气冷却至室温后,将反应液滴加于冰中,用乙酸乙酯萃取,用硫酸钠干燥有机相。将干燥的有机相过滤,将滤液浓缩后,进行柱纯化,得到具有下述结构式的4-氯-6-甲氧基-2-(4-吡啶基)-5-三氟甲基嘧啶0.006g(0.031mmol)。收率约为8%。
[0356]
[化学式47]
[0357][0358]
分析结果如下。
[0359]1h nmr(400mhz,cdcl3)δppm:8.84(s,2h),8.33(d,j=5.2hz,2h),4.25(s,3h)
[0360]
apci-ms(m/z):390.4[m+h]
+
[0361]
(实施例11)
[0362]
4,6-二氯-2-(4-吡啶基)-5-三氟甲基嘧啶的制造
[0363]
·
工序1)6-羟基-2-(4-吡啶基)-5-(三氟甲基)-4(3h)-嘧啶酮的制造将4,6-双(1,1-二甲基乙氧基)-2-(4-吡啶基)-5-三氟甲基嘧啶0.21g(0.57mmol)溶解于二氯甲烷1.0ml中,加入三氟乙酸(tfa)1.0ml,在室温下搅拌3小时。然后,将反应液浓缩,用乙酸乙酯进行洗涤过滤,得到具有下述结构式的6-羟基-2-(4-吡啶基)-5-(三氟甲基)-4(3h)-嘧啶酮0.13g(0.51mmol)。收率为89%。
[0364]
[化学式48]
[0365][0366]
分析结果如下。另外,所得到的嘧啶酮化合物在apci-ms测定中使用的溶剂中的溶解性差,因此无法进行该ms测定。
[0367]1h nmr(400mhz,dmso-d6)δppm:8.82(dd,j=4.8,2.0hz,2h),7.97(dd,j=4.4,1.6hz,2h)
[0368]
·
工序2)4,6-二氯-2-(4-吡啶基)-5-三氟甲基嘧啶的制造
[0369]
将工序1)得到的6-羟基-2-(4-吡啶基)-5-(三氟甲基)-4(3h)-嘧啶酮的粗产物0.10g(0.38mmol)溶解于pocl
3 1.0ml中,在加热回流条件下搅拌1小时。空气冷却至室温后,将反应液滴加于冰中,加入碳酸氢钠进行中和后,用乙酸乙酯萃取,用硫酸钠干燥有机相。将干燥的有机相过滤,将滤液浓缩后,进行柱纯化,得到具有下述结构式的4,6-二氯-2-(4-吡啶基)-5-三氟甲基嘧啶0.08g(0.28mmol)。收率为73%。
[0370]
[化学式49]
[0371][0372]
分析结果如下。
[0373]1h nmr(400mhz,cdcl3)δppm:8.86(dd,j=4.8,1.6hz,2h),8.28(dd,j=4.4,1.6hz,2h)
[0374]
apci-ms(m/z):294.5[m+h]
+
[0375]
(实施例12)
[0376]
《6-甲氧基-4-[(4-甲基苯基)硫代]-2-(4-吡啶基)-5-三氟甲基嘧啶的制造》
[0377]
将对甲苯硫酚0.1g(0.81mmol)溶解于dmf 5.0ml中,加入氢化钠0.05g(1.3mmol),在室温下搅拌30分钟。然后,加入4-氟-6-甲氧基-2-(4-吡啶基)-5-三氟甲基嘧啶0.10g(0.37mmol),在室温下搅拌6天。在反应液中加入水,用乙酸乙酯萃取,用硫酸钠干燥有机相。将干燥的有机相过滤,将滤液浓缩后,进行柱纯化,得到具有下述结构式的6-甲氧基-4-[(4-甲基苯基)硫代]-2-(4-吡啶基)-5-三氟甲基嘧啶0.10g(0.25mmol)。收率为52.7%。
[0378]
[化学式50]
[0379][0380]
分析结果如下。
[0381]1h nmr(400mhz,cdcl3)δppm:8.60(dd,j=4.4,1.2hz,2h),7.72(dd,j=4.8,2.0hz,2h),7.46(d,j=8.4hz,2h),7.32(d,j=8.0hz,2h),4.17(s,3h),2.49(s,3h)
[0382]
apci-ms(m/z):377.5[m+h]
+
[0383]
(实施例13)
[0384]
《6-甲氧基-4-[(4-甲基苯基)亚磺酰基]-2-(4-吡啶基)-5-三氟甲基嘧啶和6-甲氧基-4-[(4-甲基苯基)磺酰基]-2-(4-吡啶基)-5-三氟甲基嘧啶的制造》
[0385]
在实施例12得到的6-甲氧基-4-[(4-甲基苯基)硫代]-2-(4-吡啶基)-5-三氟甲基嘧啶0.10g(0.25mmol)中加入乙酸1.0ml、30%过氧化氢水6滴,在室温下搅拌30小时。在反应液中加入水和碳酸氢钠,将溶液调整为ph5后,用乙酸乙酯萃取,用硫酸钠干燥有机相。将干燥的有机相过滤,将滤液浓缩后,进行柱纯化,得到6-甲氧基-4-[(4-甲基苯基)亚磺酰基]-2-(4-吡啶基)-5-三氟甲基嘧啶0.11g(0.11mmol)。收率为32.2%。
[0386]
[化学式51]
[0387][0388]
6-甲氧基-4-[(4-甲基苯基)亚磺酰基]-2-(4-吡啶基)-5-三氟甲基嘧啶的分析结果如下。
[0389]1h nmr(400mhz,cd3od)δppm:8.85(dd,j=4.8,2.0hz,2h),8.38(dd,j=4.8,2.0hz,2h),7.75(d,j=8.0hz,2h),7.28(d,j=8.4hz,2h),4.23(s,3h),2.37(s,3h)
[0390]
apci-ms(m/z):393.5[m+h]
+
[0391]
同时,还得到6-甲氧基-4-[(4-甲基苯基)磺酰基]-2-(4-吡啶基)-5-三氟甲基嘧啶0.004g(0.01mmol)。收率为2.8%。
[0392]
[化学式52]
[0393][0394]
6-甲氧基-4-[(4-甲基苯基)磺酰基]-2-(4-吡啶基)-5-三氟甲基嘧啶的分析结果如下。
[0395]1h nmr(400mhz,cd3od)δppm:8.67(br,2h),7.93(d,j=8.4hz,2h),7.66(d,j=4.4hz,2h),7.47(d,j=8.0hz,2h),4.27(s,3h),2.56(s,3h)
[0396]
apci-ms(m/z):409.5[m+h]
+
[0397]
(实施例14)
[0398]
《6-甲氧基-2-(2-吡啶基)-5-(三氟甲基)-4(3h)-嘧啶酮的制造》
[0399]
将4-氟-6-甲氧基-2-(2-吡啶基)-5-三氟甲基嘧啶0.10g(0.37mmol)溶解于乙酸5.0ml中,在室温下搅拌18.5小时后,进一步在70℃下搅拌8小时。冷却至室温后,在反应液中加入水,用乙酸乙酯萃取,用硫酸钠干燥有机相。将干燥的有机相过滤,将滤液浓缩后,进行柱纯化,得到具有下述结构式的6-甲氧基-2-(2-吡啶基)-5-(三氟甲基)-4(3h)-嘧啶酮。
[0400]
[化学式53]
[0401][0402]
分析结果如下。
[0403]1h nmr(400mhz,cdcl3)δppm:10.97(br,1h),8.72(d,j=4.4hz,1h),8.43(d,j=7.6hz,1h),7.97(ddd,j=8.0,8.0,1.6hz,1h),7.58(ddd,j=7.2,4.8,0.8hz,1h),4.17(s,3h)
[0404]
apci-ms(m/z):271.2[m+h]
+
[0405]
(实施例15)
[0406]
《4-氰基-6-甲氧基-2-(4-吡啶基)-5-三氟甲基嘧啶的制造》
[0407]
将4-氟-6-甲氧基-2-(4-吡啶基)-5-三氟甲基嘧啶0.10g(0.38mmol)溶解于dmso 1.0ml中,加入氰化钠0.03g(0.65mmol),在室温下23小时、在80℃下5.5小时、在100℃下5小时搅拌。在反应液中加入水,用乙酸乙酯萃取,用硫酸钠干燥有机相。将干燥的有机相过滤,将滤液浓缩后,进行柱纯化,得到具有下述结构的4-氰基-6-甲氧基-2-(4-吡啶基)-5-三氟甲基嘧啶0.003g(0.01mmol)。收率为3%。
[0408]
[化学式54]
[0409][0410]
分析结果如下所述。
[0411]1h nmr(400mhz,cdcl3)δppm:8.86(d,j=5.6hz,2h),8.29(d,j=6.0hz,2h),4.31(s,3h)
[0412]
apci-ms(m/z):280.4[m+h]
+
[0413]
(实施例16)
[0414]
《4-乙氧基-6-甲氧基-2-(4-吡啶基)-5-三氟甲基嘧啶的制造》
[0415]
将4-氟-6-甲氧基-2-(4-吡啶基)-5-三氟甲基嘧啶0.12g(0.42mmol)溶解于乙醇1.0ml中,加入20%含有乙醇钠的乙醇溶液5滴,室温下搅拌22.8小时。进一步加入20%含有乙醇钠的乙醇溶液5滴和乙醇1ml,在50℃下搅拌5.8小时。进一步加入20%含有乙醇钠的乙醇溶液5滴,在50℃下搅拌2小时后,加入水,用乙酸乙酯萃取,用硫酸钠干燥有机相。将干燥的有机相过滤,将滤液浓缩后,进行柱纯化,得到具有下述结构的4-乙氧基-6-甲氧基-2-(4-吡啶基)-5-三氟甲基嘧啶0.11g(0.37mmol)。收率为87%。
[0416]
[化学式55]
[0417][0418]
分析结果如下所述。
[0419]1h nmr(400mhz,cdcl3)δppm:8.79(d,j=5.2hz,2h),8.24(d,j=4.9hz,2h),4.65(q,j=7.3hz,2h),4.17(s,3h),1.48(t,j=7.0hz,3h)
[0420]
apci-ms(m/z):300.0[m+h]
+
[0421]
(实施例17)
[0422]
《4,6-二甲氧基-2-(3-吡啶基)-5-三氟甲基嘧啶的制造》
[0423]
将4-氟-6-甲氧基-2-(3-吡啶基)-5-三氟甲基嘧啶0.11g(0.38mmol)溶解于甲醇1.0ml中,加入28%含有甲醇钠的甲醇溶液1.0ml,在室温下搅拌8.3小时。在反应液中加入水,用乙酸乙酯萃取,用硫酸钠干燥有机相。将干燥的有机相过滤,将滤液浓缩后,进行柱纯化,得到具有下述结构的4,6-二甲氧基-2-(3-吡啶基)-5-三氟甲基嘧啶0.11g(0.38mmol)。收率为99%。
[0424]
[化学式56]
[0425][0426]
分析结果如下所述。
[0427]1h nmr(400mhz,cdcl3)δppm:9.64(d,j=1.5hz,1h),8.75(dd,j=4.6,1.5hz,1h),8.68(ddd,j=8.0,4.6,1.5hz,1h),7.43(ddd,j=8.0,4.9,0.9hz,1h),4.17(s,6h)
[0428]
apci-ms(m/z):286.0[m+h]
+
[0429]
(实施例18)
[0430]
《n-丙基-6-甲氧基-2-(3-吡啶基)-5-(三氟甲基)-4-嘧啶胺的制造》
[0431]
将正丙胺0.05g(0.80mmol)溶解于dmf 5.0ml中,加入氢化钠0.02g(0.38mmol),在室温下搅拌45分钟。然后,加入4-氟-6-甲氧基-2-(3-吡啶基)-5-三氟甲基嘧啶0.10g(0.38mmol),在室温下搅拌5.3小时。在反应液中加入水,用乙酸乙酯萃取,用硫酸钠干燥有机相。将干燥的有机相过滤,将滤液浓缩后,进行柱纯化,具有下述结构的n-丙基-6-甲氧基-2-(3-吡啶基)-5-(三氟甲基)-4-嘧啶胺0.10g(0.32mmol)。收率为84%。
[0432]
[化学式57]
[0433][0434]
分析结果如下所述。
[0435]1h nmr(400mhz,cdcl3)δppm:9.61(dd,j=2.1,0.9hz,1h),8.71(dd,j=6.4,1.5hz,1h),8.64(ddd,j=8.0,1.8,1.8hz,1h),7.39(ddd,j=8.0,4.9,0.9hz,1h),5.65(br,1h),4.10(s,3h),3.60(dt,j=6.7,6.7hz,2h),1.70(tq,j=7.6,7.0hz,2h),1.01(t,j=7.3hz,3h)
[0436]
apci-ms(m/z):313.8[m+h]
+
[0437]
(实施例19)
[0438]
《4,6-二甲氧基-2-(2-吡啶基)-5-三氟甲基嘧啶的制造》
[0439]
将4-氟-6-甲氧基-2-(2-吡啶基)-5-三氟甲基嘧啶0.11g(0.39mmol)溶解于甲醇1.0ml中,加入28%含有甲醇钠的甲醇溶液1.0ml,在室温下搅拌8.1小时。在反应液中加入水,用乙酸乙酯萃取,用硫酸钠干燥有机相。将干燥的有机相过滤,将滤液浓缩后,进行柱纯化,得到具有下述结构的4,6-二甲氧基-2-(2-吡啶基)-5-三氟甲基嘧啶0.11g(0.39mmol)。收率为99%。
[0440]
[化学式58]
[0441][0442]
分析结果如下所述。
[0443]1h nmr(400mhz,cdcl3)δppm:8.86(m,1h),8.48(m,1h),7.87(ddd,j=8.0,8.0,1.8hz,1h),7.45(ddd,j=7.5,4.9,1.2hz,1h),4.21(s,6h)
[0444]
apci-ms(m/z):286.0[m+h]
+
[0445]
(实施例20)
[0446]
《n-丙基-6-甲氧基-2-(2-吡啶基)-5-(三氟甲基)-4-嘧啶胺的制造》
[0447]
将正丙胺0.07g(1.21mmol)溶解于dmf 5.0ml中,加入氢化钠0.02g(0.40mmol),在室温下搅拌45分钟。然后,将4-氟-6-甲氧基-2-(2-吡啶基)-5-三氟甲基嘧啶0.11g(0.41mmol),在室温下搅拌5.3小时。在反应液中加入水,用乙酸乙酯萃取,用硫酸钠干燥有机相。将干燥的有机相过滤,将滤液浓缩后,进行柱纯化,得到具有下述结构的n-丙基-6-甲氧基-2-(2-吡啶基)-5-(三氟甲基)-4-嘧啶胺0.10g(0.33mmol)。收率为80%。
[0448]
[化学式59]
[0449][0450]
分析结果如下所述。
[0451]1h nmr(400mhz,cdcl3)δppm:8.82(ddd,j=4.9,1.8,0.9hz,1h),8.42(ddd,j=8.0,1.2,0.9hz,1h),7.83(ddd,j=7.6,7.6,1.8hz,1h),7.40(ddd,j=7.6,4.9,1.2hz,1h),5.63(br,1h),4.15(s,3h),3.65(dt,j=7.0,5.8hz,2h),1.70(tq,j=7.3,7.3hz,2h),1.01(t,j=7.3hz,3h)
[0452]
apci-ms(m/z):312.8[m+h]
+
[0453]
(实施例21)
[0454]
《4,6-二溴-2-(4-吡啶基)-5-三氟甲基嘧啶的制造》
[0455]
将实施例11的工序1)得到的6-羟基-2-(4-吡啶基)-5-(三氟甲基)-4(3h)-嘧啶酮的粗产物0.03g溶解于二氯乙烷1.0ml,加入pobr
3 2.0g,在65℃下40分钟、在80℃下2小时、在90℃下8小时、在110℃下9.5小时搅拌。空气冷却至室温后,将反应液滴加于冰中,用乙酸乙酯萃取。用硫酸镁干燥后,进行过滤。将滤液浓缩后,进行柱纯化,得到痕量具有下述结构的4,6-二溴-2-(4-吡啶基)-5-三氟甲基嘧啶。
[0456]
[化学式60]
[0457][0458]
分析结果如下所述。
[0459]1h nmr(400mhz,cdcl3)δppm:8.85(dd,j=4.4,1.6hz,2h),8.28(dd,j=4.8,2.0hz,2h)
[0460]
apci-ms(m/z):383.5[m+h]
+
[0461]
(实施例22)
[0462]
《6-甲氧基-4-[(4-甲基苯基)硫代]-2-(3-吡啶基)-5-三氟甲基嘧啶的制造》
[0463]
将对甲苯硫酚0.04g(0.33mmol)溶解于dmf 5.0ml中,加入氢化钠0.01g(0.25mmol),在室温下搅拌30分钟。然后,加入4-氟-6-甲氧基-2-(3-吡啶基)-5-三氟甲基嘧啶0.10g(0.36mmol),在室温下搅拌26小时。在反应液中加入水,用乙酸乙酯萃取,用硫酸钠干燥有机相。将干燥的有机相过滤,将滤液浓缩后,进行柱纯化,得到具有下述结构的6-甲氧基-4-[(4-甲基苯基)硫代]-2-(3-吡啶基)-5-三氟甲基嘧啶。
[0464]
[化学式61]
[0465][0466]
分析结果如下。
[0467]1h nmr(400mhz,cdcl3)δppm:9.12(dd,j=2.1,0.9hz,1h),8.63(dd,j=4.9,1.5hz,1h),8.17(ddd,j=8.0,2.1,1.8hz,1h),7.46(d,j=8.3hz,2h),7.31(d,j=7.6hz,2h),7.25(ddd,j=8.0,4.9,0.6hz,1h),4.16(s,3h),2.48(s,3h)
[0468]
apci-ms(m/z):377.3[m+h]
+
[0469]
(实施例23)
[0470]
《6-甲氧基-4-[(4-甲基苯基)硫代]-2-(2-吡啶基)-5-三氟甲基嘧啶的制造》
[0471]
将对甲苯硫酚0.04g(0.34mmol)溶解于dmf 5.0ml中,加入氢化钠0.01g(0.23mmol),在室温下搅拌30分钟。然后,加入4-氟-6-甲氧基-2-(2-吡啶基)-5-三氟甲基嘧啶0.10g(0.37mmol),在室温下搅拌26.5小时。在反应液中加入水,用乙酸乙酯萃取,用硫酸钠干燥有机相。将干燥的有机相过滤,将滤液浓缩后,进行柱纯化,得到具有下述结构的6-甲氧基-4-[(4-甲基苯基)硫代]-2-(2-吡啶基)-5-三氟甲基嘧啶0.11g(0.28mmol)。收率为76.7%。
[0472]
[化学式62]
[0473][0474]
分析结果如下。
[0475]1h nmr(400mhz,cdcl3)δppm:8.74(ddd,j=4.9,2.8,1.5hz,1h),7.59(m,2h),7.48(m,2h),7.31(m,3h),4.25(s,3h)
[0476]
apci-ms(m/z):377.4[m+h]
+
[0477]
(实施例24)
[0478]
《6-氯-4-氟-2-(4-吡啶基)-5-三氟甲基嘧啶的制造》
[0479]
在用甲苯10ml减压干燥的环丁砜25ml中加入实施例11得到的4,6-二氯-2-(4-吡啶基)-5-三氟甲基嘧啶0.10g(0.35mmol)和氟化钾0.02g(0.34mmol),在148℃下搅拌18.8小时。然后,进一步加入氟化钾0.02g(0.34mmol),在148℃下搅拌7小时。空气冷却至室温后,加入水并用二乙醚萃取。用硫酸镁干燥后,实施过滤,将滤液浓缩后,进行柱纯化,得到痕量具有下述结构的6-氯-4-氟-2-(4-吡啶基)-5-三氟甲基嘧啶。
[0480]
[化学式63]
[0481][0482]
分析结果如下。
[0483]1h nmr(400mhz,cdcl3)δppm:8.74(d,j=4.9hz,2h),8.24(d,j=5.4hz,1h)
[0484]
apci-ms(m/z):277.0[m+h]
+
[0485]
(实施例25)
[0486]
《6-甲氧基-n-(4-甲基苯基)-2-(2-吡啶基)-5-(三氟甲基)-4-嘧啶胺的制造》
[0487]
将对甲苯胺0.24g(2.22mmol)溶解于dmf 6.1ml中,加入氢化钠0.09g(2.27mmol),在室温下搅拌30分钟后,加入4-氟-6-甲氧基-2-(2-吡啶基)-5-三氟甲基吡啶0.50g(1.83mmol),在100℃下搅拌18.8小时。在反应液中加入水,用乙酸乙酯萃取,用硫酸钠干燥有机相。将干燥的有机相过滤,将滤液浓缩后进行柱纯化,得到具有下述结构的6-甲氧基-n-(4-甲基苯基)-2-(2-吡啶基)-5-(三氟甲基)-4-嘧啶胺0.31g(0.87mmol)。收率为48%。
[0488]
[化学式64]
[0489][0490]
分析结果如下所述。
[0491]1h nmr(400mhz,cdcl3)δppm:8.81(m,1h),8.31(d,j=8.0hz,1h),7.80(ddd,j=7.6,7.6,1.8hz,1h),7.49(d,j=8.2hz,2h),7.32-7.40(m,2h),7.21(d,j=8.3hz,2h),4.21(s,3h),2.37(s,3h)
[0492]
apci-ms(m/z):360.1[m+h]
+
[0493]
(实施例26)
[0494]
《6-甲氧基-n-(4-甲基苯基)-2-(3-吡啶基)-5-(三氟甲基)-4-嘧啶胺的制造》
[0495]
将对甲苯胺1.89g(17.60mmol)溶解于dmf 49.0ml中,加入氢化钠0.72g(17.98mmol),在室温下搅拌30分钟后,加入4-氟-6-甲氧基-2-(3-吡啶基)-5-三氟甲基吡啶4.02g(14.73mmol),在100℃下搅拌24小时。在反应液中加入水,用乙酸乙酯萃取,用硫酸钠干燥有机相。将干燥的有机相过滤,将滤液浓缩后进行柱纯化,得到具有下述结构的6-甲氧基-n-(4-甲基苯基)-2-(3-吡啶基)-5-(三氟甲基)-4-嘧啶胺0.71g(1.98mmol)。收率为13%。
[0496]
[化学式65]
[0497][0498]
分析结果如下所述。
[0499]1h nmr(400mhz,cdcl3)δppm:9.52(m,1h),8.68(dd,j=4.6,1.2hz,1h),8.54(ddd,j=8.0,1.5,1.5hz,1h),7.40(d,j=8.3hz,2h),7.35(dd,j=8.0,4.9hz,1h),7.31(br,1h),7.21(d,j=8.3hz,2h),4.13(s,3h),2.38(s,3h)
[0500]
apci-ms(m/z):360.0[m+h]
+
[0501]
(实施例27)
[0502]
《6-甲氧基-n-(4-甲基苯基)-2-(4-吡啶基)-5-(三氟甲基)-4-嘧啶胺的制造》
[0503]
将对甲苯胺0.24g(2.27mmol)溶解于dmf 6.1ml中,加入氢化钠0.09g(2.30mmol),在室温下搅拌30分钟后,加入4-氟-6-甲氧基-2-(4-吡啶基)-5-三氟甲基吡啶0.50g(1.82mmol),在100℃下搅拌24小时。在反应液中加入水,用乙酸乙酯萃取,用硫酸钠干燥有机相。将干燥的有机相过滤,将滤液浓缩后进行柱纯化,得到具有下述结构的6-甲氧基-n-(4-甲基苯基)-2-(4-吡啶基)-5-(三氟甲基)-4-嘧啶胺0.24g(0.65mmol)。收率为36%。
[0504]
[化学式66]
[0505][0506]
分析结果如下所述。
[0507]1h nmr(400mhz,cdcl3)δppm:8.73(dd,j=4.3,1.4hz,2h),8.13(dd,j=4.3,1.8hz,2h),7.41(d,j=8.3hz,2h),7.33(br,1h),7.23(d,j=8.3hz,2h),4.16(s,3h),2.40(s,3h)
[0508]
apci-ms(m/z):360.0[m+h]
+
[0509]
(实施例28)
[0510]
《6-氯-n-(4-甲基苯基)-2-(4-吡啶基)-5-(三氟甲基)-4-嘧啶胺的制造》
[0511]
将对甲苯胺0.04g(0.36mmol)溶解于dmf 1.1ml中,加入氢化钠0.02g(0.45mmol),在室温下搅拌30分钟后,加入实施例11中得到的4,6-二氯-2-(4-吡啶基)-5-三氟甲基吡啶0.10g(0.34mmol),在室温下搅拌18.3小时。在反应液中加入水,用乙酸乙酯萃取,用硫酸钠干燥有机相。将干燥的有机相过滤,将滤液浓缩后进行柱纯化,得到具有下述结构的6-氯-n-(4-甲基苯基)-2-(4-吡啶基)-5-(三氟甲基)-4-嘧啶胺0.11g(0.30mmol)。收率为89%。
[0512]
[化学式67]
[0513][0514]
分析结果如下所述。
[0515]1h nmr(400mhz,cdcl3)δppm:8.74(dd,j=4.6,1.5hz,2h),8.10(dd,j=4.3,1.8hz,2h),7.51(br,1h),7.39(d,j=8.3hz,2h),7.27(d,j=8.3hz,2h),2.42(s,3h)
[0516]
apci-ms(m/z):365.1[m+h]
+
[0517]
(实施例29)
[0518]
《4,6-双(1,1-二甲基乙氧基)-2-(2-吡啶基)-5-三氟甲基嘧啶的制造》
[0519]
将4-氟-6-甲氧基-2-(2-吡啶基)-5-三氟甲基吡啶4.00g(14.64mmol)溶解于thf 48.0ml中,加入叔丁醇钾4.14g(36.89mmol),在50℃下搅拌29.8小时。将反应液浓缩后,加入饱和氯化铵水溶液,用乙酸乙酯萃取,用硫酸钠干燥、过滤、浓缩,进行柱纯化,得到具有下述结构的4,6-双(1,1-二甲基乙氧基)-2-(2-吡啶基)-5-三氟甲基嘧啶2.34g(6.34mmol)。收率为43%。
[0520]
[化学式68]
[0521][0522]
分析结果如下。其中,对于apci-ms(m/z),检测出2个叔丁基脱落的产物的m/z。
[0523]1h nmr(400mhz,cdcl3)δppm:8.81(ddd,j=4.6,1.8,0.9hz,1h),8.29(ddd,j=8.0,1.2,0.9hz,1h),7.82(ddd,j=7.6,7.6,1.5hz,1h),7.38(ddd,j=7.3,4.6,1.2hz,1h),1.71(s,18h)
[0524]
apci-ms(m/z):257.9[m-t bu]
+
[0525]
(实施例30)
[0526]
《6-羟基-2-(2-吡啶基)-5-(三氟甲基)-4(3h)-嘧啶酮的制造》
[0527]
将实施例29得到的4,6-双(1,1-二甲基乙氧基)-2-(2-吡啶基)-5-三氟甲基嘧啶2.34g(6.34mmol)溶解于二氯甲烷10.5ml中,加入三氟乙酸(tfa)10.5ml,在室温下搅拌15.7小时后,将反应液浓缩,用乙酸乙酯进行洗涤过滤,得到具有下述结构的6-羟基-2-(2-吡啶基)-5-(三氟甲基)-4(3h)-嘧啶酮1.55g(6.01mmol)。收率为95%。
[0528]
[化学式69]
[0529][0530]
分析结果如下。
[0531]1h nmr(400mhz,dmso-d6)δppm:12.74(br,2h),8.79(ddd,j=4.6,1.5,0.9hz,1h),8.27(ddd,j=8.0,1.2,0.9hz,1h),8.11(ddd,j=7.6,7.6,1.8hz,1h),7.72(ddd,j=7.6,4.6,1.2hz,1h)
[0532]
apci-ms(m/z):255.7[m+h]-[0533]
(实施例31)
[0534]
《4,6-二氯-2-(2-吡啶基)-5-三氟甲基嘧啶的制造》
[0535]
将实施例30得到的6-羟基-2-(2-吡啶基)-5-(三氟甲基)-4(3h)-嘧啶酮1.00g(3.88mmol)溶解于pocl
3 10.0ml中,加入3滴dmf,在加热回流条件下搅拌6小时。空气冷却至室温后,将反应液滴加至添加有碳酸氢钠的冰中进行中和后,用乙酸乙酯进行萃取。用硫酸钠干燥后,进行过滤。将滤液浓缩,进行柱纯化,得到具有下述结构的4,6-二氯-2-(2-吡啶基)-5-三氟甲基嘧啶0.98g(3.34mmol)。收率为86%。
[0536]
[化学式70]
[0537][0538]
分析结果如下。
[0539]1h nmr(400mhz,cdcl3)δppm:8.92(d,j=4.6hz,1h),8.57(d,j=8.0hz,1h),7.93(ddd,j=8.0,8.0,1.8hz,1h),7.52(ddd,j=7.6,4.9,1.2hz,1h)
[0540]
apci-ms(m/z):293.8[m+h]
+
[0541]
(实施例32)
[0542]
《6-氯-n-(4-甲基苯基)-2-(2-吡啶基)-5-(三氟甲基)-4-嘧啶胺的制造》
[0543]
将对甲苯胺0.36g(3.34mmol)溶解于dmf 4.0ml中,加入氢化钠0.17g(4.25mmol),在室温下搅拌30分钟后,加入溶解于dmf 7.0ml中的实施例30得到的4,6-二氯-2-(2-吡啶基)-5-三氟甲基吡啶0.98g(3.34mmol),在室温下搅拌21.7小时。在反应液中加入水,用乙酸乙酯萃取,用硫酸钠干燥有机相。将干燥的有机相过滤,将滤液浓缩后进行柱纯化,得到具有下述结构的6-氯-n-(4-甲基苯基)-2-(2-吡啶基)-5-(三氟甲基)-4-嘧啶胺0.89g(2.44mmol)。收率为73%。
[0544]
[化学式71]
[0545][0546]
分析结果如下所述。
[0547]1h nmr(400mhz,cdcl3)δppm:8.84(ddd,j=4.6,1.8,0.9hz,1h),8.24(ddd,j=8.0,0.9,0.9hz,1h),7.80(ddd,j=8.0,7.6,1.8hz,1h),7.52(br,1h),7.45(dd,j=8.3,1.8,1.8hz,2h),7.41(ddd,j=7.6,4.9,1.2hz,1h),7.25(d,j=9.2hz,2h),2.40(s,3h)
[0548]
apci-ms(m/z):365.0[m+h]
+
[0549]
(实施例33)
[0550]
《4,6-双(1,1-二甲基乙氧基)-2-(3-吡啶基)-5-三氟甲基嘧啶的制造》
[0551]
将4-氟-6-甲氧基-2-(3-吡啶基)-5-三氟甲基吡啶4.00g(14.63mmol)溶解于thf 48.0ml中,加入叔丁醇钾4.12g(36.68mmol),在50℃下搅拌29.8小时。将反应液浓缩后,加入饱和氯化铵水溶液,用乙酸乙酯萃取,用硫酸钠干燥、过滤。浓缩后,进行柱纯化,得到具有下述结构的4,6-双(1,1-二甲基乙氧基)-2-(3-吡啶基)-5-三氟甲基嘧啶2.2g
(6.0mmol)。收率为41%。
[0552]
[化学式72]
[0553][0554]
4,6-双(1,1-二甲基乙氧基)-2-(3-吡啶基)-5-三氟甲基嘧啶的分析结果如下。
[0555]1h nmr(400mhz,cdcl3)δppm:9.56(dd,j=2.1,0.6hz,1h),8.73(dd,j=4.9,1.5hz,1h),8.55(dd,j=8.0,2.1,1.8hz,1h),7.43(ddd,j=8.0,4.9,0.9hz,1h),1.70(s,18h)
[0556]
apci-ms(m/z):370.1[m+h]
+
[0557]
同时,还得到4-(1,1-二甲基乙氧基)-6-甲氧基-2-(3-吡啶基)-5-三氟甲基嘧啶0.3g(收率5%)。
[0558]
[化学式73]
[0559][0560]
4-(1,1-二甲基乙氧基)-6-甲氧基-2-(3-吡啶基)-5-三氟甲基嘧啶的分析结果如下。
[0561]1h nmr(400mhz,cdcl3)δppm:9.60(d,j=2.1hz,1h),8.74(dd,j=4.9,1.8hz,1h),8.62(ddd,j=8.3,2.1,1.8hz,1h),7.43(ddd,j=8.0,4.9,0.6hz,1h),4.14(s,3h),1.70(s,18h)
[0562]
apci-ms(m/z):328.1[m+h]
+
[0563]
(实施例34)
[0564]
《6-羟基-2-(3-吡啶基)-5-(三氟甲基)-4(3h)-嘧啶酮的制造》
[0565]
将实施例33得到的4,6-双(1,1-二甲基乙氧基)-2-(3-吡啶基)-5-三氟甲基吡啶2.22g(6.02mmol)溶解于二氯甲烷10.0ml中,加入三氟乙酸(tfa)10.0ml,在室温下搅拌20.4小时。然后,将反应液浓缩,用乙酸乙酯进行洗涤过滤,得到具有下述结构的6-羟基-2-(3-吡啶基)-5-(三氟甲基)-4(3h)-嘧啶酮的粗产物。
[0566]
[化学式74]
[0567][0568]
分析结果如下所述。
[0569]1h nmr(400mhz,dmso-d6)δppm:13.10(br,2h),9.15(d,j=1.7hz,1h),8.80(dd,j=4.9,1.8hz,1h),8.37(ddd,j=8.0,2.1,1.8hz,1h),7.61(ddd,j=8.0,4.9,0.6hz,1h)
[0570]
apci-ms(m/z):255.9[m+h]-[0571]
(实施例35)
[0572]
《4,6-二氯-2-(3-吡啶基)-5-三氟甲基嘧啶的制造》
[0573]
将实施例34得到的6-羟基-2-(3-吡啶基)-5-(三氟甲基)-4(3h)-嘧啶酮的粗产物1.0g溶解于pocl
3 10.0ml中,加入3滴dmf,在加热回流条件下搅拌6小时。空气冷却至室温后,将反应液滴加至添加有碳酸氢钠的冰中进行中和后,用乙酸乙酯进行萃取。用硫酸钠干燥后,进行过滤。将滤液浓缩,进行柱纯化,得到具有下述结构的4,6-二氯-2-(3-吡啶基)-5-三氟甲基嘧啶0.63g(2.16mmol)。
[0574]
[化学式75]
[0575][0576]
分析结果如下所述。
[0577]1h nmr(400mhz,cdcl3)δppm:9.66(d,j=1.5hz,1h),8.83(dd,j=4.9,1.5hz,1h),8.73(ddd,j=8.0,2.1,1.8hz,1h),7.49(ddd,j=8.0,4.9,0.9hz,1h)
[0578]
apci-ms(m/z):293.9[m+h]
+
[0579]
(实施例36)
[0580]
《6-氯-n-(4-甲基苯基)-2-(3-吡啶基)-5-(三氟甲基)-4-嘧啶胺的制造》
[0581]
将对甲苯胺0.23g(2.17mmol)溶解于dmf 2.0ml中,加入氢化钠0.11g(2.63mmol),在室温下搅拌30分钟后,加入溶解于dmf 8.0ml中的实施例35得到的4,6-二氯-2-(3-吡啶基)-5-三氟甲基吡啶0.63g(2.16mmol),在室温下搅拌21.5小时。在反应液中加入水,用乙酸乙酯萃取,用硫酸钠干燥有机相。将干燥的有机相过滤,将滤液浓缩后进行柱纯化,得到具有下述结构的6-氯-n-(4-甲基苯基)-2-(3-吡啶基)-5-(三氟甲基)-4-嘧啶胺0.51g(1.40mmol)。收率为65%。
[0582]
[化学式76]
[0583][0584]
分析结果如下所述。
[0585]1h nmr(400mhz,cdcl3)δppm:9.45(dd,j=2.1,0.6hz,1h),8.72(dd,j=4.9,1.5hz,1h),8.56(ddd,j=8.0,2.1,1.8hz,1h),7.49(br,1h),7.36-7.40(m,3h),7.25(d,j=9.5hz,2h),2.40(s,3h)
[0586]
apci-ms(m/z):365.1[m+h]
+
[0587]
(实施例37)
[0588]
《6-甲氧基-n-(4-甲基苯基)-2-(6-正丙基-2-吡啶基)-5-(三氟甲基)-4-嘧啶胺的制造》
[0589]
将对甲苯胺0.4g(3.3mmol)溶解于dmf 2.0ml中,加入氢化钠0.13g(3.3mmol),在室温下搅拌35分钟后,加入溶解于dmf 7.0ml中的4-氟-6-甲氧基-2-(3-正丙基-2-吡啶基)-5-三氟甲基吡啶0.9g(2.7mmol),在室温下搅拌51.7小时。在反应液中加入水,用乙酸乙酯萃取,用硫酸钠干燥有机相。将干燥的有机相过滤,将滤液浓缩后进行柱纯化,得到具有下述结构的6-甲氧基-n-(4-甲基苯基)-2-(6-正丙基-2-吡啶基)-5-(三氟甲基)-4-嘧啶胺0.7g(1.7mmol)。收率为61%。
[0590]
[化学式77]
[0591][0592]
分析结果如下所述。
[0593]1h nmr(400mhz,cdcl3)δppm:8.14(d,j=7.6hz,1h),7.70(dd,j=8.0,7.6hz,1h),7.64(d,j=8.6hz,2h),7.36(br,1h),7.25(d,j=8.3hz,1h),7.18(d,j=8.3hz,2h),4.18(s,3h),2.90(t,j=7.6hz,1h),2.36(s,3h),1.92(tq,j=7.3,7.3hz,2h),1.05(t,j=7.3hz,3h)
[0594]
apci-ms(m/z):403.0[m+h]
+
[0595]
(实施例38)
[0596]
《6-甲氧基-2-(2-甲氧基-5-吡啶基)-n-(4-甲基苯基)-5-(三氟甲基)-4-嘧啶胺的制造》
[0597]
将对甲苯胺0.03g(0.3mmol)溶解于dmf 1.0ml中,加入氢化钠0.02g(0.6mmol),在
室温下搅拌30分钟后,加入4-氟-6-甲氧基-2-(2-甲氧基-5-吡啶基)-5-三氟甲基吡啶0.1g(0.3mmol),在室温下搅拌25小时。在反应液中加入水,用乙酸乙酯萃取,用硫酸钠干燥有机相。将干燥的有机相过滤,将滤液浓缩后进行柱纯化,得到具有下述结构的6-氯-2-(2-甲氧基-5-吡啶基)-n-(4-甲基苯基)-5-(三氟甲基)-4-嘧啶胺0.002g(0.005mmol)。收率为2%。
[0598]
[化学式78]
[0599][0600]
分析结果如下所述。
[0601]1h nmr(400mhz,cdcl3)δppm:9.14(d,j=1.8hz,1h),8.44(dd,j=2.5,8.6hz,1h),7.40(d,j=8.3hz,2h),7.26(br,1h),7.21(d,j=8.3hz,1h),6.78(d,j=8.3hz,2h),4.11(s,3h),4.00(s,3h),2.38(s,3h)
[0602]
apci-ms(m/z):390.5[m]
+
[0603]
(实施例39)
[0604]
《6-甲氧基-2-(2-甲氧基-5-吡啶基)-4-[(4-甲基苯基)硫代]-5-三氟甲基嘧啶的制造》
[0605]
将对甲苯硫酚0.08g(0.3mmol)溶解于dmf 5.0ml中,加入氢化钠0.02g(0.5mmol),在室温下搅拌30分钟后,冷却至0℃,加入4-氟-6-甲氧基-2-(2-甲氧基-5-吡啶基)-5-三氟甲基吡啶0.09g(0.3mmol),在室温下搅拌16.5小时。在反应液中加入水,用乙酸乙酯萃取,用硫酸钠干燥有机相。将干燥的有机相过滤,将滤液浓缩后进行柱纯化,得到具有下述结构的6-甲氧基-2-(2-甲氧基-5-吡啶基)-4-[(4-甲基苯基)硫代]-5-三氟甲基嘧啶0.1g(0.2mmol)。收率为80%。
[0606]
[化学式79]
[0607][0608]
分析结果如下所述。
[0609]1h nmr(400mhz,cdcl3)δppm:8.82(d,j=2.5hz,1h),7.95(dd,j=8.9,2.5hz,1h),7.45(d,j=8.3hz,2h),7.30(d,j=8.0hz,2h),6.63(d,j=8.6hz,1h),4.12(s,3h),3.97(s,3h),2.47(s,3h)
[0610]
apci-ms(m/z):407.4[m]
+
[0611]
(实施例40)
[0612]
《6-甲氧基-2-(2-甲氧基-5-吡啶基)-4-(苯基甲氧基)-5-三氟甲基嘧啶的制造》
[0613]
将苯甲醇0.05g(0.5mmol)溶解于dmf 3.0ml中,加入氢化钠0.03g(0.7mmol),在室温下搅拌30分钟后,冷却至0℃,加入4-氟-6-甲氧基-2-(6-甲氧基-3-吡啶基)-5-三氟甲基吡啶0.09g(0.3mmol),在室温下搅拌19小时。在反应液中加入水,用乙酸乙酯萃取,用硫酸钠干燥有机相。将干燥的有机相过滤,将滤液浓缩后进行柱纯化,得到具有下述结构的6-甲氧基-2-(2-甲氧基-5-吡啶基)-4-(苯基甲氧基)-5-三氟甲基嘧啶0.08g(0.2mmol)。收率为72%。
[0614]
[化学式80]
[0615][0616]
分析结果如下所述。
[0617]1h nmr(400mhz,cdcl3)δppm:9.26(ddd,j=7.6,2.5,0.6hz,1h),8.54(ddd,j=9.5,8.6,2.1hz,1h),7.30-7.50(m,5h),6.83(d,j=8.6hz,1h),5.63(s,2h),4.13(s,3h),4.03(d,j=8.6hz,3h)
[0618]
apci-ms(m/z):391.5[m]
+
[0619]
(实施例41)
[0620]
《6-甲氧基-n-(4-甲基苯基)-5-(三氟甲基)-2-(2-三氟甲基-5-吡啶基)-4-嘧啶胺的制造》
[0621]
将对甲苯胺0.04g(0.4mmol)溶解于dmf 5.0ml中,加入氢化钠0.02g(0.6mmol),在室温下搅拌30分钟后,冷却至0℃,加入4-氟-6-甲氧基-5-三氟甲基-2-(6-三氟甲基-3-吡啶基)吡啶0.1g(0.4mmol),在室温下搅拌26.8小时。在反应液中加入水,用乙酸乙酯萃取,用硫酸钠干燥有机相。将干燥的有机相过滤,将滤液浓缩后进行柱纯化,得到具有下述结构的6-甲氧基-n-(4-甲基苯基)-5-(三氟甲基)-2-(2-三氟甲基-5-吡啶基)-4-嘧啶胺0.001g(0.002mmol)。收率为1%。
[0622]
[化学式81]
[0623][0624]
分析结果如下所述。
[0625]1h nmr(400mhz,cdcl3)δppm:9.59(s,1h),8.72(dd,j=8.3,1.2hz,1h),7.75(d,j=8.0hz,1h),7.36(d,j=8.3hz,2h),7.34(br,1h),7.22(d,j=8.3hz,2h),4.15(s,3h),2.39(s,3h)
[0626]
apci-ms(m/z):428.4[m]
+
[0627]
(实施例42)
[0628]
《6-甲氧基-4-[(4-甲基苯基)硫代]-5-三氟甲基-2-(2-三氟甲基-5-吡啶基)嘧啶的制造》
[0629]
将对甲苯硫酚0.04g(0.3mmol)溶解于dmf 5.0ml中,加入氢化钠0.02g(0.6mmol),在室温下搅拌30分钟后,冷却至0℃,加入4-氟-6-甲氧基-5-三氟甲基-2-(6-三氟甲基-3-吡啶基)吡啶0.1g(0.3mmol),在室温下搅拌28.5小时。在反应液中加入水,用乙酸乙酯萃取,用硫酸钠干燥有机相。将干燥的有机相过滤,将滤液浓缩后进行柱纯化,得到具有下述结构的6-甲氧基-4-[(4-甲基苯基)硫代]-5-三氟甲基-2-(2-三氟甲基-5-吡啶基)嘧啶0.1g(0.3mmol)。收率为89%。
[0630]
[化学式82]
[0631][0632]
分析结果如下所述。
[0633]1h nmr(400mhz,cdcl3)δppm:9.23(d,j=1.8hz,1h),8.32(dd,j=8.3,1.2hz,1h),7.63(dd,j=8.3,0.6hz,1h),7.45(m,2h),7.31(m,2h),4.17(s,3h),2.48(s,3h)
[0634]
apci-ms(m/z):445.2[m]
+
[0635]
(实施例43)
[0636]
《6-甲氧基-4-苯氧基-5-三氟甲基-2-(2-三氟甲基-5-吡啶基)嘧啶的制造》
[0637]
将苯酚0.04g(0.3mmol)溶解于dmf 5.0ml中,加入氢化钠0.02g(0.5mmol),在室温下搅拌30分钟后,冷却至0℃,加入4-氟-6-甲氧基-5-三氟甲基-2-(2-三氟甲基-5-吡啶基)
吡啶0.1g(0.3mmol),在室温下搅拌30.5小时。在反应液中加入水,用乙酸乙酯萃取,用硫酸钠干燥有机相。将干燥的有机相过滤,将滤液浓缩后进行柱纯化,得到具有下述结构的6-甲氧基-4-苯氧基-5-三氟甲基-2-(2-三氟甲基-5-吡啶基)嘧啶0.1g(0.3mmol)。收率为97%。
[0638]
[化学式83]
[0639][0640]
分析结果如下所述。
[0641]1h nmr(400mhz,cdcl3)δppm:9.41(d,j=1.8hz,1h),8.56(dd,j=8.3,1.2hz,1h),7.71(d,j=7.6hz,1h),7.26(br,1h),7.43-7.47(m,2h),7.29-7.33(m,1h),7.16-7.19(m,2h),4.22(s,3h)
[0642]
apci-ms(m/z):415.4[m]
+
[0643]
(实施例44)
[0644]
《6-甲氧基-n-(4-甲基苯基)-5-(三氟甲基)-2-(4-甲硫基-2-吡啶基)-4-嘧啶胺的制造》
[0645]
将对甲苯胺0.02g(0.1mmol)溶解于dmf 1.0ml中,加入氢化钠0.01g(0.3mmol),在室温下搅拌30分钟后,冷却至0℃,加入溶解于dmf2ml中的4-氟-6-甲氧基-2-(4-甲硫基-2-吡啶基)-5-三氟甲基吡啶0.05g(0.1mmol),在室温下搅拌22.6小时。在反应液中加入水,用乙酸乙酯萃取,用硫酸钠干燥有机相。将干燥的有机相过滤,将滤液浓缩后进行柱纯化,得到痕量具有下述结构的6-甲氧基-n-(4-甲基苯基)-5-(三氟甲基)-2-(4-甲硫基-2-吡啶基)-4-嘧啶胺。
[0646]
[化学式84]
[0647][0648]
分析结果如下所述。
[0649]1h nmr(400mhz,cdcl3)δppm:8.56(d,j=5.5hz,1h),8.14(d,j=2.1,1h),7.46(d,j=8.6hz,2h),7.32-7.54(m,1h),7.18-7.21(m,3h),4.22(s,3h),2.48(s,3h),2.37(s,3h)
[0650]
apci-ms(m/z):406.3[m]
+
[0651]
(实施例45)
[0652]
《2-(2-溴-3-吡啶基)-6-甲氧基-n-(4-甲基苯基)-5-(三氟甲基)-4-嘧啶胺的制
造》
[0653]
将对甲苯胺0.03g(0.2mmol)溶解于dmf 3.0ml中,加入氢化钠0.01g(0.4mmol)中,在室温下搅拌30分钟后,冷却至0℃,加入2-(2-溴-5-吡啶基)-4-氟-6-甲氧基-5-三氟甲基吡啶0.09g(0.3mmol),在室温下搅拌22小时。在反应液中加入水,用乙酸乙酯萃取,硫酸钠干燥有机相。将干燥的有机相过滤,将滤液浓缩后进行柱纯化,得到痕量具有下述结构的2-(2-溴-3-吡啶基)-6-甲氧基-n-(4-甲基苯基)-5-(三氟甲基)-4-嘧啶胺。
[0654]
[化学式85]
[0655][0656]
分析结果如下所述。
[0657]1h nmr(400mhz,cdcl3)δppm:9.23(ddd,j=2.5,0.6hz,1h),8.38(dd,j=8.3,2.5hz,1h),7.54(dd,j=8.3,0.6hz,1h),7.36(d,j=11.0hz,2h),7.30-7.32(m,1h),7.20(d,j=8.0hz,1h),4.13(s,3h),2.38(s,3h)
[0658]
apci-ms(m/z):440.3[m+h]
+
[0659]
(实施例46)
[0660]
《2-(2-溴-5-吡啶基)-6-甲氧基-4-[(4-甲基苯基)硫代]-5-三氟甲基嘧啶的制造》
[0661]
将对甲苯硫酚0.04g(0.3mmol)溶解于dmf 3.0ml中,加入氢化钠0.02g(0.5mmol),在室温下搅拌30分钟后,冷却至0℃,加入2-(2-溴-5-吡啶基)-4-氟-6-甲氧基-5-三氟甲基吡啶0.10g(0.3mmol),在室温下搅拌21.6小时。在反应液中加入水,用乙酸乙酯萃取,用硫酸钠干燥有机相。将干燥的有机相过滤,将滤液浓缩后进行柱纯化,具有下述结构的2-(2-溴-5-吡啶基)-6-甲氧基-4-[(4-甲基苯基)硫代]-5-三氟甲基嘧啶0.02g(0.03mmol)。收率为12%。
[0662]
[化学式86]
[0663][0664]
分析结果如下所述。
[0665]1h nmr(400mhz,cdcl3)δppm:8.83(d,j=2.5hz,1h),8.01(dd,j=8.3,2.5hz,1h),
7.43-7.45(m,3h),7.29(d,j=8.3hz,2h),4.14(s,3h),2.47(s,3h)
[0666]
apci-ms(m/z):457.1[m+h]
+
[0667]
(实施例47)
[0668]
《2-(2-溴-5-吡啶基)-6-甲氧基-4-苯氧基-5-三氟甲基嘧啶的制造》
[0669]
将苯酚0.03g(0.3mmol)溶解于dmf 3.0ml中,加入氢化钠0.02g(0.4mmol),在室温下搅拌30分钟后,冷却至0℃,加入2-(2-溴-5-吡啶基)-4-氟-6-甲氧基-5-三氟甲基吡啶0.1g(0.3mmol),在室温下搅拌19.8小时。在反应液中加入水,用乙酸乙酯萃取,用硫酸钠干燥有机相。将干燥的有机相过滤,将滤液浓缩后进行柱纯化,得到具有下述结构的2-(2-溴-5-吡啶基)-6-甲氧基-4-苯氧基-5-三氟甲基嘧啶0.13g(0.3mmol)。收率为80%。
[0670]
[化学式87]
[0671][0672]
分析结果如下所述。
[0673]1h nmr(400mhz,cdcl3)δppm:9.06(d,j=2.0hz,1h),8.21(dd,j=8.6,2.5hz,1h),7.50(d,j=8.3hz,1h),7.44(t,j=7.8hz,2h),7.30(t,j=7.6hz,1h),7.17(d,j=8.0hz,2h),4.19(s,3h)
[0674]
apci-ms(m/z):427.0[m+h]
+
[0675]
(实施例48)
[0676]
《2-(2-二甲基氨基-4-吡啶基)-6-甲氧基-n-(4-甲基苯基)-5-(三氟甲基)-4-嘧啶胺的制造》
[0677]
将对甲苯胺0.03g(0.3mmol)溶解于dmf 3.0ml中,加入氢化钠0.02g(0.4mmol),在室温下搅拌30分钟后,冷却至0℃,加入2-(2-二甲基氨基-4-吡啶基)-4-氟-6-甲氧基-5-三氟甲基吡啶0.08g(0.3mmol),在室温下搅拌41.4小时。在反应液中加入水,用乙酸乙酯萃取,用硫酸钠干燥有机相。将干燥的有机相过滤,将滤液浓缩后进行柱纯化,得到具有下述结构的2-(2-二甲基氨基-4-吡啶基)-6-甲氧基-n-(4-甲基苯基)-5-(三氟甲基)-4-嘧啶胺0.008g(0.02mmol)。收率为8%。
[0678]
[化学式88]
[0679]
[0680]
分析结果如下所述。
[0681]1h nmr(400mhz,cdcl3)δppm:8.27(d,j=5.5,1h),7.48(s,1h),7.45(d,j=8.3hz,2h),7.41(dd,j=5.2,1,2hz,1h),7.30-7.32(m,1h),7.19(d,j=8.6hz,2h),4.40(s,3h),3.14(s,6h),2.37(s,3h)
[0682]
apci-ms(m/z):403.3[m]
+
[0683]
(实施例49)
[0684]
《2-(2-二甲基氨基-4-吡啶基)-6-甲氧基-4-[(4-甲基苯基)硫代]-5-三氟甲基嘧啶的制造》
[0685]
将对甲苯硫酚0.04g(0.3mmol)溶解于dmf 1.0ml中,加入氢化钠0.02g(0.5mmol),在室温下搅拌30分钟后,冷却至0℃,加入溶解于dmf 3.5ml中的2-(2-二甲基氨基-4-吡啶基)-4-氟-6-甲氧基-5-三氟甲基吡啶0.09g(0.4mmol),在室温下搅拌17.5小时。在反应液中加入水,用乙酸乙酯萃取,用硫酸钠干燥有机相。将干燥的有机相过滤,将滤液浓缩后进行柱纯化,得到具有下述结构的2-(2-二甲基氨基-4-吡啶基)-6-甲氧基-4-[(4-甲基苯基)硫代]-5-三氟甲基嘧啶0.10g(0.2mmol)。收率为82%。
[0686]
[化学式89]
[0687][0688]
分析结果如下所述。
[0689]1h nmr(400mhz,cdcl3)δppm:8.18(d,j=5.2,0.9hz,1h),7.47(d,j=8.3hz,2h),7.28(d,j=8.0hz,2h),7.25-7.60(m,1h),6.89(s,1h),4.15(s,3h),2.98(s,6h),2.41(s,3h)
[0690]
apci-ms(m/z):420.2[m]
+
[0691]
(实施例50)
[0692]
《2-(2-二甲基氨基-4-吡啶基)-6-甲氧基-4-苯氧基-5-三氟甲基嘧啶的制造》
[0693]
将苯酚0.04g(0.4mmol)溶解于dmf 3.0ml中,加入氢化钠0.02g(0.5mmol),在室温下搅拌30分钟后,冷却至0℃,加入2-(2-二甲基氨基-4-吡啶基)-4-氟-6-甲氧基-5-三氟甲基吡啶0.09g(0.3mmol),在室温下搅拌15.4小时。在反应液中加入水,用乙酸乙酯萃取,用硫酸钠干燥有机相。将干燥的有机相过滤,将滤液浓缩后进行柱纯化,得到具有下述结构的2-(2-二甲基氨基-4-吡啶基)-6-甲氧基-4-苯氧基-5-三氟甲基嘧啶0.09g(0.2mmol)。收率为85.6%。
[0694]
[化学式90]
[0695][0696]
分析结果如下所述。
[0697]1h nmr(400mhz,cdcl3)δppm:8.21(d,j=5.2,0.9hz,1h),7.41-7.47(m,2h),7.19-7.31(m,5h),7.20(s,3h),3.04(s,3h)
[0698]
apci-ms(m/z):390.3[m]
+
[0699]
(实施例51)
[0700]
《6-甲氧基-2-(4-硝基-2-吡啶基)-4-苯氧基-5-三氟甲基嘧啶的制造》
[0701]
将苯酚0.04g(0.4mmol)溶解于dmf 1.0ml中,加入氢化钠0.01g(0.3mmol),在室温下搅拌30分钟后,冷却至0℃,加入溶解于dmf2.0ml中的4-氟-2-(4-硝基-2-吡啶基)-6-甲氧基-5-三氟甲基吡啶0.06g(0.2mmol),在室温下搅拌23.3小时。在反应液中加入水,用乙酸乙酯萃取,用硫酸钠干燥有机相。将干燥的有机相过滤,将滤液浓缩后进行柱纯化,得到具有下述结构的6-甲氧基-2-(4-硝基-2-吡啶基)-4-苯氧基-5-三氟甲基嘧啶的粗纯化物0.01g。
[0702]
[化学式91]
[0703][0704]
分析结果如下所述。
[0705]1h nmr(400mhz,cdcl3)δppm:9.05(d,j=5.2,0.6hz,1h),8.72(d,j=1.8hz,1h),8.08(dd,j=5.2,2.1hz,1h),7.45-7.51(m,2h),7.32-7.36(m,1h),7.23-7.26(m,2h),4.29(s,3h)
[0706]
apci-ms(m/z):392.3[m]
+
[0707]
(实施例52)
[0708]
《2-[6-甲氧基-4-[(4-甲基苯基)氨基]-5-(三氟甲基)-2-嘧啶基]-4-吡啶羧酸甲酯的制造》
[0709]
将对甲苯胺0.07g(0.6mmol)溶解于dmf 6.0ml中,加入氢化钠0.03g(0.7mmol),在室温下搅拌30分钟后,冷却至10℃,加入2-[(4-氟-6-甲氧基-5-三氟甲基)-2-嘧啶基]-4-吡啶羧酸甲酯0.2g(0.6mmol),在室温下搅拌62.6小时。在反应液中加入水,用乙酸乙酯萃
取,用硫酸钠干燥有机相。将干燥的有机相过滤,滤液浓缩后进行柱纯化,得到具有下述结构的2-[6-甲氧基-4-(4-甲基苯基)氨基-5-(三氟甲基)-2-嘧啶基]-4-吡啶羧酸甲酯0.02g(0.05mmol)。收率为8%。
[0710]
[化学式92]
[0711][0712]
分析结果如下所述。
[0713]1h nmr(400mhz,cdcl3)δppm:8.96(dd,j=4.9,0.9hz,1h),8.87(dd,j=1.5,0.9,1h),7.94(dd,j=4.9,1.5hz,1h),7.53(d,j=8.3hz,2h),7.38-7.41(m,1h),7.23(d,j=8.3hz,2h),4.22(s,3h),4.00(s,3h),2.38(s,3h)
[0714]
apci-ms(m/z):418.6[m]
+
[0715]
(实施例53)
[0716]
《2-[6-甲氧基-4-[(4-甲基苯基)硫代]-5-(三氟甲基)-2-嘧啶基]-4-吡啶羧酸甲酯的制造》
[0717]
将对甲苯硫酚0.05g(0.4mmol)溶解于dmf 3.0ml中,加入氢化钠0.02g(0.5mmol),在室温下搅拌30分钟后,冷却至0℃,加入2-[(4-氟-6-甲氧基-5-三氟甲基)-2-嘧啶基]-4-吡啶羧酸甲酯0.1g(0.3mmol),在室温下搅拌16.6小时。在反应液中加入水,用乙酸乙酯萃取,用硫酸钠干燥有机相。将干燥的有机相过滤,将滤液浓缩后进行柱纯化,得到具有下述结构的2-[6-甲氧基-4-[(4-甲基苯基)硫代]-5-(三氟甲基)-2-嘧啶基]-4-吡啶羧酸甲酯0.10g(0.2mmol)。收率为75%。
[0718]
[化学式93]
[0719][0720]
分析结果如下所述。
[0721]1h nmr(400mhz,cdcl3)δppm:8.88(d,j=4.9,0.9hz,1h),8.23(m,1h),7.86(dd,j=4.9,1.5hz,1h),7.50(d,j=8.0hz,2h),7.34(d,j=8.3hz,2h),4.25(s,3h),3.97(s,3h),2.49(s,3h)
[0722]
apci-ms(m/z):435.9[m]
+
[0723]
(实施例54)
[0724]
《2-[6-甲氧基-4-苯氧基-5-(三氟甲基)-2-嘧啶基]-4-吡啶羧酸甲酯的制造》
[0725]
将苯酚0.03g(0.3mmol)溶解于dmf 3.0ml中,加入氢化钠0.02g(0.5mmol),在室温下搅拌30分钟后,冷却至0℃,加入2-[(4-氟-6-甲氧基-5-三氟甲基)-2-嘧啶基]-4-吡啶羧酸甲酯0.10g(0.3mmol),在室温下搅拌16小时。在反应液中加入水,用乙酸乙酯萃取,用硫酸钠干燥有机相。将干燥的有机相过滤,将滤液浓缩后进行柱纯化,得到具有下述结构的2-[6-甲氧基-4-苯氧基-5-(三氟甲基)-2-嘧啶基]-4-吡啶羧酸甲酯0.09g(0.2mmol)。收率为74%。
[0726]
[化学式94]
[0727][0728]
分析结果如下所述。
[0729]1h nmr(400mhz,cdcl3)δppm:8.91(d,j=4.9hz,1h),8.59(m,1h),7.91(dd,j=4.9,1.5hz,1h),7.45-7.49(m,2h),7.29-7.33(m,1h),7.25-7.27(m,2h),4.29(s,3h),3.95(s,3h)
[0730]
apci-ms(m/z):405.9[m]
+
[0731]
(实施例55)
[0732]
《6-甲氧基-n-(4-甲基苯基)-2-(3-甲基-2-吡啶基)-5-(三氟甲基)-4-嘧啶胺的制造》
[0733]
将对甲苯胺0.02g(0.2mmol)溶解于dmf 1.0ml中,加入氢化钠0.02g(0.4mmol),在室温下搅拌30分钟后,冷却至0℃,加入溶解于dmf2.0ml中的4-氟-6-甲氧基-2-(3-甲基-2-吡啶基)-5-三氟甲基吡啶的粗纯化物0.05g,在室温下搅拌17.1小时。在反应液中加入水,用乙酸乙酯萃取,用硫酸钠干燥有机相。将干燥的有机相过滤,将滤液浓缩后进行柱纯化,得到痕量的具有下述结构的6-甲氧基-n-(4-甲基苯基)-2-(3-甲基-2-吡啶基)-5-(三氟甲基)-4-嘧啶胺。
[0734]
[化学式95]
[0735][0736]
分析结果如下所述。
[0737]
apci-ms(m/z):374.3[m]
+
[0738]
(实施例56)
[0739]
《6-甲氧基-2-(3-甲基-2-吡啶基)-4-[(4-甲基苯基)硫代]-5-三氟甲基嘧啶的制造》
[0740]
将对甲苯硫酚0.03g(0.2mmol)溶解于dmf 1.0ml中,加入氢化钠0.02g(0.4mmol),在室温下搅拌30分钟后,冷却至0℃,加入4-氟-6-甲氧基-2-(3-甲基-2-吡啶基)-5-三氟甲基吡啶0.05g(0.2mmol),在室温下搅拌16小时。在反应液中加入水,用乙酸乙酯萃取,用硫酸钠干燥有机相。将干燥的有机相过滤,将滤液浓缩后进行柱纯化,得到具有下述结构的6-甲氧基-2-(3-甲基-2-吡啶基)-4-[(4-甲基苯基)硫代]-5-三氟甲基嘧啶0.01g(0.03mmol)。收率为21%。
[0741]
[化学式96]
[0742][0743]
分析结果如下所述。
[0744]1h nmr(400mhz,cdcl3)δppm:8.52(dd,j=4.9,0.9hz,1h),7.44(d,j=7.6hz,1h),7.41(d,j=8.0hz,2h),7.21(dd,j=8.0,4.9hz,1h),7.18(d,j=8.0hz,2h),4.15(s,3h),2.38(s,3h),1.84(s,3h)
[0745]
apci-ms(m/z):391.5[m]
+
[0746]
(实施例57)
[0747]
《6-甲氧基-2-(3-甲基-2-吡啶基)-4-苯氧基-5-三氟甲基嘧啶的制造》
[0748]
将苯酚0.03g(0.3mmol)溶解于dmf 1.0ml中,加入氢化钠0.02g(0.5mmol),在室温下搅拌30分钟后,冷却至15℃,加入溶解于dmf2ml中的4-氟-6-甲氧基-2-(3-甲基-2-吡啶基)-5-三氟甲基吡啶的粗纯化物0.09g,在室温下搅拌26.3小时。在反应液中加入水,用乙酸乙酯萃取,用硫酸钠干燥有机相。将干燥的有机相过滤,将滤液浓缩后进行柱纯化,得到具有下述结构的6-甲氧基-2-(3-甲基-2-吡啶基)-4-苯氧基-5-三氟甲基嘧啶0.06g(0.2mmol)。收率在2个工序中为1.9%。
[0749]
[化学式97]
[0750][0751]
分析结果如下所述。
[0752]1h nmr(400mhz,cdcl3)δppm:8.54(dd,j=4.6,0.9hz,1h),7.50(dd,j=7.6,0.9hz,1h),7.27-7.41(m,2h),7.21-7.25(m,2h),7.14-7.16(m,2h),4.19(s,3h),2.16(s,3h)
[0753]
apci-ms(m/z):361.3[m]
+
[0754]
(实施例58)
[0755]
《4,6-双(1,1-二甲基乙氧基)-2-(6-正丙基-2-吡啶基)-5-三氟甲基嘧啶和4-(1,1-二甲基乙氧基)-6-甲氧基-2-(6-正丙基-2-吡啶基)-5-三氟甲基嘧啶的制造》
[0756]
将4-氟-6-甲氧基-2-(3-正丙基-2-吡啶基)-5-三氟甲基吡啶0.6g(2.0mmol)溶解于thf 6.8ml中,加入叔丁醇钾0.6g(5.2mmol),在室温下搅拌18.8小时。将反应液浓缩后,加入饱和氯化铵水溶液,用乙酸乙酯萃取,用硫酸钠干燥有机相。将干燥的有机相过滤,将滤液浓缩后进行柱纯化,得到具有下述结构的4,6-双(1,1-二甲基乙氧基)-2-(6-正丙基-2-吡啶基)-5-三氟甲基嘧啶0.4g(0.9mmol)。收率为44%。
[0757]
[化学式98]
[0758][0759]
4,6-双(1,1-二甲基乙氧基)-2-(6-正丙基-2-吡啶基)-5-三氟甲基嘧啶的分析结果如下。
[0760]1h nmr(400mhz,cdcl3)δppm:8.08(d,j=8.0hz,1h),7.71(dd,j=7.6,7.6hz,1h),7.22(d,j=7.6hz,1h),2.86(t,j=7.0hz,2h),1.85-1.94(m,2h),1.70(s,18h),1.00(t,j=7.3hz,3h)
[0761]
apci-ms(m/z):411.9[m]
+
[0762]
同时,还得到4-(1,1-二甲基乙氧基)-6-甲氧基-2-(6-正丙基-2-吡啶基)-5-三氟甲基嘧啶0.04g(收率5%)。
[0763]
[化学式99]
[0764][0765]
4-(1,1-二甲基乙氧基)-6-甲氧基-2-(6-正丙基-2-吡啶基)-5-三氟甲基嘧啶的分析结果如下。
[0766]1h nmr(400mhz,cdcl3)δppm:8.14(d,j=7.6hz,1h),7.73(dd,j=7.6,7.6hz,1h),7.26-7.27(m,1h),4.17(s,3h),2.90(t,j=7.6hz,2h),1.87(tq,j=7.3,7.3hz,2h),1.71(s,9h),1.03(t,j=7.5hz,3h)
[0767]
apci-ms(m/z):369.9[m]
+
[0768]
(实施例59)
[0769]
《6-羟基-2-(6-正丙基-2-吡啶基)-5-(三氟甲基)-4(3h)-嘧啶酮的制造》
[0770]
将实施例58得到的4,6-双(1,1-二甲基乙氧基)-2-(6-正丙基-2-吡啶基)-5-三氟甲基吡啶0.4g(0.9mmol)溶解于二氯甲烷0.9ml中,加入三氟乙酸(tfa)0.9ml,在室温下搅拌3小时。然后,将反应液浓缩,用乙酸乙酯进行洗涤过滤,得到具有下述结构的6-羟基-2-(6-正丙基-2-吡啶基)-5-(三氟甲基)-4(3h)-嘧啶酮的粗纯化物0.4g。
[0771]
[化学式100]
[0772][0773]
分析结果如下所述。
[0774]1h nmr(400mhz,dmso-d6)δppm:12.6(br,2h),8.09(d,j=7.0hz,1h),7.99(dd,j=8.0,7.6hz,1h),7.58(d,j=7.0hz,1h),2.83(t,j=7.6hz,2h),1.79(tq,j=7.3,7.3hz,2h),0.94(t,j=7.3hz,3h)
[0775]
apci-ms(m/z):299.8[m]
+
[0776]
(实施例60)
[0777]
《4,6-二氯-2-(6-正丙基-2-吡啶基)-5-三氟甲基嘧啶的制造》
[0778]
将实施例59得到的6-羟基-2-(6-正丙基-2-吡啶基)-5-(三氟甲基)-4(3h)-嘧啶酮的粗纯化物0.4g溶解于甲苯1.8ml和pocl
3 0.4ml中,在加热回流条件下搅拌6小时。空气冷却至室温后,将反应液滴加至添加有碳酸氢钠的冰中,用乙酸乙酯萃取。然后,用硫酸钠进行干燥、过滤。再将滤液浓缩、柱纯化、具有下述结构的4,6-二氯-2-(6-正丙基-2-吡啶基)-5-三氟甲基嘧啶0.2g(0.7mmol)。收率在2个工序中为79%。
[0779]
[化学式101]
(6-正丙基-2-吡啶基)-5-三氟甲基嘧啶0.004g(0.01mmol)。收率在2个工序中为12%。
[0795]
[化学式103]
[0796][0797]
分析结果如下所述。
[0798]1h nmr(400mhz,cdcl3)δppm:8.25(d,j=7.6hz,1h),7.78(dd,j=8.0,7.6hz,2h),7.34(d,j=8.0hz,1h),4.25(s,3h),2.94(t,j=7.6hz,2h),1.84(tq,j=7.6,7.3hz,2h),1.03(t,j=7.3hz,3h)
[0799]
apci-ms(m/z):331.6[m]
+
[0800]
(实施例63)
[0801]
《6-氯-2-(4-吡啶基)-4-[(4-甲基苯基)硫代]-5-三氟甲基嘧啶的制造》
[0802]
将重复实施例11而得到的4,6-二氯-2-(4-吡啶基)-5-三氟甲基嘧啶0.16g(0.6mmol)溶解于thf 3.0ml中,加入三乙胺0.06g(0.6mmol)和对甲苯硫酚0.05g(0.4mmol),在室温下搅拌24.3小时。在反应液中加入水,用乙酸乙酯萃取,用硫酸钠干燥有机相。将干燥的有机相过滤,将滤液浓缩后进行柱纯化,得到具有下述结构的6-氯-2-(4-吡啶基)-4-[(4-甲基苯基)硫代]-5-三氟甲基嘧啶0.13g(0.3mmol)。收率为63%。
[0803]
[化学式104]
[0804][0805]
分析结果如下所述。
[0806]1h nmr(400mhz,cdcl3)δppm:8.63(dd,j=4.6,1.8hz,2h),7.70(dd,j=4.6,1.5hz,2h),7.45(d,j=8.3hz,2h),7.36(d,j=8.3hz,2h),2.51(s,3h)
[0807]
apci-ms(m/z):381.8[m]
+
[0808]
(实施例64)
[0809]
《6-氯-4-羟基-2-(2-吡啶基)-5-(三氟甲基)-嘧啶的制造》
[0810]
将实施例31得到的4,6-二氯-2-(2-吡啶基)-5-三氟甲基嘧啶0.05g(0.2mmol)溶解于1n naoh水溶液1.0ml中,在室温下搅拌2.3小时。将反应液用10%硫酸水溶液中和,将析出的结晶用水洗涤,得到具有下述结构的6-氯-4-羟基-2-(2-吡啶基)-5-(三氟甲基)-嘧啶0.02g(0.06mmol)。收率为39%。
[0811]
[化学式105]
[0812][0813]
分析结果如下所述。
[0814]1h nmr(400mhz,cdcl3)δppm:11.23(br,1h),8.72-8.73(m,1h),8.49(d,j=8.0hz,1h),7.98(ddd,j=8.0,7.6,1.5hz,1h),7.61(ddd,j=7.6,4.9,1.2hz,1h)
[0815]
apci-ms(m/z):275.5[m]
+
[0816]
(实施例65)
[0817]
《6-氯-2-(2-吡啶基)-5-(三氟甲基)-4-嘧啶胺的制造》
[0818]
将实施例31得到的4,6-二氯-2-(2-吡啶基)-5-三氟甲基吡啶0.05g(0.2mmol)溶解于thf 1.0ml中,加入三乙胺0.02g(0.2mmol)和2m氨甲醇溶液7滴,在室温下搅拌4小时。浓缩反应液,用二乙醚清洗析出的结晶,得到具有下述结构的6-氯-2-(2-吡啶基)-5-(三氟甲基)-4-嘧啶胺的粗纯化物。
[0819]
[化学式106]
[0820][0821]
分析结果如下所述。
[0822]1h nmr(400mhz,cdcl3)δppm:8.84-8.85(m,1h),8.50(d,j=8.0hz,1h),7.87(ddd,j=8.0,7.6,1.8hz,1h),7.45(ddd,j=7.3,4.9,0.9hz,1h),5.96(br,2h)
[0823]
apci-ms(m/z):274.6[m]
+
[0824]
(实施例66)
[0825]
《4-氯-6-乙氧基-2-(2-吡啶基)-5-三氟甲基嘧啶的制造》
[0826]
将实施例31得到的4,6-二氯-2-(2-吡啶基)-5-三氟甲基吡啶0.05g(0.2mmol)溶解于thf 1.7ml中,加入乙醇钠0.01g(0.2mmol),在0℃下搅拌1小时。向反应液中加入水,用乙酸乙酯萃取,用硫酸钠干燥有机相。将干燥的有机相过滤,将滤液浓缩后进行柱纯化,得到具有下述结构的4-氯-6-乙氧基-2-(2-吡啶基)-5-三氟甲基嘧啶的粗纯化物。
[0827]
[化学式107]
[0828][0829]
分析结果如下所述。
[0830]1h nmr(400mhz,cdcl3)δppm:8.87-8.88(m,1h),8.47(d,j=8.0hz,1h),7.86-7.90(m,1h),7.45-7.49(m,1h),4.73(q,j=7.0hz,2h),1.51(t,j=7.0hz,3h)
[0831]
apci-ms(m/z):303.5[m]
+
[0832]
(实施例67)
[0833]
《4,6-二乙氧基-2-(2-吡啶基)-5-三氟甲基嘧啶的制造》
[0834]
将实施例31得到的4,6-二氯-2-(2-吡啶基)-5-三氟甲基吡啶0.05g(0.2mmol)溶解于thf 1.7ml中,冷却至0℃后,加入乙醇钠乙醇溶液0.13g(0.3mmol),在室温下搅拌23小时。将反应液浓缩后进行柱纯化,得到具有下述结构的4,6-二乙氧基-2-(2-吡啶基)-5-三氟甲基嘧啶0.05g(0.2mmol)。收率为88%。
[0835]
[化学式108]
[0836][0837]
分析结果如下所述。
[0838]1h nmr(400mhz,cdcl3)δppm:8.84(m,1h),8.43(d,j=7.9hz,1h),7.85(ddd,j=8.0,7.6,1.8hz,1h),7.24(ddd,j=7.6,4.9,1.2hz,1h),4.68(q,j=7.0hz,4h),1.46(t,j=7.0hz,6h)
[0839]
apci-ms(m/z):313.7[m]
+
[0840]
(实施例68)
[0841]
《4,6-二苯氧基-2-(2-吡啶基)-5-三氟甲基嘧啶的制造》
[0842]
将苯酚0.03g(0.3mmol)溶解于thf 1.7ml中,加入乙醇钠0.01g(0.3mmol),在室温下搅拌30分钟。然后,冷却至0℃,加入实施例31得到的4,6-二氯-2-(2-吡啶基)-5-三氟甲基吡啶0.05g(0.2mmol),在室温下搅拌15.3小时。在反应液中加入水,用乙酸乙酯萃取,用硫酸钠干燥有机相。将干燥的有机相过滤,将滤液浓缩后进行柱纯化,得到具有下述结构的4,6-二苯氧基-2-(2-吡啶基)-5-三氟甲基嘧啶0.04g(0.10mmol)。收率为55%。
[0843]
[化学式109]
[0844][0845]
分析结果如下所述。
[0846]1h nmr(400mhz,cdcl3)δppm:8.63-8.64(m,1h),7.89(d,j=8.0hz,1h),7.64(ddd,j=7.6,7.6,1.5hz,1h),7.44-7.48(m,5h),7.29-7.31(m,6h)
[0847]
apci-ms(m/z):409.4[m]
+
[0848]
(实施例69)
[0849]
《6-甲氧基-4-甲基-2-(4-吡啶基)-5-三氟甲基嘧啶的制造》
[0850]
将4-氟-6-甲氧基-2-(4-吡啶基)-5-三氟甲基嘧啶0.10g(0.38mmol)溶解于thf 1.2ml中,加入1m甲基锂(约3~5%乙醚溶液)0.4ml,在0℃下搅拌22.8小时后,进一步加入1m甲基锂(约3~5%乙醚溶液)0.4ml,搅拌7.5小时。在反应液中加入饱和氯化铵水溶液,用乙酸乙酯萃取,用硫酸钠干燥有机相。将干燥的有机相过滤,将滤液浓缩后,进行柱纯化,得到具有下述结构的6-甲氧基-4-甲基-2-(4-吡啶基)-5-三氟甲基嘧啶0.003g(0.01mmol)。收率为3%。
[0851]
[化学式110]
[0852][0853]
分析结果如下所述。
[0854]1h nmr(400mhz,cdcl3)δppm:8.79(dd,j=4.3,1.5hz,2h),8.29(dd,j=4.6,1.5hz,2h),4.19(s,3h),2.73(q,j=2.8hz,3h)
[0855]
apci-ms(m/z):270.0[m+h]
+
[0856]
(实施例70)
[0857]
《6-甲氧基-2-(5-甲基-2-吡啶基)-4-[(4-甲基苯基)硫代]-5-三氟甲基嘧啶的制造》
[0858]
将对甲苯硫酚0.05g(0.4mmol)溶解于dmf 3.0ml中,加入氢化钠0.02g(0.6mmol),在室温下搅拌30分钟后,冷却至0℃,加入6-氟-4-甲氧基-2-(5-甲基-2-吡啶基)-5-三氟甲基吡啶0.1g(0.4mmol),在室温下搅拌20小时。在反应液中加入水,用乙酸乙酯萃取,用硫酸钠干燥有机相。将干燥的有机相过滤,将滤液浓缩后进行柱纯化,得到具有下述结构的6-甲氧基-2-(5-甲基-2-吡啶基)-4-[(4-甲基苯基)硫代]-5-三氟甲基嘧啶0.08g(0.2mmol)。收
率为57%。
[0859]
[化学式111]
[0860][0861]
分析结果如下所述。
[0862]1h nmr(400mhz,cdcl3)δppm:8.56(m,1h),7.46-7.49(m,3h),7.37-7.39(m,1h),7.29(d,j=8.0hz,2h),4.24(s,3h),2.47(s,3h),2.35(s,3h)
[0863]
apci-ms(m/z):391.9[m]
+
[0864]
(实施例71)
[0865]
《6-甲氧基-2-(5-甲基-2-吡啶基)-4-苯氧基-5-三氟甲基嘧啶的制造》
[0866]
将苯酚0.05g(0.5mmol)溶解于dmf 3.0ml中,加入氢化钠0.02g(0.6mmol),在室温下搅拌30分钟后,冷却至0℃,加入6-氟-4-甲氧基-2-(5-甲基-2-吡啶基)-5-三氟甲基吡啶0.10g(0.4mmol),在室温下搅拌21.2小时。在反应液中加入水,用乙酸乙酯萃取,用硫酸钠干燥有机相。将干燥的有机相过滤,将滤液浓缩后进行柱纯化,得到具有下述结构的6-甲氧基-2-(5-甲基-2-吡啶基)-4-苯氧基-5-三氟甲基嘧啶0.13g(0.4mmol)。收率为99%。
[0867]
[化学式112]
[0868][0869]
分析结果如下所述。
[0870]1h nmr(400mhz,cdcl3)δppm:8.59(m,1h),7.93(d,j=8.3hz,1h),7.51(dd,j=8.0,2.2hz,1h),7.42-7.46(m,2h),7.28-7.30(m,1h),7.22-7.23(m,2h),4.27(s,3h),2.37(s,3h)
[0871]
apci-ms(m/z):362.0[m+h]
+
[0872]
(实施例72)
[0873]
《6-甲氧基-n-(4-甲基苯基)-2-(5-甲基-2-吡啶基)-5-(三氟甲基)-4-嘧啶胺的制造》
[0874]
将对甲苯胺0.09g(0.8mmol)溶解于dmf 6.0ml中,加入氢化钠0.03g(0.9mmol),在
室温下搅拌30分钟后,冷却至0℃,加入6-氟-4-甲氧基-2-(5-甲基-2-吡啶基)-5-三氟甲基吡啶0.2g(0.7mmol),在室温下搅拌64小时。在反应液中加入水,用乙酸乙酯萃取,用硫酸钠干燥有机相。将干燥的有机相过滤,将滤液浓缩后进行柱纯化,得到具有下述结构的6-甲氧基-n-(4-甲基苯基)-2-(5-甲基-2-吡啶基)-5-(三氟甲基)-4-嘧啶胺0.07g(0.18mmol)。收率为26%。
[0875]
[化学式113]
[0876][0877]
分析结果如下所述。
[0878]1h nmr(400mhz,cdcl3)δppm:8.63(m,1h),8.20(d,j=8.0,1h),7.58-7.61(m,1h),7.49(d,j=8.3hz,2h),7.33(br,1h),7.20(d,j=8.3hz,2h),4.21(s,3h),2.41(s,3h),2.37(s,3h)
[0879]
apci-ms(m/z):374.8[m]
+
[0880]
(实施例73)
[0881]
《4,6-双(1,1-二甲基乙氧基)-5-三氟甲基-2-(2-三氟甲基-5-吡啶基)嘧啶的制造》
[0882]
将6-氟-4-甲氧基-2-(2-三氟-5-吡啶基)-5-三氟甲基吡啶0.6g(2.8mmol)溶解于thf 9.3ml中,加入叔丁醇钾0.8g(7.0mmol),在室温下搅拌21.5小时。将反应液浓缩后,加入饱和氯化铵水溶液,用乙酸乙酯萃取,用硫酸钠干燥、过滤、浓缩,进行柱纯化,得到具有下述结构的4,6-双(1,1-二甲基乙氧基)-5-三氟甲基-2-(2-三氟甲基-5-吡啶基)嘧啶0.2g(0.5mmol)。收率为19%。
[0883]
[化学式114]
[0884][0885]
分析结果如下所述。
[0886]1h nmr(400mhz,cdcl3)δppm:9.66(d,j=1.8hz,1h),8.70-8.23(m,1h),7.82(dd,j
=8.0,0.6hz,1h),1.70(s,18h)
[0887]
apci-ms(m/z):437.8[m]
+
[0888]
(实施例74)
[0889]
《6-羟基-2-5-(三氟甲基)-(2-三氟甲基-5-吡啶基)-4(3h)-嘧啶酮的制造》
[0890]
将实施例73得到的4,6-双(1,1-二甲基乙氧基)-5-三氟甲基-2-(2-三氟甲基-5-吡啶基)嘧啶0.2g(0.5mmol)溶解于二氯甲烷0.5ml中,加入tfa0.5ml,在室温下搅拌3.7小时。然后,浓缩反应液,用乙酸乙酯进行洗涤过滤,得到具有下述结构的6-羟基-2-5-(三氟甲基)-(2-三氟甲基-5-吡啶基)-4(3h)-嘧啶酮的粗纯化物0.2g。
[0891]
[化学式115]
[0892][0893]
分析结果如下所述。
[0894]1h nmr(400mhz,dmso-d6)δppm:13.3(br,2h),9.32(d,j=1.2hz,1h),8.65(dd,j=8.3,2.1hz,1h),8.16(d,j=8.3hz,1h)
[0895]
apci-ms(m/z):325.8[m]
+
[0896]
(实施例75)
[0897]
《4,6-双(1,1-二甲基乙氧基)-2-(5-甲基-2-吡啶基)-5-三氟甲基嘧啶和4-(1,1-二甲基乙氧基)-6-甲氧基-2-(5-甲基-2-吡啶基)-5-三氟甲基嘧啶的制造》
[0898]
将6-氟-4-甲氧基-2-(5-甲基-2-吡啶基)-5-三氟甲基吡啶1.0g(3.4mmol)溶解于thf 11.6ml中,加入叔丁醇钾1.0g(8.7mmol),在室温下搅拌21.3小时。将反应液浓缩后,加入饱和氯化铵水溶液,用乙酸乙酯萃取,用硫酸钠干燥、过滤、浓缩,进行柱纯化,得到具有下述结构的4,6-双(1,1-二甲基乙氧基)-2-(5-甲基-2-吡啶基)-5-三氟甲基嘧啶0.3g(0.9mmol)。收率为25%。
[0899]
[化学式116]
[0900]
[0901]
4,6-双(1,1-二甲基乙氧基)-2-(5-甲基-2-吡啶基)-5-三氟甲基嘧啶的分析结果如下所述。
[0902]1h nmr(400mhz,cdcl3)δppm:8.62-8.63(m,1h),8.18(d,j=8.3,1h),7.61(ddd,j=8.0,2.1,0.6hz,1h),2.41(s,3h),1.70(s,18h)
[0903]
apci-ms(m/z):383.8[m]
+
[0904]
同时,还得到4-(1,1-二甲基乙氧基)-6-甲氧基-2-(5-甲基-2-吡啶基)-5-三氟甲基嘧啶0.2g(收率13%)。
[0905]
[化学式117]
[0906][0907]
4-(1,1-二甲基乙氧基)-6-甲氧基-2-(5-甲基-2-吡啶基)-5-三氟甲基嘧啶的分析结果如下所述。
[0908]1h nmr(400mhz,cdcl3)δppm:8.66(d,j=2.1hz,1h),8.25(d,j=8.0hz,1h),7.64(ddd,j=8.0,2.1,0.6hz,1h),4.19(s,3h),2.43(s,3h),1.70(s,9h)
[0909]
apci-ms(m/z):341.8[m]
+
[0910]
(实施例76)
[0911]
《6-羟基-2-(5-甲基-2-吡啶基)-5-(三氟甲基)-4(3h)-嘧啶酮的制造》
[0912]
将实施例75得到的4,6-双(1,1-二甲基乙氧基)-2-(5-甲基-2-吡啶基)-5-三氟甲基嘧啶0.3g(0.8mmol)溶解于二氯甲烷1.0ml中,加入tfa 1.0ml,在室温下搅拌17.4小时。然后,将反应液浓缩,用乙酸乙酯进行洗涤过滤,得到具有下述结构的6-羟基-2-(5-甲基-2-吡啶基)-5-(三氟甲基)-4(3h)-嘧啶酮的粗纯化物0.3g。
[0913]
[化学式118]
[0914][0915]
分析结果如下所述。
[0916]1h nmr(400mhz,dmso-d6)δppm:12.7(br,2h),8.63(m,1h),8.17(d,j=8.3hz,1h),7.91(ddd,j=8.0,2.1,0.6hz,1h),2.43(s,3h)
[0917]
apci-ms(m/z):371.9[m]
+
[0918]
(实施例77)
[0919]
《4,6-二氯-2-(5-甲基-2-吡啶基)-5-三氟甲基嘧啶的制造》
[0920]
将实施例76得到的6-羟基-2-(5-甲基-2-吡啶基)-5-(三氟甲基)-4(3h)-嘧啶酮的粗纯化物0.3g溶解于甲苯1.7ml、pocl
3 0.4ml,在加热回流条件下搅拌6小时。空气冷却至室温后,将反应液滴加至添加有碳酸氢钠的冰中,用乙酸乙酯萃取。用硫酸钠干燥后,进行过滤。将滤液浓缩、柱纯化,得到具有下述结构的4,6-二氯-2-(5-甲基-2-吡啶基)-5-三氟甲基嘧啶0.2g(0.6mmol)。收率在2个工序中为73%。
[0921]
[化学式119]
[0922][0923]
分析结果如下所述。
[0924]1h nmr(400mhz,cdcl3)δppm:8.73(m,1h),8.46(d,j=8.0hz,1h),7.71(ddd,j=8.0,2.5,0.9hz,1h),2.47(s,3h)
[0925]
apci-ms(m/z):307.8[m]
+
[0926]
(实施例78)
[0927]
《6-甲氧基-2-(5-甲基-2-吡啶基)-5-(三氟甲基)-4(3h)-嘧啶酮的制造》
[0928]
将实施例75得到的4-(1,1-二甲基乙氧基)-6-甲氧基-2-(5-甲基-2-吡啶基)-5-三氟甲基嘧啶0.2g(0.5mmol)溶解于二氯甲烷2.0ml,加入tfa1.0ml,在室温下搅拌12.8小时。然后,将反应液浓缩,用乙酸乙酯进行洗涤过滤,得到具有下述结构的6-甲氧基-2-(5-甲基-2-吡啶基)-5-(三氟甲基)-4(3h)-嘧啶酮的粗纯化物0.2g。
[0929]
[化学式120]
[0930][0931]
分析结果如下所述。
[0932]1h nmr(400mhz,dmso-d6)δppm:12.6(br,1h),8.64(m,1h),8.33(d,j=8.0hz,1h),7.93(ddd,j=8.0,2.1,0.9hz,1h),4.11(s,3h),2.44(s,3h)
[0933]
apci-ms(m/z):285.9[m]
+
[0934]
(实施例79)
[0935]
《4-氯-6-甲氧基-2-(5-甲基-2-吡啶基)-5-三氟甲基嘧啶的制造》
[0936]
将实施例78得到的6-甲氧基-2-(5-甲基-2-吡啶基)-5-(三氟甲基)-4(3h)-嘧啶酮的粗纯化物0.2g溶解于甲苯1.0ml、pocl
3 0.2ml中,在加热回流条件下搅拌6小时。空气冷却至室温后,将反应液滴加至添加有碳酸氢钠的冰中,用乙酸乙酯萃取。用硫酸钠干燥后,进行过滤。滤液浓缩、柱纯化,得到具有下述结构的4-氯-6-甲氧基-2-(5-甲基-2-吡啶基)-5-三氟甲基嘧啶0.02g(0.06mmol)。收率在2个工序中为12%。
[0937]
[化学式121]
[0938][0939]
分析结果如下所述。
[0940]1h nmr(400mhz,cdcl3)δppm:8.70(d,j=2.1hz,1h),8.39(d,j=8.3hz,1h),7.68(d,j=8.0,2.1,0.6hz,1h),4.25(s,3h),2.45(s,3h)
[0941]
apci-ms(m/z):303.8[m]
+
[0942]
(实施例80)
[0943]
《6-氯-4-苯氧基-2-(-2-吡啶基)-5-三氟甲基嘧啶的制造》
[0944]
将苯酚0.01g(0.1mmol)溶解于dmf 1.0ml中,加入氢化钠0.006g(0.2mmol),在室温下搅拌30分钟。然后,冷却至0℃,加入溶解于dmf 2ml中的4,6-二氯-2-(2-吡啶基)-5-三氟甲基吡啶0.04g(0.1mmol),在室温下搅拌16.7小时。在反应液中加入水,用乙酸乙酯萃取,用硫酸钠干燥有机相。将干燥的有机相过滤,将滤液浓缩后进行柱纯化,得到具有下述结构的6-氯-4-苯氧基-2-(-2-吡啶基)-5-三氟甲基嘧啶的粗纯化物0.03g。
[0945]
[化学式122]
[0946][0947]
分析结果如下所述。
[0948]
apci-ms(m/z):351.8[m]
+
[0949]
(实施例81)
[0950]
《6-氯-4-甲基-2-(-2-吡啶基)-5-三氟甲基嘧啶的制造》
[0951]
将4,6-二氯-2-(2-吡啶基)-5-三氟甲基吡啶0.1g(0.3mmol)溶解于thf1.2ml中,加入约3-5%甲基锂0.4ml,在0℃下搅拌29.2小时。在反应液中加入饱和氯化铵水溶液,用乙酸乙酯萃取,用硫酸钠干燥有机相。将干燥的有机相过滤,将滤液浓缩后进行柱纯化,得到具有下述结构的6-氯-4-甲基-2-(-2-吡啶基)-5-三氟甲基嘧啶的粗纯化物0.008g。
[0952]
[化学式123]
[0953][0954]
apci-ms(m/z):273.8[m]
+
[0955]
(实施例82)
[0956]
《6-氯-n-(4-甲基苯基)-2-(6-正丙基-2-吡啶基)-5-(三氟甲基)-4-嘧啶胺的制造》
[0957]
将对甲苯胺0.04g(0.3mmol)溶解于dmf 3.0ml中,加入氢化钠0.02g(0.2mmol),在室温下搅拌30分钟后,冷却至0℃,加入实施例60得到的4,6-二氯-2-(6-正丙基-2-吡啶基)-5-三氟甲基吡啶0.1g(0.3mmol),在室温下搅拌15.8小时。在反应混合物中加入水,用乙酸乙酯萃取,用硫酸钠干燥有机相。将干燥的有机相过滤,浓缩滤液后进行柱纯化,得到具有下述结构的6-氯-n-(4-甲基苯基)-2-(6-正丙基-2-吡啶基)-5-(三氟甲基)-4-嘧啶胺0.09g(0.2mmol)。收率为26%。
[0958]
[化学式124]
[0959][0960]
分析结果如下所述。
[0961]1h nmr(400mhz,cdcl3)δppm:8.11(dd,j=8.0,0.9hz,1h),7.71(dd,j=8.0,7.6hz,1h),7.59(d,j=8.3hz,2h),7.53(br,1h),7.28(dd,j=7.6,0.9hz,1h),7.22(d,j=8.0hz,2h),2.92(t,j=8.1hz,2h),2.38(s,3h),1.88(tq,j=7.6,7.3hz,2h),1.03(t,j=7.3hz,3h)
[0962]
apci-ms(m/z):406.9[m]
+
[0963]
(对黄瓜白粉病的评价试验)
[0964]
将实施例32和36中制作的各含氟嘧啶化合物溶解于丙酮中,稀释至500ppm的浓度。接着,在稀释后的丙酮溶液中加入黄瓜叶叶盘(直径20mm)使其完全润湿后,以黄瓜叶叶
盘的背面与另外制作的素琼脂培养基接触的方式设置黄瓜叶叶盘,使其风干。风干后,将黄瓜白粉病的孢子悬浮液均匀地散布于黄瓜叶叶盘,使其风干。然后,将黄瓜叶叶盘静置在恒温器内(25℃,照明12小时),14天后调查病斑面积,计算出防除值。将其结果示于表1。另外,防除值按照下述式计算出。在下述式中,“无处理”表示作为被测液仅用丙酮润湿了黄瓜叶叶盘,“无处理区”表示其分区。
[0965]
[表1]
[0966]
试验化合物防除值实施例3257.1实施例3667.9
[0967]
[数学式1]
[0968]
防除值={(无处理区发病面积平均值-处理区发病面积平均值)/无处理区发病面积平均值}
×
100
[0969]
如表1所示,可知本发明中的含氟嘧啶化合物对黄瓜白粉病的病原菌显示出除菌效果,作为显示出生物活性的化合物、特别作为杀菌剂是有效的。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1