直接连接到纳米间隙装置的酶突变体的制作方法
直接连接到纳米间隙装置的酶突变体
1.交叉引用
2.本技术要求于2020年3月25日提交的美国临时专利申请号62/994,712的权益,该申请的全部内容通过引用并入本文。
技术领域
3.本发明涉及用于传感和测序生物分子的纳米装置。更具体地,本发明提供了用于构建蛋白质桥接纳米间隙装置的装置、方法和物质组合物。
背景技术:
4.当将单个蛋白质分子连接到相隔几纳米的两个电极时,可以测量其电导率。使用扫描隧道显微镜(stm)通过使用识别其各自同源蛋白的配体或抗原对其金属尖端和金属基材进行功能化,已经实现了这种布置。此外,上述stm装置可以感应酶的生化反应,例如来自电阻脉冲的φ29dna聚合酶。这些科学发现有力地表明了开发一种通过测量电信号来检测酶的构象运动的电子技术的可能性。然而,电极和蛋白质之间的共价连接比起非共价连接能够提供更稳定的接触,进而提供改善的电流。
5.附图简要说明
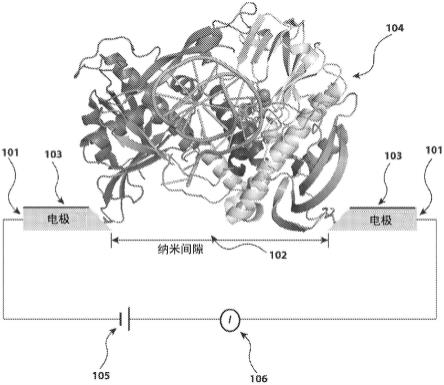
6.图1说明了一种用于监测酶活性的电子纳米装置。
7.图2显示了φ29dna聚合酶(pdb#1xhx)的晶体结构,并标出了其结构性区域和半胱氨酸残基。
8.图3说明了本发明中野生型φ29dna聚合酶中的突变位点,其基于与引物-模板dna和进入的核苷酸底物(pdb#:2pyl)复合的φ29dna聚合酶的晶体结构。
9.图4显示了制造纳米间隙的过程。
10.图5显示了制造垂直纳米间隙阵列的过程。
11.图6显示了本发明中φ29dna聚合酶的半胱氨酸突变体的结构,其基于与引物-模板dna和进入的核苷酸底物(pdb#:2pyl)复合的φ29dna聚合酶的晶体结构。
12.图7显示了本发明中φ29dna聚合酶的硒代半胱氨酸突变体的结构,其基于与引物-模板dna和进入的核苷酸底物(pdb#:2pyl)复合的φ29dna聚合酶的晶体结构。
13.图8显示了本发明中φ29dna聚合酶的4-(叠氮甲基)-l-苯丙氨酸突变体的结构,其基于与引物-模板dna和进入的核苷酸底物(pdb#:2pyl)复合的φ29dna聚合酶的晶体结构。
14.图9a和9b说明了(a)4-(叠氮甲基)-l-苯丙氨酸突变体中的叠氮化物与涂覆在电极上的单层中的三苯膦酯的反应;(b)通过形成酰胺键将蛋白质与电极直接连接以桥接纳米间隙。
15.图10显示了使用热化学纳米光刻术(tcnl)制造纳米间隙的过程。
技术实现要素:
16.本发明提供一种直接监测酶活性以检测生物分子的电子设备。如图1所示,所述装置包括具有两个电极(101)的电路,两个电极(101)相隔数纳米以形成纳米间隙(102)。每个电极除了其楔形端外都用介电层(103)钝化。酶(104)是其野生型的突变体,其被直接共价连接到电极上,以桥接纳米间隙。与上述非共价接触相比,共价连接降低了欧姆电阻。酶的活性可以通过在偏压(106)下用电信号记录装置(105)记录电信号来监测。
17.本发明还提供了一种酶突变体,其具有两个突变位点以带有用于连接到电极而不影响其天然功能的官能团。酶可以是dna聚合酶、rna聚合酶、dna解旋酶、dna连接酶、dna核酸外切酶、逆转录酶、rna引发酶、核糖体、蔗糖酶、乳糖酶,其为天然的、突变的或合成的,及其组合。酶也可以被天然的、突变的或合成的受体、配体、抗原和抗体等替代。选择噬菌体φ29dna聚合酶作为例子来证明本公开中提出的本发明的优点和新颖性。一般来说,同样的原理也适用于其他酶。φ29dna聚合酶是一种具有高加工能力和链置换能力以高效合成dna的酶。3由于其高核苷酸插入识别值(10
4-106)5和3'至5'核酸外切酶活性以校正聚合错误,它比其它聚合酶4具有更高的保真性。
6,7
所有这些都归因于其结构的独特性。基于其晶体结构,8φ29dna聚合酶包含五个结构亚结构域——分别为核酸外切酶、tpr1和trp2、掌、拇指、指(图2)。掌、拇指和其他指可以类似于半张开的右手。在蛋白质引发的dna聚合酶亚组中也特定地存在两个插入,称为末端蛋白质区域1(tpr1)和2(tpr2)。tpr1亚结构域参与末端蛋白质(tp)的相互作用,以供蛋白质引发的起始。tpr2、拇指和掌亚结构域形成内部环状结构,其围绕聚合活性位点处的上游双链dna,为酶提供其固有的高加工能力。tpr2、掌和指亚结构域和核酸外切酶结构域一起形成了包裹下游模板链的通道。该通道的狭窄尺寸阻止了dsdna结合,迫使两条链解链以允许模板到达活性位点并为聚合酶提供链置换能力。众所周知,半胱氨酸的硫醇侧链能与金属表面发生反应。φ29dna聚合酶有7个半胱氨酸残基,但它们位于蛋白质内部(如图2所示),这阻止它们与金属电极有效反应。在本发明中,φ29dna聚合酶突变体在核酸外切酶和tpr1结构域的环中包含两个氨基酸突变(位点301和302,图3)。该突变不会影响酶的生化功能,并且两个突变位点相隔一段距离,能够桥接所述纳米间隙。
18.本发明提供了一种用于感应和测序生物分子的纳米装置,所述生物分子例如核酸、蛋白质、多糖,但不限于它们,其为天然的、合成的或修饰的,及其组合。
具体实施方式
19.在一个实施方式中,本发明提供了一种由两个纳米电极形成的纳米间隙,所述两个纳米电极相隔3nm至20nm的距离。这两个电极的末端在它们的纳米间隙侧是楔形的,并且它们的顶面被介电层和/或单层化学钝化分子覆盖。制造纳米间隙的过程如图4所示,并在方法1中详细描述。
20.在另一个实施方式中,本发明提供了通过介电层与单个底部电极垂直分离的电极阵列(图5)。这种类型的形式允许更高的纳米间隙包装密度。此外,所有顶部电极都具有相同的电极性,这提供了防止带电分子在顶部电极之间横向接触交联的方法。顶部电极之间的横向距离与垂直间隙尺寸相当或更大,从几纳米(nm)到微米(um)和毫米(mm),基本上没有上限。
21.在一些实施方式中,用于桥接纳米间隙的蛋白质是野生型φ29dna聚合酶的c至x
突变体,其具有2至7个半胱氨酸(含端点),且是突变的。聚合酶工程改造过程在方法3中进行了描述。如表1所示,具有c22a和c290a(m-2)以及c22a、c290a和c455v(m-4)的突变体具有与野生型相同的活性。与野生型相比,其他突变体的活性较低。
22.表1.φ29dna聚合酶的半胱氨酸诱变
[0023][0024][0025]
在一些实施方式中,用于桥接纳米间隙的蛋白质是具有g111c和v276c突变的野生型φ29dna聚合酶的突变体(图6)。新引入的半胱氨酸位于蛋白质的环上,相隔约6.4nm。与天然半胱氨酸相比,它们可以更快地可及。两个经工程改造的半胱氨酸的硫醇基分别与金属电极反应以共价桥接纳米间隙。
[0026]
在一些实施方式中,金属表面被ω-巯基peg(sr-1,如下所示)钝化以防止酶附接后在电极上的非特异性吸附:
[0027][0028]
在一些实施方式中,蛋白质是具有g111u和v276u突变的野生型φ29dna聚合酶的突变体(u是硒代半胱氨酸)。与类似sam中的s-au键相比,se-au键更稳定,尽管两者具有相似的电荷载流子隧穿的总概率。9硒代半胱氨酸的pka为约5.2,这意味着它的侧链硒醇在生理ph下被去质子化。
10
[0029]
在一个实施方式中,本发明提供了一种合成化学试剂(cr-1)以在金属电极上形成单层的方法(方案1,详见方法4)。cr-1的三苯基膦酰酯与叠氮基官能团反应形成酰胺键。
11
[0030]
在另一个实施方式中,本发明提供了一种合成化学试剂(cr-2)的方法,该方法与方法4中描述的用于在金属电极上形成单层(方案2)的方法相似。cr-2的三苯基膦酰酯与叠
氮基官能团反应形成酰胺键。
[0031]
方案1
[0032][0033]
方案2
[0034][0035]
在一些实施方式中,电极的表面被单层cr-1、cr-2或sr-1与cr-1或cr-2的混合物覆盖。本发明提供了一种形成所述单层的方法(方法5)。
[0036]
在一个实施方式中,本发明提供了一种g111x和v276x(x是4-(叠氮甲基)-l-苯丙氨酸)突变的φ29dna聚合酶(图8),用于桥接所述纳米间隙。通过方法6中描述的方法表达突变蛋白。
[0037]
在一些实施方式中,本发明提供了一种将叠氮基突变体连接到涂有cr-1或cr-2的电极上的方法,用于通过施陶丁格反应(staudinger reaction)桥接纳米间隙。如图9a所示,叠氮化物与三苯基膦酯通过无痕施陶丁格反应形成如图9b所示的酰胺键,从而将蛋白质连接到电极。
[0038]
在另一个实施方式中,无关蛋白质(非限制性实例包括来自酿酒酵母(saccharomyces cerevisiae)的smt3和来自日本血吸虫(schistosoma japonicum)的谷胱甘肽-s-转移酶)遗传插入在φ29dna聚合酶的两个二级结构元件之间(包括但不限于残基
k110和g111、k150和e151,以及y156和k157)。这种保留催化活性的蛋白质可以与上述实施方式结合使用以桥接拉长的间隙,该间隙对于野生型φ29dna聚合酶来说将会过宽。
[0039]
在另一个实施方式中,将无关蛋白质(非限制性实例包括来自酿酒酵母的smt3和来自日本血吸虫的谷胱甘肽-s-转移酶)插入到φ29dna聚合酶n端并通过刚性肽连接(一个非限制性实例是papap序列)。这种保留催化活性的蛋白质可以与上述实施方式结合使用以弥合拉长的间隙,该间隙对于野生型φ29dna聚合酶来说将会过宽。
[0040]
在一个实施方式中,本发明使用热化学纳米光刻术(tcnl)
12、13
在导电层上提供单个纳米间隙或多个纳米间隙,参见方法7。
[0041]
方法
[0042]
方法1与图4中描述的工作流程相关,按照以下程序产生所述纳米间隙。
[0043]
p1:制备半导体或绝缘(玻璃)基材(401)。
[0044]
p2:通过化学气相沉积(cvd)、原子层沉积(ald)、物理气相沉积(pvd)、分子气相沉积(mvd)、电镀或旋涂,沉积sin
x
、sio
x
或其他电介质材料的绝缘层(402)。优选的方法是等离子体增强cvd(pecvd)或低压cvd(lpcvd)。
[0045]
p3:通过化学气相沉积(cvd)、原子层沉积(ald)、物理气相沉积(pvd)、分子气相沉积(mvd)、电镀或旋涂,沉积另一个sin
x
、sio
x
或任何电介质材料的绝缘层(403)。优选的方法是等离子体增强cvd(pecvd)或低压cvd(lpcvd)。
[0046]
p4:以10,000~500,000uc/cm2的剂量进行ebl电极线图案化工艺,然后以光刻胶(404)为掩模进行光刻。
[0047]
p5:使用rie或ibe进行线蚀刻(line etching),然后是反应离子蚀刻(rie)或离子束蚀刻(ibe),在绝缘层402上停止,或几乎不过蚀,然后去除光刻胶掩膜。
[0048]
p6:沉积导电材料的电极层(405),例如au、pt、pd、w、ti、ta、tinx、tanx、al、ag或其他金属复合材料,和/或半导体中使用的常见hk/mg材料。它也可以是两层或更多层的组合,以提供良好的附着力和电/化学性能。其可以通过p2中提到的方法制备,最优选的方法是ald。p7:进行化学机械抛光工艺,然后进行平面化(cmp)。
[0049]
p8:完成cmp润色
[0050]
p9:通过化学气相沉积(cvd)、原子层沉积(ald)、物理气相沉积(pvd)、分子气相沉积(mvd)、电镀或旋涂等来沉积sin
x
、sio
x
、al
x
oy、hfo
x
或其他介电材料的介电层(406)。优选的方法是ald。
[0051]
p10:使用ebl,剂量为10,000~500,000uc/cm2,进行电极间隙图案化工艺,然后进行光刻。
[0052]
p11:执行使用rie或ibe的间隙蚀刻工艺,在绝缘层402上停止或几乎无过蚀。
[0053]
p12:剥离(strip)光刻胶。
[0054]
p13:升离(lift-off)互连体和焊盘图案结构,然后删除。
[0055]
方法2与图5中描述的工作流程有关,按照以下程序产生所述纳米间隙的阵列。
[0056]
p1:制备半导体或绝缘(玻璃)基材(501)。
[0057]
p2:通过化学气相沉积(cvd)、原子层沉积(ald)、物理气相沉积(pvd)、分子气相沉积(mvd)、电镀或旋涂沉积sin
x
、sio
x
、al
x
oy、hfo
x
或其他介电材料的绝缘层(502)。优选的方法是等离子体增强cvd(pecvd)或低压cvd(lpcvd)。
[0058]
p3和p4:沉积常见金属导电材料的底部电极层(503),所述常见金属导电材料例如au、pt、pd、w、ti、ta、tin
x
、tan
x
、al、ag、其他金属、金属复合材料和/或,p2中提到方法的半导体行业常用的hk/mg材料。优选的方法是ald。此外,可以通过线图案化方法(ebl、euv、duv、接触掩模)对电极层进行图案化以使其具有大于1nm的电极宽度。
[0059]
p5:通过cvd、ald、pvd、mvd、电镀或旋涂(504)沉积介电层(504)以用作sin
x
、sio
x
、al
x
oy、hfo
x
或其他介电材料的纳米间隙。优选的方法是ald。间隙大小通常与蛋白质分子的直径相当。
[0060]
p6和p7:制造包括导电材料、au、pt、pd、w、ti、ta、tin
x
、tan
x
、al、ag、其他金属、金属复合材料和/或普通hk/mg的顶部电极阵列(505)半导体工业中使用的材料,按p2中提到的方法。优选的方法是ald。电极阵列的制造使用线图案化
‑‑
ebl、euv、duv或接触掩模和蚀刻方法进行。每个电极的宽度和厚度均大于1nm。
[0061]
p8:通过cvd、ald、pvd、mvd、电镀或旋涂沉积sin
x
、sio
x
、al
x
oy、hfo
x
或其他介电材料的端介电层。优选的方法是ald。
[0062]
方法3:使用携带φ29dna聚合酶基因的质粒作为模板,通过定点诱变
14
将半胱氨酸残基的密码子突变为其他残基(包括但不限于丙氨酸、缬氨酸、丝氨酸、甘氨酸和亮氨酸)。所有突变均通过双脱氧(桑格)(sanger)测序验证。将含有所需突变基因的质粒转化进bl-21(de3)细胞。使液体培养物生长,并用iptg诱导蛋白质的表达。在30℃下生长3h后,收获细胞,裂解,重组蛋白通过ni-nta色谱法纯化。使用肝素柱进一步纯化蛋白质。蛋白质储存在-80℃以备后用。含有显示足够表达和催化活性的蛋白质突变体的基因的质粒被用作进一步轮次定点诱变的模板。
[0063]
方法4:向4-(乙酰基硫代)苯甲酸的无水dmf溶液中加入1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(edc)和催化量的二甲基氨基吡啶(dmap)。将溶液在0℃搅拌30分钟,然后加入(2-羟基苯基)二苯基氧化膦的无水dmf溶液并搅拌过夜。然后,通过旋转蒸发除去溶剂,并通过使用二氯甲烷中的5%甲醇的快速柱色谱法纯化残余物,得到所需产物。
[0064]
方法5:首先用吡咯烷处理cr-1或cr-2的乙醇溶液一小时以在氮气下除去乙酰基保护基团。然后,将溶液添加至纳米间隙基板并孵育一小时,接着用乙醇冲洗基材。
[0065]
方法6:使用携带φ29dna聚合酶基因的质粒作为模板,通过定点诱变
14
将φ29dna聚合酶的特定位置(包括但不限于33、111、276和369)的密码子突变为tag.所有突变均通过双脱氧(桑格)(sanger)测序验证。含有所需突变基因的质粒与pevol-pazf15共同转化进bl-21(de3)细胞。液体培养物生长,并用iptg和阿拉伯糖诱导蛋白质的表达。如方法3所述,进行进一步的生长和蛋白质表达。
[0066]
方法7与图10中描述的工作流程相关,以使用热化学纳米光刻术(tcnl)生产纳米传感器。
[0067]
p1:制备半导体或绝缘(如玻璃)基材(1001)。
[0068]
p2:通过化学气相沉积(cvd)、原子层沉积(ald)、物理气相沉积(pvd)、分子气相沉积(mvd)、电镀或旋涂沉积sinx、siox、alxoy、hfox或其他介电材料的绝缘层(1002)。优选的方法是等离子体增强cvd(pecvd)或低压cvd(lpcvd)。
[0069]
p3:沉积常见金属导电材料的底部电极层(1003),例如au、pt、pd、w、ti、ta、tinx、tanx、al、ag、其他金属、金属复合材料和/或方法2中提到的常见的半导体行业使用的hk/mg
材料。优选的方法是ald。
[0070]
p4:通过线图案化方法(ebl、euv、duv、接触掩模)对电极层(1003)进行图案化,然后将电极蚀刻得更大以形成具有预定宽度的间隙。
[0071]
p5:旋涂保护盖层(1004),该保护盖层(1004)是温度响应性的(与tcnl兼容),例如但不限于聚苯二醛聚合物(ppa)。
[0072]
p6-1:热化学方法去除预定体积的盖层(1004),暴露出所需的单对电极(1003)区域。
[0073]
p6-2:热化学方法去除预定体积的盖层(1004),暴露多对电极(1003)的多个区域。
[0074]
以下是本发明的一些可要求保护的关键点:
[0075]
1.一种用于生物聚合物的鉴定、表征或测序的系统,其包括,
[0076]
(a)由第一电极和第二电极形成的纳米间隙,所述第一电极和第二电极由3nm至20nm距离隔开(平面纳米间隙)或由厚度在2nm至20nm之间的介电质绝缘层隔开(垂直纳米间隙);
[0077]
(b)一种蛋白质突变体,其具有两个官能团,所述两个官能团由与纳米间隙尺寸相当或更大的距离隔开,以供所述纳米间隙通过以下方式被桥接:第一官能团与第一电极共价反应,且第二官能团与第二电极共价反应;
[0078]
(c)施加在第一电极和第二电极之间的偏压;
[0079]
(d)能记录所述蛋白质在其进行化学反应时产生的电信号的装置;以及
[0080]
(e)用于数据分析的软件。
[0081]
2.一种监测酶活性的方法:
[0082]
(a)提供由间隔3nm至20nm距离的第一电极和第二电极形成的纳米间隙(平面纳米间隙)或由厚度在2nm至20nm之间的介电质绝缘层形成的纳米间隙(垂直纳米间隙);
[0083]
(b)提供一种酶突变体,该酶突变体具有来自天然或非天然氨基酸侧链的至少两个官能团,其由相当于或大于用于连接到电极的纳米间隙尺寸的距离隔开;
[0084]
(c)通过使酶通过第一官能团与第一电极反应,并且第二官能团与第二电极共价反应来桥接所述纳米间隙;
[0085]
(d)在所述第一电极和第二电极之间施加偏压;
[0086]
(e)记录酶与其底物反应产生的电信号;以及
[0087]
(f)提供软件用于数据分析。
[0088]
3.一种识别、表征或测序生物聚合物的方法:
[0089]
(a)提供由间隔3nm至20nm距离的第一电极和第二电极形成的纳米间隙(平面纳米间隙)或由厚度在2nm至20nm之间的介电质绝缘层形成的纳米间隙(垂直纳米间隙);
[0090]
(b)提供一种聚合酶突变体,该聚合酶突变体具有来自天然或非天然氨基酸侧链的至少两个官能团,其间距相当于或大于用于连接到电极的纳米间隙尺寸;
[0091]
将酶的第一官能团共价连接第一电极,并且将第二官能团共价连接到第二电极反应来桥接所述纳米间隙;
[0092]
在所述第一电极和第二电极之间施加偏压;
[0093]
记录酶与其底物反应产生的电信号;以及
[0094]
提供软件用于数据分析。
[0095]
4.一种使用热化学纳米光刻术(tcnl)制造纳米间隙和纳米间隙阵列的方法。
[0096]
5.一种在电极表面形成单分子层以防止生物分子非特异性吸附的方法。
[0097]
6.一种合成化学试剂cr-1和cr-2以形成混合单分子层的方法。
[0098]
7.一种通过cr-1或cr-2与蛋白质突变体的反应通过形成酰胺键来桥接所述纳米间隙的方法。
[0099]
一般性说明:除非另有定义,本文提及的所有技术出版物、专利和其他文件均通过引用整体并入,本文使用的科学术语与本发明所属领域的普通技术人员通常理解的含义相同。虽然通过本发明实施方式介绍本发明,并且相当详细地描述了这些实施方式,但它们不应局限或以任何方式限制所附权利要求书的范围。本领域的技术人员将容易地明白另外的优点和修改。因此,本发明在其更广泛的方面不限于所示和描述的具体细节、代表性装置、设备和方法以及说明性示例。因此,背离这些细节并不一定背离本发明的精神。
[0100]
引用的参考文献
[0101]
1.zhang,b.;song,w.;pang,p.;lai,h.;chen,q.;zhang,p.;lindsay,s.,接触在长距离蛋白质传导中的作用(role of contacts in long-range protein conductance).pnas 2019,116,5886
–
5891.
[0102]
2.zhang,b.;deng,h.;mukherjee,s.;song,w.;wang,x.;lindsay,s.,设计一种用于直接电监测活动的酶(engineering an enzyme for direct electrical monitoring of activity).acs nano 2019,14,1360-1368
[0103]
3.blanco,l.;bernad,a.;lharo,j.m.;martin,g.;garmendia,c.;salasn,m.,φ29dna聚合酶高效的dna合成(highly efficient dna synthesis by the phi29 dna polymerase).j.biol.chem.1989,15,8935-8940
[0104]
4.de paz,a.m.;tyo,k.e j.;cybulski,t.r.;marblestone,a.h.;church,g.m.;zamft,b.m.;boyden,e.s.;kording,k.p.,使用核苷酸失衡和下一代测序对dna聚合酶保真度进行高分辨率绘图(high-resolution mapping of dna polymerase fidelity using nucleotide imbalances and next-generation sequencing).nucleic acids research 2018,46,e78-e78.
[0105]
5.esteban,j.a.;salas,m.;blanco,l.,φ29dna聚合酶的保真度(fidelity ofφ29dna polymerase).j.biol.chem.1993,268,2713-2726
[0106]
6.blanco,l.;salas,m.,噬菌体φ29编码的dna聚合酶中3'-5'核酸核酸外切酶活性的表征(characterization of a 3'-5'exonuclease activity in the phage phi29-encoded dna polymerase).nucleic acids research 1985,13,1239-1249。
[0107]
7.garmendia,c.;bernad,a.;estebane,j.a.;blanco,l.;salad,m.,噬菌体φ29dna聚合酶,一种校对酶(the bacteriophage phi29 dna polymerase,aproofreading enzyme).j.biol.chem.1992,267,2594-2599。
[0108]
8.kamtekar,s.;berman,a.j.;wang,j.;lazaro,j.m.;de vega,m.;blanco,l.;salas,m.;steitz,t.a.,从噬菌体φ29的蛋白激发的dna聚合酶的晶体结构中洞察到链的置换和过程性(insights into strand displacement and processivity from the crystal structure of the protein-primed dna polymerase of bacteriophage phi29).molecular cell 2004,16,609-618。
[0109]
9.ossowski,j.;t.;silies,l.;kind,m.;noworolska,a.;blobner,f.;gnatek,d.;rysz,j.;bolte,m.;feulner,p.;terfort,a.;cyganik,p.;zharnikov,m.,硫酸盐与硒酸盐:结构、稳定性和电荷转移特性(thiolate versus selenolate:structure,stability,and charge transfer properties).acs nano 2015,9,4508-4526.
[0110]
10.mousa,r.;notis dardashti,r.;metanis,n.,蛋白质化学中的硒和硒代半胱氨酸。(selenium and selenocysteine in protein chemistry.)angewandte chemie international edition 2017,56,15818-15827.
[0111]
11.senapati,s.;biswas,s.;zhang,p.,乙酰化硫醇-叠氮基异双功能接头的生物素化及其与金表面的连接的无痕施陶丁格连接(traceless staudinger ligation for biotinylation of acetylated thiol-azido heterobifunctional linker and its attachment to gold surface).current organic chemistry 2018,22,411-415.
[0112]
12.wang,d.;kodali,v.k.;underwood ii,w.d.;jarvholm,j.e.;okada,t.;jones,s.c.;rumi,m.;dai,z.;king,w.p.;marder,s.r.;curtis,j.e.;riedo,e.,用于组装纳米物体的多功能纳米模板的热化学纳米光刻(thermochemical nanolithography of multifunctional nanotemplates for assembling nano-objects).advanced functional materials 2009,19,3696-3702.
[0113]
13.carroll,k.m.;lu,x.;kim,s.;gao,y.;kim,h.-j.;somnath,s.;polloni,l.;sordan,r.;king,w.p.;curtis,j.e.;riedo,e.,热化学纳米光刻的平行化(parallelization of thermochemical nanolithography).nanoscale2014,6,1299-1304.
[0114]
14.liu,h.;naismith,j.h.,一种高效的一步定点缺失、插入、单点和多点质粒诱变方案(an efficient one-step site-directed deletion,insertion,single and multiple-site plasmid mutagenesis protocol.)bmc biotechnol 2008,8,91.
[0115]
15.young,t.s.;ahmad,i.;yin,j.a.;schultz,p.g.,大肠杆菌中非天然氨基酸诱变的增强系统(an enhanced system for unnatural amino acid mutagenesis in e.coli).j mol biol 2010,395,361-374.
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1