新型转谷氨酰胺酶
1.本发明涉及转谷氨酰胺酶。详细地说,涉及曲霉属菌来源的新型转谷氨酰胺酶及其用途等。
背景技术:
2.转谷氨酰胺酶是催化位于肽链内的谷氨酰胺残基的γ-羧酰胺基的酰基转移反应的酶,蛋白质中的赖氨酸残基的ε-氨基作为酰基受体起作用时,在蛋白质分子的分子内或分子间形成ε-(γ-gln)-lys交联键。转谷氨酰胺酶一般在细胞分化、细胞信号传递、血液凝固、创伤治愈等一系列的生理学功能中发挥重要作用,转谷氨酰胺酶功能的调节的异常与神经变性疾病、乳糜泻、癌及组织纤维化等自身免疫疾病有关。转谷氨酰胺酶功能的研究在细菌、酵母、植物、无脊椎动物、两栖类、鱼类和鸟类中进行,另一方面,多细胞真菌的转谷氨酰胺酶功能至今还没有阐明。
3.另外,如果利用转谷氨酰胺酶的作用,则能够进行蛋白质或肽的改性,因此链霉菌属来源的转谷氨酰胺酶(例如参照专利文献1)被用于肉的粘结、香肠、豆腐、面包、面类的制造。另外,不限于食品领域,还研究了在纤维领域、医疗领域、化妆品领域等中的转谷氨酰胺酶的利用。伴随着这样的利用扩大,尝试改良转谷氨酰胺酶的特性(耐热性、比活性、底物特异性、稳定性等)(例如参照专利文献2~4、非专利文献1~4)。现有技术文献专利文献
4.专利文献1:日本特开平4-108381号公报专利文献2:日本特开2002-253272号公报专利文献3:日本特开2008-194004号公报专利文献4:国际公开第2019/107288号小册子非专利文献
5.非专利文献1:marx ck et al.,j.biotechnol.2008sep 10;136(3-4):156-62.非专利文献2:tagami u et al.,protein eng des sel.2009dec;22(12):747-752.非专利文献3:yokoyama k et al.,appl microbiol biotechnol(2010)87:2087-2096.非专利文献4:buettner k et al.,amino acids.2012feb;42(2-3):987-96.
技术实现要素:
发明要解决的技术问题
6.如上所述,转谷氨酰胺酶在各种领域中实现了其利用,但对于适用于食品、医疗领域等要求高安全性的用途的转谷氨酰胺酶的需求依然很高。因此,本发明所要解决的技术问题是提供可用于食品或医疗用途的新型转谷氨酰胺酶及其用途。
用于解决问题的技术方案
7.为了解决上述技术问题进行了深入研究,其结果是,本发明人等通过从丝状菌特异性存在的功能未知的基因中进行筛选,发现了新型的转谷氨酰胺酶。作为丝状菌的米曲霉的基因组信息已经解析,但没有发现具有转谷氨酰胺酶活性的蛋白质。本发明人等通过运用低渗透压冲击实验这样的新的方法来检测转谷氨酰胺酶活性,成功地鉴定了米曲霉来源的转谷氨酰胺酶。
8.本发明提供下述方式的发明。[1]一种转谷氨酰胺酶,其由下述(a)~(c)中任一项所示的蛋白质构成,(a)包含序列号1或2所示的氨基酸序列的蛋白质;(b)含有在序列号1或2所示的氨基酸序列中置换、添加、插入或缺失一个或几个氨基酸而成的氨基酸序列、并且具有催化位于肽链内的谷氨酰胺残基的γ-羧酰胺基的酰基转移反应的活性的蛋白质;(c)含有相对于序列号1或2所示的氨基酸序列的序列一致性为90%以上的氨基酸序列、并且具有催化位于肽链内的谷氨酰胺残基的γ-羧酰胺基的酰基转移反应的活性的蛋白质。[2]根据[1]所述的转谷氨酰胺酶,其中,转谷氨酰胺酶来自米曲霉。[3]一种dna,其编码[1[或[2]所述的转谷氨酰胺酶。[4]根据[3]所述的dna,其含有与序列号4的碱基序列具有90%以上的序列一致性的碱基序列。[5]一种酶制剂,其将[1]或[2]所述的转谷氨酰胺酶作为有效成分。[6]根据[5]所述的酶制剂,其在蛋白质或肽的交联中使用。[7]根据[5]所述的酶制剂,其用于食品的制造。[8]根据[5]所述的酶制剂,其用于医疗或用于工业。[9]一种酰基转移方法,其是对蛋白质或肽中的谷氨酰胺残基的γ-羧酰胺基进行酰基转移反应的方法,所述方法使下述(a)~(c)中任一项所示的蛋白质作用于成为底物的蛋白质或肽,(a)包含序列号1或2所示的氨基酸序列的蛋白质;(b)含有在序列号1或2所示的氨基酸序列中置换、添加、插入或缺失一个或几个氨基酸而成的氨基酸序列、并且具有催化位于肽链内的谷氨酰胺残基的γ-羧酰胺基的酰基转移反应的活性的蛋白质;(c)含有相对于序列号1或2所示的氨基酸序列的序列一致性为90%以上的氨基酸序列、并且具有催化位于肽链内的谷氨酰胺残基的γ-羧酰胺基的酰基转移反应的活性的蛋白质。[10]根据[9]所述的酰基转移方法,其是为了使蛋白质或肽交联而进行的。[11]一种食品的制造方法,其使下述(a)~(c)中任一项所示的蛋白质作用于包含蛋白质或肽的食品原料,(a)包含序列号1或2所示的氨基酸序列的蛋白质;(b)含有在序列号1或2所示的氨基酸序列中置换、添加、插入或缺失一个或几个氨基酸而成的氨基酸序列、并且具有催化位于肽链内的谷氨酰胺残基的γ-羧酰胺基的酰基
转移反应的活性的蛋白质;(c)含有相对于序列号1或2所示的氨基酸序列的序列一致性为90%以上的氨基酸序列、并且具有催化位于肽链内的谷氨酰胺残基的γ-羧酰胺基的酰基转移反应的活性的蛋白质。[12]下述(a)~(c)中任一项所示的蛋白质的、用于对蛋白质或肽中的谷氨酰胺残基的γ-羧酰胺基进行酰基转移反应的用途,(a)包含序列号1或2所示的氨基酸序列的蛋白质;(b)含有在序列号1或2所示的氨基酸序列中置换、添加、插入或缺失一个或几个氨基酸而成的氨基酸序列、并且具有催化位于肽链内的谷氨酰胺残基的γ-羧酰胺基的酰基转移反应的活性的蛋白质;(c)含有相对于序列号1或2所示的氨基酸序列的序列一致性为90%以上的氨基酸序列、并且具有催化位于肽链内的谷氨酰胺残基的γ-羧酰胺基的酰基转移反应的活性的蛋白质。[13]根据[12]所述的用途,其用于使蛋白质或肽交联。
附图说明
[0009]
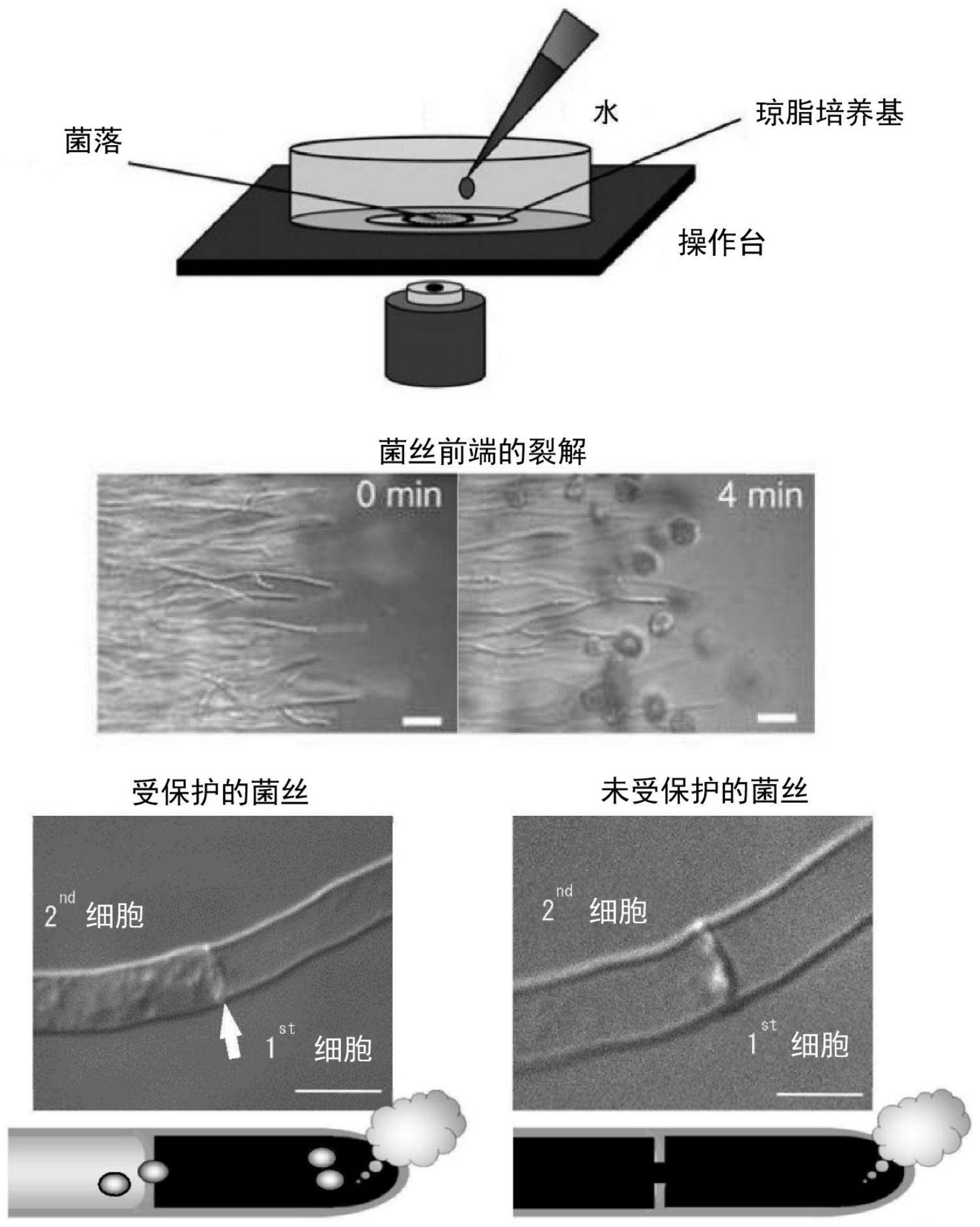
图1是低渗透压冲击实验的概要。评价防止菌丝损伤时裂解向相邻的细胞传播的功能。用dpy琼脂培养基培养18小时后,加水诱导菌丝前端的裂解。随机选择30个显示菌丝前端的裂解的菌丝,用微分干涉显微镜进行观察,对防止了裂解传播的菌丝进行计数。图2是低渗透压冲击实验的结果。具体而言,显示野生株(wild type;nspld1株)和ao090023000250破坏株(δao090023000250)中的菌丝保护率。图3是低渗透压冲击实验的结果。具体而言,显示ao090023000250的活性中心的氨基酸置换株的菌丝保护率。在图中,“wild type”是野生株(nspld1株)、“δao090023000250”是ao090023000250破坏株,“ao090023000250”是在ao090023000250破坏株中导入了ao090023000250的株,“vector”是在ao090023000250破坏株中导入了没有插入dna的空载体的株,“δao090023000250_c417a”是导入了编码c417a置换体的ao090023000250的株,“δao090023000250_h464a”是导入了编码h464a置换体的ao090023000250的株,以及“δao090023000250_d480a”是导入了编码d480a置换体的ao090023000250的株。图4是利用荧光显微镜的细胞内局部存在的观察结果。具体而言,显示ao090023000250的部分缺失型的细胞内局部存在的结果。箭头表示隔壁,向隔膜孔的蓄积用虚线的圆表示。标尺为5μm。图4中,“ao090023000250-egfp”是将全长ao090023000250和egfp的融合蛋白导入到ao090023000250破坏株中的株;“ao090023000250(1-358aa)-egfp”是将c末端区域(序列号1所示的氨基酸序列的359~697位的区域)缺失的ao090023000250和egfp的融合蛋白导入到ao090023000250破坏株中的株;“ao090023000250(359-481aa)-egfp”是将c末端区域(序列号1所示的氨基酸序列的482~697位的区域)和n末端区域(序列号1所示的氨基酸序列的1~358位的区域)缺失的ao090023000250和egfp的融合蛋白导入到ao090023000250破坏株中的株;“ao090023000250(359-697aa)-egfp”是将n末端区域(序列号1所示的氨基酸序列的1~358位的区域)缺失的ao090023000250和egfp的融合蛋白导
入到ao090023000250破坏株中的株;“dic”为微分干涉显微镜照片;“egf”是观察利用egep的绿色荧光的荧光显微镜照片;“通常时”是低渗透压冲击实验前;以及“菌丝损伤时”表示低渗透压冲击实验后。图5是酪蛋白的聚合分析的结果(sds-page)。从左开始是分子量标记、酶未处理酪蛋白、未纯化3
×
ha-6his标签融合转谷氨酰胺酶(10μl)处理酪蛋白、纯化3
×
ha-6his标签融合转谷氨酰胺酶(10μl)处理酪蛋白、纯化3
×
ha-6his标签融合转谷氨酰胺酶(5μl)处理酪蛋白的结果。图6是使用了5-fitc尸胺的转谷氨酰胺酶活性的评价。具体而言,显示ao090023000250破坏株和野生株(nsp1d1株)中在隔膜孔中确认到荧光的菌丝的比例。
具体实施方式
[0010]
术语“米曲霉来源的转谷氨酰胺酶”是指其起源为米曲霉的转谷氨酰胺酶,包括米曲霉产生的转谷氨酰胺酶或利用该转谷氨酰胺酶的遗传信息在其他微生物等中表达的转谷氨酰胺酶等。
[0011]
1.转谷氨酰胺酶本发明的第一方面涉及转谷氨酰胺酶(以下,也称为“本酶”)。本发明的转谷氨酰胺酶在食品或医疗用途中特别有用。
[0012]
本发明的转谷氨酰胺酶的一个实施方式由(a)包含序列号1或2所示的氨基酸序列的蛋白质构成。
[0013]
序列号1所示的氨基酸序列是本发明人等鉴定成功的米曲霉来源的转谷氨酰胺酶的氨基酸序列全长。根据本发明人的研究,判明了由序列号1所示的氨基酸序列构成的米曲霉来源的蛋白质显示转谷氨酰胺酶活性,即作为转谷氨酰胺酶发挥功能。另外,如后述的实施例所示,该蛋白质示出能够防止低渗透压冲击引起的菌丝前端细胞的裂解传播到相邻细胞的特性。另外,通过使用酪蛋白蛋白质的实验确认该蛋白质催化蛋白质交联化,以及通过使用5-fitc尸胺的实验确认该蛋白质示出转谷氨酰胺酶活性。
[0014]
另外,由本发明人等的研究结果可知,序列号1的氨基酸序列的1~358位的n末端区域是与局部存在相关的序列(局部存在序列),预想与转谷氨酰胺酶活性无关。因此,能够合理预想从序列号1的氨基酸序列中去除局部存在序列的部分序列(序列号2;序列号1中的359~697位的氨基酸序列)所构成的蛋白质也作为转谷氨酰胺酶发挥功能。因此,作为本发明的一个方式,由序列号2所示的氨基酸序列构成的蛋白质也能够作为转谷氨酰胺酶使用。
[0015]
本发明的转谷氨酰胺酶的其他实施方式由与序列号1或2所示的氨基酸序列等效的氨基酸序列构成。此处的“等效的氨基酸序列”是指与基准的氨基酸序列(序列号1或2所示的氨基酸序列)在一部分上不同,但该不同对蛋白质的功能(此处是转谷氨酰胺酶活性)没有实质影响的氨基酸序列。因此,具有与序列号1或2所示的氨基酸序列等效的氨基酸序列的蛋白质催化转谷氨酰胺酶反应。活性的程度只要能够发挥作为转谷氨酰胺酶的功能即可,没有特别限定。但是,优选与由成为基准的氨基酸序列构成的蛋白质(具有序列号1或2所示的氨基酸序列)相同程度或比其高。
[0016]
与序列号1或2所示的氨基酸序列等效的氨基酸序列例如通过构成序列号1或2所示的氨基酸序列的氨基酸中的一个或几个氨基酸的缺失、置换、对序列号1或2所示的氨基
酸序列添加、插入一个或多个氨基酸,或这些的任意组合而产生。另外,作为与序列号1或2所示的氨基酸序列等效的氨基酸序列,例如可举出相对于序列号1或2所示的氨基酸序列,相当于不足约10%的数量的氨基酸不同的氨基酸序列。因此,作为本发明的转谷氨酰胺酶的其他实施方式的具体例,可以举出由下述(b)或(c)所示的蛋白质构成的转谷氨酰胺酶的例子。(b)含有在序列号1或2所示的氨基酸序列中置换、添加、插入或缺失一个或几个氨基酸而成的氨基酸序列、并且具有催化位于肽链内的谷氨酰胺残基的γ-羧酰胺基的酰基转移反应的活性的蛋白质;(c)含有相对于序列号1或2所示的氨基酸序列的序列一致性为90%以上的氨基酸序列、并且具有催化位于肽链内的谷氨酰胺残基的γ-羧酰胺基的酰基转移反应的活性的蛋白质。
[0017]
在上述(b)和(c)的蛋白质中,相对于序列号1或2所示的氨基酸序列不同的氨基酸的位置,以具有催化位于肽链内的谷氨酰胺残基的γ-羧酰胺基的酰基转移反应的活性为限度,没有特别限定。另外,序列号1中的417位的半胱氨酸、464位的组氨酸和480位的天冬氨酸,以及序列号2中的59位的半胱氨酸、106位的组氨酸和122位的天冬氨酸被推定为活性中心,因此在上述(b)和(c)的蛋白质中,优选在这些部位没有突变(置换、缺失和插入)。另外,序列号1中的359~481位的区域和序列号2中的1~123位的区域被推定为转谷氨酰胺酶的活性域,因此作为上述(b)和(c)的蛋白质的一例,可以举出在这些区域中没有突变(置换、缺失和插入)者。
[0018]
作为上述(b)和(c)的蛋白质的优选的一例,可以举出在序列号1或2所示的氨基酸序列中对转谷氨酰胺酶活性而言不是必需的氨基酸残基被保守氨基酸置换的蛋白质。此处的“保守氨基酸置换”是指将某个氨基酸残基置换为具有同样性质的侧链的氨基酸残基。氨基酸残基通过其侧链被分类为碱性侧链(例如赖氨酸、精氨酸、组氨酸)、酸性侧链(例如天冬氨酸、谷氨酸)、不带电的极性侧链(例如甘氨酸、天冬酰胺、谷氨酰胺、丝氨酸、苏氨酸、酪氨酸、半胱氨酸)、非极性侧链(例如丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、蛋氨酸、色氨酸)、β支链侧链(例如苏氨酸、缬氨酸、异亮氨酸)、芳香族侧链(例如酪氨酸、苯丙氨酸、色氨酸、组氨酸)等几个家族。保守氨基酸置换优选为同一家族内的氨基酸残基间的置换。
[0019]
在上述(b)的蛋白质中,对于序列号1或2所示的氨基酸序列引入的突变(置换、添加、插入和/或缺失)的数量没有特别限制,例如,对于序列号1或2所示的氨基酸序列,可以列举1~40个(优选1~30个,更优选1~10个,进一步优选1~7个,更进一步优选1~5个,再更进一步优选1~3个)氨基酸的缺失和/或置换;对序列号1或2所示的氨基酸序列添加和/或插入1~40个(优选1~30个,更优选1~10个,进一步优选1~7个,更进一步优选1~5个,再更进一步优选1~3个)氨基酸;以及通过这些的组合在氨基酸序列上产生突变(变化)的例子。
[0020]
作为上述(c)的蛋白质,可以举出相对于序列号1或2所示的氨基酸序列,具有优选约92%以上,更优选约94%以上,进一步优选约96%以上,更进一步优选约98%以上,最优选约99%以上的序列一致性的蛋白质。
[0021]
在本发明中,两个氨基酸序列或两个碱基序列(以下,作为包含这些的术语使用“两个序列”)的一致性(%)例如可以通过以下的步骤来决定。首先,为了能够进行最佳的比较而排列两个序列(例如,也可以在第一序列中导入间隙而使与第二序列的对准最佳化)。第一序列的特定位置的分子(氨基酸残基或核苷酸)与第二序列中对应位置的分子相同时,可以说该位置的分子相同。两个序列的一致性是在该两个序列中共同的相同位置的数量的函数(即,一致性(%)=相同位置的数量/位置的总数
×
100)),因此优选考虑对准的最优化所需的间隙的数量和尺寸。
[0022]
两个序列的比较和一致性的确定可以采用数学算法实现。作为可用于序列比较的数学算法的具体例子,有karlin和altschul(1993)proc.natl.acad.sci.usa 90:5873-77中记载的算法。这样的算法被编入altschul等(1990)j.mol.biol.215:403-10中记载的nblast程序和xblast程序(版本2.0)中。为了得到等效的核苷酸序列,例如,只要在nblast程序中以score=100、wordlength=12进行blast核苷酸检索即可。为了得到等效的氨基酸序列,例如,可以在xblast程序中以score=50、wordlength=3进行blast多肽检索。为了得到用于比较的间隙对准,可以使用在altschul等(1997)amino acids research 25(17):3389-3402中记载的gapped blast。在利用blast以及gapped blast的情况下,能够使用对应的程序(例如xblast以及nblast)的默认参数。详细而言,希望参照http://www.ncbi.nlm.nih.gov。作为可用于序列比较的其他数学算法的例子,有myers和miller(1988)comput appl biosci.4:11-17中记载的算法。这样的算法被编入例如可在genestream网络服务器(igh montpellier,法国)或isrec服务器中利用的align程序中。在氨基酸序列的比较中利用align程序的情况下,例如可以使用pam120残底物量表,使间隙长度罚分=12,间隙罚分=4。
[0023]
可以使用emboss软件包的gap程序,使用blosum62矩阵且设间隙加权=10、间隙长度加权=2来决定两个氨基酸序列的一致性。另外,使用emboss软件包(可利用http://emboss.open-bio.org/)的gap程序且设间隙加权=50,间隙长度加权=3来决定两个碱基序列的一致性。
[0024]
在上述(b)和(c)的蛋白质中,“催化位于肽链内的谷氨酰胺残基的γ-羧酰胺基的酰基转移反应的活性”可以按照以下的方法测定。首先,将含有成为测定对象的蛋白质的溶液5~10μl与10重量%n,n-二甲基化酪蛋白溶液10μl、反应缓冲液(50mm hepes(ph7.5)、500mm nacl、10mm cacl2、1mm dtt)35μl混合,在30℃下反应2小时。接着,将反应后的溶液用sds-page泳动,通过考马斯亮蓝染色确认有无聚合的酪蛋白。确认到聚合的酪蛋白时,判定作为测定对象的蛋白质具有“催化位于肽链内的谷氨酰胺残基的γ-羧酰胺基的酰基转移反应的活性”。
[0025]
另外,作为上述(b)及(c)的蛋白质的优选例,可以举出转谷氨酰胺酶与未改变的蛋白质(即,由序列号1或2所示的氨基酸序列构成的蛋白质)相比为同等的蛋白质。具体而言,可以举出:在将上述(a)的蛋白质的转谷氨酰胺酶活性设为100%的情况下,上述(b)及(c)的蛋白质的转谷氨酰胺酶活性的相对值50%以上,优选为50~200%,更优选为70~150%,进一步优选为80~120%,特别优选为90~110%。此处,在上述(b)和(c)的蛋白质为改变了序列号1所示的氨基酸序列的氨基酸序列的情况下,转谷氨酰胺酶活性的相对值是将由序列号1所示的氨基酸序列构成的蛋白质的转谷氨酰胺酶活性作为100%而算出的值,另外,在上述(b)和(c)的蛋白质为改变了序列号2所示的氨基酸序列的氨基酸序列的情况
下,为将由序列号2所示的氨基酸序列构成的蛋白质的转谷氨酰胺酶活性作为100%而算出的值。另外,上述转谷氨酰胺酶活性是用以下所示的活性测定法测定的值。
[0026]
《转谷氨酰胺酶活性测定法》用200mm tris-hcl ph6.0将成为测定对象的蛋白质稀释成适当的浓度(样品溶液)。在10μl样品溶液中添加100μl底物溶液(r-1)并混合后,在37℃下反应10分钟。加入发色溶液(r-2)100μl,停止反应,同时形成fe络合物后,测定525nm的吸光度。作为对照,使用预先热失活的酶液,测定同样反应的产物的吸光度,求出与样品溶液的吸光度差。另外,使用l-谷氨酸-γ-单羟肟酸代替酶液制作标准曲线,由上述吸光度差求出生成的羟肟酸的量。以1分钟内生成1微摩尔的羟肟酸的酶活性为1单位(1u)。(底物溶液(r-1))将2-氨基-2-羟甲基-1,3-丙二醇2.42g、盐酸羟基铵0.70g、还原型谷胱甘肽0.31g、z-gln-gly(苄氧羰基-l-谷氨酰甘氨酸)1.01g溶解于蒸馏水中,使总量为100ml(ph6.0)。(底物溶液(r-2))将3m盐酸溶液30ml、12%三氯乙酸溶液30ml、5%氯化铁(iii)溶液30ml混合。
[0027]
本发明的转谷氨酰胺酶例如也可以是与其他蛋白质融合的融合蛋白的一部分。作为在融合蛋白中添加的序列,例如可以举出多重组氨酸残基这样的有助于纯化的序列,确保重组生产时的稳定性的添加序列等。
[0028]
本发明的转谷氨酰胺酶可以通过培养产生该转谷氨酰胺酶的微生物(产生转谷氨酰胺酶的株)(例如米曲霉(aspergillus oryzae))而得到。转谷氨酰胺酶产生株可以是野生株,也可以是突变株(例如通过紫外线照射得到突变株)。转谷氨酰胺酶产生株的具体例为米曲霉rib40株。
[0029]
本发明的转谷氨酰胺酶可以由产生本发明的转谷氨酰胺酶的微生物的培养液和/或菌体制备。培养条件、培养方法没有特别限制,只要能够生产本发明的转谷氨酰胺酶即可。即,可以以生产本发明的转谷氨酰胺酶为条件来适当设定适合所使用的微生物的培养的方法、培养条件。作为培养法,可以是液体培养、固体培养中的任一种,优选利用液体培养。以液体培养为例,说明其培养条件。
[0030]
作为培养基,只要是使用的微生物能够生长发育的培养基即可,没有特别限定。例如可以使用添加了葡萄糖、蔗糖、龙胆二糖、可溶性淀粉、甘油、糊精、糖蜜、有机酸等碳源,进而硫酸铵、碳酸铵、磷酸铵、醋酸铵,或者蛋白胨、酵母提取物、玉米浆、酪蛋白水解物、麸皮、肉提取物等氮源,进而钾盐、镁盐、钠盐、磷酸盐、锰盐、铁盐、锌盐等无机盐的物质。为了促进所使用的微生物的生长,也可以在培养基中添加维生素、氨基酸等。培养基的ph调整为例如约3~8,优选约4~7左右,培养温度通常为约20~40℃,优选约25~35℃左右,在好氧条件下培养1~20天,优选3~10天左右。作为培养法,例如可以利用振荡培养法、利用发酵罐的好氧的深部培养法。
[0031]
在以上条件下培养后,从培养液或菌体中回收目标酶。从培养液中回收时,例如通过对培养上清液进行过滤,离心处理等去除不溶物后,通过适当组合利用超滤膜的浓缩、硫酸铵沉淀等盐析、透析、离子交换树脂等各种色谱等进行分离、纯化,可以得到本酶。另一方面,从菌体内回收时,例如通过加压处理、超声波处理等将菌体破碎后,与上述同样地进行
分离、纯化,由此可以得到本酶。另外,也可以通过过滤、离心处理等预先从培养液中回收菌体后,进行上述一系列的工序(菌体的破碎、分离、纯化)。
[0032]
另外,本发明的转谷氨酰胺酶也可以通过基因工程的方法容易地制备。例如,可以通过用编码本酶的dna转化适当的宿主细胞(例如大肠杆菌),回收在转化体内表达的蛋白质来制备。回收的蛋白质根据目的适当纯化。这样,如果作为重组蛋白质得到目标酶,则可以进行各种修饰。例如,如果将编码本发明的转谷氨酰胺酶的dna和其他适当的dna插入到相同的载体中,使用该载体进行重组蛋白质的生产,则可以得到由连结了任意肽或蛋白质的重组蛋白构成的本发明的转谷氨酰胺酶。另外,也可以实施糖链和/或脂质的添加,或产生n末端或c末端的处理的修饰。通过以上的修饰,可以简化重组蛋白的提取、纯化或者添加生物学功能等。
[0033]
通常,如上所述,可以利用适当的宿主-载体系统来制造本发明的转谷氨酰胺酶,但也可以利用无细胞合成系统来制造本发明的转谷氨酰胺酶。在此,“无细胞合成系统(无细胞转录系统、无细胞转录/翻译系统)细胞”指不使用活细胞,而使用活细胞来源的(通过基因工程的方法得到的)核糖体或转录/翻译因子等,从作为模板的核酸(dna或mrna)在体外合成其编码的mrna或蛋白质。在无细胞合成系统中,通常使用根据需要将细胞破碎液纯化而得到的细胞提取液。细胞提取液中一般含有蛋白质合成所需的核糖体、引发因子等各种因子、trna等各种酶。在进行蛋白质的合成时,在该细胞提取液中添加各种氨基酸、atp、gtp等能量源、肌酸磷酸等蛋白质的合成所必需的其他物质。当然,在蛋白质合成时,也可以根据需要补充另外准备的核糖体、各种因子和/或各种酶等。
[0034]
还报道了对蛋白质合成所需的各分子(因子)进行重构的转录/翻译系统的开发(shimizu,y.et al.;nature biotech.,19,751-755,2001)。在该合成系统中,从大肠杆菌基因组中扩增构成细菌的蛋白质合成系统的由3种引发因子、3种延伸因子、参与终结的4种因子、使各氨基酸与trna结合的20种氨酰trna合成酶以及甲硫氨酸trna甲酰基转移酶构成的31种因子的基因,使用这些在体外重构蛋白质合成系统。在本发明中也可以利用这样重构的合成系统。
[0035]
术语“无细胞转录/翻译系”可与无细胞蛋白质合成系、体外翻译系或体外转录/翻译系交换使用。在体外翻译系统中,使用rna作为模板来合成蛋白质。作为模板rna,使用总rna、mrna、体外转录产物等。在另一个体外转录/翻译系统中,使用dna作为模板。模板dna应包含核糖体结合区域,并优选包含适当的终止子序列。另外,在体外转录/翻译系统中,设定添加了各反应所需的因子的条件,以使转录反应和翻译反应连续进行。
[0036]
也可以通过例如冷冻干燥、真空干燥或喷雾干燥等将如上所述得到的转谷氨酰胺酶粉末化而提供。此时,也可以预先将纯化酶溶解在醋酸缓冲液、磷酸缓冲液、三乙醇胺缓冲液、tris缓冲液或good缓冲液中。优选使用醋酸缓冲液、磷酸缓冲液、三乙醇胺缓冲液。此外,此处作为good缓冲液,包括pipes、mes和mops。
[0037]
2.与转谷氨酰胺酶相关的核酸和转化体本发明的第二方面提供与上述转谷氨酰胺酶相关的核酸。
[0038]
具体地,在本发明的一个实施方式中,提供了编码所述转谷氨酰胺酶的氨基酸序列的dna。编码所述转谷氨酰胺酶的氨基酸序列的dna典型地用于所述转谷氨酰胺酶的制备。根据使用编码转谷氨酰胺酶的氨基酸序列的dna的基因工程制备方法,可以获得更均质
的状态的上述转谷氨酰胺酶。另外,该方法在制备大量的上述转谷氨酰胺酶时也可以说是优选的方法。此外,编码上述转谷氨酰胺酶的氨基酸序列的dna的用途不限于上述转谷氨酰胺酶的制备。例如,该dna也可以用作以弄清上述转谷氨酰胺酶的作用机理等为目的的实验用工具,或者用于设计或制作上述转谷氨酰胺酶的突变体(变体)的工具。
[0039]
在本发明中,编码转谷氨酰胺酶的氨基酸序列的dna是指在使其表达时可以得到上述转谷氨酰胺酶的核酸,当然包括具有与上述转谷氨酰胺酶的氨基酸序列对应的碱基序列的核酸,也包括在这样的核酸上添加不编码氨基酸序列的序列而成的核酸。另外,还考虑了密码子的简并。
[0040]
作为对上述转谷氨酰胺酶的氨基酸序列进行编码的dna的一个方式,可以举出包含序列号4或5所示的碱基序列的dna。序列号4所示的碱基序列的dna编码米曲霉来源的转谷氨酰胺酶的全长的氨基酸序列(序列号1)。序列号5的dna编码在米曲霉来源的转谷氨酰胺酶中去除了局部存在序列的部分氨基酸序列(序列号2)。
[0041]
在本发明中,作为编码上述转谷氨酰胺酶的氨基酸序列的dna的一个方式,提供在与序列号4或5所示的碱基序列进行比较的情况下在其所编码的转谷氨酰胺酶的功能相同的部分中碱基序列不同的dna(以下也称为“等效dna”。另外,将规定等效dna的碱基序列也称为“等效碱基序列”)。作为等效dna的例子,可以列举由以序列号4或5所示的碱基序列为基准含有1个或多个碱基的置换、缺失、插入、添加或倒位的碱基序列构成,编码具有转谷氨酰胺酶活性的蛋白质的dna。碱基的置换、缺失等也可以在多个部位产生。此处的“多个”根据该dna编码的蛋白质的立体结构中的氨基酸残基的位置或种类而不同,例如为2~40个碱基,优选为2~20个碱基,更优选为2~10个碱基。等效dna相对于序列号4或5所示的碱基序列具有例如90%以上,优选92%以上,更优选94%以上,进一步优选96%以上,更进一步优选约98%以上,最优选99%以上的一致性。碱基序列的一致性的计算方法如上述“1.转谷氨酰胺酶”一栏中记载的那样。
[0042]
以上的等效dna例如可以通过限制酶处理、外切核酸酶、dna连接酶等的处理、基于定点诱变法(molecular cloning,third edition,chapter13,cold spring harbor laboratory press,newyork)或随机诱变法(molecular cloning,third edition,chapter13,cold spring harbor laboratory press,newyork)的突变导入等得到。另外,通过紫外线照射等其他方法也可以得到等效核酸。
[0043]
进而,在本发明的另一实施方式中,还提供了编码转谷氨酰胺酶活性域推定氨基酸序列(序列号3)的dna。作为该dna,具体而言,可以举出具有序列号6所示的碱基序列的dna;相对于序列号6所示的碱基序列例如具有90%以上,优选92%以上,更优选94%以上,进一步优选96%以上,更进一步优选约98%以上,最优选99%以上的一致性的dna。碱基序列的一致性的计算方法如上述“1.转谷氨酰胺酶”一栏中记载的那样。
[0044]
进而,在本发明的其他方式中,提供一种dna,其具有与对上述转谷氨酰胺酶的氨基酸序列进行编码的dna的碱基序列(例如,序列号4或5所示的碱基序列)互补的碱基序列。本发明的另一方式提供一种dna,其相对于与编码上述转谷氨酰胺酶的氨基酸序列的dna的碱基序列(例如,序列号4或5所示的碱基序列)互补的碱基序列,具有至少约90%左右、92%左右、94%左右、96%左右、98%或99%同源的碱基序列。碱基序列的一致性的计算方法如上述“1.转谷氨酰胺酶”一栏中记载的那样。
cerevisiae)等微生物,但只要是能够复制重组dna且能够表达本酶的基因的宿主细胞即可利用。作为大肠杆菌的例子,在利用t7系启动子时可以举出大肠杆菌bl21(de3)plyss,该情况以外可以举出大肠杆菌jm109。另外,作为酿酒酵母,可举出酿酒酵母shy2、酿酒酵母ah22和酿酒酵母invsc1(invitrogen社)。
[0054]
上述转化体可以通过转染或转化而得到。例如,氯化钙法(j.mol.biol,第53卷,第159页(1970);hanahan法(j.mol.biol,第166卷,第557页(1983);sem法(gene,第96卷,第23页(1990)]、chung等的方法(proceeding of the national academy of sciences usa,第86卷,第2172页(1989)、磷酸钙共沉淀法、电穿孔(potter,h.et al.et al.proc.natl.acad.sci.u.s.a.81,7161-7165(1984))、脂转染(felgner,p.l.et al.et al.proc.natl.acad.sci.u.s.a.84,7413-7417(1984))等。另外,上述转化体可以用于生产本发明的本酶。
[0055]
3.酶制剂本发明的又一方面提供一种将转谷氨酰胺酶作为有效成分的酶制剂。在本说明书中,“将转谷氨酰胺酶作为有效成分的酶制剂”是指含有上述转谷氨酰胺酶,以表现转谷氨酰胺酶活性(即位于肽链内的谷氨酰胺残基的γ-羧酰胺基的酰基转移反应的催化功能)为目的而使用的制剂。
[0056]
上述酶制剂中转谷氨酰胺酶的纯化度没有特别限定。另外,所述酶制剂的最终形态可以是液体状,也可以是固体状(包括粉体状)。
[0057]
上述酶制剂中的有效成分(上述转谷氨酰胺酶)的含量没有特别限定,例如可以设定或调整有效成分的含量,以使利用上述转谷氨酰胺酶活性测定法测定时的转谷氨酰胺酶活性相对于每1g酶制剂为0.01u~10000u,优选为0.1u~1000u。上述酶制剂通常以固体状(例如,颗粒、粉体、在二氧化硅或多孔质聚合物等能够于表面或内部固定酶的材料上固定该酶的固定化酶)或液体状提供。上述酶制剂除了有效成分(上述转谷氨酰胺酶)以外,还可以含有赋形剂、缓冲剂、悬浮剂、稳定剂、保存剂、防腐剂、生理盐水等。作为赋形剂,可以使用乳糖、山梨糖醇、d-甘露醇、麦芽糊精、白糖等。作为缓冲剂,可以使用磷酸盐、柠檬酸盐、醋酸盐等。作为稳定剂,可以使用丙二醇、抗坏血酸等。作为保存剂,可以使用苯酚、苯扎氯铵、苄醇、氯丁醇、对羟基苯甲酸甲酯等。作为防腐剂,可以使用苯扎氯铵、对羟基苯甲酸、氯丁醇等。
[0058]
4.转谷氨酰胺酶和酶制剂的用途本发明的又一方面提供了上述转谷氨酰胺酶和酶制剂的用途。具体而言,上述转谷氨酰胺酶和酶制剂用于催化蛋白质或肽中谷氨酰胺残基的γ-羧酰胺基的酰基转移反应。使上述转谷氨酰胺酶和酶制剂作用于蛋白质或肽时,通常,蛋白质或肽中的赖氨酸残基的ε-氨基与谷氨酰胺残基的γ-羧酰胺基缩合,在蛋白质或肽的分子内或分子间形成ε-(γ-gln)-lys交联键,在分子内或分子间形成交联结构。因此,上述转谷氨酰胺酶和酶制剂可以用于通过使蛋白质或肽发生交联来进行改性的目的。
[0059]
在本说明书中,关于上述转谷氨酰胺酶和酶制剂的底物,“蛋白质”是指50个以上的氨基酸以肽键键合而成的化合物,“肽”是指小于50个的氨基酸以肽键键合而成的化合物。在成为转谷氨酰胺酶和酶制剂底物的肽中优选包含至少一个谷氨酰胺残基和至少一个赖氨酸残基。
[0060]
使上述转谷氨酰胺酶或酶制剂作用于蛋白质或肽时,例如,每1g蛋白质或肽,上述转谷氨酰胺酶以换算成转谷氨酰胺酶活性值为1000~0.0001u,优选为100~0.001u,更优选为50~0.01u的方式添加酶制剂即可。
[0061]
另外,作为上述转谷氨酰胺酶使酶制剂作用于蛋白质或肽时的反应温度,转谷氨酰胺酶可以根据酶制剂的添加量、蛋白质或肽的改性程度等适当设定,例如可以举出5~70℃,优选10~60℃,更优选20~50℃。
[0062]
另外,作为上述转谷氨酰胺酶使酶制剂作用于蛋白质或肽时的反应时间,转谷氨酰胺酶可以根据酶制剂的添加量、蛋白质或肽的改性程度等适当设定,例如可以举出5分钟~24小时,优选10分钟~12小时,更优选15分钟~6小时。
[0063]
所述转谷氨酰胺酶和酶制剂例如可以是作为食品原料使用的蛋白质或肽的改性;医药中使用的蛋白质或肽的改性;可以用于纤维、皮革、固定化酶等工业用制品中使用的蛋白质或肽的改性。即,作为上述转谷氨酰胺酶及酶制剂的用途的例子,提供食品(例如香肠、成形肉等畜肉加工品、豆腐等大豆加工品、面包、面类等小麦加工品、鱼糕等水产加工品、酸奶等乳加工品)的制造方法、医疗用途(抗体医药组合物、再生医疗用途)、工业用途(纤维、皮革、固定化酶的制造)。在本发明的食品制造方法中,使本酶制剂作用于食品原料(例如通过添加形成作为有效成分的酶起作用的状态)而发生酶反应。在医疗用途中,使本酶制剂作用于医药原料,或将酶制剂本身用于医疗用途,使其发生酶反应。在工业用途中,使本酶制剂作用于工业原料,发生酶反应。实施例
[0064]
《具有转谷氨酰胺酶活性的蛋白质的探索》从存在于米曲霉的功能未知的776基因发现了局部存在于隔膜孔的60个基因。从其中获取特定基因的破坏株,进行低渗透压冲击实验。确认是否可以防止菌丝前端细胞的裂解传播到相邻的细胞,探索具有转谷氨酰胺酶(tgase)活性的蛋白质。
[0065]
用于转谷氨酰胺酶活性评价的低渗透压冲击实验的方法如下所示。(低渗透压冲击实验)通过在米曲霉的菌落中加入1ml水,诱导菌丝前端的裂解,并在玻璃底皿薄的dpy琼脂培养基(0.5%yeast extract、1%hipolypeptone、2%dextrin、0.5%kh2po4、0.05%mgso4·
7h2o、1.5%agar)上在30℃下生长18小时。随机选择30个菌丝前端显示裂解的菌丝,用微分干涉显微镜观察。如果能够保持与裂解前端细胞相邻的细胞的细胞质,并防止裂解的传播,则判断为具有转谷氨酰胺酶活性(图1)。
[0066]
1.基因破坏菌株的制备1-1.隔壁局部存在蛋白质基因破坏株的构建和评价从米曲霉rib40株的基因组dna中扩增60个隔壁局部存在的蛋白质的各基因的上游区域1.5kb及下游区域1.5kb和pyrg标记。使用in-fusion hd cloning kit(clontech laboratories,mountainview,ca,usa),融合3个扩增dna片段(各基因的上游区域、下游区域、pyrg标记)和puc19载体。以所得质粒为模板,扩增基因破坏用dna片段。将扩增的pcr片段用乙醇沉淀,通过同源重组导入米曲霉nspld1株(niad-sc-δpyrgδligd)的对应的基因座。将得到的各基因的破坏株和野生株(nspld1株)供于低渗透压冲击实验。其结果表明,在60个隔壁局部存在蛋白质的基因中,在由序列号4的序列构成的ao090023000250基因(以
下,省略为“ao090023000250”)的破坏株中,防止裂解传播的能力最低(图2),推测ao090023000250具有转谷氨酰胺酶活性。此外,将ao090023000250编码的氨基酸序列表示为序列号1。
[0067]
1-2.ao090023000250的活性中心的氨基酸置换株的构建和评价接着,确认将推定为构成ao090023000250的转谷氨酰胺酶活性中心的3个残基(cys417、his464、asp480)置换为丙氨酸时有无防止裂解传播的能力。首先,以米曲霉rib40株的基因组dna为模板,使用设计成在cys417、his464或asp480中导入丙氨酸置换的引物,用pcr扩增ao090023000250。将得到的dna片段与用smai切断的puxn载体(mori et al.biosci biotechnol biochem 83:1557-1569,2019)融合。分离导入了各突变型基因的质粒,用noti消化后,通过同源重组导入ao090023000250破坏株的niad基因座。将导入了各突变型基因的破坏株、ao090023000250破坏株和野生株(nspld1株)供于低渗透压冲击实验。其结果是,在cys417ala和his464ala置换株中,防止裂解传播的能力以与基因缺失株同等的水平降低。另外,通过asp480ala的氨基酸置换,也确认了防止菌丝损伤中的裂解传播的能力的降低(图3)。以上结果证明了“cys417、his464和asp480构成转谷氨酰胺酶活性中心”的推断。
[0068]
1-3.ao090023000250的部分缺失株的构建和评价制备米曲霉的推定转谷氨酰胺酶蛋白(具有序列号1所示的氨基酸序列)的部分缺失体。首先,使用设计成n末端区域(序列号1所示的氨基酸序列的1~358位的区域)缺失的引物来扩增编码n末端缺失型(序列号1所示的氨基酸序列的359~697位的区域、序列号2)的dna片段。使用米曲霉rib40株的基因组dna作为模板。同样地,分别扩增了对设计成c末端区域(序列号1所示的氨基酸序列的359~697位的区域)缺失的c末端缺失型(序列号1所示的氨基酸序列的1~358位的区域)进行编码的dna片段、和对设计成c末端区域(序列号1所示的氨基酸序列的482~697位的区域)和n末端区域(序列号1所示的氨基酸序列的1~358区域)缺失的n末端/c末端缺失型(序列号1所示的氨基酸序列的359~481位的区域)进行编码的dna片段。将通过以上方法准备的3种dna片段分别与设计为在c末端融合egfp(绿色荧光蛋白)的质粒融合。将各质粒用noti消化后进行乙醇沉淀,将得到的dna通过同源重组导入ao090023000250破坏株的niad基因座。通过低渗透压冲击实验诱导裂解,用荧光显微镜观察的结果是c末端缺失型在裂解时蓄积在隔膜孔中,与此相对,n末端缺失型和n末端/c末端缺失型均匀地局部存在于细胞质中(图4)。由以上结果可知,n末端区域(序列号1所示的氨基酸序列的1~358位的区域)参与菌丝损伤向隔膜孔的蓄积,换言之,该n末端区域不是转谷氨酰胺酶活性,而是与酶的局部存在相关的区域。推定转谷氨酰胺酶活性域的氨基酸序列(序列号1所示的氨基酸序列的359~481位的区域)示于序列号3。
[0069]
2.转谷氨酰胺酶的制备和评价2-1.转谷氨酰胺酶的制备对于米曲霉的推定tgase蛋白,作为3
×
ha-6his标签融合蛋白表达/纯化,以酪蛋白的聚合为指标测定转谷氨酰胺酶活性。以rib40的基因组dna为模板,用设计成在c末端融合3
×
ha-6his标签的引物来扩增ao090023000250的orf。使用in-fusion hd cloning kit,将扩增的dna片段与用smai切断的put-nan载体(katayama et al.appl environ microbiol 85:1-16,2019)融合。将制作的质粒用noti切断,通过同源重组导入ns1d1株的niad基因座。
[0070]
将3
×
ha-6his标签融合蛋白的表达株接种于dpy液体培养基(0.5%yeast extract、1% hipolypeptone、2%dextrin、0.5% kh2po4、0.05%mgso4·
7h2o)中,在30℃下培养18小时。回收培养后的菌体,用液氮冷冻并破碎。添加提取缓冲液(50mm tris-hcl(ph8.0)、200mm nacl、1mm pmsf),并悬浮菌体破碎粉末。将悬浮液在冰上保持10分钟后,通过离心分离得到上清。3
×
ha-6his标签融合蛋白使用ni-nta purification system(thermo fisher scientific、waltham、ma)进行纯化,将通过咪唑溶出的组分通过超滤离心进行透析/浓缩。
[0071]
2-2.转谷氨酰胺酶的评价将5~10μl的酶溶液(纯化或未纯化的3
×
ha-6his标签融合蛋白溶液)与10μl的10%n,n-二甲基化酪蛋白溶液、35μl的反应缓冲液(50mm hepes(ph7.5)500mm nacl、10mm cacl2、1mm dtt)混合,在30℃下反应2小时。将反应后的样品用sds-page泳动,通过考马斯亮蓝染色分析酪蛋白的聚合。图5显示在纯化或未纯化的3
×
ha-6his标签融合蛋白的存在下发生酪蛋白的聚合。在不存在纯化或未纯化的3
×
ha-6his标签融合蛋白的情况下,在约30kda左右发现了单体型酪蛋白的条带,与此相对,在存在纯化或未纯化的3
×
ha-6his标签融合蛋白的情况下,观察到酪蛋白的聚合。由以上结果可知,ao090023000250具有转谷氨酰胺酶活性。
[0072]
3.使用5-fitc尸胺的转谷氨酰胺酶活性的观察5-fitc尸胺是用于检测转谷氨酰胺酶活性的荧光底物。由于尸胺被荧光物质fitc标记,因此不使用其他荧光探针就能够检测交联产物。具体的实验方法如下。将上述制作的ao090023000250破坏株和野生株(nsp1d1株)的分生孢子接种到薄薄地铺展在玻璃底皿上的50μl的dpy琼脂培养基上,培养16小时。将菌落用50μl的20μm 5-fitc尸胺(anaspec,usa)溶液在室温下轻轻振荡15分钟的同时进行处理。接着,用1ml的灭菌水洗涤菌落,除去灭菌水。然后,进行低渗透压冲击实验,利用荧光显微镜观察与裂解的菌丝前端细胞相邻的隔膜孔的荧光。在各株中仅以防止裂解传播的菌丝为对象,求出在隔膜孔中确认到荧光的菌丝的比例。在各实验中,以10根菌丝为对象进行分析,进行3次独立的实验,算出在隔膜孔中确认到荧光的菌丝的比例的平均值。
[0073]
在与因低渗透压冲击而裂解的菌丝前端细胞相邻的隔膜孔中观察到示出转谷氨酰胺酶活性的绿色荧光。在野生株和ao090023000250破坏株中,仅以防止裂解传播的菌丝为对象,计数隔膜孔有无转谷氨酰胺酶活性。其结果是,在ao090023000250破坏株中,可以确认显示荧光的隔膜孔的减少(图6)。从以上的结果可以确认ao090023000250编码具有转谷氨酰胺酶活性的蛋白质。产业上的可利用性
[0074]
本发明的新型转谷氨酰胺酶是曲霉属菌来源,也适用于食品用途。另外,不限于食品,可以适用于各种用途。这样,本发明的用途广泛及其产业上的利用价值极高。
[0075]
本发明并不限定于上述发明的实施方式及实施例的说明。在不脱离权利要求书的记载,在本领域技术人员能够容易想到的范围内,各种变形方式也包含在本发明中。本说明书中明示的论文、公开专利公报及专利公报等的内容通过援用而引用其全部的内容。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1