确定细菌和制造纤维幅材的方法及其相关工具和用途与流程
1.本发明涉及确定细菌和/或制造纤维幅材(fibrous webs)的领域。具体地,本发明涉及用于确定纤维素纤维混悬液、用于纤维幅材生产方法的生产用水、纤维幅材或用于生产纤维幅材的机器中属于thermicanaceae科的细菌以及可选地控制所述细菌的方法,和用于确定样品中属于thermicanaceae科的细菌的方法。另外,本发明涉及制造纤维幅材的方法。本发明还涉及用于确定属于thermicanaceae科的细菌的特异性引物、引物对、探针和试剂盒及其用途。此外,本发明涉及一种或多种杀生物剂和/或一种或多种酶抑制剂用于控制属于thermicanaceae科的细菌的用途和控制所述细菌的系统。
背景技术:
2.在造纸厂或纸板厂中,高微生物生长和不良操作条件可以存在问题。例如,微生物产酸导致在所生产的纸或板中产生气味,并且此外在纸或板的生产过程中ph的降低可以导致高电导率,从而干扰造纸化学品的性能并且降低机器生产能力。与其他微生物相比,一些特定微生物可以在非常特定的过程、过程步骤或特定的操作条件下引起更多问题,并因此所述特定微生物的确定和可选的控制是获得顺利且成本有效的方法的极其重要的工具。
3.例如,专利公开wo 2016/168430 a1描述了预测在水处理系统中引起问题的微生物的方法。所述方法包括(例如)测量所述系统的至少一部分中的整体微生物群体并相对于所述整体微生物群体测量微生物群体的至少一种亚群的量。
4.但仍然,对于可以用作纸或板制造过程或它们的任何过程步骤的简单、有效且快速控制的智能目标的鉴定和检测造成特定问题的微生物,例如,特定细菌的需求仍明显未满足。事实上,在纸和板行业领域中需要更有效的靶向控制措施。
技术实现要素:
5.本发明可以克服现有技术缺陷,其包括但不限于对造纸厂或纸板厂的特异、有害的微生物的认识以及用于确定或控制所述微生物的特异性工具的缺乏。本发明公开的发明人意外地能够识别纸和板的过程或机器中的特异性主要腐败细菌。所述特异性细菌可以是非常大量的,具有成问题的代谢能力和/或通过发酵引起酸的产生。
6.本发明公开的发明人现已开发了用于对特异的造成问题的细菌检测和计数的快速、有效且特异的方法和工具。所述用于确定特异性污染物的工具可以直接用于过程样品。本发明提供了用于属于特定科、属或单一细菌菌种的细菌的确定和/或定量的工具,如引物和探针。事实上,本发明公开的发明人已克服了开发检测细菌目标组的所有目标变体,但是区分所述目标组以外即使最近缘的细菌的方法的巨大困难。
7.可以通过使用特定方法步骤来实现本发明的目标,即用于监测或控制纤维幅材制造过程的方法和工具,所述方法步骤包括在所述制造过程或它们的任何步骤期间测量或确定属于thermicanaceae科的细菌。
8.令人惊讶地,属于thermicanaceae科的细菌可以大量存在于纸或板的制造过程中
并且导致不希望的操作条件或最终产品质量的扰动。在确定属于thermicanaceae科的细菌后,可以通过利用一种或多种杀生物剂和/或一种或多种酶抑制剂控制所述细菌。
9.此外,本发明公开的发明人目前显示当操作条件变差时(例如,高电导率和/或低orp),在相同造纸机或纸板机中属于thermicanaceae科的细菌在百分比(相对丰度)和数目(绝对丰度)两者中更普遍。因此,属于thermicanaceae科的细菌可以用作过程健康性的指示。
10.本发明使得有可能在生产纤维幅材时确定和/或降低一个或多个步骤中属于thermicanaceae科的细菌,当需要时所述细菌可以以特定方式降低或降低至非常具体的水平。
11.事实上,本发明提供了用于监测和控制纤维幅材生产的简单且成本有效的工业规模方法和工具。此外,通过控制方法,可以优化用于处理纤维素纤维混悬液或纤维幅材生产方法的生产用水的所使用的杀生物组合物和/或酶抑制剂的量,并因此可以避免杀生物剂和/或酶抑制剂的过量使用。改善的卫生情况和低化学负荷还降低了水消耗并且允许封闭的水循环过程且不会提高维护中断(maintenance break)和最终产品质量缺陷的风险。
12.在现有技术中,尚未在纸或板的生产过程中监测和/或控制属于thermicanaceae科的细菌。因此,本发明的目标是提供在纤维幅材生产方法期间,有效且特异性监测属于thermicanaceae科的细菌的工具和方法。
13.本发明涉及确定纤维素纤维混悬液、用于纤维幅材生产方法的生产用水、纤维幅材或生产纤维幅材的机器中属于thermicanaceae科的细菌和控制所述细菌的方法,其中所述方法包括:
14.确定纤维素纤维混悬液、用于纤维幅材生产方法的生产用水、纤维幅材或生产纤维幅材的机器中属于thermicanaceae科的细菌,和
15.通过用一种或多种杀生物剂和/或一种或多种酶抑制剂处理纤维素纤维混悬液或用于纤维幅材生产方法的生产用水一次或多次来控制属于thermicanaceae科的细菌。
16.另外,本发明涉及用于确定样品中属于thermicanaceae科的细菌的方法,其中所述方法包括使能够特异性杂交属于thermicanaceae科的细菌的多核苷酸的引物或探针与所述样品的多核苷酸杂交,并借此确定所述样品中细菌的存在或不存在或者属于thermicanaceae科的细菌的水平。
17.另外,本发明涉及制造纤维幅材,如纸张、纸板、棉纸等的方法,其中所述方法包括:
18.—从一种或多种原材料流和/或生产用水形成包含纤维素纤维的水性纤维混悬液,
19.—确定水性纤维素纤维混悬液、原材料流、生产用水、纤维幅材和/或生产纤维幅材的机器的属于thermicanaceae科的细菌,
20.—可选地通过用一种或多种杀生物剂和/或一种或多种酶抑制剂处理所述水性纤维素纤维混悬液或生产用水一次或多次来控制属于thermicanaceae科的细菌,
21.—将所述水性纤维素纤维混悬液形成纤维幅材并干燥所述纤维幅材
22.仍然,本发明涉及用于确定样品中所述细菌的能够与属于thermicanaceae科的细菌的rrna基因或其rrna多核苷酸特异性杂交的thermicanacae特异性引物或探针。
23.仍然,本发明涉及用于确定样品中所述细菌的能够与属于thermicanaceae科的细菌的rrna基因或其rrna多核苷酸特异性杂交的包含两个引物的thermicanacae特异性引物对。
24.仍然,本发明涉及用于确定样品中属于thermicanaceae科的细菌的thermicanacae特异性试剂盒,其中所述试剂盒包含本发明所述的引物、探针或引物对和可选地用于确定所述属于thermicanaceae科的细菌的试剂。
25.此外,本发明涉及本发明所述的引物、探针、引物对或试剂盒用于确定纤维素纤维混悬液、用于纤维幅材生产方法的生产用水、纤维幅材或用于生产纤维幅材的机器中属于thermicanaceae科的细菌存在、不存在或水平的用途。
26.此外,本发明涉及一种或多种杀生物剂和/或一种或多种酶抑制剂用于控制纤维素纤维混悬液或用于纤维幅材生产方法的生产用水中属于thermicanaceae科的细菌的用途。
27.此外,本发明涉及控制纤维素纤维混悬液或用于纤维幅材生产方法的生产用水中属于thermicanaceae科的细菌的系统,其中所述系统包含一种或多种杀生物剂和/或一种或多种酶抑制剂以及本发明所述的引物、探针、引物对或试剂盒。
28.根据以下附图、具体实施方式和实施例,本发明的其他目标、细节和优势将变得显而易见。
附图说明
29.图1显示了使用新的特异性引物通过qpcr测定对热杆菌的定量(y轴)相对于通过下一代测序(ngs)的定量(热杆菌%)乘以来源于总dna得率(图a)或来源于细菌qpcr(图b)的总原核细胞计数(x轴)。所有轴上的量是单位体积造纸过程样品的热杆菌基因组的拷贝数。
30.序列表
31.seq id no:1显示了16s rrna基因,(et-5b株)aj242495.1的多核苷酸序列。
32.seq id no:2显示了能够结合rrna基因(例如,如seq id no:1所示)或者属于热杆菌属的细菌(例如,thermicanus aegyptius)的rrna多核苷酸的正向引物的多核苷酸序列。
33.seq id no:3显示了能够结合rrna基因(例如,如seq id no:1所示)或者属于热杆菌属的细菌(例如,thermicanus aegyptius)的rrna多核苷酸的反向引物的多核苷酸序列。
具体实施方式
34.本发明涉及监测或确定纤维素纤维混悬液、用于纤维幅材生产方法的生产用水、纤维幅材或用于生产纤维幅材的机器中属于thermicanaceae科的细菌和可选地控制所述细菌的方法。事实上,本发明公开的发明人现已发现属于知之甚少的thermicanaceae科的细菌在纸和板的制造过程中非常丰富,并且可以控制所述细菌以获得更有效的方法并甚至获得改善的最终产品。
35.纤维素纤维可以是通过任何已知的制浆方法获得的原生纤维和/或它们可以是再循环纤维和/或它们可以来源于损纸。例如,纤维储料可以包括通过机械制浆、化学制浆、化学热磨机械制浆或者通过再循环或回收纤维的再制浆获得的纤维素纤维。所述纤维素纤维
可以是精制或非精制的,漂白或未漂白的。所述纤维素纤维可以是再循环的未漂白或漂白的牛皮纸浆纤维、硬木半化学纸浆纤维、草浆纤维或它们的任何混合物。在本发明的一个实施方式中,所述纤维素纤维混悬液包含再循环纤维或者所述纤维素纤维混悬液的纤维是再循环纤维。在另一个实施方式中,所述纤维混悬液包含来自损纸的纤维或者所述混悬液的纤维来自损纸。在一个实施方式中,所述纤维素纤维混悬液是水性纤维素纤维混悬液,例如,由纤维素或木质纤维素纤维、可选的造纸添加剂和水形成。
36.可以通过将两种或更多种原材料流(至少一种材料流包含来自一种或不同来源的纤维素纤维)和/或清水和/或循环生产用水合并来形成所述水性纤维素纤维混悬液。所述水性纤维混悬液可以含有在纸浆和造纸中使用的一种或几种已知的化学添加剂。
37.如本文所使用的,“用于生产纤维幅材的机器”包括但不限于使用含任何纤维素的材料,如再循环纤维(rcf)的所有纸张、棉纸和板(如盒纸板、折叠箱纸板、液体包装板、饮食行业板、挂面纸板、瓦楞纸或芯板)的机器或系统。例如,所述机器包括使用rcf以及任何纸张等级的损纸系统和湿浆板(wet-lap)系统的机器。在一个实施方式中,这些机器的特征包括但不限于它们使用包含纤维素和淀粉的材料。
38.在本发明所述方法的一个实施方式中,所述纤维素纤维混悬液或生产用水的温度为至少40℃、45℃、50℃、55℃、60℃、65℃、70℃、75℃或80℃,通常45-65℃;或者使用所述纤维素纤维混悬液、生产用水或用于生产纤维幅材的机器的过程的温度为至少40℃、45℃、50℃、55℃、60℃、65℃、70℃、75℃或80℃,通常45-65℃。
39.在本发明的方法中,确定了纤维素纤维混悬液、用于纤维幅材生产方法的生产用水、纤维幅材或用于生产纤维幅材的机器中属于thermicanaceae科的细菌,并且可选地通过用一种或多种杀生物剂和/或一种或多种酶抑制剂处理所述纤维素纤维混悬液或生产用水一次或多次来控制所述细菌。
40.如本文所使用的“属于thermicanaceae科的细菌”是指属于thermicanaceae科的任何细菌,可选地根据silva v.138分类学或者gtdb基因组分类学数据库04-rs89发行版(2019年6月19日)分类学,和/或涉及属芽孢杆菌(bacillales)科x.分类位置未定(x.incertae sedis)的任何细菌,可选地根据bergey's manual of systematic bacteriology,第2版,和silva v.132分类学。事实上,通过本发明,有可能确定通常属于thermicanaceae科的细菌或者所述科(例如,热杆菌)内的属或者特定的细菌(例如,thermicanus aegyptius)。在一个实施方式中,所述细菌属于热杆菌属或者为t.aegyptius。在一个实施方式中,属于thermicanaceae科或热杆菌属的细菌不是粘液形成细菌。
41.在一个实施方式中,本发明的方法包括确定属于thermicanaceae科的细菌的潜力、存在、不存在、量、水平或特定的属或种。可以将化学或生物技术领域中已知的任何方法或工具用于检测所述细菌。例如,可以在本发明中使用任何微生物学方法、群落指纹技术,包括dgge、t-rflp和lh-pcr、maldi、maldi-tof、质谱和/或与所述细菌有关的分子、有机分子、多核苷酸、多肽、抗体、酶、激素、分泌或活性的任何测量。适合于本发明的检测或测量可以直接或间接显示细菌。如本文所使用的“间接”检测或测量包括但不限于显示属于thermicanaceae科的潜在细菌的那些。例如,当从样品检测到与所述细菌有关的特异性分子、有机分子、多核苷酸、多肽、抗体、酶、激素、分泌或活性时,可以间接确定所述样品中所
述细菌的存在。
42.在一个实施方式中,通过分子方法、基于核酸的方法或者通过使用一种或多种引物和/或探针确定所述细菌的存在、不存在或水平。基于rna和/或dna的方法是适合于本发明的分子方法或核酸方法并且包括但不限于杂交方法(例如,dna或rna印迹、狭缝/斑点印迹、集落印迹、荧光原位杂交、微阵列)、pcr方法(例如,qpcr、rt-pcr、qrt-pcr、多路-pcr、数字pcr、集落pcr)和测序方法(例如,基础克隆和sanger测序方法、下一代测序、高通量测序)。分子方法或基于核酸的方法还可以与生物技术领域中已知的任何其他方法组合。例如,在具体的实施方式中,本发明的方法还可以包括微生物学方法,如在特定生长培养基上培养细菌。
43.在一个实施方式中,本发明的方法包括使得能够与细菌的dna或rna杂交的引物或探针接触或与样品的dna或rna或者得自所述样品的dna或rna杂交,例如,在严格杂交条件下杂交。
44.本发明还涉及用于确定样品中属于thermicanaceae科的细菌的方法,其中所述方法包括使能够特异性杂交属于thermicanaceae科的细菌的多核苷酸的引物或探针与所述样品的多核苷酸杂交,例如,在严格杂交条件下杂交。
45.在本发明的一个实施方式中,用于监测或确定细菌的方法包括或者为聚合酶链反应(pcr)或定量pcr(qpcr)。明显地,将反转录酶pcr用于rna多核苷酸的聚合反应(rt-pcr;rt-qpcr)。
46.在一个实施方式中,在允许引物或探针与靶标核苷酸序列之间特异性结合(即特异性杂交)的严格条件下进行本发明或者用于本发明所述方法的引物或探针的杂交。这类用于杂交的严格条件是序列依赖性的并且基于环境参数改变。
47.在具体的实施方式中,所述严格条件是极严格条件。例如,严格或极严格杂交条件可以包括温度50-80℃(如55-75℃,59-70℃或59-63℃,例如,60℃、61℃或62℃)至少10-30秒(例如,至少15秒),或者至少一分钟或更长时间,例如,一次或多次,如在pcr反应,如qpcr反应的退火步骤期间的情况。在一个实施方式中,可以在pcr或qpcr反应中使用pcr或qpcr master mix,例如,具有2.2mm mg
2+
(50mm盐),可选地以及sybr green。
48.特异性(例如,1、2、3个或更多个)鉴定序列具有非常特异的化学特性,并因此对于本发明公开的发明人来说,开发检测细菌,如具有特定更高的分类学水平,即属于thermicanaceae科或热杆菌属的那些细菌的工具是非常困难的。
49.在本发明的方法、引物、探针、引物对或试剂盒的一个实施方式中,一种或多种引物或探针能够与属于热杆菌属的细菌的rrna基因或rrna多核苷酸杂交。核糖体rna基因是多核苷酸(dna)编码rrna,它是一类非编码rna。rrna结合至核糖体蛋白以形成用于蛋白质合成的小和大核糖体亚基。在一个实施方式中,rrna基因或其rrna多核苷酸是16s rrna基因或其rrna。
50.本发明还涉及用于确定样品中所述细菌的能够与属于thermicanaceae科的细菌的rrna基因或其rrna多核苷酸杂交的引物或探针,或者包含两个引物的引物对。本发明用于确定样品中属于thermicanaceae科的细菌的试剂盒包括本发明的引物、探针或引物对。在一个实施方式中,所述细菌属于热杆菌属。
51.在本发明的方法或工具中使用的所述引物或探针(即dna或rna的片段,或dna或
rna的化学修饰的片段,如锁核酸、lna)可以具有任何适合的长度,可选地,能够在严格条件下杂交的长度。例如,所述引物或探针可以具有至少15个核苷酸,例如,18-50个核苷酸、18-40个核苷酸、18-30个核苷酸、18-25个核苷酸、19-24个核苷酸、20-23个核苷酸或20-22个核苷酸的长度。在一些实施方式中,探针可以是至少50nt长,例如,100-10000个碱基长。可以可选地将化学修饰的或未修饰的引物或探针标记用于检测。
52.在本发明的方法、引物、探针、引物对或试剂盒的一个实施方式中,一个或多个引物或探针能够可选地在seq id no:1内,例如,在核苷酸400-1000、600-900或638-873内(如seq id no:1中所编号的)杂交(例如,能够特异性杂交)。seq id no:1显示了thermicanus aegyptius 16s rrna基因的多核苷酸序列。
53.在所述方法、引物、探针、引物对或试剂盒的一个实施方式中,所述引物用于聚合酶链反应(pcr)或定量pcr。在一个实施方式中,所述引物或探针包含seq id no:2或者seq id no:3中所提供的序列,或者所述引物对包含含有seq id no:2中所提供的序列的第一引物和包含seq id no:3中所提供的序列的第二引物。在一个实施方式中,包含seq id no:2和/或seq id no:3中所提供的序列的引物、探针或引物对用于rrna基因或其rrna多核苷酸的特异性结合。在一个实施方式中,本发明所述的引物或探针,例如,如seq id no:2和/或3中所提供的引物或探针很好地覆盖了当前的thermicanaceae或热杆菌(thermicanus)序列,例如,rcf thermicanaceae或热杆菌。
54.在一个实施方式中,引物或探针的特异性结合或杂交是指与属于thermicanaceae科、热杆菌属或者thermicanaceae或热杆菌内的种(如t.aegyptius)的细菌的dna或rna(如rrna基因或其rrna多核苷酸,例如,16s rrna基因或其rrna)的特异性结合或杂交,并因此不表示分别属于thermicanaceae以外的科,热杆菌以外的属或者thermicanaceae或热杆菌以外的物种(如t.aegyptius)的细菌的dna或rna。事实上,在一个实施方式中,所述引物或探针是thermicanaceae、热杆菌或t.aegyptius特异性引物或探针。
55.在一个实施方式中,所述引物、探针或试剂盒用于本发明的任何方法。本发明的方法、引物、探针、引物对或试剂盒可以用于确定纤维素纤维混悬液、用于纤维幅材生产方法的生产用水、纤维幅材或用于生产纤维幅材的机器中属于thermicanaceae科的细菌的存在、不存在或水平。
56.在一个实施方式中,本发明的方法或试剂盒包含用于检测属于thermicanaceae科的2、3、4、5或更多种细菌(例如,所述细菌可以属于该科内不同的属或者属于相同的属)的引物和/或探针。在具体的实施方式中,本发明的方法或试剂盒还包含用于检测属于thermicanaceae以外的科(包括但不限于,例如,蛋白菌门和/或异常球(deinococcus)-栖热菌(thermus)门内的任何科)、热杆菌以外的属和/或thermicanus aegyptius以外的种的细菌的一种或多种其他引物和/或探针。
57.除包含本发明的引物、探针或引物对外,用于确定thermicanaceae细菌的试剂盒可选地包含用于确定所述细菌的试剂。适合的试剂包括但不限于反应溶液(例如,用于杂交、pcr或基于测序的反应或方法的溶液)、清洗溶液、缓冲剂和/或酶。在一个实施方式中,用于确定thermicanaceae细菌的其他工具包括但不限于选自标记、着色剂和/或抗体或抗原结合片段的检测方式。本发明的方法或试剂盒的检测方式可以是任何常规检测方式,其包括但不限于例如比色或荧光检测方式。
58.可选地,本发明的试剂盒或方法还可以包括与之有关的任何适合的统计方法、工具和/或说明书的使用。
59.在一个实施方式中,所述试剂盒还包括确定thermicanaceae细菌的说明。所述说明可以包括但不限于选自下列的说明:用于实施确定thermicanaceae细菌的方法的说明、用于实施基于杂交、pcr或测序的方法的说明、基于杂交、pcr或测序的反应的条件、用于检测得自基于杂交、pcr或测序的反应的产物的说明和解释结果的说明。
60.在具体的实施方式中,所述试剂盒还包含一种或多种对照样品。一种或多种对照样品可以(例如)选自包含thermicanaceae细菌或所述细菌的任何细胞成分的样品,例如,其通过细胞培养产生或合成产生、thermicanaceae细菌或其细胞成分的特定水平、缺乏thermicanaceae细菌的样品或它们的任何组合。
61.本发明能够检测来自任何样品,包括但不限于例如来自造纸厂或纸板厂的过程样品的属于thermicanaceae科的细菌。本发明公开意外地显示属于thermicanaceae科的细菌可以用作制造纤维幅材时的操作条件的指示。所述细菌的存在、不存在、水平、升高或降低可以用于估计操作条件。在本发明所述方法的一个实施方式中,所述细菌的不存在、降低或低水平或者低于预定值的水平指示了生产纤维幅材的优良操作条件;水性纤维素纤维混悬液的降低的或低导电率;水性纤维素纤维混悬液提高的或高ph;水性纤维素纤维混悬液的提高的或高氧化还原电位(orp)值;和/或(水性)纤维素纤维混悬液的纤维素和/或淀粉的降低的或低降解作用。在一个实施方式中,所述细菌的存在、提高的或高水平或者高于预定值的水平指示了生产纤维幅材的不良操作条件;水性纤维素纤维混悬液的提高的或高导电率;水性纤维素纤维混悬液降低的或低ph;水性纤维素纤维混悬液的降低的或低orp值;和/或(水性)纤维素纤维混悬液的纤维素和/或淀粉的提高的或高降解作用。因此,在本发明的方法、引物、探针、引物对或试剂盒的一个实施方式中,所述引物、引物对、探针或试剂盒用于指示生产纤维幅材的操作条件、水性纤维素纤维混悬液的电导率或ph、水性纤维素纤维混悬液的orp和/或(水性)纤维素纤维混悬液的纤维素和/或淀粉的降解作用。
62.在所述方法中使用或用于本发明的引物、探针、引物对或试剂盒的用于确定细菌的样品可以是任何样品,例如,固体或液体样品,例如,含水样品,优选地,包含基因材料的样品。所述样品可以得自任何纤维幅材,制造所述纤维幅材的机器或系统或者来自制造纤维幅材、纸或板的任何方法步骤。在一个实施方式中,样品中存在高淀粉含量。在一个实施方式中,所述样品是rcf或rcf过程样品。在一个实施方式中,从得自纤维素纤维混悬液(例如,得自中间产物停留实体)、用于纤维幅材生产方法的生产用水(例如,白水)、纤维幅材或者用于生产纤维幅材的机器的样品确定属于thermicanaceae科的细菌。在一个实施方式中,用于确定细菌的样品是(来自)纤维素纤维混悬液、用于纤维幅材生产方法的生产用水、纤维幅材或者用于生产纤维幅材的方法或机器。要确定的样品可以来自中间产物停留实体。
63.在一些实施方式中,本发明涉及纤维幅材生产方法、机器或其部件,并且包括但不限于所有纸张、棉纸或纸板生产系统以及中间产物停留实体(如贮浆塔、损纸塔(broke tower)、纤维混悬液塔)和生产用水容器。水性纤维素纤维混悬液由一些原材料流,通常多种原材料流,如水流和包含纤维素纤维的多种纸浆流形成。将原材料流合并在一起并形成进料至中间产物停留实体的水性纤维混悬液。可以在生产纤维幅材的任何步骤中确定纤维
混悬液、生产用水、纤维幅材或用于生产纤维幅材的机器的属于thermicanaceae科的细菌。在一个实施方式中,在中间产物停留实体的入口之前、在中间产物停留实体中和/或在中间产物停留实体的出口之后确定属于thermicanaceae科的细菌。因此,可以将(例如)中间产物停留实体中所测量的thermicanaceae水平控制或调节至(例如)所述中间产物停留实体中和/或在所述中间产物停留实体出口之后所期望的水平。所述中间产物停留实体可以是任何纸浆、水、损纸储存塔或罐或相应实体。在一个实施方式中,在贮浆塔、储浆罐、水槽、损纸储存塔和/或损纸储存罐之前、中或之后,或者从在贮浆塔、储浆罐、水槽、损纸储存塔和/或损纸储存罐之前、来自它们或在它们之后所获得的样品确定thermicanaceae细菌。根据本发明的一个实施方式,用于制造纤维幅材的方法或系统包括串联布置的多个中间产物停留实体,如纸浆、水或损纸储存塔或罐或相应实体或它们的任何
64.组合。
65.所述中间产物停留实体可以在幅材形成之前具有至少一小时,优选地至少两小时的延迟时间。在本文中,延迟时间应被理解为中间产物停留实体中的平均停留时间(例如,对于水或水性纤维素纤维混悬液)。所述中间产物停留实体可以具有在1-48h、1-24h、1-12h、通常1-8h、更通常2-7h的范围内的延迟时间。在一个实施方式中,要确定的水性纤维素纤维混悬液以1-48小时、1-24小时、1-12小时,通常至少1小时或2小时,例如,至少3、4、5、6、7、8、9、10或11小时的延迟时间处于或来自中间产物停留实体。通常,所述中间产物停留实体中水性纤维素纤维混悬液的浓度为至少2g/l,通常在10-150g/l的范围内。
66.在本发明的一个实施方式中,(例如,从样品)确定属于thermicanaceae科的细菌并与预定水平相比较。在一个实施方式中,所述细菌的预定水平为约、大于或小于1
×
104、1
×
105、1
×
106、1
×
107、1
×
108、1
×
109或1
×
10
10
个细菌每ml所述纤维混悬液、生产用水或纤维幅材;和/或所述预定细菌水平为纤维混悬液、生产用水、纤维幅材或用于生产纤维幅材的机器中总细菌的0-5%、0-10%、0-15%、0-20%、0-25%、0-30%、0-35%、0-40%、0-45%、0-50%、0-55%或0-60%。
67.在一个实施方式中,本发明的方法包括通过用一种或多种杀生物剂和/或一种或多种酶抑制剂处理纤维素纤维混悬液或用于纤维幅材生产方法的生产用水一次或多次来控制属于thermicanaceae科的细菌。
68.如果所述细菌所确定的水平(例如)不存在、低或低于预定值,则无需调整或控制thermicanaceae细菌。然而,如果(例如)基于其他参数,认为有利或甚至必需,则可以进行调整。事实上,在确定thermicanaceae细菌(第一确定)后,如果需要,可以通过使用一种或多种杀生物剂和/或一种或多种酶抑制剂维持或调整(降低或提高)一次或多次来控制所述细菌。
69.在确定thermicanaceae细菌后,如果需要,可以通过一种或多种杀生物剂和/或一种或多种酶抑制剂维持、升高或降低所述细菌(例如,水平、值、%值、绝对值、比例或活性)以获得所期望的最终的thermicanaceae细菌水平、值或活性。例如,一种或多种杀生物剂和/或一种或多种酶抑制剂可以用于维持其中thermicanaceae细菌的量或比例在无所述杀生物剂和/或酶抑制剂的情况下将提高的情况下thermicanaceae细菌的量、绝对量或比例。另一方面,仅少量的一种或多种杀生物剂和/或酶抑制剂可以导致thermicanaceae细菌一定程度的升高。在一个实施方式中,将一种或多种杀生物剂和/或酶抑制剂用于降低
thermicanaceae细菌的水平或比例。此外,thermicanaceae细菌的控制包括当不需要它们时,不使用一种或多种杀生物剂和/或酶抑制剂的选择。可以确定杀生物剂和/或酶抑制剂处理的纤维混悬液或生产用水的thermicanaceae细菌一次或多次以用于确认thermicanaceae细菌所期望的所获得的水平、值、比例或活性。可能需要一种或多种杀生物剂和/或酶抑制剂处理或处理步骤以获得所期望的thermicanaceae细菌水平、值、比例或活性。事实上,可以可选地确定第二、第三或更多个和/或最终的thermicanaceae细菌水平、值、比例或活性以评价一种或多种杀生物剂和/或酶抑制剂处理的作用或进一步处理的需要。在一个实施方式中,使用了通过确定thermicanaceae细菌,例如,以连续或反复方式确定thermicanaceae细菌的连续监测,和可选地通过杀生物剂和/或酶抑制剂的剂量施用的过程控制。
70.所确定的(第一或可选的第二、第三或更多个或最终)纤维混悬液或生产用水的thermicanaceae细菌水平、值、比例或活性可以用于控制任何过程步骤或系统中,例如,在中间产物停留实体入口之前、在中间产物停留实体中和/或在中间产物停留实体(如贮浆塔和/或损纸储存塔)出口之后,但是例如,在水性纤维混悬液离开流浆箱等并形成幅材之前的thermicanaceae细菌(例如,水平、值、比例或活性)。
71.在一个实施方式中,如果在两次或更多次确定后认为所确定的thermicanaceae细菌水平、值、比例或活性过高或具有升高趋势,则通过用一种或多种杀生物剂和/或酶抑制剂处理所述纤维素纤维混悬液或生产用水一次或多次来控制(例如,维持、升高或降低)thermicanaceae细菌。在具体的实施方式中,如果所确定的thermicanaceae细菌高于预定值,则通过用杀生物剂和/或酶抑制剂处理所述纤维素纤维混悬液或生产用水一次或多次来控制thermicanaceae细菌。可以将至少一种杀生物剂和/或酶抑制剂应用于水性纤维素纤维混悬液、至少一种原材料流和/或生产用水。例如,可以将一种或多种杀生物剂和/或酶抑制剂(可选地与其他化学品或试剂一起)添加至损纸系统、一个或多个损纸储存塔、一个或多个损纸储存罐、纸浆、一个或多个贮浆塔、一个或多个贮浆罐、进入打浆机或任何储罐的水、一个或多个水槽和/或损纸储存罐或贮浆罐之前的管路中。事实上,例如可以在损纸系统、损纸储存塔、损纸储存罐、纸浆、贮浆塔和/或贮浆罐中,用一种或多种杀生物剂和/或酶抑制剂处理所述水性纤维素纤维混悬液。可以用一种或多种杀生物剂和/或酶抑制剂处理生产用水,例如,当进入打浆机或任何储罐,在水槽中和/或在损纸储存罐或贮浆罐之前的管路中时。在一个实施方式中,可选地与其他一种或多种试剂一起,用一种或多种杀生物剂和/或酶抑制剂改变thermicanaceae细菌水平或值。例如,可以降低thermicanaceae细菌的数目、水平、比例或值或者可以消除所述细菌。如果杀生物剂和/或酶抑制剂不用于控制thermicanaceae细菌,则可以在纤维幅材制造方法期间保持或升高所述细菌。
72.在一个实施方式中,如果所确定的属于thermicanaceae科的细菌是丰富的,例如,所述细菌水平较高(例如,高于预定值)或估计会升高(例如,高于预定值),则可以将所述细菌控制在特定水平(例如,低于所述预定值),例如,控制在0-1
×
104、0-1
×
105、0-1
×
106、0-1
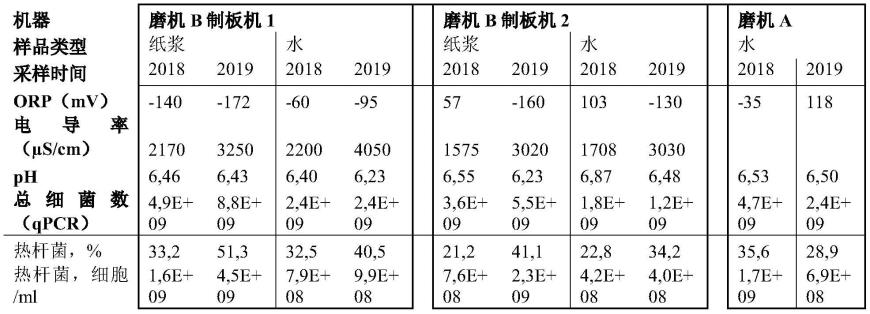
×
107、0-1
×
108、0-1
×
109或0-1
×
10
10
个细菌每ml纤维混悬液或生产用水,和/或控制在纤维混悬液或生产用水中总细菌(每ml纤维混悬液或生产用水中的细菌)的0-5%、0-6%、0-7%、0-8%、0-9%、0-10%、0-15%、0-20%、0-25%、0-30%、0-35%、0-40%、0-45%、0-50%、0-55%或0-60%的水平。可以通过本领域技术人员已知的任何适合的方法或方法的
组合测量本发明的总细菌,所述方法包括但不限于测量好氧和厌氧可培养的细菌之和、使用一般细菌或原核引物的基于pcr的方法(例如,qpcr)、基于测序的方法(例如,ngs)、通过定量细菌基因组dna或者作为总细菌rrna(例如,16s rrna)基因序列的百分比对细菌生物量的估计。
73.在本发明的一个实施方式中,在确定属于thermicanaceae科的细菌后,通过将所述细菌水平降低至少5%、10%、20%、30%、40%、50%、60%、70%、80%、90%或100%(每ml纤维素纤维混悬液或生产用水中的细菌)来控制所述细菌。
74.可能需要一种或多种杀生物剂和/或酶抑制剂处理步骤以获得所期望的thermicanaceae水平。
75.在一个实施方式中,在本发明的方法或系统中使用一种或多种杀生物剂(单独或与一种或多种酶抑制剂和/或其他化学或生物化学试剂一起)控制thermicanaceae细菌或其活性。
76.在一个实施方式中,在本发明的方法或系统中用于控制细菌或其活性的一种或多种杀生物剂是或包含氧化杀生物剂和/或非氧化杀生物剂。在一个实施方式中,所述一种或多于一种杀生物剂是一种或多种非氧化杀生物剂,其选自:2,2-二溴-3-氮基丙酰胺(dbnpa);2-溴-2-硝基丙烷-1,3-二醇(bronopol);2-溴-2-硝基-丙-1-醇(bnp);2,2-二溴-2-氰基-n-(3-羟丙基)乙酰胺;2,2-二溴丙二酰胺;1,2-二溴-2,4-二氰基丁烷(dcb);双(三氯甲基)砜;2-溴-2-硝基苯乙烯(bns);二癸基-二甲基氯化铵(ddac);adbac及其他季铵化合物;3-碘代丙炔基-n-丁基氨甲酸酯(ipbc);甲基和二甲基-硫代氨基甲酸酯及其盐;5-氯-2-甲基-4-异噻唑啉-3-酮(cmit);2-甲基-4-异噻唑啉-3-酮(mit)以及它们的混合物;2-正辛基-4-异噻唑啉-3-酮(oit);4,5-二氯-2-(正辛基)-3(2h)-异噻唑酮(dcoit);4,5-二氯-1,2-二巯基-3-酮;1,2-苯并异噻唑啉-3-酮(bit);2-(硫氰基甲基硫基)苯并噻唑(tcmbt);2-甲基-1,2-苯并异噻唑啉-3(2h)-酮(mbit);四羟甲基硫酸磷鎓(thps);四氢-3,5-二甲基-2h-1,3,5-噻二嗪-2-硫酮(dazomet);亚甲基双硫氰酸酯(mbt);邻苯基苯酚(opp)及其盐;戊二醛;邻苯二甲醛(opa);胍和双胍;n-十二烷胺或n-十二烷基胍;十二烷胺盐或十二烷基胍盐,如十二烷基胍盐酸盐;双-(3-氨基丙基)十二烷胺;羟基吡啶硫酮,如吡啶硫酮锌;三嗪,如六氢-1,3,5-三甲基-1,3,5-三嗪;3-[(4-甲基苯基)磺酰基]-2-丙烯腈;3-苯基磺酰基-2-丙烯腈;3-[(4-三氟甲基苯基)磺酰]-2-丙烯腈;3-[(2,4,6-三甲基苯基)磺酰]-2-丙烯腈;3-(4-甲氧基苯基)磺酰-2-丙烯腈;3-[(4-甲基苯基)磺酰]丙-2-烯酰胺;和任何它们的异构体;及它们的任何组合;和/或
[0077]
所述一种或多于一种杀生物剂是一种或多种氧化杀生物剂,其选自:氯;碱金属和碱土金属的次氯酸盐;次氯酸;溴;碱金属和碱土金属的次溴酸盐;次溴酸;二氧化氯;臭氧;过氧化氢;过氧化合物,如过甲酸、过乙酸、过碳酸盐或过硫酸盐;卤化乙内酰脲,如单卤代二甲基乙内酰脲;二卤代二甲基乙内酰脲;全卤化乙内酰脲;一氯胺;一溴胺;二卤胺;三卤胺;与氧化剂反应的脲,所述氧化剂为,例如,碱金属和碱土金属的次氯酸盐或者碱金属和碱土金属的次溴酸盐;铵盐,例如,与氧化剂反应的溴化铵、硫酸铵或氨基甲酸铵,所述氧化剂优选地为碱金属和碱土金属的次氯酸盐或碱金属和碱土金属的次溴酸盐;及它们的任何组合。
[0078]
在一个实施方式中,在本发明的方法或系统中用于控制纤维素分解活性的杀生物
剂是或包含氧化杀生物剂和非氧化杀生物剂。在一个实施方式中,所述非氧化杀生物剂包括一种或多种杀生物剂,其选自:2,2-二溴-3-氮基丙酰胺(dbnpa);2-溴-2-硝基丙烷-1,3-二醇(溴硝丙二醇);5-氯-2-甲基-4-异噻唑啉-3-酮(cmit)、2-甲基-4-异噻唑啉-3-酮(mit)和它们的混合物;戊二醛;十二烷基胍盐酸盐;3-[(4-甲基苯基)磺酰基]-2-丙烯腈和任何它的异构体;及它们的任何组合;并且所述氧化杀生物剂选自:
[0079]
过甲酸、一氯胺、与次氯酸盐反应的铵盐、一氯二甲基乙内酰脲或一溴二甲基乙内酰脲;及它们的任何组合。
[0080]
在一个实施方式中,在本发明的方法或系统中用于控制纤维素分解活性的杀生物剂包括一种氧化杀生物剂,其选自:过甲酸、一氯胺、与次氯酸盐反应的铵盐、一氯二甲基乙内酰脲或一溴二甲基乙内酰脲,和两种或更多种非氧化杀生物剂,其选自:2,2-二溴-3-氮基丙酰胺(dbnpa);2-溴-2-硝基丙烷-1,3-二醇(溴硝丙二醇);5-氯-2-甲基-4-异噻唑啉-3-酮(cmit)、2-甲基-4-异噻唑啉-3-酮(mit)和它们的混合物;戊二醛;和十二烷基胍盐酸盐;3-[(4-甲基苯基)磺酰基]-2-丙烯腈和任何它的异构体;及它们的任何组合。
[0081]
要使用的杀生物剂的量取决于(例如)所使用的纤维混悬液或生产用水的类型、中间实体中的延迟时间、用于制造纤维幅材的方法的持续时间、清水使用程度、杀生物剂类型和/或杀生物剂处理次数。在一个实施方式中,用一种或多种杀生物剂处理所述纤维混悬液或生产用水。基于所述杀生物剂的活性化合物含量,所添加的杀生物剂浓度可以是(例如)约0.1-1000ppm、1-800ppm、3-500ppm、5-250ppm,例如,约10、50、100、150或200ppm。如本文所使用的,ppm表示每体积的活性化合物重量。在一个实施方式中,基于所述杀生物剂的活性成分,所添加的杀生物剂浓度可以是(例如)约0.1-1000mg/l、1-800mg/l、3-500mg/l、5-250mg/l,例如,约10、50、100、150或200mg/l。
[0082]
在一个实施方式中,在本发明的方法或系统中使用一种或多种酶抑制剂(单独或与一种或多种杀生物剂和/或其他化学或生物化学试剂一起)控制thermicanaceae细菌或其活性。这类酶抑制剂可以与氧化和/或非氧化杀生物剂组合使用。在一个实施方式中,所述酶抑制剂包含锌离子。
[0083]
在一个实施方式中,所述杀生物剂是一氯胺。在一个实施方式中,所述一氯胺与另一种氧化杀生物剂和/或一种或多种非氧化杀生物剂组合使用。在一个实施方式中,还使用一种或多种酶抑制剂。
[0084]
在一个实施方式中,锌离子来源于或者锌离子源选自无机或有机锌盐。例如,可以使用无机锌盐,因为它不会将碳引入制造过程,碳将是微生物可用的。另外,由于无机盐不是强酸或碱,因此它们对ph无任何直接影响。已显示锌在对环境无害的浓度中有效。此外,锌离子通常被认为是安全的,即使在用于人消费的应用中(美国:食品和药物管理局;gras物质数据库(scogs))。另外,锌是廉价的原材料。在一个实施方式中,锌离子来源于或者锌离子源选自:znbr2、zncl2、znf2、zn、zno、zn(oh)2、zns、znse、znte、zn3n2、zn3p2、zn3as、zn3sb2、zno2、znh2、znco3、zn(no3)2、zn(clo3)2、znso4、zn3(po4)2、znmoo4、zncro4、zn(aso2)2、zn(aso4)2、zn(o2cch3)2、锌金属及它们的任何组合。在具体的实施方式中,锌盐选自zncl2、znbr2和znso4及它们的任何组合,和在水溶液、如生产用水中具有高溶解度的其他盐。
[0085]
要使用的锌离子的量可以取决于(例如)所使用的纤维混悬液或生产用水、所述杀生物剂的类型和/或所述锌离子的类型。在一个实施方式中,用一种或多种锌离子源处理所
述纤维混悬液或生产用水。所添加的锌离子浓度可以是(例如)在所述水性纤维素纤维混悬液或生产用水中的约0.1-500ppm、1-400ppm、3-250ppm、5-100ppm,例如,约10、20、30、40、50、60、70、80或90ppm锌离子。在一个实施方式中,所添加的锌离子浓度可以是(例如)在要处理的水性纤维素纤维混悬液或生产用水中的约0.1-500mg/l、1-400mg/l、3-250mg/l、5-100mg/l,例如,约10、20、30、40、50、60、70、80或90mg/l的锌离子。
[0086]
在一个实施方式中,用一种或多种杀生物剂和一种或多种酶抑制剂(例如,所添加的锌离子,如一种或多种锌盐)的组合处理所述水性纤维素纤维混悬液或生产用水一次或多次。可以将杀生物剂和酶抑制剂同时(例如,作为预混合物或单独的制剂/产物)或连续添加至纤维素纤维混悬液或生产用水;可以在酶抑制剂添加前添加杀生物剂;和/或可以在杀生物剂添加前添加酶抑制剂。另外,有可能连续添加杀生物剂并间歇添加酶抑制剂,或者连续添加酶抑制剂并间歇添加杀生物剂。如果连续添加杀生物剂和酶抑制剂,则杀生物剂和酶抑制剂添加之间的时间可以是(例如)1秒-180分钟、1-60分钟、5-30分钟或者10-20分钟。
[0087]
在一个实施方式中,以约1:1至100:1,通常1:10至100:1,如1:20至20:1、1:10至10:1、1:5至20:1、1:5至5:1、1:2至5:1或者1:2至2:1的比例使用酶抑制剂(例如,锌离子)和杀生物剂。
[0088]
本发明还涉及制造纤维幅材,如纸张、纸板、棉纸等的方法,其中所述方法包括
[0089]
—从一种或多种原材料流和/或生产用水形成包含纤维素纤维的水性纤维混悬液,
[0090]
—确定水性纤维素纤维混悬液、原材料流、生产用水、纤维幅材和/或生产纤维幅材的机器的属于thermicanaceae科的细菌,
[0091]
—可选地通过用一种或多种杀生物剂和/或一种或多种酶抑制剂处理所述水性纤维素纤维混悬液或生产用水一次或多次来控制属于thermicanaceae科的细菌,
[0092]
—将所述水性纤维素纤维混悬液形成纤维幅材并干燥所述纤维幅材
[0093]
可以将所述水性纤维混悬液形成纤维幅材并以任何适合的方式(例如,通过加热和/或通过挤压除去液体或水)干燥。加热期间的温度可以为(例如)至少100℃,通常至少110℃,持续至少0.3min,例如,至少0.5min,有时至少1min。通过挤压除水期间的温度可以不同并且可以是(例如)至少rt,通常至少20℃、25℃、40℃、60℃、80℃或至少100℃。
[0094]
本发明还涉及一种或多种杀生物剂和/或一种或多种酶抑制剂用于控制纤维素纤维混悬液或用于纤维幅材生产方法的生产用水中属于thermicanaceae科的细菌的用途。例如,可以将杀生物剂和/或酶抑制剂应用于损纸系统、损纸储存塔、损纸储存罐、纸浆、贮浆塔、贮浆罐、进入打浆机或任何储罐的水,和/或损纸储存罐或贮浆罐之前的管路中。例如,所述杀生物剂和/或酶抑制剂可以作为预混物或作为单独或同时施用的单独的试剂使用。
[0095]
本发明用于控制属于thermicanaceae科的细菌的系统包括一种或多种杀生物剂和/或一种或多种酶抑制剂(作为一种或多种预混物或作为单独的试剂)和本发明的引物、探针、引物对或试剂盒。
[0096]
在一个实施方式中,本发明的系统还包括适合于确定和/或控制纤维素纤维混悬液、用于纤维幅材生产方法的生产用水、纤维幅材或用于生产纤维幅材的机器中的thermicanaceae细菌的工具、试剂和/或说明。适合的工具的非限制性实例包括(例如)用于采样的孔、管和工具。适合的试剂包括但不限于反应溶液(例如,用于基于杂交、pcr或测序
的反应或方法的溶液)、清洗溶液、缓冲剂和/或酶。在一个实施方式中,用于确定thermicanaceae细菌的其他工具包括但不限于选自标记、着色剂和/或抗体或抗原结合片段的检测方式。所述系统的检测方式可以是任何常规的检测方式,其包括但不限于,例如,比色或荧光检测方式。
[0097]
本发明用于控制细菌的系统可以包括用于确定样品中所述细菌的说明。例如,所述说明可以包括选自下列的说明:用于控制细菌(例如,当取样时,当需要和当不需要杀生物剂和/或酶抑制剂处理时,需要哪种类型的杀生物剂和/或酶抑制剂处理(类型、浓度、处理时间段等))的说明、用于实施确定特定细菌的方法的说明、用于采样的说明、用于解释结果的说明、用于实施统计分析的说明、一种或多种杀生物剂和/或酶抑制剂处理的说明和所述说明的任何组合。可选地,说明可以包括预定值或要控制的细菌水平。
[0098]
如在本发明公开中使用的,“多核苷酸”是指任何多核苷酸,如单链或双链dna(例如,基因组dna或cdna)或者rna(例如,mrna、rrna),其可选地包含编码所讨论的多肽或其保守序列变体的核酸序列。保守核苷酸序列变体(即核苷酸序列修饰,其不显著改变编码多肽的生物学性质)包括由遗传密码简并和由沉默突变所产生的变体。
[0099]
如在本发明公开中使用的,术语“多肽”和“蛋白”是可互换使用的以表示具有任何长度的氨基酸的聚合物。
[0100]
在本发明公开中,术语“微生物(micro-organism)”和“微生物(microbe)”是可互换使用的。
[0101]
对于本领域技术人员显而易见地,随着技术进步,可以通过多种方式实现本发明的概念。本发明及其实施方式不限于以下所描述的实施例,而是可以在权利要求的范围内改变。
[0102]
实施例
[0103]
实施例1:热杆菌是制板机过程样品中的新的细菌属
[0104]
采集自主要使用再循环纤维材料的机器的纸板过程样品(白水和纸浆)的基于全局下一代测序(ngs)的原核群落调查显示出意外的新的组,热杆菌。先前在水性纸或板的过程样品中未报道这种细菌属的存在。在一些机器中,多达总原核16s rrna基因序列的一半可以被划分为细菌属热杆菌。使用可变区v4-v5的16s rrna引物,通过illumina miseq测序进行原始调查,但通过多种技术变化验证该发现:在4个不同的商业或学术测序实验室,使用几种不同的商品化或非商品化dna提取方法,使用16s rrna基因可变区v4和v1-v3的引物并使用ion torrent pgm测序。制板过程样品的热杆菌的新的检测不取决于通过ngs的微生物组学分析的技术细节。
[0105]
在所调查的数十个制板机中,在温度更高的机器中检测到了最高的热杆菌丰度,如磨机a(55℃,~36%)、磨机b制板机1和2(50℃,分别~33%和~22%)、磨机c(45℃,~37%)、磨机d(46℃,~6%)、磨机e(~45℃,不同采样时的~3%和~9%)和磨机f(42℃,~17%)。在温度《40℃的过程样品中,热杆菌不是显著丰富的。
[0106]
实施例2:热杆菌在较差的纸板操作条件下相对并绝对更丰富
[0107]
对来自实施例1的一些机器再次采样。基于如以上所描述的16srrna基因序列比例,通过ngs定量了主要细菌分类群的相对丰度,并且通过将这些比例乘以通过常规原核qpcr定量的总细菌计数确定了绝对丰度(参见表1)。令人惊讶地,我们发现当较差的操作条
件在机器中占优时:具有低ph、低orp和/或高电导率的抽样时间,所采集的制板过程样品中的热杆菌的相对和绝对丰度更高。
[0108]
表1.在制板机的两次不同的采样时,热杆菌的相对和绝对丰度、总细菌和其他制板过程参数。
[0109][0110]
实施例3:用于热杆菌的新的基于dna的检测和定量方法
[0111]
对于热杆菌属设计了新的并且据我们所知第一个属-特异性qpcr引物。具体地,设计所述引物以区分热杆菌和地芽孢杆菌属(geobacillus),其是另一种厚壁菌门(firmicutes)的属,一些热杆菌序列被错误分类至该属。使用了来自实施例1-2的16s rrna基因ngs序列以及核苷酸数据库序列两者。识别了潜在的区别的引发位点并手动设计引物。使用多种工具检查潜在引物的性质(解链温度、二级结构和二聚体)。
[0112]
对热杆菌特异的qpcr测定的最佳引物序列为5'-cttgaggctaggagagggaagt-3'(seq id no:2)和5'-caggcggagtgcttattgtgt-3'(seq id no:3)。通过允许最大2个错配,这些引物检测无其他细菌属的16s rrna基因。对于thermicanus aegyptius(至今唯一描述的热杆菌种),pcr产物的长度为236bp。在具有2.2mm mg
2+
(50mm盐)和sybr green的qpcr master mix中,在59-63℃的退火温度下,从热杆菌基因组dna产生了特异性扩增(qpcr解链曲线分析中的一个峰)。
[0113]
除计算机验证外,使用来自rcf纸浆和白水的16个制板过程dna样品验证了使用新的引物的热杆菌qpcr测定的有效性(图1)。基于测序结果将样品选择为分类学不同的,包括广泛的热杆菌,并且包括热杆菌的最近缘的群落,包括地芽孢杆菌属(geobacilllus)(芽孢杆菌科(bacillaceae))。使用严格杂交的61℃的退火温度,在bio-rad cfx96循环仪或热循环仪上,将sybr green qpcr检测化学用于热启动qpcr mastermix。当基于基因组dna浓度定量总细菌时,ngs和qpcr-来源的热杆菌丰度之间的皮尔逊相关性为0.993(图1a),并且当基于常规细菌qpcr定量总细菌时,为0.997(图1b)。这些极高的相关性验证了新的热杆菌qpcr引物对于定量制板过程样品中热杆菌的特异性和有效性。
[0114]
实施例4:使用一种或多种杀生物剂和/或一种或多种酶抑制剂控制thermicanaceae细菌
[0115]
采集来自使用再循环纤维的箱板纸机的白水,并且用水将干燥、棕色、再循环的包装板匀浆,从而纤维的最终浓度为2.0%。将纸浆分成几部分,并根据表2将杀生物剂和酶抑制剂(锌)加入至瓶中。在测试开始时,纸浆的ph为7.75且orp+175mv。此后,将所述瓶在+50℃培育24小时。在24h,测量ph和orp并收集样品用于dna分析。如实施例1和2所述定量热杆
菌的量。
[0116]
表2提供了测试结果。杀生物剂和酶抑制剂处理的样品具有明显比对照样品更高的ph和orp。所述杀生物剂和/或酶抑制剂处理还降低了属于thermicanaceae科或热杆菌属的细菌的量:对照样品含有3.2*107个热杆菌细胞/ml并且处理样品降低》90%,1.2-2.2*106个细胞/ml。因此,在所处理的样品中,物理条件更好,且热杆菌的量小于对照样品。
[0117]
表2.微生物控制测试结果。在24h接触时间后,测量ph和orp,并且使用ngs测序和总细菌qpcr定量热杆菌属中细菌的量。
[0118][0119]
实施例5:使用一氯胺大规模控制thermicanaceae细菌
[0120]
使用一氯胺(mca)对使用再循环纤维的造纸机进行杀生物剂试验。在开始试验前7个月和1天以及在开始mca试验后3周采集来自储料和浑浊白水的样品。通过如实施例3所述的thermicanaceae-特异性qpcr定量热杆菌的量。表3提供了测试结果。mca试验将储料和白水中的热杆菌密度降低了≥99%。
[0121]
表3.造纸机上的微生物控制试验结果。使用特异性qpcr定量热杆菌。
[0122]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1