利用吸热反应移除反应热的甲烷化反应设备及吸热材料再生工艺的制作方法
1.近年来,为了防止大气中的导致全球变暖的气体二氧化碳浓度增加或为了减少大气中的二氧化碳浓度,正在研发碳的捕集和存储(ccs)(一种用于分离和回收二氧化碳的技术)和二氧化碳捕集利用和分离(ccus,carbon capture utilization&separation)技术(包括其用途)。
2.另一方面,在促进可再生能源利用方面,为了根据需求使波动能源,诸如,太阳能和风能,变成稳定的能源供应来源,通过利用这些能源进行电解来生成氢气(绿色氢气)。并且,也正在对制备、存储和利用这种氢气的氢气转化过程进行研发和论证。
3.另外,正在研发将上述ccs技术捕获的二氧化碳和来自这种可再生能源的氢气转化为甲烷的甲烷化(=甲烷化反应)工艺,该工艺更加安全、与当前基础设施更加兼容,并且更易于使用。
4.本发明涉及一种ccus技术,它融合了捕获二氧化碳的ccs技术与将氢气转化为甲烷的工艺。
背景技术:
5.目前,用于从大气或烟气吸收、分离和回收二氧化碳的技术的主流是利用基于胺的吸收剂的吸收方法。有很多类型的胺吸收液体以供使用,但是它们全部在室温至50℃范围内吸收烟气中的二氧化碳,然后将其加热至100-150℃,以脱去二氧化碳并回收二氧化碳。此外,如非专利文献3中所述,还存在用胺浸渍固体颗粒以吸收二氧化碳的方法。
6.在另一方面,根据非专利文献1,大约120年前,萨巴蒂尔发现了在ni基催化剂的存在下进行的由氢气和二氧化碳合成甲烷的方法。然而,时至今日,它仍不能实现为实际批量产生工艺。其主要原因是,这种反应在约600℃以下温度发生,并且它是一种伴随有大量热产生的平衡反应。当反应气体的温度升高时,与甲烷化反应反向的甲烷分解(蒸汽重整反应)开始占据主要地位,从而降低了转化率和收率。结果,这种反应产生的甲烷气体包含高浓度的未反应的易爆炸氢气,这很难安全和容易地使用甲烷。
7.现今,这种技术利用氢气转化为甲烷的主要工业用途,受限于移除二氧化碳,二氧化碳是氨合成工艺中的反应抑制剂,并少量包含在非专利文献2中所述的气体中。
8.在这种情况下,由于少量二氧化碳甲烷化产生的反应热被大量周围气体稀释,所以热生成的影响微乎其微的小,并且不会成为阻碍。然而,在不存在此类稀释后气体的氢气与高浓度二氧化碳(浓度接近100%)的反应中,热生成的影响较大,并且热量不充分地从催化剂表面(是反应场)移除。如上所述,除了由于温度提升而降低甲烷转化率之外,催化剂本身还由于热量而劣化。另外,由于并不容易移除生成的热量,所以这是为什么由高浓度二氧化碳和氢气生成甲烷的工艺时至今日仍没有投入实际使用的原因之一。
9.然而,近年来,由于全球变暖对策的必要性增加,所以根据非专利文献6,已研发了低温下具有高活性的催化剂;并且根据专利文献1和非专利文献4、5,对被设计为移除生成
的反应热或控制反应量的反应器进行研发与论证试验。
10.进一步地,在非专利文献1中,通过利用基于胺的吸收方法回收烟气中的二氧化碳来获得的二氧化碳,用作是本甲烷化方法原材料的二氧化碳。也就是说,正在对利用烟气中的二氧化碳将绿色氢气转化为甲烷的工艺进行调查和研发。
11.[现有技术文献]
[0012]
[专利文献]
[0013]
[专利文献1]:在日本专利申请第2016-524796号(pct/ep2014/064625)和日本专利申请第2020-63206号中描述了下列方法。利用吸收方法(诸如,上述基于胺的吸收方法)从烟气获得的二氧化碳和氢气被用于生成甲烷。在这种方法中,从甲烷化反应器中移除热量获得的热量,用于预加热锅炉燃烧空气。
[0014]
[专利文献2]:日本专利申请第2020-71387号提出了移动床和配备有摆动机构的多级流化床,摆动机构阻止了漂移发生,并通过为特别难以流化的细粉提供水平摆动运动使得气体与固体之间均匀接触。
[0015]
[非专利文献]
[0016]
[非专利文献1]保尔
·
萨巴蒂埃(paul sabatier)于1913年在“catalysis in organic chemistry”中提出了,在ni催化剂的存在下,二氧化碳与氢气反应以生成甲烷。
[0017]
[非专利文献2]根据栗山常吉,化学与教育66(11),p529(2018),描述了甲烷化反应用于在氨工业生产中移除痕量二氧化碳。
[0018]
[非专利文献3]
[0019]
根据2020年7月13日https://www.nedo.go.jp/news/press/aa5_101330.html,nedo与川崎重工业社制造有限公司和地球创新技术研究所(合作,介绍了“利用固体吸收方法的二氧化碳分离与回收技术”,其利用胺浸渍颗粒。他们正在研发甲烷生产工艺并致力于降低二氧化碳分离与回收技术的成本。
[0020]
[非专利文献4]
[0021]
在“review on methanation-from fundamentals to current projects”,第276-296页,fuel 2016,166(史蒂芬
·
罗池(stefan ronsch)等人)中,分别概述了甲烷化工艺技术及其问题的综述。
[0022]
[非专利文献5]
[0023]
根据2019年10月16日新发布的新能源和工业技术发展组织(nedo)中的https://www.nedo.go.jp/news/press/aa5_101217.html,inpex公司和日立造船株式会社共同宣布,已完成了对“利用二氧化碳的甲烷合成试验设施”的研发,并开始尝试为全面进行生产做准备。
[0024]
[非专利文献6]
[0025]
在“富山大学氢同位素科学研究中心研究报告”,36,39-44,(2016)中,亚伯等人报道,承载纳米级ru金属催化剂的tio2颗粒何时在150-200℃的低温下具有活性。
[0026]
[非专利文献7]
[0027]
在“日本陶瓷学会杂志,71,p61,(1963)”中,浜野建哉报道,氢氧化镁的脱水反应为约2%直至约290℃;并且当超过330℃时,开始快速脱水,并将在430℃完成。
[0028]
[非专利文献8]
[0029]
在“日本化学学会杂志,p.57-64,(1979)”中,泽田裕隆等人报道了碱式碳酸镁的热分解工艺的测量结果。
[0030]
[非专利文献9]
[0031]
在“化学工程学31(6),p538(1967)”中,前田司郎、山川规夫报道了流化床的传热系数较大。
[0032]
[非专利文献10]
[0033]
在“化学储存废热技术的实例和问题”:日本汽车工程师协会no.14-14讨论会,takayuki kobayashi于2015年2月13日提出,在http://www.energy.gr.jp/wp-content/uploads/2018/02/ch heatstorage.pdf的图5中示出各种化学蓄热剂及其工作温度。其中,氢氧化镁和碳酸镁标示为能够在300-500℃范围内工作的化学蓄热剂。
技术实现要素:
[0034]
[本发明要解决的问题]
[0035]
利用基于胺的吸收剂的吸收方法中的二氧化碳的吸收温度,取决于胺的类型,据说为大约20-60℃,这低于正常烟气温度(大约140℃)。因此,为了吸收烟气中的二氧化碳,需要马上降低烟气温度。
[0036]
降低烟气温度减少了大气污染防治法中规定的“囱道有效高度”。人们认为有必要将温度再次提高至140℃左右,或者增强排气机并提高废气风速。此外,已知,在脱硫工艺后,基于胺的吸收剂与烟气中少量sox反应,并逐步劣化,所以需要对吸收剂进行周期性精炼和补充。
[0037]
因此,需要一种在没有降低烟气温度且没有劣化吸收剂的情况下,能够吸收并固定二氧化碳的新型方法。
[0038]
另一方面,反应式1示出了用于由二氧化碳和氢气合成甲烷的甲烷化反应。如上所述,这种反应是平衡反应和放热反应。
[0039]
在此,使用本反应中涉及的每个成分的吉布斯(gibbs)自由能变g值,由等式1给出甲烷化反应的吉布斯自由能变δg值。当等式1的值为负时,反应进行;并且当等式1的值为正时,反应朝向相反方向进行,即逆反应。因此,针对反应式1计算0-1000℃的δg,并且结果示出在图1中。一般而言,很多化合物在每个温度下的δg值和焓变δh值能够引用自各种热力学数据库,诸如,化学手册。在此,通过使用aspen plus(用作具有这些数据库的程序模拟器)计算这些值。从图1可知,甲烷化反应的δg值在580℃左右为0,并在低于这个温度时为负,所以甲烷化反应进行;但是高于580℃时,δg值转为正,所以逆反应(甲烷的蒸汽重整反应)开始占主导地位。
[0040]
进一步地,当计算每个成分的焓时,在反应式1中生成甲烷的反应是放热反应,但是作为逆反应的蒸汽重整反应是吸热反应。
[0041]
一般而言,给定热量调节吸热反应的反应速率,所以很容易控制反应速率。但是,在放热反应和阿仑尼乌斯型反应的情况下,当反应热的热量移除能力不足时,反应温度提高,并且反应速率也随着反应温度的提高而提高,结果是反应可能会失控。
[0042]
然而,在这种甲烷化反应的情况下,当温度提高时,逆反应开始占主导地位;所以,尽管这不会导致反应失控,但是反应产率仍会降低。因此,具有足够的热量移除能力以抑制
反应温度提高是很重要的。
[0043]
[反应式1]
[0044][0045]
[等式1]
[0046][0047]
此外,因为这种反应发生在催化剂表面,所以,由于反应生成的热量,催化剂温度趋向于提高。当不会很快从催化剂中移除热量时,催化剂温度提高;如上所述,结果是,不仅转化率降低,而且催化剂的寿命也缩短。
[0048]
因此,本甲烷化反应要解决的问题是快速从含有催化剂的反应场中移除反应热。
[0049]
接下来,甲烷化反应在低于580℃下进行。反应式2中的氢氧化镁的脱水反应是一种吸热反应;因为图1中δg值在高于约270℃时为负,所以这意味着,这个脱水反应进行。事实上,这与非专利文献7中的报告几乎一致,即“氢氧化镁的脱水反应在300℃以上发生”。
[0050]
接下来,从图1可以看出,反应式3中的碳酸镁的脱羧反应也在进行,这是因为δg值在410℃以上时为负。事实上,根据非专利文献8,脱羧反应取决于二氧化碳在大气中的浓度,但是与报告一致的是,当二氧化碳分压低于5mol%时,全部脱羧在400℃以上发生。
[0051]
从这些脱水反应和脱羧反应可知,生成氧化镁,但是在图1中,氢氧化镁脱水反应的计算线在低于270℃时为正范围。这意味着,逆反应(水合作用)在低于这个温度时进行。即,如反应式4中所示,通过与水反应,氧化镁转变为氢氧化镁。另外,在反应式5中氢氧化镁的碳化反应中,图1的计算线在宽温度范围内为负区域,这意味着,甚至在低于600℃时也进行碳化。因此,即使在140℃的烟气温度下也希望进行碳化。
[0052]
[反应式2]
[0053]
mg(oh)2→
mgo+h2o
[0054]
[反应式3]
[0055]
mgco3→
mgo+co2[0056]
[反应式4]
[0057]
mgo+h2o
→
mg(oh)2[0058]
[反应式5]
[0059]
mg(oh)2+co2→
mgco3+h2o
[0060]
现今,反应在任意温度t下的平衡常数k能够通过等式2由δg获得,其中,r是气体常数。另外,从反应式1可知,等式3给出了该平衡常数k和每个成分的浓度之间的关系。即,通过任意温度t下的δg值,k值能够从等式2获得;然后,通过k值,能够由等式3计算出任意温度下每个成分的平衡组成。根据等式3的平衡组成由试错法确定。将会在每个温度下进行甲烷化反应,以接近这个平衡组成。
[0061]
图2是示出按这种方式确定的根据温度变化的二氧化碳平衡转化率变化的图。在这个图中,实线指示反应气体没有被蒸汽稀释的情况;虚线指示当将1mol蒸汽添加至反应气体中时平衡转化率的变化。如下面将会描述的,这与氢氧化镁吸收反应热并进行脱水以生成1mol水蒸气的情况相对应。
[0062]
在580℃左右温度下,二氧化碳到甲烷的转化率为50%。并且,在350℃左右,平衡转化率为约87%,由虚线示出;然后未反应的二氧化碳减少至约13%。
[0063]
[等式2]
[0064][0065]
[等式3]
[0066][0067]
另外,从图2可知,能够看出,在较低温度下进行反应以便获得高甲烷转化率是有效的。即,在这个反应中,反应温度越低,反应的转化率就越高。因此,为了提高反应器出口处的转化率,随着反应进行降低反应温度是有效的。
[0068]
然而,如上所述,当反应时,这个反应生成热,所以,如果热量移除能力不够充足,则这个反应热提升温度,并反过来降低转化率。在另一方面,根据反应动力学,反应温度越低,反应速率就越低。因此,反应温度越高越好。这是这种甲烷化反应的窘境和待要解决的问题。
[0069]
因此,在反应初始阶段,反应温度提高以进行反应;但是在此之后,逐步降低反应温度的同时,进行反应;并且在温度开始变低的反应装置的出口处,应当提升反应速率。需要一种通过提高催化剂浓度或使用较高活性的催化剂,即使在低温度区域内,也能够在没有降低反应速率的情况下提高甲烷转化率的反应装置。
[0070]
在此,以往主要研究和开发进展的综述如下。
[0071]
专利文献1和非专利文献4、5中的甲烷化反应在ni基催化剂的存在下,在300-400℃温度范围内进行。
[0072]
进一步地,已提出在工艺内部或外部通过这个热移除获得热量的工艺。
[0073]
关于催化剂,催化剂成形为丸状或蜂窝状,将它们填充到反应管中,将反应气体传递穿过这个反应管,并使用从外部冷却该反应管来移除反应管内生成的热量的间接冷却方法。
[0074]
在反应器中在300-400℃进行反应,根据图2,反应器出口温度为350℃和300℃时的平衡转化率分别为约87%和92%。
[0075]
为了使得实际转化率接近平衡转化率,需要确保充足的反应时间。假设甲烷化反应器中的转化率进行到90%,由原材料气体(1kmol二氧化碳和4kmol氢气)生成的气体组分为0.90kmol甲烷和1.80kmol水蒸气。
[0076]
并且,未反应气体的组分为0.10kmol二氧化碳和0.40kmol氢气。当转化为浓度时,未反应氢气的浓度为12.5mol%;使用含有这种高浓度的极其易爆炸氢气的甲烷作为通用燃料是危险的且不合需求的。
[0077]
近年来,根据非专利文献6,即使在150-200℃下也开发出较高活性的载ru催化剂,以便进一步提高转化率。因此,反应首先300-400℃下进行,然后生成的气体冷却至150℃;如果在这个催化剂的存在下进一步进行反应,则转化率将能够接近0.98(即,平衡转化率)。
[0078]
当转化率是0.98时,未反应氢气的浓度将降低至2.6mol%。即,能够极大地降低生成的甲烷的危险。综上所述,提高甲烷化反应中甲烷的转化率,降低产物气体中未反应氢气的浓度,这不仅从反应产率方面来说很重要,而且从安全角度来说也很重要。出于这个理由,在300-400℃反应后,需要增加反应器在150-300℃进行进一步反应,以提高平衡转化率至将近98%。
[0079]
在进入设备的特定结构之前,应当组织设备的元件。出于这个理由,假设在多个不同温度范围内通过连接反应器来执行甲烷化反应,其中,温度逐步从500℃降低至200℃,每次降低100℃。
[0080]
即,在第一阶段,常规催化剂用于在400-500℃温度范围内进行反应,然后在进入第二阶段前,冷却反应气体以在300-400℃范围内反应。
[0081]
另外,在第三阶段,同样冷却至300-200℃范围内。在这个温度下,反应速率明显下降,所以,假设非专利文献6中所述的高活性ru催化剂在这个温度范围内用于这种反应。
[0082]
这样,通过随着反应进行降低反应温度和在较低温度区域内使用较高活性的催化剂,使得能够在没有明显降低甲烷化反应速率的情况下提高转化率;然后,能够降低剩余的未反应氢气浓度;并且能够安全使用生成的甲烷。
[0083]
然而,在这个过程中,需要连接多个反应器并安装冷却器以降低它们之间的气体温度,这意味着这个工艺将会变得复杂。
[0084]
需要一种具有高的热量移除性能并能够随着反应进程降低反应温度的紧凑型反应器。如果实现了这种反应器,则应该有可能利用这种紧凑型反应器,提高甲烷化反应的最终转化率,并降低未反应氢气的浓度。
[0085]
[解决问题的手段]
[0086]
在如上所述的三级反应器的情况下,在每个反应器之间需要冷却器以降低反应气体的温度,从而导致工艺复杂。所以,需要一种不需要冷却器的紧凑工艺。
[0087]
根据非专利文献9,流化床是具有优异传热性能的反应器。本发明中,为了解决热量移除问题,使用具有优异传热性能的流化床,并且由反应器底部供给的反应气体用作流化气体。
[0088]
图3示出了使用无机粉体作为流化介质和反应气体作为流化气体的一级流化床甲烷化反应器的概念。装置配置与正常流化床装置相同。即,在流化床反应器1底部存在分散板4,流化介质的粉末床2位于其上。通过流经分散板4的反应气体3硫化粉末。将催化剂以颗粒状或蜂窝状放置于这个硫化粉末中,其未在图中示出。
[0089]
用于移除热量的传热管5也浸入这个流化床中,并通过使冷却水或热介质油流入管5中来冷却流化粉末,以吸收和移除这个流化床中生成的热量。流化床的混合特性是完全混合,并且它的高传热性能使得床内温度几乎均匀分布。因此,这个反应器中的温度不会随着反应进行而降低。因此,在这个一级流化床的情况下,当反应温度为300-400℃时,如上所述,产生的甲烷中残留氢气的浓度超过10%。
[0090]
接下来,通过将这个流化床的反应温度降低至200-300℃,有可能提高转化率,并降低残留氢气的浓度;但是,这意味着温度越低,反应速率就会越低。因此,为了提高反应速率,需要采取相应措施,诸如,使用高活性催化剂,提高催化剂的量,或提高反应气体在这个反应器中的滞留时间,即,提高反应器的尺寸。
[0091]
从上述研究可知,作为优选反应器,为了提高反应器出口处的甲烷转化率,如上所述,将具有不同内部温度的多个流化床反应器进行串连。例如,能够通过将气体供给至300-400℃的反应器,然后将来自这个反应器的出口气体传递给150-300℃的下一个反应器,来进一步提高转化率。
[0092]
因此,在本发明中,应用多级流化床,其中,多个此类流化床反应器能够集成为一
个反应器。它的概念示出如下。
[0093]
使用设置在多级流化床外部的粉末冷却器,将粉末(它是多级流化床中使用的流化介质)冷却至多级流化床中最上级中的流化介质的温度或低于这个温度;然后,将冷却的粉末持续送入这个多级流化床反应器中的最上级。并且,当粉末向下流入多级流化床中时,通过吸收反应器内部热量,来提升它的温度。通过吸收热量而变得更加高温的粉末被持续提取。然后,通过上述外部冷却器冷却该粉末,并使其循环进入多级流化床中的最上级。借此形成温度分布,其中,最下级的温度最高,最上级的温度最低,并且最上级与最下级之间每一级的温度都从下到上逐渐降低。
[0094]
这类反应器的概念和配置与多级蒸馏塔类似,其中,流化介质从外部冷却并循环形成如上所述的温度分布。在蒸馏塔中,通过再沸器在塔底部加热液体进行蒸发,并且从塔顶部出来的蒸气通过外部冷凝器冷却并冷凝,该冷凝物的一部分回流至塔内。通过使冷却的冷凝物回流至塔顶部,形成了逐步温度分布,其中,塔顶部温度低并且塔底部温度高。回流冷却和冷凝的液体,与将本发明的多级流化床的外部冷却器冷却的粉末装入最上级以冷却反应器内部类似。
[0095]
图4是两级流化床的示意图,用于更具体地阐述这个概念。为了降低反应器上级温度,由外部冷却器11冷却的粉末(其温度低于反应器上级的温度)通过粉末输送管13被持续送入该流化床反应器1的上级。即,与借由冷却传热管来降低这个两级流化床的上级温度相反,通过送入冷却的粉末来将内部温度降低至较低温度。结果,流化床1的上级温度低于流化床7的下级温度。送入上级的粉末吸收内部气体的反应热量和气体温度下降的显热,提升温度,然后进入下级的流化床7。
[0096]
在下级流化床中,从上级向下流动的较低温度的粉末吸收反应热量和这个区域内气体的显热,然后提升其自身温度,从而抑制流化床7的温度提升。
[0097]
结果,流化床的上级温度变得比流化床的下级温度低,另一方面,温度较高的流化床下级中的反应气体进行反应,然后反应气体向上流入温度低于下级的上级。通过降低气体温度,进一步提高平衡转化率;并且通过在低温度下使用较高活性的催化剂,进一步进行反应。最终,有可能增加甲烷转化率和降低残留氢气浓度。
[0098]
因为从上级持续输送粉末,所以需要持续提取加热至与从下级底部中流化床7的排放段9送入的摩尔相对应的较高温度的粉末量。提取的高温粉末被送入外部换热器11中移动床12的上部,从内部冷却,从底部提取,并通过粉末输送管13再次送入进行甲烷化。即,它被送入反应器的流化床1上级。反应气体3、分散板4和热量移除管5的配置与图3中一样。
[0099]
以上是使用多级流化床和在它与外部粉末冷却器之间循环流化介质的意义和作用。以上是一种用于解释本发明概念的简化两级流化床。在将这个方法应用于甲烷化反应的情况下,温度在约600℃至约150℃之间变化较大,所以具有三级或更多级的多级流化床是优选的。
[0100]
接下来,下面将给出具有此类温度分布的多级流化床的更详细描述。在此,假设多级流化床的最上级温度在140-200℃范围内,最下级温度在300-500℃范围内,以及每个中间级的温度都从最低到最高按顺序降低。在每个级中,布置催化剂颗粒或催化剂模塑体,从这个多级流化床底部供给作为反应原材料的二氧化碳和氢气,用作流化气体。用这个气体流流化流化床中的粉末,然后使气体与流化床中的催化剂接触,以合成甲烷。由于在反应器
出口最上级处的温度范围140-200℃内,甲烷的平衡转化率随着反应温度的降低而提高;与由反应温度为300-500℃的常规单个甲烷反应器获得的甲烷相比,能够获得更低的未反应的残留氢气浓度和更高的甲烷浓度。
[0101]
在这个多级流化床中,使得下降的粉末和升高的气体直接逆流接触,并交换热量,这与塔盘蒸馏塔类似。结果,在不同温度的流化床多级之间不使用粉末加热器或气体冷却器的情况下,实现了最上级温度最低且最下级温度最高的多级流化床。这种配置极大地简化了设备,并且是本发明突出特征之一。
[0102]
此外,在填充有引发放热反应的催化剂的填充床反应器中可通常出现热点。因为流化床具有高传热性能,所以温度分布均匀,预期与常规填充床反应器相比,催化剂的较长寿命将会延长。
[0103]
接下来,用作这个多级流化床的流化介质的粉末是期望的安全无机化合物,这些化合物是廉价的、稳定的且没有毒性或环境负荷。即,如沙子、二氧化硅、氧化铝、氧化镁和氧化钙是此类候选。
[0104]
在此,将会以具有三级配置的多级流化床为例,描述这个多级流化床的每一级的热负载。
[0105]
作为本发明装置概念的说明,假设了一种三级多级反应器,其温度从200℃到500℃每次进行100℃变化。在500℃反应器底部级注入反应气体,并且反应气体流入400℃的下一个上级。
[0106]
图2所示三个竖直杆的左侧杆示出了这个多级流化床中400-500℃温度范围内的平衡转化率和达到这个转化率的相对反应量。接下来,这个气体升高并进入温度范围为300-400℃的流化床上级,并指示反应进一步进行时的转化率增量和相对提高的反应量。另外,它还示出200-300℃范围内的反应量增加。400-500℃范围内的反应量是从零转化率开始的反应,即,这意味着,在这个反应器底侧,生成的热量相对较大。由此处,读取图2中平衡转化率的数值,并粗略估计每个级中生成的热量。
[0107]
从图2虚线可知,450℃的平衡转化率为80%。假设所达到的实际反应率是该平衡转化率的80%,则这个级中的反应量将会是总反应的64%。这表明,甲烷化反应放热值的64%出现在这个温度区域内。
[0108]
相反,根据图2,下一级中350℃区域内的平衡转化率为92%。同样地,当实际转化率为80%时,甲烷转化率为74%。这意味着,从450℃区域内的64%至350℃区域的74%,反应进行另外10%。即,最低级所需的热量移除量大于第二级中所需的热量移除量,这是因为它的反应量从零转化开始,并且与第二级反应量相比,大了约6.4倍。因此,需要移除最低流化床中的大量热,并需要通过增加传热区域(诸如,安装大量传热管)来增强热量移除能力。
[0109]
为了解决这个问题,本发明使用已被描述为流化介质的无机粉末,并进一步混合在300-600℃范围内吸收热量而分解为粉末的物质的粉末。因此,人们设计了,300℃以上温度范围内的多级流化床中生成的甲烷化反应放出的热的一部分或全部被这些化合物的分解反应吸收。
[0110]
作为一种吸收热量、在300-600℃范围内分解并能够在分解后再生的物质,氢氧化镁粉末是非专利文献10中所示的化学蓄热剂,即,它根据反应式2在300℃以上进行脱水并吸收热量;并且碳酸镁粉末根据反应式3在400℃以上脱碳酸。通过使用这些物质,在这个多
级流化床反应器中在300℃以上温度范围内发生的甲烷化的反应热的一部分或全部能够被这些化学蓄热剂的这些吸热反应吸收。因此,在本发明中,使用这些物质增强这个温度范围内的热量移除能力。
[0111]
即,作为这个多级流化床的反应气体入口的最低级生成大的反应热,并需要增强它的热量移除能力。通过使用在这个温度范围内进行吸热反应的吸热剂,并将其与从最上级向下流入最下级的流化介质混合,能够极大地降低这个温度范围内的热量移除负载。
[0112]
这些化学蓄热剂的吸热反应,即,氢氧化镁的脱水反应生成了氧化镁,并且碳酸镁的脱碳酸反应也生成了氧化镁。
[0113]
如反应式4中所示,这种氧化镁可通过与水的水合反应再生为氢氧化镁。另外,如反应式5中所示,这种氢氧化镁可通过与二氧化碳反应再生为碳酸镁。即,有可能将这种氧化镁再生为氢氧化镁,然后再生为碳酸镁,并反复再循环它们。
[0114]
因为这两种再生处理反应都是放热反应,所以这意味着在这些再生处理过程中,回收并利用了甲烷化反应器中吸收的反应热。
[0115]
在此,当通过吸收工厂烟气中的二氧化碳进行这种碳化反应时,这意味着这种二氧化碳被固定为碳酸镁。另外,当这种碳酸镁用作二氧化碳(这种甲烷化的原料气体之一)的供给源时,这意味着在这种碳酸镁中的二氧化碳被转化为甲烷。即,能够从烟气中的二氧化碳生成甲烷,这就是ccus技术中的一种。
[0116]
并且,此时,当利用“绿色氢气”作为氢气用于合成甲烷时,这意味着由可再生能源和温室气体合成了易于我们使用的燃料,或者绿色氢气与全球变暖气体转化为更可用的甲烷。
[0117]
另一特征是用于这种甲烷化反应的装置是多级流化床,所以有可能针对每一级的每个温度范围,选择并使用不同的最佳催化剂。
[0118]
除了经常在300-500℃使用的催化剂之外,已开发出在低温下有高活性的催化剂。所以,在多级流化床的低温范围内,能够使用针对低温的即使在150-200℃低温范围内也具有高活性的催化剂。在这个流化床的高温范围内,能够使用常规甲烷化反应催化剂,诸如,ni催化剂;并且在这些催化剂之间的中温范围内,有可能选择这些催化剂中的任何一个或使用催化剂的混合物。
[0119]
即,在使用温度随着反应进行而降低的多级流化床的反应器中,通过针对每个温度范围选择并使用不同最的佳催化剂,即使在反应温度降低和反应速率降低的反应器出料侧处没有减缓反应速率的情况下,也能够合成高浓度甲烷。
[0120]
在这类反应器中,为了阻止带有流化介质的这些催化剂向下移动至多级流化床的下级,催化剂颗粒应当大于下降管的孔直径,或者催化剂应当成形为蜂窝状以保持在每一级中。
[0121]
接下来,因为流化介质中混合的化学蓄热剂是粉末状的,所以优选地使用具有高比表面积的细粉,以便提高反应速率。在这种情况下,通常认为难以流化细粉,所以需要提供一种用于流化细粉的装置。
[0122]
[发明的效果]
[0123]
以上是本发明的概念描述,在下面,将通过热量计算证实,通过化学蓄热剂的吸热反应吸收热量来移除反应热的理念(这是本发明的概念)的可行性。
[0124]
表1示出了标准条件下每个反应的放热值和吸热值。此外,在最右列示出了每个反应的反应开始温度。
[0125]
首先,这个表的底部行示出了燃烧4kmol氢气时的燃烧热,其值为968mj/kmol。从最下行数的第二行示出,甲烷燃烧热的值为803mj/kmol。这两个值之间的差值为165mj/kmol,与氢气燃烧热的17%对应。
[0126]
接下来,从最下行数的第三行示出,当4kmol氢气与1kmol二氧化碳反应以制备1kmol甲烷时生成的热值,该热值为165mj/kmol并等于氢气燃烧热与甲烷燃烧热之间的差值。换而言之,这个差值意味着,当4kmol氢气转化为甲烷时,它拥有的能量的一部分作为反应热被释放到外部。
[0127]
这个计算示出,从能量定量角度来看,直接燃烧氢气比使用由氢气转化的甲烷更具优势。然而,氢气需要在高压下储蓄,并且它是一旦泄漏就会有氢爆炸高风险的物质,并为了安全使用,必须配备有严的格安全设备。
[0128]
另一方面,因为甲烷是用于家用煤气炉等的燃料,所以优选地将它转化为甲烷,并安全使用,这是因为能够利用现有基础设施来安全使用它。然而,通过转化为甲烷,能量减少了17%,所以,期望一种方法来尽可能回收并高效利用这17%的热量。
[0129]
在本发明中,通过利用氢氧化镁的脱水反应和碳酸镁的脱碳酸反应(其300℃以上吸热),17%的该热量损失能够被吸收并储蓄在生成的氧化镁中。如果该储蓄的热量高效用于其它工艺中,则将不会损失这17%的能量。
[0130]
首先,氢氧化镁的脱水反应在300℃以上进行,并且它的吸热量为81mj/kmol;其次,碳酸镁的脱碳酸反应的吸热量为118mj/kmol,并且它们的和为199mj/kmol。即,因为它比甲烷化反应放出的热量(165mj/kmol)大,所以能够通过调整这两个反应量来吸收并储蓄甲烷化反应的全部反应热。
[0131]
尽管在标准状态下利用焓来进行以上研究,但是实际计算应该利用每个反应温度下的焓值进行。下面描述了每个反应温度下的反应和热计算。
[0132]
[表1]
[0133][0134]
表2示出300-400℃和400-500℃两个温度范围内的甲烷化反应的反应量和反应热,以及对应的吸热反应和它们的吸热量。下面,在这两个温度范围内,示出了由于甲烷化反应产生的所有放热值都可以被这些吸热反应抵消。
[0135]
首先,用450℃中间温度执行热计算,以计算400-500℃温度范围内的反应热。在
450℃甲烷化的反应热为183mj/kmol,这比25℃标准状态的值高。其次,因为在450℃的平衡转化率是0.72(从图2),假设反应达到这个平衡转化率,则放出的热量是132mj/kmol。另一方面,在450℃下1kmol碳酸镁的脱碳酸热量为114mj/kmol。因此,18mj/kmol甲烷化反应热为1kmol是过多的,并不能被吸收。
[0136]
再次,当执行用于300-400℃温度范围内热计算的温度时,以中间值350℃为温度进行计算。根据图2,350℃的平衡转化率为0.90,因此假设反应转化率从0.72进行到0.90,转化率的增量为0.18,并且此时,二氧化碳的反应量为0.18kmol。并且,因为在350℃的甲烷化的反应热为180mj/kmol,所以这个温度范围的反应热为32mj/kmol。在400-500℃范围内将这个值与18mj/kmol余热相加,待移除的热量为50mj/kmol。另一方面,因为在350℃时1kmol氢氧化镁的脱水反应的热量为76mj/kmol,因此这50mj/kmol热量能够被0.66kmol氢氧化镁的脱水反应吸收。因此,300℃以上的甲烷化反应热的全部能够用1kmol碳酸镁的脱碳酸和0.66kmol氢氧化镁的脱水所吸收和抵消。即,能够在不使用用于热量移除的传热管的情况下抑制反应器中的温度升高。
[0137]
[表2]
[0138][0139]
以上假设400-500℃下18mj/kmol热量被带入到300-400℃温度范围内。此外,另一种方式是,1.16kmol碳酸镁的脱碳酸反应吸收了全部132mj热量;接下来,32mj热量能够被0.42kmol氢氧化镁的脱水反应吸收,然后,1kmol甲烷化全部反应热能够被这些吸热反应吸收。在这种情况下,在没有将400-500℃区域内的热带入300-400℃区域内的情况下,吸收了全部反应热。
[0140]
以上所述意味着,在没有使用利用传热管的热量移除方法的情况下,能够通过在甲烷化反应器中使用适当量的这些化学蓄热剂,吸收从300-500℃高温段移除的热量(其中,反应生成的热量大)。另外,这表明放热反应生成的热量能够储蓄在氧化镁中。
[0141]
这两种吸热反应在前一情况下生成1.66kmol氧化镁,在后一情况下生成1.58kmol氧化镁。通过与水的水合作用,氧化镁能够再生为氢氧化镁;然后通过将该氢氧化镁与二氧化碳反应,能够再生并用作碳酸镁。而且,因为这些再生反应都是放热反应,所以有可能在该再生过程中回收并利用甲烷化反应器中吸收的热量。
[0142]
换而言之,通过将氢气转化为甲烷并使用它,减少氢气具有能量的17%,并会下降
400℃)。表3中的小表示出每个反应阶段中进行的反应后的气体和无机粉末的组分。
[0158]
该热计算中,当分别计算了反应热和显热时,反应器低级的温度范围为300-400℃;但是反应热计算中,使用350℃处的值作为这个范围中值计算焓变。因为温度升高或下降时这个范围内的温度变化为100℃,所以300-400℃下从每个组分和焓值获得每个显热。
[0159]
反应器上级温度范围为140-300℃,但是用于计算反应热的代表性温度在此假设为200℃,并且在这个范围内升高或下降的温度变化为140-300℃。因此,温度变化设置为160℃。
[0160]
甲烷化反应所需的1kmol二氧化碳和4kmol氢气从反应器底部供给到反应器中,如表3中右下方所示。当在室温(25℃)下直接供给这些反应气体时,反应器内的温度下降,因此通过与预先自反应器提取的400℃高温粉末交换热量,而将反应器的温度提升至400℃。即,氢气进行预热并送入反应器。
[0161]
下面是这些条件下的计算结果。在粉末侧,在140℃下从反应器顶部送入2.08kmol氢氧化镁粉末(用作吸热材料)和4.01kmol氧化镁粉末的混合粉末。从反应器底部提取向下流动期间完全反应的粉末,并在如上所述预热原料气体后,将粉末送至再生过程中。
[0162]
在140-300℃温度范围内,从反应器顶部送入的粉末不会发生脱水作用,即,组成不会发生改变,并且粉末吸收来自气体的显热,以仅提升它的温度。
[0163]
在下一级中,温度范围为300-400℃,假设送入的2.08kmol氢氧化镁的80%脱水,并且剩余20%的0.416kmol氢氧化镁的不发生反应。(这仅仅是针对试算的一种假设,并且期望使用通过实验确定的实际脱水率)。因此,从反应器底部提取这0.416kmol氢氧化镁作为5.674kmol氧化镁,其是送入的4.01kmol和脱水反应所生成的1.66kmol的总和。这个脱水作用生成的水蒸气的量为1.66kmol,并且该水蒸气与反应气体一起升高。
[0164]
接下来,将说明气体侧的计算结果。
[0165]
1.0kmol二氧化碳和4.0kmol氢气进入反应器下级的300-400℃温度范围内,作为400℃的反应气体,并与从上级向下流动的粉末交换它的热量,然后反应气体达到300℃温度,并流动进入上层。此时,根据图2,甲烷化反应的平衡转化率为0.89。然而,因为这个反应的实际转化率不会达到流化床实际滞留时间内的平衡转化率,故在此这个平衡转化率假设达到了平衡率的85%。结果,反应后气体侧的组分为:甲烷=0.77kmol,二氧化碳=0.23kmol,水=1.54kmol以及氢气=0.92kmol。并且,这些组分示出在表3右手侧的热生成侧的下部。
[0166]
接下来,在140-300℃温度范围内,假设甲烷转化从0.85提高至0.98。因此,反应器出口处的气体组分为:甲烷=0.98kmol,二氧化碳=0.02kmol,水=3.62kmol,以及氢气=0.08kmol。
[0167]
反应不涉及的氧化镁粉末作为吸热剂工作,当吸热剂向下流到反应器内部时吸收来自反应气体的显热。
[0168]
在此,考虑到再生处理后的粉末温度,送入反应器顶部的粉末温度假设为140℃。
[0169]
如果粉末温度低于或高于这个温度,则能够通过降低或提高待送入氧化镁粉末的量来调整温度。
[0170]
[表3]
[0171][0172]
接下来,表4示出,基于表3中组成变化,由每个成分的温度变化和焓变获得的传热量的试算结果。表4括号[]中的数值指示以mj(兆焦耳)计的热量。下面描述来自反应器底部的反应器中的热传递。
[0173]
在逆流接触法中,诸如在移动床中,氢气直接与从反应器底部在400℃提取的6.09kmol氧化镁与氢氧化镁的混合粉末交换热量,并且接收60mj热量以将其预热至400℃,并将它送入反应器底部。另一方面,通过这个换热将温度从400℃降至288℃后,混合的粉末被送入再生过程。(实际上,在升温侧粉末与被加热侧气体之间需要至少几摄氏度的温度差,但是该温度差在此假设为零,这是因为它是一个近似值。)
[0174]
进入反应器下级的400℃的反应气体反应,以形成转化率为77%的甲烷,然后放出144mj热量。
[0175]
这个热量被提供给从反应器上级向下流动的约300℃混合粉末。另外,通过在温度下降期间想粉末提供19mj的自身显热(粉末吸收了该热量),反应气体本身温度下降至300℃的同时,气体在反应器内向上流动以进入反应器上级的300℃区域。
[0176]
另一方面,通过吸收并交换反应气体温度正在下降时的反应气体的37mj显热以及在反应器下级处的甲烷化反应热,提升从反应器上级进入反应器下级的300℃混合粉末的温度。即,此时,1.66kmol氢氧化镁吸收来自反应气体的127mj脱水热,然后通过脱水转化为氧化镁,并进一步升温至400℃。
[0177]
综上所述,在反应器下级中,来自反应气体的提供给粉末的热量示出在表的右侧。
[0178]
[从气体供给粉末的热量]=气体放出的反应热+气体温度下降期间的显热=144+19=163mj。
[0179]
粉末从气体接收的热量示出在表4左侧。
[0180]
[粉末从气体接收的热量]=吸收的反应热+用于升温的粉末显热=127+37=
164mj。
[0181]
此时,这两个值几乎相等,并且(放出的热+气体温度下降期间的显热)和(吸收的热+粉末温度上升的显热)彼此抵消,因此在该反应条件下,不需要用于热量移除的传热管来维持温度恒定,并且在反应器下级中,不会出现任何温度变化。
[0182]
[表4]
[0183][0184]
接下来,将以相同方式说明反应器上级中的热传递。
[0185]
在此同样,向下流动到反应器内部的无机粉末和上升的反应气体通过逆流接触交换它们的热量。
[0186]
300℃反应气体从反应器下级进入上级,在此,二氧化碳进一步进行反应高达98%,释放31mj热量,并将31mj热量提供给正向下流动的氧化镁和氢氧化镁的无机粉末,然后反应气体的温度下降至140℃。
[0187]
另一方面,送入反应器上部的140℃的混合粉末接收62mj(它是31mj甲烷化反应热和当反应气体的温度正从300℃下降至140℃时从反应气体中释放的31mj显热的和),然后通过接收这个热量,粉末温度升高至300℃。即,
[0188]
[气体提供给粉末的热量]=放出的热+气体温度下降的显热=31+31=62mj。
[0189]
[粉末从气体接收的热量]=用于粉末升温的热量=62mj。
[0190]
这两个热量变得相等。在此同样,指出生成的热量由吸收的热量抵消,反应器上级中的温度不会改变,并且能维持恒定的温度。
[0191]
上述计算不包括插入到流化床内的热量移除传热管的热量移除。
[0192]
实际上,与仅依赖于化学蓄热材料的热量移除相反,还可能结合传热管的热量移
除控制内部温度,以便提高响应工艺中各种扰动的能量。当同样使用利用传热管移除热量时,可以减少对应于传热管移除的热量送入的无机粉末的量,以进行调整。
[0193]
顺便一提,在表3和表4中,为了简化热计算,将反应器内部说明为具有两级结构,即,上级和下级。
[0194]
然而,并不需要受限于两级配置,当然,能够允许配置有更多级。
[0195]
接下来,表5示出了当假设烟气直接供给到反应器中用作二氧化碳的供给源时,组成变化与热量传递之间的关系,与表3和表4类似。然而,组成变化和热量传递汇总在一个表中。即,这个表每一阶段中实线表示的小表中的数值指明,每个反应场中每个成分的组成,与表3中类似。并且,表中虚线指示的小数值指明反应热的量和显热的量,与表4中类似。
[0196]
[表5]
[0197][0198]
在此,使用的烟气温度为140℃。组成示出在表5底部,并且假设为:二氧化碳=1kmol、水蒸气=2.5kmol、氮气=5.0kmol、以及残留氧气=0.25kmol。
[0199]
为了避免将烟气中的残留氧气引入甲烷化反应器中,与剩余氧气化学计量当量的氢气用于预燃烧成水蒸气。这个氢氧燃烧后的气体组成变为:二氧化碳=1kmol、水蒸气=3.0kmol以及氮气=5.0kmol。
[0200]
此时,氢氧燃烧导致的燃烧热为123mj,并消耗该热中的74mj以将烟气温度从140℃提升至400℃。
[0201]
此外,供给到甲烷化反应的4kmol氢气从这个燃烧热接收44mj热量,并同样升温至400℃。推导出这些后,剩余的余热为5mj,但是从反应器底部将这个热量与烟气和氢气一起载至反应器下级。实际上,5mj的这个热量使得供给的气体温度仅从400℃提升了几摄氏度。
[0202]
在气体侧,在反应器下级中,反应气体发生反应变成:甲烷=0.8kmol、二氧化碳=0.2kmol、水蒸气=4.60kmol、氢气=0.8kmol、氮气=5.0kmol。另一方面,粉末中2.34kmol氢氧化镁的80%进行脱水反应,释放出1.87kmol水蒸气。通过将8.38kmol与1.87kmol相加,氧化镁的量为10.25kmol。同样地,未反应的氢氧化镁为0.468kmol。
[0203]
基于上述组成变化计算反应器的下级中的热量传递,将反应气体的反应热144mj、气体降温的显热52mj与反应气体引入的热量5mj相加。即,热的总量为144+52+5=201mj,并且这个热量提供给从反应器上级向下流动的粉末。
[0204]
在此,当1.87kmol氢氧化镁脱水时吸收的热量为143mj,并且混合粉末升温至300-400℃所需的热量为58mj。总和为143+58=201mj,其中,热释放也通过热吸收来抵消。综上所述,在反应器下级中,
[0205]
[气体提供给粉末的热量]=(气体反应热+气体温度下降的显热+氧氢燃烧余热)=144+52+5=201mj。
[0206]
[粉末从气体接收的热量]=(混合粉末升温的显热)=143+58=201mj。
[0207]
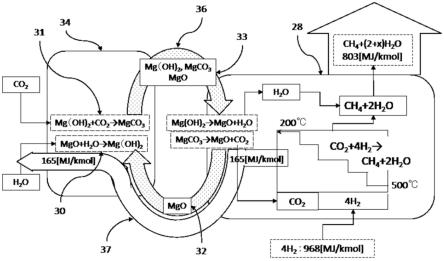
即,放出的热由吸热的值抵消。
[0208]
对反应器上级也是如此,每个组成变化示出在表中,并且基于这个组成变化的热量传递为:
[0209]
[气体提供给粉末的热量]=(气体反应热+气体温度下降的显热)=31+67=98mj。
[0210]
[粉末从气体接收的热量]=(混合粉末升温的显热)=98mj。
[0211]
所以,吸收的热抵消了放出的热。如上所述,示出通过利用其中烟气中的残留氧先前已移除的含二氧化碳的烟气用作甲烷化反应的原材料气体,根据热计算,用氢气合成甲烷是可能的。
[0212]
在此,通过直接供给烟气的胺法吸收二氧化碳气体的工艺中,当烟气直接供给到胺吸收工艺时,通过少量sox成分可以劣化胺吸收液体。因为本发明不会使用基于胺的吸收液体,所以不会有此类担心。由于担心用于甲烷化反应的催化剂会由于烟气中的少量sox成分而中毒。然而,在本发明中,氢氧化镁和氧化镁(它们还是脱硫剂)的量比催化剂大很多。因此,sox转化为mgso4,并被认为变得无害。
[0213]
作为第三情况,表6假设,碳酸镁脱碳酸反应释放的二氧化碳用作二氧化碳的供给源。同样地,从热计算的这个结果可知。基于每种无机粉末成分的组成变化和热计算,示出每个阶段生成的热量和吸收的热量能够彼此抵消的反应条件。
[0214]
在此,氢氧化镁碳酸化获得的碳酸镁经常是碱式碳酸镁。根据热计算,碱式碳酸镁的化学组成可被认为是氢氧化镁和碳酸镁的混合物,所以这个试算将其处理为氢氧化镁和碳酸镁的混合物。
[0215]
表3至表5之间的主要不同点是,在这个热计算中,反应器内部由三级(上、中和下)组成。
[0216]
该反应器底部的温度是400-500℃温度范围,在这个温度下,进行脱碳酸反应。
[0217]
在这种情况下,仅仅甲烷化反应的热不足以获得400℃以上的高温。在此,假设不充足量的热由与空气进行的氧氢燃烧弥补,并使用该燃烧热进行弥补,从而升温至500℃。即,25℃空气(0.14kmol o2、0.56kmol n2)和0.28氢气进行氧氢燃烧,并且此时的燃烧热能提高气体温度至500℃。当然,如果气体源氢气的温度能被其它预热方式提升,则不需要这
种氧氢燃烧。
[0218]
[表6]
[0219][0220]
这种氧氢燃烧的热值是69mj,将空气温度从25℃至500℃所需的热为13mj,并且提升用于甲烷化的4kmol氢气温度所需的热量为56mj;并且当通过这个燃烧热加热至500℃的气体在反应器底部被带入至400-500℃区域内时,过剩热为55mj。再次,该过剩热实际上将原料气体温度提升至500℃以上。当在反应器的最下级中发生该氧氢燃烧时,通过由氢气燃烧生成的热同时进行脱碳酸反应(吸热反应),因此能够阻止温升过高。
[0221]
接下来,在这个400-500℃区域内,甲烷化反应的平衡转化率为约70%。假设,到甲烷的实际反应率是70%,即49%,热值为91mj。此时气体组成如小表中所述。
[0222]
另外,该反应气体从500℃降温至400℃时的热量(降温的显热)为19mj,因此在反应器下级中,
[0223]
[由气体供给至粉末的热量]=气体带入的热量+反应热+降温的显热=55+91+19=165mj。
[0224]
另一方面,用作吸热材料的混合粉末的输入量为:氧化镁=4.74kmol、氢氧化镁=0.45kmol以及碳酸镁=1.0kmol。
[0225]
在该最低级中,温度比中部高,因此全部氢氧化镁已进行脱水并转变为氧化镁,并且各自的量为:氧化镁=5.19以及碳酸镁=1.0kmol。将这个混合粉末的温度提升至400-500℃所需的热量为51mj,并且使1kmol碳酸镁完全脱碳酸所需的热量为114mj,则
[0226]
[粉末从气体接收的热量]=吸热反应热+粉末升温的显热=114+51=165mj。
[0227]
再次,生成的热量由吸收的热量抵消。(同样在此,当然碳酸镁的反应速率可以是
50%或80%。例如,当反应速率是50%时,待送入的碳酸镁的量为双倍;并且,可以通过降低与作为未反应组分的碳酸镁的显热量对应的氧化镁的量来调整热吸收量。)
[0228]
在该400-500℃范围内,由碳酸镁通过脱碳酸释放的二氧化碳成为用于甲烷化反应的原材料气体,因此当与氢气反应时,该气体在反应器中与其它气体一起向上流动。
[0229]
接下来,在反应器中级,气体侧和粉末侧的组成示出在表6中。基于这些组成变化,
[0230]
在气体侧,
[0231]
甲烷化反应热=54mj;
[0232]
气体降温的显热=17mj;
[0233]
以及它们的总和为71mj。
[0234]
[由气体供给粉末的热]=放热反应的热+气体降温的显热=54+17=71mj。
[0235]
在粉末侧,
[0236]
0.45kmol氢氧化镁脱水反应的热=34mj;
[0237]
粉末升温的热=37mj;
[0238]
以及它们的总和为71mj。
[0239]
[粉末从气体接收的热量]=吸热反应热+粉末的显热=34+37=71mj。
[0240]
同样在此,生成的热量被吸收的热量抵消。0.45kmol水蒸气被释放并与反应气体一起在反应器中上升。
[0241]
最后,同样地,在反应器最上级中,
[0242]
甲烷化反应的热为31mj,气体降温的显热为27mj,以及它们的总和为
[0243]
[气体提供给粉末的热量]=放热反应热+降温显热的热=31+27=58mj。
[0244]
并且,这个值等于将140℃粉末升温至300℃所需的热58mj。
[0245]
[粉末从气体接收的热量]=粉末的显热=58mj。
[0246]
因此,即使在这种情况下,生成的热量也可以被反应器中每一级吸收的热量抵消,并且反应器中的温度能够稳定。
[0247]
在表6中示出的情况中,将碳酸镁粉末与作为甲烷化反应器的流化介质的无机粉末混合后,使用碳酸镁粉末。能够通过将氧化镁与烟气中的二氧化碳反应来获得该碳酸镁。这意味着,通过使用二氧化碳气体用作原材料生成甲烷;一旦转化为碳酸镁,然后在反应器中对其脱碳酸,即可获得该二氧化碳气体。即,这是ccus技术中的一种。
[0248]
如上所述,在表3至表6中,在用作原材料的二氧化碳供给源不同的三种情况中,在不存在用于热量移除的传热管的情况下,通过输入其组成和量调整后的化学吸热材料,能够完全抵消甲烷化反应器放热量。即,示出了在没有利用用于热量移除的传热管的情况下,多级流化床每一级中的温度都能被控制为恒定的。
[0249]
当然,可以假设这三个情况之外的情况,在任何情况下,能够通过调整氧化镁、氢氧化镁和碳酸镁粉末中的每一种的量和比例,来调整热吸收量。在不存在用于热量移除的传热管的情况下,这种类型的反应器中的每个温度区域中的温度都能保持恒定。
[0250]
现今,在上述试算中,不考虑每一情况的粉末的反应速率、甲烷化反应速率和滞留时间(=反应时间)。下面,将这些纳入考虑中,将示出如何在每个流化床中匹配吸收的热量和生成的热量。
[0251]
一般而言,气体的反应速度很快,气体的燃烧速度是典型示例。相反地,因为粉末
的反应速率为固体反应速率,并取决于它的比表面积。因此,如果颗粒是块形式,诸如,木炭,则反应速率要比气体慢很多。实际上,根据非专利文献7,氢氧化镁晶体粉末的脱水反应速率为约50分钟(=3000秒),以在350℃左右达到约90%的脱水率,这比气体要慢很多。
[0252]
另一方面,关于流化床中粉末和气体的滞留时间,当粉末和气体以相同摩尔量反应时,气体的比体积远远大于粉末的比体积。与粉末流速相比,气体流速非常快,即,与粉末相比,气体的滞留时间变得非常短。
[0253]
如上所述,粉末的反应速率慢,但滞留时间长;而气体的反应速率快,但是滞留时间短。
[0254]
每一级中的热吸收和热生成都与粉末和气体各自的反应量成比例,并且反应量与反应速率和滞留时间的乘积成比例。因此,应当基于(=反应量)乘积的值讨论每一级中的热平衡。
[0255]
尽管进行了粗略估计,但是考虑到滞留时间,下面将示出流化床中的粉末和气体的反应量的结果。
[0256]
等式4是针对多级流化床中流化床的一级的流化床体积v
fb
、流化床横截面积s和流化床高度h
fb
之间的关系。因为流化床包含用于热量移除的传热管和催化剂,因此当它们的占用体积分别为v
管
和v
cat
时,等式5给出了粉末和气体占用的实际流化介质的体积v
fpg
。在此,当这个v
fpg
的孔隙率为ε时,在这个v
fpg
中粉末占用的体积v
fp
在等式6右侧的左部分表示,并且流化气体占用的体积v
fg
在等式6右侧的右部分表示。
[0257]
在此,粉末以摩尔流速q
p
持续流入流化床中粉末占用的体积v
fp
,停留一段平均滞留时间τ
p
,然后以速率q
p
离开。在此,因为流入这个流化床的粉末分别包含反应涉及的物质和反应未涉及的物质的摩尔流速q
rp
和q
ip
,因此粉末的摩尔流速q
p
是这两个摩尔流速的和(等式7的左侧)。另一方面,气体侧还包含反应的气体组分和未参与反应的气体组分。摩尔流速qg是上述两者的和,并在等式7的右侧表达。
[0258]
在此,当镁基化合物用作化学蓄热剂时,反应涉及的粉末q
rp
是氢氧化镁或碳酸镁。并且作为反应未涉及的物质,q
ip
是热吸收反应生成的氧化镁。
[0259]
反应涉及的气体q
rp
指的是二氧化碳和氢气;以及反应未涉及的气体q
ig
是氮气包含在输入气体中时的氮气,和用作反应产物的甲烷或水蒸气。
[0260]
关于等式8,左侧示出粉末的反应式;并且右侧示出气体的甲烷化反应的反应式。每个组分的化学计量系数示出在下面每个反应式中。因为在此示出脱水反应,所以在气体侧反应后,1kmol脱水反应生成的1kmol水蒸气应当加到摩尔流速中,并且这个水蒸气的摩尔流速在等式8中用圆括号示出为(1)。在脱碳酸反应情况下,全部生成的二氧化碳被作为用于甲烷化的原材料被消耗掉。
[0261]
[等式4]
[0262][0263]
[等式5]
[0264]vfpg
=(v
fb-v
管-v
cat
)
[0265]
[等式6]
[0266]vfp
=v
fpg
(1-ε),v
fg
=v
fpg
ε
[0267]
[等式7]
[0268]qp
=q
ip
+q
rp
,qg=q
ig
+q
rg
[0269]
[等式8]
[0270]
mg(oh)2→
mgo+h2o
↑
,co2+4h2→
ch4+2h2o(+h2o]
[0271]1→
1+(1),[1+4=5]
→
[1+2=3](+1)
[0272]
通过把这个摩尔流速乘以粉末和气体各自的比体积v
p
和vg,来确定流经这个流化床的粉末和气体的各自体积流率u
p
和ug。在此,当反应前后摩尔比体积变化时,使用反应前后的平均值,并且这些平均值分别为v
p(av)
和v
g(av)
。因此,粉末的体积流率是等式9左侧的u
p(av)
,并且气体的体积流率u
g(av)
在等式9的右侧。通过使用这些体积流率,将流化床中的占用体积除以体积流率以获得等式10,来计算通过流化床的时间,即,滞留时间τ
p
和τg,并且将等式6和等式9分别代入等式10以获得等式11和等式12。因此,获得流化床中粉末和气体的滞留时间的关系式。
[0273]
在此,与正在反应的粉末的摩尔数相比,根据等式8,气体在反应前的摩尔数为5mol,并在反应后的摩尔数为3mol。因此,当这个计算中的平均值为4mol时,由于等式13给出了粉末和气体的摩尔流速的比值,因此等式14给出了τ
p
与τg的比值。
[0274]
[等式9]
[0275]up(av)
=q
p
×vp(av)
,u
g(av)
=qg×vg(av)
[0276]
[等式10]
[0277][0278]
[等式11]
[0279][0280]
[等式12]
[0281][0282]
[等式13]
[0283]
4q
rp
≈q
rg
(av)
[0284]
[等式14]
[0285][0286]
在此,当使用作为无机粉末的氧化镁与气体的摩尔标准比体积进行比较时,根据氧化镁的真密度值,氧化镁的摩尔比体积v
p
为约0.011[l/mol]。氢氧化镁和碳酸镁的摩尔比体积分别为0.025[l/mol]和0.028[l/mol]。另一方面,当在400℃的理想气体状态下,气体的摩尔体积为约50[l/mol],因此比值为约4500-1800倍。因此,在以下计算中,通过采用3000倍作为该平均值来进行下面的检查,如等式13所示。
[0287]
一般而言,具有良好流动性的颗粒的孔隙率ε假设为约0.3,并且此时(1-ε)/ε的值为约2.3,如等式16的右部分所示,因此将这些值代入到等式14中。然后,通过流化床的粉末和气体的平均滞留时间的比值τ
p
/τg为约28,000,如等式17所示。即,在甲烷化反应器中,这意味着,气体的滞留时间(=通过时间)要远远小于通过流化床的粉末的滞留时间。
[0288]
[等式15]
[0289][0290]
[等式16]
[0291][0292]
[等式17]
[0293][0294]
在350℃的流化床中,当氢氧化镁粉末的滞留时间为3000秒时,这期间脱水率达到约90%。然而,通过这个流化床的气体滞留时间仅为约0.11秒。当在这0.11秒内,气体反应的反应量(=热生成)等于存在于此的氢氧化镁的脱水反应的热吸收的90%时,热吸收和热生成相等。即,反应温度不会上升或下降,并维持恒定。
[0295]
然而,尽管气体的反应速率快,但是仍担心滞留时间在0.11秒可能太短。因此,下面示出了当反应速率与滞留时间不匹配(当气体的滞留时间太短时,或当气体反应量(放出的热)比吸热反应量大时)时,如何处理匹配问题。
[0296]
当气体的滞留时间短并且气体侧的反应量比预期少时,放出的热减少;但是另一方面,除非提供热量,否则不会进行粉末的吸热反应;结果,粉末的反应量等于气体的反应量。
[0297]
相反的,如果气体的反应量大于粉末的反应量,则针对热生成量,热吸收量将会是不充足的,因此温度将会提升。然而,如图2所示,反应场的升温导致平衡转化率降低,并且与该降低的转化率相对应的逆反应(蒸汽重整反应,其为吸热反应)发生;结果,气体的放出热被抑制达到平衡。
[0298]
基于上述考虑,当粉末供给速率q
p
和气体供给速率qg恒定时,流化床每一级中的气体反应量通过气体的反应速率与滞留时间τg的乘积给出;此外,能够通过流化床中催化剂的量和活性来调整反应速率。另一方面,根据等式4-12,气体滞留时间τg(=通过流化床的时间)与流化床高度h
fb
和流化床孔隙率ε成比例。
[0299]
当给出获得每个流化床中期望的气体反应量所需的滞留时间τg的流化床高度为hg时,并且同样地,同样给出获得期望的粉末反应量所需的滞留时间τ
p
的流化床高度为h
p
时,另外,当条件为h
p
》hg(即,这意味着气体反应速率较快)时,则粉末的反应量不会超过气体的反应量,如上所述。因为这两个量的结果相等,所以流化床高度可被设置为给出所需气体反应量的高度h
p
,即,h
fb
=h
p
。
[0300]
另一方面,如果h
p
《hg,则流化床的高度必须为hg,以便获得期望的气体反应量,即,h
fb
=hg。然而,此时,无机粉末(在表3示例中,2.08kmol氢氧化镁和4.01kmol氧化镁)的供给
量q
p
和气体(1.0kmol二氧化碳和4.0kmol氢气)的供给量qg应该不会改变。这是因为粉末吸收的热量和气体吸收的热量由q
p
和qg定义,而与流化床中存在的粉末量(滞留量)无关。换而言之,此时,h
fb
变得比h
p
高(尽管粉末的滞留时间τ
p
变得比所需时间长),粉末吸收的热量不会增加超过气体生成的热量,因此这不是问题。
[0301]
可以通过调整每一级下降管堰(图5中21)的高度,来调整流化床的高度。当然,调整反应气体的供给量以平衡装置运行期间对抗扰动的热量也是有效的。
[0302]
接下来,能够提高h
fb
以获得所需的气体反应量,在表3至表6中的示例中,每一级之间的温度差被设置为100℃,以简化计算。考虑到实际设备中的热应变等,优选地,这个温度差更小。因此,例如,通过把温度差为100℃的流化床分为4级并设置每一级之间的温度差为25℃,能够极大降低设备的热应变。进一步地,提高级的数量是优选的,因为多级流化床中的粉末的流动性质变得更加接近活塞流。以上知识应当反映在装置设计中。
[0303]
在此,粉末的反应速率取决于它的比表面积。因此,当粒径大时,将会降低反应速率。因此,优选地,使用细粉或使用通过粒化细粉获得的多孔颗粒。然而,使用细粉的流化床易于导致漂移,并且通常认为难以流化细粉。为了能够对细粉进行流化并对粉末进行均匀化处理,优选地,使用利用专利文件2的摆动机构的多级流化床。
[0304]
此时,在利用细粉的流化床中,由于均匀流化使得流化床的床高易于扩展,并且床的这种扩展提高了床内的孔隙率,使得气体滞留时间增加。另一方面,因为粉末占用的体积减少,所以粉末滞留时间倾向于缩短。因此,必须小心不要缩短滞留时间太多。
[0305]
接下来,应该关注伴随粉末反应的性质变化。即,当反应进行到100%时,全部物质转变为不同的其它物质。换而言之,颗粒的真比重改变;结果,发生颗粒性质的改变,诸如,粒径改变。因此,当反复进行粉末的脱水反应和脱碳酸反应及其再生时,可以想象,这些性质改变影响了操作条件,诸如粉末处理。为了抑制这种性质改变对粉末流动特性的影响,可以设想粉末处理,诸如,用非活性物质(诸如,二氧化硅)封装粉末。最简易的方式可能是,在没有进行此类处理的情况下,限制反应速率为50%或30%。
[0306]
表6中的示例是当1kmol碳酸镁反应高达100%时的试算。如果这设置为50%,则400-500℃范围内移除的热量将会减半,且不充足。在这种情况下,需要使待送入的碳酸镁粉末的量翻倍至2kmol,并将碳酸镁粉末的反应量维持在1kmol。此时,关于显热,140℃与500℃之间的每摩尔碳酸镁的显热值为氧化镁的摩尔显热的约2.3倍。因此,因为待加入的碳酸镁的量增加了1kmol,所以与这个显热相对应的2.3kmol氧化镁的输入量应当从4.74kmol减少至2.44kmol。
[0307]
以上试算仅是机上计算,并且反应器内部的实际温度可以因为各种因素而变化。为了处理这些变化,优选地,通过调整反应气体的供给量来控制生成的热量,这是因为对装置条件反映的响应速度较快。此外,当出于部分移除热量的目的,安装传热管时,可以调整通过传热管移除的热量。
[0308]
如上所述,本发明的主要特征之一是,使用用作流化介质的无机粉末和用于移除甲烷化反应热的化学蓄热剂,化学蓄热剂是300℃以上吸热的氢氧化镁和碳酸镁以及氧化镁。因为这些粉末不会改变,除非它们与水分或二氧化碳接触,所以在大气压下,能够稳定存储它们长的时间段(蓄热)。
[0309]
因此,如果由甲烷化反应器提取并冷却的氧化镁粉末被输送至工厂排放的含二氧
化碳的烟气中,并存储在筒仓中,则氧化镁能够用于生成这些工厂中需要热量时所需的热。在这些工厂需要热量时,取出所需量的氧化镁、再生过程中水合反应和进一步的碳化反应,然后在再生期间能够回收并使用储存的热。
[0310]
一般而言,工厂里废热利用率不会提高的理由是,释放的废热的温度、量和时间并不匹配对利用废热的工艺的温度、量和时间的需求。然而,在工厂中热利用峰值处,提取并再生这些粉末,此时生成的热能够被回收并用于,诸如预加热锅炉水或预加热锅炉燃烧空气。即,能够弥补工厂热使用的一部分。
[0311]
这意味着,当将氢气转化为甲烷时损失的17%能量不会损失,并能够在其它地方有效使用。
[0312]
总结利用本发明多级流化床的甲烷化反应器的特征。
[0313]
a.它提升了反应器中生成的反应热的热量移除性能,抑制了催化剂表面温度的提升,并有助于催化剂寿命的延长。
[0314]
b.从反应器的底部到顶部逐步降低多级流化床中的温度,另外,通过选择并使用在每个温度范围内起作用的催化剂,即使在温度低的反应器出口处,在没有降低反应速率的情况下,也能够实现到甲烷的高转化率。然后,能够降低残留氢气浓度。
[0315]
c.针对多级流化床中300℃以上温度范围内的大量的放热量,分解并吸收热的化学蓄热剂,诸如氢氧化镁粉末和碳酸镁粉末,混合在用作流化介质的无机粉末中,并通过将混合粉末送入甲烷化反应器中,在这个温度范围内使用混合粉末进行热量移除。这些吸热反应极大地增加了这个温度范围内的热量移除能力。
[0316]
d.从氢氧化镁脱水反应和碳酸镁脱碳酸反应获得的氧化镁能够再生并使用,并且这个再生处理期间生成的热能够被回收并使用。通过使用这个回收热,当将氢气转化为甲烷时,可以降低能量损失。
[0317]
e.氧化镁、氢氧化镁和碳酸镁是化学蓄热剂,并且只要隔绝了水分和二氧化碳,它们就能在大气压下稳定存储和输送。然后,工厂烟气中的二氧化碳(即,二氧化碳源)反应以在氧化镁再生处理期间形成碳酸镁。因此,通过将烟气中的二氧化碳固定在碳酸镁中,并将它输送至甲烷化反应器,能将这个二氧化碳转化为甲烷进行再利用。
[0318]
f.因为与二氧化碳反应的碳酸镁能够在大气压下易于存储并输送,因此即使二氧化碳再生源的操作时间和处理能力与甲烷化反应器并不匹配,此外,即使作为二氧化碳源的工厂规模小并且它们的位置较为分散,但是在将从这些工厂的烟气获得的碳酸镁输送至甲烷化反应器并储存收集到的全部碳酸镁之后,能够通过从存储中取出所需量的碳酸镁,将碳酸镁中的二氧化碳转化为甲烷。即,在没有彼此干扰的情况下,能独立并单独执行有效操作。
附图说明
[0319]
[图1]吉布斯自由能变δg与本工艺中涉及的各种反应的温度之间的关系。
[0320]
[图2]关于甲烷化反应,由δg计算的平衡常数k获得的二氧化碳与甲烷的转化率与温度之间的关系。在该图中竖直条是多级装置每一级中的转化率。
[0321]
[图3]配备有用于热量移除的传热管的一级流化床。
[0322]
[图4]配备有用于热量移除的传热管的二级流化床,其中,粉末在反应器与外部冷
却器之间循环。
[0323]
[图5]配备有摆动机构和用于热量移除的传热管的多级流化床的概念图。
[0324]
[图6]多级流化床内一个级中的蜂窝状催化剂、用于热量移除的传热管和摆动多孔板的布置的示例。
[0325]
[图7]再生过程的方框流程图,左侧是将氧化镁的一部分或全部再生为氢氧化镁的过程;并且右侧是将氢氧化镁的一部分或全部再生为碳酸镁的过程。
[0326]
[图8]当氧化镁再生为氢氧化镁时或当氢氧化镁再生为碳酸镁时使用的配备有摆动机构的移动床。
[0327]
[图9]当化学蓄热剂在甲烷化过程和化学蓄热剂再生过程之间循环时化学蓄热剂和热量的流动。
[0328]
[图10]示出由可再生能源生成氢气的工厂、与其相邻的甲烷化装置、固定多个工厂烟气中二氧化碳的含二氧化碳的碳酸镁粉末的输送线、二氧化碳提供给甲烷化反应以及来自甲烷化工厂的氧化镁再循环至工厂进行再生的概念图。
具体实施方式
[0329]
上面已描述了利用化学蓄热剂的多级流化床的甲烷化反应器的可能性和特征。下文将描述实现该功能的设备。
[0330]
氢氧化镁的脱水和氧化镁的水合、以及碳酸镁的脱碳酸和氢氧化镁或氧化镁的碳酸化,这些是添加至流化介质中的化学蓄热剂。这些反应发生在固体表面。因此,为了提高反应速率并增加气体的滞留时间,优选地,使用具有高比表面积的细粉。然而,细粉通常被认为难以自身流化。因此,需要设计一种实现细粉均匀流化的方式。
[0331]
为了流化细粉,使用振动流化床,其中,整个流化床上下振动。当然,这种方法也能应用于该甲烷化反应器,但是对于这个系统而言,因为振动能量与设备的质量和幅度成比例,所以设备越大,振动所需的能量就越大。
[0332]
另一方面,使用专利文件2的摆动机构的多级流化床中,在没有移动设备的情况下,仅仅轻轻摇动在内部的粉末。
[0333]
因此,待移动的质量比其中整个装置振动的振动流化床系统小很多。
[0334]
据说,振动流化床的优选振动频率应当为5-50hz,但是在摆动机构的情况下,该值小至约0.01-1hz。因为振动能量与振动频率的平方成比例,因此可以看出,与振动流化床所需的能量相比,这种摆动运动所需的能量要小得多。
[0335]
如上所述,从所需能量的角度看,在本发明的甲烷化反应器中,优选地,使用配备有摆动机构的多级流化床,以便能够流化细粉并均匀化处理粉末。
[0336]
接下来,图5示出了使用多级流化床的甲烷化反应器的概念。在本图中,流化床具有四级结构,但并不受限于四级结构,也可以使用多于四级。在本图中,140℃无机粉末被送入顶级,底部温度为400℃或500℃,并且各个级中中间温度变化。
[0337]
此外,在本图中,假设细粉用作粉末,上述摆动机构用于辅助细粉的均匀流化。
[0338]
出于这个目的,示出了用于驱动摆动机构的电机16、用于将旋转运动传输至摆动板的驱动轴17和多孔摆动板18。
[0339]
当使用该摆动机构时,除了平均床中粉末的堆积密度之外,从供给端口15进入分
散板上的粉末散布在分散板的整个表面上,并通过利用摆动多孔板18的摆动运动而平滑地整平。
[0340]
同样在此,假设使用大粒径的催化剂19,并通过摆动板的移动在分散板上碾压催化剂19。本图中的催化剂颗粒19具有大粒径的理由是,在粉末中在没有被流化气体流化的情况下,它们留存在每一级的流化床中。当然,当使用模塑体,诸如蜂窝时,就不需要碾压催化剂。
[0341]
图6示出了催化剂、用于热量移除的传热管和床内多孔摆动板的布局的图,在这种情况下仅取出以多级流化床中的一级。
[0342]
粉末通过下降管20从上流化床进入下流化床。
[0343]
在此,蜂窝状催化剂19固定在用于热量移除的传热管5下方。当反应气体通过蜂窝状催化剂时,它在催化剂表面上进行反应。在该蜂窝状催化剂下方在粉末床内存在摆动多孔板18;水平摆动运动在水平方向上平均粉末的堆积密度,预防飘移发生,并确保气体与粉末和催化剂的均匀接触。
[0344]
在流化床中经过预定的滞留时间后,粉末从下降管的堰21逸出,进入下降管20,并移动至下流化床。
[0345]
无机粉末中的氢氧化镁和碳酸镁吸收反应热,并在甲烷化反应器中转变为氧化镁。在它们的再生处理中,含氧化镁的无机粉末与水蒸气反应,以将氧化镁转化为氢氧化镁;然后氢氧化镁与二氧化碳反应,以形成碳酸镁。
[0346]
图7是这个氧化镁再生过程的方框流程图。该图的左侧是冷却后由氧化镁进行水合反应形成氢氧化镁的方框流程。该图的右侧是碳化氢氧化镁的一部分或全部以形成碳酸镁的方框流程。
[0347]
从甲烷化反应器28提取的氧化镁粉末在外部粉末冷却器11中冷却,然后在水合反应设备30中作为氢氧化镁返回甲烷化反应器28中。另外,当氢氧化镁的一部分待制备成碳酸镁时,这部分氢氧化镁在碳化反应设备31中制备成碳酸镁。
[0348]
在此,待处理粉末的循环比不一定是100%。
[0349]
在图3至图6中的三个试算中,粉末中的氢氧化镁和碳酸镁的比值为无机粉末的添加量的约25-35%,并且剩余物是未参与甲烷化的无机粉末(氧化镁等)。换而言之,能够通过仅再生对于抵消甲烷化反应器中的放出热所需的氢氧化镁和碳酸镁的量,来执行氧化镁再生。
[0350]
因此,在该方框流程图中,来自外部粉末冷却器11的氧化镁的一部分和来自水合反应器30的氢氧化镁粉末的一部分被提取,并与处理后的粉末混合以生成甲烷,然后将混合粉末输送至化学反应器28。
[0351]
图8是针对化学蓄热剂使用移动床作为再生处理反应器的情况的概念图。
[0352]
一旦通过外部粉末冷却器对提取自甲烷化反应器的粉末冷却,然后粉末被送入该再生反应器的上部10。
[0353]
优选地,利用能够在粉末与气体之间进行高效逆流接触的移动床对无机粉末进行再生处理。
[0354]
在使用移动床进行再生处理的情况下,当使用细粉时或者即使不使用细粉也增大装置尺寸时,因为飘移易于发生,因此优选地使用具有摆动机构的移动床,以便抑制飘移发
生,并能够进行无机蓄热剂的均匀再生。
[0355]
在图8中,移动床中的摆动多孔板18和用于热量移除的传热管5沿着高度方向交替地安装,驱动电机16的旋转运动通过传动轴17传递给多孔摆动板,以生成摆动运动。因此,沿着水平方向平整粉末床,以防止飘移发生,并使得气体与粉末之间能够均匀接触。
[0356]
在氧化镁的水合反应中,因为湿蒸汽优选地用于水蒸气(即,反应气体),所以该湿蒸汽从在下部的气体分配器27分散并供给到移动床中,以形成活塞流。
[0357]
在再生处理后,粉末从反应器下部提取,并通过输送管13输送至碳化步骤,或经由储存罐传输至甲烷化反应器。
[0358]
在氢氧化镁的碳化反应中,从下空气分配器27供给二氧化碳或烟气(也是反应气体),以均匀分散在这个移动床中。
[0359]
最后,从甲烷化反应器出来的产物气体是未反应的二氧化碳、氢气和140℃含蒸汽的甲烷。在将这个产物气体存储在储存罐中之前,它被图5中所示的气体冷却器25冷却,以冷凝包含的蒸汽,从而从生成的甲烷气体中分离并移除出来。
[0360]
少量包含的未反应的二氧化碳可以通过诸如利用氢氧化钙的水溶液进行化学吸收以转化为碳酸钙的方法去除,然后可以获得含有约1%氢气的甲烷。
[0361]
工业实用性
[0362]
本发明涉及一种利用氢气和二氧化碳合成甲烷的反应器。二氧化碳是一种温室气体,并且它的主要来源是燃烧化石燃料(诸如煤炭、石油和天然气)的锅炉。如果由可再生能源生成的氢气能够覆盖来自这些燃料的能量总量,则它是优选的。然而,氢气极易爆炸,且必须在相当高的压力下进行储存。使用氢气作为通用燃料具有极大风险。因此,如果该氢气能够转化为甲烷并使用,则将会极大改进了它的安全性和易用性。因此,期望一种高效的甲烷化反应器。
[0363]
如上所述,甲烷是一种优异的通用燃料;但是,另一方面,通过将氢气转化为甲烷,热能量减少了约17%。
[0364]
如果在热量移除期间,甲烷化反应器中生成的热会释放到环境中,则将会损失氢气所具有的热能的17%。如果该热量能够被存储,然后能有效使用储存的热,则能够有效使用全部热能。出于这个目的,优选地,使用含氢氧化镁和碳酸镁(即化学蓄热剂)的无机粉末用作流化介质,并且作为甲烷化反应器中使用的多级流化床中反应热的热量移除方法。
[0365]
此外,当对这个碳酸镁进行脱碳酸而释放的二氧化碳可以用作甲烷化的原材料时,该技术将成为一种将二氧化碳固定为碳酸镁并更加有效地使用二氧化碳的ccus技术。
[0366]
作为具体形象,该ccus技术能够用于将来自发电厂锅炉、水泥工业、钢铁工业等(其为二氧化碳的大规模来源)的烟气中的二氧化碳固定为碳酸镁。该碳酸镁输送至氢气生产设施,并且能够由氢气和碳酸镁在这个设施中的甲烷化反应器中合成甲烷。结果,可以通过使用该甲烷或将它供应给其它作为燃料,来实现碳循环。
[0367]
当前,用于捕集二氧化碳的ccs技术的主流是利用基于胺的吸收剂的方法,并且自然地,这种二氧化碳也能用作针对甲烷化的原材料的供给源。然而,必须对二氧化碳加压以进行储存。
[0368]
另一方面,由于其能够在大气压下稳定长期储存以及易于输送,所以认为碳酸镁是有优势的。
[0369]
通过这个技术,碳酸镁粉末被储存在储存罐中,并易于从储存罐中取出并输送。这种技术不仅能应用于上述大规模的二氧化碳生成源,还能应用于彼此分离且分散的小规模的二氧化碳生成源。
[0370]
因此,通过将多数这种小规模工厂生成的二氧化碳转化为碳酸镁,并将它们输送至甲烷化反应器中进行聚集并储存,来自这些小型分布二氧化碳源的二氧化碳也能转化为甲烷。
[0371]
这意味着,这种技术不必受限于大规模发电厂的锅炉,但是多数来自位置分散的小规模工厂的烟气中的二氧化碳被固定为碳酸镁,然后输送至具有甲烷化反应器的设施,并且转化为甲烷。
[0372]
从大规模二氧化碳源捕集并转化二氧化碳无疑是非常重要的,但最终,也需要从位置分散的小规模二氧化碳源捕集并转化二氧化碳。本发明的方法对此类情况也是有用的。
[0373]
在图9中概述了根据本发明的热和质量流。
[0374]
968mj/kmol的氢气燃烧热在甲烷化反应器28中转化为甲烷,并且通过热生成释放165mj/kmol燃烧热,减少至803mj/kmol。在该图中,甲烷化反应器的内部温度在底部为约500℃,在顶部为200℃;但是底部与顶部之间的流化床温度逐步改变。随着气体反应的进行以此方式降低反应温度,装置出口处的到甲烷的转化率能够提高。
[0375]
通过吸收该反应生成的热,氢氧化镁脱水为氧化镁,并且碳酸镁脱碳酸为氧化镁。即,生成的氧化镁吸收165mj/kmol的热并将其储存。
[0376]
接下来,通过诸如粉末输送的方式,将该氧化镁粉末通过化学蓄热剂的循环回路36传输至再生处理设施34中。在此,因为当氧化镁再生时,甲烷化反应器中吸收的165mj/kmol的反应热被释放,因此能够将其回收并使用。这意味着,甲烷化反应器中生成的热由热蒸汽34携带至再生设施,并在再生设施中回收并使用它。
[0377]
在该再生处理设施中,氧化镁再生为氢氧化镁和碳酸镁,其再次经由循环回路36输送至甲烷化反应器进行再利用。这样,镁基化学蓄热剂充当用于将来自甲烷化反应器28的热输送至再生处理设备34的介质,以及充当用于将再生处理设备34中的二氧化碳传输至甲烷化反应器28的输送介质。镁基化学蓄热剂在这两个设施之间循环。在此,当粉末在甲烷化反应器和再生处理装置中聚集或破碎时,在该循环回路中,应当添加粉碎或制粒工艺以促进粉末处理。
[0378]
图10以甲烷化反应器与再生反应器之间的流示出了图9的热和材料流的概念。从多个工厂34收集到的将二氧化碳固定为碳酸镁的粉末,被输送至正储存由可再生能源生产的氢气的甲烷化设施28,其中,该碳酸镁和由氢气生成设施35供给的氢气用于生成甲烷。并且,甲烷存储在甲烷气体的盛放器29中。
[0379]
从甲烷化反应设备28中提取的氧化镁粉末由外部粉末冷却器11冷却至室温,然后储存在储存罐32中,诸如筒仓中。该氧化镁粉末返回二氧化碳源工厂34,被水合为氢氧化镁,然后通过吸收来自工厂烟气的二氧化碳而再生为碳酸镁。一旦氢氧化镁和碳酸镁储存在储存罐33中,它就会被输送至甲烷化设施28。换而言之,分隔较远的工厂烟气中的二氧化碳能通过将其转化为碳酸镁的工艺而转化为甲烷。另一方面,在每个工厂34中,当氢气转化为甲烷时储存的热能可以通过在再生为碳酸镁时产生热量来使用。
[0380]
即,根据该观点,氢气转化为甲烷过程中损失的能量可以被回收并用于其它工厂中。
[0381]
另一方面,每个工厂都以碳酸镁的形式提供二氧化碳,以换取该量的热量。此外,即使热生成的量和时间与需求不同,但是甲烷化反应设施与二氧化碳生成源之间的能量交换也能够通过蓄热剂、储存罐和输送而彼此独立操作。这也是本发明的一个优势。
[0382]
根据图1中的计算线,认为即使在140℃左右,氢氧化镁的碳化反应也能充分进行。
[0383]
另一方面,在胺吸收方法中,需要冷却烟气温度至20-60℃,用于吸收二氧化碳;但是在本发明中,不需要这种冷却。即,在没有冷却的情况下,烟气中的二氧化碳直接转化为碳酸镁。因此,另一个优势是它不会影响有效的堆叠高度。
[0384]
现今,作为对抗全球变暖的措施,强烈呼吁减少二氧化碳排放和促进可再生能源的利用。
[0385]
根据本发明,在表5所示的情况下,直接使用锅炉中燃烧燃料后提取的二氧化碳;或者在表6所示的情况下,二氧化碳固定为碳酸镁并进行使用。在任一情况下,使用由可再生能源获得的绿色氢气可以将二氧化碳转化为燃料甲烷,并将其再利用作为合成燃料。换而言之,这是一种实现完全碳循环并有助于急剧减少二氧化碳排放作为全球变暖的对策和减少化石资源使用的ccus技术。
[0386]
[标号描述]
[0387]
1 流化床或移动床装置
[0388]
2 粉末的流化床或移动床
[0389]
3 气体流
[0390]
4 气体分布板
[0391]
5 用于冷却的传热管
[0392]
6 冷却介质(水、油等)
[0393]
7 流化床下级
[0394]
8 用于反应气体的连接管
[0395]
9 粉末排放部分
[0396]
10 来自反应器底部的粉末输送线
[0397]
11 外部粉末冷却器
[0398]
12 移动床
[0399]
13 到反应器上部的粉末输送(供给)线
[0400]
14 多级流化床
[0401]
15 到多级流化床的粉末供给单元
[0402]
16 用于摆动机构的驱动电机
[0403]
17 用于摆动机构的驱动轴
[0404]
18 摆动多孔板
[0405]
19 催化剂颗粒、蜂窝状催化剂
[0406]
20 下降管
[0407]
21 下降管的溢流堰
[0408]
22 下降管底部的分隔板
[0409]
23 原材料气体供给端口
[0410]
24 生成气体出口
[0411]
25 生成气体冷却器
[0412]
26 冷却后生成的气体
[0413]
27 气体扩散器(气体分布器)
[0414]
28 甲烷化反应器
[0415]
29 生成甲烷盛放器
[0416]
30 水合反应器
[0417]
31 碳化反应器
[0418]
32 氧化镁储存罐
[0419]
33 再生处理后的粉末储存罐
[0420]
34 工厂(水合反应设施+二氧化碳源)
[0421]
35 氢气生成装置
[0422]
36 化学蓄热剂的循环回路
[0423]
37 吸收的反应热流
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1