新的核酸配体及其鉴定方法与流程
本技术涉及新的核酸配体及其鉴定方法。
背景技术:
1、1.用于适配体检测的selex技术
2、适配体是可以与各种类型靶标结合的单链核酸(dna或rna)片段,包括低分子化合物和蛋白,具有高亲和力和特异性。适配体只能特异性地结合靶标分子,因此结合亲和力非常高,从几μm到几nm的水平。与单克隆抗体类似,适配体特异性识别并结合靶标。因此,适配体能代替单克隆抗体用于诊断试剂、分析试剂、有害物质检测等,并且可应用于生物传感器、生物成像、药物递送和药物领域。例如,自2004年fda批准的作为治疗黄斑变性药物的第一个适配体药物macugen以来,基于适配体的药物在世界范围内得到了积极的研究和开发。在韩国,学术界和生物技术公司对适配体越来越感兴趣。
3、适配体的检测和开发通过被称为指数富集的配体系统进化技术(selex)的方法来完成。selex最早开发于1990年,是一种从具有随机序列的核酸文库中反复筛选与所需靶标结合的寡核苷酸,由此可以获得对“一种特定靶标”具有高结合亲和力的核酸适配体的方法。也就是说,在selex方法中,从selex核酸文库中选择结合靶标的寡核苷酸,并使之与未结合靶标的寡核苷酸分开,其中selex核酸文库包括1014至1016个单链随机寡核苷酸,每个寡核苷酸通常由40至100个核苷酸组成。结合靶标的寡核苷酸通过pcr扩增,然后经扩增的寡核苷酸再次用作文库池(library pool)。将上述选择过程重复几次,以排除未结合靶标的寡核苷酸,从而获得以高亲和力与“仅一种靶标”特异性结合的适配体。
4、基于这种技术,研究和开发聚焦于如何更快且更准确地检测和筛选与一种靶标特异性结合的适配体,或者如何寻找实际上具有效用或治疗效果的适配体。例如,在经典selex过程中,研究和开发聚焦于改变结合条件、进行选择的平台、靶标的类型、核酸文库的设计,或者寡核苷酸文库固定于其上的基质,以简化该过程或产生改进的适配体(非专利文献1)。因此,在最初的经典selex之后,开发了阴性selex(negative selex)和反向selex(counter selex),并且此后,开发了另外的技术,诸如ip-selex、捕获-selex、细胞-selex、ce-selex、m-selex、afm-selex、aegis-selex和动物-selex(animal-selex)(非专利文献1)。
5、迄今为止,已经开发的selex和适配体研究的方向具有不变的前提条件,即寡核苷酸仅与一种靶标结合。该方向是找出仅对一种靶标具有特异性结合亲和力的寡核苷酸,即适配体。正在进行各种额外的研究,以将通过现有selex方法开发和研究的适配体用于各种目的,但是在将适配体用作药物时出现了下述问题。
6、2.来自常规selex技术的适配体的局限性
7、通过常规selex技术获得的适配体由于其物理化学性质而在体内实际用作药物具有致命缺点。也就是说,由于核酸酶降解导致的不稳定性和快速肾清除已经成为适配体临床应用的主要障碍(非专利文献2)。已经进行了各种研究来解决这些问题。
8、由于被通常存在于活体内的核酸酶降解,适配体在血清中具有约5分钟的半衰期,在细胞中具有约1小时的半衰期(非专利文献3)。为了保护适配体免受核酸酶降解,可以对适配体进行化学修饰,其中已知各种方法,例如修饰寡核苷酸的两端、核酸的糖结构或者磷酸二酯主链。此外,适配体具有小于5nm的平均直径,以及约6至30kda的分子量。因此,尽管通过使用经修饰的核苷酸在一定程度上解决了适配体的代谢不稳定性,但是适配体的临床应用受限于通过血管施用的适配体由于其分子量小而通过肾迅速从体内排出,因此具有缩短的停留时间(非专利文献2)。为了克服这个问题,适配体被配制成与大分子,诸如聚乙二醇(peg)、蛋白、胆固醇、脂肪酸或脂质体缀合的形式,因此不容易通过肾脏过滤,从而延长了在体内的停留时间。其中,peg的应用最为广泛。
9、然而,为单链寡核苷酸的适配体天然形成各种三维形状,诸如螺旋和环,并且这些三维结构参与靶标识别和结合。适配体对靶的亲和力和特异性敏感地受到其结构的影响。因此,足以预测的是,selex后过程中用大分子对适配体的修饰会对适配体的性质和折叠结构产生的不利影响。
10、特别是,已有案例报道,由于体内已经存在针对peg的抗体,使用peg化的适配体来增加适配体在体内的循环半衰期在iii期试验中引起严重的过敏反应(非专利文献4)。此外,将适配体与大分子(诸如peg)一起使用可能会失去治疗作用,这是因为这种分子会影响适配体的结构而使得对所需靶标的亲和力或特异性降低。此外,适配体的修饰或者适配体与其他物质的使用可能会改变适配体生产中每批次中适配体的品质或性能,因此难以恒定地控制适配体的品质,且因此,当将适配体实际制成药物时,不能确保其效果的一致性。品质控制所需的高成本降低了适配体生产成本低的优势。
11、此外,迄今为止研究的适配体不能通过细胞膜主动地单独递送到细胞质中。因此,已经开发的大多数适配体为仅靶向膜蛋白或分泌蛋白,并且靶向细胞质或胞内细胞器的膜中存在的蛋白的适配体主要选自经纯化的蛋白,其中载体,诸如转铁蛋白、胆固醇和脂质体被用于提高所选适配体的细胞渗透性。因此,为了将适配体用作实际应用于临床试验的药物,需要克服各种问题,并且已经进行了多种尝试来克服这些问题,但是最终,失败的案例不断出现在临床试验中。macugen是迄今为止唯一被批准的适配体药物。因此,持续需要一种新的物质,其可以通过解决适配体的问题而被临床使用并实现为实际药物。
12、3.双特异性适配体及其局限性
13、如上所述,适配体具有仅结合一种靶标的性质。为了克服这一局限性,已经持续研究了双特异性或多特异性适配体,其具有对不同靶标具有特异性结合亲和力的两个或更多个适配体。
14、双特异性适配体由两个不同的适配体组成,并且这种特征可以促进或调节例如功能性分子和靶标细胞之间的免疫反应,因此已经主要在免疫抗癌药物领域进行了持续研究(非专利文献5)。
15、然而,构成双特异性适配体的每个单特异性适配体具有特异性结合其靶标的独特结构,因此这些在有或没有接头的情况下相互偶联的适配体可能相互干扰,因此可能会影响每个适配体的特异性结合亲和力。特异于不同靶标的两个适配体的简单结合不能保持对两种靶标的结合亲和力完整,也不能确保这一点。因此,为了获得正确发挥功能的双特异性适配体,难以通过无数次试验和错误来找到既不相互干扰也不影响彼此结构的适配体。而且,需要检查接头是否不影响适配体,甚至在适配体的偶联期间也需如此(专利文献2:美国专利no.8969318)。因此,双特异性适配体的检测是非常令人疲惫的。
16、此外,双特异性适配体难以大规模生产,并且可能会丧失作为适配体优点之一的易于制造性。随着适配体越来越长,具有所需序列的纯的经纯化的适配体在制造或合成期间越来越难以分离,导致杂质增加,因此品质控制困难。因此,为了满足需要考虑最终产物的纯度和合成产率的大规模生产过程,适配体的长度优选尽可能短。然而,大多数双特异性适配体是通过接头偶联两个适配体获得的,这是适配体作为药物商业化的实质性限制。
17、此外,由于双特异性适配体具有上述适配体作为药物的缺点(体内不稳定性、快速肾清除、不能递送至细胞等),所以双特异性适配体难以用作药物。
18、(专利文献1)korean patent publication no.2019-0126356
19、(专利文献2)u.s.patent no.8,969,318
20、(非专利文献1)zhang et al.,recent advances in aptamer discovery andapplications,molecules 2019,24,941
21、(非专利文献2)zhou,j.;rossi,j.aptamers as targeted therapeutics:current potential and challenges.nat.rev.drug discovery 2017,16,181-202.
22、(非专利文献3)dougan,h.;lyster,d.m.;vo,c.v.;stafford,a.;weitz,j.i.;hobbs,j.b.extending the lifetime of anticoagulant oligodeoxynucleotideaptamers in blood.nucl.med.biol.2000,27,289-297.
23、(非专利文献4)povsic,t.j.,et al.j allergy clin immunol,2016,138(6),1712
24、(非专利文献5)m.m.soldevilla,h.villanueva,f.pastor,"aptamers:afeasible technology in cancer immunotherapy",journal of immunology research,vol.2016,article id 1083738,12pages,2016.https://doi.org/10.1155/2016/1083738
技术实现思路
1、本发明人发现了超越常规适配体概念的新的核酸配体,从而完成了本技术。
2、尽管进行了长期研究,但是常规selex方法和由此开发的适配体显示出难以克服的局限性,因此难以提供利用适配体的药物。事实上,自macugen推出以来的15年中,还没有成功的开发案例。
3、面对上述问题,本技术的发明人发现新的核酸配体(nucleic acid ligand)而非适配体(aptamer)能解决常规适配体的局限性,然后完成了本技术。适配体被定义为结合单一靶标,诸如单克隆抗体的核酸分子。然而,本技术的发明人发现了一种新的核酸配体,其能够对两种或更多种不同的靶标具有特异性结合亲和力,从而解决了常规适配体的问题。
4、根据本技术一个实施方式的核酸配体可通过利用常规selex方法来获得,并且在本领域中还没有完全知晓可检测能够结合两种或更多种不同靶标的核酸配体。从事本技术领域的研究人员或科学家认为通过使用常规selex技术不可能发现能够结合两种或更多种不同靶标的核酸配体。原因是在常规selex技术中,去除或排除不与所需靶标结合的寡核苷酸或者去除或排除与其它靶标结合的寡核苷酸是公知常识。本技术的核酸配体不符合适配体的常规定义,并且是不遵循适配体领域的发展趋势或公知常识的突破。
5、本技术的各种实施方式提供了新的核酸配体,其同时解决了当上述常规适配体应用于临床试验时出现的局限性。
6、本技术的各种实施方式提供了用于新的核酸配体的新的制备方法或新的筛选方法。
7、具体地,本技术能够提供一种新的核酸配体,其能够对两种或更多种不同靶标具有特异性结合亲和力,其中所述核酸配体与两种或更多种靶标的结合位点不是彼此分开存在的。就该点而言,根据本技术一个实施方式的核酸配体不是以两个或多个适配体彼此偶联的形式提供的双特异性适配体。
8、在一个实施方式中,当施用至血液时,与作为第一靶标的血浆蛋白(例如,白蛋白)结合并与作为第二靶标的癌细胞特异性分子结合的单一核酸配体利用第一靶标(即,与血浆中的白蛋白结合),因此可到达癌组织,同时避免在体内被核酸酶降解或肾排泄。核酸配体到达癌组织后,经由内吞作用等途径进入细胞,以与细胞中的癌细胞特异性分子结合,从而发挥预期的治疗效果。如上所述,根据本技术的一个实施方式的核酸配体是为了解决常规适配体的问题,诸如体内不稳定性、快速肾清除和不能递送到细胞中。
9、1.本技术在一个实施方式可涉及对两种或更多种不同靶标具有特异性结合亲和力的非天然核酸配体,其中所述靶标中的每一种具有三维结构,并且其中所述非天然核酸配体不是多个适配体的偶联体(非偶联的)。
10、2.本技术在一个实施方式可涉及对两种或更多种不同靶标具有特异性结合亲和力的非天然核酸配体,其中所述靶标中的每一种具有三维结构,并且其中在所述核酸配体中,形成一种靶标的结合位点的全部或部分核酸序列构成形成另一种靶标的结合位点的全部或部分核酸序列。
11、3.本技术在一个实施方式可涉及对两种或更多种不同靶标具有特异性结合亲和力的非天然核酸配体,其中所述靶标中的每一种具有三维结构,并且其中在所述核酸配体中,用于两种或更多种靶标的结合位点不是彼此分开存在的。
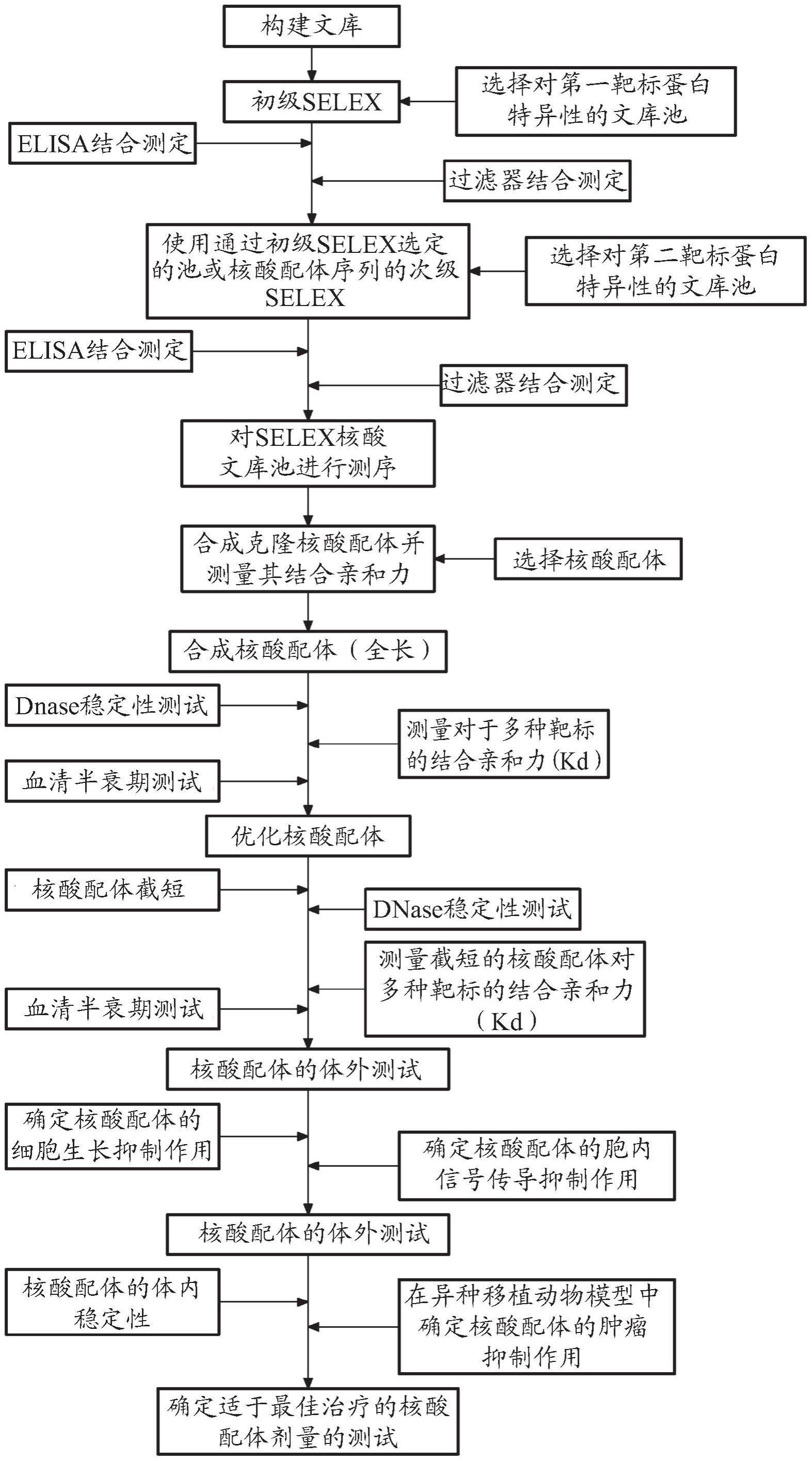
12、4.本技术在一个实施方式可涉及对两种或更多种不同靶标具有特异性结合亲和力的非天然核酸配体,其中所述靶标中的每一种具有三维结构,并且其中用于两种或更多种靶标的结合位点在一个单一核酸配体中形成。
13、5.在一个实施方式中,核酸序列形成所述靶标的结合位点的部分占所述非天然核酸配体的整个序列的约1%至约99%,约5%至约95%,约10%至约90%,约20%至约80%,约30%至约70%,或约40%至约60%。
14、6.在一个实施方式中,所述非天然核酸配体可对两种不同靶标具有特定结合特异性。
15、7.在一个实施方式中,所述靶标可选自由细胞、病毒和蛋白组成的组。
16、8.在一个实施方式中,所述靶标之一可为血浆蛋白,并且另一种靶标可为治疗性靶标。
17、9.在一个实施方式中,所述血浆蛋白可选自由白蛋白、α1球蛋白、α2球蛋白、β球蛋白、γ球蛋白、免疫球蛋白a、免疫球蛋白g、脂蛋白、纤维蛋白原、转铁蛋白和甲状腺素运载蛋白组成的组。
18、10.在一个实施方式中,所述治疗性靶标可为细胞中存在的蛋白或细胞膜中存在的蛋白。
19、11.在一个实施方式中,所述治疗性靶标可选自由膜蛋白、跨膜蛋白、糖蛋白、免疫抗体、病毒、病毒包膜糖蛋白、病毒酶、分泌蛋白、丝氨酸蛋白酶、肽激素、神经递质、激素、脱氢酶、细胞因子、e3泛素连接酶、神经肽、水解酶、丝氨酸蛋白酶抑制剂、磷酸酶、趋化因子蛋白、甲基转移酶、氧化酶、生长因子、细菌、细菌蛋白、胞内蛋白、胞外基质、受体、转录因子和肿瘤蛋白组成的组。
20、12.在一个实施方式中,所述治疗性靶标可选自由4-1bb、乙酰胆碱受体、α凝血酶、胰淀素、血管生成素1、血管生成素2、axl、bcl-2、bmpr-1r、brd1、brd2、brd3、brd4、brdt、btla、降钙素基因相关肽、creb结合蛋白(cpb)、cck4/ptk7、cd16a、cd16b、cd19、cd20、cd200、cd200r、cd27、cd28、cd3、cd30、cd32a、cd32b、cd33、cd4、cd40l、cd52、cd80、cd94、csf1r、ctla-4、ddr1、ddr2、e2f1、egfr、eph、erbb2、fgf、fgfr、胃饥饿素、gitr、磷酯酰肌醇蛋白聚糖3、促性腺激素释放激素1、hiv gp120、hiv-1整合酶、hiv-1逆转录酶、hras、hvem、icos、idh1、igf1r、免疫球蛋白e、干扰素-γ、kit、kras、lag3、lfa、l-选择素、ltk、mdm2、mdmx、粘蛋白1、myc、神经降压素1、中性粒细胞弹性蛋白酶、nf-kb、nkg2d、痛敏肽、ntrk1、ntrk2、ox-40、pd-1、pdgf、pdgfr家族、pd-l1、pd-l2、磷脂酶a2、纤溶酶原激活物抑制剂1、pp2a、ppm1d、ppp2ca、蛋白酪氨酸磷酸酶、p-选择素、psma、呼吸道合胞病毒、ret、sdf1b、setdb1、slamf7、葡萄球菌肠毒素b、stat3、腱生蛋白、tgfbr、tigit、tim3、tnfsf7、酪氨酸酶、vcam-1、vegf、vegfr家族、αvβ3整合蛋白,以及它们的突变体组成的组。
21、13.在一个实施方式中,所述治疗性靶标可选自由kras g12d、kras g12v、krasg12c、kras g12a、kras g12s、kras g12r、kras g13d、kras q61h,及它们的组合组成的组。
22、14.在一个实施方式中,所述非天然核酸配体可由约100个或更少的核苷酸组成。
23、15.在一个实施方式中,所述核苷酸可选自由dna核苷酸、rna核苷酸、其经修饰的核苷酸,及它们的组合组成的组。
24、16.在一个实施方式中,所述非天然核酸配体可由选自由seq id no:6至seq idno:183组成的组中的一种核酸序列组成。
25、17.在一个实施方式中,所述核酸可选自由单链rna、双链rna、单链dna和双链dna组成的组。
26、18.根据本发明的一个实施方式用于预防或治疗癌症的药物组合物可包括根据一个实施方式的非天然核酸配体。
27、19.在一个实施方式中,所述非天然核酸配体对作为第一靶标的血浆蛋白和作为第二靶标的治疗性靶标蛋白可具有特异性结合亲和力。
28、20.在一个实施方式中,所述药物组合物可经静脉内施用至患者。
29、21.在一个实施方式中,所述癌症可为实体癌。
30、22.在一个实施方式中,所述癌症可在癌细胞的表面表达pd-l1蛋白。
31、23.在一个实施方式中,所述癌症可为选自由脑癌、肺癌、结肠直肠癌、小肠癌、胃癌、睾丸癌、甲状腺癌、宫颈癌、皮肤癌、膀胱癌、卵巢癌、肾癌、肝癌、胰腺癌、尿路上皮细胞癌和乳腺癌组成的组中的至少一种。
32、24.在一个实施方式中,所述癌症的癌细胞可具有kras突变体蛋白。
33、25.在一个实施方式中,所述癌症可为选自由肺癌、结肠直肠癌、胰腺癌、乳腺癌、卵巢癌、子宫内膜癌、宫颈癌、膀胱癌、胆囊癌、胆道癌、皮肤癌、胃癌、脑癌、肾癌和急性髓性白血病组成的组中的至少一种。
34、26.在一个实施方式中,所述非天然核酸配体可由选自由seq id no:24、seq idno:27、seq id no:30、seq id no:84和seq id no:100组成的组中的一种核酸序列组成。
35、27.根据本技术的一个实施方式的诊断组合物可包含根据一个实施方式的非天然核酸配体。
36、28.根据本技术的一个实施方式的一种造影剂可包含根据一个实施方式的非天然核酸配体。
37、29.根据本技术的一个实施方式的放射性药物可包含根据一个实施方式的非天然核酸配体。
38、30.根据本技术的一个实施方式的用于诊断癌症的组合物可包含根据一个实施方式的非天然核酸配体。
39、31.根据本技术的一个实施方式的鉴定对两种或更多种不同靶标具有特异性结合亲和力的非天然核酸配体的方法可包括:使一个或多个核酸配体候选序列与两种或更多种不同靶标中的每一种以顺序方式接触,其中,与所述靶标中的每一种的接触包括鉴定对所述靶标具有特异性结合亲和力的一个或多个核酸配体候选序列,并且其中所述靶标中的每一种具有三维结构。
40、32.在一个实施方式中,所述方法可包括:(a)使一个或多个第一核酸配体候选序列与靶标接触,并鉴定出与所述靶标特异性结合的一个或多个第二核酸配体候选序列;和(b)使(i)步骤(a)中获得所述一个或多个第二核酸配体候选序列与和步骤(a)靶标不同的靶标接触,或者使(ii)利用步骤(a)中获得的所述一个或多个第二核酸配体候选序列制备的一个或多个第三核酸配体候选序列与和步骤(a)靶标不同的靶标接触,并鉴定出与所述不同的靶标特异性结合的一个或多个第四核酸配体候选序列。
41、33.在一个实施方式中,步骤(b)可进一步包括:通过将由多个核苷酸组成的随机序列连接到步骤(a)中获得的所述一个或多个第二核酸配体候选序列的两端中的至少一端来制备所述一个或多个第三核酸配体候选序列。
42、34.在一个实施方式中,所述随机序列可连接到所述第二核酸配体候选序列的两端中的任一端,并且在所述第三核酸配体候选序列中,所述第二核酸配体候选序列或其部分可用作核酸扩增的引物序列。
43、35.在一个实施方式中,所述随机序列可由约20至约40个连续核苷酸组成,或者所述第三核酸配体候选序列由约40至约100个连续核苷酸组成。
44、36.在一个实施方式中,所述方法可通过指数富集的配体系统进化技术(selex)来进行。
45、37.根据本技术的一个实施方式,一种鉴定对两种或更多种不同靶标具有特异性结合亲和力的非天然核酸配体的方法,所述核酸配体通过从一个核酸文库开始通过指数富集的配体系统进化技术(selex)来鉴定,所述方法可包括:在每轮selex中,从由两种或更多种不同靶标组成的组中选择一种靶标,每种靶标具有三维结构;和在每轮selex中,选择对所选靶标具有特异性结合亲和力的核酸配体。
46、38.在一个实施方式中,在针对一种靶标完成一轮或多轮进行的selex之后,可进行针对另一靶标在一轮或多轮中进行的selex。
47、39.在一个实施方式中,所述方法可包括:(i)对一种靶标进行一轮或多轮selex;(ii)通过使用步骤(i)中获得的核酸文库,对与步骤(i)中的靶标不同的靶标进行一轮或多轮selex;(iii)通过使用在步骤(ii)中获得的核酸文库再次进行步骤(i);以及(iv)重复步骤(i)至(iii)。
48、40.在一个实施方式中,所述方法可进一步包括:进行阴性selex或针对所述靶标的另一性状进行反向selex。
49、39.在一个实施方式中,所述selex可为选自由经典selex、高级selex、ip-selex、捕获-selex、细胞-selex、ce-selex、m-selex、afm-selex、aegis-selex和动物-selex组成的组中的至少一种。
50、41.在一个实施方式中,所述方法可进一步包括:评估所述经鉴定的核酸配体候选序列对靶标的特异性结合亲和力
51、42.在根据一个实施方式的方法中,所述靶标可选自由细胞、病毒和蛋白组成的组。
52、43.在根据一个实施方式的方法中,所述靶标可为两种不同的靶标。
53、44.在根据一个实施方式的方法中,所述靶标之一可为血浆蛋白,另一种可为治疗性靶标。
54、45.在根据一个实施方式的方法中,所述非天然核酸配体可由约40至约100个核苷酸组成。
55、46.在一个实施方式中,所述方法可包括:从经鉴定的核酸配体候选序列中的每一个中移除不涉及对靶标的特异性结合亲和力的核苷酸。
56、47.根据本技术的一个实施方式,一种从样品中检测靶标的方法可包括:使样品中的靶标与根据一个实施方式的核酸配体接触。
57、48.通过根据一个实施方式的方法制备的根据本技术的一个实施方式的非天然核酸配体。
58、根据本技术,在一些实施方式中,新的核酸配体是单一核酸配体,并且可以表现出对两种或更多种不同靶标优异的特异性结合亲和力。
59、根据本技术,在一些实施方式中,当作为药物施用到体内时,该新的核酸配体特异性结合血浆蛋白,因此可表现出优异的体内稳定性、缓慢的肾清除和通过内吞作用等途径递送到细胞中的能力。该新的核酸配体对依赖于治疗性靶标的疾病可表现出优异的治疗效果,并且可以用作实际应用于临床试验的药物。此外,该新的核酸配体可用于诊断、生物成像、药物开发工具、分析试剂、生物传感器、食品检测、靶标(例如蛋白)纯化等领域。
60、根据本技术,在一些实施方式中,该新的核酸配体在制备后不需要与其他大分子(例如,peg)一起使用来获得体内稳定性或缓慢的肾清除,因此可以排除这些分子影响核酸配体的结构或降低对所需靶标的亲和力或特异性的问题。因此,该核酸配体作为应用于临床试验的药物,可以完整地保持已经在测试中证实的优异的治疗效果。
61、根据本技术,在一些实施方式中,该新的核酸配体具有相对较短的序列长度(例如,约20至约100个寡核苷酸序列,优选约25至约65个寡核苷酸序列),并且不需要与其他物质一起使用。因此,在大规模生产过程中,核酸配体的品质或性能不会因批次而异,获得了容易的品质控制,并且可以满足将核酸配体用作药物的纯度和合成产率。因此,仅使用au-合成器就可以有效地大量生产该新的核酸配体。
62、根据本技术,在一些实施方式中,新的核酸配体可以结合到细胞、病毒或蛋白的三维结构,并且这种结合可表现出想要获得的优异治疗效果。
- 还没有人留言评论。精彩留言会获得点赞!