针对SARS-COV-2的抗体的制作方法
针对sars-cov-2的抗体
1.关于序列表的声明
2.与本技术相关的序列表以文本格式提供以代替纸质副本,并且特此通过引用并入本说明书中。包括序列表的文本文件名称为是930585_409wo_sequence_listing.txt。文本文件的大小为489kb,创建于2021年5月7日,并且通过efs-web以电子方式提交。
背景技术:
3.近年来出现了一种新型β冠状病毒,需要用于预防或治疗sars-cov-2感染的疗法。
附图说明
4.图1a-1d示出了某些抗体与sars-cov-2刺突蛋白rbd和sars-cov-1刺突蛋白rbd的结合。将从sars-cov-2感染中恢复的患者中分离的人单克隆抗体重组表达,并通过elisa测试rbd结合。图1a示出了五种抗体的结合,图1b和图1c各自示出了七种抗体的结合,并且图1d示出了四种抗体的结合。图1b上图中的两种抗体用黑色符号示出。在图1b中,s2x28结合由一条在被测全部浓度范围内保持在零od或接近零od的线表示。在图1b(上图)中,s2x41结合由曲线表示,其ec50为大约20.01ng/ml。在图1a-1d中的每个图中,上图示出了与sars-cov-2rbd的结合,并且下图示出了与sars-cov-1rbd的结合。每个图右侧的方框(如果存在的话)指示所指示抗体的计算的ec50值。
5.图2示出了从sars-cov-2感染中恢复的患者中分离的重组表达的单克隆抗体对sars-cov-2rbd与人ace2结合的抑制作用。用重组人ace2(内部产生)涂覆elisa板。以含有2ug/ml ace2的pbs进行涂覆。将板在4℃下温育过夜,并且在室温下用封闭剂酪蛋白(1%酪蛋白,来自赛默飞世尔公司(thermofisher))封闭1小时。
6.图3a-3f示出了使用某些针对sars-cov-2假型化病毒的抗体的感染中和测定的结果。将从sars-cov-2感染中恢复的患者中分离的单克隆抗体重组表达,并在针对用sars-cov-2刺突蛋白假型化的鼠类白血病病毒(mlv)的中和测定中进行测试。图3a示出了三种抗体的结果。图3b-3f各自示出了四种抗体的结果。在x轴所指示的浓度下对抗体进行测试。每个图右侧的方框(如果存在的话)指示所指示抗体的计算的ic50。
7.图4a-4n示出了另外的抗体与sars-cov-2刺突蛋白、sars-cov-2刺突蛋白rbd和sars-cov-1刺突蛋白rbd的结合。将从sars-cov-2感染中恢复的患者中分离的单克隆抗体重组表达,并通过elisa测试rbd结合。每个图右侧的方框示出了所指示抗体的计算的ec50值。
8.图5a-5d示出了使用另外的针对sars-cov-2假型化病毒的抗体的感染中和测定的结果。将从sars-cov-2感染中恢复的患者中分离的单克隆抗体重组表达,并在针对用sars-cov-2刺突蛋白假型化的鼠类白血病病毒(mlv)的中和测定(每个测定一种抗体)中进行测试。图5a和5c各自示出了三种抗体的结果。图5b示出了两种抗体的结果,并且图5d示出了四种抗体的结果。在如x轴所指示的浓度下对抗体进行测试。每个图右侧的方框(如果存在的话)示出了所指示抗体的计算的ec50。
9.图6a和6b示出了使用针对真实sars-cov-2病毒的单克隆抗体的感染中和测定的结果。比较抗体“s309-v2”包括如seq id no:342所示的vh氨基酸序列以及如seq id no:346所示的vl氨基酸序列(如seq id no:343-345和347-349中分别所示的cdrh1-h3和l1-l3),并且是从sars-cov-1感染中恢复的患者中分离的抗体的工程化变体。将在补充有10%fbs(vwr)和1x青霉素/链霉素(赛默飞世尔科技公司(thermo fisher scientific))的dmem中培养的vero e6细胞以20,000个细胞/孔接种在白色96孔板中,并附着过夜。将抗体的连续1:4稀释液与200pfu的sars-cov-2(分离株usa-wa1/2020,传代3,在vero e6细胞中传代)在37℃下于bsl-3设施中一起温育30分钟。去除细胞上清液,并将病毒-抗体混合物添加到细胞中。感染后24小时,用4%多聚甲醛将细胞固定30分钟,随后用pbs(ph 7.4)洗涤两次,并用含0.25%triton x-100的pbs透化30分钟。在5%奶粉/pbs中封闭30分钟后,将细胞与靶向sars-cov-2核衣壳蛋白(义翘神州科技有限公司(sino biological),目录号40143-r001)的初级抗体以1:2000稀释度一起温育1小时。在洗涤并与和1μg/ml赫斯特33342(hoechst33342)混合的次级alexa647标记的抗体一起温育1小时后,在自动细胞成像读取器(cytation 5,伯腾公司(biotek))上对板进行成像,并使用制造商提供的软件对核衣壳阳性细胞进行计数。使用prism软件(graphpad prism8.0)处理数据。
10.图7a-7d示出了使用另外的针对sars-cov-2假型化病毒的抗体的感染中和测定的结果。将从sars-cov-2感染中恢复的患者中分离的单克隆抗体重组表达,并在针对用sars-cov-2刺突蛋白假型化的鼠类白血病病毒(mlv)的中和测定中进行测试。图7a和7b各自示出了四种抗体以及从sars-cov-1感染中恢复的患者中分离的比较抗体s309(seq id no:139的vh氨基酸序列,seq id no:143的vl氨基酸序列;如seq id no:140-142和144-146中分别所示的cdrh1-h3和l1-l3)的结果。图7c示出了三种抗体和s309的结果,并且图7d示出了两种抗体和s309的结果。图7d中的抗体“s2h58”包括如seq id no:228所示的vh氨基酸序列以及如seq id no:238所示的vl氨基酸序列。在如x轴所指示的浓度下对抗体进行测试。
11.图8a和8b示出了抗体与sars-cov-2刺突蛋白rbd和sars-cov-1刺突蛋白rbd的结合。将从sars-cov-2感染中恢复的患者中分离的单克隆抗体重组表达,并通过elisa测试rbd结合。图8a示出了五种抗体和一种从sars-cov-1感染中恢复的患者中分离的比较抗体s309(seq id no:139的vh氨基酸序列,seq id no:143的vl氨基酸序列;如seq id no:140-142和144-146中分别所示的cdrh1-h3和l1-l3)的结合。图8b示出了四种抗体和s309的结合。在图8a和8b中的每个图中,左图示出了与sars-cov-2rbd的结合,并且右图示出了与sars-cov-1rbd的结合。每个图右侧的方框指示所指示抗体的计算的ec50值。
12.图9a-9f示出了使用针对sars-cov-2假型化病毒的抗体的感染中和测定的结果。将从sars-cov-2感染中恢复的患者中分离的单克隆抗体重组表达,并在针对用sars-cov-2刺突蛋白假型化的鼠类白血病病毒(mlv)的中和测定中进行测试。在如x轴所指示的浓度下对抗体进行测试。计算的ic50、ic80和ic90值(以ng/ml表示)在每个图中的图表下方示出。
13.图10a-10e示出了抗体与sars-cov-2刺突蛋白rbd和sars-cov-1刺突蛋白rbd的结合(在每个图中的下方图表中,sars-cov-1刺突蛋白rbd被标记为“sars rbd”)。将从sars-cov-2感染中恢复的患者中分离的单克隆抗体重组表达,并通过elisa测试rbd结合。在图10a-10e中的每个图中,上图示出了与sars-cov-2rbd的结合,并且下图示出了与sars-cov-1rbd的结合。每个图右侧的方框(如果存在的话)示出了所指示抗体的计算的ec50值。
no:400、766、402和404-406中分别所示的cdrh1-h3和l1-l3)以及比较抗体s309-v2对sars-cov-2感染的中和。图16c示出了通过单克隆抗体s2h37、s2h73、s2h40、s2h70和s2h71以及比较抗体s309-v2(具有m428l/n434s fc突变)对sars-cov-2感染的中和。图16d示出了通过单克隆抗体s2x30、s2h58-v1、s2h66、s2h62和s2h30以及比较抗体s309-v2对sars-cov-2感染的中和。计算的ic50值在每个图表的下方示出。
21.图17a-17c示出了使用某些单克隆抗体的感染中和测定的结果。图17a示出了单克隆抗体s2m11和s2m28的结果。图17b示出了单克隆抗体s2m16的结果。图17c示出了单克隆抗体s2m7和s2l49的结果。在针对用sars-cov-2刺突蛋白假型化的鼠类白血病病毒(mlv)的中和测定中对抗体进行测试。x轴示出了抗体的总浓度。计算的ic50、ic80和ic90值(以ng/ml表示)在每个图表下方的方框中示出。
22.图18a-18e示出了某些单克隆抗体与sars-cov-2刺突蛋白、sars-cov-2刺突蛋白rbd、sars-cov-1刺突蛋白和sars-cov-1刺突蛋白rbd的结合。将从sars-cov-2感染中恢复的患者中分离的抗体重组表达,并通过elisa测试刺突和刺突rbd结合。每个图右侧的方框示出了计算的ec50值(以ng/ml表示)。
23.图19a-19e示出了使用某些单克隆抗体的感染中和测定的结果。在针对用sars-cov-2刺突蛋白假型化的鼠类白血病病毒(mlv)的中和测定中对抗体进行测试。图19a示出了单克隆抗体s2x149和s2x179的结果。图19b示出了单克隆抗体s2d65的结果。图19c示出了单克隆抗体s2d97的结果。图19d示出了单克隆抗体s2d106的结果。图19e示出了单克隆抗体s2h101的结果。x轴示出了抗体的总浓度。计算的ic50、ic80和ic90值在每个图右侧的方框中示出,在方框的左栏中。
24.图20a和20b示出了人单克隆抗体s2x149和比较抗体s309-v2 ls(seq id no:342的vh氨基酸序列,seq id no:346的vl氨基酸序列;如seq id no:343-345和347-349中分别所示的cdrh1-h3和l1-l3;表示为具有m428l和n434s fc突变的rigg1)与sars-cov-1刺突蛋白、sars-cov-1刺突蛋白rbd和sars-cov-2刺突蛋白rbd的结合。重组表达人单克隆抗体,并通过elisa测试结合。图20a示出了抗体与sars-cov-1刺突蛋白rbd(上图)和sars-cov-1刺突蛋白(下图)的结合。图20b示出了抗体与sars-cov-2刺突蛋白rbd(上图)和未涂覆对照板(下图)的结合。图表右侧的方框示出了计算的ec50值。
25.图21a和21b示出了人单克隆抗体s2x179和比较抗体s2x200与sars-cov-1刺突蛋白、sars-cov-1刺突蛋白rbd和sars-cov-2刺突蛋白rbd的结合。重组表达人单克隆抗体,并通过elisa测试结合。图21a示出了抗体与sars-cov-1刺突蛋白rbd(上图)和sars-cov-1刺突蛋白(下图)的结合。图21b示出了抗体与sars-cov-2刺突蛋白rbd(上图)和未涂覆对照板(下图)的结合。图21b中的顶部图表右侧的方框示出了结合sars-cov-2rbd的计算的ec50值。
26.图22a和22b示出了人单克隆抗体s2h101、s2d65(22a)、s2d97和s2d106(22b)与sars-cov-2刺突蛋白rbd的结合。重组表达抗体,并通过elisa测试结合。图表右侧的方框示出了计算的ec50值。
27.图23a和23b示出了通过elisa测量的sars-cov-2rbd与人ace2结合的抗体抑制。图23a示出了单克隆抗体s2x149的结果。图24b示出了单克隆抗体s2x179和比较抗体s2x200的结果。计算的ic50值在每个图表的右侧示出。
28.图24概述了使用单克隆抗体s309和其它抗刺突抗体的定量表位特异性血清学研究的结果,如通过结合竞争、cryo-em和晶体学数据确定的。带下划线的抗体对sars-cov-1具有交叉反应性。
29.图25a和25b示出了某些单克隆抗体对sars-cov-2感染的中和。图25a示出了本公开的四种抗体以及比较抗体s309 n55q ls和s2x193的结果。s309 n55q ls包括如seq id no:342所示的vh氨基酸序列和如seq id no:346所示的vl氨基酸序列,并且包括fc区中的mlns修饰。图25b示出了抗体s2x129和s2x132以及四种比较抗体的结果。计算的ic50值在每个图表下方的方框中示出。计算的ec50和ec90值在每个图底部示出。
30.图26示出了使用vsv假病毒通过某些单克隆抗体对sars-cov-2感染的中和。数据来自一个单一实验,一式三份孔vsv-luc(刺突d19)假病毒。“ls”=fc突变m428l+n434s。
31.图27示出了某些单克隆抗体对活sars-cov-2引起的感染的中和。数据来自一式三份孔sars-cov-2-luc,moi 0.1,6小时感染。
32.图28a和28b示出了某些单克隆抗体对fcγriiia(v158等位基因)(图28a)和fcγriia(h131等位基因)(图28b)的激活。数据示出了使用表达sars cov2 s蛋白的cho靶细胞的实验。
33.图29a和29b示出了某些抗体与sars-cov-2rbd和刺突蛋白的结合(elisa)。
34.图30a和30b示出了针对sars-cov-2rbd、sars-cov-2s蛋白和sars-cov-1rbd的某些抗体的结合。
35.图31a和31b示出了在存在不同浓度的aaph(2,2'-偶氮双(2-脒基丙烷)二盐酸盐)的情况下或在uv照射后,抗体s2d106与sars-cov-2rbd的结合。aaph和uv照射两者都用于诱导抗体中的氧化应激。图31a示出了s2d106与rbd的结合,如通过间接elisa测量的。图31b示出了s2d106的结合,如通过夹心elisa测量的;x轴=rbd的浓度。
36.图32a-32c示出了s2e12和其工程化变体对感染(假病毒颗粒)的中和(参见实施例9中的表22中s2e12抗体的vh和vl序列)。图32a和图32b示出了相同实验的两次重复的结果。图32c示出了使用s2e12和其其它变体的第三个实验的结果。
37.图33a和33b示出了通过间接elisa测量的某些抗体与sars-cov-2rbd的结合。图33a示出了八种抗体的结果。图33b示出了六种抗体的一式两份实验结果的平均值。
38.图34a和34b示出了通过夹心elisa测量的某些抗体与sars-cov-2rbd的结合。图34a示出了八种抗体的结果。图34b示出了六种抗体的一式两份实验结果的平均值。
39.图35示出了使用活sars-cov-2病毒通过五种抗体对感染的中和。使用存在于被转化以表达s2e12抗体的cho细胞的上清液中的抗体产生标记为“s2e12-11”的曲线。使用在经转化的hek细胞中产生的经纯化的抗体产生标记为“s2e12 wt”的曲线。
40.图36示出了通过流式细胞术测量的某些抗体与在cho细胞表面上表达的sars-cov-2刺突蛋白的结合。每个抗体的计算的ec50值在每个抗体名称右侧的图例中示出。使用存在于被转化以表达s2e12抗体的cho细胞的上清液中的抗体产生标记为“s2e12-11”的曲线。使用在经转化的hek细胞中产生的经纯化的抗体产生标记为“s2e12”的曲线。
41.图37a和37b示出了通过某些单克隆抗体使用假病毒颗粒中和感染。图37a和图37b示出了相同实验的两次重复的结果。
42.图38a和38b示出了某些抗体与sars-cov-2rbd的结合。还示出了比较抗体s309-14
(具有vh w105f突变的s309,与s309具有与rbd类似的亲和力)的结合。图38a示出了如通过间接elisa测量的结合。图38b示出了如通过夹心elisa测量的结合。图38a和38b中的每一个都示出了一式两份实验结果的平均值。
43.图39a和39b示出了某些工程化s2e12抗体相较于亲本单克隆抗体s2e12的特性(s2e12值在y轴上指示为“wt”)。使用每个图右侧图例中列出的测定产生比较数据。
44.图40示出了某些工程化s2d106抗体相较于亲本单克隆抗体s2d106的特性(s2d106值在y轴上指示为“wt”)。使用每个图右侧图例中列出的测定产生比较数据。
45.图41示出了dc-sign/l-sign、dc-sign和ace2转基因在被工程化以过表达所指示蛋白质的hek293t细胞中的表达(免疫荧光)。参见实施例14。
46.图42示出了野生型hek293t细胞和被工程化以过表达dc-sign、l-sign或ace2的hek293t细胞中的vsv假病毒感染水平。假病毒表达具有荧光素酶报告基因的重组sars-cov-2刺突蛋白。参见实施例14。
47.图43示出了单克隆抗体s309(seq id no:139的vh,seq id no:143的vl)在被工程化以过表达dc-sign、l-sign或ace2的hek293t细胞中对vsv假病毒感染的中和。在该实施例中,抗体s309包括m428l和n434s fc突变。参见实施例14。
48.图44示出了野生型hek293t细胞和被工程化以过表达dc-sign、l-sign或ace2的hek293t细胞中的活sars-cov-2感染水平。使用具有荧光素酶报告基因的重组s蛋白确定感染。参见实施例14。
49.图45示出了单克隆抗体s309(seq id no:139的vh,seq id no:143的vl)在被工程化以过表达dc-sign、l-sign或ace2的hek293t细胞中对活sars-cov-2感染的中和。在该实施例中,抗体s309包括m428l和n434s fc突变。参见实施例14。
50.图46示出了dc-sign/l-sign、dc-sign、siglec1和ace2转基因在被工程化以过表达所指示蛋白质的hek293t细胞中的表达(免疫荧光)。参见实施例14。
51.图47示出了野生型hek293t细胞和被工程化以过表达dc-sign、l-sign、siglec-1或ace2的hek293t细胞中的活sars-cov-2感染水平。使用具有荧光素酶报告基因的重组s蛋白确定感染。参见实施例14。
52.图48示出了单克隆抗体s309(seq id no:139的vh,seq id no:143的vl)在被工程化以过表达dc-sign、l-sign、siglec-1或ace2的hek293t细胞中对活sars-cov-2感染的中和。在该实施例中,抗体s309包括m428l和n434s fc突变。参见实施例14。
53.图49示出了单克隆抗体s2e12-ls(seq id no:399的vh,seq id no:403n的vl,m428l/n434s fc突变)在被工程化以过表达dc-sign、l-sign、siglec-1或ace2的hek293t细胞中对活sars-cov-2感染的中和。在该实施例中,抗体s2e12包括m428l和n434s fc突变。参见实施例14。
54.图50a和50b示出了若干种细胞类型中的受体蛋白(包括cd209(dc-sign)和siglec蛋白)的表达分析。点的大小与表达蛋白质的所指示类型的细胞的百分比相关,并且点阴影的强度与蛋白质的表达水平相关。参见实施例14。
55.图51示出了在hek293t细胞(“亲本”)或稳定表达dc-sign、l-sign、siglec-1或ace2的hek293t细胞中表达n-荧光素酶的活sars-cov-2引起的感染。数据表示在三种感染复数(moi)下测试sars-cov-2的实验。参见实施例14。
56.图52示出了在用慢病毒瞬时转导以表达dc-sign、l-sign、siglec-1或ace2的hek293t细胞、hela细胞和mrc5细胞中sars-cov-2假型化的vsv引起的感染。未感染的细胞示出为阴性对照。参见实施例14。
57.图53示出了s2e12对感染的中和。一组7种细胞系(hela、293t(wt)、vero e6、huh7、293t ace2、mrc 5-ace2-tmprss2、a549-ace2-tmprss2克隆5、a549-ace2-tmprss2克隆10)在存在s2e12的情况下用sars-cov-2-nluc感染。感染后24小时对荧光素酶信号进行定量。
58.图54示出了s2e12对感染的中和。一组7种细胞系(hela、293t(wt)、vero e6、huh7、293t ace2、mrc 5-ace2-tmprss2、a549-ace2-tmprss2克隆5、a549-ace2-tmprss2克隆10)在存在s2e12-ls的情况下用sars-cov-2刺突蛋白假型化的vsv感染。感染后24小时对荧光素酶信号进行定量。
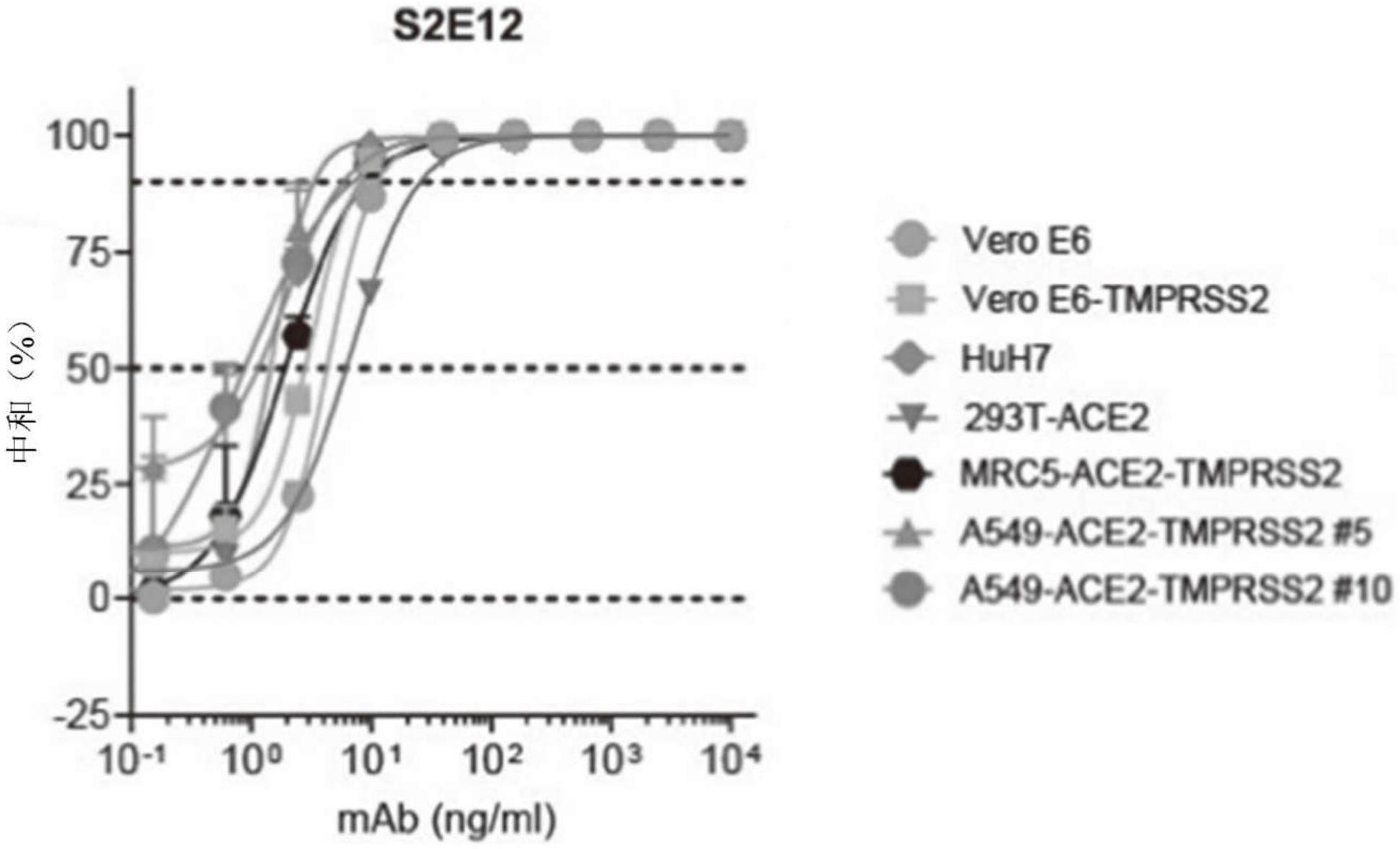
59.图55示出了通过流式细胞术定量的,经纯化的、荧光标记的sars-cov-2刺突蛋白与7种细胞系中的每一种的结合。hela和239t wt细胞的mfi最低,随后是huh7和veroe6细胞。293t ace2细胞(最高)、mrc 5-ace2-tmprss2(第三高)、a549-ace2-tmprss2克隆5(第四高)和a549-ace2-tmprss2克隆10(第二高)具有较高的mfi。
60.图56a和56b示出s309(vh seq id no:139;vl seq id no:143)或s309和s2e12-ls的组合提供了针对sars-cov-2激发的稳健的体内保护。在用sars-cov-2鼻内激发前48小时,向叙利亚仓鼠注射所指示量的mab。图56a顶行示出了感染后4天肺中病毒rna的定量。图56a中间行示出了使用tcid50测定感染后4天采集的肺匀浆中的复制病毒的定量。图56a底行示出了感染后4天评估的肺组织的组织学评分。图56b示出感染前(第0天)在血清中测量的mab浓度与感染后4天肺中的病毒rna载量负相关。参见实施例14。
61.图57示出了通过vsv-sars-cov-2假病毒对被转染以过表达ace2或一组选定的凝集素和受体候选物之一的hek293t细胞的感染。
62.图58示出了用真实sars-cov-2(moi为0.1)感染,然后固定并对sars-cov-2核蛋白(红色)进行免疫染色持续24小时的过表达dc-sign、l-sign、siglec1或ace2的稳定hek293t细胞系的显微照片。
63.图59示出了过表达dc-sign、l-sign、siglec1或ace2的稳定hek293t细胞系中荧光素酶水平的定量,如在用sars-cov-2-nluc感染后24小时测量的。
64.图60示出了在与不同浓度的抗siglec1单克隆抗体(克隆7-239)一起温育并用sars-cov-2-nluc感染后过表达dc-sign、l-sign、siglec1或ace2的稳定hek293t细胞系中荧光素酶水平的定量。
65.图61示出了vsv-sars-cov-2假病毒对瞬时转导以过表达dc-sign、l-sign、siglec1或ace2的细胞的感染。示出了hek293t细胞(左图)、hela细胞(中间图)和mrc5细胞(右图)的结果。
66.图62示出了在用ace2 sirna处理,随后用vsv-sars-cov-2假病毒感染后,过表达dc-sign、l-sign、siglec1或ace2的稳定hek293t细胞系的感染。
67.图63示出了在用不同浓度的抗ace2抗体(多克隆血清)处理,随后用vsv-sars-cov-2假病毒感染后,过表达dc-sign、l-sign、siglec1或ace2的稳定hek293t细胞系的感染。
68.图64示出了ace2、dc-sign(cd209)、l-sign(clec4m)和siglec1在人肺细胞图谱中
的分布和表达。
69.图65示出了在重度covid-19患者的支气管肺泡灌洗液或痰液中具有可检测到的sars-cov-2基因组的主要细胞类型的分析。单细胞基因表达谱示出为t-sne(t-分布式随机邻域嵌入)图,按细胞类型着色,并按病毒载量确定大小。
70.图66示出了在重度covid-19患者的支气管肺泡灌洗液或痰液中具有可检测到的sars-cov-2基因组的主要细胞类型的分析。示出了所指示细胞类型中的每个所指示细胞类型的每个细胞具有检测到的病毒rna的细胞的累积分数(y轴)与对应的logcpm(log(每百万计数);x轴)。
71.图67示出了具有在x轴上示出的受体基因的检测到的转录物的细胞计数和在y轴上示出的sars-cov-2+细胞类型的热图矩阵。来自八名受试者的总n=3,085个细胞。参见ren,x.等人,通过大规模单细胞转录组图谱揭示的covid-19免疫特征(covid-19immune features revealed by a large-scale single cell transcriptome atlas.)《细胞(cell)》,doi:10.1016/j.cell.2021.01.053(2021)。
72.图68示出了巨噬细胞和分泌细胞中的受体转录物计数(每个图的y轴)与sars-cov-2rna计数(每个图的x轴)的相关性。相关性基于ren等人的对数转换前的计数。
73.图69右侧示出了用vsv-sars-cov-2进行反式感染的结果。左图示出了反式感染过程的示意图。将用dc-sign、l-sign或siglec1转导的hela细胞与vsv-sars-cov-2一起温育,充分洗涤,并与vero-e6-tmprss2易感靶细胞共培养。右图示出了存在或不存在靶细胞的结果。
74.图70示出了反式感染的结果,其中在存在或不存在抗siglec1阻断抗体的情况下进行vsv-sars-cov-2病毒吸附。
75.图71示出了通过抗体s309、s2e12-ls和s2x33对vero-e6细胞的sars-cov-2感染的中和。s2e12-ls包括seq id no:399的vh序列和seq id no:403的vl序列以及fc中的m428l/n434s。
76.图72示出了通过抗体s309、s2e12-ls和s2x33对vero-e6-tmprss2细胞的sars-cov-2感染的中和。
77.图73示出了通过流式细胞术测量的,经纯化的、荧光标记的sars-cov-2刺突蛋白或rbd与所指示细胞系的结合的定量。“a”指示过表达ace2的细胞系;“t”指示过表达tmprss2的细胞系。
78.图74示出了通过rt-qpcr测量的,所指示细胞系中细胞ace2和tmprss2转录物的定量。“a”指示过表达ace2的细胞系;“t”指示过表达tmprss2的细胞系。
79.图75示出了通过抗体s309、s2e12-ls或s2x333对sars-cov-2-nluc感染的中和。对所指示的七种细胞系中的每一种进行测试。感染后24小时对荧光素酶信号进行定量。
80.图76示出了通过抗体s309、s2e12-ls或s2x333对vsv-sars-cov-2假病毒感染的中和。对所指示的七种细胞系中的每一种进行测试。感染后24小时对荧光素酶信号进行定量。
81.图77示出了通过免疫荧光测量的,在不存在(上图)或存在(下图)5μg/ml的抗体s2e12-ls的情况下,在质膜上表达sars-cov-2s蛋白(cho-s)的cho细胞的细胞间融合。将细胞核用赫斯特染料(hoechst dye)染色;将细胞质用celltracker green染色。
82.图78示出了由不同刺突特异性抗体介导的cho-s细胞间融合。使用cytation 5成
像仪(伯腾公司)和将细胞核作为对象进行检测并测量其大小的对象检测方案对融合进行定量。融合的细胞中对象的面积除以所有对象的总面积乘以100提供了融合的细胞的百分比。
83.图79示出了15μg/ml所指示抗体对s2e12-ls诱导的cho-s细胞的细胞间融合的抑制。
84.图80示出了在不存在ace2的情况下,s阳性cho-s细胞与荧光标记的s阴性cho细胞的s2e12-ls诱导的单向融合(也称为反式融合)。将细胞核用赫斯特染料染色;将细胞质用celltracker green染色。
85.图81示出了通过用所指示抗体预温育的真实sars-cov-2对过表达ace2的稳定hek293t细胞系的感染的中和。通过在24小时对sars-cov-2核蛋白进行免疫染色来测量感染。
86.图82示出了通过用所指示抗体预温育的真实sars-cov-2对过表达siglec1的稳定hek293t细胞系的感染的中和。通过在24小时对sars-cov-2核蛋白进行免疫染色来测量感染。
87.图83示出了通过用所指示单克隆抗体预温育的真实sars-cov-2对过表达dc-sign的稳定hek293t细胞系的感染的中和。通过在24小时对sars-cov-2核蛋白进行免疫染色来测量感染。
88.图84示出了通过用所指示单克隆抗体预温育的真实sars-cov-2对过表达l-sign的稳定hek293t细胞系的感染的中和。通过在24小时对sars-cov-2核蛋白进行免疫染色来测量感染。
89.图85示出了不同类别的刺突特异性抗体的作用机制的概述。“融合抑制”是指cho-s细胞与ace2+vero-e6细胞之间的融合的抗体介导的抑制。效应子功能的评估基于人fcγr的抗体依赖性激活,如使用生物发光报告基因测定所测量的。rbm ia-iia抗体包括s2e12、s2x259、s2x58、s2d106、ly-cov016、ct-p59和regn10933。rbm ib抗体包括ly-cov555、regn10987和s2m11。ntd抗体包括s2x333。茎螺旋抗体包括s2p6。
90.图86示出了通过流式细胞术测量的,靶向dc/l-sign、dc-sign、siglec1或ace2的抗体在稳定过表达相应附着受体的hek293t细胞上的结合的分析。
91.图87示出了通过免疫荧光测量的,靶向dc/l-sign、dc-sign、siglec1或ace2的抗体在稳定过表达相应附着受体的hek293t细胞上的结合的分析。
92.图88示出了通过用野生型刺突蛋白假型化的vsv-sars-cov-2(灰色条)或用携带b1.1.7谱系突变的刺突蛋白假型化的vsv-sars-cov-2(红色条)对稳定过表达所指示附着受体的hek293t细胞的感染。感染后一天分析发光。
93.图89示出了通过10μg/ml s309、s2e12-v2和s2x333对vero-e6或vero-e6-tmprss2细胞的sars-cov-2感染的中和。在存在所指示抗体的情况下,以moi 0.01用sars-cov-2(分离株usa-wa1/2020)感染细胞。感染后24小时固定细胞,并对病毒核衣壳蛋白进行免疫染色。
94.图90示出了通过流式细胞术测量的,经纯化的、荧光标记的sars-cov-2刺突蛋白(左图)或rbd(右图)与所指示细胞系的结合的定量。
95.图91示出了通过流式细胞术测量的,经纯化的、荧光标记的sars-cov-2刺突蛋白
(左图)或rbd(右图)与所指示细胞系的结合的定量。
96.图92示出了抗体s309(左图)或抗体s309和s2e12-v2的组合(右图)在叙利亚仓鼠中针对sars-cov-2激发的保护作用的分析。上图示出了感染后四天肺中病毒rna的定量。下图示出了使用tcid50测定对感染后四天采集的肺匀浆中的复制病毒的定量。
97.图93示出了抗体s309(左图)或抗体s309和s2e12-ls的组合(右图)在叙利亚仓鼠中针对sars-cov-2激发的保护作用的分析。上图示出了感染后四天评估的肺组织的组织病理学评分。下图示出了基于感染时测量的血清抗体水平(x轴)与感染后第四天在肺中测量的sars-cov-2病毒rna水平(y轴)之间的相关性的功效图。虚线表示病毒减少的ec50和ec90。单独s309的ec90为9μg/ml;s309+s2e12-v2的ec90为11μg/ml。
98.图94示出了免疫复合物与仓鼠脾细胞的结合。对alexa-488荧光免疫复合物(ic)进行滴定(0-200nm范围),并与完全未经处理的仓鼠脾细胞一起温育。在排除死亡/凋亡细胞并对真实的单核细胞群体进行物理门控后,用血细胞计数器揭示结合。左图示出了与用仓鼠或人fc抗体制备的ic的仓鼠细胞相关的荧光强度(人s309以绿色示出;gh-s309以深灰色示出;gh-s309-n297a以蓝色示出)。示出了二者的单个复制品。右图示出了在整个单核细胞群体上测量的复制品的相对alexa-488平均荧光强度。
99.图95示出了宿主效应子功能在sars-cov-2激发中的作用分析。向叙利亚仓鼠注射指示量(mg/kg)的仓鼠igg2a s309,其是wt或fc沉默的(s309-n297a)。上图示出了感染后4天肺中病毒rna的定量。中间图示出了感染后4天肺中的复制病毒的定量。下图示出了感染后4天肺中的组织病理学评分。向对照动物(白色符号)注射4mg/kg不相关的对照同种型抗体。相对于对照动物,*p《0.05,**p《0.01,***p《0.001,****p《0.0001,使用曼-惠特尼检验(mann-whitney test)。
100.图96示出了在存在所指示抗体的情况下,sars-cov-2-nluc对稳定表达dc-sign的hela细胞中感染的抑制。细胞以0.04的moi被感染。通过对感染后24小时的发光信号进行定量来分析感染。
101.图97示出了在存在所指示抗体的情况下,稳定表达ace2(上图)或dc-sign(下图)的hek293t细胞的sars-cov-2感染的中和。细胞以0.02的moi被感染。感染后24小时固定细胞,对病毒核衣壳蛋白进行免疫染色并对阳性细胞进行定量。
102.图98示出了在存在所指示抗体的情况下,稳定表达siglec1(上图)或l-sign(下图)的hek293t细胞的sars-cov-2感染的中和。细胞以0.02的moi被感染。感染后24小时固定细胞,对病毒核衣壳蛋白进行免疫染色并对阳性细胞进行定量。
103.图99示出了在雌性非人灵长类动物中的包括fc中的ls突变的s2e12工程化变体409_11_4_v2在64天内的浓度曲线。
104.图100示出了来自非人灵长类动物研究的409_11_4_v2-ls药代动力学值。
具体实施方式
105.本文提供了与sars-cov-2冠状病毒(例如,如本文所描述的在sars-cov-2病毒粒子中和/或在sars-cov-2冠状病毒引起的感染的细胞表面上表达的sars-cov-2表面糖蛋白和/或rbd)结合的抗体和抗原结合片段。在某些实施方式中,当前公开的抗体和抗原结合片段可以在体外感染模型和/或感染动物模型和/或人受试者中中和sars-cov-2感染。还提供
了编码抗体和抗原结合片段的多核苷酸、载体、宿主细胞和相关组合物,以及使用抗体、核酸、载体、宿主细胞和相关组合物治疗(例如减少、延迟、消除或预防)受试者的sars-cov-2感染和/或制造用于治疗受试者的sars-cov-2感染的药物的方法。
106.在更加详细地阐述本公开之前,提供本文要使用的某些术语的定义可能有助于理解本公开。贯穿本公开阐述另外的定义。
107.如本文所使用的,“sars-cov-2”,在本文中也被称为“新型cov”,或“ncov”,或“2019n-cov”是被认为是谱系b的β冠状病毒(沙贝病毒(sarbecovirus))。sars-cov-2感染的症状包括发烧、干咳和呼吸困难。
108.seq id no:1中提供了sars-cov-2分离株的基因组序列(还参见genbank mn908947.3),并且seq id no:2中提供了基因组的氨基酸翻译(还参见genbank qhd43416.1)。像其它冠状病毒(例如,sars-cov-1)一样,sars-cov-2包括包含受体结合结构域(rbd)的“刺突”或表面(“s”)i型跨膜糖蛋白。据信rbd通过与细胞表面受体血管紧张素转换酶2(ace2)结合来介导谱系b sars冠状病毒进入呼吸道上皮细胞。特别地,据信病毒rbd中的受体结合基序(rbm)与ace2相互作用。
109.seq id no:3中提供了genbank登录号mn908947.3的sars-cov-2分离株表面糖蛋白的氨基酸序列。seq id no:4中提供了genbank登录号mn908947.3的sars-cov-2分离株的rbd的氨基酸序列。sars-cov-2s蛋白与sars-cov-1具有大约73%氨基酸序列同一性。seq id no:5中提供了genbank登录号mn908947.3的sars-cov-2分离株的rbm的氨基酸序列。genbank登录号mn908947.3的sars-cov-2分离株的rbd与sars-cov-1rbd具有大约75%至77%氨基酸序列相似性,并且genbank登录号mn908947.3的sars-cov-2分离株的rbm与sars-cov-1rbm具有大约50%氨基酸序列相似性。
110.除非本文另外指示,否则genbank登录号mn908947.3的sars-cov-2分离株是指包括如seq id no:2、3和4中的任一者或多者所示的氨基酸序列的病毒,任选地具有如seq id no:1所示的基因组序列。
111.已经存在许多新出现的sars-cov-2变体。一些sars-cov-2变体包括n439k突变,所述突变增强了对人ace2受体的结合亲和力(thomson,e.c.等人,循环的sars-cov-2刺突变体n439k在避开抗体介导的免疫的同时维持健壮(the circulating sars-cov-2spike variant n439k maintains fitness while evading antibody-mediated immunity)biorxiv,2020)。一些sars-cov-2变体包括n501y突变,所述突变与增加的传播性有关,包括分别在英国和南非发现的谱系b.1.1.7(也称为20i/501y.v1和voc 202012/01;(del69-70、del144、n501y、a570d、d614g、p681h、t716i、s982a和d1118h突变))和b.1.351(也称为20h/501y.v2;l18f、d80a、d215g、r246i、k417n、e484k、n501y、d614g和a701v突变)(tegally,h.等人,具有多个刺突突变的新的严重急性呼吸综合征相关冠状病毒2(sars-cov-2)谱系在南非的出现和快速传播(emergence and rapid spread of a new severe acute respiratory syndrome-related coronavirus 2(sars-cov-2)lineage with multiple spike mutations in south africa)medrxiv,2020:p.2020.12.21.20248640;leung,k.等人,2020年10月至11月英国对sars-cov-2的n501y突变体菌株的早期经验评估(early empirical assessment of the n501y mutant strains of sars-cov-2in the united kingdom,october to november 2020)medrxiv,2020:p.2020.12.20.20248581)。b.1.351
还包括sars-cov2刺突蛋白的rbd结构域中的另外两个突变k417n和e484k(tegally,h.等人,具有多个刺突突变的新的严重急性呼吸综合征相关冠状病毒2(sars-cov-2)谱系在南非的出现和快速传播(emergence and rapid spread of a new severe acute respiratory syndrome-related coronavirus 2(sars-cov-2)lineage with multiple spike mutations in south africa)medrxiv,2020:p.2020.12.21.20248640)。其它sars-cov-2变体包括在巴西首次报道的谱系b.1.1.28;在日本首次报道的变体p.1,谱系b.1.1.28(也被称为20j/501y.v3);在美国加利福尼亚州首次报道的变体l452r(泛美卫生组织(pan american health organization),《流行病学更新:sars-cov-2变体在美洲的出现(epidemiological update:occurrence of variants of sars-cov-2in the americas)》,2021年1月20日,可从reliefweb.int/sites/reliefweb.int/files/resources/2021-jan-20-phe-epi-update-sars-cov-2.pdf获得)。其它变体包括进化枝19a的sars cov-2;进化枝19b的sars cov-2;进化枝20a的sars cov-2;进化枝20b的sars cov-2;进化枝20c的sars cov-2;进化枝20d的sars cov-2;进化枝20e(eu1)的sars cov-2;进化枝20f的sars cov-2;进化枝20g的sars cov-2;和sars cov-2b1.1.207;以及在rambaut,a.等人,用于辅助基因组流行病学的sars-cov-2谱系的动态命名建议(a dynamic nomenclature proposal for sars-cov-2lineages to assist genomic epidemiology)《自然微生物学(nat microbiol)》,5,1403-1407(2020)中描述的其它sars cov-2谱系。前述sars-cov-2变体以及其氨基酸和核苷酸序列以引用的方式并入本文中。因此,应当理解,sars-cov-2包括genbank登录号mn908947.3的sars-cov-2分离株以及其变体,包括当前公开的变体。
112.在本说明书中,除非另外指示,否则任何浓度范围、百分比范围、比率范围或整数范围应被理解为包括所列举的范围内的任何整数值并且适当时包括其分数(如整数的十分之一和百分之一)。而且,除非另外指示,否则本文所列举的关于如聚合物亚基、大小或厚度等任何物理特征的任何数字范围应被理解为包括所列举的范围内的任何整数。除非另外指示,否则如本文所使用的,术语“约(about)”意指所指示的范围、数值或结构的
±
20%。应当理解,如本文所使用的术语“一个(a)”和“一个(an)”是指所列举的组分中的“一个或多个(one or more)”。替代方案的使用(例如,“或(or)”)应被理解为意指替代方案中的一个、两个或其任何组合。如本文所使用的,术语“包括/包含(include)”、“具有(have)”和“包括/包含(comprise)”是同义使用的,这些术语和其变体旨在被解释为非限制性的。
[0113]“任选(optional)”或“任选地(optionally)”意指随后所描述的要素、组分、事件或情形可发生或可不发生,且所述描述包括其中所述要素、组分、事件或情形发生的情况以及其中所述要素、组分、事件或情形不发生的情况。
[0114]
另外,应当理解,衍生自本文所描述的结构和亚基的各种组合的单独构建体或构建体组由本技术公开,其公开程度与每个构建体或构建体组被单独阐述的程度相同。因此,特定结构或特定亚基的选择在本公开的范围内。
[0115]
术语“基本上由
…
组成(consisting essentially of)”不等效于“包括/包含(comprising)”,并且是指权利要求的指定材料或步骤,或指那些不实质上影响所要求的主题的基本特性的材料或步骤。例如,当结构域、区、模块或蛋白质的氨基酸序列包括延伸、缺失、突变或其组合(例如,在氨基或羧基末端或结构域之间的氨基酸)时,蛋白质结构域、区
或模块(例如,结合结构域)或蛋白质“基本上由”特定的氨基酸序列组成,所述延伸、缺失、突变或其组合总共占结构域、区、模块或蛋白质长度的至多20%(例如,至多15%、10%、8%、6%、5%、4%、3%、2%或1%)并且基本上不影响(即,不将活性降低超过50%,如不超过40%、30%、25%、20%、15%、10%、5%或1%)结构域、区、模块或蛋白质的活性(例如,结合蛋白质的靶结合亲和力)。
[0116]
如本文所使用的,“氨基酸(amino acid)”是指天然存在的或合成的氨基酸,以及以与天然存在的氨基酸类似的方式起作用的氨基酸类似物和氨基酸模拟物。天然存在的氨基酸是由遗传密码编码的那些氨基酸、以及后来被修饰的那些氨基酸,例如,羟基脯氨酸、γ-羧基谷氨酸以及o-磷酸丝氨酸。氨基酸类似物是指具有与天然存在的氨基酸相同的基本化学结构的化合物,即,与氢、羧基、氨基和r基团结合的α-碳,例如,高丝氨酸、正亮氨酸、甲硫氨酸亚砜、甲硫氨酸甲基锍。此类类似物具有经修饰的r基(例如,正亮氨酸)或经修饰的肽骨架,但是保留了与天然存在的氨基酸相同的基本化学结构。氨基酸模拟物是指具有与氨基酸的通式化学结构不同的结构,但是以与天然存在的氨基酸类似的方式起作用的化学化合物。
[0117]
如本文所使用的,“突变(mutation)”是指核酸分子或多肽分子序列分别与参比或野生型核酸分子或多肽分子相比的改变。突变可以引起序列的若干不同类型变化,包括核苷酸或氨基酸的取代、插入或缺失。
[0118]“保守取代(conservative substitution)”是指不显著影响或改变特定蛋白质的结合特性的氨基酸取代。通常,保守取代是其中取代的氨基酸残基被具有相似侧链的氨基酸残基替换的取代。保守取代包括在以下组之一中发现的取代:组1:丙氨酸(ala或a)、甘氨酸(gly或g)、丝氨酸(ser或s)、苏氨酸(thr或t);组2:天冬氨酸(asp或d)、谷氨酸(glu或z);组3:天冬酰胺(asn或n)、谷氨酰胺(gln或q);组4:精氨酸(arg或r)、赖氨酸(lys或k)、组氨酸(his或h);组5:异亮氨酸(ile或i)、亮氨酸(leu或l)、甲硫氨酸(met或m)、缬氨酸(val或v);以及组6:苯丙氨酸(phe或f)、酪氨酸(tyr或y)、色氨酸(trp或w)。另外地或可替代地,氨基酸可以根据类似功能、化学结构或组成(例如,酸性、碱性、脂肪族、芳香族或含硫)分成保守取代基团。例如,为了取代,脂肪族分组可以包括gly、ala、val、leu和ile。其它保守取代组包括:含硫的:met和半胱氨酸(cys或c);酸性的:asp、glu、asn和gln;小脂肪族、非极性或略有极性的残基:ala、ser、thr、pro和gly;极性带负电荷的残基和其酰胺:asp、asn、glu和gln;极性带正电荷的残基:his、arg和lys;大脂肪族、非极性残基:met、leu、ile、val和cys;以及大芳香族残基:phe、tyr和trp。另外的信息可以在creighton(1984)《蛋白质(proteins)》,w.h.弗里曼出版社和公司(w.h.freeman and company)中找到。
[0119]
如本文所使用的,“蛋白质(protein)”或“多肽(polypeptide)”是指氨基酸残基的聚合物。蛋白质适用于天然存在的氨基酸聚合物,以及其中一个或多个氨基酸残基是对应的天然存在的氨基酸的人工化学模拟物的氨基酸聚合物,和非天然存在的氨基酸聚合物。还考虑了本公开的蛋白质、肽和多肽的变体。在某些实施方式中,变体蛋白质、肽和多肽包括与如本文所描述的定义或参比氨基酸序列的氨基酸序列至少70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或99.9%相同的氨基酸序列或由其组成。
[0120]“核酸分子(nucleic acid molecule)”或“多核苷酸(polynucleotide)”或“多核
酸(polynucleic acid)”是指包括共价连接的核苷酸的聚合化合物,其可由天然亚基(例如,嘌呤或嘧啶碱基)或非天然亚基(例如,吗啉环)组成。嘌呤碱基包括腺嘌呤、鸟嘌呤、次黄嘌呤和黄嘌呤,并且嘧啶碱基包括尿嘧啶、胸腺嘧啶和胞嘧啶。核酸分子包括聚核糖核酸(rna),其包括mrna、微小rna、sirna、病毒基因组rna和合成rna,以及聚脱氧核糖核酸(dna),其包括cdna、基因组dna和合成dna,其中的任一者可以是单链或双链的。如果是单链的,则核酸分子可以是编码链或非编码(反义)链。编码氨基酸序列的核酸分子包括编码相同氨基酸序列的所有核苷酸序列。核苷酸序列的一些版本还可以包括内含子,其程度使得内含子将通过共转录或转录后机制被去除。换句话说,由于遗传密码的冗余或简并,或通过剪接,不同的核苷酸序列可以编码相同的氨基酸序列。
[0121]
还考虑了本公开的核酸分子的变体。变体核酸分子与如本文所描述的定义或参比多核苷酸的核酸分子至少70%、75%、80%、85%、90%,优选地95%、96%、97%、98%、99%或99.9%相同,或者在约65-68℃下的0.015m氯化钠、0.0015m柠檬酸钠或约42℃下的0.015m氯化钠、0.0015m柠檬酸钠和50%甲酰胺的严格杂交条件下与多核苷酸杂交。核酸分子变体保留编码其结合结构域的能力,所述结合结构域具有本文所描述的功能,如结合靶分子。
[0122]“序列同一性百分比(percent sequence identity)”是指如通过比较序列所确定的两个或多个序列之间的关系。确定序列同一性的优选方法被设计成给出所比较序列之间的最佳匹配。例如,出于最佳比较目的,将序列进行比对(例如,可以在第一氨基酸或核酸序列和第二氨基酸或核酸序列中的一个或两个中引入空位以进行最优比对)。此外,出于比较目的,可以忽略非同源序列。除非另外指示,否则本文所引用的序列同一性百分比在参比序列的长度上计算。用于确定序列同一性和相似性的方法可以在公开可用的计算机程序中找到。序列比对和同一性百分比计算可以使用blast程序(例如,blast 2.0、blastp、blastn或blastx)进行。可以在altschul等人,《核酸研究(nucleic acids res.)》25:3389-3402,1997中找到blast程序中使用的数学算法。在本公开的上下文中,应当理解,在使用序列分析软件进行分析的情况下,分析的结果基于所引用的程序的“默认值”。“默认值”意指软件首次初始化时最初加载的值或参数的任何集合。
[0123]
术语“分离的(isolated)”意指将材料从其原始环境(例如,如果其天然存在的话,天然环境)中去除。例如,活动物中存在的天然存在的核酸或多肽不是分离的,但与天然系统中的一些或全部共存材料分离的相同核酸或多肽是分离的。此类核酸可以是载体的一部分和/或此类核酸或多肽可以是组合物(例如,细胞裂解物)的一部分,并且仍然是分离的,因为此类载体或组合物不是所述核酸或多肽的天然环境的一部分。
[0124]
术语“基因”意指参与产生多肽链的dna或rna区段;在某些情况下,所述基因包括编码区之前和之后的区(例如,5'未翻译区(utr)和3'utr)以及单独编码区段(外显子)之间的间插序列(内含子)。
[0125]“功能变体(functional variant)”是指与本公开的亲本或参比化合物在结构上相似或基本结构上相似但在组成上略有不同(例如,一个碱基、原子或官能团不同、被添加或被去除)的多肽或多核苷酸,使得多肽或经编码的多肽能够以至少50%的效率,优选地至少55%、60%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%、99.9%或100%的亲本多肽活性水平执行亲本多肽的至少一种功能。换句话说,当本公开的多肽或经编码的
多肽的功能变体在所选的测定中与亲本或参比多肽相比显示出不超过50%的性能降低时,如用于测量结合亲和力的测定(例如,测量缔合(ka)或解离(kd)常数的或四聚体染色),所述功能变体具有“相似结合”、“相似亲和力”或“相似活性”。
[0126]
如本文所使用的,“功能部分”或“功能片段”是指仅包括亲本或参比化合物的结构域、部分或片段的多肽或多核苷酸,并且多肽或经编码的多肽保留与亲本或参比化合物的结构域、部分或片段相关的至少50%的活性,优选地至少55%、60%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%、99.9%或100%的亲本多肽活性水平,或提供生物学益处(例如,效应子功能)。当本公开的多肽或经编码多肽的“功能部分”或“功能片段”在所选的测定中与亲本或参比多肽相比显示出不超过50%的性能降低(优选地不超过20%或10%,或在亲和力方面与亲本或参比相比不超过对数差异)时,所述功能部分或片段具有“相似结合”或“相似活性”。
[0127]
如本文所使用的,术语“工程化(engineered)”、“重组(recombinant)”或“非天然(non-natural)”是指包括至少一种遗传改变或已经通过引入外源或异源核酸分子修饰的生物体、微生物、细胞、核酸分子或载体,其中此类改变或修饰通过基因工程(即,人为干预)引入。遗传改变包括例如引入编码功能rna、蛋白质、融合蛋白或酶的可表达的核酸分子的修饰,或其它核酸分子添加、缺失、取代或细胞的遗传物质的其它功能破坏。另外的修饰包括例如非编码调节区,其中修饰改变多核苷酸、基因或操纵子的表达。
[0128]
如本文所使用的,“异源”或“非内源”或“外源”是指对宿主细胞或受试者而言不是天然的任何基因、蛋白质、化合物、核酸分子或活性,或对宿主细胞或受试者而言是天然的已改变的任何基因、蛋白质、化合物、核酸分子或活性。异源、非内源或外源包括已经突变或以其它方式改变的基因、蛋白质、化合物或核酸分子,使得结构、活性或两者在天然与改变的基因、蛋白质、化合物或核酸分子之间不同。在某些实施方式中,异源、非内源或外源基因、蛋白质或核酸分子(例如,受体、配体等)对于宿主细胞或受试者可能不是内源的,而是通过缀合、转化、转染、电穿孔等将编码此类基因、蛋白质或核酸分子的核酸添加到宿主细胞中,其中添加的核酸分子可以整合到宿主细胞基因组中或者可以作为染色体外遗传物质(例如,作为质粒或其它自我复制载体)存在。术语“同源(homologous)”或“同源物(homolog)”是指发现于或衍生自宿主细胞、物种或菌株的基因、蛋白质、化合物、核酸分子或活性。例如,编码多肽的异源或外源多核苷酸或基因可以与天然多核苷酸或基因同源并且编码同源多肽或活性,但是多核苷酸或多肽可以具有改变的结构、序列、表达水平或其任何组合。非内源多核苷酸或基因以及经编码的多肽或活性可以来自相同物种、不同物种或其组合。
[0129]
在某些实施方式中,如果对宿主细胞而言天然的核酸分子或其部分已经改变或突变,则其将被视为对宿主细胞来说是异源的,或者如果对宿主细胞而言是天然的核酸分子已经用异源表达控制序列改变或已经用通常不与对宿主细胞而言天然的核酸分子相关的内源表达控制序列改变,则其可以被视为是异源的。另外,术语“异源”可以指对于宿主细胞来说不同、改变或并非内源的生物活性。如本文所描述的,多于一种异源核酸分子可以作为独立的核酸分子、作为多个单独控制的基因、作为多顺反子核酸分子、作为编码融合蛋白的单个核酸分子或其任何组合引入到宿主细胞中。
[0130]
如本文所使用的,术语“内源”或“天然”是指通常存在于宿主细胞或受试者中的多
核苷酸、基因、蛋白质、化合物、分子或活性。
[0131]
如本文所使用的,术语“表达(expression)”是指基于如基因等核酸分子的编码序列产生多肽的过程。过程可以包括转录、转录后控制、转录后修饰、翻译、翻译后控制、翻译后修饰或其任何组合。表达的核酸分子典型地可操作地连接到表达控制序列(例如,启动子)。
[0132]
术语“可操作地连接”是指单个核酸片段上两个或多个核酸分子的缔合,使得一者的功能受另一者影响。例如,当启动子能够影响编码序列的表达(即,编码序列在启动子的转录控制之下)时,所述启动子与所述编码序列可操作地连接。“未连接(unlinked)”意指相关遗传元件彼此不紧密相关并且一者的功能不影响另一者。
[0133]
如本文所描述的,多于一种异源核酸分子可以作为独立的核酸分子、作为多个单独控制的基因、作为多顺反子核酸分子、作为编码蛋白质(例如,抗体的重链)的单个核酸分子或其任何组合引入宿主细胞。当两种或多种异源核酸分子引入宿主细胞时,应当理解,两种或多种异源核酸分子可以作为单个核酸分子(例如,在单个载体上)引入、在独立的载体上引入、在单个位点或多个位点整合于宿主染色体中或其任何组合。所引用的异源核酸分子或蛋白质活性的数量是指编码核酸分子的数量或蛋白质活性的数量,而非引入宿主细胞的独立的核酸分子的数量。
[0134]
术语“构建体”是指包括重组核酸分子(或者当上下文清楚地指示时,本公开的融合蛋白)的任何多核苷酸。(多核苷酸)构建体可以存在于载体(例如,细菌载体、病毒载体)中或者可以整合于基因组中。“载体”是能够运输另一种核酸分子的核酸分子。载体可以是例如质粒、粘粒、病毒、rna载体或可以包括染色体、非染色体、半合成或合成核酸分子的线性或环状dna或rna分子。本公开的载体还包括转座子系统(例如,睡美人(sleeping beauty),参见例如geurts等人,《分子疗法(mol.ther.)》8:108,2003;m
á
t
é
s等人,《自然遗传学(nat.genet.)》41:753,2009)。示例性载体是那些能够自主复制的载体(游离型载体)、能够将多核苷酸递送到细胞基因组的载体(例如,病毒载体)或能够表达其所连接的核酸分子的载体(表达载体)。
[0135]
如本文所使用的,“表达载体”或“载体”是指包括核酸分子的dna构建体,所述核酸分子可操作地连接到能够实现核酸分子在合适宿主中表达的合适控制序列。此类控制序列包括实现转录的启动子、控制此类转录的任选的操纵子序列、编码合适的mrna核糖体结合位点的序列和控制转录与翻译终止的序列。载体可以是质粒、噬菌体颗粒、病毒或仅仅是潜在基因组插入物。一旦转化到合适的宿主中,载体就可以独立于宿主基因组复制并起作用,或者在一些情况下,可以整合到基因组自身中或将载体中所含的多核苷酸在没有载体序列的情况下递送到基因组中。在本说明书中,“质粒”、“表达质粒”、“病毒”和“载体”经常可互换使用。
[0136]
在向细胞插入核酸分子的上下文中,术语“引入(introduced)”意指“转染(transfection)”、“转化(transformation)”或“转导(transduction)”并且包括提及向真核或原核细胞并入核酸分子,其中核酸分子可以并入到细胞的基因组(例如,染色体、质粒、质体或线粒体dna)中,转化成自主复制子,或瞬时表达(例如,经转染的mrna)。
[0137]
在某些实施方式中,本公开的多核苷酸可以可操作地连接到载体的某些元件。例如,实现多核苷酸序列所连接的编码序列的表达和加工所需的所述多核苷酸序列可以可操
作地连接。表达控制序列可以包括合适的转录起始、终止、启动子和增强子序列;有效rna加工信号,如剪接和聚腺苷酸化信号;稳定胞质mrna的序列;增强翻译效率的序列(即,kozak共有序列);增强蛋白质稳定性的序列;以及可能增强蛋白质分泌的序列。如果表达控制序列与所关注基因和以反式作用或隔一定距离作用以控制所关注基因的表达控制序列邻接,则所述表达控制序列可以可操作地连接。
[0138]
在某些实施方式中,载体包括质粒载体或病毒载体(例如,慢病毒载体或γ-逆转录病毒载体)。病毒载体包括逆转录病毒;腺病毒;细小病毒(例如,腺相关病毒);冠状病毒;负链rna病毒,如正粘病毒(例如,流感病毒)、弹状病毒(例如,狂犬病和水疱性口炎病毒)、副粘病毒(例如,麻疹和仙台病毒(sendai));正链rna病毒,如小核糖核酸病毒和α病毒;以及双链dna病毒,包括腺病毒、疱疹病毒(例如,单纯疱疹病毒1和2型、埃-巴二氏病毒(epstein-barr virus)、巨细胞病毒)和痘病毒(例如,牛痘、鸡痘和金丝雀痘)。其它病毒包括例如诺沃克病毒、披膜病毒、黄病毒、呼肠孤病毒、乳多空病毒、嗜肝dna病毒和肝炎病毒。逆转录病毒的实例包括禽白血病-肉瘤、哺乳动物c型病毒、b型病毒、d型病毒、htlv-blv基团、慢病毒、泡沫病毒(coffin,j.m.,《逆转录病毒科:病毒及其复制(retroviridae:the viruses and their replication)》,在《基础病毒学(fundamental virology)》中,第三版,b.n.fields等人编辑,费城利平科特-雷文出版社(lippincott-raven publishers,philadelphia),1996)。
[0139]“逆转录病毒(retrovirus)”是具有rna基因组的病毒,所述rna基因组使用逆转录酶逆转录成dna,随后逆转录的dna并入宿主细胞基因组中。“γ逆转录病毒(gammaretrovirus)”是指逆转录病毒科的一个属。γ逆转录病毒的实例包括小鼠干细胞病毒、鼠类白血病病毒、猫白血病病毒、猫肉瘤病毒和禽网状内皮组织增生病毒。
[0140]“慢病毒载体(lentiviral vector)”包括用于基因递送的基于hiv的慢病毒载体,其可以为整合或非整合的,具有相对大的包装容量,并且可以转导一系列不同细胞类型。慢病毒载体通常在将三种(包装、包膜和转移)或多种质粒瞬时转染到生产细胞中之后产生。类似于hiv,慢病毒载体通过病毒表面糖蛋白与细胞表面上受体的相互作用进入靶细胞。在进入时,病毒rna经历逆转录,其由病毒逆转录酶复合物介导。逆转录的产物是双链线性病毒dna,其是病毒整合到受感染细胞dna中的底物。
[0141]
在某些实施方式中,病毒载体可以是γ逆转录病毒,例如,莫洛尼鼠类白血病病毒(moloney murine leukemia virus,mlv)衍生载体。在其它实施方式中,病毒载体可以是更复杂的逆转录病毒衍生载体,例如,慢病毒衍生载体。hiv-1衍生载体属于此类别。其它实例包括衍生自hiv-2、fiv、马传染性贫血病毒、siv和梅迪-维斯纳(maedi-visna)病毒(绵羊慢病毒)的慢病毒载体。使用逆转录病毒和慢病毒载体以及包装细胞来用包括转基因的病毒颗粒转导哺乳动物宿主细胞的方法是本领域已知的并且已经在例如以下文献中描述:美国专利8,119,772;walchli等人,《公共科学图书馆
·
综合(plos one)》6:327930,2011;zhao等人,《免疫学杂志(j.immunol.)》174:4415,2005;engels等人,《人类基因疗法(hum.gene ther.)》14:1155,2003;frecha等人,《分子疗法》18:1748,2010;以及verhoeyen等人,《分子生物学方法(methods mol.biol.)》506:97,2009。逆转录病毒和慢病毒载体构建体和表达系统也是可商购的。其它病毒载体也可以用于多核苷酸递送,包括dna病毒载体,包括例如基于腺病毒的载体和基于腺相关病毒(aav)的载体;衍生自单纯疱疹病毒(hsv)的载体,包
括扩增子载体、复制缺陷型hsv和减毒hsv(krisky等人,《基因疗法(gene ther.)》5:1517,1998)。
[0142]
可以与本公开的组合物和方法一起使用的其它载体包括那些衍生自杆状病毒和α-病毒的载体。(jolly,d j.1999.新兴病毒载体。(emerging viral vectors.)第209-40页,friedmann t.编辑,《人类基因疗法的发展。(the development of human gene therapy.)》纽约:冷泉港实验室(new york:cold spring harbor lab),或质粒载体(如睡美人或其它转座子载体)。
[0143]
当病毒载体基因组包括要在宿主细胞中作为独立的转录物表达的多种多核苷酸时,病毒载体还可以包括两种(或多种)转录物之间的另外的序列,从而允许双顺反子或多顺反子表达。用于病毒载体的此类序列的实例包括内部核糖体进入位点(ires)、弗林蛋白酶切割位点、病毒2a肽或其任何组合。
[0144]
本文进一步描述质粒载体,包括用于直接向受试者施用的基于dna的抗体或抗原结合片段编码质粒载体。
[0145]
如本文所使用的,术语“宿主(host)”是指用异源核酸分子进行遗传修饰以产生所关注多肽(例如,本公开的抗体)的靶标的细胞或微生物。
[0146]
宿主细胞可以包括可以接受载体或核酸并入或表达蛋白质的任何单独细胞或细胞培养物。术语还涵盖宿主细胞的后代,无论在遗传或表型上相同还是不同。合适的宿主细胞可以取决于载体并且可以包括哺乳动物细胞、动物细胞、人细胞、猴细胞、昆虫细胞、酵母细胞和细菌细胞。这些细胞可以通过使用病毒载体、通过磷酸钙沉淀转化、deae-葡聚糖、电穿孔、显微注射或其它方法诱导以并入载体或其它材料。参见例如sambrook等人,《分子克隆:实验室手册(molecular cloning:a laboratory manual)》第2版(冷泉港实验室,1989)。
[0147]
在sars-cov-2感染的情况下,“宿主”是指受sars-cov-2感染的细胞或受试者。
[0148]
如本文所使用的,“抗原”或“ag”是指引起免疫应答的免疫原性分子。这种免疫应答可能涉及抗体产生、特定免疫活性细胞的激活、补体的激活、抗体依赖性细胞毒性或其任何组合。抗原(免疫原性分子)可以是例如肽、糖肽、多肽、糖聚肽、多核苷酸、多糖、脂质等。显而易见,抗原可以合成、重组产生或衍生自生物样品。可以包括一种或多种抗原的示例性生物样品包括组织样品、粪便样品、细胞、生物流体或其组合。抗原可以由已经修饰或基因工程化以表达抗原的细胞产生。抗原还可以存在于sars-cov-2(例如,表面糖蛋白或其部分)中,如存在于病毒粒子中,或在受sars-cov-2感染的细胞表面上表达或呈现。
[0149]
术语“表位”或“抗原表位”包括由同源结合分子,如免疫球蛋白或其它结合分子、结构域或蛋白质识别且特异性结合的任何分子、结构、氨基酸序列或蛋白质决定簇。表位决定簇通常包括如氨基酸或糖侧链等分子的化学活性表面分组,并且可以具有特异性三维结构特性以及特异性电荷特性。在抗原是或包括肽或蛋白质时,表位可以包括连续氨基酸(例如,线性表位),或者可以包括来自通过蛋白质折叠而接近的蛋白质的不同部分或区的氨基酸(例如,不连续或构象表位),或者与蛋白质折叠无关紧密接近的不连续氨基酸。
[0150]
抗体、抗原结合片段和组合物
[0151]
一方面,本公开提供了一种分离的抗体或其抗原结合片段,其包括重链可变结构域(vh),所述vh包括cdrh1、cdrh2和cdrh3;以及轻链可变结构域(vl),所述vl包括cdrl1、
cdrl2和cdrl3,并且能够与sars-cov-2的表面糖蛋白结合。在某些实施方式中,所述抗体或抗原结合片段能够与宿主细胞的细胞表面和/或sars-cov-2病毒粒子上表达的sars-cov-2的表面糖蛋白结合。
[0152]
在某些实施方式中,本公开的抗体或抗原结合片段与sars-cov-2表面糖蛋白表位或包括所述表位的抗原缔合或联合,而不与样品中的任何其它分子或组分显著缔合或联合。
[0153]
在某些实施方式中,本公开的抗体或抗原结合片段与sars-cov-2表面糖蛋白表位缔合或联合(例如,结合),并且还可以与来自样品中存在的另一冠状病毒(例如,sars-cov-1)的表位缔合或联合,但不与样品中的其它分子或组分显著缔合或联合。换句话说,在某些实施方式中,本公开的抗体或抗原结合片段对sars-cov-2和一种或多种其它冠状病毒具有交叉反应性。
[0154]
在某些实施方式中,本公开的抗体或抗原结合片段与sars-cov-2表面糖蛋白特异性结合。如本文所使用的,“特异性结合(specifically binds)”是指抗体或抗原结合片段与抗原缔合或联合,其中亲和力或ka(即,特定结合相互作用的平衡缔合常数,单位为1/m)等于或大于105m-1
(其等于此缔合反应的缔合速率[k
on
]与解离速率[k
off
]的比率),而不与样品中的其它分子或组分显著缔合或联合。可替代地,亲和力可以被定义为特定结合相互作用的平衡解离常数(kd),单位为m(例如,10-5
m到10-13
m)。抗体可以分类为“高亲和力(high-affinity)”抗体或“低亲和力(low-affinity)”抗体。“高亲和力”抗体是指那些ka为至少107m-1
、至少108m-1
、至少109m-1
、至少10
10
m-1
、至少10
11
m-1
、至少10
12
m-1
或至少10
13
m-1
的抗体。“低亲和力”抗体是指那些ka为至多107m-1
、至多106m-1
、至多105m-1
的抗体。可替代地,亲和力可以被定义为特定结合相互作用的平衡解离常数(kd),单位为m(例如,10-5
m到10-13
m)。
[0155]
已知多种测定用于鉴定与特定靶标结合的本公开的抗体,以及确定结合结构域或结合蛋白亲和力,如蛋白质印迹、elisa(例如,直接、间接或夹心)、分析超速离心、光谱法和表面等离子体共振分析(参见例如scatchard等人,《美国纽约科学院年报(ann.n.y.acad.sci.)》51:660,1949;wilson,《科学(science)》295:2103,2002;wolff等人,《癌症研究(cancer res.)》53:2560,1993;以及美国专利第5,283,173号、第5,468,614号或等效物)。还已知用于评估亲和力或表观亲和力或相对亲和力的测定。
[0156]
在某些实例中,可以通过在宿主细胞中重组表达sars-cov-2抗原(例如,通过转染)并用抗体对(例如,固定的或固定的且透化的)宿主细胞进行免疫染色并通过流式细胞术(例如,使用ze5细胞分析仪和flowjo软件(treestar))进行分析结合来确定结合。在一些实施方式中,可以通过表达sars-cov-2的细胞与对照(例如,模拟)细胞的差异性抗体染色来定义阳性结合。
[0157]
在一些实施方式中,如使用生物层干涉法所测量的,本公开的抗体或抗原结合片段与sars-cov-2s蛋白结合。
[0158]
在某些实施方式中,本公开的抗体或抗原结合片段以小于约4.5x 10-9
m、小于约5x10-9
m、小于约1x 10-10
m、小于约5x 10-10
m、小于约1x 10-11
m、小于约5x 10-11
m、小于约1x 10-12
m或小于约5x 10-12
m的kd与sars-cov-2s蛋白结合。在一些实施方式中,本公开的抗体或抗原结合片段以小于约4.5x 10-9
m、小于约5x 10-9
m、小于约1x 10-10
m、小于约5x 10-10
m、小于约1x 10-11
m、小于约5x 10-11
m、小于约1x 10-12
m或小于约5x 10-12
m的kd与sars-cov-2s
蛋白rbd结合。
[0159]
可以使用ic50或ec50值来描述当前公开的抗体或抗原结合片段的某些特性。在某些实施方式中,ic50是引起所指示的生物或生化功能、活性或应答的半最大抑制的组合物(例如,抗体)的浓度。在某些实施方式中,ec50是在测定中提供半最大应答的组合物的浓度。在一些实施方式中,例如,为了描述当前公开的抗体或抗原结合片段中和sars-cov-2引起的感染的能力,ic50和ec50可互换使用。
[0160]
在某些实施方式中,本公开的抗体能够中和由sars-cov-2引起的感染。如本文所使用的,“中和抗体”是可以中和,即预防、抑制、减少、阻碍或干扰病原体在宿主中引发和/或永存感染的能力的抗体。术语“中和抗体(neutralizing antibody)”和“中和的抗体(an antibody that neutralizes/antibodies that neutralize)”在本文中可互换使用。在当前公开的实施方式中的任何实施方式中,抗体或抗原结合片段能够在体外感染模型中和/或体内感染动物模型(例如使用鼻内递送sars-cov-2的叙利亚仓鼠模型)中和/或人体内预防和/或中和sars-cov-2感染。
[0161]
在一些实施方式中,本公开的抗体或抗原结合片段能够中和sars-cov-2感染或由以约16μg/ml至约20μg/ml的ic50用sars-cov-2s蛋白假型化的病毒引起的感染。在一些实施方式中,抗体或抗原结合片段能够中和sars-cov-2感染或以约3μg/ml至约4μg/ml的ic50用sars-cov-2s蛋白假型化的病毒。在当前公开的实施方式中的任何实施方式中,抗体或抗原结合片段能够中和sars-cov-2感染或以如表4中示出的ic50、ic80和/或ic90用sars-cov-2s蛋白假型化的病毒。
[0162]
在一些实施方式中,本公开的抗体或抗原结合片段或包括两种或多种抗体或抗原结合片段的组合物能够中和sars-cov-2感染或以约0.8μg/ml至约0.9μg/ml的ic50用sars-cov-2s蛋白假型化的病毒。在一些实施方式中,本公开的抗体或抗原结合片段或包括两种或多种抗体或抗原结合片段的组合物能够中和sars-cov-2感染或以约0.5μg/ml至约0.6μg/ml的ic50用sars-cov-2s蛋白假型化的病毒。在一些实施方式中,本公开的抗体或抗原结合片段或包括两种或多种抗体或抗原结合片段的组合物能够中和sars-cov-2感染或以约0.1μg/ml至约0.2μg/ml的ic50用sars-cov-2假型化的病毒。
[0163]
在某些实施方式中,抗体或抗原结合片段(i)识别sars-cov-2的ace2受体结合基序(rbm,seq id no:5)中的表位;(ii)能够阻断sars-cov-2与人ace2之间的相互作用(即,通过与sars-cov-2结合部分或完全阻断相互作用);(ii)能够与sars-cov-2s蛋白结合;(iv)识别在sars-cov-2的ace2 rbm中和sars-cov-1的ace2 rbm中保守的表位;(v)对sars-cov-2和sars-cov-1具有交叉反应性;(vi)识别sars-cov-2表面糖蛋白中不存在于ace2 rbm中的表位;或(vii)(i)-(vii)的任何组合。
[0164]
除非在本文中明确地以不同方式定义,否则抗体技术领域的技术人员所理解的术语各自被赋予本领域中获得的含义。例如,术语“抗体(antibody)”是指包括通过二硫键相互连接的至少两条重(h)链和两条轻(l)链的完整抗体,以及完整抗体的任何抗原结合部分或片段,所述抗原结合部分或片段具有或保留与由完整抗体识别的抗原靶分子结合的能力,如scfv、fab或fab'2片段。因此,术语“抗体”在本文中以最广泛的意义使用并且包括多克隆和单克隆抗体,包括完整抗体和其功能(抗原结合)抗体片段,包括片段抗原结合(fab)片段、f(ab')2片段、fab'片段、fv片段、重组igg(rigg)片段、单链抗体片段,包括单链可变
片段(scfv)和单结构域抗体(例如,sdab、sdfv、纳米抗体)片段。所述术语涵盖基因工程化和/或其它方式修饰的免疫球蛋白形式,如胞内抗体、肽体、嵌合抗体、完全人抗体、人源化抗体和异缀合抗体、多特异性(例如,双特异性)抗体、双抗体、三抗体、四抗体、串联双价scfv和串联三价scfv。除非另有说明,否则术语“抗体”应被理解为涵盖其功能抗体片段。所述术语还涵盖完整或全长抗体,包括任何类别或亚类的抗体,包括igg和其亚类(igg1、igg2、igg3、igg4)、igm、ige、iga和igd。
[0165]
术语“v
l”或“vl”和“v
h”或“vh”是指分别来自抗体轻链和抗体重链的可变结合区。在某些实施方式中,vl为卡帕(κ)类(在本文中也被称为“vk”)。在某些实施方式中,vl为拉姆达(λ)类。可变结合区包括被称为“互补决定区”(cdr)和“框架区”(fr)的离散、明确定义的子区。术语“互补决定区”和“cdr”与“高变区”或“hvr”同义,并且是指抗体可变区内的氨基酸序列,通常,其共同将抗原特异性和/或结合亲和力赋予抗体,其中连续cdr(即,cdr1和cdr2、cdr2和cdr3)在一级结构中由框架区彼此分隔。每个可变区有三个cdr(hcdr1、hcdr2、hcdr3;lcdr1、lcdr2、lcdr3;也分别被称为cdrh和cdrl)。在某些实施方式中,抗体vh包括如下四个fr和三个cdr:fr1-hcdr1-fr2-hcdr2-fr3-hcdr3-fr4;并且抗体vl包括如下四个fr和三个cdr:fr1-lcdr1-fr2-lcdr2-fr3-lcdr3-fr4。通常,vh和vl通过其相应cdr共同形成抗原结合位点。
[0166]
如本文所使用的,cdr的“变体”是指cdr序列的具有至多1-3个氨基酸取代(例如,保守或非保守取代)、缺失或其组合的功能变体。
[0167]
cdr和框架区的编号可以根据任何已知的方法或方案,如kabat、chothia、eu、imgt和aho编号方案(参见例如kabat等人,《免疫学所关注的蛋白质序列(sequences of proteins of immunological interest)》,美国健康与人类服务部(usdept.health and human services),美国国立卫生研究院公共卫生服务(public health service national institutes of health),1991,第5版;chothia和lesk,《分子生物学杂志(j.mol.biol.)》196:901-917(1987);lefranc等人,《发展竞争免疫学(dev.comp.immunol.)》27:55,2003;honegger和pl
ü
ckthun,《分子生物学杂志》309:657-670(2001))。可以使用抗原受体编号和受体分类(antigen receptor numbering and receptor classification,anarci)软件工具(2016,《生物信息学(bioinformatics)》15:298-300)标注等效残基位置并且用于比较不同分子。因此,根据一种编号方案鉴别如本文所提供的示例性可变结构域(vh或vl)序列的cdr不排除包括如使用不同编号方案确定的相同可变结构域的cdr的抗体。在某些实施方式中,提供了抗体或抗原结合片段,所述抗体或抗原结合片段包括根据seq id no:22、32、42、52、62、72、74、84、96、106、119、129、139、150、163、173、175、178、186、189、191、198、208、218、228、240、254、264、274、284、298、312、322、332、350、351、353、359、361、363、365、367、368、369、379、389、399、409、419、429、434、444、454、464、474、484、494、504、514、524、534、544、554、564、574、584、594、604、614、624、626、628、630、634、636、638、640、642、644、646、648、650、652、654、656、658、660、662、664、666、668、670、672、674、676、678、680、682、684、692、740、741、742、743、748、749、750、752、754、756、758、759、761、762和764中任一项的vh序列和根据seq id no:26、36、46、56、66、78、88、94、100、110、123、133、143、154、157、168、194、196、202、212、222、232、238、244、250、252、258、268、278、288、294、296、302、308、310、316、326、336、355、357、373、383、393、403、413、423、438、448、458、468、478、488、498、508、
518、528、538、548、558、568、578、588、598、608、618、686、696、738、744和746中任一项的vl序列的cdr,如使用任何已知的cdr编号方法(包括kabat、chothia、eu、imgt、martin(增强型chothia)、contact和aho编号方法)所确定的。在某些实施方式中,cdr根据imgt编号方法。在某些实施方式中,cdr根据由化学计算组(ccg)开发的抗体编号方法;例如,使用分子操作环境(moe)软件(www.chemcomp.com)。
[0168]
在某些实施方式中,提供了抗体或抗原结合片段,其包括重链可变结构域(vh),所述vh包括cdrh1、cdrh2和cdrh3;以及轻链可变结构域(vl),所述vl包括cdrl1、cdrl2和cdrl3,其中:(i)所述cdrh1包括或由以下氨基酸序列组成:根据seq id no:23、33、43、53、63、75、85、97、107、120、130、140、147、160、170、174、183、190、199、209、219、229、241、255、265、275、285、299、313、323、333、370、380、390、400、410、420、430、435、445、455、465、475、485、495、505、515、525、535、545、555、565、575、585、595、605、615、631、693、740、741、742和743中的任一者或其序列变体,所述序列变体包括一个、两个或三个酸取代,其中一个或多个取代任选地是保守取代和/或种系编码的氨基酸的取代;(ii)所述cdrh2包括或由以下氨基酸序列组成:根据seq id no:24、34、44、54、64、76、86、98、108、121、131、141、148、151、161、171、184、200、210、220、230、242、256、266、276、286、300、314、324、334、352、360、362、364、366、371、381、391、401、411、421、431、436、446、456、466、476、486、496、506、516、526、536、546、556、566、576、586、596、606、616、625、632、635、637、639、641、643、645、647、649、651、653、655、657、659、661、663、665、667、669、671、673、675、677、679、681、683、685和694中的任一者或其序列变体,所述序列变体包括一个、两个或三个氨基酸取代,其中一个或多个取代任选地是保守取代和/或种系编码的氨基酸的取代;(iii)所述cdrh3包括或由以下氨基酸序列组成:根据seq id no:25、35、45、55、65、77、87、99、109、122、132、142、149、162、164、165、172、176、177、179、180、185、187、188、201、211、221、231、243、257、267、277、287、301、315、325、335、354、372、382、392、402、412、422、432、437、447、457、467、477、487、497、507、517、527、537、547、557、567、577、587、597、607、617、627、633、695、751、753、755、757、760、763、765和766中的任一者或其序列变体,所述序列变体包括一个、两个或三个氨基酸取代,其中一个或多个取代任选地是保守取代和/或种系编码的氨基酸的取代;(iv)所述cdrl1包括或由以下氨基酸序列组成:根据seq id no:27、37、47、57、67、79、89、101、111、124、134、144、152、155、156、158、159、166、181、192、203、213、223、233、245、259、269、279、289、303、317、327、337、356、374、384、394、404、414、424、439、449、459、469、479、489、499、509、519、529、539、549、559、569、579、589、599、609、619、687和697中的任一者或其序列变体,所述序列变体包括一个、两个或三个氨基酸取代,其中一个或多个取代任选地是保守取代和/或种系编码的氨基酸的取代;(v)所述cdrl2包括或由以下氨基酸序列组成:根据seq id no:28、38、48、58、68、80、90、102、112、125、135、145、153、167、182、193、204、214、224、234、246、260、270、280、290、304、318、328、338、375、385、395、405、415、425、440、450、460、470、480、490、500、510、520、530、540、550、560、570、580、590、600、610、620、688和698中的任一者或其序列变体,所述序列变体包括一个、两个或三个氨基酸取代,其中一个或多个取代任选地是保守取代和/或种系编码的氨基酸的取代;和/或(vi)所述cdrl3包括或由以下氨基酸序列组成:根据seq id no:29、39、49、59、69、81、91、103、113、126、136、146、169、195、197、205、215、225、235、247、261、271、281、291、305、319、329、339、358、376、386、396、
406、416、426、441、451、461、471、481、491、501、511、521、531、541、551、561、571、581、591、601、611、621、689、699、745和747中的任一者或其序列变体,所述序列变体包括一个、两个或三个氨基酸取代,其中一个或多个取代任选地是保守取代和/或种系编码的氨基酸的取代,其中所述抗体或抗原结合片段能够与在宿主细胞的细胞表面上表达的sars-cov-2的表面糖蛋白结合。
[0169]
在当前公开的实施方式中的任何实施方式中,所述抗体或抗原结合片段能够在体外感染模型和/或体内感染动物模型和/或人体内预防和/或中和sars-cov-2感染。
[0170]
在当前公开的实施方式中的任何实施方式中,所述抗体或抗原结合片段包括根据以下的cdrh1、cdrh2、cdrh3、cdrl1、cdrl2和cdrl3氨基酸序列:(i)分别为seq id no:23-25和27-29;(ii)分别为seq id no:33-35和37-39;(iii)分别为seq id no:43-45和47-49;(iv)分别为seq id no:53-55和57-59;(v)分别为seq id no:63-65和67-69;(vi)分别为seq id no:75-77和79-81;(vii)分别为seq id no:85-87和89-91;(viii)分别为seq id no:97-99和101-103;(ix)分别为seq id no:107-109和111-113;(x)分别为seq id no:120-122和124-126;(xi)分别为seq id no:130-132和134-136;(xii)分别为seq id no:23或147,在24、148或151中的任一者,25或149,在27、152、155、156、158或159中的任一者,28或153,和29;(xiii)分别为seq id no:43或160,44或161,在45、162、164或165中的任一者,47或166,48或167,和49或169;(xiv)分别为在seq id no:130、170或174中的任一者,130,131,132,134或181,135或182,和136;(xv)分别为在seq id no:53、183或190中的任一者,54或184,在55、185、187或188中的任一者,57或192,58或193,以及在59、195或197中的任一者;(xvi)分别为seq id no:199-201和203-205;(xvii)分别为seq id no:209-211和213-215;(xviii)分别为seq id no:219-221和223-225;(xix)分别为seq id no:229-231和233-235;(xx)分别为seq id no:241-243和245-247;(xxi)分别为seq id no:255-257和259-261;(xxii)分别为seq id no:265-267和269-271;(xxiii)分别为seq id no:275-277和279-281;(xxiv)分别为seq id no:285-287、289-291;(xxv)分别为seq id no:299-301和303-305;(xxvi)分别为seq id no:313-315和317-319;(xxvii)分别为seq id no:323-325和327-329;(xxviii)分别为seq id no:333-335和337-339;(xxix)分别为seq id no:229,230或352,231或354,和233或356,234,和235或358;(xxx)分别为seq id no:313,在314、360、362、364或366中的任一者,315,和317-319;(xxxi)分别为seq id no:370-372和374-376;(xxxii)分别为seq id no:380-382和384-386;(xxxiii)分别为seq id no:390-392和394-396;(xxxiv)分别为seq id no:400-402和404-406;(xxxv)分别为seq id no:410-412和414-416;(xxxvi)分别为seq id no:420-422和424-426;(xxxvii)分别为seq id no:435-437和439-441;(xxxviii)分别为seq id no:445-447和449-451;(xxxix)分别为seq id no:455-457和459-461;(xxxx)分别为seq id no:465-467和469-471;(xxxxi)分别为seq id no:475-477和479-481;(xxxxii)分别为seq id no:485-487和489-491;(xxxxiii)分别为seq id no:494-497和499-501;(xxxxiv)分别为seq id no:505-507和509-511;(xxxxv)分别为seq id no:515-517和519-521;(xxxxvi)分别为seq id no:525-527和529-531;(xxxxvii)分别为seq id no:535-537和539-541;(xxxxviii)分别为seq id no:545-547和549-551;(xxxxix)分别为seq id no:555-557和559-561;(xxxxx)分别为seq id no:565-567和569-571;(xxxxxi)分别为seq id no:575-577和579-581;(xxxxxii)分别
v2 mab、sars-cov-2s2x30-v3 mab、sars-cov-2s2x30-v4 mab、sars-cov-2s2x30-v5 mab、sars-cov-2s2x30-v6 mab、sars-cov-2s2x47-v1 mab、sars-cov-2s2x47-v2 mab、sars-cov-2s2x47-v3 mab、sars-cov-2s2x47-v4 mab、sars-cov-2s2x47-v5 mab、sars-cov-2s2x47-v6 mab、sars-cov-2s2x47-v7 mab、sars-cov-2s2x47-v8 mab、sars-cov-2s2x47-v9 mab、sars-cov-2s2x55-v1 mab、sars-cov-2s2x55-v2 mab、sars-cov-2s2x56-v1 mab、sars-cov-2s2x58-v1 mab、sars-cov-2s2x58-v2 mab、sars-cov-2s2x71-v1 mab、sars-cov-2s2x76-v1 mab、sars-cov-2s2x76-v2 mab、sars-cov-2s2x76-v3 mab、sars-cov-2s2x76-v4 mab、sars-cov-2s2x11-v1 mab或sars-cov-2s2x35-v1 mab、sars-cov-2s2x35-v2 mab、sars-cov-2s2x35-v3 mab、sars-cov-2s2x35-v4 mab、sars-cov-2s2x35-v5 mab、sars-cov-2s2x35-v6 mab、sars-cov-2s2x35-v7 mab、sars-cov-2s2x35-v8 mab、sars-cov-2s2h30-v1 mab、sars-cov-2s2h37-v1 mab、sars-cov-2s2h40-v1 mab、sars-cov-2s2h58-v1 mab、sars-cov-2s2h58-v2 mab、sars-cov-2s2h58-v3 mab、sars-cov-2s2h58-v4 mab、sars-cov-2s2h58-v5 mab、sars-cov-2s2h58-v6 mab、sars-cov-2s2h58-v7 mab、sars-cov-2s2h62-v1 mab、sars-cov-2s2h62-v2 mab、sars-cov-2s2h62-v3 mab、sars-cov-2s2h66-v1 mab、sars-cov-2s2h66-v2 mab、sars-cov-2s2h66-v3 mab、sars-cov-2s2h70-v1 mab、sars-cov-2s2h71-v1 mab、sars-cov-2s2h73-v1 mab、sars-cov-2s2n12-v1 mab、sars-cov-2s2n12-v2 mab、sars-cov-2s2n12-v3 mab、sars-cov-2s2n22-v1 mab、sars-cov-2s2n22-v2 mab、sars-cov-2s2n22-v3 mab、sars-cov-2s2n22-v4 mab、sars-cov-2s2n22-v5 mab、sars-cov-2s2n22-v6 mab、sars-cov-2s2n22-v7 mab、sars-cov-2s2n25-v1 mab、sars-cov-2s2n28-v1 mab、sars-cov-2s2e6-v1 mab、sars-cov-2s2e7-v1 mab、sars-cov-2s2e9-v1 mab、sars-cov-2s2e12-v1 mab、sars-cov-2s2e12-v2 mab、sars-cov-2s2e13-v1 mab、sars-cov-2s2e14-v1 mab、sars-cov-2s2k4-v1 mab、sars-cov-2s2x193-v1 mab、sars-cov-2s2x195-v1 mab、sars-cov-2s2x219-v1 mab、sars-cov-2s2x244-v1 mab、sars-cov-2s2x246-v1 mab、sars-cov-2s2x256-v1 mab、sars-cov-2s2x269-v1 mab、sars-cov-2s2x278-v1 mab、sars-cov-2s2m7-v1 mab、sars-cov-2s2m11-v1 mab、sars-cov-2s2m16-v1 mab、sars-cov-2s2m28-v1 mab、sars-cov-2s2l49-v1 mab、sars cov-2s2d65-v1 mab、sars cov-2s2d97-v1 mab、sars cov-2s2d106-v1 mab、sars cov-2s2x149-v1 mab、sars cov-2s2x179-v1 mab、sars-cov-2s2h101 mab、抗体409_11_1_v2、抗体409_11_1_v3、抗体409_11_1_v4、抗体409_11_1_v5、抗体409_11_1_v6、抗体409_11_2_v1、抗体409_11_2_v2、抗体409_11_2_v3、抗体409_11_2_v4、抗体409_11_2_v5、抗体409_11_2_v6、抗体409_11_2_v7、抗体409_11_2_v8、抗体409_11_2_v9、抗体409_11_2_v10、抗体409_11_2_v11、抗体409_11_2_v12、抗体409_11_2_v13、抗体409_11_2_v14、抗体409_11_2_v15、抗体409_11_2_v16、抗体409_11_2_v17、抗体409_11_2_v18、抗体409_11_2_v19、抗体409_11_2_v20、抗体409_11_2_v21、抗体409_11_2_v22、抗体409_11_2_v23、抗体409_11_2_v24、抗体409_11_2_v25、抗体409_11_2_v26、抗体409_11_2_v27、抗体409_11_3_v1、抗体409_11_4_v2、抗体409_11_4_v3、抗体409_11_4_v4、抗体409_11_4_v5、抗体409_11_4_v6、抗体409_11_4_v7、抗体409_11_4_v8、抗体409_11_4_v9、抗体409_11_4_v10、抗体409_11_4_v11、抗体409_11_4_v12或抗体409_11_4_v13的对应cdr。也就是说,考虑了来自sars-cov-2mab的cdr的所有组合和表2中所提供的其变体序列。
[0174]
在抗体开发期间,种系可变(v)、接合(j)和多样性(d)基因座中的dna可以重排并且可以发生编码序列中核苷酸的插入和/或缺失。体细胞突变可以由所得序列编码,并且可以通过参考对应的已知种系序列鉴别。在一些情况下,对抗体所期望的性质(例如,与sars-cov-2抗原结合)不重要的体细胞突变或将非所期望的性质赋予抗体(例如,施用抗体的受试者中免疫原性的风险提高)的体细胞突变,或两者可以由对应的经种系编码的氨基酸或不同氨基酸替换,使得抗体所期望的性质得到改良或维持并且抗体的非所期望的性质被减少或消除。因此,在一些实施方式中,与亲本抗体或抗原结合片段相比,本公开的抗体或抗原结合片段在可变区中包括至少一个以上经种系编码的氨基酸,前提是亲本抗体或抗原结合片段包括一个或多个体细胞突变。本文中的表2中提供了本公开的抗sars-cov-2抗体的可变区和cdr氨基酸序列。
[0175]
本公开的示例性抗体包括抗体s2e12和其工程化变体。工程化的s2e12变体包括“抗体409_11_4_v2”、“抗体409_11_4_v3”、“抗体409_11_4_v4”、“抗体409_11_4_v5”、“抗体409_11_4_v6”、“抗体409_11_4_v7”、“抗体409_11_4_v8”、“抗体409_11_4_v9”、“抗体409_11_4_v10”、“抗体409_11_4_v11”、“抗体409_11_4_v12”、“抗体409_11_4_v13”。在特定实施方式中,抗体或抗原结合片段包括选自表1中(分别)提供的cdrh1、cdrh2、cdrh3、cdrl1、cdrl2和/或cdrl3氨基酸序列中的任何氨基酸序列的cdrh1、cdrh2、cdrh3、cdrl1、cdrl2和cdrl3。表1还提供了包括s2e12 cdrh3序列和紧邻s2e12中的cdrh3的n末端的两个氨基酸(ala-ser)的氨基酸序列。
[0176]
在一些实施方式中,抗体或抗原结合片段包括:在如seq id no:399、748、749、750、752、754、756、758、759和761中的任一者中所示的vh氨基酸序列的cdrh1、cdrh2和/或cdrh3;以及在如seq id no:403、738、744和746中的任一者中所示的vl氨基酸序列的cdrl1、cdrl2和/或cdrl3(即,根据本领域已知的任何cdr编号或测定方法,如imgt、kabat、chothia、aho、north、contact、ccg、eu或martin(增强型chothia))。例如,在一些实施方式中,抗体或抗原结合片段包括如seq id no:399所示的vh氨基酸序列的cdrh1、cdrh2和/或cdrh3,以及如seq id no:738所示的vl氨基酸序列的cdrl1、cdrl2和/或cdrl3,其中cdr根据imgt。作为另一个非限制性实例,在一些实施方式中,抗体或抗原结合片段包括如seq id no:399所示的vh氨基酸序列的cdrh1、cdrh2和/或cdrh3,以及如seq id no:738所示的vl氨基酸序列的cdrl1、cdrl2和/或cdrl3,其中cdr根据imgt。
[0177]
在另外的实施方式中,抗体或抗原结合片段包括与表1中提供的vh氨基酸序列具有至少85%(例如,85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)同一性的vh和/或与表1中提供的vl氨基酸序列具有至少85%(例如,85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)同一性的vl。在仍另外的实施方式中,抗体或抗原结合片段包括与表1中提供的vh氨基酸序列具有至少90%同一性的vh和/或与表1中提供的vl氨基酸序列具有至少90%同一性的vl。在仍另外的实施方式中,抗体或抗原结合片段包括与表1中提供的vh氨基酸序列具有至少95%同一性的vh和/或与表1中提供的vl氨基酸序列具有至少95%同一性的vl。在仍另外的实施方式中,抗体或抗原结合片段包括与表1中提供的vh氨基酸序列具有至少99%同一性的vh和/或与表1中提供的vl氨基酸序列具有至少99%同一性的vl。在一些实施方式中,抗体或抗原结合片段包括选自表1中提供的vh氨基酸序列的vh氨基酸序列和选自
表1中提供的vl氨基酸序列的vl氨基酸序列。在一些实施方式中,s2e12抗体包括κ轻链,例如,k1m3、igkc*01。
[0178]
表1.某些s2e12抗体的cdr(imgt)和可变区氨基酸序列
[0179]
[0180]
[0181][0182]
在一些实施方式中,抗体或其抗原结合片段包括重链可变结构域(vh)和轻链可变结构域(vl),所述vh包括互补决定区(cdr)h1、cdrh2和cdrh3,所述vl包括cdrl1、cdrl2和cdrl3,其中cdrh1、cdrh2、cdrh3、cdrl1、cdrl2和cdrl3包括如下所示的氨基酸序列或由其组成:(a)分别为seq id no:400、401、766、404、405和406;(b)分别为seq id no:400、401、769、404、405和406;(c)分别为seq id no:400、401、770、404、405和406;(d)分别为seq id no:400、401、771、404、405和406;(e)分别为seq id no:400、401、772、404、405和406;(f)分别为seq id no:400、401、773、404、405和406;(g)分别为seq id no:400、401、766、404、405和745;(h)分别为seq id no:400、401、769、404、405和745;(i)分别为seq id no:400、401、770、404、405和745;(j)分别为seq id no:400、401、771、404、405和745;(k)分别为seq id no:400、401、772、404、405和745;(l)分别为seq id no:400、401、773、405、405和745;(m)分别为seq id no:400、401、766、404、405和747;(n)分别为seq id no:400、401、769、404、405和747;(o)分别为seq id no:400、401、770、404、405和747;(p)分别为seq id no:400、401、771、404、405和747;(q)分别为seq id no:400、401、772、404、405和747;或(r)分别为seq id no:400、401、773、404、405和747。
[0183]
在另外的实施方式中,抗体或抗原结合片段包括如下所示的氨基酸序列:(a)seq idno:400、401、402、404、405和406;(b)seq id no:400、401、751、404、405和406;(c)seq id no:400、401、753、404、405和406;(d)seq id no:400、401、755、404、405和406;(e)seq id no:400、401、757、404、405和406;(f)seq id no:400、401、760、404、405和406;(g)seq id no:400、401、402、404、405和745;(h)seq id no:400、401、751、404、405和745;(i)seq id no:400、401、753、404、405和745;(j)seq id no:400、401、755、404、405和745;(k)seq id no:400、401、757、404、405和745;(l)seq id no:400、401、760、405、405和745;(m)seq id no:400、401、402、404、405和747;(n)seq id no:400、401、751、404、405和747;(o)seq id no:400、401、753、404、405和747;(p)seq id no:400、401、755、404、405和747;(q)seq id no:400、401、757、404、405和747;或(r)seq id no:400、401、760、404、405和747。在上述(a)-(r)中的每一者中,应当理解的是,前三个引用的seq id no是vh氨基酸序列,并且后三
个引用的seq id no是vl氨基酸序列。例如,在(a)中,seq id no:400、401和402是vh中的氨基酸序列,并且seq id no:404、405和406是vl中的氨基酸序列。
[0184]
其它示例性抗体包括s2m11、s2d106、s2h58和其工程化变体。在一些实施方式中,抗体或抗原结合片段分别包括如seq id no:525-527和529-531所示的cdrh1、cdrh2、cdrh3、cdrl1、cdrl2和cdrl3氨基酸序列。在另外的实施方式中,抗体或抗原结合片段包括具有至少80%、至少85%、至少90%、至少95%、至少97%、至少99%或包括如seq id no:524所示的氨基酸序列或由其组成的vh,以及具有至少80%、至少85%、至少90%、至少95%、至少97%、至少99%或包括如seq id no:528所示的氨基酸序列或由其组成的vl。在其它实施方式中,抗体或抗原结合片段分别包括如seq id no:585、586、587、589、590和591所示的或如seq id no:585、625、627、589、590和591所示的cdrh1、cdrh2、cdrh3、cdrl1、cdrl2和cdrl3氨基酸序列。在另外的实施方式中,抗体或抗原结合片段包括具有至少80%、至少85%、至少90%、至少95%、至少97%、至少99%或包括在如seq id no:584、624、626和628中的任一者中所示的氨基酸序列或由其组成的vh,以及具有至少80%、至少85%、至少90%、至少95%、至少97%、至少99%或包括如seq id no:588所示的氨基酸序列或由其组成的vl。在其它实施方式中,抗体或抗原结合片段分别包括如seq id no:229、230、231、233、234和235所示的cdrh1、cdrh2、cdrh3、cdrl1、cdrl2和cdrl3氨基酸序列。在另外的实施方式中,抗体或抗原结合片段包括具有至少80%、至少85%、至少90%、至少95%、至少97%、至少99%或包括在如seq id no:228、740、741、742和743中的任一者中所示的氨基酸序列或由其组成的vh,以及具有至少80%、至少85%、至少90%、至少95%、至少97%、至少99%或包括如seq id no:232所示的氨基酸序列或由其组成的vl。在其它实施方式中,抗体或抗原结合片段包括具有至少80%、至少85%、至少90%、至少95%、至少97%、至少99%或包括在如seq id no:228、740、741、742和743中的任一者中所示的氨基酸序列或由其组成的vh,以及具有至少80%、至少85%、至少90%、至少95%、至少97%、至少99%或包括如seq id no:238所示的氨基酸序列或由组成的vl。
[0185]
在某些实施方式中,抗体或抗原结合片段包括氨基酸修饰(例如,取代突变)以去除非所期望的氧化、去酰胺化和/或异构化风险。
[0186]
与当前公开的具有特定序列的抗体相比,本文提供的变体抗体包括在可变区(例如,vh、vl、框架或cdr)中包括一个或多个氨基酸改变的那些变体抗体,其中变体抗体能够与sars-cov-2抗原结合。
[0187]
在某些实施方式中,所述vh包括与以下任一者的氨基酸序列具有至少85%(例如,具有85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)同一性的氨基酸序列或由其组成:seq id no:22、32、42、52、62、72、74、84、96、106、119、129、139、150、163、173、175、178、186、189、191、198、208、218、228、240、254、264、274、284、298、312、322、332、350、351、353、359、361、363、365、367、368、369、379、389、399、409、419、429、434、444、454、464、474、484、494、504、514、524、534、544、554、564、574、584、594、604、614、624、626、628、630、634、636、638、640、642、644、646、648、650、652、654、656、658、660、662、664、666、668、670、672、674、676、678、680、682、684、692、740、741、742、743、748、749、750、752、754、756、758、759、761、762和765中的任一者的氨基酸序列具有至少85%(例如,具有85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、
97%、98%、99%或100%)同一性的氨基酸序列或由其组成,其中的改变任选地限于一个或多个框架区和/或改变包括一个或多个种系编码的氨基酸的取代;和/或(ii)所述vl包括与以下任一者的氨基酸序列具有至少85%(例如,具有85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)同一性的氨基酸序列或由其组成:seq id no:26、36、46、56、66、78、88、94、100、110、123、133、143、154、157、168、194、196、202、212、222、232、238、244、250、252、258、268、278、288、294、296、302、308、310、316、326、336、355、357、373、383、393、403、413、423、438、448、458、468、478、488、498、508、518、528、538、548、558、568、578、588、598、608、618、686、696、738、744和746,其中的改变任选地限于一个或多个框架区和/或改变包括一个或多个种系编码的氨基酸的取代。
[0188]
在另外的实施方式中,vh与在如seq id no:399、748、749、750、752、754、756、758、759和761中的任一者中所示的氨基酸序列具有至少85%(例如,具有85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)同一性,并且vl与在如seq id no:403、738、744和746中的任一者中所示的氨基酸序列具有至少85%(例如,具有85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)同一性。
[0189]
在另外的实施方式中,vh与在如seq id no:399、748、749、750、752、754、756、758、759和761中的任一者中所示的氨基酸序列具有至少85%(例如,具有85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)同一性,并且vl与如seq id no:403所示的氨基酸序列具有至少85%(例如,具有85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)同一性。
[0190]
在另外的实施方式中,vh与在如seq id no:399、748、749、750、752、754、756、758、759和761中的任一者中所示的氨基酸序列具有至少85%(即,具有85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)同一性,并且vl与如seq id no:738所示的氨基酸序列具有至少85%(例如,具有85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)同一性。
[0191]
在另外的实施方式中,vh与在如seq id no:399、748、749、750、752、754、756、758、759和761中的任一者中所示的氨基酸序列具有至少85%(例如,具有85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)同一性,并且vl与如seq id no:744所示的氨基酸序列具有至少85%(例如,具有85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)同一性。
[0192]
在另外的实施方式中,vh与在如seq id no:399、748、749、750、752、754、756、758、759和761中的任一者中所示的氨基酸序列具有至少85%(例如,具有85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)同一性,并且vl与如seq id no:746所示的氨基酸序列具有至少85%(例如,具有85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)同一性。
[0193]
在一些实施方式中,vh包括如seq id no:399所示的氨基酸序列或由其组成,并且vl包括如seq id no:403所示的氨基酸序列或由其组成。在一些实施方式中,vh包括如seq id no:399所示的氨基酸序列或由其组成,并且vl包括如seq id no:738所示的氨基酸序列或由其组成。在一些实施方式中,vh包括如seq id no:399所示的氨基酸序列或由其组成,
并且vl包括如seq id no:744所示的氨基酸序列或由其组成。在一些实施方式中,vh包括如seq id no:399所示的氨基酸序列或由其组成,并且vl包括如seq id no:746所示的氨基酸序列或由其组成。
[0194]
在一些实施方式中,vh包括如seq id no:748所示的氨基酸序列或由其组成,并且vl包括如seq id no:403所示的氨基酸序列或由其组成。在一些实施方式中,vh包括如seq id no:748所示的氨基酸序列或由其组成,并且vl包括如seq id no:738所示的氨基酸序列或由其组成。在一些实施方式中,vh包括如seq id no:748所示的氨基酸序列或由其组成,并且vl包括如seq id no:744所示的氨基酸序列或由其组成。在一些实施方式中,vh包括如seq id no:748所示的氨基酸序列或由其组成,并且vl包括如seq id no:746所示的氨基酸序列或由其组成。
[0195]
在一些实施方式中,vh包括如seq id no:749所示的氨基酸序列或由其组成,并且vl包括如seq id no:403所示的氨基酸序列或由其组成。在一些实施方式中,vh包括如seq id no:749所示的氨基酸序列或由其组成,并且vl包括如seq id no:738所示的氨基酸序列或由其组成。在一些实施方式中,vh包括如seq id no:749所示的氨基酸序列或由其组成,并且vl包括如seq id no:744所示的氨基酸序列或由其组成。在一些实施方式中,vh包括如seq id no:749所示的氨基酸序列或由其组成,并且vl包括如seq id no:746所示的氨基酸序列或由其组成。
[0196]
在一些实施方式中,vh包括如seq id no:750所示的氨基酸序列或由其组成,并且vl包括如seq id no:403所示的氨基酸序列或由其组成。在一些实施方式中,vh包括如seq id no:750所示的氨基酸序列或由其组成,并且vl包括如seq id no:738所示的氨基酸序列或由其组成。在一些实施方式中,vh包括如seq id no:750所示的氨基酸序列或由其组成,并且vl包括如seq id no:744所示的氨基酸序列或由其组成。在一些实施方式中,vh包括如seq id no:750所示的氨基酸序列或由其组成,并且vl包括如seq id no:746所示的氨基酸序列或由其组成。
[0197]
在一些实施方式中,vh包括如seq id no:750所示的氨基酸序列或由其组成,并且vl包括如seq id no:403所示的氨基酸序列或由其组成。在一些实施方式中,vh包括如seq id no:752所示的氨基酸序列或由其组成,并且vl包括如seq id no:738所示的氨基酸序列或由其组成。在一些实施方式中,vh包括如seq id no:752所示的氨基酸序列或由其组成,并且vl包括如seq id no:744所示的氨基酸序列或由其组成。在一些实施方式中,vh包括如seq id no:752所示的氨基酸序列或由其组成,并且vl包括如seq id no:746所示的氨基酸序列或由其组成。
[0198]
在一些实施方式中,vh包括如seq id no:754所示的氨基酸序列或由其组成,并且vl包括如seq id no:403所示的氨基酸序列或由其组成。在一些实施方式中,vh包括如seq id no:754所示的氨基酸序列或由其组成,并且vl包括如seq id no:738所示的氨基酸序列或由其组成。在一些实施方式中,vh包括如seq id no:754所示的氨基酸序列或由其组成,并且vl包括如seq id no:744所示的氨基酸序列或由其组成。在一些实施方式中,vh包括如seq id no:754所示的氨基酸序列或由其组成,并且vl包括如seq id no:746所示的氨基酸序列或由其组成。
[0199]
在一些实施方式中,vh包括如seq id no:756所示的氨基酸序列或由其组成,并且
vl包括如seq id no:403所示的氨基酸序列或由其组成。在一些实施方式中,vh包括如seq id no:756所示的氨基酸序列或由其组成,并且vl包括如seq id no:738所示的氨基酸序列或由其组成。在一些实施方式中,vh包括如seq id no:756所示的氨基酸序列或由其组成,并且vl包括如seq id no:744所示的氨基酸序列或由其组成。在一些实施方式中,vh包括如seq id no:756所示的氨基酸序列或由其组成,并且vl包括如seq id no:746所示的氨基酸序列或由其组成。
[0200]
在一些实施方式中,vh包括如seq id no:758所示的氨基酸序列或由其组成,并且vl包括如seq id no:403所示的氨基酸序列或由其组成。在一些实施方式中,vh包括如seq id no:758所示的氨基酸序列或由其组成,并且vl包括如seq id no:738所示的氨基酸序列或由其组成。在一些实施方式中,vh包括如seq id no:758所示的氨基酸序列或由其组成,并且vl包括如seq id no:744所示的氨基酸序列或由其组成。在一些实施方式中,vh包括如seq id no:758所示的氨基酸序列或由其组成,并且vl包括如seq id no:746所示的氨基酸序列或由其组成。
[0201]
在一些实施方式中,vh包括如seq id no:759所示的氨基酸序列或由其组成,并且vl包括如seq id no:403所示的氨基酸序列或由其组成。在一些实施方式中,vh包括如seq id no:759所示的氨基酸序列或由其组成,并且vl包括如seq id no:738所示的氨基酸序列或由其组成。在一些实施方式中,vh包括如seq id no:759所示的氨基酸序列或由其组成,并且vl包括如seq id no:744所示的氨基酸序列或由其组成。在一些实施方式中,vh包括如seq id no:759所示的氨基酸序列或由其组成,并且vl包括如seq id no:746所示的氨基酸序列或由其组成。
[0202]
在一些实施方式中,vh包括如seq id no:761所示的氨基酸序列或由其组成,并且vl包括如seq id no:403所示的氨基酸序列或由其组成。在一些实施方式中,vh包括如seq id no:761所示的氨基酸序列或由其组成,并且vl包括如seq id no:738所示的氨基酸序列或由其组成。在一些实施方式中,vh包括如seq id no:761所示的氨基酸序列或由其组成,并且vl包括如seq id no:744所示的氨基酸序列或由其组成。在一些实施方式中,vh包括如seq id no:761所示的氨基酸序列或由其组成,并且vl包括如seq id no:746所示的氨基酸序列或由其组成。
[0203]
在一些实施方式中,vh包括表2中所示的任何vh氨基酸序列或由其组成,并且vl包括表2中所示的任何vl氨基酸序列或由其组成。在特定实施方式中,所述vh和所述vl包括以下各项的氨基酸序列或由其组成,分别如以下seq id no.所示:(i)分别为seq id no:22和26;(ii)分别为seq id no:32和36;(iii)分别为seq id no:42和46;(iv)分别为seq id no:52和56;(v)分别为seq id no:62和66;(vi)分别为seq id no:72和66;(vii)分别为seq id no:74和78;(viii)分别为seq id no:84和88;(ix)分别为seq id no:84和94;(x)分别为seq id no:96和100;(xi)分别为seq id no:106和110;(xii)分别为seq id no:119和123;(xiii)分别为seq id no:129和133;(xiv)分别为seq id no:22或150,和26、154或157;(xv)分别为seq id no:42或163,和46或168;(xvi)分别为在seq id no:129、173、175或178中的任一者,和133;(xvii)分别为在seq id no:52、186、189或191中的任一者,和在56、194或196中的任一者;(xviii)分别为seq id no:198和202;(xix)分别为seq id no:208和212;(xx)分别为seq id no:218和222;(xxi)分别为seq id no:228,和232或238;
(xxii)分别为seq id no:240,以及在244、250或252中的任一者;(xxiii)分别为seq id no:254和258;(xxiv)分别为seq id no:264和268;(xxv)分别为274和278;(xxvi)分别为seq id no:284,以及在288、294或296中的任一者;(xxvii)分别为seq id no:298,以及在302、308或310中的任一者;(xxviii)分别为seq id no:312和316;(xxix)分别为seq id no:322和326;(xxx)分别为seq id no:332和336;(xxxi)分别为在seq id no:228、350、351或353中的任一者,和在232、238、355或357中的任一者;(xxxii)分别为在seq id no:312、359、361、363、365、367或368中的任一者,和316;(xxxiii)分别为seq id no:369和373;(xxxiv)分别为seq id no:379和383;(xxxv)分别为seq id no:389和393;(xxxvi)分别为seq id no:399和403或738;(xxxvii)分别为seq id no:409和413;(xxxviii)分别为seq id no:419和423;(xxxix)分别为seq id no:434和438;(xxxx)分别为seq id no:444和448;(xxxxi)分别为seq id no:454和458;(xxxxii)分别为seq id no:464和468;(xxxxiii)分别为seq id no:474和478;(xxxxiv)分别为seq id no:484和488;(xxxxv)分别为494和498;(xxxxvi)分别为seq id no:504和508;(xxxxvii)分别为seq id no:514和518;(xxxxviii)分别为seq id no:524和528;(xxxxix)分别为seq id no:534和538;(xxxxx)分别为seq id no:544和548;(xxxxxi)分别为seq id no:554和558;(xxxxxii)分别为seq id no:564和568;(xxxxxiii)分别为seq id no:574和578;(xxxxxiv)分别为seq id no:584和588;(xxxxxv)分别为seq id no:594和598;(xxxxxvi)分别为seq id no:604和608;(xxxxxvii)分别为seq id no:614和618;(xxxxxviii)分别为seq id no:624、626或628,和588;(xxxxxix)分别为seq id no:630、634、636、638、640、642、644、646、648、650、652、654、656、658、660、662、664、666、668、670、672、674、676、678、680、682或684,和686;(xxxxxx)分别为seq id no:692和696;(xxxxxxi)分别为在seq id no:740-743中的任一者,和238;(xxxxxxii)分别为在seq id no:399、748、749、750、752、754、756、758、759或761中的任一者,和在403、744或746中的任一者;或(xxxxxxiii)分别为seq id no:762或764,和588。
[0204]
在某些实施方式中,vh和vl分别包括根据seq id no:624、626或628和588的氨基酸序列或由其组成。在某些实施方式中,vh和vl分别包括根据seq id no:630、634、636、638、640、642、644、646、648、650、652、654、656、658、660、662、664、666、668、670、672、674、676、678、680、682或684,和686的氨基酸序列或由其组成。在某些实施方式中,vh和vl分别包括根据seq id no:692和696的氨基酸序列或由其组成。
[0205]
在某些实施方式中,vh和vl分别包括根据seq id no:399和738的氨基酸序列或由其组成。在某些实施方式中,vh和vl分别包括根据seq id no:399和403的氨基酸序列或由其组成。在某些实施方式中,vh和vl分别包括根据seq id no:399和738的氨基酸序列或由其组成。在某些实施方式中,vh和vl分别包括根据seq id no:399和744的氨基酸序列或由其组成。在某些实施方式中,vh和vl分别包括根据seq id no:399和746的氨基酸序列或由其组成。在某些实施方式中,vh和vl分别包括根据seq id no:748和403的氨基酸序列或由其组成。在某些实施方式中,vh和vl分别包括根据seq id no:749和403的氨基酸序列或由其组成。在某些实施方式中,vh和vl分别包括根据seq id no:750和403的氨基酸序列或由其组成。在某些实施方式中,vh和vl分别包括根据seq id no:752和403的氨基酸序列或由其组成。在某些实施方式中,vh和vl分别包括根据seq id no:754和403的氨基酸序列或由
其组成。在某些实施方式中,vh和vl分别包括根据seq id no:756和403的氨基酸序列或由其组成。在某些实施方式中,vh和vl分别包括根据seq id no:758和403的氨基酸序列或由其组成。在某些实施方式中,vh和vl分别包括根据seq id no:759和403的氨基酸序列或由其组成。在某些实施方式中,vh和vl分别包括根据seq id no:761和403的氨基酸序列或由其组成。
[0206]
术语“cl”是指“免疫球蛋白轻链恒定区(immunoglobulin light chain constant region)”或“轻链恒定区(light chain constant region)”,即来自抗体轻链的恒定区。术语“ch”是指“免疫球蛋白重链恒定区(immunoglobulin heavy chain constant region)”或“重链恒定区(heavy chain constant region)”,取决于抗体同种型,其可以进一步分为ch1、ch2和ch3(iga、igd、igg)或ch1、ch2、ch3和ch4结构域(ige、igm)。本文进一步描述抗体重链的fc区。在当前公开的实施方式中的任何实施方式中,本公开的抗体或抗原结合片段包括cl、ch1、ch2和ch3中的任何一者或多者。在某些实施方式中,cl包括与seq id no:8或seq id no:9的氨基酸序列具有90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的氨基酸序列。在某些实施方式中,ch1-ch2-ch3(也称为ch1-ch3)包括与seq id no:6或seq id no:7的氨基酸序列具有90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的氨基酸序列。
[0207]
在某些实施方式中,本公开的抗体或抗原结合片段包括重链多肽和轻链多肽,所述重链多肽包括如seq id no:767所示的氨基酸序列或由其组成,所述轻链多肽包括如seq id no:768所示的氨基酸序列或由其组成。
[0208]
应当理解的是,例如,在哺乳动物细胞系中的产生可以去除抗体重链的一个或多个c末端赖氨酸(参见例如liu等人,mab 6(5):1145-1154(2014))。因此,本公开的抗体或抗原结合片段可以包括重链、ch1-ch3、ch3或fc多肽,其中存在或不存在c末端赖氨酸残基;换句话说,涵盖重链、ch1-ch3或fc多肽的c末端残基由于c末端赖氨酸的去除而不是赖氨酸的实施方式以及赖氨酸是c末端残基的实施方式。在某些实施方式中,组合物包含多种本公开的抗体和/或抗原结合片段,其中一种或多种抗体或抗原结合片段不包括重链、ch1-ch3或fc多肽的c末端处的赖氨酸残基,并且其中一种或多种抗体或抗原结合片段包括重链、ch1-ch3或fc多肽的c末端处的赖氨酸残基。换句话说,在某些实施方式中,重链可以包括如seq id no:767所示的氨基酸序列或由其组成,而没有c末端赖氨酸。在某些实施方式中,重链或ch1-ch3可以包括如seq id no:6或seq id no:7所示的氨基酸序列或由其组成,而没有c末端赖氨酸。
[0209]“fab”(片段抗原结合)是抗体与抗原结合的部分并且包括通过链间二硫键与轻链连接的重链的可变区和ch1。每个fab片段关于抗原结合是单价的,即,其具有单个抗原结合位点。抗体的胃蛋白酶处理产生单个大f(ab')2片段,其大致对应于具有二价抗原结合活性的两个二硫键连接的fab片段并且仍然能够交联抗原。fab和f(ab')2均为“抗原结合片段”的实例。fab'片段与fab片段的不同之处在于在ch1结构域的羧基末端具有另外的少量残基,包括来自抗体铰链区的一个或多个半胱氨酸。fab'-sh在本文中是对其中恒定结构域的半胱氨酸残基带有游离硫醇基团的fab'的名称。f(ab')2抗体片段最初是作为其间具有铰链半胱氨酸的fab'片段对产生的。抗体片段的其它化学偶联也是已知的。
[0210]
fab片段可以例如通过肽接头连接以形成单链fab,在本文中也称为“scfab”。在这
些实施方式中,天然fab中存在的链间二硫键可能不存在,并且接头完全或部分用于在单个多肽链中连接(link/connect)fab片段。重链衍生的fab片段(例如包括vh+ch1或“fd”、由其组成或基本上由其组成)和轻链衍生的fab片段(例如包括vl+cl、由其组成或基本上由其组成)可以以任何排列连接以形成scfab。例如,可以根据(重链fab片段-接头-轻链fab片段)或(轻链fab片段-接头-重链fab片段)以n末端到c末端的方向排列scfab。本文中进一步详细论述用于scfab的肽接头和示例性接头序列。
[0211]“fv”是包括完整抗原识别和抗原结合位点的小抗体片段。这一片段通常由紧密地非共价缔合的一个重链和一个轻链可变区结构域的二聚体组成。然而,即使单个可变结构域(或包括仅三个对抗原具有特异性的cdr的fv的一半)也具有识别并结合抗原的能力,但典型地亲和力低于完整结合位点。
[0212]“单链fv”也缩写为“sfv”或“scfv”,是包括连接成单个多肽链的vh抗体结构域和v
l
抗体结构域的抗体片段。在一些实施方式中,scfv多肽包括安置于vh与v
l
结构域之间并且连接所述结构域的多肽接头,所述多肽接头使scfv能够保留或形成抗原结合的期望结构。此类肽接头可以使用本领域众所周知的标准技术并入到融合多肽中。关于scfv的综述,参见《单克隆抗体药理学(the pharmacology of monoclonal antibodies)》中的pluckthun,第113卷,rosenburg和moore编辑,纽约的斯普林格出版社(springer-verlag,new york),第269-315页(1994);borrebaeck 1995,参见下文。在某些实施方式中,抗体或抗原结合片段包括scfv,其包括vh结构域、vl结构域和将vh结构域与vl结构域连接的接头。在特定实施方式中,scfv包括通过肽接头与vl结构域连接的vh结构域,所述vh结构域可以处于vh-接头-vl朝向或处于vl-接头-vh朝向。本公开的任何scfv可以被工程化,使得vl结构域的c末端通过短肽序列连接到vh结构域的n末端,反之亦然(即,(n)vl(c)-接头-(n)vh(c)或(n)vh(c)-接头-(n)vl(c))。可替代地,在一些实施方式中,接头可以连接到vh结构域、vl结构域或两者的n末端部分或末端。
[0213]
可以例如基于以下来选择肽接头序列:(1)其能够采用灵活的扩展构象;(2)其不能或缺乏采用可以与第一多肽和第二多肽上和/或靶分子上的功能性表位相互作用的次级结构的能力;和/或(3)缺乏或相对缺乏可能与多肽和/或靶分子反应的疏水残基或带电残基。关于接头设计(例如,长度)的其它考虑因素可以包括vh和vl可以形成功能性抗原结合位点的构象或构象范围。在某些实施方式中,肽接头序列包括例如gly、asn和ser残基。其它近中性氨基酸,如thr和ala,也可以包括在接头序列中。可以有效地用作接头的其它氨基酸序列包括以下中公开的那些氨基酸序列:maratea等人,《基因(gene)》40:39 46,1985;murphy等人,《美国国家科学院院刊(proc.natl.acad.sci.usa)》83:8258 8262(1986);美国专利第4,935,233号和美国专利第4,751,180号。接头的其它说明性和非限制性实例可以包括例如glu-gly-lys-ser-ser-gly-ser-gly-ser-glu-ser-lys-val-asp(seq id no:19)(chaudhary等人,《美国国家科学院院刊》87:1066-1070(1990))和lys-glu-ser-gly-ser-val-ser-ser-glu-gln-leu-ala-gln-phe-arg-ser-leu-asp(seq id no:20)(bird等人,《科学》242:423-426(1988))以及当存在于单次迭代或重复1至5次或更多次时,五聚体gly-gly-gly-gly-ser(seq id no:21);参见例如seq id no:17。可以使用任何合适的接头,并且通常长度可以为约3个、4个、5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18个、19个、20个、21个、22个、15个、23个、24个、25个、26个、27个、28个、29个、30
个、40个、50个、60个、70个、80个、90个、100个氨基酸,或者长度少于约200个氨基酸,并且将优选地包括柔性结构(可以为由接头连接的两个区、结构域、基序、片段或模块之间的构象移动提供柔性和空间),并且将优选地在人中是生物惰性的和/或具有低免疫原性风险。示例性接头包括包含在如seq id no:10-21中的任一者或多者中所示的氨基酸序列或由其组成的那些接头。在某些实施方式中,接头包括与在如seq id no:10-21中的任一者中所示的氨基酸序列具有至少75%(即,至少约75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更多)同一性的氨基酸序列或由其组成。
[0214]
可以使用本文所公开的vh和vl序列的任何组合或者cdrh1、cdrh2、cdrh3、cdrl1、cdrl2和cdrl3序列的任何组合来构建scfv。
[0215]
在一些实施方式中,例如当第一多肽和第二多肽具有可以用于将功能性结构域分开并防止空间干扰的非必需n末端氨基酸区时,不需要接头序列。
[0216]
在某些实施方式中,本公开的抗体或抗原结合片段为单特异性的(例如,与单一表位结合)或多特异性的(例如,与多个表位和/或靶分子结合)。抗体和抗原结合片段可以以各种形式构建。在spiess等人,《分子免疫学(mol.immunol.)》67(2):95(2015)以及brinkmann和kontermann,mab 9(2):182-212(2017)中公开了示例性抗体形式,所述形式和其制备方法通过引用并入本文并且包括例如双特异性t细胞衔接子(bite)、dart、杵臼(knobs-into-holes,kih)组装体、scfv-ch3-kih组装体、kih普通轻链抗体、tandab、三链抗体(triple body)、tribi微抗体、fab-scfv、scfv-ch-cl-scfv、f(ab')2-scfv2、四价hcab、胞内抗体、crossmab、双重作用fab(daf)(二合一或四合一)、dutamab、dt-igg、电荷对(charge pair)、fab臂交换(fab-arm exchange)、seed体、triomab、luz-y组装体、fcab、κλ体、正交fab、dvd-ig(例如,美国专利第8,258,268号,所述形式以全文引用的方式并入本文)、igg(h)-scfv、scfv-(h)igg、igg(l)-scfv、scfv-(l)igg、igg(l,h)-fv、igg(h)-v、v(h)-igg、igg(l)-v、v(l)-igg、kih igg-scfab、2scfv-igg、igg-2scfv、scfv4-ig、zybody和dvi-igg(四合一)、以及所谓的fit-ig(例如,pct公开第wo 2015/103072号,所述形式以全文引用的方式并入本文)、所谓的wuxibody形式(例如,pct公开第wo 2019/057122号,所述形式以全文引用的方式并入本文)以及所谓的弯管内插入ig形式(in-elbow-insert ig format,iei-ig;pct公开第wo 2019/024979号和第wo 2019/025391号,所述形式以全文引用的方式并入本文)。
[0217]
在某些实施方式中,抗体或抗原结合片段包括两个或多个vh结构域、两个或多个vl结构域或两者(即,两个或多个vh结构域和两个或多个vl结构域)。在特定实施方式中,抗原结合片段包括形式(n末端到c末端方向)vh-接头-vl-接头-vh-接头-vl,其中两个vh序列可以相同或不同并且两个vl序列可以相同或不同。此类连接的scfv可以包括被布置成与给定靶标结合的vh和vl结构域的任何组合,并且在包括两个或多个vh和/或两个或多个vl的形式中,一种、两种或多种不同表位或抗原可以结合。应当理解,并入多个抗原结合结构域的形式可以包括呈任何组合或朝向的vh和/或vl序列。例如,抗原结合片段可以包括形式vl-接头-vh-接头-vl-接头-vh、vh-接头-vl-接头-vl-接头-vh或vl-接头-vh-接头-vh-接头-vl。
[0218]
所构建的本公开的单特异性或多特异性抗体或抗原结合片段包括本文公开的vh和vl序列的任何组合和/或cdrh1、cdrh2、cdrh3、cdrl1、cdrl2和cdrl3序列的任何组合。在
一些实施方式中,双特异性或多特异性抗体或抗原结合片段可以包括本公开的一个、两个或多个抗原结合结构域(例如,vh和vl)。可能存在与相同或不同sars-cov-2表位结合的两个或多个结合结构域,并且在一些实施方式中,如本文所提供的双特异性或多特异性抗体或抗原结合片段包括另外的sars-cov-2结合结构域和/或可以包括完全与不同抗原或病原体结合的结合结构域。
[0219]
在当前公开的实施方式中的任何实施方式中,所述抗体或抗原结合片段可以是多特异性的;例如,双特异性的、三特异性的等。
[0220]
在某些实施方式中,所述抗体或抗原结合片段包括:(i)第一vh和第一vl;以及(ii)第二vh和第二vl,其中所述第一vh和所述第二vh是不同的并且各自独立地包括与在如seq id no:22、32、42、52、62、72、74、84、96、106、119、129、139、150、163、173、175、178、186、189、191、198、208、218、228、240、298、312、322、332、350、351、353、359、361、363、365、367、368、369、379、389、399、409、419、429、434、444、454、464、474、484、494、504、514、524、534、544、554、564、574、584、594、604、614、624、626、628、630、634、636、638、640、642、644、646、648、650、652、654、656、658、660、662、664、666、668、670、672、674、676、678、680、682、684、692、740、741、742、743、748、749、750、752、754、756、758、759、761、762和764中的任一者中所示的氨基酸序列具有至少85%(例如,具有85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)同一性的氨基酸序列,并且其中所述第一vl和所述第二vl是不同的并且各自独立地包括与在如seq id no:26、36、46、56、66、78、88、94、100、110、123、133、143、154、157、168、194、196、202、212、222、232、238、244、250、252、258、268、278、288、294、296、302、308、310、316、326、336、355、357、373、383、393、403、413、423、438、448、458、468、478、488、498、508、518、528、538、548、558、568、578、588、598、608、618、686、696、738、744和746中的任一者中所示的氨基酸序列具有至少85%(例如,具有85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)同一性的氨基酸序列,并且其中所述第一vh和所述第一vl一起形成第一抗原结合位点,并且其中所述第二vh和所述第二vl一起形成第二抗原结合位点。
[0221]
在某些实施方式中,抗体和抗原结合片段包括:(i)第一vh和第一vl;以及(ii)第二vh和第二vl,其中所述第一vh包括与在如seq id no:139和342中的任一者中所示的氨基酸序列具有至少85%(例如,具有85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)同一性的氨基酸序列,并且所述第一vl包括与在如seq id no:143和346中的任一者中所示的氨基酸序列具有至少85%(例如,具有85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)同一性的氨基酸序列,并且其中所述第二vh包括与在如seq id no:399、748、749、750、752、754、756、758、759和761中的任一者中所示的氨基酸序列具有至少85%(例如,具有85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)同一性的氨基酸序列,并且所述第二vl包括与在如seq id no:403、744和746中的任一者中所示的氨基酸序列具有至少85%(例如,具有85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)同一性的氨基酸序列。
[0222]
在某些实施方式中,抗体或抗原结合片段包括fc多肽或其片段。“fc”片段或fc多肽包括通常通过二硫键保持在一起的两条抗体h链的羧基末端部分(即,igg的ch2结构域和
ch3结构域)。抗体“效应子功能”是指可归因于抗体fc区(天然序列fc区或氨基酸序列变体fc区)的生物活性,并随抗体同种型而变化。抗体效应子功能的实施例包括:c1q结合和补体依赖性细胞毒性;fc受体结合;抗体依赖性细胞介导的细胞毒性(adcc);吞噬作用;细胞表面受体(例如,b细胞受体)的下调;以及b细胞激活。如本文所讨论的,可以对fc结构域进行修饰(例如,氨基酸取代)以便修饰(例如,改良、减少或消除)含fc的多肽(例如,本公开的抗体)的一种或多种功能。此类功能包括例如fc受体(fcr)结合、抗体半衰期调节(例如,通过与fcrn结合)、adcc功能、蛋白a结合、蛋白g结合和补体结合。修饰(例如,改良、减少或消除)fc功能的氨基酸修饰包括例如t250q/m428l、m252y/s254t/t256e、h433k/n434f、m428l/n434s、e233p/l234v/l235a/g236+a327g/a330s/p331s、e333a、s239d/a330l/i332e、p257i/q311、k326w/e333s、s239d/i332e/g236a、n297q、k322a、s228p、l235e+e318a/k320a/k322a、l234a/l235a(在本文中也被称为“lala”)和l234a/l235a/p329g突变,这些突变在invivogen公司(2011)出版的《工程化fc区(engineered fc regions)》中进行了总结和注释并且可以在invivogen.com/pdf/review/review-engineered-fc-regions-invivogen.pdf?utm_source=review&utm_medium=pdf&utm_
[0223]
campaign=review&utm_content=engineered-fc-regions在线获取,并通过引用并入本文。
[0224]
例如,为了活化补体级联,当免疫球蛋白分子与抗原靶标连接时,c1q蛋白复合物可以与至少两个igg1分子或一个igm分子结合(ward,e.s.和ghetie,v.,《免疫学疗法(ther.immunol.)》2(1995)77-94)。burton,d.r.(《分子免疫学》22(1985)161-206)描述了包括氨基酸残基318到337的重链区参与补体固定。duncan,a.r.和winter,g.(《自然(nature)》332(1988)738-740)使用定点诱变报道了glu318、lys320和lys322形成与c1q的结合位点。glu318、lys320和lys 322残基在c1q结合中的作用通过包括这些残基的短合成肽抑制补体介导的裂解的能力得到证实。
[0225]
例如,fcr结合可以通过(抗体的)fc部分与fc受体(fcr)的相互作用介导,fcr是包括造血细胞的细胞上的特化细胞表面受体。fc受体属于免疫球蛋白超家族,并且示出介导通过免疫复合物的吞噬作用清除抗体涂覆的病原体以及通过抗体依赖性细胞介导的细胞毒性(adcc;van de winkel,j.g.和anderson,c.l.,《白细胞生物学杂志(j.leukoc.biol.)》49(1991)511-524)裂解涂覆有对应抗体的红细胞和各种其它细胞靶标(例如,肿瘤细胞)两者。fcr由其对免疫球蛋白类别的特异性定义;igg抗体的fc受体被称为fcγr,ige抗体的fc受体被称为fcεr,iga抗体的fc受体被称为fcαr等,并且新生儿fc受体被称为fcrn。例如ravetch,j.v.和kinet,j.p.《免疫学年度评论(annu.rev.immunol.)》9(1991)457-492;capel,p.j.等人,《免疫方法(immunomethods)》4(1994)25-34;de haas,m.等人,《实验室临床医学杂志(j lab.clin.med.)》126(1995)330-341;以及gessner,j.e.等人,《血液学年鉴(ann.hematol.)》76(1998)231-248中描述了fc受体结合。
[0226]
天然igg抗体(fcγr)的fc结构域与受体的交联触发了多种效应子功能,包括吞噬作用、抗体依赖性细胞毒性和炎性介体释放,以及免疫复合物清除和抗体产生调节。本文考虑了提供受体(例如,fcγr)交联的fc部分。在人类中,迄今为止已对以下三类fcγr进行表征:(i)fcγri(cd64),其以高亲和力结合单体igg,并在巨噬细胞、单核细胞、中性粒细胞和嗜酸性粒细胞上表达;(ii)fcγrii(cd32),其以中到低亲和力结合复合igg,广泛表达(具
体地在白细胞上),被认为是抗体介导免疫的核心参与者,并且可以分为fcγriia、fcγriib和fcγriic,在免疫系统中发挥不同的功能,但以相似的低亲和力与igg-fc结合,并且这些受体的胞外结构域高度同源;以及(iii)fcγriii(cd16),其以中到低亲和力结合igg,并且已发现其有两种形式:fcγriiia,其已在nk细胞、巨噬细胞、嗜酸性粒细胞以及一些单核细胞和t细胞上发现,并且被认为可介导adcc;以及在中性粒细胞上高度表达的fcγriiib。
[0227]
fcγriia在许多参与杀伤的细胞(例如巨噬细胞、单核细胞、中性粒细胞)上发现并且似乎能够激活杀伤过程。fcγriib似乎在抑制过程中发挥作用并在b细胞、巨噬细胞以及肥大细胞和嗜酸性粒细胞上发现。重要的是,已经表明所有fcγriib的75%在肝脏中发现(ganesan,l.p.等人,2012:“肝窦内皮上的fcγriib清除小免疫复合物(fcγriib on liver sinusoidal endothelium clears small immune complexes)”,《免疫学杂志》189:4981
–
4988)。fcγriib在肝窦内皮(称为lsec)上和肝脏中的kupffer细胞中大量表达,并且lsec是清除小免疫复合物的主要部位(ganesan,l.p.等人,2012:肝窦内皮上的fcγriib清除小免疫复合物,《免疫学杂志》189:4981-4988)。
[0228]
在一些实施方式中,本文所公开的抗体和其抗原结合片段包括用于与fcγriib,特别是fc区,例如igg型抗体结合的fc多肽或其片段。此外,可以通过引入突变s267e和l328f来工程化fc部分以增强fcγriib结合,如chu,s.y.等人,2008:通过cd19和fcγriib与fc工程化抗体的共结合抑制b细胞受体介导的原代人b细胞活化。(inhibition of b cell receptor-mediated activation of primary human b cells by coengagement of cd19 and fcgammariib with fc-engineered antibodies.)《分子免疫学》45,3926
–
3933所描述的。因此,可以增强免疫复合物的清除(chu,s.等人,2014:黑猩猩中ige的加速清除由xmab7195(即一种fc工程化抗体)介导,对抑制性受体fcγriib具有增强的亲和力(accelerated clearance of ige in chimpanzees is mediated by xmab7195,an fc-engineered antibody with enhanced affinity for inhibitory receptor fcγriib)《美国呼吸道与危重症监护医学杂志(am j respir crit)》,美国胸科学会国际会议摘要)。在一些实施方式中,本公开的抗体或其抗原结合片段包括具有突变s267e和l328f的工程化fc部分,具体地如chu,s.y.等人,2008:通过cd19和fcγriib与fc工程化的抗体的共连接抑制原代人b细胞的b细胞受体介导的活化,《分子免疫学》45,3926-3933所述。
[0229]
在b细胞上,fcγriib可能起到抑制免疫球蛋白进一步产生和同种型转换为例如ige类的作用。在巨噬细胞上,fcγriib被认为抑制通过fcγriia介导的吞噬作用。在嗜酸性粒细胞和肥大细胞上,b形式可以通过ige与其独立的受体结合帮助抑止这些细胞的激活。
[0230]
关于fcγri结合,e233-g236、p238、d265、n297、a327和p329中的至少一种的天然igg中的修饰降低了与fcγri的结合。被取代为对应位置igg1和igg4的位置233-236处的igg2残基将igg1和igg4与fcγri的结合降低103倍,并消除了人单核细胞对抗体致敏红细胞的反应(armour,k.l.等人,《欧洲免疫学杂志(eur.j.immunol.)》,29(1999)2613-2624)。
[0231]
关于fcγrii结合,发现对fcγriia的结合降低,例如,对于e233-g236、p238、d265、n297、a327、p329、d270、q295、a327、r292和k414中的至少一种的igg突变。
[0232]
人fcγriia的两种等位基因形式是以高亲和力与igg1 fc结合的“h131”变体以及
以低亲和力与igg1 fc结合的“r131”变体。参见例如bruhns等人,《血液(blood)》113:3716-3725(2009)。
[0233]
关于fcγriii结合,发现与fcγriiia的结合降低,例如,对于e233-g236、p238、d265、n297、a327、p329、d270、q295、a327、s239、e269、e293、y296、v303、a327、k338和d376中的至少一种的突变。在shields,r.l.等人,《生物化学杂志(j.biol.chem.)》276(2001)6591-6604中描述了人igg1上fc受体的结合位点的作图、上述突变位点以及用于测量与fcγri和fcγriia结合的方法。
[0234]
人fcγriiia的两种等位基因形式是以低亲和力与igg1 fc结合的“f158”变体以及以高亲和力与igg1 fc结合的“v158”变体。参见例如bruhns等人,《血液》113:3716-3725(2009)。
[0235]
关于与fcγrii的结合,天然igg fc的两个区似乎参与了fcγrii与igg之间的相互作用,即(i)igg fc的下铰链位点,特别是氨基酸残基l,l,g,g(234
–
237,eu编号),和(ii)igg fc的ch2结构域的相邻区,特别是与下铰链区相邻的上ch2结构域中的环和链,例如在p331的区中(wines,b.d.等人,《免疫学杂志》2000;164:5313
–
5318)。此外,fcγri似乎与igg fc上的相同位点结合,而fcrn和蛋白a与igg fc上的不同位点结合,所述位点似乎位于ch2-ch3界面(wines,b.d.等人,《免疫学杂志》2000;164:5313
–
5318)。
[0236]
还考虑了增加本公开的fc多肽或其片段与(即,一种或多种)fcγ受体的结合亲和力的突变(例如,与参比fc多肽或其片段或包括不包括突变的参比fc多肽或其片段相比)。参见例如delillo和ravetch,《细胞》161(5):1035-1045(2015)和ahmed等人,《结构生物学杂志(j.struc.biol.)》194(1):78(2016),其fc突变和技术通过引用并入本文中。
[0237]
在本文公开的实施方式中的任何实施方式中,抗体或抗原结合片段可以包括fc多肽或其片段,所述fc多肽或其片段包括选自以下的突变:g236a;s239d;a330l和i332e;或包括其任意两种或多种的组合;例如s239d/i332e;s239d/a330l/i332e;g236a/s239d/i332e;g236a/a330l/i332e(本文也称为“gaalie”);或g236a/s239d/a330l/i332e。在一些实施方式中,所述fc多肽或其片段不包括s239d。
[0238]
在某些实施方式中,所述fc多肽或其片段可以包括参与结合fcrn结合的fc多肽或其片段的至少一部分或由其组成。在某些实施方式中,所述fc多肽或其片段包括一种或多种氨基酸修饰,其改良对fcrn的结合亲和力(例如,增强与fcrn的结合)(例如,在约6.0的ph下),并且在一些实施方式中,从而延长包括所述fc多肽或其片段的分子的体内半衰期(例如,与在其它方面相同但不包括修饰的参比fc多肽或其片段或抗体相比)。在某些实施方式中,所述fc多肽或其片段包括或衍生自igg fc,并且半衰期延长突变包括以下中的任何一者或多者:m428l;n434s;n434h;n434a;n434s;m252y;s254t;t256e;t250q;p257i;q311i;d376v;t307a;e380a(eu编号)。在某些实施方式中,半衰期延长突变包括m428l/n434s(在本文中也被称为“mlns”)。在某些实施方式中,半衰期延长突变包括m252y/s254t/t256e。在某些实施方式中,半衰期延长突变包括t250q/m428l。在某些实施方式中,半衰期延长突变包括p257i/q311i。在某些实施方式中,半衰期延长突变包括p257i/n434h。在某些实施方式中,半衰期延长突变包括d376v/n434h。在某些实施方式中,半衰期延长突变包括t307a/e380a/n434a。
[0239]
在一些实施方式中,抗体或抗原结合片段包括fc部分,所述fc部分包括取代突变
m428l/n434s。在一些实施方式中,抗体或抗原结合片段包括fc多肽或其片段,所述fc多肽或其片段包括取代突变g236a/a330l/i332e。在某些实施方式中,抗体或抗原结合片段包括(例如,igg)fc部分,所述fc部分包括g236a突变、a330l突变和i332e突变(gaalie),并且不包括s239d突变(例如在位置239处包括天然s)。在特定实施方式中,抗体或抗原结合片段包括fc多肽或其片段,所述fc多肽或其片段包括取代突变:m428l/n434s和g236a/a330l/i332e,并且任选地不包括s239d。在某些实施方式中,抗体或抗原结合片段包括fc多肽或其片段,所述fc多肽或其片段包括取代突变:m428l/n434s和g236a/s239d/a330l/i332e。
[0240]
在某些实施方式中,所述抗体或抗原结合片段包括改变糖基化的突变,其中改变糖基化的突变包括n297a、n297q或n297g,和/或所述抗体或抗原结合片段是部分或完全去糖基化和/或部分或完全去岩藻糖基化的。制备部分或完全去糖基化或部分或完全去岩藻糖基化的抗体和抗原结合片段的宿主细胞系和方法是已知的(参见例如pct公开第wo 2016/181357号;suzuki等人,《临床癌症研究(clin.cancer res.)》13(6):1875-82(2007);huang等人,mab 6:1-12(2018))。
[0241]
在某些实施方式中,所述抗体或抗原结合片段能够在受试者体内引发持续保护,即使是在受试者中无法发现可检测水平的抗体或抗原结合片段后(即,当所述抗体或抗原结合片段在施用之后已经从受试者中清除时)。此类保护在本文中被称为疫苗效应。在不希望受理论束缚的情况下,据信树突状细胞可以内化抗体与抗原的复合物并且其后诱导或促成针对抗原的内源免疫应答。在某些实施方式中,抗体或抗原结合片段包括一种或多种修饰,例如包括g236a、a330l和i332e的fc中的突变,所述突变能够激活可以诱导例如对抗原的t细胞免疫的树突状细胞。
[0242]
在当前公开的实施方式中的任何实施方式中,所述抗体或抗原结合片段包括fc多肽或其片段,包括ch2(或其片段)、ch3(或其片段)或ch2和ch3,其中ch2、ch3或两者可以是任何同种型并且与对应的野生型ch2或ch3相比可以分别包括氨基酸取代或其它修饰。在某些实施方式中,本公开的fc多肽包括缔合以形成二聚体的两个ch2-ch3多肽。
[0243]
在当前公开的实施方式中的任何实施方式中,所述抗体或抗原结合片段可以是单克隆的。如本文所使用的,术语“单克隆抗体(mab)”是指从基本上均质抗体群体中获得的抗体,即包括所述群体的单独抗体除了可以在一些情况下少量存在的可能天然存在的突变之外是相同的。单克隆抗体是高度特异性的,针对单个抗原位点。此外,相较于包括针对不同表位的不同抗体的多克隆抗体制剂,每个单克隆抗体针对抗原的单个表位。除特异性外,单克隆抗体的有利之处还在于,可以合成这些抗体,而不受其它抗体污染。术语“单克隆(monoclonal)”不应被解释为需要通过任何特定方法产生抗体。例如,适用于本发明的单克隆抗体可以通过kohler等人,《自然》256:495(1975)首次描述的杂交瘤方法制备,或者可以使用重组dna方法在细菌、真核动物或植物细胞中制备(参见例如美国专利第4,816,567号)。例如,单克隆抗体也可以使用clackson等人,《自然》352:624-628(1991)和marks等人,《分子生物学杂志》222:581-597(1991)中描述的技术从噬菌体抗体库中分离。还可以使用pct公开第wo 2004/076677a2号中公开的方法获得单克隆抗体。
[0244]
本公开的抗体和抗原结合片段包括“嵌合抗体”,其中重链和/或轻链的一部分与衍生自特定物种或属于特定抗体类或亚类的抗体中的对应序列相同或同源,而链的其余部分与衍生自另一物种或属于另一抗体类或亚类的抗体连同此类抗体的片段中的对应序列
相同或同源,只要它们表现出预期的生物活性即可(参见美国专利第4,816,567号;第5,530,101号和第7,498,415号;以及morrison等人,《美国国家科学院院刊》81:6851-6855(1984))。例如,嵌合抗体可以包括人和非人残基。此外,嵌合抗体可以包括在受体抗体或供体抗体中未发现的残基。进行这些修饰以进一步优化抗体性能。关于另外的细节,参见jones等人,《自然》321:522-525(1986);reichmann等人,《自然》332:323-329(1988);以及presta,《当代结构生物学评论(curr.op.struct.biol.)》,2:593-596(1992)。嵌合抗体还包括灵长类化和人源化抗体。
[0245]“人源化抗体”一般被视为具有从非人源引入其中的一个或多个氨基酸残基的人抗体。这些非人氨基酸残基典型地取自可变结构域。人源化可以按照winter和合作者的方法(jones等人,《自然》,321:522-525(1986);reichmann等人,《自然》,332:323-327(1988);verhoeyen等人,《科学》,239:1534-1536(1988))通过用非人可变序列取代人抗体的对应序列来进行。因此,此类人源化抗体是嵌合抗体(美国专利第4,816,567号;第5,530,101号;以及第7,498,415号),其中已由来自非人物种的对应序列取代基本上少于完整的人可变结构域。在一些情况下,“人源化”抗体是由非人细胞或动物产生并且包括人序列(例如,hc结构域)的抗体。
[0246]“人抗体”是仅包括存在于由人产生的抗体中的序列的抗体。然而,如本文所使用的,人抗体可以包括在天然存在的人抗体(例如,从人分离的抗体)中未发现的残基或修饰,包括本文所描述的那些修饰和变体序列。典型地进行这些以进一步优化或增强抗体性能。在一些情况下,人抗体由转基因动物产生。例如参见美国专利第5,770,429号;第6,596,541号;以及第7,049,426号。
[0247]
在某些实施方式中,本公开的抗体或抗原结合片段是嵌合、人源化或人的。
[0248]
在一些实施方式中,本公开的抗体或抗原结合片段能够以小于500ng/ml、小于250ng/ml、小于100ng/ml、小于90ng/ml、小于80ng/ml、小于70ng/ml、小于60ng/ml、小于50ng/ml、小于40ng/ml、小于30ng/ml、小于25ng/ml、小于20ng/ml、小于16ng/ml、小于15ng/ml、小于14ng/ml、小于13ng/ml、小于12ng/ml、小于10ng/ml、小于9ng/ml、小于8ng/ml、小于7ng/ml、小于6ng/ml、小于5ng/ml、小于4ng/ml或小于2mg/ml的ec50与sars-cov-2表面糖蛋白结合,如通过elisa(任选地,间接elisa和/或夹心elisa)测量的和/或通过流式细胞术测量的,其中所述sars cov-2表面糖蛋白在宿主细胞的细胞表面处表达。
[0249]
在一些实施方式中,本公开的抗体或抗原结合片段能够以小于500ng/ml、小于250ng/ml、小于100ng/ml、小于90ng/ml、小于80ng/ml、小于70ng/ml、小于60ng/ml、小于50ng/ml、小于40ng/ml、小于30ng/ml、小于25ng/ml、小于20ng/ml、小于16ng/ml、小于15ng/ml、小于14ng/ml、小于13ng/ml、小于12ng/ml、小于10ng/ml、小于9ng/ml、小于8ng/ml、小于7ng/ml、小于6ng/ml、小于5ng/ml、小于4ng/ml或小于2mg/ml的ec50与sars-cov-2表面糖蛋白rbd结合,如通过elisa(任选地,间接elisa和/或夹心elisa)测量的和/或通过流式细胞术测量的,其中所述sars cov-2表面糖蛋白在宿主细胞的细胞表面处表达。
[0250]
在一些实施方式中,本公开的抗体或抗原结合片段能够以小于5x 10-8
m、小于4x 10-8
m、小于3x 10-8
m、小于2x 10-8
m、小于1x 10-8
m、小于5x 10-9
m、小于1x 10-9
m、小于5x 10-10
m、小于1x 10-10
m、小于5x 10-11
m、小于1x 10-11
m、小于5x 10-12
m或小于1x 10-12
m的kd与sars-cov-2rbd结合,如使用生物层干涉法(bli)所确定的,任选地使用在蛋白a针上上样有
抗体或抗原结合片段的octet仪器,任选地以2.7μg/ml,和sars-cov-2rbd以6μg/ml、1.5μg/ml或0.4μg/ml上样5分钟,进一步任选地测量解离7分钟。
[0251]
在一些实施方式中,本公开的抗体或抗原结合片段能够以小于6x 10-8
m、小于5x 10-8
m、小于4x 10-8
m、小于3x 10-8
m、小于2x 10-8
m、小于1x 10-8
m、小于5x 10-9
m、小于4x 10-9
m、小于3x 10-9
m、小于2x 10-9
m、小于1x 10-9
m或小于8x 10-10
m的kd与sars-cov-2rbd结合,如使用表面等离子体共振(spr)所确定的,任选地使用利用单循环动力学方法的biacore t200仪器。
[0252]
在一些实施方式中,本公开的抗体或抗原结合片段能够与sars-cov-2rbd结合并抑制(i)所述rbd与(ii)人ace2和/或人siglec-1之间的相互作用。
[0253]
在一些实施方式中,本公开的抗体或抗原结合片段能够中和:(i)由sars-cov-2假病毒引起的感染,任选地:(i)(a)中和ic50小于100ng/ml、小于90ng/ml、小于80ng/ml、小于70ng/ml、小于60ng/ml、小于50ng/ml、小于40ng/ml、小于30ng/ml、小于25ng/ml、小于20ng/ml、小于15ng/ml、小于10ng/ml、小于9ng/ml、小于8ng/ml、小于7ng/ml、小于6ng/ml、小于5ng/ml、小于4ng/ml、小于3ng/ml、小于2ng/ml或小于1ng/ml,优选地小于10ng/ml、小于9ng/ml、小于8ng/ml、小于7ng/ml、小于6ng/ml、小于5ng/ml、小于4ng/ml、小于3ng/ml、小于2ng/ml或小于1ng/ml,和/或(i)(b)中和ic80小于100ng/ml、小于90ng/ml、小于80ng/ml、小于70ng/ml、小于60ng/ml、小于50ng/ml、小于40ng/ml、小于30ng/ml或小于25ng/ml,优选地小于50ng/ml、小于40ng/ml、小于30ng/ml或小于25ng/ml,和/或(i)(c)中和ec90小于300ng/ml、小于200ng/ml、小于100ng/ml、小于90ng/ml、小于80ng/ml、小于70ng/ml、小于60ng/ml、50ng/ml、小于40ng/ml、小于30ng/ml、小于25ng/ml、小于20ng/ml、小于15ng/ml或小于10ng/ml,其中进一步任选地,所述sars-cov-2假病毒包括vsv假病毒和/或mlv假病毒,和/或(i)(d)所述sars-cov-2假病毒包括vsv假病毒和/或mlv假病毒;和/或(ii)由活sars-cov-2引起的感染,任选地(ii)(a)ec50小于60ng/ml、小于50ng/ml、小于40ng/ml、小于30ng/ml、小于25ng/ml、小于20ng/ml、小于15ng/ml、小于12ng/ml、小于11ng/ml、小于10ng/ml、小于9ng/ml、小于8ng/ml、小于7ng/ml、小于6ng/ml、小于5ng/ml或小于4ng/ml,优选地小于15ng/ml、小于12ng/ml、小于11ng/ml、小于10ng/ml、小于9ng/ml、小于8ng/ml、小于7ng/ml、小于6ng/ml、小于5ng/ml或小于4ng/ml,和/或(ii)(b)ec90小于50ng/ml、小于40ng/ml、小于35ng/ml、小于30ng/ml、小于25ng/ml、小于20ng/ml、小于15ng/ml、小于12ng/ml、小于11ng/ml、小于10ng/ml、小于9ng/ml、小于8ng/ml、小于7ng/ml、小于6ng/ml、小于5ng/ml或小于4ng/ml,优选地小于30ng/ml、小于25ng/ml、小于20ng/ml、小于15ng/ml或小于12ng/ml,和/或(ii)(c)在6小时的时间段内,感染复数为0.1;和/或(iii)由宿主细胞(例如,hek293t细胞)中的活sars-cov-2引起的感染,所述宿主细胞表达dc-sign、l-sign、siglec或ace2,任选地被工程化以过表达dc-sign、l-sign、siglec或ace2;和/或(iv)由宿主细胞(例如,hek293t细胞)中的活sars-cov-2引起的感染,所述宿主细胞表达siglec-1或ace2,任选地被工程化以过表达siglec-1或ace2,其中中和感染包括完全中和感染。
[0254]
在一些实施方式中,本公开的抗体或抗原结合片段能够中和由sars-cov-2变体引起的感染,与包括seq id no:3的sars-cov-2表面糖蛋白相比,所述变体在所述表面糖蛋白中包括以下突变中的任一者:n501y;s477n;n439k;l452r;e484k;k417n;t478k;s494p;a520s;n501t;a522s;y453f;p384l。
[0255]
在一些实施方式中,本公开的抗体或抗原结合片段能够中和由所述sars-cov-2变体引起的感染,其效力比所述抗体或抗原结合片段中和由sars-cov-2引起的感染的效力低不到三倍,所述抗体或抗原结合片段包括如seq id no:3所示的表面糖蛋白氨基酸序列。
[0256]
在一些实施方式中,本公开的抗体或抗原结合片段能够激活fcγriia、fcγriiia或两者,其中,任选地:(i)所述fcγriia包括h131等位基因;和/或(ii)所述fcγriiia包括v158等位基因;和/或(iii)使用表达sars-cov-2s的靶细胞(如cho细胞)和表达nfat驱动报告基因的报告基因细胞(如荧光素酶)来确定激活。
[0257]
在一些实施方式中,本公开的抗体或抗原结合片段在非人灵长类动物中的体内半衰期介于20天与30天之间、或介于22天与28天之间、或介于23天与27天之间、或介于24天与26天之间或为约25天。
[0258]
在一些实施方式中,本公开的抗体或抗原结合片段能够以约20ng/ml至约30ng/ml的ic50中和sars-cov-2感染和/或中和靶细胞感染。
[0259]
在一些实施方式中,本公开的抗体或抗原结合片段能够以约10ng/ml至约20ng/ml的ic50中和sars-cov-2感染和/或中和靶细胞感染。
[0260]
在一些实施方式中,本公开的抗体或抗原结合片段能够以约5ng/ml至约10ng/ml的ic50中和sars-cov-2感染和/或中和靶细胞感染。
[0261]
在一些实施方式中,本公开的抗体或抗原结合片段能够以约1ng/ml至约5ng/ml的ic50中和sars-cov-2感染和/或中和靶细胞感染。
[0262]
在一些实施方式中,本公开的抗体或抗原结合片段能够中和由sars-cov-2引起的感染并且不与人ace2竞争与sars-cov-2s蛋白结合,其中任选地,所述中和包括在体外感染模型中中和感染。
[0263]
在一些实施方式中,提供了本公开的抗体或抗原结合片段,所述抗体或抗原结合片段与本公开的抗体或抗原结合片段竞争与sars-cov-2表面糖蛋白结合。
[0264]
多核苷酸、载体和宿主细胞
[0265]
另一方面,本公开提供编码当前公开的抗体中的任一者或其抗原结合片段或其一部分(例如,cdr、vh、vl、重链或轻链)的分离的多核苷酸。在某些实施方式中,多核苷酸为在宿主细胞中表达而进行了密码子优化。一旦已知或鉴定了编码序列,可以使用已知的技术和工具进行密码子优化,例如使用optimiumgene
tm
工具;还参见scholten等人,《临床免疫学(clin.immunol.)》119:135,2006)。密码子优化的序列包括部分密码子优化的序列(即,一个或多个密码子被优化用于在宿主细胞中表达)和完全密码子优化的序列。
[0266]
还应该理解的是,编码本公开的抗体和抗原结合片段的多核苷酸可以具有不同核苷酸序列,同时归因于例如遗传密码的简并、剪接等而仍编码相同抗体或抗原结合片段。
[0267]
在某些实施方式中,所述多核苷酸包括与根据以下中的任一者的多核苷酸序列具有至少50%(即50%、55%、60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)同一性的多核苷酸:seq id no:30、31、40、41、50、51、60、61、70、71、73、82、83、92、93、95、104、105、114、115、116、117、118、127、128、137、138、206、207、216、217、226、227、236、237、239、248、249、251、253、262、263、272、273、282、283、292、293、295、297、306、307、309、311、320、321、330、331、340、341、377、378、387、388、397、398、407、408、417、418、427、428、433、442、443、452、453、462、463、472、473、482、483、
492、493、502、503、512、513、552、523、532、533、542、543、552、553、562、563、572、573、582、583、592、593、602、603、612、613、622、623、690、691、700-737和739。
[0268]
在某些实施方式中,所述多核苷酸包括:(i)与如seq id no:407所示的核苷酸序列具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少97%或至少99%同一性或包括所述核苷酸序列或由其组成的多核苷酸;以及(ii)与如seq id no:408、737或739所示的核苷酸序列具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少97%或至少99%同一性或包括所述核苷酸序列或由其组成的多核苷酸。
[0269]
在当前公开的实施方式中的任何实施方式中,所述多核苷酸可以包括脱氧核糖核酸(dna)或核糖核酸(rna)。在一些实施方式中,所述rna包括信使rna(mrna)。
[0270]
还提供了载体,其中所述载体包括或包含如本文所公开的多核苷酸(例如,编码与sars-cov-2结合的抗体或抗原结合片段的多核苷酸)。载体可以包括本文所公开的载体中的任何一者或多者。在特定实施方式中,提供了包括编码抗体或抗原结合片段或其部分的dna质粒构建体的载体(例如,所谓的“dmab”;参见例如muthumani等人,《传染病杂志(j infect dis.)》214(3):369-378(2016);muthumani等人,《人类疫苗和免疫疗法(hum vaccin immunother)》9:2253-2262(2013));flingai等人,《科学报告(sci rep.)》5:12616(2015);以及elliott等人,《npj疫苗(npj vaccines)》18(2017),所述抗体编码dna构建体和相关的使用方法(包括其施用)通过引用并入本文)。在某些实施方式中,dna质粒构建体包括编码抗体或抗原结合片段的重链和轻链(或vh和vl)的单个开放阅读框,其中编码重链的序列和编码轻链的序列任选地由编码蛋白酶裂解位点的多核苷酸和/或编码自我裂解肽的多核苷酸分开。在一些实施方式中,所述抗体或抗原结合片段的取代组分由包括于单个质粒中的多核苷酸编码。在其它实施方式中,所述抗体或抗原结合片段的取代组分由包括在两个或多个质粒中的多核苷酸(例如,第一质粒包括编码重链vh或vh+ch的多核苷酸,并且第二质粒包括编码同源轻链、vl或vl+cl的多核苷酸)编码。在某些实施方式中,单个质粒包括编码来自本公开的两种或多种抗体或抗原结合片段的重链和/或轻链的多核苷酸。示例性表达载体是可从获得的pvax1。本公开的dna质粒可以通过例如电穿孔(例如,肌内电穿孔)或用适当调配物(例如,透明质酸酶)递送到受试者。
[0271]
另一方面,本公开还提供了一种宿主细胞,所述宿主细胞表达根据本公开的抗体或抗原结合片段;或包括或包含根据本公开的载体或多核苷酸。
[0272]
此类细胞的实例包括但不限于真核细胞(例如,酵母细胞)、动物细胞、昆虫细胞、植物细胞以及原核细胞(包括大肠杆菌(e.coli))。在一些实施方式中,细胞是哺乳动物细胞。在某些此类实施方式中,细胞是哺乳动物细胞系,如cho细胞(例如,dhfr-cho细胞(urlaub等人,《美国国家科学院院刊(pnas)》77:4216(1980))、人胚肾细胞(例如,hek293t细胞)、per.c6细胞、y0细胞、sp2/0细胞。ns0细胞、人肝细胞,例如hepa rg细胞、骨髓瘤细胞或杂交瘤细胞。哺乳动物宿主细胞系的其它实例包括:小鼠支持细胞(例如,tm4细胞);sv40(cos-7)转化的猴肾cv1系;小仓鼠肾细胞(bhk);非洲绿猴肾细胞(vero-76);猴肾细胞(cv1);人宫颈癌细胞(hela);人肺细胞(w138);人肝细胞(hep g2);犬肾细胞(mdck;水牛大鼠肝细胞(brl 3a);小鼠乳腺肿瘤(mmt 060562);tri细胞;mrc5细胞;以及fs4细胞。适用于抗体产生的哺乳动物宿主细胞系还包括在例如yazaki和wu,《分子生物学方法》,第248卷
(b.k.c.lo编辑,新泽西州托托瓦的胡玛纳出版社(humana press,totowa,n.j.),第255-268页(2003)中描述的哺乳动物宿主细胞系。
[0273]
在某些实施方式中,宿主细胞是原核细胞,如大肠杆菌。肽在如大肠杆菌等原核细胞中的表达是公认的(参见例如pluckthun,a.《生物/技术(bio/technology)》9:545-551(1991))。例如,抗体可以在细菌中产生,确切地说,当不需要糖基化和fc效应子功能时。对于抗体片段和多肽在细菌中的表达,参见例如美国专利第5,648,237号;第5,789,199号;以及第5,840,523号。
[0274]
在特定实施方式中,可以用根据本说明书的载体与表达载体转染细胞。术语“转染”是指将核酸分子,如dna或rna(例如mrna)分子引入细胞,如真核细胞中。在本说明书的上下文中,术语“转染”涵盖技术人员已知的用于将核酸分子引入到细胞(如真核细胞,包括哺乳动物细胞)中的任何方法。此类方法涵盖例如电穿孔、脂转染(例如,基于阳离子脂质和/或脂质体)、磷酸钙沉淀、基于纳米颗粒的转染、基于病毒的转染或基于阳离子聚合物(如deae-葡聚糖或聚乙烯亚胺等)的转染。在某些实施方式中,引入是非病毒的。
[0275]
此外,可以用根据本公开的载体稳定或瞬时转染本公开的宿主细胞,例如以表达根据本公开的抗体或其抗原结合片段。在此类实施方式中,可以用如本文所描述的载体稳定转染细胞。可替代地,可以用编码如本文所公开的抗体或抗原结合片段的根据本公开的载体瞬时转染细胞。在当前公开的实施方式中的任何实施方式中,多核苷酸对宿主细胞来说可以是异源的。
[0276]
因此,本公开还提供异源表达本公开的抗体或抗原结合片段的重组宿主细胞。例如,细胞可以是与完全或部分获得抗体的物种不同的物种(例如,表达人抗体或工程化人抗体的cho细胞)。在一些实施方式中,宿主细胞的细胞类型在自然界中不表达所述抗体或抗原结合片段。此外,宿主细胞可以对不存在于抗体或抗原结合片段的天然状态(或不存在于工程化或衍生抗体或抗原结合片段的亲本抗体的天然状态)的抗体或抗原结合片段赋予翻译后修饰(ptm;例如糖基化或岩藻糖基化)。此类ptm可以引起功能差异(例如,降低的免疫原性)。因此,由如本文所公开的宿主细胞产生的本公开的抗体或抗原结合片段可以包括一种或多种翻译后修饰,所述翻译后修饰不同于呈原生状态的抗体(或亲本抗体)(例如,由cho细胞产生的人抗体可以包括多种翻译后修饰,所述翻译后修饰不同于从人分离和/或由天然人b细胞或浆细胞产生的抗体)。
[0277]
可用于表达本公开的结合蛋白的昆虫细胞是所属领域已知的,并且包括例如草地贪夜蛾sf9细胞(spodoptera frugipera sf9 cell)、粉纹夜蛾bti-tn5b1-4细胞(trichoplusia ni bti-tn5b1-4 cell)和草地贪夜蛾sfswt01“mimic
tm”细胞(spodoptera frugipera sfswt01“mimic
tm”cell)。参见例如palmberger等人,《生物技术杂志(j.biotechnol.)》153(3-4):160-166(2011)。已经鉴定了许多杆状病毒株,其可以与昆虫细胞结合使用,特别是用于草地贪夜蛾细胞的转染。
[0278]
真核微生物(如丝状真菌或酵母)也是用于克隆或表达蛋白质编码载体的合适宿主,并且包括具有“人源化”糖基化路径的真菌和酵母菌株,从而产生具有部分或完全人糖基化型态的抗体。参见gerngross,《自然生物技术(nat.biotech.)》22:1409-1414(2004);li等人,《自然生物技术》24:210-215(2006)。
[0279]
植物细胞也可以用作表达本公开的结合蛋白的宿主。例如,plantibodies
tm
技术
(在例如美国专利第5,959,177号;第6,040,498号;第6,420,548号;第7,125,978号;以及第6,417,429号中描述)采用转基因植物来产生抗体。
[0280]
在某些实施方式中,宿主细胞包括哺乳动物细胞。在特定实施方式中,宿主细胞是cho细胞、hek293细胞、per.c6细胞、y0细胞、sp2/0细胞、ns0细胞、人肝细胞、骨髓瘤细胞或杂交瘤细胞。
[0281]
在相关方面,本公开提供用于产生抗体或抗原结合片段的方法,其中所述方法包括在足以产生抗体或抗原结合片段的条件下培养本公开的宿主细胞,并且持续足以产生抗体或抗原结合片段的时间。举例来说,适用于分离和纯化重组产生的抗体的方法可以包括从将重组抗体分泌到培养基中的合适宿主细胞/载体系统获得上清液,且随后使用市售过滤器浓缩培养基。在浓缩之后,可以将浓缩物施加到单个合适纯化基质或一系列合适基质,如亲和基质或离子交换树脂。可以采用一个或多个反相hplc步骤来进一步纯化重组多肽。当将免疫原从其天然环境中分离时,也可以采用这些纯化方法。用于大规模产生本文所描述的一种或多种分离/重组抗体的方法包括分批细胞培养,所述分批细胞培养被监测和控制以维持适当培养条件。可溶性抗体的纯化可以根据本文所描述和本领域中已知,并且符合国内外管理机构的法律和指南的方法进行。
[0282]
组合物
[0283]
本文还提供组合物,其单个或以任何组合包含当前公开的抗体、抗原结合片段、多核苷酸、载体或宿主细胞中的任何一者或多者,并且可以进一步包含药学上可接受的载体、赋形剂或稀释剂。本文中进一步详细地论述载体、赋形剂和稀释剂。
[0284]
在某些实施方式中,组合物包含两种或多种不同的根据本公开的抗体或抗原结合片段。在某些实施方式中,用于组合中的抗体或抗原结合片段各自独立地具有以下特性中的一种或多种:中和天然存在的sars-cov-2变体;不相互竞争与刺突蛋白结合;与不同刺突蛋白表位结合;对sars-cov-2具有减少的抗性形成;当在组合中时,具有减少的对sars-cov-2的抗性形成;有效中和活sars-cov-2病毒;当组合使用时,对活sars-cov-2病毒的中和表现出相加或协同作用;展示效应子功能;在相关的感染动物模型中具有保护性;能够以足够的数量进行大规模生产。
[0285]
在某些实施方式中,组合物包括两种或多种不同的抗体或抗原结合片段,所述抗体或抗原结合片段可以是两种或多种当前公开的抗体或抗原结合片段。在当前公开的实施方式中的任何实施方式中,抗体或其抗原结合片段可以包括在进一步包括抗体或抗原结合片段的组合物中,所述抗体或抗原结合片段包括:(i)分别如seq id no:343-345和347-349所示的cdrh1、cdrh2、cdrh3、cdrl1、cdrl2和cdrl3氨基酸序列;或(ii)分别如seq id no:140-142和144-146所示的cdrh1、cdrh2、cdrh3、cdrl1、cdrl2和cdrl3氨基酸序列;或(iii)分别如seq id no:342和346所示的vh和vl氨基酸序列;或(iv)分别如seq id no:139和143所示的vh和vl氨基酸序列。
[0286]
在某些实施方式中,组合物包括:第一抗体或抗原结合片段,所述第一抗体或抗原结合片段包括包含如seq id no:32所示的氨基酸序列或由其组成的vh和包含如seq id no:36所示的氨基酸序列或由其组成的vl;以及第二抗体或抗原结合片段,所述第二抗体或抗原结合片段包括包含如seq id no:139所示的氨基酸序列或由其组成的vh和包含如seq id no:143所示的氨基酸序列或由其组成的vl。在某些实施方式中,组合物包括:第一抗体
或抗原结合片段,所述第一抗体或抗原结合片段包括重链可变结构域(vh)和轻链可变结构域(vl),所述vh包括cdrh1、cdrh2和cdrh3,所述vl包括cdrl1、cdrl2和cdrl3,其中所述cdrh1、cdrh2、cdrh3分别包括seq id no:33-35所示的氨基酸序列或由其组成,并且所述cdrl1、cdrl2和cdrl3分别包括seq id no:37-39所示的氨基酸序列或由其组成;以及第二抗体或抗原结合片段,所述第二抗体或抗原结合片段包括重链可变结构域(vh)和轻链可变结构域(vl),所述vh包括cdrh1、cdrh2和cdrh3,所述vl包括cdrl1、cdrl2和cdrl3,其中所述cdrh1、cdrh2、cdrh3分别包括如seq id no:140-142所示的氨基酸序列或由其组成,并且所述cdrl1、cdrl2和cdrl3分别包括如seq id no:144-146所示的氨基酸序列或由其组成。
[0287]
在某些实施方式中,组合物包括:第一抗体或抗原结合片段,所述第一抗体或抗原结合片段包括包含如seq id no:139或342所示的氨基酸序列或由其组成的vh和包含如seq id no:143或346所示的氨基酸序列或由其组成的vl;以及第二抗体或抗原结合片段,所述第二抗体或抗原结合片段包括包含如seq id no:399、748、749、750、752、754、756、758、759或761所示的氨基酸序列或由其组成的vh和包含如seq id no:403、744或746所示的氨基酸序列或由其组成的vl。在某些实施方式中,组合物包括:第一抗体或抗原结合片段,所述第一抗体或抗原结合片段包括重链可变结构域(vh)和轻链可变结构域(vl),所述vh包括cdrh1、cdrh2和cdrh3,所述vl包括cdrl1、cdrl2和cdrl3,其中所述cdrh1、cdrh2、cdrh3分别包括如seq id no:140-142或343-345所示的氨基酸序列或由其组成,并且所述cdrl1、cdrl2和cdrl3分别包括如seq id no:144-146所示的氨基酸序列或由其组成;以及第二抗体或抗原结合片段,所述第二抗体或抗原结合片段包括重链可变结构域(vh)和轻链可变结构域(vl),所述vh包括cdrh1、cdrh2和cdrh3,所述vl包括cdrl1、cdrl2和cdrl3,其中所述cdrh1、cdrh2、cdrh3分别包括在如seq id no:400、401和751、753、755、757、760中的任一者中所示的氨基酸序列或由其组成,并且所述cdrl1、cdrl2和cdrl3分别包括在如seq id no:404、405和406、745和747中的任一者中所示的氨基酸序列或由其组成。
[0288]
本文还提供了组合物,其包括:(i)第一抗体或抗原结合片段,所述第一抗体或抗原结合片段能够与sars-cov-2表面糖蛋白结合并抑制sars-cov-2表面糖蛋白与选自ace2、dc-sign、l-sign和siglec-1的第一细胞表面受体之间的相互作用;以及(ii)第二抗体或抗原结合片段,所述第二抗体或抗原结合片段能够与sars-cov-2表面糖蛋白结合并抑制sars-cov-2表面糖蛋白与选自ace2、dc-sign、l-sign和siglec-1的第二细胞表面受体之间的相互作用,其中所述第一细胞表面受体和所述第二细胞表面受体是不同的。如本公开所教导的,感染中和可以通过组合抗体或抗原结合片段来实现或改善,所述抗体或抗原结合片段与sars-cov-2的结合抑制了sars-cov-2与两种或多种细胞表面受体之间的相互作用;例如附着受体和进入受体、两个进入受体、两个附着受体等。还提供了使用此类抗体组合来治疗或预防sars-cov-2感染的方法。
[0289]
在某些实施方式中,组合物包含包括第一质粒的第一载体和包括第二质粒的第二载体,其中第一质粒包括编码重链、vh或vh+ch的多核苷酸,并且第二质粒包括编码抗体或其抗原结合片段的同源轻链、vl或vl+cl的多核苷酸。在某些实施方式中,组合物包含与合适递送媒剂或载体偶联的多核苷酸(例如,mrna)。用于向人受试者施用的示例性媒剂或载体包括脂质或脂质衍生的递送媒剂,如脂质体、固体脂质纳米颗粒、油性悬浮液、亚微米脂质乳剂、脂质微泡、反脂质胶束、耳蜗脂质体、脂质微管、脂质微圆柱体、或脂质纳米颗粒
(lnp)或纳米级平台(参见例如li等人,《威利跨学科评论:纳米医学与纳米生物技术(wilery interdiscip rev.nanomed nanobiotechnol.)》11(2):e1530(2019))。用于设计适当的mrna和调配mrna-lnp并递送其的原理、试剂和技术描述于例如pardi等人(《控制释放杂志(j control release)》217345-351(2015));thess等人(《分子疗法》)23:1456-1464(2015));thran等人(《embo分子医学(embo mol med)》9(10):1434-1448(2017);kose等人(《科学免疫学(sci.immunol.)》4eaaw6647(2019);以及sabnis等人(《分子疗法》26:1509-1519(2018)),这些技术包括封端、密码子优化、核苷修饰、mrna纯化、将mrna并入稳定的脂质纳米颗粒中(例如,可电离的阳离子脂质/磷脂酰胆碱/胆固醇/peg-脂质;可电离的脂质:二硬脂酰pc:胆固醇:聚乙二醇脂质)和其皮下、肌内、皮内、静脉内、腹膜内和气管内施用,通过引用并入本文。
[0290]
方法和用途
[0291]
本文还提供了用于将本公开的抗体或抗原结合片段、核酸、载体、细胞或组合物用于诊断sars-cov-2感染(例如,在人类受试者中,或在从人类受试者获得的样品中)的方法。
[0292]
诊断(例如,体外、离体)的方法可以包括将抗体、抗体片段(例如,抗原结合片段)与样品接触。此类样品可以从受试者分离,例如从例如鼻道、窦腔、唾液腺、肺、肝、胰、肾、耳、眼、胎盘、消化道、心脏、卵巢、垂体、肾上腺、甲状腺、脑、皮肤或血液获取的分离组织样品。诊断方法还可以包括检测抗原/抗体复合物,尤其在将抗体或抗体片段与样品接触之后。这种检测步骤可以在工作台上进行,即不与人体或动物体有任何接触。检测方法的实例是本领域的技术人员众所周知并且包括例如elisa(酶联免疫吸附测定),包括直接、间接和夹心elisa。其它检测方法包括但不限于免疫组织化学(ihc)、流式细胞术(例如,facs)、蛋白质印迹、免疫细胞化学(icc)、酶联免疫斑点(elispot)和免疫沉淀(ip)。检测方法中使用的抗体和抗原结合片段可以例如被荧光地或以其它方式可检测地标记(例如,直接与荧光团缀合或包括荧光团-次级缀合物)。
[0293]
本文还提供了使用本公开的抗体或抗原结合片段或包括所述抗体或抗原结合片段的组合物治疗受试者的方法,其中受试者患有、被认为患有sars-cov-2感染或有患所述感染的风险。“治疗(treat)”、“治疗(treatment)”或“改善(ameliorate)”是指对受试者(例如,人或非人哺乳动物,如灵长类动物、马、猫、狗、山羊、小鼠或大鼠)的疾病、病症或病状的医学管理。通常,包括本公开的抗体或组合物的适当剂量或治疗方案以足以引发治疗或防治益处的量施用。治疗或预防(prophylactic/preventive)益处包括改善临床结果;减轻或缓解与疾病相关的症状;减少症状的发生;提高生活质量;更长的无病状态;减轻疾病的程度;稳定疾病状态;延缓或预防疾病进展;缓解;存活;延长存活率;或其任何组合。在某些实施方式中,治疗或防治/预防益处包括减少或预防为治疗sars-cov-2感染而住院(即,以统计显著方式)。在某些实施方式中,治疗或防治/预防益处包括缩短为治疗sars-cov-2感染而住院的持续时间(即,以统计显著方式)。在某些实施方式中,治疗或防治/预防益处包括减少或消除对呼吸干预,如插管和/或使用呼吸器装置的需要。在某些实施方式中,治疗或防治/预防益处包括逆转晚期疾病病理和/或降低死亡率。
[0294]
本公开的抗体、抗原结合片段、多核苷酸、载体、宿主细胞或组合物的“治疗有效量”或“有效量”是指足以产生治疗效果的组合物或分子的量,所述治疗效果包括:改善的临床结果;减轻或缓解与疾病相关的症状;减少症状的发生;提高生活质量;更长的无病状态;
减轻疾病的程度;稳定疾病状态;延缓疾病进展;缓解;存活;或以统计显著方式延长存活期。当提及独自施用的单独的活性成分时,治疗有效量是指所述成分或独自表达所述成分的细胞的效果。当提及组合时,治疗有效量是指活性成分或组合的辅助活性成分与表达产生治疗效果的活性成分的细胞的组合量,无论连续、依序还是同时施用。组合可以包括例如与sars-cov-2抗原特异性结合的两种不同的抗体,在某些实施方式中,所述抗原可以是相同或不同的sars-cov-2抗原,和/或可以包括相同或不同的表位。
[0295]
因此,在某些实施方式中,提供了用于治疗受试者中的sars-cov-2感染的方法,其中所述方法包括向受试者施用有效量的本文所公开的抗体、抗原结合片段、多核苷酸、载体、宿主细胞或组合物。
[0296]
通常,可以通过本公开治疗的受试者是人和其它灵长类动物受试者,如用于兽医学目的猴和猿。其它模式生物,如小鼠和大鼠也可以根据本公开治疗。在前述实施方式中的任何实施方式中,受试者可以是人受试者。受试者可以是男性或女性,并且可以处于任何合适的年龄,包括婴儿、少年、青少年、成人和老年受试者。
[0297]
许多指标被认为促成与sars cov-2感染相关的严重症状或死亡的高风险。这些包括但不限于年龄、职业、一般健康状况、预先存在的健康状况和生活习惯。在一些实施方式中,根据本公开治疗的受试者包括一种或多种风险因素。
[0298]
在某些实施方式中,根据本公开治疗的人受试者是婴儿、儿童、年轻成人、中年成人或老年人。在某些实施方式中,根据本公开治疗的人受试者小于1岁,或是1岁到5岁,或在5岁与125岁之间(例如5岁、10岁、15岁、20岁、25岁、30岁、35岁、40岁、45岁、50岁、55岁、60岁、65岁、70岁、75岁、80岁、85岁、90岁、95岁、100岁、105岁、110岁、115岁或125岁,包括其中或其间的任何和所有年龄)。在某些实施方式中,根据本公开治疗的人受试者是0-19岁、20-44岁、45-54岁、55-64岁、65-74岁、75-84岁或85岁或更年长。中年人和尤其老年人被认为处于特别风险下。在特定实施方式中,人受试者是45-54岁、55-64岁、65-74岁、75-84岁或85岁或更年长。在一些实施方式中,人受试者是生物学男性。在一些实施方式中,人受试者是生物学女性。
[0299]
在某些实施方式中,根据本公开治疗的人受试者是护理院或长期护理机构的居住者、是临终关怀工作者、是医疗保健提供者或医疗保健工作者、是第一响应者、是诊断患有或疑似患有sars-cov-2感染的受试者的家庭成员或其它密切接触者、超重或临床肥胖、吸烟或曾经吸烟、患有或曾患有慢性阻塞性肺病(copd)、哮喘(例如,患有中度至重度哮喘)、患有自身免疫疾病或病状(例如,糖尿病)和/或免疫系统受损或耗竭(例如,归因于aids/hiv感染、癌症如血癌、淋巴耗竭疗法如化疗、骨髓或器官移植或遗传免疫病状)、患有慢性肝病、患有心血管疾病、患有肺或心脏缺陷、工作或以其它方式长时间与其它人紧密接触,如在工厂、装运中心、医院机构中等。
[0300]
在某些实施方式中,根据本公开治疗的受试者已经接受针对sars-cov-2的疫苗并且疫苗确定为无效(即,至少部分或完全无效),例如通过受试者的疫苗后感染或症状,通过临床诊断或科学或监管共识。
[0301]
在某些实施方式中,治疗以暴露周围防治形式施用。在某些实施方式中,向可以处于门诊环境中的患有轻度至中度疾病的受试者施用治疗。在某些实施方式中,向患有中度至重度疾病,如需要住院的受试者施用治疗。
[0302]
因此,施用当前公开的组合物的典型途径包括但不限于口服、局部、经皮、吸入、肠胃外、舌下、口腔、直肠、阴道以及鼻内。如本文所施用的术语“肠胃外”包括皮下注射、静脉内注射、肌内注射、胸骨内注射或输注技术。在某些实施方式中,施用包括通过选自以下的途径施用:口服、静脉内、肠胃外、胃内、胸膜内、肺内、直肠内、皮内、腹膜内、瘤内、皮下、局部、经皮、脑池内、鞘内、鼻内和肌内。在特定实施方式中,方法包括向受试者口服施用抗体、抗原结合片段、多核苷酸、载体、宿主细胞或组合物。
[0303]
根据本发明的某些实施方式的药物组合物调配成允许其中所包括的活性成分在将组合物施用到患者时生物可用。将向受试者或患者施用的组合物可以采取一种或多种剂量单位形式,其中例如,片剂可以是单个剂量单位,并且气雾剂形式的本文所描述的抗体或抗原结合的容器可以保存多个剂量单位。制备此类剂型的实际方法对于本领域的技术人员来说是已知的或者是显而易见的;例如,参见《雷明顿:药学科学与实践(remington:the science and practice of pharmacy)》,第20版(费城医药科学学院(philadelphia college of pharmacy and science),2000)。在任何情况下,要施用的组合物将包括有效量的本公开的抗体或抗原结合片段、多核苷酸、载体、宿主细胞或组合物,以便根据本文中的教导治疗所关注的疾病或病状。
[0304]
组合物可以呈固体或液体形式。在一些实施方式中,载体是颗粒状的,使得组合物例如呈片剂或散剂形式。载体可以是液体,同时组合物是例如口服油、可注射液体或适用于例如吸入施用的气雾剂。当打算口服施用时,药物组合物优选为固体或液体形式,其中半固体、半液体、悬浮液和凝胶形式包括在本文视为固体或液体的形式中。
[0305]
作为用于口服施用的固体组合物,药物组合物可以调配成散剂、颗粒、压缩片剂、丸剂、胶囊、口嚼锭、粉片等。此类固体组合物将典型地包括一种或多种惰性稀释剂或可食用载体。另外,可能存在以下中的一项或多项:如羧甲基纤维素、乙基纤维素、微晶纤维素、黄蓍胶或明胶等粘合剂;如淀粉、乳糖或糊精等赋形剂;如海藻酸、海藻酸钠、primogel、玉米淀粉等崩解剂;如硬脂酸镁或sterotex等润滑剂;如胶体二氧化硅等助流剂;如蔗糖或糖精等甜味剂;如薄荷、水杨酸甲酯或橙味调味品等调味剂;以及着色剂。当组合物呈胶囊(例如明胶胶囊)形式时,除以上类型的物质以外,其可以包括如聚乙二醇或油等液体载体。
[0306]
组合物可以呈液体形式,例如,酏剂、糖浆、溶液、乳液或悬浮液。作为两个实例,液体可以口服或通过注射递送。当旨在用于口服施用时,除本发明化合物以外,优选组合物包括甜味剂、防腐剂、染料/着色剂以及香味增强剂中的一种或多种。在旨在通过注射施用的组合物中,可以包含表面活性剂、防腐剂、润湿剂、分散剂、悬浮剂、缓冲液、稳定剂和等渗剂中的一种或多种。
[0307]
液体药物组合物,无论其是溶液、悬浮液还是其它类似形式,都可以包含一种或多种以下佐剂:无菌稀释剂,如注射用水、盐水溶液,优选地生理盐水、林格氏溶液(ringer’ssolution)、等渗氯化钠;固定油,如可以用作溶剂或悬浮介质的合成单甘油酯或二甘油酯、聚乙二醇、甘油、丙二醇或其它溶剂;抗菌剂,如苯甲醇或对羟基苯甲酸甲酯;抗氧化剂,如抗坏血酸或亚硫酸氢钠;螯合剂,如乙二胺四乙酸;缓冲剂,如乙酸盐、柠檬酸盐、或磷酸盐;以及用于张度调节的药剂,如氯化钠或右旋糖。肠胃外制剂可以封装在由玻璃或塑料制成的安瓿、一次性注射器或多剂量小瓶中。生理盐水是优选佐剂。可注射药物组合物优选是无菌的。
[0308]
旨在用于肠胃外或口服施用的液体组合物应包括一定量的如本文所公开的抗体或抗原结合片段,从而将获得合适剂量。典型地,此量为组合物中抗体或抗原结合片段的至少0.01%。当旨在用于口服施用时,此量可以在组合物重量的0.1%到约70%之间变化。某些口服药物组合物包括约4%到约75%的抗体或抗原结合片段。在某些实施方式中,制备根据本发明的药物组合物和制剂,使得在稀释之前,肠胃外剂量单位包括0.01重量%到10重量%的抗体或抗原结合片段。
[0309]
组合物可以旨在用于局部施用,在这种情况下,载体可以适合地包括溶液、乳液、软膏或凝胶基质。例如,基质可以包括以下中的一种或多种:矿脂、羊毛脂、聚乙二醇、蜂蜡、矿物油、如水和醇等稀释剂、以及乳化剂和稳定剂。增稠剂可以存在于用于局部施用的组合物中。如果旨在用于经皮施用,则组合物可以包括经皮贴片或离子电渗疗法装置。药物组合物可以旨在以例如栓剂形式用于直肠施用,栓剂将在直肠中融化并且释放药物。用于经直肠施用的组合物可以包括油性基质作为适合的无刺激性赋形剂。此类基质包括但不限于羊毛脂、可可脂和聚乙二醇。
[0310]
组合物可以包含修改固体或液体剂量单位的物理形式的多种材料。例如,组合物可以包括围绕活性成分形成包衣壳的材料。形成包衣壳的材料通常是惰性的,并且可以选自例如糖、虫胶以及其它肠溶包衣剂。可替代地,活性成分可以包裹在明胶胶囊中。固体或液体形式的组合物可以包括与本公开的抗体或抗原结合片段结合并且由此帮助递送化合物的试剂。可以起这一作用的合适试剂包括单克隆或多克隆抗体、一种或多种蛋白质或脂质体。组合物可以基本上由可以气雾剂形式施用的剂量单位组成。术语气雾剂用于表示范围从胶体性质的系统到由加压包装组成的系统的各种系统。递送可以通过液化或压缩气体或通过分配活性成分的合适的泵系统进行。气雾剂可以单相、双相或三相系统递送,以便递送活性成分。气雾剂的递送包括必要的容器、活化剂、阀门、子容器等,其可共同形成试剂盒。本领域的普通技术人员无需过多的实验就可以确定优选的气溶胶。
[0311]
应当理解,本公开的组合物还涵盖如本文所描述的多核苷酸的载体分子(例如,脂质纳米颗粒、纳米级递送平台等)。
[0312]
药物组合物可以通过制药领域熟知的方法制备。例如,可以通过将包括如本文所描述的抗体、其抗原结合片段或抗体缀合物和任选地盐、缓冲液和/或稳定剂中的一者或多者的组合物与无菌蒸馏水组合从而形成溶液,来制备旨在通过注射施用的组合物。可以添加表面活性剂以促进形成均匀溶液或悬浮液。表面活性剂是与肽化合物非共价相互作用以便促进抗体或其抗原结合片段在水性递送系统中的溶解或均匀悬浮的化合物。
[0313]
通常,适当剂量和治疗方案提供足以提供治疗和/或防治益处(如本文所描述的,包括改良临床结果(例如,腹泻或相关脱水或发炎的频率降低、持续时间缩短或严重程度降低,或无疾病存活期和/或总存活期更长,或症状严重程度减轻)的量的组合物。对于防治用途,剂量应足以预防与疾病或病症相关的疾病、延迟其发病或减轻其严重程度。根据本文所描述的方法施用的组合物的防治益处可以通过进行临床前(包括体外和体内动物研究)和临床研究并且通过适当统计、生物和临床方法和技术分析从其中获得的数据来确定,所有这些都可由本领域的技术人员容易地实践。
[0314]
以有效量(例如,治疗冠状病毒感染)施用组合物,所述有效量将根据多种因素而变化,包括所用特定化合物的活性;化合物的代谢稳定性和作用时间;受试者的年龄、体重、
一般健康状况、性别和饮食;施用模式和时间;排泄率;药物组合;特定病症或病状的严重程度;以及经受疗法的受试者。在某些实施方式中,在施用根据本公开的调配物和方法的疗法后,与安慰剂治疗的或其它合适的对照受试者相比,测试受试者将表现出与所治疗的疾病或病症相关的一种或多种症状减少约10%至约99%。
[0315]
一般来说,抗体或抗原结合片段的治疗有效日剂量(对于70kg哺乳动物)为约0.001mg/kg(即,0.07mg)至约100mg/kg(即,7.0g);优选地,治疗有效剂量(对于70kg哺乳动物)为约0.01mg/kg(即,0.7mg)至约50mg/kg(即,3.5g);更优选地,治疗有效剂量(对于70kg哺乳动物)为约1mg/kg(即,70mg)至约25mg/kg(即,1.75g)。对于本公开的多核苷酸、载体、宿主细胞和相关组合物,治疗有效剂量可以不同于抗体或抗原结合片段。
[0316]
在某些实施方式中,方法包括向受试者施用2次、3次、4次、5次、6次、7次、8次、9次、10次或更多次抗体、抗原结合片段、多核苷酸、载体、宿主细胞或组合物。
[0317]
在某些实施方式中,方法包括多次向受试者施用抗体、抗原结合片段或组合物,其中第二或连续施用分别在第一或前一施用之后约6小时、约7小时、约8小时、约9小时、约10小时、约11小时、约12小时、约24小时、约48小时、约74小时、约96小时或更长时间进行。
[0318]
在某些实施方式中,方法包括在受试者受sars-cov-2感染之前施用抗体、抗原结合片段、多核苷酸、载体、宿主细胞或组合物至少一次。
[0319]
包括本公开的抗体、抗原结合片段、多核苷酸、载体、宿主细胞或组合物的组合物也可以在施用一种或多种其它治疗剂的同时、之前或之后施用。此类组合疗法可以包括施用包括本发明的化合物和一种或多种另外的活性剂的单个药物剂量调配物,以及施用包括呈自身独立剂量调配物的本公开的抗体或抗原结合片段和每种活性剂的组合物。例如,如本文所描述的抗体或其抗原结合片段和其它活性剂可以以单个口服剂量组合物形式(如片剂或胶囊)向患者一起施用,或每种药剂以独立口服剂量调配物形式施用。类似地,如本文所描述的抗体或抗原结合片段和其它活性剂可以以单个肠胃外剂量组合物(如在盐水溶液或其它生理学上可接受的溶液中)向受试者一起施用,或每种药剂以独立肠胃外剂量调配物形式施用。当使用独立剂量调配物时,包括抗体或抗原结合片段和一种或多种另外的活性剂的组合物可以基本上在同一时间(即,同时)施用或在交错时间分别(即,依序和以任何次序)施用;组合疗法应理解为包括所有这些方案。
[0320]
在某些实施方式中,提供了组合疗法,其包括一种或多种本公开的抗sars-cov-2抗体(或一种或多种核酸、宿主细胞、载体或组合物)和一种或多种抗炎剂和/或一种或多种抗病毒剂。在特定实施方式中,所述一种或多种抗炎剂包括皮质类固醇,例如地塞米松(dexamethasone)、泼尼松(prednisone)等。在一些实施方式中,所述一种或多种抗炎剂包括细胞因子拮抗剂,例如与il6(如司妥昔单抗(siltuximab))或il-6r(如托珠单抗(tocilizumab)),或il-1β、il-7、il-8、il-9、il-10、fgf、g-csf、gm-csf、ifn-γ、ip-10、mcp-1、mip-1a、mip1-b、pdgr、tnf-α或vegf结合的抗体。在一些实施方式中,使用抗炎剂,如鲁索替尼(ruxolitinib)和/或阿那白滞素(anakinra)。在一些实施方式中,所述一种或多种抗病毒剂包括核苷酸类似物或核苷酸类似物前药,例如瑞德西韦(remdesivir)、索非布韦(sofosbuvir)、阿昔洛韦(acyclovir)和齐多夫定(zidovudine)。在特定实施方式中,抗病毒剂包括洛匹那韦(lopinavir)、利托那韦(ritonavir)、法匹拉韦(favipiravir)或其任何组合。在一些实施方式中,组合疗法包括乐昂立单抗(leronlimab)。用于本公开的组合疗
法的抗炎剂包括非甾体抗炎药(nsaids)。应当理解,在此类组合疗法中,所述一种或多种抗体(或一种或多种核酸、宿主细胞、载体或组合物)和所述一种或多种抗炎剂和/或所述一种或多种抗病毒剂可以以任何次序和任何顺序施用,或者一起施用。
[0321]
在一些实施方式中,向先前已经接受一种或多种抗炎剂和/或一种或多种抗病毒剂的受试者施用抗体(或一种或多种核酸、宿主细胞、载体或组合物)。在一些实施方式中,向先前已经接受抗体(或一种或多种核酸、宿主细胞、载体或组合物)的受试者施用一种或多种抗炎剂和/或一种或多种抗病毒剂。
[0322]
在某些实施方式中,提供了组合疗法,其包括两种或多种抗sars-cov-2抗体,所述抗体中的一种或两种抗体可以是本公开的抗体。方法可以包括向已经接受第二抗体的受试者施用第一抗体,或者可以包括一起施用两种或多种抗体。例如,在特定实施方式中,提供了一种方法,其包括向受试者施用(a)第一抗体或抗原结合片段,当受试者已经接受第二抗体或抗原结合片段时;(b)第二抗体或抗原结合片段,当受试者已经接受所述第一抗体或抗原结合片段时;或(c)所述第一抗体或抗原结合片段和所述第二抗体或抗原结合片段。
[0323]
在一些实施方式中,任何当前公开的抗体可以用于治疗或预防sars-cov-2感染的方法中,其中所述方法进一步包括使用抗体或抗原结合片段,所述抗体或抗原结合片段包括:(i)分别如seq id no:343-345和347-349所示的cdrh1、cdrh2、cdrh3、cdrl1、cdrl2和cdrl3氨基酸序列;或(ii)分别如seq id no:140-142和144-146所示的cdrh1、cdrh2、cdrh3、cdrl1、cdrl2和cdrl3氨基酸序列;或(iii)分别如seq id no:342和346所示的vh和vl氨基酸序列;或(iv)分别如seq id no:139和143所示的vh和vl氨基酸序列。
[0324]
在相关方面,提供了当前公开的抗体、抗原结合片段、载体、宿主细胞和组合物的用途。
[0325]
在某些实施方式中,提供了抗体、抗原结合片段、多核苷酸、载体、宿主细胞或组合物,其用于治疗受试者的sars-cov-2感染的方法。
[0326]
在某些实施方式中,提供了抗体、抗原结合片段或组合物,其用于制造或制备用于治疗受试者的sars-cov-2感染的药物的方法。
[0327]
本公开还提供以下实施方式:
[0328]
实施方式1.一种抗体或其抗原结合片段,其包括重链可变结构域(vh)和轻链可变结构域(vl),所述vh包括cdrh1、cdrh2和cdrh3,所述vl包括cdrl1、cdrl2和cdrl3,其中:
[0329]
(i)所述cdrh1包括或由以下氨基酸序列组成:根据seq id no:400、23、33、43、53、63、75、85、97、107、120、130、140、147、160、170、174、183、190、199、209、219、229、241、255、265、275、285、299、313、323、333、370、380、390、410、420、430、435、445、455、465、475、485、495、505、515、525、535、545、555、565、575、585、595、605、615、631和693中的任一者或其序列变体,所述序列变体包括一个、两个或三个酸取代,其中一个或多个取代任选地是保守取代和/或种系编码的氨基酸的取代;
[0330]
(ii)所述cdrh2包括或由以下氨基酸序列组成:根据seq id no:401、24、34、44、54、64、76、86、98、108、121、131、141、148、151、161、171、184、200、210、220、230、242、256、266、276、286、300、314、324、334、352、360、362、364、366、371、381、391、411、421、431、436、446、456、466、476、486、496、506、516、526、536、546、556、566、576、586、596、606、616、625、632、635、637、639、641、643、645、647、649、651、653、655、657、659、661、663、665、667、669、
no:23或147,在24、148或151中的任一者,25或149,在27、152、155、156、158或159中的任一者,28或153,和29;(xiii)分别为seq id no:43或160,44或161,在45、162、164或165中的任一者,47或166,48或167,和49或169;(xiv)分别为在seq id no:130、170或174中的任一者,130,131,132,134或181,135或182,和136;(xv)分别为在seq id no:53、183或190中的任一者,54或184,在55、185、187或188中的任一者,57或192,58或193,以及在59、195或197中的任一者;(xvi)分别为seq id no:199-201和203-205;(xvii)分别为seq id no:209-211和213-215;(xviii)分别为seq id no:219-221和223-225;(xix)分别为seq id no:229-231和233-235;(xx)分别为seq id no:241-243和245-247;(xxi)分别为seq id no:255-257和259-261;(xxii)分别为seq id no:265-267和269-271;(xxiii)分别为seq id no:275-277和279-281;(xxiv)分别为seq id no:285-287和289-291;(xxv)分别为seq id no:299-301和303-305;(xxvi)分别为seq id no:313-315和317-319;(xxvii)分别为seq id no:323-325和327-329;(xxviii)分别为seq id no:333-335和337-339;(xxix)分别为seq id no:229,230或352,231或354,和233或356,234和235或358;(xxx)分别为seq id no:313,在314、360、362、364或366中的任一者,315和317-319;(xxxi)分别为seq id no:370-372和374-376;(xxxii)分别为seq id no:380-382和384-386;(xxxiii)分别为seq id no:390-392和394-396;(xxxiv)分别为seq id no:23-25和27-29;(xxxv)分别为seq id no:410-412和414-416;(xxxvi)分别为seq id no:420-422和424-426;(xxxvii)分别为seq id no:435-437和439-441;(xxxviii)分别为seq id no:445-447和449-451;(xxxix)分别为seq id no:455-457和459-461;(xxxx)分别为seq id no:465-467和469-471;(xxxxi)分别为seq id no:475-477和479-481;(xxxxii)分别为seq id no:485-487和489-491;(xxxxiii)分别为seq id no:494-497和499-501;(xxxxiv)分别为seq id no:505-507和509-511;(xxxxv)分别为seq id no:515-517和519-521;(xxxxvi)分别为seq id no:525-527和529-531;(xxxxvii)分别为seq id no:535-537和539-541;(xxxxviii)分别为seq id no:545-547和549-551;(xxxxix)分别为seq id no:555-557和559-561;(xxxxx)分别为seq id no:565-567和569-571;(xxxxxi)分别为seq id no:575-577和579-581;(xxxxxii)分别为seq id no:585、586或625,587或627,和589-591;(xxxxxiii)分别为seq id no:595-597和599-601;(xxxxxiv)分别为seq id no:605-607和609-611;(xxxxxv)分别为seq id no:615-617和619-621;(xxxxxvi)分别为seq id no:631、632、或635、或637、或639、或641、或643、或645、或647、或649、或651、或653、或655、或657、或659、或661、或663、或665、或667、或669、或671、或673、或675、或677、或679、或681、或683或685、633和697-699;(xxxxxvii)分别为seq id no:693-695和697-699;(xxxxxviii)分别为seq id no:400,401,和在751、753、755、757或760中的任一者,和404,405,以及在745或747中的任一者;(xxxxxxix)分别为seq id no:585,586,和762或764,和589-591;(xxxxxxx)分别为seq id no:33-35和37-39;或(xxxxxxxi)分别为seq id no:400、401、766、404、405或405的变体以及406,所述变体包括一个、两个或三个氨基酸取代,其中所述一个、两个或三个氨基酸取代中的每一个任选地是保守氨基酸取代。
[0338]
实施方式4.一种抗体或其抗原结合片段,其包括:如seq id no:399所示的vh氨基酸序列的cdrh1、cdrh2和cdrh3;以及如seq id no:738所示的vl氨基酸序列的cdrl1、cdrl2或所述cdrl2的变体以及cdrl3,所述变体包括一个、两个或三个氨基酸取代,其中所述一
个、两个或三个氨基酸取代中的每一个任选地是保守氨基酸取代,其中所述cdr根据imgt,
[0339]
并且其中所述抗体或抗原结合片段能够与在宿主细胞的细胞表面上和/或在病毒粒子上表达的sars-cov-2的表面糖蛋白结合。
[0340]
实施方式5.一种抗体或其抗原结合片段,其包括重链可变结构域(vh)和轻链可变结构域(vl),所述vh包括互补决定区(cdr)h1、cdrh2和cdrh3,所述vl包括cdrl1、cdrl2和cdrl3,其中cdrh1、cdrh2、cdrh3、cdrl1、cdrl2和cdrl3包括如下所示的氨基酸序列:(a)分别为seq id no:400、401、766、404、405和406;(b)分别为seq id no:400、401、769、404、405和406;(c)分别为seq id no:400、401、770、404、405和406;(d)分别为seq id no:400、401、771、404、405和406;(e)分别为seq id no:400、401、772、404、405和406;(f)分别为seq id no:400、401、773、404、405和406;(g)分别为seq id no:400、401、766、404、405和745;(h)分别为seq id no:400、401、769、404、405和745;(i)分别为seq id no:400、401、770、404、405和745;(j)分别为seq id no:400、401、771、404、405和745;(k)分别为seq id no:400、401、772、404、405和745;(l)分别为seq id no:400、401、773、405、405和745;(m)分别为seq id no:400、401、766、404、405和747;(n)分别为seq id no:400、401、769、404、405和747;(o)分别为seq id no:400、401、770、404、405和747;(p)分别为seq id no:400、401、771、404、405和747;(q)分别为seq id no:400、401、772、404、405和747;或(r)分别为seq id no:400、401、773、404、405和747,
[0341]
其中所述抗体或抗原结合片段能够与在宿主细胞的细胞表面上和/或在病毒粒子上表达的sars-cov-2的表面糖蛋白结合。
[0342]
实施方式6.根据实施方式5所述的抗体或其抗原结合片段,其包括重链可变结构域(vh)和轻链可变结构域(vl),所述vh包括cdrh1、cdrh2和cdrh3,所述vl包括cdrl1、cdrl2和cdrl3,其中cdrh1、cdrh2、cdrh3、cdrl1、cdrl2和cdrl3包括如下所示的氨基酸序列:(a)分别为seq id no:400、401、766、404、405和406。
[0343]
实施方式7.根据实施方式4至6中任一项所述的抗体或抗原结合片段,其包括如下所示的氨基酸序列:(a)seq id no:400、401、402、404、405和406;(b)seq id no:400、401、751、404、405和406;(c)seq id no:400、401、753、404、405和406;(d)seq id no:400、401、755、404、405和406;(e)seq id no:400、401、757、404、405和406;(f)seq id no:400、401、760、404、405和406;(g)seq id no:400、401、402、404、405和745;(h)seq id no:400、401、751、404、405和745;(i)seq id no:400、401、753、404、405和745;(j)seq id no:400、401、755、404、405和745;(k)seq id no:400、401、757、404、405和745;(l)seq id no:400、401、760、404、405和745;(m)seq id no:400、401、402、404、405和747;(n)seq id no:400、401、751、404、405和747;(o)seq id no:400、401、753、404、405和747;(p)seq id no:400、401、755、404、405和747;(q)seq id no:400、401、757、404、405和747;或(r)seq id no:400、401、760、404、405和747。
[0344]
实施方式8.根据实施方式4至7中任一项所述的抗体或抗原结合片段,其包括在vh中的如seq id no:400所示的氨基酸序列、如seq id no:401所示的氨基酸序列和如seq id no:402所示的氨基酸序列以及在vl中的如seq id no:404所示的氨基酸序列、如seq id no:405所示的氨基酸序列和如seq id no:406所示的氨基酸序列。
[0345]
实施方式9.一种抗体或其抗原结合片段,其包括重链可变结构域(vh)和轻链可变
结构域(vl),所述vh包括互补决定区(cdr)h1、cdrh2和cdrh3,所述vl包括cdrl1、cdrl2和cdrl3,其中cdrh1、cdrh2、cdrh3、cdrl1、cdrl2和cdrl3包括如下所示的氨基酸序列:分别为seq id no:525、526、527、529、530和531,
[0346]
并且其中所述抗体或抗原结合片段能够与在宿主细胞的细胞表面上和/或在病毒粒子上表达的sars-cov-2的表面糖蛋白结合。
[0347]
实施方式10.一种抗体或其抗原结合片段,其包括重链可变结构域(vh)和轻链可变结构域(vl),所述vh包括互补决定区(cdr)h1、cdrh2和cdrh3,所述vl包括cdrl1、cdrl2和cdrl3,其中cdrh1、cdrh2、cdrh3、cdrl1、cdrl2和cdrl3包括如下所示的氨基酸序列:分别为seq id no:585、586或625、587或627、589、590和591,
[0348]
并且其中所述抗体或抗原结合片段能够与在宿主细胞的细胞表面上和/或在病毒粒子上表达的sars-cov-2的表面糖蛋白结合。
[0349]
实施方式11.一种抗体或其抗原结合片段,其包括重链可变结构域(vh)和轻链可变结构域(vl),所述vh包括互补决定区(cdr)h1、cdrh2和cdrh3,所述vl包括cdrl1、cdrl2和cdrl3,其中cdrh1、cdrh2、cdrh3、cdrl1、cdrl2和cdrl3包括如下所示的氨基酸序列:分别为seq id no:229、230、231、233、234和235,
[0350]
其中所述抗体或抗原结合片段能够与在宿主细胞的细胞表面上和/或在病毒粒子上表达的sars-cov-2的表面糖蛋白结合。
[0351]
实施方式12.根据实施方式1至11中任一项所述的抗体或抗原结合片段,其中:
[0352]
(i)所述vh包括与以下任一者的氨基酸序列具有至少85%(例如,85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)同一性的氨基酸序列或由其组成:seq id no:399、22、32、42、52、62、72、74、84、96、106、119、129、139、150、163、173、175、178、186、189、191、198、208、218、228、240、254、264、274、284、298、312、322、332、350、351、353、359、361、363、365、367、368、369、379、389、409、419、429、434、444、454、464、474、484、494、504、514、524、534、544、554、564、574、584、594、604、614、624、626、628、630、634、636、638、640、642、644、646、648、650、652、654、656、658、660、662、664、666、668、670、672、674、676、678、680、682、684、692、740、741、742、743、748、749、750、752、754、756、758、759、761、762和764,其中的改变任选地限于一个或多个框架区和/或改变包括一个或多个种系编码的氨基酸的取代;和/或
[0353]
(ii)所述vl包括与以下任一者的氨基酸序列具有至少85%(例如,85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)同一性的氨基酸序列或由其组成:seq id no:738、26、36、46、56、66、78、88、94、100、110、123、133、143、154、157、168、194、196、202、212、222、232、238、244、250、252、258、268、278、288、294、296、302、308、310、316、326、336、355、357、373、383、393、403、413、423、438、448、458、468、478、488、498、508、518、528、538、548、558、568、578、588、598、608、618、686、696、744和746,其中的改变任选地限于一个或多个框架区和/或改变包括一个或多个种系编码的氨基酸的取代。
[0354]
实施方式13.根据实施方式1至12中任一项所述的抗体或抗原结合片段,其中所述vh包括与如seq id no:399所示的氨基酸序列具有至少85%同一性的氨基酸序列或由其组成,并且所述vl包括与如seq id no:403或seq id no:738所示的氨基酸序列具有至少85%
同一性的氨基酸序列或由其组成。
[0355]
实施方式14.根据实施方式1至13中任一项所述的抗体或抗原结合片段,其中所述vh包括与如seq id no:399所示的氨基酸序列具有至少90%同一性的氨基酸序列或由其组成,并且所述vl包括与如seq id no:403或seq id no:738所示的氨基酸序列具有至少90%同一性的氨基酸序列或由其组成。
[0356]
实施方式15.根据实施方式1至14中任一项所述的抗体或抗原结合片段,其中所述vh包括与如seq id no:399所示的氨基酸序列具有至少95%同一性的氨基酸序列或由其组成,并且所述vl包括与如seq id no:403或seq id no:738所示的氨基酸序列具有至少95%同一性的氨基酸序列或由其组成。
[0357]
实施方式16.根据实施方式1至15中任一项所述的抗体或抗原结合片段,其中所述vh包括与如seq id no:399所示的氨基酸序列具有至少97%同一性的氨基酸序列或由其组成,并且所述vl包括与如seq id no:403或seq id no:738所示的氨基酸序列具有至少97%同一性的氨基酸序列或由其组成。
[0358]
实施方式17.根据权利要求1至16中任一项所述的抗体或抗原结合片段,其中所述vh包括与如seq id no:399所示的氨基酸序列具有至少99%同一性的氨基酸序列或由其组成,并且所述vl包括与如seq id no:403或seq id no:738所示的氨基酸序列具有至少99%同一性的氨基酸序列或由其组成。
[0359]
实施方式18.根据实施方式1至12中任一项所述的抗体或抗原结合片段,其中所述vh和所述vl与如下所示的氨基酸序列具有至少85%同一性(例如85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%):
[0360]
(i)分别为seq id no:524和528;
[0361]
(ii)分别为seq id no:584或624或626或628,和588;
[0362]
(iii)分别为seq id no:228、或740、或741、或742、或743和232;或
[0363]
(iv)分别为seq id no:228、或740、或741、或742、或743和238。
[0364]
实施方式19.根据实施方式1至18中任一项所述的抗体或抗原结合片段,其中所述vh包括表2中所示的任何vh氨基酸序列或由其组成,并且其中所述vl包括表2中所示的任何vl氨基酸序列或由其组成,其中任选地,所述vh和所述vl包括根据以下的氨基酸序列或由其组成:(i)分别为seq id no:399和403或738;(ii)分别为seq id no:32和36;(iii)分别为seq id no:42和46;(iv)分别为seq id no:52和56;(v)分别为seq id no:62和66;(vi)分别为seq id no:72和66;(vii)分别为seq id no:74和78;(viii)分别为seq id no:84和88;(ix)分别为seq id no:84和88;(x)分别为seq id no:96和100;(xi)分别为seq id no:106和110;(xii)分别为seq id no:119和123;或(xiii)分别为seq id no:129和133;(xiv)分别为seq id no:22或150,和26、154或157;(xv)分别为seq id no:42或163,和46或168;(xvi)分别为在seq id no:129、173、175或178中的任一者,和133;(xvii)分别为在seq id no:52、186、189或191中的任一者,和在56、194或196中的任一者;(xviii)分别为seq id no:198和202;(xix)分别为seq id no:208和212;(xx)分别为seq id no:218和222;(xxi)分别为seq id no:228,和232或238;(xxii)分别为seq id no:240,以及在244、250或252中的任一者;(xxiii)分别为seq id no:254和258;(xxiv)分别为seq id no:264和268;(xxv)分别为seq id no:274和278;或(xxvi)分别为seq id no:284,以及在288、294或296中的任
一者;(xxvii)分别为seq id no:298,以及在302、308或310中的任一者;(xxviii)分别为seq id no:312和316;(xxix)分别为seq id no:322和326;(xxx)分别为seq id no:332和336;(xxxi)分别为在seq id no:228、350、351或353中的任一者,和232、238、355或357;(xxxii)分别为在seq id no:312、359、361、363、365、367或368中的任一者,和316;(xxxiii)分别为seq id no:369和373;(xxxiv)分别为seq id no:379和383;(xxxv)分别为seq id no:389和393;(xxxvi)分别为seq id no:22和26;(xxxvii)分别为seq id no:409和413;(xxxviii)分别为seq id no:419和423;(xxxix)分别为seq id no:434和438;(xxxx)分别为seq id no:444和448;(xxxxi)分别为seq id no:454和458;(xxxxii)分别为seq id no:464和468;(xxxxiii)分别为seq id no:474和478;(xxxxiv)分别为seq id no:484和488;(xxxxv)分别为seq id no:494和498;(xxxxvi)分别为seq id no:504和508;(xxxxvii)分别为seq id no:514和518;(xxxxviii)分别为seq id no:524和528;(xxxxix)分别为seq id no:534和538;(xxxxx)分别为seq id no:544和548;(xxxxxi)分别为seq id no:554和558;(xxxxxii)分别为seq id no:564和568;(xxxxxiii)分别为seq id no:574和578;(xxxxxiv)分别为seq id no:584和588;(xxxxxv)分别为seq id no:594和598;(xxxxxvi)分别为seq id no:604和608;(xxxxxvii)分别为seq id no:614和618;(xxxxxviii)分别为seq id no:624、626或628,和588;(xxxxxix)分别为seq id no:630、634、636、638、640、642、644、646、648、650、652、654、656、658、660、662、664、666、668、670、672、674、676、678、680、682或684,和686;(xxxxxx)分别为seq id no:692和696;(xxxxxxi)分别为在seq id no:740-743中的任一者,和238;(xxxxxxii)分别为在seq id no:399、748、749、750、752、754、756、758、759和761中的任一者,和在403、744和746中的任一者;或(xxxxxxiii)分别为seq id no:762或764,和588。
[0365]
实施方式20.一种抗体或其抗原结合片段,其包括重链可变结构域(vh)和轻链可变结构域(vl),其中所述vh包括如seq id no:399所示的氨基酸序列或由其组成,并且所述vl包括如seq id no:738所示的氨基酸序列或由其组成,
[0366]
其中所述抗体或抗原结合片段能够与在宿主细胞的细胞表面上和/或在病毒粒子上表达的sars-cov-2的表面糖蛋白结合。
[0367]
实施方式21.一种抗体或其抗原结合片段,其包括重链可变结构域(vh)和轻链可变结构域(vl),其中所述vh包括如seq id no:399所示的氨基酸序列或由其组成,并且所述vl包括如seq id no:403所示的氨基酸序列或由其组成,
[0368]
其中所述抗体或抗原结合片段能够与在宿主细胞的细胞表面上和/或在病毒粒子上表达的sars-cov-2的表面糖蛋白结合。
[0369]
实施方式22.一种抗体或其抗原结合片段,其包括重链可变结构域(vh)和轻链可变结构域(vl),其中所述vh包括在如seq id no:399、748、749、750、752、754、756、758、759和761中的任一者中所示的氨基酸序列或由其组成,并且所述vl包括如seq id no:403所示的氨基酸序列或由其组成,
[0370]
其中所述抗体或抗原结合片段能够与在宿主细胞的细胞表面上和/或在病毒粒子上表达的sars-cov-2的表面糖蛋白结合。
[0371]
实施方式23.一种抗体或其抗原结合片段,其包括重链可变结构域(vh)和轻链可变结构域(vl),其中所述vh包括在如seq id no:399、748、749、750、752、754、756、758、759
和761中的任一者中所示的氨基酸序列或由其组成,并且所述vl包括如seq id no:738所示的氨基酸序列或由其组成,
[0372]
其中所述抗体或抗原结合片段能够与在宿主细胞的细胞表面上和/或在病毒粒子上表达的sars-cov-2的表面糖蛋白结合。
[0373]
实施方式24.一种抗体或其抗原结合片段,其包括重链可变结构域(vh)和轻链可变结构域(vl),其中所述vh包括在如seq id no:399、748、749、750、752、754、756、758、759和761中的任一者中所示的氨基酸序列或由其组成,并且所述vl包括如seq id no:744所示的氨基酸序列或由其组成,
[0374]
其中所述抗体或抗原结合片段能够与在宿主细胞的细胞表面上和/或在病毒粒子上表达的sars-cov-2的表面糖蛋白结合。
[0375]
实施方式25.一种抗体或其抗原结合片段,其包括重链可变结构域(vh)和轻链可变结构域(vl),其中所述vh包括在如seq id no:399、748、749、750、752、754、756、758、759和761中的任一者中所示的氨基酸序列或由其组成,并且所述vl包括如seq id no:746所示的氨基酸序列或由其组成,
[0376]
其中所述抗体或抗原结合片段能够与在宿主细胞的细胞表面上和/或在病毒粒子上表达的sars-cov-2的表面糖蛋白结合。
[0377]
实施方式26.一种抗体或其抗原结合片段,其包括重链可变结构域(vh)和轻链可变结构域(vl),其中所述vh包括如seq id no:524所示的氨基酸序列或由其组成,并且所述vl包括如seq id no:528所示的氨基酸序列或由其组成,
[0378]
其中所述抗体或抗原结合片段能够与在宿主细胞的细胞表面上和/或在病毒粒子上表达的sars-cov-2的表面糖蛋白结合。
[0379]
实施方式27.一种抗体或其抗原结合片段,其包括重链可变结构域(vh)和轻链可变结构域(vl),其中所述vh包括在如seq id no:584、624、626和628中的任一者中所示的氨基酸序列或由其组成,并且所述vl包括如seq id no:588所示的氨基酸序列或由其组成,
[0380]
其中所述抗体或抗原结合片段能够与在宿主细胞的细胞表面上和/或在病毒粒子上表达的sars-cov-2的表面糖蛋白结合。
[0381]
实施方式28.一种抗体或其抗原结合片段,其包括重链可变结构域(vh)和轻链可变结构域(vl),其中所述vh包括在如seq id no:228、740、741、742和743中的任一者中所示的氨基酸序列或由其组成,并且所述vl包括如seq id no:232所示的氨基酸序列或由其组成,
[0382]
其中所述抗体或抗原结合片段能够与在宿主细胞的细胞表面上和/或在病毒粒子上表达的sars-cov-2的表面糖蛋白结合。
[0383]
实施方式29.一种抗体或其抗原结合片段,其包括重链可变结构域(vh)和轻链可变结构域(vl),其中所述vh包括在如seq id no:228、740、741、742和743中的任一者中所示的氨基酸序列或由其组成,并且所述vl包括如seq id no:238所示的氨基酸序列或由其组成,
[0384]
其中所述抗体或抗原结合片段能够与在宿主细胞的细胞表面上和/或在病毒粒子上表达的sars-cov-2的表面糖蛋白结合。
[0385]
实施方式30.一种抗体或其抗原结合片段,其包括重链可变结构域(vh)和轻链可
变结构域(vl),其中所述vh包括如seq id no:32所示的氨基酸序列或由其组成,并且所述vl包括如seq id no:36所示的氨基酸序列或由其组成。
[0386]
实施方式31.一种抗体或其抗原结合片段,其包括重链可变结构域(vh)和轻链可变结构域(vl),所述vh包括cdrh1、cdrh2和cdrh3,所述vl包括cdrl1、cdrl2和cdrl3,其中所述cdrh1、cdrh2、cdrh3包括如下所示的氨基酸序列或由其组成:分别为seq id no:33-35,并且所述cdrl1、cdrl2和cdrl3包括如下所示的氨基酸序列或由其组成:分别为seq id no:37-39。
[0387]
实施方式32.根据实施方式3至31中任一项所述的抗体或抗原结合片段,其能够在体外感染模型和/或体内感染动物模型和/或人体内中和sars-cov-2感染。
[0388]
实施方式33.根据实施方式1至32中任一项所述的抗体或抗原结合片段,其进行以下:
[0389]
(i)识别sars-cov-2的ace2受体结合基序(rbm,seq id no:5)中的表位;
[0390]
(ii)能够阻断sars-cov-2(例如,sars-cov-2rbm)与人ace2之间的相互作用;
[0391]
(iii)能够与sars-cov-2s蛋白结合;
[0392]
(iv)识别在sars-cov-2的ace2 rbm和sars-cov-1的ace2 rbm中保守的表位;
[0393]
(v)对sars-cov-2和sars-cov-1冠状病毒具有交叉反应性;
[0394]
(vii)识别sars-cov-2表面糖蛋白中不存在于ace2 rbm中的表位;
[0395]
(viii)能够以融合前构象与sars-cov-2s蛋白三聚体结合;
[0396]
或者
[0397]
(ix)(i)-(vii)的任何组合。
[0398]
实施方式34.根据实施方式1至33中任一项所述的抗体或抗原结合片段,其是igg、iga、igm、ige或igd同种型。
[0399]
实施方式35.根据实施方式1至34中任一项所述的抗体或抗原结合片段,其是选自igg1、igg2、igg3和igg4的igg同种型。
[0400]
实施方式36.根据实施方式1至35中任一项所述的抗体或抗原结合片段,其是人的、人源化的或嵌合的。
[0401]
实施方式37.根据实施方式1至36中任一项所述的抗体或抗原结合片段,其中所述抗体或所述抗原结合片段包括人抗体、单克隆抗体、经纯化的抗体、单链抗体、fab、fab'、f(ab')2、fv、scfv或scfab。
[0402]
实施方式38.根据实施方式37所述的抗体或抗原结合片段,其中所述scfv包括多于一个vh结构域和多于一个vl结构域。
[0403]
实施方式39.根据实施方式1至38中任一项所述的抗体或抗原结合片段,其中所述抗体或抗原结合片段是多特异性抗体或抗原结合片段。
[0404]
实施方式40.根据实施方式39所述的抗体或抗原结合片段,其中所述抗体或抗原结合片段是双特异性抗体或抗原结合片段。
[0405]
实施方式41.根据实施方式39或40所述的抗体或抗原结合片段,其包括:
[0406]
(i)第一vh和第一vl;以及
[0407]
(ii)第二vh和第二vl,
[0408]
其中所述第一vh和所述第二vh是不同的并且各自独立地包括与如下任一者中所
示的氨基酸序列具有至少85%(例如,85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)同一性的氨基酸序列:seq id no:22、32、42、52、62、72、74、84、96、106、119、129、139、150、163、173、175、178、186、189、191、198、208、218、228、240、254、264、274、284、298、312、322、332、350、351、353、359、361、363、365、367、368、369、379、389、399、409、419、429、434、444、454、464、474、484、494、504、514、524、534、544、554、564、574、584、594、604、614、624、626、628、630、634、636、638、640、642、644、646、648、650、652、654、656、658、660、662、664、666、668、670、672、674、676、678、680、682、684、692、740、741、742、743、748、749、750、752、754、756、758、759、761、762和764,并且
[0409]
其中所述第一vl和所述第二vl是不同的并且各自独立地包括与如下任一者中所示的氨基酸序列具有至少85%(例如,85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)同一性的氨基酸序列:seq id no:26、36、46、56、66、78、88、94、100、110、123、133、143、154、157、168、194、196、202、212、222、232、238、244、250、252、258、268、278、288、294、296、302、308、310、316、326、336、355、357、373、383、393、403、413、423、438、448、458、468、478、488、498、508、518、528、538、548、558、568、578、588、598、608、618、686、696、738、744和746;
[0410]
并且其中所述第一vh和所述第一vl一起形成第一抗原结合位点,并且其中所述第二vh和所述第二vl一起形成第二抗原结合位点。
[0411]
实施方式42.根据实施方式40或41所述的抗体或抗原结合片段,其包括:
[0412]
(i)第一vh和第一vl;以及
[0413]
(ii)第二vh和第二vl,
[0414]
其中所述第一vh包括与如下任一者中所示的氨基酸序列具有至少85%(例如,85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)同一性的氨基酸序列:seq id no:139和342,并且所述第一vl包括与如下任一者中所示的氨基酸序列具有至少85%(即,85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)同一性的氨基酸序列:seq id no:143和346,并且其中所述第二vh包括与如下任一者中所示的氨基酸序列具有至少85%(例如,85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)同一性的氨基酸序列:seq id no:399、748、749、750、752、754、756、758、759和761,并且所述第二vl包括与如下任一者中所示的氨基酸序列具有至少85%(即,85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)同一性的氨基酸序列:seq id no:403、744和746。
[0415]
实施方式43.根据实施方式39或40所述的抗体或抗原结合片段,其包括具有第一特异性的第一抗原结合部分和具有第二特异性的第二抗原结合部分,其中所述第一抗原结合部分包括vh和vl,所述vh包括如seq id no:399所示的氨基酸序列或由其组成,所述vl包括如seq id no:738或seq id no:403所示的氨基酸序列或由其组成。
[0416]
实施方式44.根据实施方式43所述的抗体或抗原结合片段,其中所述第二抗原结合部分包括vh和vl,所述vh包括如seq id no:139所示的氨基酸序列或由其组成,所述vl包括如seq id no:143所示的氨基酸序列或由其组成。
[0417]
实施方式45.根据实施方式43所述的抗体或抗原结合片段,其中所述第二抗原结
合部分包括vh和vl,所述vh包括如seq id no:342所示的氨基酸序列或由其组成,所述vl包括如seq id no:346所示的氨基酸序列或由其组成。
[0418]
实施方式46.根据实施方式1至45中任一项所述的抗体或抗原结合片段,其中所述抗体或抗原结合片段进一步包括fc多肽或其片段。
[0419]
实施方式47.根据实施方式46所述的抗体或抗原结合片段,其中所述fc多肽或其片段包括:
[0420]
(i)突变,所述突变与不包括所述突变的参比fc多肽相比增强与fcrn结合;和/或
[0421]
(ii)突变,所述突变与不包括所述突变的参比fc多肽相比增强与fcγr结合。
[0422]
实施方式48.根据实施方式47所述的抗体或抗原结合片段,其中所述增强与fcrn结合的突变包括:m428l;n434s;n434h;n434a;n434s;m252y;s254t;t256e;t250q;p257i;q311i;d376v;t307a;e380a;或其任何组合。
[0423]
实施方式49.根据实施方式47或48所述的抗体或抗原结合片段,其中所述增强与fcrn结合的突变包括:(i)m428l/n434s;(ii)m252y/s254t/t256e;(iii)t250q/m428l;(iv)257i/q311i;(v)p257i/n434h;(vi)d376v/n434h;(vii)t307a/e380a/n434a;或(viii)(i)-(vii)的任何组合。
[0424]
实施方式50.根据实施方式47至49中任一项所述的抗体或抗原结合片段,其中所述增强与fcrn结合的突变包括m428l/n434s。
[0425]
实施方式51.根据实施方式47至50中任一项所述的抗体或抗原结合片段,其中所述增强与fcγr结合的突变包括:s239d;i332e;a330l;g236a;或其任何组合。
[0426]
实施方式52.根据实施方式47至51中任一项所述的抗体或抗原结合片段,其中所述增强与fcγr结合的突变包括:(i)s239d/i332e;(ii)s239d/a330l/i332e;(iii)g236a/s239d/i332e;或
[0427]
(iv)g236a/a330l/i332e。
[0428]
实施方式53.根据实施方式47至52中任一项所述的抗体或抗原结合片段,其中所述fc多肽包括l234a突变和l235a突变。
[0429]
实施方式54.根据实施方式1至53中任一项所述的抗体或抗原结合片段,其包括改变糖基化的突变,其中所述改变糖基化的突变包括n297a、n297q或n297g,和/或其是去糖基化的和/或去岩藻糖基化的。
[0430]
实施方式55.根据实施方式1至54中任一项所述的抗体或抗原结合片段,其能够以小于500ng/ml、小于250ng/ml、小于100ng/ml、小于90ng/ml、小于80ng/ml、小于70ng/ml、小于60ng/ml、小于50ng/ml、小于40ng/ml、小于30ng/ml、小于25ng/ml、小于20ng/ml、小于16ng/ml、小于15ng/ml、小于14ng/ml、小于13ng/ml、小于12ng/ml、小于10ng/ml、小于9ng/ml、小于8ng/ml、小于7ng/ml、小于6ng/ml、小于5ng/ml、小于4ng/ml或小于2mg/ml的ec50与sars-cov-2表面糖蛋白结合,如通过elisa(任选地,间接elisa和/或夹心elisa)测量的和/或通过流式细胞术测量的,其中所述sars cov-2表面糖蛋白在宿主细胞的细胞表面处表达。
[0431]
实施方式56.根据实施方式1至55中任一项所述的抗体或抗原结合片段,其能够以小于500ng/ml、小于250ng/ml、小于100ng/ml、小于90ng/ml、小于80ng/ml、小于70ng/ml、小于60ng/ml、小于50ng/ml、小于40ng/ml、小于30ng/ml、小于25ng/ml、小于20ng/ml、小于
16ng/ml、小于15ng/ml、小于14ng/ml、小于13ng/ml、小于12ng/ml、小于10ng/ml、小于9ng/ml、小于8ng/ml、小于7ng/ml、小于6ng/ml、小于5ng/ml、小于4ng/ml或小于2mg/ml的ec50与sars-cov-2表面糖蛋白rbd结合,如通过elisa(任选地,间接elisa和/或夹心elisa)测量的和/或通过流式细胞术测量的,其中所述sars cov-2表面糖蛋白在宿主细胞的细胞表面处表达。
[0432]
实施方式57.根据实施方式1至56中任一项所述的抗体或抗原结合片段,其能够以小于5x 10-8
m、小于4x 10-8
m、小于3x 10-8
m、小于2x 10-8
m、小于1x 10-8
m、小于5x 10-9
m、小于1x 10-9
m、小于5x 10-10
m、小于1x 10-10
m、小于5x 10-11
m、小于1x 10-11
m、小于5x 10-12
m或小于1x 10-12
m的kd与sars-cov-2rbd结合,如使用生物层干涉法(bli)所确定的,任选地使用在蛋白a针上上样有抗体或抗原结合片段的octet仪器,任选地以2.7μg/ml,和sars-cov-2rbd以6μg/ml、1.5μg/ml或0.4μg/ml上样5分钟,进一步任选地测量解离7分钟。
[0433]
实施方式58.根据实施方式1至57中任一项所述的抗体或抗原结合片段,其能够以小于6x 10-8
m、小于5x 10-8
m、小于4x 10-8
m、小于3x 10-8
m、小于2x 10-8
m、小于1x 10-8
m、小于5x 10-9
m、小于4x 10-9
m、小于3x 10-9
m、小于2x 10-9
m、小于1x10-9
m或小于8x 10-10
m的kd与sars-cov-2rbd结合,如使用表面等离子体共振(spr)所确定的,任选地使用利用单循环动力学方法的biacore t200仪器。
[0434]
实施方式59.根据权利要求1至58中任一项所述的抗体或抗原结合片段,其能够与sars-cov-2rbd结合并抑制(i)所述rbd与(ii)人ace2和/或人siglec-1之间的相互作用。
[0435]
实施方式60.根据实施方式1至59中任一项所述的抗体或抗原结合片段,其能够中和以下:
[0436]
(i)由sars-cov-2假病毒引起的感染,任选地:
[0437]
(i)(a)中和ic50小于100ng/ml、小于90ng/ml、小于80ng/ml、小于70ng/ml、小于60ng/ml、小于50ng/ml、小于40ng/ml、小于30ng/ml、小于25ng/ml、小于20ng/ml、小于15ng/ml、小于10ng/ml、小于9ng/ml、小于8ng/ml、小于7ng/ml、小于6ng/ml、小于5ng/ml、小于4ng/ml、小于3ng/ml、小于2ng/ml或小于1ng/ml,优选地小于10ng/ml、小于9ng/ml、小于8ng/ml、小于7ng/ml、小于6ng/ml、小于5ng/ml、小于4ng/ml、小于3ng/ml、小于2ng/ml或小于1ng/ml,和/或
[0438]
(i)(b)中和ic80小于100ng/ml、小于90ng/ml、小于80ng/ml、小于70ng/ml、小于60ng/ml、小于50ng/ml、小于40ng/ml、小于30ng/ml或小于25ng/ml,优选地小于50ng/ml、小于40ng/ml、小于30ng/ml或小于25ng/ml,和/或
[0439]
(i)(c)中和ec90小于300ng/ml、小于200ng/ml、小于100ng/ml、小于90ng/ml、小于80ng/ml、小于70ng/ml、小于60ng/ml、50ng/ml、小于40ng/ml、小于30ng/ml、小于25ng/ml、小于20ng/ml、小于15ng/ml或小于10ng/ml,其中进一步任选地,所述sars-cov-2假病毒包括vsv假病毒和/或mlv假病毒,和/或
[0440]
(i)(d)所述sars-cov-2假病毒包括vsv假病毒和/或mlv假病毒;和/或
[0441]
(ii)由活sars-cov-2引起的感染,任选地
[0442]
(ii)(a)ec50小于60ng/ml、小于50ng/ml、小于40ng/ml、小于30ng/ml、小于25ng/ml、小于20ng/ml、小于15ng/ml、小于12ng/ml、小于11ng/ml、小于10ng/ml、小于9ng/ml、小于8ng/ml、小于7ng/ml、小于6ng/ml、小于5ng/ml或小于4ng/ml,优选地小于15ng/ml、小于
12ng/ml、小于11ng/ml、小于10ng/ml、小于9ng/ml、小于8ng/ml、小于7ng/ml、小于6ng/ml、小于5ng/ml或小于4ng/ml,和/或
[0443]
(ii)(b)ec90小于50ng/ml、小于40ng/ml、小于35ng/ml、小于30ng/ml、小于25ng/ml、小于20ng/ml、小于15ng/ml、小于12ng/ml、小于11ng/ml、小于10ng/ml、小于9ng/ml、小于8ng/ml、小于7ng/ml、小于6ng/ml、小于5ng/ml或小于4ng/ml,优选地小于30ng/ml、小于25ng/ml、小于20ng/ml、小于15ng/ml或小于12ng/ml,和/或
[0444]
(ii)(c)在6小时的时间段内,感染复数为0.1;和/或
[0445]
(iii)由宿主细胞(例如,hek293t细胞)中的活sars-cov-2引起的感染,所述宿主细胞表达dc-sign、l-sign、siglec或ace2,任选地被工程化以过表达dc-sign、l-sign、siglec或ace2;和/或
[0446]
(iv)由宿主细胞(例如,hek293t细胞)中的活sars-cov-2引起的感染,所述宿主细胞表达siglec-1或ace2,任选地被工程化以过表达siglec-1或ace2,其中中和感染包括完全中和感染。
[0447]
实施方式61.根据实施方式1至60中任一项所述的抗体或抗原结合片段,其能够中和由sars-cov-2变体引起的感染,与包括seq id no:3的sars-cov-2表面糖蛋白相比,所述变体在所述表面糖蛋白中包括以下突变中的任一者:n501y;s477n;n439k;l452r;e484k;k417n;t478k;s494p;a520s;n501t;a522s;y453f;p384l。
[0448]
实施方式62.根据实施方式61所述的抗体或抗原结合片段,其能够中和由所述sars-cov-2变体引起的感染,其效力比所述抗体或抗原结合片段中和由sars-cov-2引起的感染的效力低不到三倍,所述抗体或抗原结合片段包括如seq id no:3所示的表面糖蛋白氨基酸序列。
[0449]
实施方式63.根据实施方式1至62中任一项所述的抗体或抗原结合片段,其能够激活fcγriia、fcγriiia或两者,其中任选地:(i)所述fcγriia包括h131等位基因;和/或
[0450]
(ii)所述fcγriiia包括v158等位基因;和/或
[0451]
(iii)使用表达sars-cov-2s的靶细胞,如cho细胞和表达nfat驱动报告基因的报告基因细胞,如荧光素酶来确定激活。
[0452]
实施方式64.根据实施方式1至63中任一项所述的抗体或抗原结合片段,其包括:
[0453]
(a)如seq id no:6所示的ch1-ch3氨基酸序列和如seq id no:8所示的cl氨基酸序列;
[0454]
(b)如seq id no:6所示的ch1-ch3氨基酸序列和如seq id no:9所示的cl氨基酸序列;
[0455]
(c)如seq id no:7所示的ch1-ch3氨基酸序列和如seq id no:8所示的cl氨基酸序列;或者
[0456]
(d)如seq id no:7所示的ch1-ch3氨基酸序列和如seq id no:9所示的cl氨基酸序列。
[0457]
实施方式65.一种分离的抗体,其包括:
[0458]
(i)如seq id no:767所示的重链氨基酸序列;和
[0459]
(ii)如seq id no:768所示的轻链氨基酸序列。
[0460]
实施方式66.根据实施方式1至65中任一项所述的抗体或抗原结合片段,其在非人
灵长类动物中的体内半衰期介于20天与30天之间、或介于22天与28天之间、或介于23天与27天之间、或介于24天与26天之间或为约25天。
[0461]
实施方式67.根据实施方式1至66中任一项所述的抗体或抗原结合片段,其中所述抗体或抗原结合片段能够以约20ng/ml至约30ng/ml的ic50中和sars-cov-2感染和/或中和靶细胞的感染。
[0462]
实施方式68.根据实施方式1至66中任一项所述的抗体或抗原结合片段,其中所述抗体或抗原结合片段能够以约10ng/ml至约20ng/ml的ic50中和sars-cov-2感染和/或中和靶细胞的感染。
[0463]
实施方式69.根据实施方式1至66中任一项所述的抗体或抗原结合片段,其中所述抗体或抗原结合片段能够以约5ng/ml至约10ng/ml的ic50中和sars-cov-2感染和/或中和靶细胞的感染。
[0464]
实施方式70.根据实施方式1至66中任一项所述的抗体或抗原结合片段,其中所述抗体或抗原结合片段能够以约1ng/ml至约5ng/ml的ic50中和sars-cov-2感染和/或中和靶细胞的感染。
[0465]
实施方式71.根据实施方式1至70中任一项所述的抗体或抗原结合片段,其中所述抗体或抗原结合片段能够中和由sars-cov-2引起的感染并且不与人ace2竞争与所述sars-cov-2s蛋白结合,
[0466]
其中任选地,所述中和包括在体外感染模型中中和感染。
[0467]
实施方式72.一种抗体或其抗原结合片段,其与根据实施方式1至71中任一项所述的抗体或抗原结合片段竞争与sars-cov-2表面糖蛋白结合。
[0468]
实施方式73.一种分离的多核苷酸,其编码根据实施方式1至72中任一项所述的抗体或抗原结合片段、或编码所述抗体或所述抗原结合片段的vh、重链、vl和/或轻链。
[0469]
实施方式74.根据实施方式73所述的多核苷酸,其中所述多核苷酸包括脱氧核糖核酸(dna)或核糖核酸(rna),其中所述rna任选地包括信使rna(mrna)。
[0470]
实施方式75.根据实施方式73或74所述的多核苷酸,其被密码子优化以在宿主细胞中表达。
[0471]
实施方式76.根据实施方式73至75中任一项所述的多核苷酸,其包括与根据以下中的任一者或多者的多核苷酸序列具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少97%或至少99%同一性或包括所述多核苷酸序列或由其组成的多核苷酸:seq id no:30、31、40、41、50、51、60、61、70、71、73、82、83、92、93、95、104、105、114、115、116、117、118、127、128、137、138、206、207、216、217、226、227、236、237、239、248、249、251、253、262、263、272、273、282、283、292、293、295、297、306、307、309、311、320、321、330、331、340、341、377、378、387、388、397、398、407、408、417、418、427、428、433、442、443、452、453、462、463、472、473、482、483、492、493、502、503、512、513、552、523、532、533、542、543、552、553、562、563、572、573、582、583、592、593、602、603、612、613、622、623、690、691、700-737和739。
[0472]
实施方式77.根据实施方式73至76中任一项所述的多核苷酸,其包括:
[0473]
(i)与如seq id no:407所示的核苷酸序列具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少97%或至少
99%同一性或包括所述核苷酸序列或由其组成的多核苷酸;以及
[0474]
(ii)与如seq id no:408、737或739所示的核苷酸序列具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少97%或至少99%的同一性或包括所述核苷酸序列或由其组成的多核苷酸。
[0475]
实施方式78.一种重组载体,其包括根据实施方式73至77中任一项所述的多核苷酸。
[0476]
实施方式79.一种宿主细胞,其包括根据实施方式77中任一项所述的多核苷酸和/或根据实施方式78所述的载体,其中所述多核苷酸对所述宿主细胞是异源的。
[0477]
实施方式80.一种人b细胞,其包括根据实施方式73至77中任一项所述的多核苷酸,其中所述多核苷酸对于所述人b细胞是异源的和/或其中所述人b细胞是永生化的。
[0478]
实施方式81.一种组合物,其包括:(i)根据实施方式1至72中任一项所述的抗体或抗原结合片段;(ii)根据实施方式73至77中任一项所述的多核苷酸;(iii)根据实施方式78所述的重组载体;(iv)根据实施方式79所述的宿主细胞;和/或(v)根据实施方式80所述的人b细胞,以及药学上可接受的赋形剂、载体或稀释剂。
[0479]
实施方式82.根据实施方式81所述的组合物,其包括两个或多个根据实施方式1至72中任一项所述的抗体或抗原结合片段。
[0480]
实施方式83.根据实施方式82所述的组合物,其包括:
[0481]
(i)第一抗体或抗原结合片段,所述第一抗体或抗原结合片段包括vh和vl,所述vh包括如seq id no:32所示的氨基酸序列或由其组成,所述vl包括如seq id no:36所示的氨基酸序列或由其组成;以及
[0482]
(ii)第二抗体或抗原结合片段,所述第二抗体或抗原结合片段包括vh和vl,所述vh包括如seq id no:139所示的氨基酸序列或由其组成,所述vl包括如seq id no:143所示的氨基酸序列或由其组成。
[0483]
实施方式84.根据实施方式82所述的组合物,其包括:
[0484]
(i)第一抗体或抗原结合片段,所述第一抗体或抗原结合片段包括重链可变结构域(vh)和轻链可变结构域(vl),所述vh包括cdrh1、cdrh2和cdrh3,所述vl包括cdrl1、cdrl2和cdrl3,其中所述cdrh1、cdrh2、cdrh3包括如下所示的氨基酸序列或由其组成:分别为seq id no:33-35,并且所述cdrl1、cdrl2和cdrl3包括如下所示的氨基酸序列或由其组成:分别为seq id no:37-39;以及
[0485]
(ii)第二抗体或抗原结合片段,所述第二抗体或抗原结合片段包括重链可变结构域(vh)和轻链可变结构域(vl),所述vh包括cdrh1、cdrh2和cdrh3,所述vl包括cdrl1、cdrl2和cdrl3,其中所述cdrh1、cdrh2、cdrh3包括如下所示的氨基酸序列或由其组成:分别为seq id no:140-142,并且所述cdrl1、cdrl2和cdrl3包括如下所示的氨基酸序列或由其组成:分别为seq id no:144-146。
[0486]
实施方式85.根据实施方式82所述的组合物,其包括:
[0487]
(i)第一抗体或抗原结合片段,所述第一抗体或抗原结合片段包括vh和vl,所述vh包括如seq id no:139或342所示的氨基酸序列或由其组成,所述vl包括如seq id no:143或346所示的氨基酸序列或由其组成;以及
[0488]
(ii)第二抗体或抗原结合片段,所述第二抗体或抗原结合片段包括vh和vl,所述
vh包括如seq id no:399、748、749、750、752、754、756、758、759或761所示的氨基酸序列或由其组成,所述vl包括如seq id no:403、744或746所示的氨基酸序列或由其组成。
[0489]
实施方式86.根据实施方式82所述的组合物,其包括:
[0490]
(i)第一抗体或抗原结合片段,所述第一抗体或抗原结合片段包括重链可变结构域(vh)和轻链可变结构域(vl),所述vh包括cdrh1、cdrh2和cdrh3,所述vl包括cdrl1、cdrl2和cdrl3,其中所述cdrh1、cdrh2、cdrh3包括如下所示的氨基酸序列或由其组成:分别为seq id no:140-142或分别为343-345,并且所述cdrl1、cdrl2和cdrl3包括如下所示的氨基酸序列或由其组成:分别为seq id no:144-146;以及
[0491]
(ii)第二抗体或抗原结合片段,所述第二抗体或抗原结合片段包括重链可变结构域(vh)和轻链可变结构域(vl),所述vh包括cdrh1、cdrh2和cdrh3,所述vl包括cdrl1、cdrl2和cdrl3,其中所述cdrh1、cdrh2、cdrh3包括如下所示的氨基酸序列或由其组成:分别为seq id no:400、401以及751、753、755、757、760中的任一者,并且所述cdrl1、cdrl2和cdrl3包括如下所示的氨基酸序列或由其组成:分别为seq id no:404、405以及406、745和747中的任一者。
[0492]
实施方式87.一种组合物,其包括:
[0493]
(i)第一抗体或抗原结合片段,所述第一抗体或抗原结合片段包括:
[0494]
(i)(a)vh,所述vh包括如seq id no:32所示的氨基酸序列或由其组成;以及
[0495]
(i)(b)vl,所述vl包括如seq id no:36所示的氨基酸序列或由其组成;以及
[0496]
(ii)第二抗体或抗原结合片段,所述第二抗体或抗原结合片段包括:
[0497]
(ii)(a)vh,所述vh包括如seq id no:139所示的氨基酸序列或由其组成;以及
[0498]
(ii)(b)vl,所述vl包括如seq id no:143所示的氨基酸序列或由其组成。
[0499]
实施方式88.一种组合物,其包括:
[0500]
(i)第一抗体或抗原结合片段,所述第一抗体或抗原结合片段能够与sars-cov-2表面糖蛋白结合并且包括:
[0501]
(i)(a)vh,所述vh分别包括如seq id no:400、402和766所示的cdrh1、cdrh2和cdrh3氨基酸序列;以及
[0502]
(i)(b)vl,所述vl分别包括如seq id no:404、405和406所示的cdrl1、cdrl2和cdrl3氨基酸序列;以及
[0503]
(ii)第二抗体或抗原结合片段,所述第二抗体或抗原结合片段能够与sars-cov-2表面糖蛋白结合并且包括:
[0504]
(ii)(a)vh,所述vh分别包括如seq id no:140、141或344和142所示的cdrh1、cdrh2和cdrh3氨基酸序列;以及
[0505]
(ii)(b)vl,所述vl分别包括如seq id no:144、145和146所示的cdrl1、cdrl2和cdrl3氨基酸序列。
[0506]
实施方式89.一种组合物,其包括:
[0507]
(i)第一抗体或抗原结合片段,所述第一抗体或抗原结合片段能够与sars-cov-2表面糖蛋白结合并且包括:
[0508]
(i)(a)vh,所述vh包括如seq id no:399所示的氨基酸序列;以及
[0509]
(i)(b)vl,所述vl包括如seq id no:403或seq id no:738所示的氨基酸序列;以
及
[0510]
(ii)第二抗体或抗原结合片段,所述第二抗体或抗原结合片段能够与sars-cov-2表面糖蛋白结合并且包括:
[0511]
(ii)(a)vh,所述vh包括如seq id no:139或342所示的氨基酸序列;以及
[0512]
(ii)(b)vl,所述vl包括如seq id no:143所示的氨基酸序列。
[0513]
实施方式90.根据实施方式82至89中任一项所述的组合物,其中所述第一抗体或抗原结合片段和所述第二抗体或抗原结合片段各自包括包含m428l突变和n434s突变的igg1 fc多肽。
[0514]
实施方式91.根据实施方式82至90中任一项所述的组合物,其中所述第一抗体或抗原结合片段和所述第二抗体或抗原结合片段各自包括包含g236a突变、a330l突变和i332e突变的igg1 fc多肽。
[0515]
实施方式92.一种组合物,其包括包封于载体分子中的根据实施方式73至77中任一项所述的多核苷酸,其中所述载体分子任选地包括脂质、脂质衍生的递送媒剂,如脂质体、固体脂质纳米颗粒、油性悬浮液、亚微米脂质乳液、脂质微泡、反脂质胶束、耳蜗脂质体、脂质微管、脂质微柱、脂质纳米颗粒(lnp)或纳米级平台。
[0516]
实施方式93.一种组合物,其包括:
[0517]
(i)第一抗体或抗原结合片段,所述第一抗体或抗原结合片段能够与sars-cov-2表面糖蛋白结合并抑制sars-cov-2表面糖蛋白与选自ace2、dc-sign、l-sign和siglec-1的第一细胞表面受体之间的相互作用;以及
[0518]
(ii)第二抗体或抗原结合片段,所述第二抗体或抗原结合片段能够与sars-cov-2表面糖蛋白结合并抑制sars-cov-2表面糖蛋白与选自ace2、dc-sign、l-sign和siglec-1的第二细胞表面受体之间的相互作用,
[0519]
其中所述第一细胞表面受体和所述第二细胞表面受体是不同的。
[0520]
实施方式94.一种治疗受试者的冠状病毒感染,例如sars-cov-2感染的方法,所述方法包括向所述受试者施用有效量的:(i)根据实施方式1至72中任一项所述的抗体或抗原结合片段;(ii)根据实施方式73至77中任一项所述的多核苷酸;
[0521]
(iii)根据实施方式78所述的重组载体;(iv)根据实施方式79所述的宿主细胞;(v)根据实施方式80所述的人b细胞;和/或(vi)根据实施方式81至93中任一项所述的组合物。
[0522]
实施方式95.一种治疗受试者的冠状病毒感染,例如sars-cov-2感染的方法,所述方法包括向所述受试者施用:
[0523]
(i)第一抗体或抗原结合片段,所述第一抗体或抗原结合片段能够与sars-cov-2表面糖蛋白结合并且包括:
[0524]
(i)(a)vh,所述vh分别包括如seq id no:400、402和766所示的cdrh1、cdrh2和cdrh3氨基酸序列;以及
[0525]
(i)(b)vl,所述vl分别包括如seq id no:404、405和406所示的cdrl1、cdrl2和cdrl3氨基酸序列;以及
[0526]
(ii)第二抗体或抗原结合片段,所述第二抗体或抗原结合片段能够与sars-cov-2表面糖蛋白结合并且包括:
[0527]
(ii)(a)vh,所述vh分别包括如seq id no:140、141或344和142所示的cdrh1、cdrh2和cdrh3氨基酸序列;以及
[0528]
(ii)(b)vl,所述vl分别包括如seq id no:144、145和146所示的cdrl1、cdrl2和cdrl3氨基酸序列。
[0529]
实施方式96.一种治疗受试者的冠状病毒感染,例如sars-cov-2感染的方法,所述方法包括向所述受试者施用:
[0530]
(i)第一抗体或抗原结合片段,所述第一抗体或抗原结合片段能够与sars-cov-2表面糖蛋白结合并且包括:
[0531]
(i)(a)vh,所述vh包括如seq id no:399所示的氨基酸序列;以及
[0532]
(i)(b)vl,所述vl包括如seq id no:403或seq id no:738所示的氨基酸序列;以及
[0533]
(ii)第二抗体或抗原结合片段,所述第二抗体或抗原结合片段能够与sars-cov-2表面糖蛋白结合并且包括:
[0534]
(ii)(a)vh,所述vh包括如seq id no:139或342所示的氨基酸序列;以及
[0535]
(ii)(b)vl,所述vl包括如seq id no:143所示的氨基酸序列。
[0536]
实施方式97.一种预防、或治疗或中和受试者的冠状病毒感染的方法,所述方法包括向已接受第一抗体或抗原结合片段的受试者施用第二抗体或抗原结合片段,所述第一抗体或抗原结合片段包括:
[0537]
(i)(a)分别根据seq id no:32和36的vh和vl氨基酸序列;或者
[0538]
(i)(b)分别根据seq id no:33-35和37-39的cdrh1、cdrh2、cdrh3、cdrl1、cdrl2和cdrl3氨基酸序列;
[0539]
所述第二抗体或抗原结合片段包括:
[0540]
(ii)(a)根据seq id no:139的vh氨基酸序列和根据seq id no:143的vl氨基酸序列;或者
[0541]
(ii)(b)分别根据seq id no:140-142的cdrh1、cdrh2和cdrh3氨基酸和根据seq id no:144-146的cdrl1、cdrl2和cdrl3氨基酸序列。
[0542]
实施方式98.一种预防、或治疗或中和受试者的冠状病毒感染的方法,所述方法包括向已接受第一抗体或抗原结合片段的受试者施用第二抗体或抗原结合片段,所述第一抗体或抗原结合片段包括:
[0543]
(i)(a)根据seq id no:139的vh氨基酸序列和根据seq id no:143的vl氨基酸序列;或者
[0544]
(i)(b)分别根据seq id no:140-142的cdrh1、cdrh2和cdrh3氨基酸序列和分别根据seq id no:144-146的cdrl1、cdrl2和cdrl3氨基酸序列;
[0545]
所述第二抗体或抗原结合片段包括:
[0546]
(ii)(a)分别根据seq id no:32和36的vh和vl氨基酸序列;或者
[0547]
(ii)(b)分别根据seq id no:33-35和37-39的cdrh1、cdrh2、cdrh3、cdrl1、cdrl2和cdrl3氨基酸序列。
[0548]
实施方式99.一种预防、或治疗或中和受试者的冠状病毒感染的方法,所述方法包括向已接受第一抗体或抗原结合片段的受试者施用第二抗体或抗原结合片段,所述第一抗
体或抗原结合片段包括:
[0549]
(i)(a)根据seq id no:139或342的vh氨基酸序列和根据seq id no:143或346的vl氨基酸序列;或者
[0550]
(i)(b)分别根据seq id no:140-142或分别根据seq id no:343-345的cdrh1、cdrh2和cdrh3氨基酸序列或分别根据seq id no:144-146的cdrl1、cdrl2和cdrl3氨基酸序列;
[0551]
所述第二抗体或抗原结合片段包括:
[0552]
(ii)(a)根据seq id no:399、748、749、750、752、754、756、758、759或761的vh氨基酸序列和根据seq id no:403、744或746的vl氨基酸序列;或者
[0553]
(ii)(b)分别根据seq id no:400、401以及751、753、755、757、760中的任一者的cdrh1、cdrh2和cdrh3氨基酸序列以及分别根据seq id no:404、405以及406、745和747中的任一者的cdrl1、cdrl2和cdrl3氨基酸序列。
[0554]
实施方式100.一种预防、或治疗或中和受试者的冠状病毒感染的方法,所述方法包括向已接受第一抗体或抗原结合片段的受试者施用第二抗体或抗原结合片段,所述第一抗体或抗原结合片段包括:
[0555]
(i)(a)根据seq id no:399、748、749、750、752、754、756、758、759或761的vh氨基酸序列和根据seq id no:403、744或746的vl氨基酸序列;或者
[0556]
(i)(b)分别根据seq id no:400、401以及751、753、755、757、760中的任一者的cdrh1、cdrh2和cdrh3氨基酸序列以及分别根据seq id no:404、405以及406、745和747中的任一者的cdrl1、cdrl2和cdrl3氨基酸序列;
[0557]
所述第二抗体或抗原结合片段包括:
[0558]
(ii)(a)根据seq id no:139或342的vh氨基酸序列和根据seq id no:143或346的vl氨基酸序列;或者
[0559]
(ii)(b)分别根据seq id no:140-142或分别根据seq id no:343-345的cdrh1、cdrh2和cdrh3氨基酸序列或分别根据seq id no:144-146的cdrl1、cdrl2和cdrl3氨基酸序列。
[0560]
实施方式101.根据实施方式95至100中任一项所述的方法,其中所述第一抗体或抗原结合片段和所述第二抗体或抗原结合片段各自包括包含m428l突变和n434s突变的igg1 fc多肽。
[0561]
实施方式102.根据实施方式95至101中任一项所述的方法,其中所述第一抗体或抗原结合片段和所述第二抗体或抗原结合片段各自包括包含g236a突变、a330l突变和i332e突变的igg1 fc多肽。
[0562]
实施方式103.一种治疗受试者的冠状病毒(例如,sars-cov-2)感染的方法,所述方法包括向所述受试者施用:
[0563]
(i)第一抗体或抗原结合片段,所述第一抗体或抗原结合片段能够与sars-cov-2表面糖蛋白结合并抑制sars-cov-2表面糖蛋白与选自ace2、dc-sign、l-sign和siglec-1的第一细胞表面受体之间的相互作用;以及
[0564]
(ii)第二抗体或抗原结合片段,所述第二抗体或抗原结合片段能够与sars-cov-2表面糖蛋白结合并抑制sars-cov-2表面糖蛋白与选自ace2、dc-sign、l-sign和siglec-1的
第二细胞表面受体之间的相互作用,
[0565]
其中所述第一细胞表面受体和所述第二细胞表面受体是不同的。
[0566]
实施方式104.根据实施方式1至72中任一项所述的抗体或抗原结合片段、根据实施方式73至77中任一项所述的多核苷酸、根据实施方式78所述的重组载体、根据实施方式79所述的宿主细胞、根据实施方式80所述的人b细胞和/或根据实施方式81至93中任一项所述的组合物,其用于治疗受试者的冠状病毒(例如,sars-cov-2)感染的方法中。
[0567]
实施方式105.根据实施方式1至72中任一项所述的抗体或抗原结合片段、根据实施方式73至77中任一项所述的多核苷酸、根据实施方式78所述的重组载体、根据实施方式79所述的宿主细胞、根据实施方式80所述的人b细胞和/或根据实施方式81至93中任一项所述的组合物,其用于制备用于治疗受试者的冠状病毒(例如,sars-cov-2)感染的药物。
[0568]
实施方式106.一种用于体外诊断冠状病毒(例如,sars-cov-2)感染的方法,所述方法包括:
[0569]
(i)使来自受试者的样品与根据实施方式1至72中任一项所述的抗体或抗原结合片段接触;以及
[0570]
(ii)检测复合物,所述复合物包括抗原和所述抗体,或包括抗原和所述抗原结合片段。
[0571]
实施方式107.根据实施方式106所述的方法,其中所述样品包括从所述受试者中分离的血液。
[0572]
表2.序列
[0573]
[0574]
[0575]
[0576]
[0577]
[0578]
[0579]
[0580]
[0581]
[0582]
[0583]
[0584]
[0585]
[0586]
[0587]
[0588]
[0589]
[0590]
[0591]
[0592]
[0593]
[0594]
[0595]
[0596]
[0597]
[0598]
[0599]
[0600]
[0601]
[0602]
[0603]
[0604]
[0605]
[0606]
[0607]
[0608]
[0609]
[0610]
[0611]
[0612]
[0613]
[0614]
[0615]
[0616]
[0617]
[0618]
[0619]
[0620]
[0621]
[0622]
[0623]
[0624]
[0625]
[0626]
[0627]
[0628]
[0629]
[0630]
[0631]
[0632]
[0633]
[0634]
[0635]
[0636]
[0637]
[0638]
[0639]
[0640]
[0641]
[0642]
[0643]
[0644]
[0645]
[0646]
[0647]
[0648]
[0649]
[0650]
[0651]
[0652]
[0653]
[0654]
[0655]
[0656]
[0657]
[0658]
[0659]
[0660]
[0661]
[0662]
[0663]
[0664]
[0665]
[0666]
[0667]
[0668]
[0669]
[0670]
[0671]
[0672]
[0673]
[0674]
[0675]
[0676]
[0677][0678]
实施例
[0679]
实施例1
[0680]
与sars-cov-2刺突蛋白结合的人抗体
[0681]
从sars-cov-2感染中恢复的人类患者中分离出单克隆抗体。简而言之,ebv永生化记忆b细胞基于在三聚体融合前构象中与sars-cov-2刺突蛋白的完整胞外域的结合进行分选。生物素部分与刺突蛋白的c末端连接,并且生物素化的刺突与荧光链霉亲和素(af647荧光团)偶联并用于对b细胞进行染色,然后基于荧光分选与三聚体融合前刺突蛋白结合的b细胞。通过此方法鉴定的单克隆抗体在用表达重链和轻链的质粒瞬时共转染的expicho细胞中重组表达。
[0682]
实施例2
[0683]
抗体与sars-cov-1rbd和sars-cov-2 rbd的结合
[0684]
使用酶联免疫吸附测定(elisa)评估从sars-cov-2感染中恢复的患者中分离的单
克隆抗体与sars-cov-1的rbd和sars-cov-2刺突蛋白的结合。
[0685]
简而言之,用sars-cov-2rbd(内部产生;来自genbank登录号mn908947.3的sars-cov-2分离株的刺突的残基331-550)或sars-cov(本文中也称为sars-cov-1)rbd(义翘神州科技有限公司)涂覆96孔板。将孔洗涤并用pbs+1%bsa在室温下封闭1小时然后用连续稀释的重组单克隆抗体在室温下温育1小时。通过将碱性磷酸酶缀合的山羊抗人igg(南部生物科技公司(southern biotechnology):2040-04)在室温下温育1小时来检测结合的抗体,并通过含1mg/ml对硝基苯磷酸底物的0.1m甘氨酸缓冲液(ph 10.4)在室温下显影30分钟。在elisa读取器(powerwave 340/96分光光度计,伯腾公司)中在405nm的波长下测量光密度(od)值。
[0686]
图1a-1d中示出了elisa测定结果。在每个图中,上图中示出了rbd与sars-cov-2的结合,并且下图中示出了rbd与sars-cov-1的结合。图右侧的方框中和表3中示出了计算的ec50值(以ng/ml表示)。
[0687]
表3.抗体与sars rbd的结合(ec50 ng/ml)(elisa)
[0688][0689][0690]
使用另外的抗体进行使用相同程序的另外的测定。图8a和8b中示出了结果。在这些图中的每个图中,左图中示出了与sars-cov-2rbd的结合,并且右图中示出了与sars-cov-1rbd的结合。每个图右侧的方框中示出了计算的ec50值(以ng/ml表示)。
[0691]
使用其它抗体进行相同的程序。图10a-10e中示出了结果。在这些图中的每个图中,上图中示出了与sars-cov-2rbd的结合,而下图中示出了sarsrbd与sars-cov-1的结合。每个图右侧的方框中示出了计算的ec50值(以ng/ml表示)(如果可获得的话)。在本测定中,抗体s2e12(seq id no:399的vh氨基酸序列;seq id no:403的vl氨基酸序列)以43.40ng/
ml的ec50与sars-cov-2rbd结合。
[0692]
使用类似的方法确定另外的抗体与sars-cov-2rbd的结合。图22a和22b中示出了结果。每个图表右侧的方框中示出了计算的ec50值。
[0693]
实施例3
[0694]
抗体与sars-cov-1和sars-cov-2刺突蛋白以及与sars-cov-1和sars-cov-2rbd
[0695]
的结合
[0696]
通过酶联免疫吸附测定(elisa)评估从sars-cov-2感染中恢复的患者中分离的某些人单克隆抗体与sars-cov-2的刺突蛋白以及与sars-cov-1和sars-cov-2刺突蛋白的rbd的结合。
[0697]
简而言之,用sars-cov刺突s1亚基蛋白(义翘神州科技有限公司)、sars-cov-2rbd(内部产生;来自genbank登录号mn908947.3的sars-cov-2分离株的刺突的残基331-550)或sars-cov rbd(义翘神州科技有限公司)涂覆96孔板。将孔洗涤并用pbs+1%bsa在室温下封闭1小时然后用连续稀释的重组单克隆抗体在室温下温育1小时。通过将碱性磷酸酶缀合的山羊抗人igg(南部生物科技公司:2040-04)在室温下温育1小时来检测结合的抗体,并通过含1mg/ml对硝基苯磷酸底物的0.1m甘氨酸缓冲液(ph 10.4)在室温下显影30分钟。在elisa读取器(powerwave 340/96分光光度计,伯腾公司)中在405nm的波长下测量光密度(od)值。
[0698]
图4a-4n中示出了elisa测定结果。每个图右侧的方框中示出了计算的ec50值(以ng/ml表示)。
[0699]
使用类似的方法评估另外的单克隆抗体与sars-cov-1和sars-cov-2的刺突蛋白以及与sars-cov-1和sars-cov-2的刺突蛋白rbd的结合。图18a-18e中示出了结果。每个图右侧的方框中示出了计算的ec50值(ng/ml)。
[0700]
通过类似的方法确定了另外的单克隆抗体与sars-cov-1刺突蛋白、sars-cov-1刺突rbd和sars-cov-2刺突rbd的结合。图20a、20b、21a和21b中示出了结果。图表右侧的方框示出了计算的ec50值(ng/ml)。
[0701]
实施例4
[0702]
抗体与人ace2结合rbd的竞争性结合
[0703]
通过竞争elisa测量重组单克隆抗体和人ace2与rbd的竞争性结合。使用从sars-cov-2感染中恢复的患者中分离的单克隆抗体产生重组抗体。
[0704]
简而言之,用重组人ace2(内部产生)涂覆elisa板。以含有2ug/ml ace2的pbs进行涂覆。将板在4℃下温育过夜,并且在室温下用封闭剂酪蛋白(1%酪蛋白,来自赛默飞世尔公司)封闭1小时。在37℃下将单克隆抗体的连续稀释液与20ng/ml的sars-cov-2rbd(rbd与小鼠fc融合,来自义翘神州科技有限公司)一起温育30分钟,然后转移到ace2涂覆的板上以在室温下另外温育。将板洗涤并使用多克隆山羊抗小鼠fc-ap抗体(南方生物技术公司)检测rbd与ace2的结合。另外洗涤后,加入ap底物pnpp(西格玛公司(sigma))并将板在室温下温育20分钟,之后用分光光度计(powerwave340伯腾公司)在405nm处测量吸光度。图2中示出了结果。
[0705]
使用类似的方法对另外的单克隆抗体进行另外的测定。图13a、13b、23a和23b中示出了结果。在这些图中,每个图表的右侧示出了计算的ic50值。
[0706]
实施例5
[0707]
通过重组人单克隆抗体中和sars-cov-2假型化的mlv
[0708]
将从sars-cov-2感染中恢复的患者中分离的单克隆抗体重组表达,并在针对sars-cov-2假型化病毒的中和测定中进行测试。
[0709]
简而言之,使用了用sars-cov-2刺突蛋白(sars-cov-2pp)假型化的鼠类白血病病毒(mlv)。veroe6细胞用作靶细胞,并在添加病毒和抗体前一天进行接种。用10ug/ml的胰蛋白酶tpck激活sars-cov-2pp。将经激活的sars-cov-2pp添加到抗体的稀释系列中并温育48小时。抗体的起始浓度为每种抗体5ug/ml,稀释3倍。在抽吸细胞培养上清液并且添加bio-glo底物(普洛麦格公司(promega))之后测量发光。
[0710]
图3a-3f中示出了结果。这些图中的每个图右侧示出了计算的ic50值(以ng/ml表示)。表4示出了计算的ic50、ic80和ic90值(以ng/ml表示)。
[0711]
表4.针对用sars-cov-2s蛋白假型化的mlv的中和
[0712][0713]
将从sars-cov-2感染中恢复的患者中分离的另外的单克隆抗体重组表达,并使用相同程序在针对sars-cov-2假型化病毒的中和测定中进行测试。图5a-5d和图7a-7d中示出了结果。图7d中标记为“s2h58”的抗体包括如seq id no:228所示的vh氨基酸序列和如seq id no:238所示的vl氨基酸序列。每个图右侧的方框中示出了图5a-5d中的抗体的计算的ec50值。表5中示出了图7a-7d中的抗体的计算的ec50和ec90值。
[0714]
表5.针对用sars-cov-2s蛋白假型化的mlv的中和
[0715]
抗体ec50(ng/ml)ec90(ng/ml)sn1237.2279.099s2n1998.71516.291s2n2236.1958.835
s2n2465.53167.841s2n2539.2288.528s2n2755.97129.421s2n2832.72174.533s2n410.1125-s2x1150.77245.392s2x7119.09174.137s2x7633.1967.599s2h589.65354.544s2h6760.12221.856s309727.21472.870
[0716]
将从sars-cov-2感染中恢复的患者中分离的另外的单克隆抗体重组表达,并使用相同程序在针对sars-cov-2假型化病毒的中和测定中进行测试。图9a-9f中示出了结果。每个图中的图表下方示出了计算的ic50、ic80和ic90值。图9e中示出的抗体s2e12包括seq id no:399的vh氨基酸序列(分别为seq id no:400、401和766的cdrh1-h3)和seq id no:403的vl氨基酸序列(分别为seq id no:404-406的cdrl1-cdrl3)。
[0717]
使用类似的方法测定其它抗体对感染的中和。图11a-11d中示出了结果。每个图的右侧示出了计算的ic50、ic80和ic90值。
[0718]
使用类似的方法在针对sars-cov-2假型化病毒的中和测定中对其它抗体进行测试。图17a-17c中示出了结果。每个图表下方示出了计算的ic50、ic80和ic90值。
[0719]
使用类似的方法在针对sars-cov-2假型化病毒的中和测定中对其它抗体进行测试。图19a-19e中示出了结果。每个图中的图表右侧示出了计算的ic50、ic80和ic90值。
[0720]
实施例6
[0721]
活sars-cov-2的抗体中和
[0722]
将从sars-cov-2感染中恢复的患者中分离的单克隆抗体重组表达,并在针对活sars-cov-2病毒的中和测定中进行测试。
[0723]
简而言之,将在补充有10%fbs(vwr)和1x青霉素/链霉素(赛默飞世尔科技公司)的dmem中培养的vero e6细胞以20,000个细胞/孔接种在白色96孔板中,并附着过夜。将单克隆抗体的连续1:4稀释液与200pfu的sars-cov-2(分离株usa-wa1/2020,传代3,在vero e6细胞中传代)在37℃下于bsl-3设施中一起温育30分钟。去除细胞上清液,并将病毒-抗体混合物添加到细胞中。感染后24小时,用4%多聚甲醛将细胞固定30分钟,随后用pbs(ph 7.4)洗涤两次,并用含0.25%triton x-100的pbs透化30分钟。在5%奶粉/pbs中封闭30分钟后,将细胞与靶向sars-cov-2核衣壳蛋白(义翘神州科技有限公司(sino biological),目录号40143-r001)的初级抗体以1:2000稀释度一起温育1小时。在洗涤并与和1μg/ml赫斯特33342混合的次级alexa647标记的抗体一起温育1小时后,在自动细胞成像读取器(cytation 5,伯腾公司)上对板进行成像,并使用制造商提供的软件对核衣壳阳性细胞进行计数。使用prism软件(graphpad prism 8.0)处理数据。
[0724]
图6a和6b中以及表6和表7中示出了结果(ec50和ec90值,ng/ml)。表8中示出了计算的ic50值(ng/ml)。
[0725]
表6.
[0726][0727][0728]
表7.
[0729][0730]
表8.
[0731][0732]
使用类似的方法,在针对活sars-cov-2病毒的中和测定中测试了二十二种另外的抗体以及比较抗体s309-v2(如seq id no:342所示的vh,如seq id no:346所示的vl(分别为如seq id no:343-345和347-349所示的cdrh1-h3和l1-l3))。图16a-16d中示出了结果。s2h58-v2包括如seq id no:228所示的vh氨基酸序列和如seq id no:238所示的vl氨基酸序列(κ轻链)。s2e12包括如seq id no:399所示的vh氨基酸序列(分别如seq id no:400、401和766所示的cdrh1-h3)和如seq id no:403所示的vl氨基酸序列(分别如seq id no:404-406所示的cdrl1-l3)。表9-12中示出了计算的ic50(ng/ml)值。表13-16中示出了计算的ec50和ec90值(ng/ml)。
[0733]
表9.
[0734]
抗体ic50s309-v2123.8s2n2213.58s2n1223.68s2n2817.59s2n2513.64s2h58-v26.337
[0735]
表10.
[0736]
抗体ic50s309-v2145.7s2e924.93s2e613.52s2e13大约14.02s2k426.36s2e148.300s2e724.43s2e125.409
[0737]
表11.
[0738]
抗体ic50s309-v2146.0
s2h3748.67s2h7312.72s2h4018.63s2h7052.69s2h715.580
[0739]
表12.
[0740]
抗体ic50s309-v2173.7s2x3011.42s2h58-v18.362s2h66633.0s2h6224.17s2h3028.80
[0741]
表13.
[0742]
抗体ec50ec90s309-v2126438s2n221346s2n122577s2n281844s2n251349s2h58-v2619
[0743]
表14.
[0744]
抗体ec50ec90s309-v2145342s2e61670s2e92566s2e131417s2k41349s2e14941s2e12516
[0745]
表15.
[0746][0747]
表16.
[0748][0749]
使用类似方法,使用另外的单克隆抗体进行中和测定。图25a和25b中示出了结果。图25a示出了四种抗体以及比较抗体s309 n55q ls和s2x193的结果。s309 n55q ls(本文也称为s309-v2)包括如seq id no:342所示的vh氨基酸序列和如seq id no:346所示的vl氨基酸序列,并且包括fc区中的m428l和n434s突变。图25b示出了抗体s2x129和s2x132以及四种比较抗体的结果。表17中示出了ic50和内插的ec50和ec90值(ng/ml)。
[0750]
表17.
[0751][0752]
使用vsv-luc(刺突d19)假病毒评估由其它抗体(表达为具有野生型或m428l/n434s(“ls”)修饰的fc的重组igg1)产生的中和。图26中示出了曲线;表18中示出了ic50值和内插的ec50和ec90值(ng/ml)。
[0753]
表18.
[0754][0755][0756]
还测试了这些抗体对活sars-cov-2的中和。图27中示出了曲线;数据来自一式三份孔sars-cov-2-luc,moi 0.1,6小时感染。表19中示出了ic50值和内插的ec50和ec90值(ng/ml)。
[0757]
表19.
[0758]
抗体ic50ec50ec90s2e12-ls4.844530
s2m11-v1-ls3.214411s2d106-ls4.485622409_11_3_v1-ls8.2331039s2x227-v2-ls7.0611044409_11_2_v1-ls5.073520s30984.3079289
[0759]
实施例7
[0760]
s2x16、s2x30、s2x35和s2x47变体抗体的产生
[0761]
重组igg1抗体使用抗体s2x16、s2x30、s2x35和s2x47或其工程化变体的vh和vl序列产生。组合物如表20所指示产生。抗体中的每一种都是通过在hd 293f细胞(金斯瑞公司(genscript))中瞬时转染和表达编码重组抗体的质粒载体而产生的。在第4天采集细胞并通过蛋白质印迹和蛋白a滴度分析验证igg表达。
[0762]
表20.
[0763][0764][0765]
实施例8
[0766]
s2h58和s2n22变体抗体
[0767]
重组igg1抗体使用单克隆抗体s2h58和s2n22或其工程化变体的vh和vl序列产生。组合物如表21所指示产生。抗体中的每一种都是通过在hd 293f细胞(金斯瑞公司)中瞬时转染和表达编码重组抗体的质粒载体而产生的。在第4天采集细胞并通过蛋白质印迹和蛋白a滴度分析验证igg表达。
[0768]
表21.
[0769][0770]
实施例9
[0771]
s2e12变体抗体
[0772]
重组igg1抗体使用单克隆抗体s2e12和其工程化变体的vh和vl序列产生。表22中概述了s2e12和某些工程化s2e12变体的v区氨基酸序列。
[0773]
表22.
[0774][0775]
实施例10
[0776]
通过重组抗体中和sars-cov-2
[0777]
将从sars-cov-2感染中恢复的患者中分离的人单克隆抗体重组表达,并在针对sars-cov-2假型化病毒(vsv)的中和测定中进行测试。
[0778]
将重组单克隆抗体连续稀释,并在37℃下与恒定量的用sars-cov-2假型化的vsv-δg-luc(登录号mn908947)一起温育1.5小时。然后将veroe6细胞添加到完全dmem培养基中,并将板在37℃下温育24小时。为了测量在受感染细胞中表达的荧光素酶的量,抽吸培养基并加入温热到室温的荧光素酶底物bio-glo荧光素酶测定系统(普洛麦格股份有限公司(promega ag))。在振荡器上于黑暗中温育10分钟后,使用1秒积分时间在光度计中测量信号。
[0779]
图12a-12d中示出了某些单克隆抗体的结果。每个图表的下方示出了计算的ic50
和ic90值(ng/ml)。
[0780]
实施例11
[0781]
使用octet将抗体与rbd结合
[0782]
通过octet测量抗体s2x193、s2x195、s2x219、s2x244、s2x246、s2x256、s2x269和s2x278对sars-cov-2rbd的结合亲和力和亲合力。抗体以2.7μg/ml上样到蛋白a针上。sars-cov-2rbd以6μg/ml、1.5μg/ml或0.4μg/ml上样5分钟。测量解离7分钟。图14a-14h中示出了结果。在每个图表中,竖直虚线指示解离阶段的开始。
[0783]
还通过octet测量抗体s2x193、s2x195、s2x219、s2x244、s2x246、s2x256、s2x269和s2x278以及四种比较抗体对sars-cov-1rbd的结合亲和力和亲合力。抗体以2.7μg/ml上样到蛋白a针上。sars-cov-1rbd以6μg/ml上样5分钟。测量解离7分钟。图15中示出了结果。在每个图表中,竖直虚线指示解离阶段的开始。
[0784]
实施例12
[0785]
sars-cov-2刺突蛋白的定量表位特异性血清学
[0786]
通过抗体竞争测定、cryo-em数据和晶体学数据分析了sars-cov-2刺突蛋白抗体结合。根据此分析,鉴定了刺突rbd抗原位点ia、ib、ic、id、ii和iv。图24示出了示出这些位点以及在每个位点内结合的抗体的图谱。
[0787]
实施例13
[0788]
s2e12抗体与sars-cov-2rbd的结合
[0789]
通过表面等离子体共振(spr)测量s2e12和s2e12变体抗体与sars-cov-2rbd的结合。使用单循环动力学方法,用biacore t200仪器进行spr实验。抗体捕获在表面上,并且注射浓度逐渐增加的经纯化的sars-cov-2rbd。监测缔合和解离动力学并且将其拟合到结合模型以确定亲和力。
[0790]
表23和24中示出了结果。从被转化以表达s2e12抗体的cho细胞的上清液中获得抗体“s2e12-11”。使用在经转化的hek细胞中产生的经纯化的抗体产生抗体s2e12 wt(seq id no:399的vh,seq id no:403的vl)。kd/kd_wt列出了所指示抗体的kd值除以s2e12 wt的kd值。kd_wt/kd列出了s2e12 wt的kd值除以所指示抗体的kd值。空白细胞指示使用此测定没有测量到结合。
[0791]
表23.
[0792][0793][0794]
表24.
[0795]
抗体kd(m)[第一相]kd_wt/kds2e12 wt2.28e-091.00409_11_4_v42.59e-080.09409_11_4_v27.88e-102.89409_11_4_v62.04e-080.11409_11_4_v124.53e-080.05409_11_4_v135.14e-080.04
[0796]
实施例14
[0797]
通过抗体中和sars-cov-2的ace2非依赖性机制
[0798]
研究了sars-cov-2感染的抗体中和机制。在以下实验中,除非另有说明,s309抗体(seq id no:139的vh,seq id no:143的vl)被表达为具有m428l和n434s突变的重组igg1。研究ace2过表达对s309抗体中和感染的影响。在存在s309(10μg/ml)的情况下,以moi 0.01用sars-cov-2(分离株usa-wa1/2020)感染vero e6或vero e6-tmprss2细胞。感染后24小时固定细胞,对病毒核衣壳蛋白进行免疫染色和定量。在抗体处理的细胞中实际上不存在核衣壳染色。s309在vero e6细胞中的ic50(ng/ml)为65,并且在vero e6-tmprss2中的ic50为91(数据未示出)。
[0799]
一组七种细胞系(hela、293t(wt)、vero e6、huh7、293t ace2、mrc 5-ace2-tmprss2、a549-ace2-tmprss2克隆5、a549-ace2-tmprss2克隆10)在存在s309的情况下用sars-cov-2刺突蛋白假型化的sars-cov-2-nluc或vsv感染。感染后24小时对荧光素酶信号进行定量。s309最大中和值如表25所示出的。
[0800]
表25.s309的最大中和值
[0801][0802][0803]
图53(sars-cov-2-nluc)和图54(假型化vsv)中示出了s2e12中和数据。值得注意的是,s2e12示出了对所有靶细胞的相当的中和活性。
[0804]
通过流式细胞术定量与这些细胞系结合的经纯化、荧光标记的sars-cov-2刺突蛋白的结合。hela和239t wt细胞的mfi最低,随后是huh7和veroe6细胞。293t ace2细胞(最高)、mrc 5-ace2-tmprss2(第三高)、a549-ace2-tmprss2克隆5(第四高)和a549-ace2-tmprss2克隆10(第二高)具有较高的mfi。确定了s309的刺突结合最大中和电位之间的相关性分析;两种病毒模型的s309斯皮尔曼相关值(spearman correlation value)为:r=-0.94。p=0.017。参见图55。
[0805]
为了进一步表征sars-cov-2易感细胞系,将上文所描述的七种细胞系与经纯化、荧光标记的sars-cov-2刺突蛋白或rbd蛋白一起温育,并且通过流式细胞术定量蛋白质结
合。按mfi递减次序,细胞系为:a549-ace2-tmprss2克隆10;293t ace2;mrc 5-ace2-tmprss2;a549-ace2-tmprss2克隆5;vero e6;huh7;293t(wt);以及hela。
[0806]
使用感染sars-cov-2vsv假病毒的hek293t细胞筛选所选择的凝集素和公开的受体候选者。ace2、dc-sign、l-sign和siglec-1产生最高信号。ace2提供大约105个相对发光单位(rlu)的信号,并且dc-sign、siglec-1和l-sign具有大约104个rlu的信号。被测的所有其它凝集素/候选物给出大约10
2-103个rlu的信号。
[0807]
将hek 293t、hela和mrc5细胞瞬时转导以过表达dc-sign、l-sign、siglec1或ace2,并用sars-cov-2vsv假病毒感染。包括未感染的细胞和未转导的细胞作为对照。在hek293t细胞中,ace2、dc-sign、siglec-1和l-sign全部提供感染的显著增加。在hela和mrc5细胞中,仅ace2增加感染。
[0808]
将过表达dc-sign、l-sign、siglec-1或ace2的稳定hek293t细胞系用真实sars-cov-2(moi 0.1)感染,固定并在24小时对sars-cov-2核蛋白进行免疫染色。野生型细胞(感染和未感染)用作对照。在过表达dc-sign、l-sign或siglec-1的细胞中观察到染色增加,并且在过表达ace2的细胞中染色显著增加。
[0809]
用sars-cov-2-nluc感染稳定细胞系并且在24小时对荧光素酶水平进行定量。按rlu递增次序:未感染(大约10
2-103个rlu);亲本293t(大约104个rlu);dc-sign(大约105个rlu);l-sign(大约105个rlu);siglec-1(大约10
5-106个rlu);ace2(》107个rlu)。
[0810]
将稳定细胞系与不同浓度的抗siglec1 mab(克隆7-239)一起温育并且用sars-cov-2-nluc感染。在表达dc-sign、l-sign或ace2的293t细胞中,感染占未处理细胞的百分比仍接近或超过100%,但在表达siglec-1的293t细胞中,感染降到低于50%(0.2μg/ml抗siglec)至接近0(1μg/ml或5μg/ml抗siglec)。
[0811]
在衍生自人肺细胞图谱(human lung cell atlas;nature.com/articles/s41586-020-2922-4)的不同肺细胞类型中确定所选择的潜在sars-cov-2(共)受体候选物的单细胞表达水平。dc-sign、l-sign和siglec-1在肺中的多种细胞类型中表达,其表达水平类似于或甚至高于ace2的表达水平。
[0812]
通过流式细胞术和免疫荧光分析来分析靶向dc/l-sign、dc-sign、siglec1或ace2的抗体在稳定过表达相应附着受体的hek293t细胞上的结合。过表达相应附着受体的hek 293t细胞感染了用sars-cov-2野生型刺突或携带b1.1.7谱系突变的刺突假型化的vsv。感染后一天分析发光。表达附着受体的细胞中感染增加。对于每个测试组,用任一刺突假型化的vsv引起的感染相似。表达ace2的细胞产生最高发光信号。
[0813]
用sars-cov-2以moi 0.01感染vero e6细胞、体外分化的modc或pbmc。感染后24小时,固定细胞,对病毒核衣壳蛋白进行免疫染色,并对受感染细胞进行定量。只有veroe6细胞示出了感染(大约7%的细胞)。在24、48和72小时取受感染细胞的上清液,并且通过ffu测定在vero e6细胞上定量感染性病毒滴度。
[0814]
评估重度covid-19患者的支气管肺泡灌洗液(balf)和痰液中具有可检测的sars-cov-2基因组的主要细胞类型。生成t-sne图,并确定每种sars-cov-2+细胞类型的计数(来自ren等人,《细胞》2021中的8名受试者的总n=3,085个细胞)。细胞类型为t细胞、nk细胞、浆细胞、嗜中性粒细胞、巨噬细胞、纤毛细胞、鳞状细胞和分泌细胞。评估每种细胞类型的ace2、dc-sign、l-sign、siglec-1和这些的组合的表达。图65-66。
[0815]
在巨噬细胞和分泌细胞中,ace2、dc-sign(cd209)、l-sign(clec4m)、siglec1转录物计数与sars-cov-2rna计数相关。相关性基于ren等人,《细胞》2021的计数(对数转换前)。
[0816]
图41中示出了示出稳定的hek293t细胞系中的受体表达的代表性数据。
[0817]
图42中示出了使用发光测定评估的表达具有荧光素酶报告基因的sars-cov-2s蛋白的vsv假病毒感染hek293t细胞的能力的代表性数据(还参见图57);与wt hek293t细胞的感染相比,dc-sign或l-sign的表达使假病毒感染水平增加了10倍以上,并且与wt hek293t细胞的感染相比,ace2的表达使假病毒感染水平增加了100倍以上。
[0818]
在工程化hek293t细胞中评估了mab s309针对vsv假病毒的中和活性。图43中示出了数据;s309完全中和了通过dc-sign和l-sign引起的感染,并且在较小程度上中和了ace2引起的感染。
[0819]
使用发光测定检查具有荧光素酶报告基因的活sars-cov-2感染hek293t细胞的能力。图44中示出了数据;与wt hek293t细胞的感染相比,dc-sign或l-sign的表达使活病毒感染水平增加了3倍以上,并且与wt hek293t细胞的感染相比,ace2的表达使活病毒感染水平增加了100倍以上。还参见图58,示出了通过对sars-cov-2核蛋白进行染色确定的感染。
[0820]
在工程化hek293t细胞中评估了s309针对vsv假病毒的中和活性。图45中示出了数据;s309完全中和了通过dc-sign和l-sign引起的感染并且在较小程度上中和了通过ace2引起的感染。
[0821]
进行实验以研究s309或s2e12抗体是否能中和sars-cov-2通过siglec-1的进入。在以下实验中,s309抗体(seq id no:139的vh,seq id no:143的vl)和s2e12抗体(seq id no:399的vh,seq id no:403的vl)被表达为具有m428l和n434s突变的重组igg1。简而言之,如上文所描述的产生稳定的细胞hek293t系,以过表达dc-sign/l-sign、dc-sign、siglec-1或ace2。图46中示出了表达数据。如图47中示出的,与wt hek293t细胞的感染相比,dc-sign、l-sign或siglec的表达使活病毒感染水平增加了10倍以上,并且与wt hek293t细胞的感染相比,ace2的表达使假病毒感染水平增加了100倍以上。如图48中示出的,s309完全中和了通过dc-sign、l-sign和siglec-1引起的感染。如图49中示出的,s2e12完全中和了通过siglec-1和ace2引起的感染。
[0822]
在多种细胞类型上确定dc-sign(cd209)和其它细胞表面受体蛋白(包括siglec-1和其它siglec)的表达。图50a和50b中概述了数据。
[0823]
进行另外的实验以研究dc-sign、l-sign和siglec-1在sars-cov-2感染中的功能。在一组实验中,用活sars-cov-2nluc以三种不同的感染复数(moi):0.01、0.1和1感染稳定表达dc-sign、l-sign、siglec-1或ace2的hek293t细胞。感染使用相对发光单位确定并且与hek293t细胞(亲本)中的感染进行比较。图51中示出了数据。在被测的最低moi时,观察到表达dc-sign、l-sign或siglec的细胞中的感染增加。在被测的最高moi下,与亲本相比,感染未通过dc-sign、l-sign或siglec的表达进一步增加。这些数据表明,亲本293t细胞易受sars-cov-2感染,并且l-sign、dc-sign和siglec-1增强感染水平但不作为感染的主要受体。
[0824]
在另一组实验中,用编码dc-sign、l-sign、siglec-1或ace2的慢病毒瞬时转导293t细胞、hela细胞和mrc5细胞,并在转导后三天用vsv假病毒感染。图52中示出了数据。虽然293t细胞示出低水平的易感性(将未感染的与未转导的进行比较),但hela和mrc5细胞对
所述病毒完全不应。l-sign、dc-sign或siglec-1的表达可以增加293t细胞中的低水平感染,这与这些蛋白质作为附着因子的作用一致。hela和mrc5细胞即使在表达l-sign、dc-sign或siglec-1后仍对感染保持不应,并且仅在表达ace2后才变得易感。这些数据指示,l-sign、dc-sign和siglec-1不是sars-cov-2的主要受体。
[0825]
进行了反式感染、细胞间融合和另外的感染中和测定。图71示出了使用抗体s309、s2e12和s2x333对veroe6细胞的中和。图72示出了使用相同抗体对vero e6-tmprss2细胞的中和。图75和76示出了这些抗体对各种细胞类型的感染的中和。图77-80示出了细胞间融合和融合抑制测定的结果。图81-84示出了抗体对过表达ace2、siglec1、dc-sign或l-sign的稳定hek293t细胞系的感染的中和。
[0826]
实施例15
[0827]
s309抗体以及s309和s2e12抗体的组合的体内功效
[0828]
在叙利亚仓鼠中研究s309以及s309和s2e12的组合的功效。此动物模型代表迄今为止不需要体内过表达ace2以支持生产性感染和疾病的最相关的sars-cov-2感染模型。s309的预防性施用在仓鼠中诱导了针对sars-cov-2感染和组织损伤的剂量依赖性保护,如肺中的病毒rna水平、病毒载量和组织病理学评分所证明的(图56a,左栏)。这些数据表明,当使用过表达ace2的细胞时,s309在体外对进入的不良和不完全中和不危害非rbm mab的体内功效。使用s309和s2e12抗体的组合获得了类似的结果(图56a,右栏)。
[0829]
由于与fcγ受体的结合减少,携带n297a突变的s309触发效应子功能的能力降低。这进一步由s309-n297a变体与脾脏中的仓鼠单核细胞的减少的结合证实。用n297a mab测量的体内功效与wt s309的体内功效相似或仅略差,表明在这些条件下,mab的中和能力在其效应子功能能力中占主导。将肺中的病毒rna减少90%所需的s309的血清浓度为9μg/ml(图56b,左栏)。使用s309和s2e12抗体的组合获得了类似的结果(图56b,右栏)。
[0830]
实施例16
[0831]
使用s2e12-v2抗体的另外的体内研究
[0832]
使用非人灵长类动物进行临床前研究,以评估s2e12-v2(在图99中示出为“s2e12”)的药代动力学和潜在的组织交叉反应安全性,所述s2e12-v2具有seq id no:399的vh氨基酸序列和seq id no:738的vl氨基酸序列,并且包括m428l和n434s fc突变。如图99和100中示出的,单次5mg/kg剂量的s2e12-v2 mlns具有25.4天的平均t
1/2
(在3只动物中)。组织交叉反应性研究(使用cho-cov2-s刺突、1:1的cho-cov2s刺突:cho和cho作为对照)未在1.25μg/ml、0.3125μg/ml或0.078125μg/ml下在任何组织中鉴定出s2e12-v2的交叉反应性染色。
[0833]
实施例17
[0834]
另外的中和研究
[0835]
研究了已知的sars-cov-2突变对s2e12中和效力的潜在影响。sars-cov-2s中的下列单独突变在s2e12对活sars-cov-2或sars-cov-2假病毒的中和中具有小于3倍的降低:n501y;s477n;n439k;l452r;e484k;k417n;t478k;s494p;a520s;n501t;a522s;y453f;p384l。
[0836]
实施例18
[0837]
材料与方法
[0838]
基于流式细胞术筛选与在哺乳动物细胞上表达的cov s蛋白的结合
[0839]
用sars-cov-2的s蛋白转染expicho细胞。然后通过流式细胞术以10μg/ml测试单克隆抗体对表达sars-cov-2转染子的s蛋白的expicho细胞的染色能力。
[0840]
重组sars-cov-2蛋白的瞬时表达
[0841]
genbank登录号mn908947.3的sars-cov-2菌株(2019-ncov-s)分离株的全长s基因针对人细胞表达进行密码子优化并克隆到phcmv1表达载体(genlantis公司)中。使用expifectamine cho增强剂,用phcmv1-sars-cov-2-s、phcmv1-mers-cov-s(london1/2012)、sars-刺突_pcdna.3(菌株sars)或空phcmv1(模拟)瞬时转染expi-cho细胞。转染后两天,收集、固定或用皂苷固定和透化细胞,以用一组对sars-cov受体结合结构域(rbd)具有反应性的单克隆抗体进行免疫染色。使用alexa647标记的次级抗体抗人igg fc进行检测。使用ze5细胞分析仪(伯乐公司(biorad))和flowjo软件(treestar)通过流式细胞术分析抗体与转染细胞的结合。阳性结合通过cov-s转染子与模拟转染子的差异性染色来定义。
[0842]
使用octet(bli,生物层干涉法)的竞争实验
[0843]
除非本文另外指示,否则使用抗his传感器(生物传感器抗penta-his(his1k))来固定sars-cov的s1亚基蛋白(义翘神州公司欧洲分公司(sino biological europe gmbh))。将传感器与动力学缓冲液(kb;含0.01%无内毒素bsa、0.002^tween-20、0.005%nan3的pbs)水合10分钟。然后将sars-cov s1亚基蛋白以10μg/ml的浓度上样到kb中持续8分钟。对于全长mab ncov-10和ncov-6mab,抗体以15μg/ml缔合6分钟,或者对于fab ncov-4,抗体以5μg/ml缔合6分钟,并且在随后的实验中,包括ncov-1的抗体都以10μg/ml缔合。然后将竞争抗体以相同浓度缔合另外6分钟。
[0844]
使用octet(bli,生物层干涉法)的竞争实验
[0845]
对于ace2竞争实验,将ace2-his(生物技术股份有限公司(bio-techne ag))在kb中以5μg/ml上样到抗his(his2)生物传感器(美谷分子仪器有限公司(molecular devices)-富迪生物公司(fortebio))上持续30分钟。在使用或不使用抗体(30μg/ml,30分钟)的预温育后,以1μg/ml将sars-cov-1rbd-兔fc或sars-cov-2rbd-小鼠fc(义翘神州公司欧洲分公司)缔合15分钟。监测解离5分钟。
[0846]
使用octet(bli,生物层干涉法)的亲和力确定
[0847]
对于全长抗体的kd确定,在用动力学缓冲液进行水合步骤10分钟之后,使用蛋白a生物传感器(颇尔富迪生物公司(pall fortebio))将重组抗体在2.7μg/ml下固定1分钟。通过将抗体涂覆的传感器与不同浓度的sars-cov-1rbd(义翘神州科技有限公司)或sars-cov-2rbd(内部产生;来自genbank登录号mn908947.3的sars-cov-2分离株的刺突的残基331-550)一起温育,记录缔合曲线5分钟。被测的最高rbd浓度为10ug/ml,然后以1:2.5连续稀释。通过将传感器移动到包括kb的孔中,记录解离9分钟。使用全局拟合模型(octet)计算kd值。使用octet red96(富迪生物公司)设备。
[0848]
对于全长抗体相较于fab片段的kd确定,sars-cov-1或sars-cov-2的his标记的rbd在kb中以3μg/ml上样到抗his(his2)生物传感器(美谷分子仪器有限公司,富迪生物公司)上持续15分钟。全长抗体和fab的缔合在kb中分别以15ug/ml和5ug/ml进行5分钟。在kb中测量解离10分钟。
[0849]
elisa结合
[0850]
通过酶联免疫吸附测定(elisa)确定mab与sars-cov-2刺突s1亚基蛋白(菌株wh20)蛋白质的反应性。简而言之,用3μg/ml的重组sars-cov-2刺突s1亚基蛋白(义翘神州科技有限公司)涂覆96孔板。将孔洗涤并用pbs+1%bsa在室温下封闭1小时,并且然后用连续稀释的mab在室温下温育1小时。通过将碱性磷酸酶缀合的山羊抗人igg(南部生物科技公司:2040-04)在室温下温育1小时来检测结合的mab,并通过含1mg/ml对硝基苯磷酸底物的0.1m甘氨酸缓冲液(ph 10.4)在室温下显影30分钟。在elisa读取器(powerwave 340/96分光光度计,伯腾公司)中在405nm的波长下测量光密度(od)值。
[0851]
中和测定
[0852]
除非另有指示,否则使用用sars-cov-2刺突蛋白(sars-cov-2pp)或sars-cov-1刺突蛋白(sars-cov-1pp)假型化的鼠类白血病病毒(mlv)。用ace2稳定转染的dbt细胞(dbt-ace2)用作靶细胞。用胰蛋白酶tpck以10ug/ml激活sars-cov-2pp或sars-cov-1pp。将经激活的sars-cov-2pp或sars-cov-1pp添加到抗体的稀释系列中(每种抗体的起始终浓度为50ug/ml,3倍稀释)。将dbt-ace2细胞加入到抗体-病毒混合物中,并温育48小时。在抽吸细胞培养上清液并且添加steady-glo底物(普洛麦格公司)之后测量发光。
[0853]
除非另外指示,否则假颗粒中和测定使用基于vsv的荧光素酶报告基因假型化系统(卡拉法斯特公司(kerafast))。将vsv假颗粒和抗体在dmem中混合,并在37c下温育30分钟。然后将感染混合物与vero e6细胞在37c下一起温育1小时,随后添加具有pen-strep和10%fbs的dmem(不去除感染混合物)。将细胞在37c下温育18-24小时。在添加bio-glo试剂(普洛麦格公司)之后,使用ensight酶标仪(珀金埃尔默公司(perkin elmer))测量荧光素酶。
[0854]
spr单循环动力学
[0855]
使用单循环动力学方法,用biacore t200仪器进行spr实验。s309 igg捕获在表面上,并且注射浓度逐渐增加的糖基化或去糖基化的经纯化的sars-cov-2rbd。监测缔合和解离动力学并且将其拟合到结合模型以确定亲和力。
[0856]
重组抗体的表达
[0857]
重组抗体在与表达如先前所描述的重链和轻链的质粒瞬时共转染的expicho细胞中表达(stettler等人(2016)寨卡病毒感染引发的抗体的特异性、交叉反应性和功能(specificity,cross-reactivity,and function of antibodies elicited by zika virus infection.)《科学》,353(6301),823-826)。单克隆抗体s303、s304、s306、s309、s310和s315被表达为rigg-ls抗体。ls突变赋予更长的体内半衰期(zalevsky等人(2010)增强的抗体半衰期提高了体内活性(enhanced antibody half-life improves in vivo activity.)《自然生物技术》,28(2),157-159)。
[0858]
序列比对
[0859]
使用“完全(》29,000bp)”和“低覆盖率排除”过滤器于2020年3月29日从gisaid下载了sars-cov-2基因组序列。去除蝙蝠和穿山甲序列以得到仅人类序列。通过用genewise2进行参比蛋白(yp_009724390.1)-基因组比对来定位刺突orf。挽救了不完全匹配和包括插入缺失的orf,并将其纳入下游分析。使用seqkit通过计算机模拟翻译核苷酸序列。具有超过10%未确定氨基酸的序列(由于n次碱基调用)被去除。使用mafft进行多序列比对。通过使用r/bioconductor软件包biostrings将比对序列(n=2,229)与参比序列进行比较来确
定变体。使用类似的策略从源自vipr的sars-cov基因组中提取刺突蛋白序列并翻译所述刺突蛋白序列(搜索标准:sars相关冠状病毒,全长基因组,人类宿主,在2019年12月之前保藏以排除sars-cov-2,n=53)。来源的sars-cov基因组序列包括所有主要公开的菌株,如urbani、tor2、tw1、p2、frankfurt1等。如tsan-yuk lam等人所示的穿山甲序列来源于gisaid。如lu等人(《柳叶刀(lancet)》2020)所示的来自沙贝病毒的三个进化枝的蝙蝠序列来源于genbank。麝猫和貉序列类似地来源于genbank。
[0860]
细胞系的稳定过表达的产生
[0861]
通过用编码dc-sign(cd209)、l-sign(clec4m)、siglec1、tmprss2或ace2的慢病毒表达质粒(全部从genecopoeia获得)和相应的慢病毒辅助质粒共转染lenti-x293t细胞(宝生物(takara))来产生慢病毒。转染后四十八小时,采集上清液中的慢病毒,并通过在20,000rpm下超速离心2小时来浓缩。lenti-x 293t(宝生物)、vero e6(atcc)、mrc5(西格玛奥德里奇公司)、a549(atcc)在存在6ug/ml聚凝胺(密理博公司(millipore))的情况下转导24小时。随后对过表达两种转基因的细胞系进行转导。转导后两天开始用嘌呤霉素和/或杀稻瘟菌素(吉博科公司(gibco))进行选择,并将选择试剂保存在生长培养基中以进行所有后续培养。单细胞克隆衍生自a549-ace2-tmprss2细胞系,所有其它细胞系代表细胞池。
[0862]
sars-cov-2中和
[0863]
将在补充有10%fbs(vwr)和1x青霉素/链霉素(赛默飞世尔科技公司)的dmem中培养的vero e6或vero e6-tmprss2细胞以20,000个细胞/孔接种在黑色96孔板中。将单克隆抗体的连续1:4稀释液与200pfu的sars-cov-2(分离株usa-wa1/2020,传代3,在vero e6细胞中传代)在37℃下于bsl-3设施中一起温育30分钟。去除细胞上清液,并将病毒-抗体混合物添加到细胞中。感染后24小时,用4%多聚甲醛固定细胞30分钟,随后用pbs(ph 7.4)洗涤两次,并用含0.25%triton x-100的pbs透化30分钟。在5%奶粉/pbs中封闭30分钟后,将细胞与靶向sars-cov-2核衣壳蛋白的初级抗体(义翘神州科技有限公司,目录号40143-r001)以1:2000稀释1小时。在洗涤并与和1ug/ml赫斯特33342混合的次级alexa647标记的抗体一起温育1小时后,在自动细胞成像读取器(cytation 5,伯腾公司)上对板进行成像,并使用制造商提供的软件对核衣壳阳性细胞进行计数。
[0864]
sars-cov-2-nluc中和
[0865]
使用编码纳米荧光素酶的sars-cov-2(基于菌株2019-ncov/usa_wa1/2020)的感染性克隆sars-cov-2-nluc代替病毒orf7确定中和,所述感染性克隆显示出与野生型病毒相当的生长动力学(xie等人,《自然通讯(nat comm.)》,2020,https://doi.org/10.1038/s41467-020-19055-7)。将细胞以20,000个细胞/孔接种到黑壁、底部透明的96孔板中(将293t细胞以35,000个细胞/孔接种到聚-l-赖氨酸涂覆的孔中),并在37℃下培养过夜。第二天,在感染培养基(dmem+10%fbs)中制备抗体的9点4倍连续稀释液。将sars-cov-2-nluc在感染培养基中以指定的moi稀释,添加到抗体稀释液中,并在37℃下温育30分钟。从细胞中去除培养基,添加mab-病毒复合物,并将细胞在37℃下温育24小时。从细胞中去除培养基,根据制造商的建议添加nano-glo荧光素酶底物(普洛麦格公司),在室温下温育10分钟,并在victor nivo酶标仪(珀金埃尔默公司)上对荧光素酶信号进行定量。
[0866]
sars-cov-2假型化的vsv产生和中和
[0867]
为了产生sars-cov-2假型化的水疱性口炎病毒,将lenti-x 293t细胞(宝生物)接
种在10cm培养皿中以第二天汇合80%。第二天,根据制造商的说明,使用transit-lenti(mirus bio公司)用编码携带c末端19aa截短的sars-cov-2s-糖蛋白(yp_009724390.1)的质粒转染细胞。转染后一天,用vsv(g*δg-荧光素酶)(卡拉法斯特公司)以3个感染单位/细胞的moi感染细胞。一小时后洗去病毒接种物,并将细胞在37℃下再温育一天。在转染后第2天收集包括sars-cov-2假型化的vsv的细胞上清液,以1000x g离心5分钟以去除细胞碎片、等分并在-80℃下冷冻。
[0868]
对于病毒中和,将细胞以20,000个细胞/孔接种到黑壁、底部透明的96孔板中(将293t细胞以35,000个细胞/孔接种到聚-l-赖氨酸涂覆的孔中),并在37℃下培养过夜。第二天,在培养基中制备抗体的9点4倍连续稀释液。在存在100ng/ml抗vsv-g抗体(克隆8g5f11,绝对抗体)的情况下在培养基中以1:30稀释sars-cov-2假型化的vsv,并以1:1添加到每种抗体稀释液中。将病毒:抗体混合物在37℃下温育1小时。从细胞中去除培养基并向细胞中添加50μl病毒:抗体混合物。感染后一小时,将100μl培养基添加到所有孔中,并在37℃下温育17-20小时。去除培养基,并将50μl bio-glo试剂(普洛麦格公司)添加到每个孔中。在室温下以300rpm在板振荡器上振荡板持续15分钟,并在ensight酶标仪(珀金埃尔默公司)上读取rlu。
[0869]
基于转染的附着受体筛选
[0870]
将lenti-x 293t细胞(宝生物)用编码下列受体候选物(全部购自genecopoeia)的质粒转染:ace2(nm_021804)、dc-sign(nm_021155)、l-sign(bc110614)、lgals3(nm_002306)、siglec1(nm_023068)、siglec3(xm_057602)、siglec9(bc035365)、siglec10(nm_033130)、mgl(nm_182906)、mincle(nm_014358)、cd147(nm_198589)、asgr1(nm_001671.4)、asgr2(nm_080913)、nrp1(nm_003873)。转染后一天,在37℃下,在存在100ng/ml抗vsv-g抗体(克隆8g5f11,绝对抗体)的情况下,用1:20稀释的sars-cov-2假型化的vsv感染细胞。感染后一小时,将100μl培养基添加到所有孔中,并在37℃下温育17-20小时。去除培养基,并将50μl bio-glo试剂(普洛麦格公司)添加到每个孔中。在室温下以300rpm在板振荡器上振荡板持续15分钟,并在ensight酶标仪(珀金埃尔默公司)上读取rlu。
[0871]
反式感染
[0872]
将亲本hela细胞或稳定表达dc-sign、l-sign或siglec1的hela细胞以每孔5,000个细胞接种在黑壁、底部透明的96孔板中。一天后,细胞达到约50%汇合,并在37℃下在存在100ng/ml抗vsv-g抗体(克隆8g5f11,绝对抗体)的情况下接种以1:10稀释的sars-cov-2假型化的vsv持续2小时。对于抗体介导的反式感染抑制,将细胞用10ug/ml抗siglec1抗体(百进生物公司(biolegend),克隆7-239)预温育30分钟。接种2小时后,用完全培养基将细胞洗涤四次,并且每孔添加10,000个veroe6-tmprss2细胞,并在37℃下温育17-20小时以进行反式感染。去除培养基,并向每个孔中加入50μl bio-glo试剂(普洛麦格公司)。在室温下以300rpm在板振荡器上振荡板持续15分钟,并在ensight酶标仪(珀金埃尔默公司)上读取rlu。
[0873]
cho-s细胞的细胞间融合
[0874]
将稳定表达sars-cov-2s-糖蛋白的cho细胞以12,500个细胞/孔接种在96孔板中以进行显微镜检查(赛默飞世尔科技公司),并且第二天向细胞中添加不同浓度的mab和细胞核标志物赫斯特(最终稀释度1:1000),并温育另外24小时。使用cytation 5成像仪(伯腾
公司)确定融合度,并使用对象检测方案将细胞核作为对象进行检测并测量其大小。发现融合的细胞(即合胞体)的细胞核聚集在合胞体的中心处,并将其识别为根据其大小门控的独特大对象。融合的细胞中对象的面积除以所有对象的总面积乘以100提供了融合的细胞的百分比。
[0875]
免疫荧光分析
[0876]
将hek 293t细胞接种到聚-d-赖氨酸涂覆的96孔板(西格玛奥德里奇公司)上,并且在用4%多聚甲醛接种30分钟后固定24小时,随后用pbs(ph 7.4)洗涤两次,并用含0.25%triton x-100的pbs透化30分钟。将细胞与初级抗体dc-sign/l-sign(百进生物公司,目录号845002,1:500稀释)、抗dc-sign(细胞信号传导公司(cell signaling),目录号13193s,1:500稀释)、抗siglec1(百进生物公司,目录号346002,1:500稀释)或抗ace2(r&d系统公司(r&d systems),目录号af933,1:200稀释)在室温下在3%奶粉/pbs中稀释2小时。在洗涤并与和1ug/ml赫斯特33342混合的次级alexa647标记的抗体一起温育1小时后,在倒置荧光显微镜(echo revolve)上对板进行成像。
[0877]
ace2/tmprss2 rt-qpcr
[0878]
根据制造商的方案,使用nucleospin rna加试剂盒(马切雷-内格尔公司(macherey-nagel))从细胞中萃取rna。根据制造商的说明,使用高容量cdna逆转录试剂盒(应用生物系统公司(applied biosystems))对rna进行逆转录。根据制造商的方案,使用luna通用qpcr主混合物(新英格兰生物实验室(new england biolabs))对ace2(正向引物:caagagcaaacggttgaacac,反向引物:ccagagcctctcattgtagtct)、hprt(正向引物:cctggcgtcgtgattagtg,反向引物:acaccctttccaaatcctcag)和tmprss2(正向引物:caagtgctccractctgggat,反向引物:aacacaccgrttctcgtcctc)的细胞内水平进行定量。使ace2和tmprss2水平相对于hprt归一化。hela细胞被用作参比样品。所有qpcr都在quantstudio 3实时pcr系统(应用生物系统公司)上运行。
[0879]
sars2 d614g刺突产生和生物素化
[0880]
使用293转染素作为转染试剂,将融合前稳定的sars2 d614g刺突(包括氨基酸序列q14至k1211)转染到hek293自由式细胞中,所述刺突具有c末端tev切割位点、t4噬菌体纤维蛋白折叠子、8x his-、avi-和epea-标签。将细胞在37℃下放置三天以产生蛋白质。之后,通过在500xg下离心细胞30分钟,随后在4000xg下再旋转30分钟来采集上清液。通过0.2um过滤器过滤细胞培养物上清液,并将其上样到5ml c-标签亲和基质柱上,用50mm tris ph 8和200mm nacl预平衡。使用10个柱体积的100mm tris、200mm nacl和3.8mm sepea肽洗脱sars2 d614g刺突。使用50mm tris ph 8和200mm nacl作为运行缓冲液,浓缩洗脱峰并注射到superose 6增加10/300gl凝胶过滤柱上。收集对应于单分散sars2 d614g刺突的sec级分,并在液氮中快速冷冻以储存在-80℃下。使用来自avidity的bira500生物素化试剂盒对经纯化的sars2 d614g刺突蛋白进行生物素化。向50ug的刺突蛋白中添加5ug的bira和11ul的biomixa和biomixb。生物素化反应过程中最终的刺突蛋白浓度为约1um。使反应在4℃下进行16小时。然后,使用用1x pbs ph 7.4预平衡的两个zeba旋转柱对蛋白质进行脱盐。
[0881]
dc-sign、l-sign、siglec1和ace-2的流式细胞术分析
[0882]
将表达dc-sign、l-sign、siglec1或ace2的hek 293t细胞以4x106细胞/ml重新悬浮,并以每孔100μl接种于v底96孔板(康宁公司(corning),3894)上。将板以2,000rpm离心5
分钟并用pbs(ph 7.4)洗涤。将细胞重新悬浮于200μl包括ghost violet 510活性染料(细胞信号传导公司,目录号13-0870-t100,1:1,000稀释)的pbs中,在冰上温育15分钟并且然后洗涤。将细胞重新悬浮于100μl用含0.5%bsa(西格玛奥德里奇公司)的pbs制备的facs缓冲液中,所述缓冲液包括在1:100稀释度下的初级抗体:小鼠抗dc/l-sign(百进生物公司,目录号845002)、兔抗dc-sign(细胞信号传导公司,目录号13193)、小鼠抗siglec1(百进生物公司,目录号346002)或山羊抗ace2(r&d系统公司,目录号af933)。在冰上温育1小时后,将细胞洗涤两次并重新悬浮于facs缓冲液中,所述缓冲液包括在1:200稀释度下的alexa fluor-488标记的次级抗体:山羊抗小鼠(英杰公司(invitrogen),目录号a11001)、山羊抗兔(英杰公司,目录号a11008)或驴抗山羊(英杰公司,目录号a11055)。在冰上温育45分钟后,将细胞用200μl facs缓冲液洗涤三次,并用200μl 4%pfa(阿法埃莎公司(alfa aesar))在室温下固定15分钟。将细胞洗涤三次,重新悬浮于200μl facs缓冲液中,并使用cytoflex流式细胞仪(贝克曼库尔特公司(beckman coulter))通过流式细胞术进行分析。
[0883]
sars-cov-2刺突和rbd与细胞结合的流式细胞术
[0884]
将生物素化的sars-cov-2刺突d614g蛋白(刺突生物素,内部产生)或生物素化的sars-cov-2刺突受体结合结构域(rbd生物素,义翘神州科技有限公司,40592-v08b)与alexa647链霉亲和素(af647-strep,英杰公司,s21374)以1:20的体积比在室温下一起温育20分钟。然后将标记的蛋白质储存在4℃下直到进一步使用为止。用trple express(吉博科公司,12605-010)解离细胞,并将105个细胞转移到96孔v底板(康宁公司,3894)的每个孔中。在流式细胞术缓冲液(含2%fbs的pbs(不具有ca/mg))中将细胞洗涤两次,并用最终浓度为20μg/ml的刺突生物素-af647-strep或最终浓度为7.5μg/ml的rbd生物素-af647-strep在冰上染色1小时。用流式细胞术缓冲液洗涤染色的细胞两次,重新悬浮于1%pfa(电子显微镜科学公司(electron microscopy sciences),15714-s)中,并用cytoflex lx(贝克曼库尔特公司)分析。
[0885]
sars-cov-2特异性mab的重组表达:
[0886]
如先前所描述的,从sars-cov-2免疫供体的浆细胞或记忆b细胞中分离出人mab。重组抗体在37℃和8%co2下在expicho细胞中表达。使用expifectamine转染细胞。转染1天后,用expicho补料和expifectamine cho增强剂补充经转染的细胞。转染后八天收集细胞培养上清液,并通过0.2μm过滤器过滤。使用5ml hitrap
tm
mabselect
tm
prisma柱在xpress fplc装置上亲和纯化重组抗体,随后使用hiprep 26/10脱盐柱对组氨酸缓冲液(20mm组氨酸,8%蔗糖,ph 6)进行缓冲液交换。
[0887]
仓鼠sars-cov-2感染模型
[0888]
病毒制备
[0889]
本研究中使用的sars-cov-2菌株βcov/belgium/ghb-03021/2020(epi isl 109 407976|2020-02-03)取自一名经rt-qpcr确诊的无症状患者的鼻咽拭子。通过系统发育分析证实了与原型sars-cov-2分离株(genbank登录号112编号mn908947.3)菌株的密切关系。通过在huh7和vero e6细胞上连续传代来分离感染性病毒;传代6病毒用于本文所描述的研究。通过reed和muench方法在vero e6细胞上进行终点稀释来确定病毒原液的滴度。
[0890]
细胞
[0891]
vero e6细胞(非洲绿猴肾,atcc crl-1586)在补充有10%胎牛血清(integro公
司)、1%l-谷氨酰胺(吉博科公司)和1%碳酸氢盐(吉博科公司)的最低必需培养基(吉博科公司)中培养。用含2%而非10%的胎牛血清的培养基进行终点滴定。
[0892]
仓鼠sars-cov-2感染模型
[0893]
以前已经描述了sars-cov-2的仓鼠感染模型。以下示意图中示出了具体的研究设计。简而言之,野生型叙利亚金黄仓鼠(黄金仓鼠(mesocricetus auratus))购自扬维尔实验室(janvier laboratories),并且每两只一组圈养在通风隔离笼(isocage n生物控制系统,tecniplast)中,可随意获取食物和水并进行笼富集(木块)。在研究开始前,使动物适应环境4天。鲁汶大学动物实验伦理委员会(the ethics committee of animal experimentation of ku leuven)批准了饲养条件和实验程序(许可证p065-2020)。用氯胺酮/甲苯噻嗪/阿托品(atropine)麻醉6-8周龄雌性仓鼠并鼻内接种50μl含2
×
106tcid50的sars-cov-2(第0天)。
[0894]
治疗方案
[0895]
在感染前48小时,通过腹膜内施用(i.p.)对动物进行预防性处理,并监测其外观、行为和体重。在感染后(p.i.)第4天,通过i.p.注射500μl dolethal(200mg/ml戊巴比妥钠,v
é
toquinol sa)对仓鼠实施安乐死。收集肺并分别通过rt-qpcr和终点病毒滴定来定量病毒rna和感染性病毒。感染前采集血液样品以进行pk分析。
[0896]
sars-cov-2rt-qpcr
[0897]
使用珠破碎(precellys)使收集的肺组织在350μl rlt缓冲液(rneasyminikit,凯杰公司(qiagen))中均质化,并离心(10.000rpm,5分钟)以沉淀细胞碎片。根据制造商的说明提取rna。在50μl洗脱液中,4μl用作rt-qpcr反应中的模板。使用itaq通用探针一步rt-qpcr试剂盒(伯乐公司(biorad))在lightcycler96平台(罗氏公司(roche))上进行rt-qpcr,所述试剂盒具有n2引物和靶向核衣壳的探针。sars-cov-2cdna(idt)标准用于表达每mg组织或每ml血清的病毒基因组拷贝。
[0898]
终点病毒滴定
[0899]
使用珠破碎(precellys)使肺组织在350μl最低必需培养基中均质化,并离心(10,000rpm,5分钟,4℃)以沉淀细胞碎片。为了定量感染性sars-cov-2颗粒,在96孔板中对汇合的vero e6细胞进行终点滴定。使用lindenbach计算器通过reed和muench方法计算病毒滴度,并表示为每mg组织的50%组织培养感染剂量(tcid50)。
[0900]
组织学
[0901]
为了进行组织学检查,将肺在4%甲醛中固定过夜,并包埋在石蜡中。在用苏木精和伊红染色后分析组织切片(5μm),并由专业病理学家对肺损伤进行盲法评分。累积评分为1至3的评分参数如下:充血、肺泡内出血、支气管壁中的凋亡小体、坏死性细支气管炎、血管周围水肿、支气管肺炎、血管周围炎症、支气管周围炎症和血管炎。
[0902]
免疫复合物与仓鼠单核细胞的结合
[0903]
通过使用精确的摩尔比(分别为4:8:1)将s309 mab(仓鼠igg,wt或n297a)与生物素化的抗独特型fab片段和alexa-488-链霉亲和素复合来产生免疫复合物(ic)。预先产生的荧光ic被连续稀释,在4℃下与新鲜再生的仓鼠脾细胞一起温育3小时,所述仓鼠脾细胞从未经处理的动物获得。然后在排除死细胞和对单核细胞群体进行物理门控后,通过细胞计数法评估细胞结合。结果表示为整个单核细胞群体的alexa-488平均荧光强度。
[0904]
生物信息学分析
[0905]
从github(github.com/krasnowlab/hlca)下载经处理的人肺细胞图谱(hlca)数据和细胞类型注释。从ncbi geo数据库(id:gse158055)和github(github.com/zhangzlab/covid_balf)下载来自经sars-cov-2感染的个体的肺上皮细胞和免疫细胞的经处理的单细胞转录组数据和注释。从ncbi sra(id:prjna608742)下载liao等人的第二单细胞转录组学研究的可用序列数据以检查对应于病毒rna的读段。通过对支持前导序列-trs接合点的含trs的读段进行计数来估计sgrna相对于基因组rna的比例。用于检测前导序列-trs接合点读段的标准和方法改编自alexandersen等人。病毒基因组参比和trs注释基于genbank登录号mn908947.3的sars-cov-2分离株nc_045512.2/mn908947
49
。只有2份来自患有重度covid-19的个体的样品具有可检测的前导序列-trs接合点读段(srr11181958,srr11181959)。
[0906]
可以将上文所描述的各种实施方式进行组合以提供进一步实施方式。本说明书中引用的和/或申请数据表中列出的所有美国专利、美国专利申请公开、美国专利申请、外国专利、外国专利申请和非专利公开以全文引用的方式并入本文,包括于2020年5月8日提交的美国专利申请第63/022,392号、于2020年5月13日提交的美国专利申请第63/024,372号、于2020年5月20日提交的美国专利申请第63/027,814号、于2020年5月22日提交的美国专利申请第63/029,338号、于2020年5月28日提交的美国专利申请第63/031,286号、于2020年6月1日提交的美国专利申请第63/033,045号、于2020年6月9日提交的美国专利申请第63/036,683号、于2020年6月16日提交的美国专利申请第63/039,939号、于2020年6月30日提交的美国专利申请第63/046,465号、于2020年7月28日提交的美国专利申请第63/057,767号、于2020年10月12日提交的美国专利申请第63/090,667号、于2020年11月13日提交的美国专利申请第63/113,450号、于2021年2月25日提交的美国专利申请第63/153,784号以及于2021年4月2日提交的美国专利申请第63/170,368号。如果需要可以修改实施方式的各方面,以采用各种专利、申请和出版物的概念来提供又进一步的实施方式。
[0907]
鉴于以上详细描述,可以对实施方式做出这些和其它改变。通常,在以下权利要求中,所用术语不应被解释为将权利要求限于本说明书和权利要求中所公开的特定实施方式,而应被解释为包括所有可能的实施方式以及这些权利要求所有权获得的等效物的全部范围。相应地,权利要求书并不受到本公开的限制。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1