特应性皮炎的重症度的检测方法与流程
1.本发明涉及一种使用特应性皮炎的重症度标记的特应性皮炎的重症度的检测方法。
背景技术:
2.特应性皮炎(以下也称为“ad”)是主要在具有特应性体质的人中发病的湿疹性皮肤疾病。特应性皮炎的典型症状是左右对称性发生的慢性和反复性的瘙痒、皮疹、红斑等、以及角质化不全、屏障功能下降、肌肤干燥等。特应性皮炎多在婴幼儿中发病,随着成长表现出好转的倾向,但近年来,成人型或难治性的特应性皮炎也在增加。
3.对于是否患有特应性皮炎或其重症度,通过皮肤的目测观察或皮肤表面的图像分析,能够在某种程度上进行评价。另外,作为能够客观地判断特应性皮炎的重症度的方法,最近使用了以血中的tarc(thymus and activation-regulated chemokine、胸腺和活化调节趋化因子)值或scca2(squamous cell carcinoma antigen 2、鳞状细胞癌抗原2)值为指标的检查方法。它们作为灵敏地反映特应性皮炎的病情的指标使用,不仅用于对是否患有特应性皮炎或其重症度进行评价,也用于确定患者的教育或治疗方针(参照非专利文献1、2、3)。
4.然而,以血中的tarc值或scca2值为指标的检查方法需要采血,因此是侵入性的方法。还存在出结果需要时间等技术问题。
5.另一方面,已开发了通过分析生物试样中的dna或rna等核酸来考查人的生物体内的现在乃至将来的生理状态的技术。使用核酸的分析具有如下的优点:确立了全面的分析方法,通过一次分析就能够获得丰富的信息,并且基于与单核苷酸多态性或rna功能等有关的多个研究报告,容易对分析结果进行功能性关联。来自生物体的核酸可以从血液等体液、分泌物、组织等中提取,最近报告了将皮肤表面脂质(skin surface lipids;ssl)所含的rna用作生物体分析用的试样,利用ssl能够检测表皮、汗腺、毛囊和皮脂腺的标记基因(专利文献1)。还报告了利用ssl能够检测特应性皮炎的标记基因(专利文献2)。
6.〔专利文献1〕国际公开公报第2018/008319号
7.〔专利文献2〕日本特开2020-74769号公报
8.〔非专利文献1〕sugawara et al.,allergy(2002)57:180-181:
9.〔非专利文献2〕ohta et al.,ann clin biochem.(2012)49:277-84
10.〔非专利文献3〕加藤等,日皮会刊(2018)128:2431-2502
技术实现要素:
11.本发明涉及以下的1)~4)。
12.1)一种被检验者的特应性皮炎的重症度的检测方法,其中,包括对于从该被检验者采集的生物试样,测定选自由capn1、ncor2、ppp1r9b、plp2、grn、ppp1r12c、loc146880、slc31a1和syvn1构成的9种基因群中的至少1种基因或其表达产物的表达水平的工序。
13.2)来自从被检验者采集的生物试样的选自由capn1、ncor2、ppp1r9b、plp2、grn、ppp1r12c、loc146880、slc31a1和syvn1构成的9种基因群中的至少1种基因或其表达产物在作为特应性皮炎的重症度标记中的用途。
14.3)一种能够在1)的方法中使用的用于检测特应性皮炎的重症度的检查用试剂盒,其中,含有:与上述基因特异性地杂交的寡核苷酸、或识别上述基因的表达产物的抗体。
15.4)一种特应性皮炎的重症度的检测标记,其中,由选自由capn1、ncor2、ppp1r9b、plp2、grn、ppp1r12c、loc146880、slc31a1和syvn1构成的9种基因群中的至少1种基因或其表达产物构成。
具体实施方式
16.本发明涉及提供一种用于检测特应性皮炎的重症度的标记和使用该标记的特应性皮炎的重症度的检测方法。
17.本发明的发明人从重症度不同的特应性皮炎患者和健康人采集ssl,将ssl中所含的rna的表达状态作为序列信息进行了全面分析,结果发现特定的基因的表达水平在重症度不同的患者间和健康人之间显著不同,将其作为指标,能够检测特应性皮炎的重症度。
18.根据本发明,能够简便且非侵入性地在早期高精度且客观地检测特应性皮炎的重症度。
19.关于本说明书中所引用的全部专利文献、非专利文献和其它的出版物,其全部在本说明书中作为参考而被引用。
20.在本说明书中,“核酸”或“多核苷酸”这样的术语是指dna或rna。cdna、基因组dna和合成dna都包含在dna中,总rna(total rna)、mrna、rrna、trna、非编码rna(non-coding rna)和合成rna都包含在“rna”中。
21.在本说明书中,“基因”是指,除了含有人基因组dna的双链dna以外,还包含含有cdna的单链dna(正链)、具有与该正链互补的序列的单链dna(互补链)和它们的片段,并且在构成dna的碱基的序列信息中,包含某种生物学信息。
22.另外,该“基因”不只是特定的碱基序列所示的“基因”,而且包含它们的同族体(即同源物或直系同源物)、基因多态性等突变体和编码衍生物的核酸。
23.本说明书中所公开的基因名称基于ncbi([www.ncbi.nlm.nih.gov/])所记载的官方代号(official symbol)。
[0024]
在本发明中,基因的“表达产物”是包含基因的转录产物和翻译产物的概念。“转录产物”为从基因(dna)转录生成的rna,“翻译产物”是指基于rna翻译合成的被基因编码的蛋白质。
[0025]
在本发明中,“特应性皮炎”指反复恶化和缓解并以瘙痒性湿疹为主要病原的疾病,其患者大多具有特应性体质。作为特应性体质,可以列举:i)家族史和既往史(支气管哮喘、过敏性鼻炎和结膜炎、特应性皮炎中的任意种或多种疾病);或ii)容易产生ige抗体的体质。
[0026]
在本发明中,“特应性皮炎的重症度”是指特应性皮炎发展的程度,根据皮疹的状态,例如可以分为无症状、轻微、轻症(轻度)、中度症状(中等度)、重症(重度)。
[0027]
作为皮疹的性状,可以列举红斑、浮肿/浸润/丘疹(充实性、浆液性)、渗出液/痂
皮、抓破痕、苔癣化、干燥、瘙痒、痒疹结节、鳞屑(糠秕状、叶状、膜样等)、水疱、脓疱、糜烂、溃疡等,作为重症度分类,例如除了湿疹面积和严重程度指数(eczema area and severity index)(“easi”<exp dermatol,2001;10:11-18.>)、研究者总体评估(investigator's global assessment)(“iga”<j am acad dermatol,2016;74:288-94.>)以外,已知还有日本皮肤科学会特应性皮炎重症度分类研究委员会的特应性皮炎重症度分类(日皮会刊<2001;111:2023-2033、日皮会刊,1998;108:1491-1496.>)、特应性皮炎严重程度评分(severity coring of atopic dermatitis)(“scorad”<dermatology,1993;186:23-31.>等。
[0028]
例如,easi是将头颈部、躯干、上肢、下肢作为评价部位,基于各评价部位的红斑、浮肿/浸润/丘疹、抓破痕、苔癣化4种症状的分别评分和上述4种症状的面积占评价部位整体的百分比(%)算出的0~72的值。
[0029]
另外,在iga中,作为评价者的医生或研究者对于全身或特定的评价部位,综合评价皮疹的状态,给予“无症状”、“轻微”、“轻度”、“中等度”和“重度”五个等级的评价。其中,有时也形成包括“最重症”的六个等级。iga的评分可以按照“无症状=0”、“轻微=1”、“轻度=2”、“中等度=3”、“重度=4”和“最重症=5”等顺序尺度进行转换后使用。
[0030]
在本发明的特应性皮炎的重症度的检测中,可以进行“无症状”、“轻度”、“中等度”和“重度”的检测,优选进行“无症状”、“轻度”和“中等度”的检测。
[0031]
在本发明中,“轻度”指以干燥和轻度的红斑、鳞层等为主体的病情,相当于easi评分大于0且小于6,或者iga评分为2。另外,“中等度”指以达到中等度的红斑、鳞层、少量丘疹、抓破痕等为主体的病情,相当于easi评分为6以上且小于23,或者iga评分为3,“重度”指以伴随高度的肿胀/浮肿/浸润或苔癣化的红斑、丘疹大量发生、高度鳞屑、痂皮附着、小水疱、糜烂、大量抓破痕、痒疹结节等为主体的病情,相当于easi评分为23以上且72以下,或者iga评分为4。另外,“无症状”是指缓解或基本缓解,没有症状,与健康人相同的水平。
[0032]
另外,在使用easi评分或iga评分的“无症状”、“轻度”、“中等度”和“重度”的评价中,各评价基准的评分范围并不限于上述数值,可以适当确定。
[0033]
在本发明中,特应性皮炎的重症度的“检测”是指明确特应性皮炎的重症度,也可以用检查、测定、判定或评价支援这样的术语替换。其中,在本发明中,“检测”、“检查”、“测定”、“判定”或“评价”这样的术语不包括医生对特应性皮炎的重症度的诊断。
[0034]
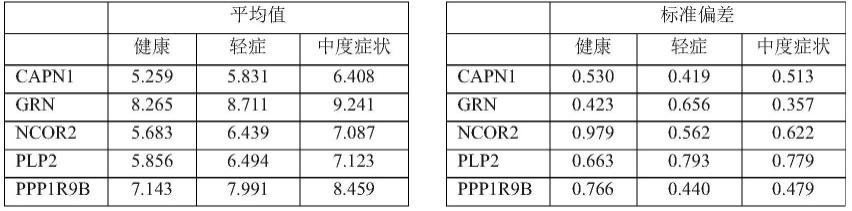
如后述的实施例所示,对于健康人14名、以及依据easi的重症度诊断为轻症(评分:大于0且小于6)的18名和判断为中度症状(评分:6以上且小于23)的11名、计29名的特应性皮炎患者,按照以下的1)~2)的步骤进行了rna表达分析,capn1、grn、ncor2、plp2、ppp1r9b这五种基因重症度依赖性地增加了。
[0035]
1)取得从健康人14名、特应性皮炎患者(成人)29名的ssl中提取的rna的表达量数据(read count值)。
[0036]
2)将read count值转换成对样品间的总read数的差异进行校正得到的rpm值,将其加上整数1得到的rpm+1值转换成以2为底的对数值,基于该值(log2(rpm+1)值),在3组间(健康人、轻症患者和中度症状患者)进行利用tukey法的检验,选择健康人对轻症患者、轻症患者对中度症状患者、健康人对中度症状患者中p值全部小于0.1的基因。
[0037]
其中,“p值(p value)”表示在统计学检验中,在零假设之下,实际能够观测到比根
据数据计算得到的统计量更极端的统计量的概率。因此可以认为,“p值”越小,比较对象间越存在显著性差异。
[0038]
另外,对于健康人14名、以及利用面部的iga、根据0(无症状)、1(轻微)、2(轻症)、3(中度症状)、4(重症)五个等级的综合评价、诊断为轻症的17名和判断为中度症状的12名、计29名的特应性皮炎患者,与上述同样按照1)~2)的步骤进行了rna表达分析,loc146880、ppp1r12c、syvn1这三种基因重症度依赖性地增加,slc31a1重症度依赖性地减少了。
[0039]
因此,选自由capn1、ncor2、ppp1r9b、plp2、grn、ppp1r12c、loc146880、slc31a1和syvn1构成的9种基因群中的基因或其表达产物能够作为用于检测特应性皮炎的重症度的特应性皮炎的重症度的检测标记。
[0040]
这样的9种基因能够分别单独作为特应性皮炎的重症度检测标记,也能够将2种以上组合使用。
[0041]
优选为了基于easi检测特应性皮炎的重症度,在上述9种基因中,从capn1、ncor2、ppp1r9b、plp2和grn这五种基因中选择检测标记。为了基于iga检测特应性皮炎的重症度,在上述9种基因中,从ppp1r12c、loc146880、slc31a1和syvn1这四种基因中选择检测标记。
[0042]
另外,这样的9种基因是迄今为止都没有报告过与特应性皮炎的重症度的关系的新型的特应性皮炎的重症度判定标记。
[0043]
另外,只要能够作为用于检测特应性皮炎的重症度的生物标记,上述的能够作为特应性皮炎的重症度检测标记的基因(以下也称为“靶标基因”)也包含具有与构成该基因的dna的碱基序列实质上相同的碱基序列的基因。其中,实质上相同的碱基序列是指,例如在使用同一性计算算法ncbi blast,在期待值=10;允许空位(gap);过滤=on;匹配评分=1;不匹配评分=-3的条件下进行检索的情况下,具有与构成该基因的dna的碱基序列90%以上、优选95%以上、更优选98%以上、进一步优选99%以上的同一性。
[0044]
本发明的特应性皮炎的重症度的检测方法包括:对于从被检验者采集的生物试样,测定靶标基因、作为一个方式的选自由capn1、ncor2、ppp1r9b、plp2、grn、ppp1r12c、loc146880、slc31a1和syvn1构成的9种基因群中的至少1种基因或其表达产物的表达水平的工序。
[0045]
在本发明的特应性皮炎的重症度的检测方法中,被检验者的性别、年龄和人种等没有特别限定,婴儿到老人都能包括在内。优选该被检验者为需要或希望检测特应性皮炎的重症度的人。例如,该被检验者为患有特应性皮炎的人、疑似患有特应性皮炎的人或具有特应性皮炎的遗传体质的人。
[0046]
作为本发明中使用的生物试样,只要是根据特应性皮炎的重症度,本发明的基因发生表达变化的组织和生物材料即可。具体可以列举脏器、皮肤、血液、尿、唾液、汗、角质层、皮肤表面脂质(ssl)、组织浸出液等体液、由血液制备的血清、血浆、其它、大便、毛发等,优选列举皮肤、角质层或皮肤表面脂质(ssl),更优选皮肤表面脂质(ssl)。作为采集ssl的皮肤部位,没有特别限定,可以列举头、面部、颈、躯干、手足等身体的任意部位的皮肤,优选皮脂分泌多的部位、例如头或面部的皮肤,更优选面部的皮肤。另外,采集ssl的皮肤部位可以是特应性皮炎发病的皮疹部,也可以是没有发病的无疹部,优选皮疹部或皮疹部附近的无疹部。在此,皮疹部附近指与皮疹部相邻的10cm以内的范围。
[0047]
其中,“皮肤表面脂质(ssl)”是指存在于皮肤的表面上的脂溶性成分,有时也称为
皮脂。一般而言,ssl主要包含由位于皮肤的皮脂腺等外分泌腺分泌的分泌物,以覆盖皮肤表面的薄层的形式存在于皮肤表面上。ssl含有在皮肤细胞中表达的rna(参照上述专利文献1)。另外,在本说明书中,“皮肤”没有特别限定,是包括角质层、表皮、真皮、毛囊以及汗腺、皮脂腺及其它的腺体等组织在内的区域的总称。
[0048]
从被检验者的皮肤采集ssl时,可以采用用于从皮肤回收或除去ssl的所有方法。优选可以使用后述的ssl吸收性材料、ssl粘附性材料或者从皮肤刮下ssl的器械。作为ssl吸收性材料或ssl粘附性材料,只要是与ssl具有亲合性的材料,就没有特别限定,例如可以列举聚丙烯、纸浆等。作为从皮肤采集ssl的过程的更详细的例子,可以列举:利用吸油纸、吸油膜等片状材料吸收ssl的方法;使ssl粘附于玻璃板、胶带等的方法;利用刮铲、刮刀等刮下ssl并回收的方法等。为了提高ssl的吸附性,也可以使用预先含有脂溶性高的溶剂的ssl吸收性材料。另一方面,ssl吸收性材料含有水溶性高的溶剂或水分时,会阻碍ssl的吸附,因此优选水溶性高的溶剂或水分的含量少。ssl吸收性材料优选以干燥的状态使用。
[0049]
从被检验者采集的含有rna的ssl也可以保存一定时间。关于所采集的ssl,为了尽可能抑制所含有的rna的分解,优选在采集后尽快在低温条件下保存。本发明的保存含有该rna的ssl的温度条件为0℃以下即可,优选为-20
±
20℃~-80
±
20℃,更优选为-20
±
10℃~-80
±
10℃,进一步优选为-20
±
20℃~-40
±
20℃,进一步优选为-20
±
10℃~-40
±
10℃,进一步优选为-20
±
10℃,进一步优选为-20
±
5℃。含有该rna的ssl在该低温条件下的保存期没有特别限定,优选为12个月以下、例如6小时以上且12个月以下,更优选为6个月以下、例如1日以上且6个月以下,进一步优选为3个月以下、例如3日以上且3个月以下。
[0050]
在本发明中,作为靶标基因或其表达产物的表达水平的测定对象,可以列举由rna人工合成的cdna、编码该rna的dna、该rna所编码的蛋白质、与该蛋白质发生相互作用的分子、与该rna发生相互作用的分子、或与该dna发生相互作用的分子等。其中,作为与rna、dna或蛋白质发生相互作用的分子,可以列举dna、rna、蛋白质、多糖、寡糖、单糖、脂质、脂肪酸、和它们的磷酸化物、烷基化物、糖加成物等、以及上述任意种的复合体。另外,表达水平概括性地指该基因或表达产物的表达量或活性。
[0051]
在本发明的方法中,作为优选的方式,可以使用ssl作为生物试样,在这种情况下,分析ssl所含的rna的表达水平,具体而言,通过逆转录将rna转变成cdna后,测定该cdna或其扩增产物。
[0052]
从ssl中提取rna时,可以使用通常用于从生物试样中提取或精制rna的方法,例如可以使用酚/氯仿法、agpc(acid guanidinium thiocyanate-phenol-chloroform extraction、酸性硫氰酸胍-酚-氯仿提取)法、或使用trizol(注册商标)、rneasy(注册商标)、qiazol(注册商标)等柱的方法、使用涂布有二氧化硅的特殊的磁体颗粒的方法、使用固相可逆固定化(solid phase reversible immobilization)磁体颗粒的方法、利用isogen等市售的rna提取试剂进行提取等。
[0053]
在该逆转录中,可以使用以要分析的特定的rna为靶标的引物,为了更全面地保存和分析核酸,优选使用随机引物。在该逆转录中,可以使用一般的逆转录酶或逆转录试剂试剂盒。适合使用准确性和效率性高的逆转录酶或逆转录试剂试剂盒,作为其例,可以列举:m-mlv逆转录酶(reverse transcriptase)及其变体;或者市售的逆转录酶或逆转录试剂试剂盒,例如primescript(注册商标)逆转录酶系列(takara bio公司)、superscript(注册商
标)逆转录酶系列(thermo scientific公司)等。优选使用superscript(注册商标)iii逆转录酶、superscript(注册商标)vilo cdna合成试剂盒(synthesis kit)(均为thermo scientific公司制造)等。
[0054]
该逆转录的延伸反应优选将温度调整成优选42℃
±
1℃、更优选42℃
±
0.5℃、进一步优选42℃
±
0.25℃,另一方面,将反应时间调整成优选60分钟以上、更优选80~120分钟。
[0055]
在将rna、cdna或dna作为对象的情况下,测定表达水平的方法可以从以与它们杂交的dna为引物的pcr法、实时rt-pcr法、多重pcr、smartamp法、lamp法等所代表的核酸扩增法、使用与它们杂交的核酸作为探针的杂交法(dna芯片、dna微阵列、斑点杂交、条形斑点杂交、northern印迹杂交等)、确定碱基序列的方法(测序)、或将它们组合而成的方法中选择。
[0056]
在pcr中,可以使用以要分析的特定的dna为靶标的引物对,只扩增该特定的1种dna,也可以使用多个引物对,同时扩增多个特定的dna。优选该pcr为多重pcr。多重pcr是通过在pcr反应系统中同时使用多个引物对而同时扩增多个基因区域的方法。多重pcr可以使用市售的试剂盒(例如ion ampliseq转录组人基因表达试剂盒(ion ampliseqtranscriptome human gene expression kit);life technologies japan株式会社等)实施。
[0057]
该pcr的退火和延伸反应的温度因依赖于所使用的引物而不能一概而论,但在使用上述的多重pcr试剂盒的情况下,优选为62℃
±
1℃,更优选为62℃
±
0.5℃,进一步优选为62℃
±
0.25℃。因此,在该pcr中,优选退火和延伸反应在1个步骤中进行。该退火和延伸反应的步骤的时间可以根据应扩增的dna的大小等来调整,优选为14~18分钟。该pcr中的变性反应的条件可以根据应扩增的dna来调整,优选以95~99℃进行10~60秒。上述那样的温度和时间条件下的逆转录和pcr可以使用通常用于pcr的热循环仪实施。
[0058]
利用该pcr得到的反应产物的精制优选通过反应产物的粒析(size separation)进行。利用粒析,能够将目标的pcr反应产物从pcr反应液中所含的引物或其它的杂质分离。dna的粒析例如可以利用粒析柱、粒析芯片、能够用于粒析的磁珠等进行。作为能够用于粒析的磁珠的优选的例子,可以列举ampure xp等的固相可逆固定化(solid phase reversible immobilization)(spri)磁珠。
[0059]
对于精制后的pcr反应产物,为了进行之后的定量分析,也可以实施必要的更进一步的处理。例如为了进行dna的测序,可以将精制后的pcr反应产物在适当的缓冲液溶液中进行制备,或切断pcr扩增得到的dna所含的pcr引物区域,或向扩增得到的dna中进一步添加接头序列。例如可以将精制后的pcr反应产物在缓冲液溶液中进行制备,对扩增dna进行pcr引物序列的除去和接头连接,使所得到的反应产物根据需要扩增,制作用于定量分析的文库(library)。关于这些操作,例如可以使用superscript(注册商标)vilo cdna合成试剂盒(life technologies japan株式会社)所附带的5
×
vilo rt reaction mix和ion ampliseq转录组人基因表达试剂盒(life technologies japan株式会社)所附带的5
×
ion ampliseq hifi mix和ion ampliseq transcriptome human gene expression core panel,基于各试剂盒所带的操作规程进行。
[0060]
在利用northern印迹杂交法测定靶标基因或来自其的核酸的表达量的情况下,例如可以列举如下的方法:首先,利用放射性同位素、荧光物质等对探针dna进行标记,接着,
使所得到的标记dna与按照通常方法转移至尼龙膜等的来自生物试样的rna杂交,之后,检测来自标记物的信号,由此能够对所形成的标记dna与rna的双链进行测定。
[0061]
在利用rt-pcr法测定靶标基因或来自其的核酸的表达量的情况下,例如,首先按照通常方法由来自生物试样的rna制备cdna,以其为模板,使以本发明的靶标基因能够扩增的方式制备的一对引物(与上述cdna(-链)结合的正链,与+链结合的反链)与其杂交。之后,按照通常方法进行pcr法,对所得到的扩增双链dna进行检测。在扩增得到的双链dna的检测中,可以采用对通过使用预先用ri、荧光物质等标记过的引物进行上述pcr而产生的标记双链dna进行检测的方法等。
[0062]
在利用dna微阵列测定靶标基因或来自其的核酸的表达量的情况下,例如将本发明的来自靶标基因的核酸(cdna或dna)的至少1种固定在支承体上,使用所得到的阵列,使由mrna制备的标记化cdna或crna结合在微阵列上,检测微阵列上的标记,由此能够测定mrna的表达量。
[0063]
作为上述阵列所固定的核酸,只要是在严格的条件下特异性(即实质上只是目标核酸)地进行杂交的核酸即可,例如可以为具有本发明的靶标基因的全部序列的核酸,也可以为由部分序列构成的核酸。其中,“部分序列”可以列举至少由15~25个碱基构成的核酸。其中,严格的条件通常可以列举“1
×
ssc、0.1%sds、37℃”左右的清洗条件,作为更严格的杂交条件,可以列举“0.5
×
ssc、0.1%sds、42℃”左右,作为进一步严格的杂交条件,可以列举“0.1
×
ssc、0.1%sds、65℃”左右的条件。杂交条件记载于j.sambrook et al.,molecular cloning:alaboratory manual,thrd edition,cold spring harbor laboratory press(2001)等中。
[0064]
在通过测序来测定靶标基因或来自其的核酸的表达量的情况下,例如可以列举使用下一代测序仪(例如ion s5/xl系统、life technologies japan株式会社)进行分析。基于测序中制作的read数(read count),能够对rna表达进行定量。
[0065]
上述测定所使用的探针或引物、即用于特异性识别并扩增本发明的靶标基因或来自其的核酸的引物、或用于特异性检测该rna或来自其的核酸的探针与其相当,它们可以基于构成该靶标基因的碱基序列进行设计。其中,“特异性识别”是指,例如在northern印迹法中,实质上只能够检测本发明的靶标基因或来自其的核酸,另外,例如在rt-pcr法中,如实质上只扩增该核酸那样,能够判断该检测物或产物为该基因或来自其的核酸。
[0066]
具体而言,能够利用含有与由构成本发明的靶标基因的碱基序列构成的dna或其互补链互补的一定数量的核苷酸的寡核苷酸。其中,“互补链”是指与由a:t(rna时为u)、g:c的碱基对构成的双链dna的一条链相对应的另一条链。另外,“互补”并不限于在该一定数量的连续的核苷酸区域内完全是互补序列的情况,只要具有优选80%以上、更优选90%以上、进一步优选95%以上、更进一步优选98%以上的碱基序列上的同一性即可。碱基序列的同一性可以利用上述blast等算法进行确定。
[0067]
这样的寡核苷酸在作为引物使用的情况下,只要是特异性退火和链增长即可,通常可以列举具有例如10个碱基以上、优选15个碱基以上、更优选20个碱基以上并且例如100个碱基以下、优选50个碱基以下、更优选35个碱基以下的链长。另外,在作为探针使用的情况下,只要是特异性杂交即可,可以使用具有由构成本发明的靶标基因的碱基序列构成的dna(或其互补链)的至少部分或全部的序列、例如10个碱基以上、优选15个碱基以上并且例
如100个碱基以下、优选50个碱基以下、更优选25个碱基以下的链长的寡核苷酸。
[0068]
另外,在此,“寡核苷酸”可以为dna或rna,既可以是合成的,也可以是天然的。或者,杂交所使用的探针通常使用标记过的寡核苷酸。
[0069]
另外,在测定本发明的靶标基因的翻译产物(蛋白质)、与该蛋白质发生相互作用的分子、与rna发生相互作用的分子、或与dna发生相互作用的分子的情况下,可以使用蛋白芯片分析、免疫测定法(例如elisa等)、质谱分析(例如lc-ms/ms、maldi-tof/ms)、单杂交法(pnas 100,12271-12276(2003))或双杂交法(biol.reprod.58,302-311(1998))这样的方法,并且可以根据对象适当选择。
[0070]
例如在使用蛋白质作为测定对象的情况下,通过以下的方式实施:使与本发明的表达产物相对应的抗体与生物试样接触,对与该抗体结合的试样中的多肽进行检测,测定其水平。例如利用蛋白质印迹法时,可以如下所述地进行:作为一次抗体,使用上述的抗体后,作为二次抗体,使用由放射性同位素、荧光物质或酶等标记过的与一次抗体结合的抗体,对其一次抗体进行标记,利用放射线测定器、荧光检测器等测定来自这些标记物质的信号。
[0071]
另外,与上述翻译产物相对的抗体可以为多克隆抗体,也可以为单克隆抗体。这些抗体可以按照公知的方法进行制造。具体而言,使用按照通常方法在大肠杆菌等中表达并精制得到的蛋白质,或者按照通常方法合成该蛋白质的部分多肽,使家兔等非人动物免疫后,能够从该免疫动物的血清中按照通常方法得到多克隆抗体。
[0072]
另一方面,利用按照通常方法在大肠杆菌等中表达并精制得到的蛋白质或该蛋白质的部分多肽,使小鼠等非人动物免疫,并将所得到的脾细胞和骨髓瘤细胞进行细胞融合,能够从所制备的杂交瘤细胞中得到单克隆抗体。另外,单克隆抗体也可以通过噬菌体展示来制作(griffiths,a.d.;duncan,a.r.,current opinion in biotechnology,volume 9,number 1,february 1998,pp.102-108(7))。
[0073]
这样,能够测定从被检验者采集的生物试样中的本发明的靶标基因或其表达产物的表达水平,并且基于该表达水平能够检测特应性皮炎的重症度。具体地通过将所测得的本发明的靶标基因或其表达产物的表达水平与对照水平进行比较而进行检测。
[0074]
在通过测序对多种靶标基因的表达水平进行分析的情况下,如上所述,作为指标,优选使用作为表达量数据的read count值、对于该read count值校正过样品间的总read数的差异而得到的rpm值、将该rpm值转换成以2为底的对数值的值(log2rpm值)或加上整数1后的以2为底的对数值(log2(rpm+1)值)、或利用deseq2(love mi et al.genome biol.2014)校正得到的count值(normalized count值)或加上整数1后的以2为底的对数值(log2(count+1)值)。另外,作为rna-seq的定量值,也可以是通常的利用fragments per kilobase of exon per million reads mapped(fpkm)、reads per kilobase of exon per million reads mapped(rpkm)、transcripts per million(tpm)等算出的值。还可以为利用微阵列法得到的信号值及其校正值。另外,在通过rt-pcr等只对特定的靶标基因进行分析的情况下,优选将对象基因的表达量转换成以管家基因的表达量为基准的相对表达量后再进行分析的方法、或使用包含靶标基因区域的质粒对绝对复制数进行定量(绝对定量)并分析的方法。也可以为利用数字pcr法得到的复制数。
[0075]
其中,“对照水平”例如可以列举在检测轻症患者时健康人的该靶标基因或其表达
产物的表达水平、在检测中度症状患者时轻症患者的该靶标基因或其表达产物的表达水平。健康人或轻症患者的表达水平也可以为从健康人或轻症患者群体中测得的该基因或其表达产物的表达水平的统计值(例如平均值等)。在靶标基因为多种的情况下,优选对于各基因或其表达产物,求出基准表达水平。
[0076]
另外,本发明的特应性皮炎的重症度的检测也可以通过本发明的靶标基因或其表达产物的表达水平上升/减少而进行。在这种情况下,来自被检验者的生物试样中的靶标基因或其表达产物的表达水平与各基因或其表达产物的临界值(cutoff value)(参照值)进行比较。关于13
[0077]
临界值,只要预先取得健康人、轻症患者、中度症状患者和重症患者的该靶标基因或其表达产物的表达水平作为基准数据,根据基于其的表达水平的平均值或标准偏差等统计数值,适当确定即可。
[0078]
还可以利用来自重症度不同的特应性皮炎患者的靶标基因或其表达产物的表达水平、和来自健康人的靶标基因或其表达产物的表达水平的测定值,构建能够区分重症度不同的患者组(例如轻症患者、中度症状患者、重症患者)和健康人(无症状)的判别式(预测模型),利用该判别式,检测特应性皮炎的重症度。即,将来自重症度不同的特应性皮炎患者组的靶标基因或其表达产物的表达水平、和来自健康人的靶标基因或其表达产物的表达水平的测定值作为教师样品,构建能够区分重症度不同的各患者组(例如轻症患者、中度症状患者、重症患者)和健康人(无症状)的判别式(预测模型),基于该判别式求出对重症度不同的各患者组进行判别的临界值(参照值)。其中,在判别式的制作中,可以通过主成分分析(pca)进行降维,将主要成分作为说明变量。
[0079]
并且,由从被检验者采集的生物试样中同样测定靶标基因或其表达产物的水平,将所得到的测定值代入该判别式中,将由该判别式得到的结果与参照值进行比较,由此能够检测被检验者的特应性皮炎的重症度。
[0080]
作为构建判别式的算法,可以利用机械学习所使用的算法等公知的算法。作为机械学习算法的例子,可以列举随机森林(random forest)、线性核的支持向量机(svm linear)、rbf核的支持向量机(svm rbf)、神经网络(nerural net)、一般线性模型(generalized linear model)、正则化线性判别分析(regularized linear discriminant analysis)、正则化逻辑回归(regularized logistic regression)等。可以向所构建的预测模型输入检验用的数据,算出预测值,选取该预测值与实测值最适合的模型、例如准确率(accuracy)最大的模型作为最佳预测模型。另外,可以根据预测值和实测值计算检出率(recall)、精度(precision)和作为它们的调和平均的f值,选取其f值最大的模型作为最佳预测模型。
[0081]
临界值(参照值)的确定方法没有特别限制,可以按照公知的方法进行确定。例如,可以利用使用判别式所制作的roc(receiver operating characteristic curve、受试者操作特征曲线)曲线求出。在roc曲线中,纵轴绘制阳性患者中出现阳性结果的概率(灵敏度)时,横轴绘制1减去阴性患者中出现阴性结果的概率(特异度)而得到的值(假阳性率)。关于roc曲线所示的“真阳性(灵敏度)”和“假阳性(1-特异度)”,可以将“真阳性(灵敏度)
”‑“
假阳性(1-特异度)”最大的值(约登指数(youden index))作为临界值(参照值)。
[0082]
本发明的用于检测特应性皮炎的重症度的检查用试剂盒含有用于测定从患者分
离得到的生物试样中的本发明的靶标基因或其表达产物的表达水平的检查试剂。具体可以列举:含有与本发明的靶标基因或来自其的核酸特异性地结合(杂交)的寡核苷酸(例如pcr用的引物)并且用于核酸扩增、杂交的试剂;或者含有识别本发明的靶标基因的表达产物(蛋白质)的抗体并且用于免疫学测定的试剂等。该试剂盒所包含的寡核苷酸、抗体等能够如上所述地利用公知的方法得到。
[0083]
另外,在该检查用试剂盒中,除了含有上述抗体、核酸以外,还可以含有标记试剂、缓冲液、显色底物、二次抗体、阻滞剂、试验所需的器具、作为阳性对照或阴性对照使用的对照试剂、用于采集生物试样的工具(例如用于采集ssl的吸油膜等)等。
[0084]
关于上述的实施方式,在本发明中进一步公开以下的方式。
[0085]
<1>一种被检验者的特应性皮炎的重症度的检测方法,其中,包括对于从该被检验者采集的生物试样,测定选自由capn1、ncor2、ppp1r9b、plp2、grn、ppp1r12c、loc146880、slc31a1和syvn1构成的9种基因群中的至少1种基因或其表达产物的表达水平的工序。
[0086]
<2>如<1>的方法,其中,重症度是基于easi评分或iga评分的重症度。
[0087]
<3>如<2>的方法,其中,重症度是基于easi评分的重症度,表达水平的测定是选自由capn1、ncor2、ppp1r9b、plp2和grn构成的5种基因群中的至少1种基因或其表达产物的表达水平的测定。
[0088]
<4>如<2>的方法,其中,重症度是基于iga评分的重症度,表达水平的测定是选自由ppp1r12c、loc146880、slc31a1和syvn1构成的4种基因群中的至少1种基因或其表达产物的表达水平的测定。
[0089]
<5>如<1>~<4>中任一项的方法,其中,重症度为选自无症状、轻症和中度症状中的1种以上。
[0090]
<6>如<1>~<5>中任一项的方法,其中,基因或其表达产物的表达水平是mrna的表达量的测定。
[0091]
<7>如<1>~<6>中任一项的方法,其中,基因或其表达产物为上述被检验者的皮肤表面脂质所含的rna。
[0092]
<8>如<1>~<7>中任一项的方法,其中,将表达水平的测定值与上述各基因或其表达产物的参照值进行比较,检测特应性皮炎的重症度。
[0093]
<9>来自从被检验者采集的生物试样的选自由capn1、ncor2、ppp1r9b、plp2、grn、ppp1r12c、loc146880、slc31a1和syvn1构成的9种基因群中的至少1种基因或其表达产物在作为特应性皮炎的重症度标记中的用途。
[0094]
<10>如<9>的用途,其中,所述用途是选自由capn1、ncor2、ppp1r9b、plp2和grn构成的5种基因群中的至少1种基因或其表达产物的用途,重症度是基于easi评分的重症度。
[0095]
<11>如<9>的用途,其中,所述用途是选自由ppp1r12c、loc146880、slc31a1和syvn1构成的4种基因群中的至少1种基因或其表达产物的用途,重症度是基于iga评分的重症度。
[0096]
<12>如<9>~<11>中任一项的用途,其中,上述基因或其表达产物为从上述被检验者采集的皮肤表面脂质所含的mrna。
[0097]
<13>一种能够在<1>~<8>中任一项的方法中使用的用于检测特应性皮炎
的重症度的检查用试剂盒,其中,该检查用试剂盒含有:与上述基因或来自其的核酸特异性地杂交的寡核苷酸、或识别上述基因的表达产物的抗体。
[0098]
<14>一种特应性皮炎的重症度的检测标记,其中,由选自由capn1、ncor2、ppp1r9b、plp2、grn、ppp1r12c、loc146880、slc31a1和syvn1构成的9种基因群中的至少1种基因或其表达产物构成。
[0099]
实施例
[0100]
以下,基于实施例对本发明进一步进行详细说明,但本发明并不限定于此。
[0101]
实施例1使用从ssl中提取的rna检测特应性皮炎的重症度
[0102]
1)特应性皮炎患者的诊断和ssl采集
[0103]
将健康人(25~57岁、男性)14名和具有特应性皮肤的成人(ad)(23~56岁、男性)29名作为被检验者。特应性皮炎患者被皮肤科专科医生诊断为重症度是轻症和中度症状的特应性皮炎。诊断使用easi评分(hanifin et al.exp dermatol.10,2001),根据文献,将评分大于0且小于6的患者诊断为轻症,将评分为6以上且小于23的患者诊断为中度症状(chopra et al.br j dermatol.177,2017)。作为其结果,轻症18名,中度症状11名。
[0104]
另外,对于上述的特应性皮炎患者的面部,使用iga评分,进行0(无症状)、1(非常轻微)、2(轻症)、3(中度症状)、4(重症)五个等级的全面评价。作为其结果,评分为2的轻症17名,评分为3的中度症状12名。使用吸油膜从各被检验者的整个面部回收皮脂后,将该吸油膜移至瓶中,以-80℃保存约1个月至用于rna提取。
[0105]
2)rna制备和测序
[0106]
将上述1)的吸油膜切成适当的大小,使用qiazol裂解试剂(lysis reagent)(qiagen),按照附带的操作规程提取rna。基于所提取的rna,使用superscript vilo cdna合成试剂盒(synthesis kit)(life technologies japan株式会社),以42℃进行90分钟逆转录,进行cdna的合成。逆转录反应的引物使用试剂盒所附带的随机引物。利用多重pcr,由所得到的cdna制作包含来自20802种基因的dna的文库。使用ion ampliseq转录组人基因表达试剂盒(life technologies japan株式会社),在[99℃、2分钟
→
(99℃、15秒
→
62℃、16分钟)
×
20次循环
→
4℃、保持(hold)]的条件下进行多重pcr。所得到的pcr产物用ampure xp(beckman coulter株式会社)精制后,进行缓冲液的再构成、引物序列的消化、接头连接和精制、扩增,制作文库。将所制作的文库载入ion 540chip中,使用ion s5/xl系统(life technologies japan株式会社)进行测序。
[0107]
3)数据分析1:利用easi评分的依赖于重症度分类的变动基因i)使用数据
[0108]
在上述2)中测得的来自被检验者的rna的表达量数据(read count值)中,转换成校正过样品间的总read数的差异而得到的rpm值。其中,只将全部样品中90%以上的样品且得到了不是缺失值的表达量数据的7429种基因用于以下的分析。为了使基于负的二项分布的rpm值与正态分布近似,使用加上整数1后的以2为底的对数值(log2(rpm+1)值)。接着,基于上述1)中评价得到的easi评分,按照重症度分类,将样品分成健康人、轻症患者、中度症状患者三个组。
[0109]
ii)rna表达分析
[0110]
基于上述i)中测得的健康人、轻症患者和中度症状患者的来自ssl的rna表达量(log2(rpm+1)值),在3组间进行利用tukey法的检验,选择健康人对轻症患者、轻症患者对
中度症状患者、健康人对中度症状患者中p值全部小于0.1的基因。作为其结果,capn1、grn、ncor2、plp2、ppp1r9b五种基因的表达重症度依赖性地增加(表1)。
[0111]
[表1-1]
[0112][0113]
[表1-2]
[0114][0115]
4)数据分析2:利用面部的全面评价(iga评分)的依赖于重症度分类的变动基因
[0116]
i)使用数据
[0117]
在上述2)中测得的来自被检验者的rna的表达量数据(read count值)中,转换成校正过样品间的总read数的差异而得到的rpm值。其中,只将全部样品中90%以上的样品且得到了不是缺失值的表达量数据的7429种基因用于以下的分析。为了使基于负的二项分布的rpm值与正态分布近似,使用加上整数1后的以2为底的对数值(log2(rpm+1)值)。接着,基于上述1)评价得到的面部的全面评价(iga评分),按照重症度分类,将样品分成健康人、轻症患者、中度症状患者三个组。
[0118]
ii)rna表达分析
[0119]
基于上述i)中测得的健康人、轻症患者和中度症状患者的来自ssl的rna表达量(log2(rpm+1)值),在3组间进行利用tukey法的检验,选择健康人对轻症患者、轻症患者对中度症状患者、健康人对中度症状患者中p值全部小于0.1的基因。作为其结果,loc146880、ppp1r12c、syvn1三种基因的表达重症度依赖性地增加,slc31a1重症度依赖性地减少(表2)。
[0120]
[表2-1]
[0121][0122]
[表2-2]
[0123]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1