喹诺酮化合物及其制备方法与流程
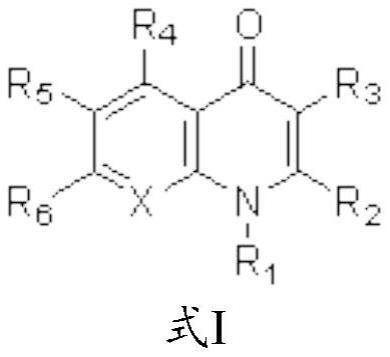
本发明涉及式(i)的喹诺酮和类似物;以及通过将胺插入到其芳基炔酮中来制备它的方法。其中,x=c、n、c-ome;r1=h、ch3;r2=c1-c12烷基、环丙基、环己基、苯基、2-氟苯基、4-氟苯基、4-甲氧基苯基、4-乙基苯基、3,4-亚甲基二氧苯基;r3=h、ome;r4=h、c1-c8烷基、溴;r5=h;r6=h;r5和r6能够结合在一起形成-och2o-。本发明还涉及作为具有通式(i)的喹诺酮的芸香碱(graveoline)(1)、芸香宁碱(graveolinine)(2)、假单素(pseudane)iv(3)、假单素vii(4)、假单素viii(5)、假单素xii(6)和和他草喹诺酮(waltherione)f(7)的制备方法。具体地,本发明还涉及具有通式i的芸香碱(1)、芸香宁碱(2)、假单素iv(3)、假单素vii(4)、假单素viii(5)、假单素xii(6)和和他草喹诺酮f(7)的全合成。
背景技术:
1、本技术中的方案聚焦于称为喹诺酮的双环含氮杂环化合物的合成。喹诺酮及其衍生物因其广泛存在于多种天然产物和药物中且表现出广泛的生物特性,已经引起了显著的关注(j.med.chem.2014,57,1952,chem.rev.2011,111,152)。4-喹诺酮环是存在于多种生物碱中的常见基序,并且是显示重要药物活性的药物中的重要基序,因此被认为是药物的优选构建单元。喹诺酮及其衍生物作为不同治疗剂的重要性在以下方面有很好的先例:抗肿瘤剂(us2005/0032832,wo 96/10563),抗有丝分裂剂(wo02/26730,eur.j.med.chem.2011,46,6046),抗疟疾剂(j.med.chem.2014,57,3818),抗病毒剂,黄嘌呤氧化酶和组织蛋白酶抑制活性(arch.pharm.2013,346,7),自诱导物(wo 02/18342),c-myc/max/dna复合物形成的抑制剂(wo 2018/021810 a1),抗细菌或抗真菌剂,锌传感器(wo2017/017631a2,wo 2017/220205 a1),赖氨酰氧化酶样2(loxl2)抑制剂(wo 2017/139274a1),治疗顶复门寄生虫相关病症(wo2017/112678 a1),酪氨酸酶和相关蛋白的活性抑制剂(wo 2017/181379 a1),作为变构调节剂用于治疗诸如阿尔茨海默病、精神分裂症疼痛或睡眠障碍等疾病(wo 2017/160670 a1),在铜绿假单胞菌的细胞间通讯系统中充当细胞间信号分子的自诱导物(wo 02/18342 a2)等。
2、合成4-喹啉酮的经典方法包括lappin环化(j.am.chem.soc.1948,70,3348),涅门托夫斯基法(tetrahedron lett.2002,43,3911),conrad-limpet法(eur.j.org.chem.2010,2010,5841),camps环化(chem.ber.1899,32,3228,org.lett.2008,10,2609)和grohe-heitzer合成(liebigs ann.chem.1987,1987,29)。在许多合成中,包括多步骤方法来构建烯胺酮前体,并且还需要高温以进行环化。camps法是将苯胺与麦氏酸(或其衍生物)和原甲酸三甲酯缩合以得到相应的烯胺,然后将烯胺在高沸点溶剂中环化(synthesis 1987,482)或在微波条件下环化(bioorg.med.chem.lett.2005,15,1015),以实现环化并产生喹诺酮。除上述之外,还有其他一些关于使用过渡金属催化剂合成喹诺酮的报道(j.org.chem.2007,72,7968,eur.j.org.chem.2012,3001,eur.j.org.chem.2014,4044)。在合成中,很少有方法包括高压或有毒的一氧化碳(chem.heterocycl.compd.2009,45,757)、或有时几乎不可获得的n-(o-酮芳基)酰胺(n-(o-ketoaryl)amide),这形成了合成喹诺酮的限制因素/瓶颈。由于喹诺酮及其衍生物的重要性,一些研究小组对一锅法合成喹诺酮产生了兴趣。几种获得喹诺酮的多组分方法包括:铜催化取代的3-(2-卤代苯基)-3-氧代丙烷、醛和aq.nh3的三组分合成,其中,使用水作为溶剂介质(adv.synth.catal.2019,361,1-15);用酰胺将炔酮氨酰化以得到取代的-3-芳酰基喹啉-4(1h)-酮骨架(org.lett.2010,12,212,j.org.chem.2016,81,12181,org.lett.2018,20,3907);用炔烃或烯烃邻位官能化苯胺以及氮杂-迈克尔加成替代法(j.org.chem.2015,80,1464,j.org.chem.2018,83,2694);在钯催化剂的存在下,邻碘苯胺与末端乙炔和一氧化碳的羰基化偶联(tetrahedron lett.1991,32,237),等等。鉴于喹诺酮的广泛应用,非常期望开发克服普遍挑战的新方法以及以一锅法为主来获得喹诺酮的环保策略。
3、发明目的
4、本发明的主要目的是提供新颖的式(i)的喹诺酮和类似物。
5、本发明的另一个目的是提供一种通过胺插入法制备式(i)的喹诺酮和类似物的有效方法。
6、本发明的另一个目的是提供一种方法,该方法可以通过使用式(ii)的预制炔酮(pre-installed ynone)在一锅法中使用添加剂和氨源的方案来进行。
7、本发明的另一个目的是天然产物例如芸香碱(1)、芸香宁碱(2)、假单素iv(3)、假单素vii(4)、假单素viii(5)和假单素xii(6)的全合成。
8、本发明的另一个目的是扩展策略并以简洁的方法利用所获得的喹诺酮产物中的一种进行天然产物和他草喹诺酮f(7)的全合成。
技术实现思路
1、因此,本发明提供了一种式(i)的化合物:
2、
3、其中,
4、x是c、n和c-ome;
5、r1是h和ch3;
6、r2是c1-c12烷基、环丙基、环己基、苯基、2-氟苯基、4-氟苯基、4-甲氧基苯基、4-乙基苯基和3,4-亚甲基二氧苯基;
7、r3是h、br和ome;
8、r4是h、c1-c8烷基和溴;
9、r5和r6是h;以及
10、r5和r6能够结合在一起形成-och2o-。
11、在一个实施例中,本发明提供了一种通过胺插入法制备通式(i)的喹诺酮的方法,包括具体实施方式中所述的步骤。
12、在优选的实施例中,本发明提供了一种式(2g)的化合物:
13、
14、在一个实施例中,本发明提供了一种通式(ii)的化合物:
15、
16、其中,取代基r2、r4、r5、r6和x如上定义。
17、在另一个实施例中,本发明提供了一种制备通式(i)的喹诺酮的方法,包括:在金属卤化物作为添加剂的存在下,在极性溶剂如dmf或甲酰胺中,用氨源如碳酸铵、氨在约80-120℃下处理式(ii)的炔酮约8-15小时。
18、
19、在另一个实施例中,本发明提供了一种制备具有下式的芸香碱(1)、芸香宁碱(2)、假单素iv(3)、假单素vii(4)、假单素viii(5)和假单素xii(6)的方法。
20、
21、在另一个实施例中,本发明提供了一种制备式(7)的和他草喹诺酮f的方法,包括通式(i)的喹诺酮作为中间体。
22、和他草喹诺酮(7)
23、在另一个实施例中,本发明提供了一种制备式(7)的和他草喹诺酮f的方法,包括以下步骤:
24、
- 还没有人留言评论。精彩留言会获得点赞!