用于用TSLPR-CD19或TSLPR-CD22免疫治疗来治疗癌症的组合物和方法与流程
本技术涉及癌症领域,特别地涉及通过tslpr-cd19或tslpr-cd22抗原靶向结构域来同时靶向tslpr和cd19或cd22 b细胞抗原的car以及包含这样的tslpr-cd19或tslpr-cd22抗原靶向结构域的嵌合抗原受体(chimeric antigen receptor,car)及其使用方法。
背景技术:
1、癌症是对人健康最致命的威胁之一。仅在美国,癌症每年影响接近130万例新患者,并且其是继心血管疾病之后第二位的主要死亡原因,引起大约四分之一的死亡。实体瘤是大多数这些死亡的原因。尽管在某些癌症的医学治疗方面已取得显著进展,但是在过去的20年中所有癌症的总体5年存活率仅提高约10%。癌症或恶性肿瘤转移并且以不受控制的方式迅速生长,使得治疗极其困难。
2、cd19是85至95kda跨膜细胞表面糖蛋白受体。cd19是蛋白质的免疫球蛋白(ig)超家族的成员,并且包含两个胞外ig样结构域、跨膜结构域和胞内信号传导结构域(teddertf,isaacs,cm,1989,j immunol 143:712-171)。cd19修饰b细胞受体信号传导,降低b细胞受体对抗原的触发阈值(carter,rh,and fearon,dt,1992,science,256:105-107),并与cd81和cd21协调以调节这种必需的b细胞信号传导复合物(bradbury,le,kansas gs,levys,evans rl,tedder tf,1992,j immunol,149:2841-50)。在b细胞个体发育期间,cd19能够独立于抗原受体在祖b细胞(pro-b)、前-前-b细胞(pre-pre-b cell)、前-b细胞(pre-b)、早期b细胞(early b cell)阶段发出信号,并且与src家族蛋白酪氨酸激酶相关,是酪氨酸磷酸化的,诱导胞内钙动员和肌醇磷脂信号传导二者(uckun fm,burkhardt al,jarvis l,jun x,stealy b,dibirdik i,myers de,tuel-ahlgren l,bolen jb,1983,j biol chem268:21172-84)。与b细胞恶性肿瘤的治疗相关的关键点是:cd19在正常b细胞上以严格受调节的方式表达,受限于处于igh基因重排阶段的早期b细胞前体、成熟b细胞,但在造血干细胞或成熟浆细胞上不表达(anderson,kc,bates,mp,slaughenhout bl,pinkus gs,schlossman sf,nadler lm,1984,blood 63:1424-1433)。
3、cd22,也称为siglec-2(唾液酸结合免疫球蛋白样凝集素2),是95kda跨膜表面糖蛋白,并且包含6个ig样c2型结构域和1个ig样v型结构域(uniprot.org/uniprot/p20273#structure,于2017年7月12日访问)。在b细胞个体发育期间,cd22从前b细胞阶段开始在b细胞表面表达,在成熟b细胞上持续,并且在浆细胞上丢失(nitschke l,2009,immunologicalreviews,230:128-143)。cd22包含胞内itim(基于免疫受体酪氨酸的抑制基序)结构域,其在针对抗原的b细胞受体的接合之后用于下调细胞活化。cd22的抗体结合诱导与shp-1和胞内磷酸酶的共定位,胞内磷酸酶也用于下调基于磷酸化的信号转导(lumb s,fleishcersj,wiedemann a,daridon c,maloney a,shock a,dorner t,2016,journal of cellcommunication and signaling,10:143-151)。与b细胞恶性肿瘤的治疗相关的关键点是:cd22在正常b细胞上以严格受调节的方式表达,但在造血干细胞或成熟浆细胞上不表达,这使得cd22成为b细胞白血病的合适靶抗原。cd22在成人和儿童(前b-all)b细胞恶性肿瘤二者上的表达已导致利用该靶标进行基于抗体和基于嵌合抗原受体(car)-t细胞二者的治疗(haso w,lee dw,shah nn,stetler-stevenson m,yuan cm,pastan ih,dimitrov ds,morgan ra,fitzgerlad dj,barrett dm,wayne as,mackall cl,orentas rj,2013,blood,121:1165-1174)(wayne as,kreitman rj,findley hw,lew g,delbrook c,steinberg sm,stetler-stevenson m,fitzgerald dj,pastan i,2010,clinical cancer research,16:1894-1903)。最近,cd22 car在all的i期临床试验中显示出较高效力,表明了cd22靶向在b-all患者中的可行性和益处,所述患者未接受过car治疗或对cd19靶向治疗产生抗性(frytj,shah nn,orentas rj,et al.nat med.2018;24(1):20-28.doi:10.1038/nm.4441)。
4、胸腺基质淋巴细胞生成素(thymic stromal lymphopoietin,tslp)是这样的细胞因子,其共享cd127但利用第二受体链tslpr(基因名称crlf2)作为异二聚体信号传导复合物的一部分。在5%至10%的儿童和成人急性淋巴细胞白血病(acute lymphoblasticleukemia,all)中鉴定出tslpr的过表达,这主要是由于易位或缺失产生了替代启动子。tslpr过表达显示出与患有all的儿童和成人二者中的不良预后相关,并且显示出tslpr途径的激活对于all母细胞(all blast)而言是生物学上重要的。此外,在约50%的病例中,tslpr表达增加与ikzf基因突变相关,其是患者中特别高风险的亚群。tslpr显示限制了正常组织的表达。已开发出许多新的治疗b细胞白血病和淋巴瘤的方法,包括与细菌毒素或化学治疗剂连接的抗cd22抗体(wayne as,fitzgerald dj,kreitman rj,pastan i,2014,immunotoxins for leukemia,blood,123:2470-2477)。奥英妥珠单抗(inotuzumabozogamicin)(cmc-544,鼠单克隆抗体的一种人源化形式g5/44)是一种抗体药物缀合物,并且其作为单一药剂或与化学治疗组合给予,目前正在临床试验中被评价(nct01664910,主办者:m.d.anderson cancer center)(dijoseph jf,et al.,2004,blood,103:1807-1814)。作为单一药剂,结局胜过在标准治疗情况下所观察到的结局,但是注意到了显著的肝毒性(kantarjian h,et al.,2016,inotuzumb ozogamicin versus standard therapyfor acute lymphoblastic leukemia,new england journal of medicine,375:740-753)。未经修饰的cd22治疗性抗体依帕珠单抗(epratuzumab)也正在与化学治疗组合进行测试(nct01219816,主办者:nantes university hospital)。依帕珠单抗是一种嵌合蛋白,其由接枝到人抗体框架上的鼠cdr构成。尽管在一些白血病中有效,但mosetumomabpasudotox由于与该抗体融合的细菌毒素的免疫原性以及与其他药剂的活性水平适度或相当的这两个问题而并不在广泛的临床开发中(参见nct01829711,主办者:medimmune,llc)。迄今为止,car构建体中使用的许多cd22结合部分都利用了来源于这些鼠抗体的结构域,并且不能有效地活化靶向该cd22结构域的t细胞(例如用作moxetumomab pasudotox基础的ha22抗cd22结合剂,参见james se,greenberg pd,jensen mc,lin y,wang j,till bg,raubitschek aa,forman sj,press ow,2008,jounral of immunology 180:7028-7038)。在国家卫生研究院(nih),目前正在对一种作为抗cd22 car有效的抗cd22结合剂进行临床试验,但结果尚未公布(临床试验政府标识符:nct02315612,anti-cd22 chimericreceptor t cells in pediatric and young adults with recurrent or refractorycd22-expressing b cell malignancies,主办者:nci)。该结合剂基于在dimiterdimitrov博士的实验室中开发的m971完全人抗体(xiao x,ho m,zhu z,pastan i,dimitrov d,2009,identification and characterization of fully human anti-cd22monoclonal antibodies,mabs,1:297-303)。证明了m971结构域作为car是有效的(haso w,et al.,2013,anti-cd22-chimeric antigen receptors targeting b-cellprecursor acute lymphoblastic leukemia,blood,121:1165-1174)。terry fry博士的团队先前已经开发了单靶向tslpr car,并在b-all临床前模型中证明了其对tslpr阳性肿瘤的效力。(qin,haiying,et al.″eradication of b-all using chimeric antigenreceptor-expressing t cells targeting the tslpr oncoprotein.″blood,thejournal of the american society of hematology 126.5(2015):629-639.)。
5、b谱系白血病和淋巴瘤的传统治疗方法可包括化学治疗和干细胞移植(参见万维网www.cancer.gov)。与这些治疗相关的高毒性以及并发症(例如复发、继发性恶性肿瘤或gvhd)的风险促使寻求更好的治疗选择。cd19在成人和儿童(前b-all)b细胞恶性肿瘤二者上的表达已导致利用该靶标进行基于抗体和基于嵌合抗原受体(car)-t细胞二者的治疗(kochenderfer jn,wilson wh,janik je,dudley me,stetler-stevenson m,feldman sa,maric i,raffeld m,nathan da,lanier bj,morgan ra,rosenberg sa,2010,blood 116:4099-102;lee dw,kochenderfer jn,stetler-stevenson m,cui yk,delbrook c,feldmansa,orentas r,sabatino m,shah nn,steinberg sm,stroncek d,tschernia n,yuan c,zhang h,zhang l,rosenberg sa,wayne as,mackall cl,2015,lancet 385:517-28)。此外,淋巴瘤(dlbcl,fl)和白血病(cll)上cd22抗原的存在使它成为有效肿瘤清除和预防肿瘤抗原逃逸的有吸引力的另外的靶标。
6、b谱系白血病的当前护理标准可由通过高剂量化学治疗或辐射进行的缓解诱导治疗随后是巩固组成,并且可以以干细胞移植和根据需要进行的另外的化学治疗过程为特征(参见万维网cancer.gov)。与这些治疗相关的高毒性以及并发症(例如复发、继发性恶性肿瘤或gvhd)的风险促使寻求更好的治疗选择。cd19在成人和儿童(前b-all)b细胞恶性肿瘤二者上的表达已导致利用该靶标进行基于抗体和基于嵌合抗原受体(car)-t细胞二者的治疗(kochenderfer jn,wilson wh,janik je,dudley me,stetler-stevenson m,feldmansa,maric i,raffeld m,nathan da,lanier bj,morgan ra,rosenberg sa,2010,blood116:4099-102;lee dw,kochenderfer jn,stetler-stevenson m,cui yk,delbrook c,feldman sa,orentas r,sabatino m,shah nn,steinberg sm,stroncek d,tschernia n,yuan c,zhang h,zhang l,rosenberg sa,wayne as,mackall cl,2015,lancet 385:517-28)。
7、已开发出许多治疗b细胞白血病和淋巴瘤的新方法,包括将抗cd19或抗cd22结合基序与t细胞结合基序连接的双特异性抗体(即旨在用于治疗费城染色体阴性复发性或难治性b细胞前体急性淋巴细胞白血病(acute lymphoblastic leukemia,all)的博纳吐单抗(blinatumomab),)。迄今为止,car构建体中所使用的许多cd19或cd22的结合部分都利用了来源于鼠抗体的结构域。目前正在考虑批准这些产品中的许多,包括由novartis和kite pharmaceuticals开发的那些。在2017年4月,novartis宣布ctl019(tisagenlecleucel)获得了fda突破性认定,用于治疗患有难治性或复发性(r/r)dlbcl(弥漫性大b细胞淋巴瘤(diffuse large b cell lymphoma))的两次或更多次既往治疗失败的成人患者,将该认定添加至针对r/r b细胞急性淋巴细胞白血病(all)的认定。这些适应证分别基于ii期juliet研究(nct02445248)和eliana研究(nct02435849)。juliet试验示出总响应率(overall response rate,orr)为45%,其中在三个月时具有37%完全响应(complete response,cr)和8%部分响应(partial response,pr)。在eliana研究中,输注该产品的患者中82%达到cr或计数恢复不完全的cr,并且在6个月时无复发存活率为60%。来自kite pharmaceuticals的car-t产品(kte-c19,axicabtagene ciloleucel)针对弥漫性大b细胞淋巴瘤(dlblc)、转化滤泡性淋巴瘤(transformed follicular lymphoma,tfl)和原发性纵隔b细胞淋巴瘤(primary mediastinal b-cell lymphoma,pmbcl)被授予突破性认定。在kte-c19在r/r all中的kite zuma-3ii期试验中,报告了73%的cr(在2个月或更长时间时)。无论是否利用了car-t治疗的抗体,仍有显著数量的患者无法通过这些治疗获得帮助,并且有可观的空间用于改善治疗方法。
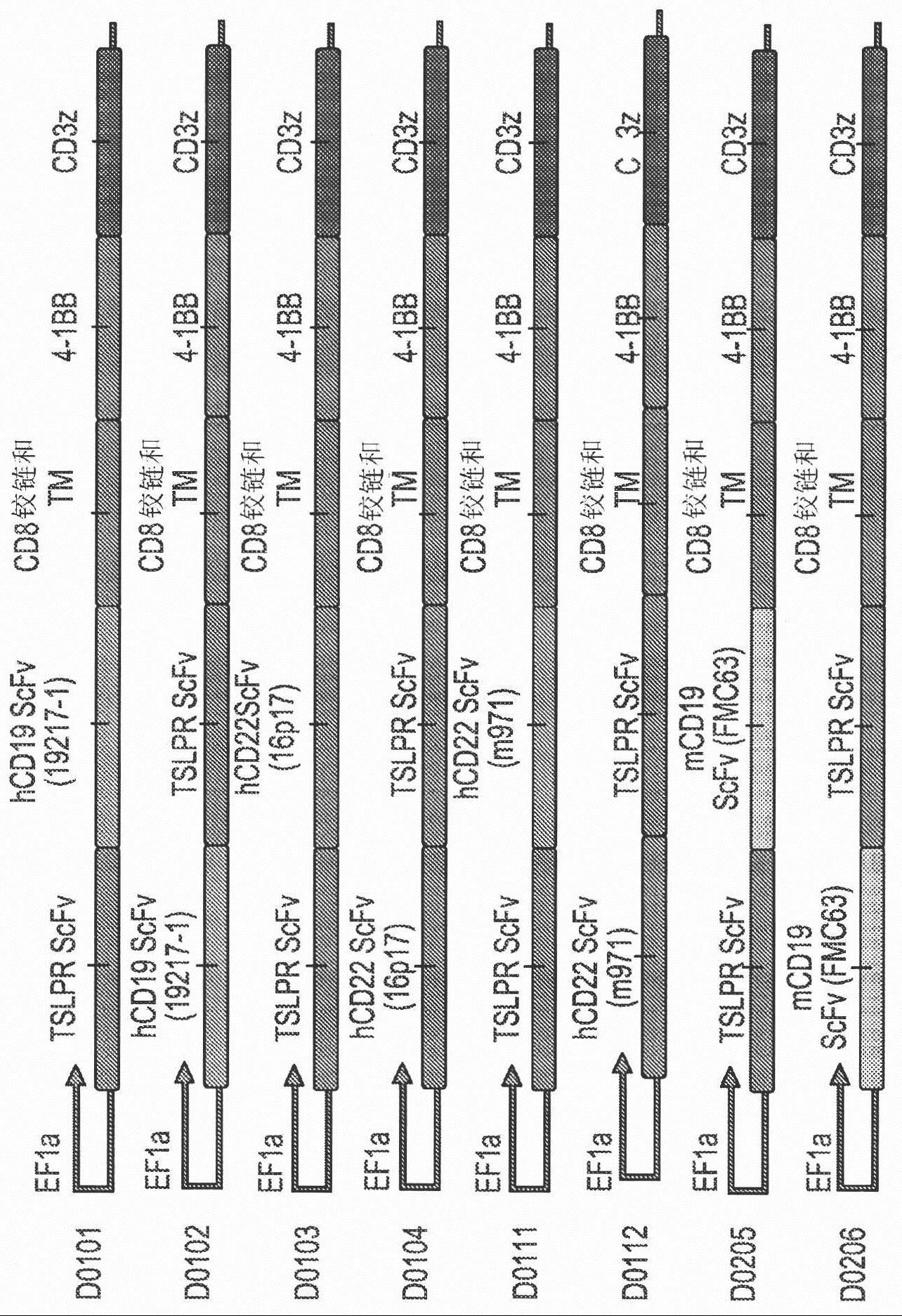
8、嵌合抗原受体(car)是包含以下三个基本单元的杂合分子:(1)胞外抗原结合基序、(2)连接/跨膜基序,以及(3)胞内t细胞信号传导基序(long ah,haso wm,orentasrj.lessons learned from a highly-active cd22-specific chimeric antigenreceptor.oncoimmunology.2013;2(4):e23621)。car的抗原结合基序通常仿照单链可变片段(single chain fragment variable,scfv),其是免疫球蛋白(ig)分子的最小结合结构域。还已改造了替选的抗原结合基序,例如受体配体(即,已将il-13改造成结合肿瘤表达的il-13受体)、完整免疫受体、文库来源肽和先天免疫系统效应分子(例如nkg2d)。用于car表达的替选细胞靶标(例如nk或γ-δt细胞)也在开发之中(brown ce et alclin cancerres.2012;18(8):2199-209;lehner m et al.plos one.2012;7(2):e31210)。关于限定最活跃的t细胞群以用car载体进行转导、确定最佳的培养和扩增技术,以及限定car蛋白结构本身的分子细节,仍然是需要完成的重要的工作。
9、car的连接基序可以是相对稳定的结构域(例如igg的恒定结构域)或被设计成是延伸的柔性接头。结构基序(例如来源于igg恒定结构域的那些)可用于将scfv结合结构域延伸远离t细胞质膜表面。这对于一些其中结合结构域与肿瘤细胞表面膜特别接近的肿瘤靶标而言可以是重要的(例如对于二唾液酸神经节苷脂gd2而言;orentas et al.,未发表的观察结果)。迄今为止,用于car的信号传导基序通常包含cd3-ζ链,因为该核心基序是t细胞活化的关键信号。报道的首个二代car以cd28信号传导结构域和cd28跨膜序列为特征。该基序还用于包含cd137(4-1bb)信号传导基序的三代car(zhao y et al j immunol.2009;183(9):5563-74)。随着新技术:用与抗cd3和抗cd28抗体连接的珠活化t细胞的出现,来自cd28的典型“信号2”的存在不再需要由car自身编码。通过使用珠激活,发现在体外测定中三代载体并不优于二代载体,并且在白血病的小鼠模型中三代载体相对于二代载体并未提供明显的益处(haso w,lee dw,shah nn,stetler-stevenson m,yuan cm,pastan ih,dimitrov ds,morgan ra,fitzgerald dj,barrett dm,wayne as,mackall cl,orentasrj.anti-cd22-chimeric antigen receptors targeting b cell precursor acutelymphoblastic leukemia,blood.2013;121(7):1165-74;kochenderfer jn etal.blood.2012;119(12):2709-20)。这通过以二代cd28/cd3-ζ(lee dw et al.americansociety of hematology annual meeting.new orleans,la;december 7-10,2013)和cd137/cd3-ζ信号传导格式(porter dl et al.n engl j med.2011;365(8):725-33)的cd19特异性car的临床成功被证明。除cd137之外,其他肿瘤坏死因子受体超家族成员(例如ox40)也能够在car转导的t细胞中提供重要的持续信号(yvon e et al.clin cancerres.2009;15(18):5852-60)。同样重要的是培养car t细胞群的培养条件,例如细胞因子il-2、il-7和/或il-15的包含(kaiser ad et al.cancer gene ther.2015;22(2):72-78)。
10、用于癌症的car治疗的更广泛且有效的适应中的目前的挑战与有力靶标的缺乏相关。建立细胞表面抗原的结合剂现今是可容易实现的,但是发现对肿瘤具有特异性同时不伤害正常组织的细胞表面抗原仍然是艰巨的挑战。赋予表达car的t细胞以更大靶细胞特异性的一种潜在方式是使用组合的car方法。在一种系统中,将cd3-ζ和cd28信号单元分离于在同一细胞内表达的两种不同car构建体中;在另一种系统中,在同一t细胞中表达两种car,但是一种具有较低的亲和力并且因此需要可替选的car首先进行接合以使另一者具有完全活性(lanitis e et al.cancer immunol res.2013;1(1):43-53;kloss cc etal.nat biotechnol.2013;31(1):71-5)。产生基于单scfv的car作为免疫治疗剂的另一挑战是肿瘤细胞异质性。至少一个团队已经开发了用于胶质母细胞瘤的car策略,其中效应细胞群同时靶向多种抗原(her2、il-13ra、epha2),希望避免靶抗原阴性群体的生长(hegde met al.mol ther.2013;21(11):2087-101)。
11、基于t细胞的免疫治疗已经成为合成生物学中的新前沿;预见多种启动子和基因产物将这些高度有效的细胞引导到肿瘤微环境,在此t细胞可避开负调节信号并且可介导有效的肿瘤杀伤。通过用基于化学的二聚化剂(例如ap1903)进行诱导型胱天蛋白酶9构建体的药物诱导二聚化来消除不期望的t细胞表明其中可在药理学上开启可控制t细胞群的强大开关的一种方式(di stasi a et al.n engl j med.2011;365(18):1673-83)。通过诱饵受体的表达而对转化生长因子β的负调节效应具有免疫的效应t细胞群的产生进一步表明针对最佳抗肿瘤活性可对效应t细胞进行改造的程度(foster ae et al.jimmunother.2008;31(5):500-5)。因此,虽然显示car可以以类似于内源性t细胞受体的方式触发t细胞活化,但是该技术的临床应用的主要障碍迄今为止受限于car+t细胞的体内扩增、输注之后细胞的迅速消失和令人失望的临床活性。这可部分归因于所采用的一些car序列的鼠源。
12、使用博纳吐单抗(双特异性抗cd19和抗cd3抗体)已对于接受该治疗的重症患者显示出令人印象深刻的结果。然而,持久缓解率小于40%,并且造血干细胞移植(hematopoietic stem cell transplant,hsct)最多仅能挽救50%的响应者(参见gore etal.,2014,nct01471782和von stackelberg,et al.,2014,nct01471782,总结于benjamin,je,stein as,2016,therapeutic advances in hematology 7:142-156)。已接受双特异性抗体或car-t治疗的患者随后进行hsct以维持持久应答的要求仍是积极争论的领域。尽管报道了cd19 car-t试验的高度响应,一些甚至大于90%,但如果将试验重塑为“意图治疗”试验,则该数字可更接近70%(davis kl,mackall cl,2016,blood advances 1:265-268)。在宾夕法尼亚大学,报道的car19治疗之后12个月的最佳结果显示,能够接受t细胞产品的患者中rfs为55%且os为79%(maude sl,teachey dt,rheingold sr,shaw pa,aplenc r,barrett dm,barker cs,callahan c,frey nv,farzana n,lacey sf,zheng a,levine b,melenhorst jj,motley l,prter dl,june ch,grupp sa,2016,j clin oncol 34,no15_suppl(may 2016)3011-3011)。
13、因此,在本领域中迫切且长期地需要发现用于使用可表现出特异性且有效抗肿瘤作用而没有前述缺点的方法来治疗b-all和其他表达tslpr、cd19和/或cd22的恶性肿瘤的新的组合物和方法。
14、本发明通过提供可用于治疗癌症和其他疾病和/或病症的car组合物和治疗方法而解决了这些需求。特别地,如本文中所公开和描述的本发明提供了这样的car:其可用于治疗与tslpr、cd19和/或cd22表达失调相关的疾病、障碍或病症,并且所述car包含在转导t细胞上表现出高表面表达的tslpr-cd19和/或tslpr-cd22抗原结合结构域,表现出表达tslpr、cd19和/或cd22的细胞的高度细胞溶解,并且其中转导的t细胞表现出体内扩增和持续性。
技术实现思路
0、发明概述
1、本文提供了新的tslpr-cd19、tslpr-cd22、tslpr-cd19-cd22和tslpr-cd22-cd19靶向抗体或其抗原结合结构域(其中在氨基酸序列中,tslpr靶向部分位于相应的cd19或cd22靶向部分之前或之后(下文分别称为“tslpr-cd19”和“tslpr-cd22”)),以及包含这样的tslpr-cd19、tslpr-cd22、tslpr-cd19-cd22和/或tslpr-cd22-cd19抗原结合结构域的嵌合抗原受体(car),以及表达受体的宿主细胞(例如,t细胞),和编码受体的核酸分子。car在转导的t细胞上表现出高表面表达,具有高度的细胞溶解,并且在体内具有转导的t细胞扩增和持续性。还提供了使用所公开的car、宿主细胞和核酸分子(例如来在对象中治疗癌症)的方法。
2、在一个方面中,提供了编码tslpr-cd19、tslpr-cd22、tslpr-cd19-cd22或tslpr-cd22-cd19嵌合抗原受体(car)的分离的核酸分子,其从n端到c端包含至少一个cd19和/或cd22抗原结合结构域、至少一个tslpr抗原结合结构域、至少一个跨膜结构域和至少一个胞内信号传导结构域,其中tslpr-cd19、tslpr-cd22、tslpr-cd19-cd22或tslpr-cd22-cd19car包含选自以下的核酸序列:seq id no:1、3、60、62、64、66、68、70、72、74、76、78、80、82、84、86、88、90、92、94、96和98。
3、在一个方面中,提供了编码tslpr-cd19、tslpr-cd22、tslpr-cd19-cd22或tslpr-cd22-cd19嵌合抗原受体(car)的分离的核酸分子,其从n端到c端包含至少一个cd19或cd22抗原结合结构域、至少一个tslpr抗原结合结构域、至少一个跨膜结构域和至少一个胞内信号传导结构域,其中由选自seq id no:1、3、60、62、64、66、68、70、72、74、76、78、80、82、84、86、88、90、92、94、96和98的核酸序列编码的tslpr-cd19、tslpr-cd22、tslpr-cd19-cd22或tslpr-cd22-cd19 car编码包含选自seq id no:2、4、61、63、65、67、69、71、73、75、77、79、81、83、85、87、89、91、93、95、97和99的氨基酸序列的tslpr-cd19、tslpr-cd22、tslpr-cd19-cd22或tslpr-cd22-cd19 car。
4、在一个实施方案中,提供了编码car的分离的核酸分子,其中所编码的胞外tslpr-cd19、tslpr-cd22、tslpr-cd19-cd22或tslpr-cd22-cd19抗原结合结构域包含与tslpr、cd19或cd22结合的抗体的至少一个单链可变片段。
5、在另一个实施方案中,提供了编码car的分离的核酸分子,其中所编码的胞外tslpr-cd19、tslpr-cd22、tslpr-cd19-cd22或tslpr-cd22-cd19抗原结合结构域包含与tslpr、cd19或cd22结合的抗体的至少一个重链可变区。
6、在另一个实施方案中,提供了编码car的分离的核酸分子,其中所编码的car胞外tslpr-cd19、tslpr-cd22、tslpr-cd19-cd22或tslpr-cd22-cd19抗原结合结构域还包含至少一种与tslpr、cd19或cd22结合的基于脂质运载蛋白的抗原结合抗原(抗运载蛋白)。
7、在一个实施方案中,提供了分离的核酸分子,其中所编码的胞外tslpr-cd19、tslpr-cd22、tslpr-cd19-cd22或tslpr-cd22-cd19抗原结合结构域通过接头结构域与跨膜结构域连接。
8、在另一个实施方案中,提供了编码car的分离的核酸分子,其中所编码的tslpr-cd19、tslpr-cd22、tslpr-cd19-cd22或tslpr-cd22-cd19胞外抗原结合结构域之前是编码前导肽或信号肽的序列。
9、在另一个实施方案中,提供了编码car的分离的核酸分子,其包含至少一个由这样的核苷酸序列编码的tslpr-cd19、tslpr-cd22、tslpr-cd19-cd22或tslpr-cd22-cd19抗原结合结构域,所述核苷酸序列包含分别含有在seq id no:1、3、60、62、64、66、68、70、72、74、76、78、80、82、84、86、88、90、92、94、96和98中的tslpr-cd19、tslpr-cd22、tslpr-cd19-cd22或tslpr-cd22-cd19核苷酸序列,并且其中car另外编码靶向抗原的胞外抗原结合结构域,所述抗原包括但不限于cd22、ror1、间皮素、cd33、cd38、cd123(il3ra)、cd138、bcma(cd269)、gpc2、gpc3、fgfr4、c-met、psma、glycolipid f77、egfrviii、gd-2、ny-eso-1 tcr、mage a3 tcr或其任意组合。
10、在一个实施方案中,car构建体由通过2a核糖体跳读元件在同一细胞中共表达的两条car链构成,一条car链包含针对cd19抗原的靶向结构域,以及另一条car链包含针对tslpr抗原的car靶向结构域。与靶向结构域框内融合,每条链都包含铰链/接头/间隔区结构域、跨膜结构域和cd3z激活结构域。在每条car链中框内可包含零个、一个或更多个共刺激结构域。
11、在一个实施方案中,car构建体由通过2a核糖体跳读元件在同一细胞中共表达的两条car链构成,一条car链包含针对cd22抗原的靶向结构域,以及另一条car链包含针对tslpr抗原的car靶向结构域,与靶向结构域框内融合,每条链都包含铰链/接头/间隔区结构域、跨膜结构域和cd3z激活结构域。在每条car链中框内可包含零个、一个或更多个共刺激结构域。
12、在一个实施方案中,car构建体由通过2a核糖体跳读元件在同一细胞中共表达的两条car链构成,一条car链包含针对cd19抗原的靶向结构域,另一条car链包含针对cd22的car靶向结构域,以及另一条car链包含针对tslpr抗原的car靶向结构域。与靶向结构域框内融合,每条链都包含铰链/接头/间隔区结构域、跨膜结构域和cd3z激活结构域。在每条car链中框内可包含零个、一个或更多个共刺激结构域。
13、在一个实施方案中,car链包含顺序连接的两个共刺激结构域(三代car)。
14、在某些实施方案中,提供了编码car的分离的核酸分子,其中另外编码的胞外抗原结合结构域包含抗cd22 scfv抗原结合结构域、抗cd19 scfv抗原结合结构域、抗ror1 scfv抗原结合结构域、抗间皮素scfv抗原结合结构域、抗cd33 scfv抗原结合结构域、抗cd38scfv抗原结合结构域、抗cd123(il3ra)scfv抗原结合结构域、抗cd138 scfv抗原结合结构域、抗bcma(cd269)scfv抗原结合结构域、抗gpc2 scfv抗原结合结构域、抗gpc3 scfv抗原结合结构域、抗fgfr4 scfv抗原结合结构域、抗tslpr scfv抗原结合结构域、抗c-met scfv抗原结合结构域、抗pmsa scfv抗原结合结构域、抗糖脂f77 scfv抗原结合结构域、抗egfrviii scfv抗原结合结构域、抗gd-2 scfv抗原结合结构域、抗ny-eso-1 tcr scfv抗原结合结构域、抗mage a3 tcr scfv抗原结合结构域,或与其具有85%、90%、95%、96%、97%、98%或99%同一性的氨基酸序列,或其任意组合。
15、在一个方面中,本文中提供的car还包含接头或间隔区结构域。
16、在一个实施方案中,提供了编码car的分离的核酸分子,其中胞外tslpr-cd19、tslpr-cd22、tslpr-cd19-cd22或tslpr-cd22-cd19抗原结合结构域、胞内信号传导结构域或这二者通过接头或间隔区结构域与跨膜结构域连接。
17、在一个实施方案中,提供了编码car的分离的核酸分子,其中所编码的接头结构域来源于cd8或cd28的胞外结构域,并且与跨膜结构域连接。
18、在另一个实施方案中,提供了编码car的分离的核酸分子,其中所编码的car还包含跨膜结构域,所述跨膜结构域包含选自以下的蛋白质的跨膜结构域:t细胞受体的α、β或ζ链,cd28、cd3ε、cd45、cd4、cd5、cd8、cd9、cd16、cd22、cd33、cd37、cd64、cd80、cd83、cd86、cd134、cd137和cd154,或其组合。
19、在另一个实施方案中,提供了编码car的分离的核酸分子,其中所编码的胞内信号传导结构域还包含cd3ζ胞内结构域。
20、在一个实施方案中,提供了编码car的分离的核酸分子,其中所编码的胞内信号传导结构域相对于cd3ζ细胞内结构域布置在c端侧。
21、在另一个实施方案中,提供了编码car的分离的核酸分子,其中所编码的至少一个胞内信号传导结构域包含共刺激结构域、初级信号传导结构域,或其组合。
22、在另一些实施方案中,提供了编码car的分离的核酸分子,其中所编码的至少一个共刺激结构域包含以下的功能性信号传导结构域:ox40、cd70、cd27、cd28、cd5、icam-1、lfa-1(cd11a/cd18)、icos(cd278)、dap10、dap12和4-1bb(cd137),或其组合。
23、在一个实施方案中,提供了编码car的分离的核酸分子,所述car还包含前导序列或信号肽,其中前导或信号肽核苷酸序列包含seq id no:11的核苷酸序列。
24、在另一个实施方案中,提供了编码car的分离的核酸分子,其中所编码的前导序列包含seq id no:12的氨基酸序列。
25、在一个方面中,本文中提供了嵌合抗原受体(car),其从n端到c端包含至少一个cd19和/或cd22抗原结合结构域、至少一个tslpr抗原结合结构域、至少一个跨膜结构域和至少一个胞内信号传导结构域。
26、在一个实施方案中,提供了car,其中胞外tslpr-cd19、tslpr-cd22、tslpr-cd19-cd22或tslpr-cd22-cd19抗原结合结构域包含与抗原结合的抗体的至少一个单链可变片段、或与抗原结合的抗体的至少一个重链可变区,或其组合。
27、在另一个实施方案中,提供了car,其中至少一个跨膜结构域包含选自以下的蛋白质的跨膜结构域:t细胞受体的α、β或ζ链,cd28、cd3ε、cd45、cd4、cd5、cd8、cd9、cd16、cd22、cd33、cd37、cd64、cd80、cd86、cd134、cd137、cd154、tnfrsf19,或其组合。
28、在一些实施方案中,提供了car,其中car另外编码包含以下的胞外抗原结合结构域:cd22、ror1、间皮素、cd33、cd38、cd123(il3ra)、cd138、bcma(cd269)、gpc2、gpc3、fgfr4、tslpr、c-met、psma、糖脂f77、egfrviii、gd-2、ny-eso-1 tcr、mage a3 tcr,或与其具有85%、90%、95%、96%、97%、98%或99%同一性的氨基酸序列,或其任意组合。
29、在一个实施方案中,提供了car,其中胞外抗原结合结构域包含抗cd22 scfv抗原结合结构域、抗ror1scfv抗原结合结构域、抗间皮素scfv抗原结合结构域、抗cd33 scfv抗原结合结构域、抗cd38 scfv抗原结合结构域、抗cd123(il3ra)scfv抗原结合结构域、抗cd138 scfv抗原结合结构域、抗bcma(cd269)scfv抗原结合结构域、抗gpc2 scfv抗原结合结构域、抗gpc3 scfv抗原结合结构域、抗fgfr4 scfv抗原结合结构域、抗c-met scfv抗原结合结构域、抗pmsa scfv抗原结合结构域、抗糖脂f77 scfv抗原结合结构域、抗egfrviiiscfv抗原结合结构域、抗gd-2 scfv抗原结合结构域、抗ny-eso-1 tcr scfv抗原结合结构域、抗mage a3 tcr scfv抗原结合结构域,或与其具有85%、90%、95%、96%、97%、98%或99%同一性的氨基酸序列,或其任意组合。
30、在另一个实施方案中,提供了car,其中至少一个胞内信号传导结构域包含共刺激结构域和初级信号传导结构域。
31、在另一个实施方案中,提供了car,其中至少一个胞内信号传导结构域包含共刺激结构域,所述共刺激结构域包含选自以下的蛋白质的功能性信号传导结构域:ox40、cd70、cd27、cd28、cd5、icam-1、lfa-1(cd11a/cd18)、icos(cd278)、dap10、dap12和4-1bb(cd137),或其组合。
32、在一个实施方案中,编码car的核酸序列包含seq id no:84的核酸序列。
33、在一个实施方案中,核酸序列编码包含seq id no:85的氨基酸序列的car。
34、在一个实施方案中,编码car的核酸序列包含seq id no:86的核酸序列。
35、在一个实施方案中,核酸序列编码包含seq id no:87的氨基酸序列的car。
36、在一个实施方案中,编码car的核酸序列包含seq id no:88的核酸序列。
37、在一个实施方案中,核酸序列编码包含seq id no:89的氨基酸序列的car。
38、在一个实施方案中,编码car的核酸序列包含seq id no:90的核酸序列。
39、在一个实施方案中,核酸序列编码包含seq id no:91的氨基酸序列的car。
40、在一个实施方案中,编码car的核酸序列包含seq id no:92的核酸序列。
41、在一个实施方案中,核酸序列编码包含seq id no:93的氨基酸序列的car。
42、在一个实施方案中,编码car的核酸序列包含seq id no:94的核酸序列。
43、在一个实施方案中,核酸序列编码包含seq id no:95的氨基酸序列的car。
44、在一个实施方案中,编码car的核酸序列包含seq id no:96的核酸序列。
45、在一个实施方案中,核酸序列编码包含seq id no:97的氨基酸序列的car。
46、在一个实施方案中,编码car的核酸序列包含seq id no:98的核酸序列。
47、在一个实施方案中,核酸序列编码包含seq id no:99的氨基酸序列的car。
48、在一个方面中,本文中所公开的car被修饰以表达或包含可检测标记以用于诊断、监测和/或预测治疗结局(例如癌症患者的无进展存活)或用于监测这样的治疗的进展。
49、在一个实施方案中,编码所公开car的核酸分子可包含在载体,例如病毒载体中。载体是dna载体、rna载体、质粒载体、黏粒载体、疱疹病毒载体、麻疹病毒载体、慢病毒载体、腺病毒载体或逆转录病毒载体,或其组合。
50、在某些实施方案中,载体还包含启动子,其中所述启动子是诱导型启动子、组织特异性启动子、组成型启动子、自杀型启动子(suicide promoter),或其任意组合。
51、在另一个实施方案中,表达car的载体还可被修饰以包含一个或更多个控制car t细胞表达或借助自杀开关来消除car-t细胞的操纵元件。自杀开关可包括例如凋亡诱导性信号传导级联反应或诱导细胞死亡的药物。在一个优选实施方案中,表达car的载体还可被修饰以表达酶,例如胸苷激酶(thymidine kinase,tk)或胞嘧啶脱氨酶(cytosinedeaminase,cd)。
52、在另一方面中,还提供了包含编码car的核酸分子的宿主细胞。在一些实施方案中,宿主细胞是t细胞,例如从对象获得的原代t细胞。在一个实施方案中,宿主细胞是cd8+t细胞。
53、在另一方面中,提供了包含抗肿瘤有效量的人t细胞群的药物组合物,其中所述t细胞包含编码嵌合抗原受体(car)的核酸序列,所述嵌合抗原受体(car)包含seq id no.2、4、61、63、65、67、69、71、73、75、77、79、81、83、85、87、89、91、93、95、97和99的氨基酸序列,其中所述car包含至少一个包含tslpr-cd19、tslpr-cd22、tslpr-cd19-cd22或tslpr-cd22-cd19抗原结合结构域的胞外抗原结合结构域、至少一个接头结构域、至少一个跨膜结构域和至少一个胞内信号传导结构域,其中所述t细胞是患有癌症的人的t细胞。所述癌症尤其包括血液学癌症(hematological cancer),例如白血病(例如,慢性淋巴细胞白血病(chronic lymphocytic leukemia,cll)、急性淋巴细胞白血病(all)或慢性髓细胞性白血病(chronic myelogenous leukemia,cml))、淋巴瘤(例如,套细胞淋巴瘤、非霍奇金淋巴瘤(non-hodgkin’s lymphoma)或霍奇金淋巴瘤(hodgkin’s lymphoma))、或多发性骨髓瘤,或其组合。
54、在一个实施方案中,提供了药物组合物,其中car的至少一个跨膜结构域包含选自以下的蛋白质的跨膜结构域:t细胞受体的α、β或ζ链,cd28、cd3ε、cd45、cd4、cd5、cd8、cd9、cd16、cd22、间皮素、cd33、cd37、cd64、cd80、cd83、cd86、cd134、cd137、cd154、tnfrsf19,或其组合。
55、在另一个实施方案中,提供了药物组合物,其中人癌症包括成人上皮癌(adultcarcinoma),其包括:口腔和咽癌(舌、口、咽、头和颈)、消化系统癌症(食管、胃、小肠、结肠、直肠、肛门、肝、肝内胆管、胆囊、胰腺)、呼吸系统癌症(喉、肺和支气管)、骨和关节癌、软组织癌、皮肤癌(黑素瘤、基底和鳞状细胞癌)、儿童肿瘤(神经母细胞瘤、横纹肌肉瘤、骨肉瘤、尤因肉瘤(ewing’s sarcoma))、中枢神经系统的肿瘤(脑、星形细胞瘤、胶质母细胞瘤、胶质瘤),以及乳腺、生殖系统(子宫颈、子宫体、卵巢、外阴、阴道、前列腺、睾丸、阴茎、子宫内膜)、泌尿系统(膀胱、肾和肾盂、输尿管)、眼和眶、内分泌系统(甲状腺)以及脑和其他神经系统的癌症,或其任意组合。
56、在另一个实施方案中,提供了包含抗肿瘤有效量的患有癌症之人的人t细胞群的药物组合物,其中所述癌症是对一种或更多种化学治疗剂不具有响应性的难治性癌症。所述癌症包括造血性癌症(hematopoietic cancer)、骨髓增生异常综合征、胰腺癌、头颈癌、皮肤肿瘤、以下中的微小残留病(minimal residual disease,mrd):急性淋巴细胞白血病(all);急性髓性白血病(acute myeloid leukemia,aml);成人b细胞恶性肿瘤,包括cll(慢性淋巴细胞白血病)、cml(慢性髓细胞性白血病)、非霍奇金淋巴瘤(nhl);儿童b细胞恶性肿瘤(包括b谱系all(急性淋巴细胞白血病));多发性骨髓瘤;肺癌;乳腺癌;卵巢癌;前列腺癌;结肠癌;黑素瘤或其他血液学癌症和实体瘤,或其任意组合。
57、另一方面中,提供了制备包含car的t细胞(下文中的“car-t细胞”)的方法。所述方法包括用编码特异性结合tslpr、cd19和/或cd22的所公开car的载体或核酸分子转导t细胞,从而制备car-t细胞。
58、在另一方面中,提供了产生经rna改造细胞群的方法,其包括将编码所公开car的核酸分子的体外转录rna或合成rna引入对象的细胞中,从而产生car细胞。
59、在一个实施方案中,与tslpr、cd19和/或cd22表达相关的疾病、障碍或病症是癌症,其包括造血性癌症、骨髓增生异常综合征、胰腺癌、头颈癌、皮肤肿瘤、以下中的微小残留病(mrd):急性淋巴细胞白血病(all);急性髓性白血病(aml);成人b细胞恶性肿瘤,包括cll(慢性淋巴细胞白血病)、cml(慢性髓细胞性白血病)、非霍奇金淋巴瘤(nhl);儿童b细胞恶性肿瘤(包括b谱系all(急性淋巴细胞白血病));多发性骨髓瘤;肺癌;乳腺癌;卵巢癌;前列腺癌;结肠癌;黑素瘤或其他血液学癌症和实体瘤,或其任意组合。
60、在另一个实施方案中,提供了在哺乳动物中阻断由表达tslpr-cd19、tslpr-cd22、tslpr-cd19-cd22或tslpr-cd22-cd19的细胞介导的t细胞抑制并改变肿瘤微环境以抑制肿瘤生长的方法,其包括向所述哺乳动物施用有效量的包含car的组合物,所述car包含选自seq id no.2、4、61、63、65、67、69、71、73、75、77、79、81、83、85、87、89、91、93、95、97和99的氨基酸序列。在一个实施方案中,所述细胞选自表达tslpr、cd19和/或cd22的肿瘤细胞、肿瘤相关巨噬细胞,及其任意组合。
61、在另一个实施方案中,提供了在哺乳动物中抑制、阻抑或防止抗肿瘤或抗癌免疫应答的免疫抑制的方法,其包括向所述哺乳动物施用有效量的包含car的组合物,所述car选自seq id no.2、4、61、63、65、67、69、71、73、75、77、79、81、83、85、87、89、91、93、95、97和99。在一个实施方案中,所述car抑制第一细胞与t细胞之间的相互作用,其中所述第一细胞选自tslpr、cd19和/或cd22表达肿瘤细胞、肿瘤相关巨噬细胞,及其任意组合。
62、在另一方面中,提供了用于在哺乳动物中诱导抗肿瘤免疫的方法,其包括向所述哺乳动物施用治疗有效量的经编码所公开car的载体或核酸分子转导的t细胞。
63、在另一个实施方案中,提供了在哺乳动物中治疗或预防癌症的方法,其包括以在所述哺乳动物中有效治疗或预防癌症的量向所述哺乳动物施用一种或更多种所公开的car。所述方法包括在以下条件下向对象施用治疗有效量的表达特异性结合tslpr、cd19和/或cd22和/或一种或更多种前述抗原的所公开car的宿主细胞,所述条件足以在所述对象中形成car上抗原结合结构域与tslpr、cd19和/或cd22和/或一种或更多种前述抗原的胞外结构域的免疫复合物。
64、在另一个实施方案中,提供了用于治疗患有与肿瘤抗原表达升高相关的疾病、障碍或病症的哺乳动物的方法,所述方法包括向所述对象施用包含抗肿瘤有效量的t细胞群的药物组合物,其中所述t细胞包含编码嵌合抗原受体(car)的核酸序列,其中所述car包含至少一个胞外tslpr、cd19和/或cd22抗原结合结构域或其任意组合、至少一个接头或间隔区结构域、至少一个跨膜结构域、至少一个胞内信号传导结构域,并且其中所述t细胞是患有癌症的对象的t细胞。
65、在另一个实施方案中,提供了用于在有此需要的对象中治疗癌症的方法,其包括向所述对象施用包含抗肿瘤有效量的t细胞群的药物组合物,其中所述t细胞包含编码嵌合抗原受体(car)的核酸序列,其中所述car包含seq id no:2、4、61、63、65、67、69、71、73、75、77、79、81、83、85、87、89、91、93、95、97和99的氨基酸序列或其任意组合,其中所述t细胞是患有癌症的对象的t细胞。在前述方法的一些实施方案中,至少一个跨膜结构域包含以下的跨膜结构域:t细胞受体的α、β或ζ链,cd28、cd3ε、cd45、cd4、cd5、cd8、cd9、cd16、cd19、cd22、间皮素、cd33、cd37、cd64、cd80、cd83、cd86、cd134、cd137、cd154、tnfrsf16、tnfrsf19,或其组合。
66、在另一个实施方案中,提供了用于在被诊断患有癌症的人中产生持续性经遗传改造t细胞群的方法。在一个实施方案中,所述方法包括向人施用被遗传改造成表达car的t细胞,其中所述car包含seq id no:2、4、61、63、65、67、69、71、73、75、77、79、81、83、85、87、89、91、93、95、97和99的氨基酸序列或其任意组合、至少一个跨膜结构域和至少一个胞内信号传导结构域,其中在施用之后,所述持续性经遗传改造t细胞群或所述t细胞的后代的群体在人中持续至少1个月、2个月、3个月、4个月、5个月、6个月、7个月、8个月、9个月、10个月、11个月、12个月、2年或3年。
67、在一个实施方案中,人中的后代t细胞包含记忆t细胞。在另一个实施方案中,所述t细胞是自体t细胞。
68、在本文中所述的方法的所有方面和实施方案中,与肿瘤抗原表达升高相关的任一种前述癌症、疾病、障碍或病症都可使用本文中公开的一种或更多种car来治疗或预防或改善。
69、在另一方面中,提供了用于制备如上所述的嵌合抗原受体t细胞或用于如上所述在对象中预防、治疗或改善与肿瘤抗原表达升高相关的任一种癌症、疾病、障碍或病症的药盒(kit),其包含容器和用于使用所述药盒的说明书,所述容器包含上文公开的任一种核酸分子、载体、宿主细胞或组合物,或其任意组合。
70、应理解,car、宿主细胞、核酸和方法在本文中详细描述的特定方面和实施方案之外也是可用的。本公开内容的前述特征和优点将通过以下详细描述变得更明显,该详细描述通过参照附图来进行。
- 还没有人留言评论。精彩留言会获得点赞!