用于大规模制造多能干细胞来源的细胞的封闭制造工艺的制作方法
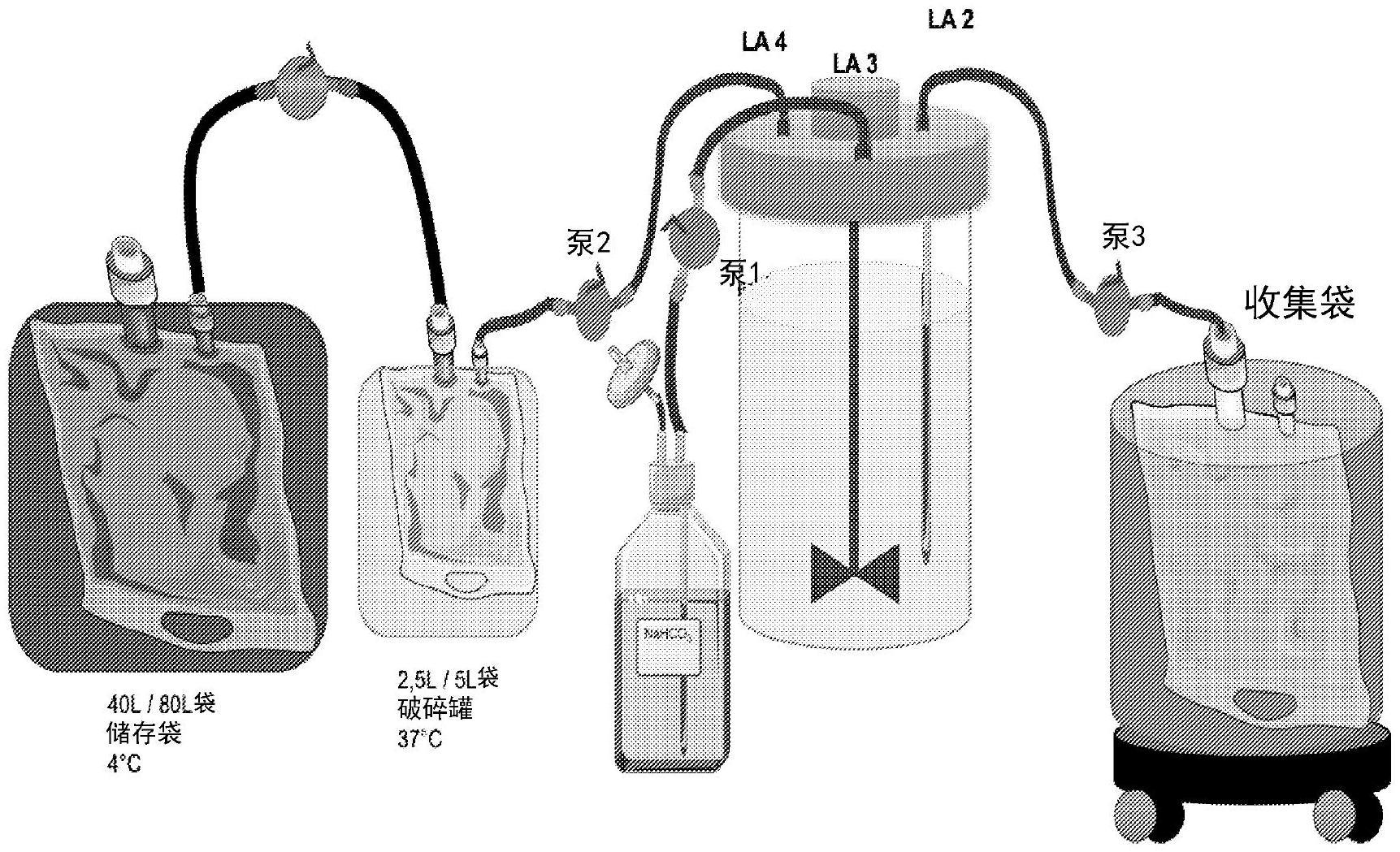
背景技术:
1、背景说明包括可能有用于理解本发明的信息。这并不是承认本文提供的任何信息是现有技术或与目前要求保护的发明相关,或者明确或隐含引用的任何出版物是现有技术。
2、在整个医学领域,基于干细胞的应用的疗法被认为是有前途的。尤其是具有增殖和分化潜力的多能干细胞(pscs)的可用性被认为是临床中细胞治疗(也称为细胞疗法、细胞替代疗法或基于细胞的疗法)的有前途的发展。例如诱导性多能干细胞和胚胎多能干细胞等多能干细胞,由于其多能性,能够分化成用于预期治疗用途的目标细胞。例如,从此类多能干细胞离体获得的神经元细胞、视网膜细胞、肺细胞、肝细胞、胰腺细胞、心血管细胞、或免疫系统的细胞用于细胞治疗的可用性将是最受欢迎的。
3、这样的多能干细胞来源的细胞的潜在治疗用途的一个实例是使用心肌细胞、内皮细胞、成纤维细胞和/或这些细胞的任何组合来替代不可逆损伤的心肌以治疗心肌梗塞(参见,例如,cell&gene therapy insights 2020;6(1),177–191doi:10.18609/cgti.2020.023)。
4、这样的多能干细胞来源的细胞的治疗用途的另一个实例可以是使用携带靶向肿瘤的抗原受体的同种异体或自体免疫细胞治疗癌症。其它实例可以是(诱导性)多能干细胞来源的淋巴细胞用于过继细胞免疫疗法的用途(参见,例如,curr hematol maligrep.2019;14(4):261–268doi:10.1007/s11899-019-00528-6)。
5、潜在的治疗用途,例如上文例示的一种,需要大量的多能干细胞来源的细胞。例如,在心肌梗塞中,可能有超过10亿个心肌细胞受到不可逆损伤。利用当前可用的方案,这仍然需要时间和材料上的巨大投资以能够在临床良好生产规范(clinical goodmanufacturing practice,cgmp)条件下制造足够量的细胞。
6、对于其它适应症,例如眼睛的疾病,较少量的细胞足以治疗一名患者,但是制造足够的细胞用于全球患者群体仍然需要扩大制造工艺以达到需求能力。
7、一个主要缺点在于,本领域已知的用于将(诱导性)ipsc分化成一种以上的预选的期望的细胞类型(例如肝细胞)的方法依赖于在小培养皿或烧瓶中最多产生每皿几百万个细胞的劳动密集型工艺,这使得制造足够的细胞用于治疗成为细胞疗法领域的头号挑战。
8、因此,为了满足工业上可应用的可扩大的制造工艺的需求,需要该领域提供可扩大的方法,并且所述方法可以与临床良好生产规范(cgmp)相容。只有在此类方法可用的情况下,才有可能生产大量的多能干细胞,并且更重要的是,大量的(预选的)多能干细胞来源的分化细胞,包括上述提及的那些。因此,高度期望以允许多能干细胞来源的分化细胞的安全、不受干扰、可控、可预测、较低操作强度和较低劳动强度的生产的方式扩大现有的培养、分化和制造工艺。
9、在本领域中充分确立的是,通过将多能干细胞暴露于特定的培养条件或方案,使用包含特定小分子和其它引导(steering)化合物(的组合)的培养基,可以诱导和控制多能干细胞向不同谱系的细胞分化(参见,例如,breckwoldt等.nat protoc.2017jun;12(6):1177-1197.doi:10.1038/nprot.2017.033或induced pluripotent stem cells–methodsand protocols(turksen and nagy);doi:10.1007/978-1-4939-3055-5)。包含小分子或引导化合物(的组合)以例如激动或拮抗在细胞分化的特定阶段中引导分化的特定途径。这意指在分化过程中在正确的时间调节正确的途径在该领域中被认为是重要的。类似地,认为拮抗或抵消在分化的特定阶段期间所需的途径的途径不被激活或被拮抗是重要的。事实上,这并不罕见,例如,需要在分化的第一阶段期间被拮抗以分化成预选细胞类型的途径,在分化的后期阶段期间不起作用,并且不应该再被拮抗,或者甚至应该在分化的后期阶段期间被激动,因为这可能在分化的后期阶段期间负面地影响分化(参见例如,欧洲专利文献ep3433355)。
10、小规模的细胞分化的方法是通过如下来进行的:在生物安全柜中操纵细胞并在培养箱中培养,通过人工操作来进行利用其它培养基的培养基替换(例如,用包含用于相同途径的第二例如拮抗性引导化合物的第二培养基替换包含第一例如激动性引导化合物的第一培养基)。然而,该领域正在寻找将人工操作减少到最低的培养系统。即,人工操作难以规模化、非常昂贵并且带来污染和破坏培养物的无菌性的重大风险。
11、同时,非常需要提高制造的可重复性和一致性。人工培养系统中的工艺参数的实时调整是劳动密集型的,因此难以实施。因此,该领域正在寻找可被监控并且可以在适当的地方进行调整的制造系统。
12、同时,该领域正在寻求扩展从多能干细胞获得的分化细胞的制造规模。然而,基于多个烧瓶的横向扩展(scale out)策略是极其劳动密集型的并且费时的。为了提供大量的细胞,需要数百个烧瓶,这在收获细胞和将细胞作为单批次进行下游处理方面面临着重大挑战。。此外,存在每个培养瓶的细胞质量的显著差异的风险(参见,例如,assou等(2018)stem cells 36,814–821)。
13、因此,已经在该领域开始多项举措以提供能够扩大多能干细胞培养的新方法。然而,此类系统的局限性在于,在培养期间,例如在进行细胞分化的下一阶段之前,所述系统仍然需要离心步骤、过滤步骤和/或洗涤步骤,诸如,例如wo2009/072003中所述。
14、现有技术中描述的在生物反应器中培养多能干细胞的方法主要涉及在培养中维持/支持干细胞群体。在这样的方法中,培养通过连续搅拌来维持,其中一旦如此频繁地人工更换培养细胞的培养基,有破坏系统的无菌性的风险。描述用于培养多能干细胞的搅拌罐式生物反应器的其它先前描述的方法利用灌注系统用于封闭系统中的培养基更换。这样的灌注系统的缺点在于存在过滤器堵塞的风险,特别是如果在培养期间必须更换大量的培养基。
15、重要的是,扩大多能干细胞来源的细胞制造通常需要向多能干细胞和/或多能干细胞来源的细胞提供一系列的不同的培养基。在这种获得分化细胞的过程中,一系列的培养基包含制备和/或诱导细胞定向分化的(不同的)化合物的组合。然而,利用封闭系统培养的本领域目前已知的方法限于维持或产生多能干细胞,并且目前没有以可控的方式和在封闭培养系统中生产大量的多能干细胞来源的分化细胞的可靠、可预测、易于操作的培养方法,并且细胞疗法的应用中的这一瓶颈在本领域中被广泛认可。
16、鉴于此,高度期望培养和生产大量的(预选的)干细胞来源的分化细胞的新方法。特别地,在本领域中明显需要可靠、有效并且可重复的方法,并且所述方法允许制造大量的不同类型的多能干细胞来源的分化细胞。
17、因此,本发明的技术问题可为提供满足任何前述需求的此类方法。所述技术问题通过权利要求和下文中表征的实施方案而得到解决。
技术实现思路
- 还没有人留言评论。精彩留言会获得点赞!