高度纯化的病毒颗粒的制剂的制作方法
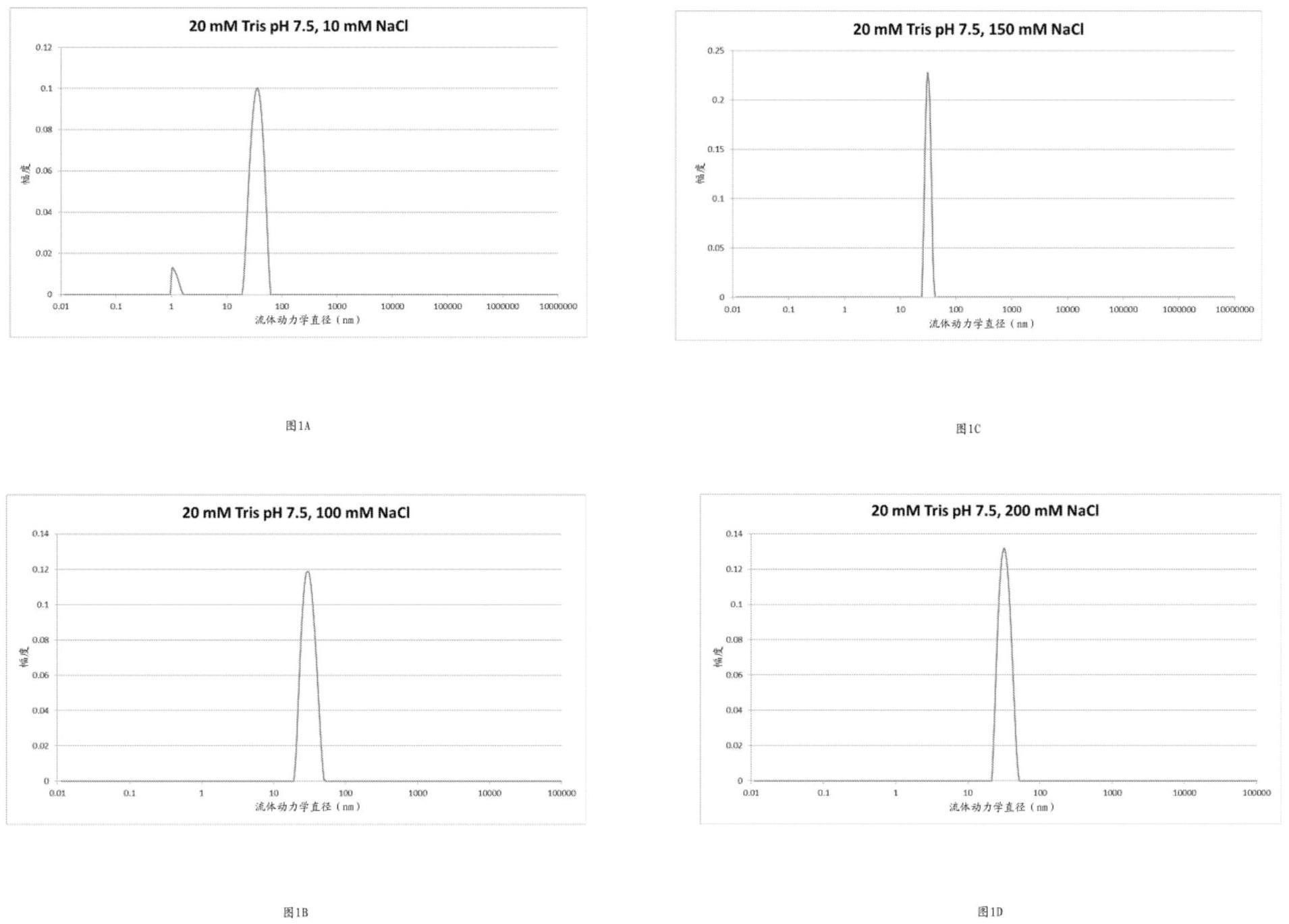
1.本文尤其提供了高度纯化的病毒颗粒(例如,腺相关病毒(aav)颗粒)的制剂。这些制剂可以包含基本上不含杂质(例如,产物相关杂质和工艺相关杂质)的纯化的aav颗粒,以及缓冲剂、冷冻保护剂、非离子表面活性剂和任选的药学上可接受的盐中的一种或多种。在某些方面,本文提供的制剂维持或增强纯化的aav颗粒的稳定性并且/或者减少或防止它们的聚集。
背景技术:
0、2.背景技术
1、腺相关病毒(aav)是一种无包膜病毒,其可经工程化以将核酸递送到靶细胞,并且已成为基因治疗和基因递送应用中的有用载体。缺少病毒dna的重组aav(raav)基本上是基于蛋白质的纳米颗粒,其经工程化以穿过细胞膜,最终可在此将其核酸货物运输和递送到细胞核中。该病毒赋予的特性:当与其他病毒系统相比时,持续的基因表达、因具有广泛组织嗜性而天然存在于人类群体中、非整合性、非致病性、低免疫原性、有丝分裂后细胞的感染性和相对易生产,迎来了人类使用方面的迅速扩张。基于aav(包括raav)的基因递送载体已成为众多临床基因疗法应用的安全且有效的载体。
2、aav颗粒的生产和纯化仍然是主要的挑战。此外,在纯化后,开发能够维持病毒感染性和物理稳定性的制剂对于确保向患者提供具有一致生物性能的高质量产品变得至关重要。对病毒载体的一个特别关注点是它们的聚集倾向(参见wright等人,moleculartherapy,2005)。因此,本文提供了一种新型aav制剂,该制剂解决了对含有具有改善的稳定性和最小聚集的高纯度aav颗粒的制剂的未满足的需求。
3、3.
技术实现要素:
4、在一个方面,本文提供了一种包含纯化的aav颗粒、缓冲剂、冷冻保护剂和非离子表面活性剂的药物组合物,其中(a)纯化的aav颗粒基本上不含杂质,(b)缓冲剂的浓度为约0mm至约50mm,(c)冷冻保护剂为约1%至约10%(w/v),并且(d)非离子表面活性剂为约0.0001%(w/v)至约0.1%(w/v)。在一个实施方案中,药物组合物包括药学上可接受的盐,其中药学上可接受的盐的浓度为约1mm至约200mm。在一个实施方案中,药学上可接受的盐为约10mm至约150mm。在一个实施方案中,药学上可接受的盐的浓度为约10mm。在一个实施方案中,药学上可接受的盐的浓度为约100mm。在一个实施方案中,药学上可接受的盐的浓度为约150mm。
5、在一个方面,本文提供了一种包含纯化的aav颗粒、药学上可接受的盐、缓冲剂、冷冻保护剂和非离子表面活性剂的药物组合物,其中(a)纯化的aav颗粒基本上不含杂质,(b)药学上可接受的盐的浓度为约1mm至约49mm,(c)缓冲剂的浓度为约0mm至约50mm,(d)冷冻保护剂为约1%至约10%(w/v),并且(e)非离子表面活性剂为约0.0001%(w/v)至约0.1%(w/v)。在一个实施方案中,药学上可接受的盐的浓度为约5mm至约45mm。在一个实施方案中,药学上可接受的盐的浓度为约7.5mm至约40mm。在一个实施方案中,药学上可接受的盐的浓度为约10mm至约30mm。在一个实施方案中,药学上可接受的盐的浓度为约10mm。
6、在一个实施方案中,药学上可接受的盐选自由钠盐、镁盐、钙盐、钾盐、磷酸盐和硫酸盐组成的组。在一个实施方案中,钠盐包括氯化钠。
7、在一个实施方案中,缓冲剂包括tris盐酸盐(hcl)。在一个实施方案中,缓冲剂包括l-组氨酸hcl。在一个实施方案中,缓冲剂的浓度包括约20mm。
8、在一个实施方案中,冷冻保护剂为约3%(w/v)至约8%(w/v)。在一个实施方案中,冷冻保护剂为约4%(w/v)至约6%(w/v)。在一个实施方案中,冷冻保护剂为约5%(w/v)。在一个实施方案中,冷冻保护剂包括糖。在一个实施方案中,糖包括蔗糖、海藻糖或它们的组合。在一个实施方案中,糖包括海藻糖。
9、在一个实施方案中,非离子表面活性剂为约0.0005%(w/v)至约0.005%(w/v)。在一个实施方案中,非离子表面活性剂为约0.00075%(w/v)至约0.0025%(w/v)。在一个实施方案中,非离子表面活性剂为约0.001%(w/v)。在一个实施方案中,非离子表面活性剂选自由共聚物、聚氧乙烯脱水山梨糖醇酯、磷脂、brij表面活性剂和脱水山梨糖醇酯或它们的组合组成的组。在一个实施方案中,聚氧乙烯脱水山梨糖醇酯选自由(ps-20)和聚山梨酯80(ps-80)或它们的组合组成的组。在一个实施方案中,共聚物包括泊洛沙姆。在一个实施方案中,泊洛沙姆选自由泊洛沙姆188(p188)、泊洛沙姆237(p237)、泊洛沙姆338(p338)和泊洛沙姆407(p407)或它们的组合组成的组。在一个实施方案中,泊洛沙姆包括泊洛沙姆188(p188)。
10、在一个方面,本文提供了一种包含纯化的aav颗粒、缓冲剂、冷冻保护剂和非离子表面活性剂的药物组合物,其中(a)纯化的aav颗粒基本上不含杂质,(b)缓冲剂的浓度为约20mm,(c)冷冻保护剂为约5%(w/v)海藻糖,并且(d)非离子表面活性剂为约0.001%(w/v)泊洛沙姆188。
11、在一个方面,本文提供了一种包含纯化的aav颗粒、药学上可接受的盐、缓冲剂、冷冻保护剂和非离子表面活性剂的药物组合物,其中(a)纯化的aav颗粒基本上不含杂质,(b)药学上可接受的盐的浓度为约10mm氯化钠,(c)缓冲剂的浓度为约20mm,(d)冷冻保护剂为约5%(w/v)海藻糖,并且(e)非离子表面活性剂为约0.001%(w/v)泊洛沙姆188。
12、在一个方面,本文提供了一种包含纯化的aav颗粒、药学上可接受的盐、缓冲剂、冷冻保护剂和非离子表面活性剂的药物组合物,其中(a)纯化的aav颗粒基本上不含杂质,(b)药学上可接受的盐的浓度为约25mm氯化钠,(c)缓冲剂的浓度为约20mm,(d)冷冻保护剂为约5%(w/v)海藻糖,并且(e)非离子表面活性剂为约0.001%(w/v)泊洛沙姆188。
13、在一个方面,本文提供了一种包含纯化的aav颗粒、药学上可接受的盐、缓冲剂、冷冻保护剂和非离子表面活性剂的药物组合物,其中(a)纯化的aav颗粒基本上不含杂质,(b)药学上可接受的盐的浓度为约50mm氯化钠,(c)缓冲剂的浓度为约20mm,(d)冷冻保护剂为约5%(w/v)海藻糖,并且(e)非离子表面活性剂为约0.001%(w/v)泊洛沙姆188。
14、在一个方面,本文提供了一种包含纯化的aav颗粒、药学上可接受的盐、缓冲剂、冷冻保护剂和非离子表面活性剂的药物组合物,其中(a)纯化的aav颗粒基本上不含杂质,(b)药学上可接受的盐的浓度为约100mm氯化钠,(c)缓冲剂的浓度为约20mm,(d)冷冻保护剂为约5%(w/v)海藻糖,并且(e)非离子表面活性剂为约0.001%(w/v)泊洛沙姆188。
15、在一个方面,本文提供了一种包含纯化的aav颗粒、药学上可接受的盐、缓冲剂、冷冻保护剂和非离子表面活性剂的药物组合物,其中(a)纯化的aav颗粒基本上不含杂质,(b)药学上可接受的盐的浓度为约125mm氯化钠,(c)缓冲剂的浓度为约20mm,(d)冷冻保护剂为约5%(w/v)海藻糖,并且(e)非离子表面活性剂为约0.001%(w/v)泊洛沙姆188。
16、在一个方面,本文提供了一种包含纯化的aav颗粒、药学上可接受的盐、缓冲剂、冷冻保护剂和非离子表面活性剂的药物组合物,其中(a)纯化的aav颗粒基本上不含杂质,(b)药学上可接受的盐的浓度为约150mm氯化钠,(c)缓冲剂的浓度为约20mm,(d)冷冻保护剂为约5%(w/v)海藻糖,并且(e)非离子表面活性剂为约0.001%(w/v)泊洛沙姆188。
17、在一个方面,本文提供了一种包含纯化的aav颗粒、药学上可接受的盐、缓冲剂、冷冻保护剂和非离子表面活性剂的药物组合物,其中(a)纯化的aav颗粒基本上不含杂质,(b)药学上可接受的盐的浓度为约200mm氯化钠,(c)缓冲剂的浓度为约20mm,(d)冷冻保护剂为约5%(w/v)海藻糖,并且(e)非离子表面活性剂为约0.001%(w/v)泊洛沙姆188。
18、在一个实施方案中,缓冲剂包括tris hcl。在一个实施方案中,缓冲剂包括l-组氨酸hcl。
19、在一个实施方案中,药物组合物的ph为约4.0至约9.0。在一个实施方案中,药物组合物的ph为约7.0至约8.0。在一个实施方案中,药物组合物的ph为约7.3至约7.7。在一个实施方案中,药物组合物的ph为约7.5。
20、在一个实施方案中,aav选自由aav1、aav2、aav3、aav4、aav5、aav6、aav7、aav8、aav9和aav10组成的组。在一个实施方案中,aav包括raav。
21、在一个实施方案中,纯化的aav颗粒的滴度为约1×1010个病毒基因组/毫升(vg/ml)或更大。在一个实施方案中,纯化的aav颗粒的滴度为约1×1011个病毒基因组/毫升(vg/ml)或更大。在一个实施方案中,纯化的aav颗粒的滴度为约1×1012个病毒基因组/毫升(vg/ml)或更大。在一个实施方案中,纯化的aav颗粒的滴度为约1×1013个病毒基因组/毫升(vg/ml)或更大。在一个实施方案中,纯化的aav颗粒的滴度为约1×1014个病毒基因组/毫升(vg/ml)或更大。在一个实施方案中,纯化的aav颗粒的滴度为约1×1015个病毒基因组/毫升(vg/ml)或更大。
22、在一个实施方案中,杂质包括工艺相关杂质、产物相关杂质或它们的组合。
23、在一个实施方案中,工艺相关杂质选自由残余宿主细胞组分、残余病毒生产组分、残余细胞培养组分、残余纯化组分或它们的组合组成的组。在一个实施方案中,残余宿主细胞组分包括宿主细胞蛋白、宿主细胞dna、宿主细胞rna或它们的组合。在一个实施方案中,宿主细胞dna包括病毒外染色质相关dna。在一个实施方案中,残余病毒生产组分包括质粒dna、辅助病毒或它们的组合。在一个实施方案中,残余细胞培养组分包括抗生素、补充剂、诱导剂、生长因子或它们的组合。在一个实施方案中,残余纯化组分包括缓冲剂、无机盐、酶、洗涤剂、培养基或它们的组合。
24、在一个实施方案中,产物相关杂质包括空衣壳、聚集的aav颗粒、降解的aav颗粒或它们的组合。
25、在一个实施方案中,纯化的aav颗粒包括完整或部分完整衣壳,并且产物相关杂质包括空衣壳。在一个实施方案中,纯化的aav颗粒包括完整衣壳,并且产物相关杂质包括空衣壳。在一个实施方案中,纯化的aav颗粒基本上由完整衣壳组成,并且产物相关杂质包括空衣壳。
26、在一个实施方案中,产物相关杂质包括聚集的aav颗粒、降解的aav颗粒或它们的组合。在一个实施方案中,纯化的aav颗粒包括空衣壳。在一个实施方案中,纯化的aav颗粒基本上由空衣壳组成。在一个实施方案中,产物相关杂质包括聚集的aav颗粒或它们的组合。
27、在一个实施方案中,药物组合物处于液体状态。在一个实施方案中,药物组合物处于固体或半固体状态。
28、在一个实施方案中,药物组合物维持或增强纯化的aav颗粒的稳定性。
29、在一个实施方案中,药物组合物减少或防止纯化的aav颗粒的聚集。
30、在一个实施方案中,药物组合物(a)维持或增强纯化的aav颗粒的稳定性;并且(b)减少或防止纯化的aav颗粒的聚集。
31、在一个实施方案中,在一个或多个冷冻/解冻循环后,纯化的aav颗粒的稳定性得以维持或增强。在一个实施方案中,在三个或更多个冷冻/解冻循环后,纯化的aav颗粒的稳定性得以维持或增强。
32、在一个实施方案中,在一个或多个冷冻/解冻循环后,aav颗粒的聚集小于5%。在一个实施方案中,在一个或多个冷冻/解冻循环后,aav颗粒的聚集小于2%。在一个实施方案中,在一个或多个冷冻/解冻循环后,aav颗粒的聚集小于1%。在一个实施方案中,在三个或更多个冷冻/解冻循环后,aav颗粒的聚集小于5%。在一个实施方案中,在三个或更多个冷冻/解冻循环后,aav颗粒的聚集小于2%。在一个实施方案中,在三个或更多个冷冻/解冻循环后,aav颗粒的聚集小于1%。
33、在一个实施方案中,aav颗粒的稳定性和/或聚集通过选自由动态光散射(dls)、分析超速离心(auc)、光学显微术、尺寸排阻色谱法(sec)、透射电子显微术和具有多角度静态光散射的场流分级(fff-mals)组成的组的测定来测量。
34、在一个实施方案中,纯化的aav颗粒通过包括以下步骤的方法获得:(a)使包含aav颗粒的上清液与包含核酸酶的组合物接触;以及(b)纯化颗粒。在一个实施方案中,核酸酶包括benzonase或和染色质-dna核酸酶。在一个实施方案中,染色质-dna核酸酶包括mnase。
35、在一个方面,本文提供了一种用于制备包含纯化的aav颗粒的药物组合物的方法,该方法包括:(a)使包含aav颗粒的上清液与包含核酸酶的组合物接触;(b)纯化aav颗粒,使得aav颗粒基本上不含杂质;(c)将纯化的aav颗粒与缓冲剂、冷冻保护剂和非离子表面活性剂组合,其中(i)缓冲剂的浓度为约0mm至约50mm,(ii)冷冻保护剂为约1%至约10%(w/v),并且(iii)非离子表面活性剂为约0.0001%(w/v)至约0.1%(w/v)。在一个实施方案中,步骤(c)还包括药学上可接受的盐,其中药学上可接受的盐的浓度为约1mm至约200mm。
36、在一个实施方案中,药学上可接受的盐为约10mm至约150mm。在一个实施方案中,药学上可接受的盐为约1mm至约49mm。在一个实施方案中,药学上可接受的盐为约5mm至约45mm。在一个实施方案中,药学上可接受的盐为约7.5mm至约40mm。在一个实施方案中,药学上可接受的盐为约10mm至约30mm。在一个实施方案中,药学上可接受的盐的浓度为约10mm。在一个实施方案中,药学上可接受的盐的浓度为约100mm。在一个实施方案中,药学上可接受的盐的浓度为约150mm。
37、在一个实施方案中,药学上可接受的盐选自由钠盐、镁盐、钙盐、钾盐、磷酸盐和硫酸盐组成的组。在一个实施方案中,钠盐包括氯化钠。
38、在一个实施方案中,缓冲剂包括tris hcl。在一个实施方案中,缓冲剂包括l-组氨酸hcl。在一个实施方案中,缓冲剂的浓度包括约20mm。
39、在一个实施方案中,冷冻保护剂为约3%(w/v)至约8%(w/v)。在一个实施方案中,冷冻保护剂为约4%(w/v)至约6%(w/v)。在一个实施方案中,冷冻保护剂为约5%(w/v)。在一个实施方案中,冷冻保护剂包括糖。在一个实施方案中,糖包括蔗糖、海藻糖或它们的组合。在一个实施方案中,糖包括海藻糖。
40、在一个实施方案中,非离子表面活性剂为约0.0005%(w/v)至约0.005%(w/v)。在一个实施方案中,非离子表面活性剂为约0.00075%(w/v)至约0.0025%(w/v)。在一个实施方案中,非离子表面活性剂为约0.001%(w/v)。在一个实施方案中,非离子表面活性剂选自由共聚物、聚氧乙烯脱水山梨糖醇酯、磷脂、brij表面活性剂和脱水山梨糖醇酯或它们的组合组成的组。在一个实施方案中,聚氧乙烯脱水山梨糖醇酯选自由(ps-20)和聚山梨酯80(ps-80)或它们的组合组成的组。在一个实施方案中,共聚物包括泊洛沙姆。在一个实施方案中,泊洛沙姆选自由泊洛沙姆188(p188)、泊洛沙姆237(p237)、泊洛沙姆338(p338)和泊洛沙姆407(p407)或它们的组合组成的组。在一个实施方案中,泊洛沙姆包括泊洛沙姆188(p188)。
41、在一个实施方案中,药物组合物的ph为约4.0至约9.0。在一个实施方案中,药物组合物的ph为约7.0至约8.0。在一个实施方案中,药物组合物的ph为约7.3至约7.7。在一个实施方案中,药物组合物的ph为约7.5。
42、在一个实施方案中,aav选自由aav1、aav2、aav3、aav4、aav5、aav6、aav7、aav8、aav9和aav10组成的组。在一个实施方案中,aav包括raav。
43、在一个实施方案中,核酸酶包括benzonase或和染色质-dna核酸酶。在一个实施方案中,染色质-dna核酸酶包括mnase。
44、在一个实施方案中,纯化的aav颗粒的滴度为约1×1010个病毒基因组/毫升(vg/ml)或更大。在一个实施方案中,纯化的aav颗粒的滴度为约1×1011个病毒基因组/毫升(vg/ml)或更大。在一个实施方案中,纯化的aav颗粒的滴度为约1×1012个病毒基因组/毫升(vg/ml)或更大。在一个实施方案中,纯化的aav颗粒的滴度为约1×1013个病毒基因组/毫升(vg/ml)或更大。在一个实施方案中,纯化的aav颗粒的滴度为约1×1014个病毒基因组/毫升(vg/ml)或更大。在一个实施方案中,纯化的aav颗粒的滴度为约1×1015个病毒基因组/毫升(vg/ml)或更大。
45、在一个实施方案中,杂质包括工艺相关杂质、产物相关杂质或它们的组合。
46、在一个实施方案中,工艺相关杂质选自由残余宿主细胞组分、残余病毒生产组分、残余细胞培养组分、残余纯化组分或它们的组合组成的组。在一个实施方案中,残余宿主细胞组分包括宿主细胞蛋白、宿主细胞dna、宿主细胞rna或它们的组合。在一个实施方案中,宿主细胞dna包括病毒外染色质相关dna。在一个实施方案中,残余病毒生产组分包括质粒dna、辅助病毒或它们的组合。在一个实施方案中,残余细胞培养组分包括抗生素、补充剂、诱导剂、生长因子或它们的组合。在一个实施方案中,残余纯化组分包括缓冲剂、无机盐、酶、洗涤剂、培养基或它们的组合。
47、在一个实施方案中,产物相关杂质包括空衣壳、聚集的aav颗粒、降解的aav颗粒或它们的组合。在一个实施方案中,纯化的aav颗粒包括完整或部分完整衣壳,并且产物相关杂质包括空衣壳。在一个实施方案中,纯化的aav颗粒包括完整衣壳,并且产物相关杂质包括空衣壳。在一个实施方案中,纯化的aav颗粒基本上由完整衣壳组成,并且产物相关杂质包括空衣壳。
48、在一个实施方案中,产物相关杂质包括聚集的aav颗粒、降解的aav颗粒或它们的组合。在一个实施方案中,纯化的aav颗粒包括空衣壳。在一个实施方案中,纯化的aav颗粒基本上由空衣壳组成。在一个实施方案中,产物相关杂质包括聚集的aav颗粒。
49、在一个方面,本文提供了一种包含用于维持或增强纯化的aav颗粒的稳定性的手段的药物组合物。在一个实施方案中,在一个或多个冷冻/解冻循环后,纯化的aav颗粒的稳定性得以维持或增强。在一个实施方案中,在三个或更多个冷冻/解冻循环后,纯化的aav颗粒的稳定性得以维持或增强。在一个实施方案中,aav颗粒的稳定性通过选自由动态光散射(dls)、分析超速离心(auc)、光学显微术、尺寸排阻色谱法(sec)、透射电子显微术和具有多角度静态光散射的场流分级(fff-mals)组成的组的测定来测量。
50、在一个方面,本文提供了一种包含用于减少或防止纯化的aav颗粒的聚集的手段的药物组合物。在一个实施方案中,在一个或多个冷冻/解冻循环后,aav颗粒的聚集小于5%。在一个实施方案中,在一个或多个冷冻/解冻循环后,aav颗粒的聚集小于2%。在一个实施方案中,在一个或多个冷冻/解冻循环后,aav颗粒的聚集小于1%。在一个实施方案中,在三个或更多个冷冻/解冻循环后,aav颗粒的聚集小于5%。在一个实施方案中,在三个或更多个冷冻/解冻循环后,aav颗粒的聚集小于2%。在一个实施方案中,在三个或更多个冷冻/解冻循环后,aav颗粒的聚集小于1%。在一个实施方案中,aav颗粒通过选自由动态光散射(dls)、分析超速离心(auc)、光学显微术、尺寸排阻色谱法(sec)、透射电子显微术和具有多角度静态光散射的场流分级(fff-mals)组成的组的测定来测量。
51、在一个方面,本文提供了一种包含用于(a)维持或增强纯化的aav颗粒的稳定性并且(b)减少或防止纯化的aav颗粒聚集的手段的药物组合物。在一个实施方案中,在一个或多个冷冻/解冻循环后,纯化的aav颗粒的稳定性得以维持或增强。在一个实施方案中,在三个或更多个冷冻/解冻循环后,纯化的aav颗粒的稳定性得以维持或增强。在一个实施方案中,在一个或多个冷冻/解冻循环后,aav颗粒的聚集小于5%。在一个实施方案中,在一个或多个冷冻/解冻循环后,aav颗粒的聚集小于2%。在一个实施方案中,在一个或多个冷冻/解冻循环后,aav颗粒的聚集小于1%。在一个实施方案中,在三个或更多个冷冻/解冻循环后,aav颗粒的聚集小于5%。在一个实施方案中,在三个或更多个冷冻/解冻循环后,aav颗粒的聚集小于2%。在一个实施方案中,在三个或更多个冷冻/解冻循环后,aav颗粒的聚集小于1%。在一个实施方案中,aav颗粒的稳定性和聚集通过选自由动态光散射(dls)、分析超速离心(auc)、光学显微术、尺寸排阻色谱法(sec)、透射电子显微术和具有多角度静态光散射的场流分级(fff-mals)组成的组的测定来测量。
52、在一个方面,本文提供了一种包含用于制备和获得包含纯化的aav颗粒、缓冲剂、冷冻保护剂和非离子表面活性剂的药物组合物的手段的系统,其中(a)纯化的aav颗粒基本上不含杂质,(b)缓冲剂的浓度为约0mm至约50mm,(c)冷冻保护剂为约1%至约10%(w/v),并且(d)非离子表面活性剂为约0.0001%(w/v)至约0.1%(w/v)。在一个实施方案中,药物组合物还包含药学上可接受的盐,其中药学上可接受的盐的浓度为约1mm至约200mm。在一个实施方案中,药学上可接受的盐为约10mm至约150mm。在一个实施方案中,药学上可接受的盐的浓度为约10mm。在一个实施方案中,药学上可接受的盐的浓度为约100mm。在一个实施方案中,药学上可接受的盐的浓度为约150mm。
53、在一个方面,本文提供了一种包含用于制备和获得包含纯化的aav颗粒、药学上可接受的盐、缓冲剂、冷冻保护剂和非离子表面活性剂的药物组合物的手段的系统,其中(a)纯化的aav颗粒基本上不含杂质,(b)缓冲剂的浓度为约0mm至约50mm,(c)冷冻保护剂为约1%至约10%(w/v),并且(d)非离子表面活性剂为约0.0001%(w/v)至约0.1%(w/v)。在一个实施方案中,药物组合物还包含药学上可接受的盐,其中药学上可接受的盐的浓度为约1mm至约200mm。在一个实施方案中,药学上可接受的盐为约10mm至约150mm。在一个实施方案中,药学上可接受的盐的浓度为约10mm。在一个实施方案中,药学上可接受的盐的浓度为约100mm。在一个实施方案中,药学上可接受的盐的浓度为约150mm。
54、在一个方面,本文提供了一种包含用于制备和获得包含纯化的aav颗粒、药学上可接受的盐、缓冲剂、冷冻保护剂和非离子表面活性剂的药物组合物的手段的系统,其中(a)纯化的aav颗粒基本上不含杂质,(b)药学上可接受的盐的浓度为约1mm至约49mm,(c)缓冲剂的浓度为约0mm至约50mm,(d)冷冻保护剂为约1%至约10%(w/v),并且(e)非离子表面活性剂为约0.0001%(w/v)至约0.1%(w/v)。在一个实施方案中,药学上可接受的盐的浓度为约5mm至约45mm。在一个实施方案中,药学上可接受的盐的浓度为约7.5mm至约40mm。在一个实施方案中,药学上可接受的盐的浓度为约10mm至约30mm。在一个实施方案中,药学上可接受的盐的浓度为约10mm。
55、在一个实施方案中,药学上可接受的盐选自由钠盐、镁盐、钙盐、钾盐、磷酸盐和硫酸盐组成的组。在一个实施方案中,钠盐包括氯化钠。
56、在一个实施方案中,缓冲剂包括tris hcl。在一个实施方案中,缓冲剂包括l-组氨酸hcl。在一个实施方案中,缓冲剂的浓度包括约20mm。
57、在一个实施方案中,冷冻保护剂为约3%(w/v)至约8%(w/v)。在一个实施方案中,冷冻保护剂为约4%(w/v)至约6%(w/v)。在一个实施方案中,冷冻保护剂为约5%(w/v)。在一个实施方案中,冷冻保护剂包括糖。在一个实施方案中,糖包括蔗糖、海藻糖或它们的组合。在一个实施方案中,糖包括海藻糖。
58、在一个实施方案中,非离子表面活性剂为约0.0005%(w/v)至约0.005%(w/v)。在一个实施方案中,非离子表面活性剂为约0.00075%(w/v)至约0.0025%(w/v)。在一个实施方案中,非离子表面活性剂为约0.001%(w/v)。在一个实施方案中,非离子表面活性剂选自由共聚物、聚氧乙烯脱水山梨糖醇酯、磷脂、brij表面活性剂和脱水山梨糖醇酯或它们的组合组成的组。在一个实施方案中,聚氧乙烯脱水山梨糖醇酯选自由(ps-20)和聚山梨酯80(ps-80)或它们的组合组成的组。在一个实施方案中,共聚物包括泊洛沙姆。在一个实施方案中,泊洛沙姆选自由泊洛沙姆188(p188)、泊洛沙姆237(p237)、泊洛沙姆338(p338)和泊洛沙姆407(p407)或它们的组合组成的组。在一个实施方案中,泊洛沙姆包括泊洛沙姆188(p188)。
59、在一个方面,本文提供了一种包含用于制备和获得包含纯化的aav颗粒、缓冲剂、冷冻保护剂和非离子表面活性剂的药物组合物的手段的系统,其中(a)纯化的aav颗粒基本上不含杂质,(b)缓冲剂的浓度为约20mm,(c)冷冻保护剂为约5%(w/v)海藻糖,并且(d)非离子表面活性剂为约0.001%(w/v)泊洛沙姆188。
60、在一个方面,本文提供了一种包含用于制备和获得包含纯化的aav颗粒、药学上可接受的盐、缓冲剂、冷冻保护剂和非离子表面活性剂的药物组合物的手段的系统,其中(a)纯化的aav颗粒基本上不含杂质,(b)药学上可接受的盐的浓度为约10mm氯化钠,(c)缓冲剂的浓度为约20mm,(d)冷冻保护剂为约5%(w/v)海藻糖,并且(e)非离子表面活性剂为约0.001%(w/v)泊洛沙姆188。
61、在一个方面,本文提供了一种包含用于制备和获得包含纯化的aav颗粒、药学上可接受的盐、缓冲剂、冷冻保护剂和非离子表面活性剂的药物组合物的手段的系统,其中(a)纯化的aav颗粒基本上不含杂质,(b)药学上可接受的盐的浓度为约25mm氯化钠,(c)缓冲剂的浓度为约20mm,(d)冷冻保护剂为约5%(w/v)海藻糖,并且(e)非离子表面活性剂为约0.001%(w/v)泊洛沙姆188。
62、在一个方面,本文提供了一种包含用于制备和获得包含纯化的aav颗粒、药学上可接受的盐、缓冲剂、冷冻保护剂和非离子表面活性剂的药物组合物的手段的系统,其中(a)纯化的aav颗粒基本上不含杂质,(b)药学上可接受的盐的浓度为约50mm氯化钠,(c)缓冲剂的浓度为约20mm,(d)冷冻保护剂为约5%(w/v)海藻糖,并且(e)非离子表面活性剂为约0.001%(w/v)泊洛沙姆188。
63、在一个方面,本文提供了一种包含用于制备和获得包含纯化的aav颗粒、药学上可接受的盐、缓冲剂、冷冻保护剂和非离子表面活性剂的药物组合物的手段的系统,其中(a)纯化的aav颗粒基本上不含杂质,(b)药学上可接受的盐的浓度为约100mm氯化钠,(c)缓冲剂的浓度为约20mm,(d)冷冻保护剂为约5%(w/v)海藻糖,并且(e)非离子表面活性剂为约0.001%(w/v)泊洛沙姆188。
64、在一个方面,本文提供了一种包含用于制备和获得包含纯化的aav颗粒、药学上可接受的盐、缓冲剂、冷冻保护剂和非离子表面活性剂的药物组合物的手段的系统,其中(a)纯化的aav颗粒基本上不含杂质,(b)药学上可接受的盐的浓度为约125mm氯化钠,(c)缓冲剂的浓度为约20mm,(d)冷冻保护剂为约5%(w/v)海藻糖,并且(e)非离子表面活性剂为约0.001%(w/v)泊洛沙姆188。
65、在一个方面,本文提供了一种包含用于制备和获得包含纯化的aav颗粒、药学上可接受的盐、缓冲剂、冷冻保护剂和非离子表面活性剂的药物组合物的手段的系统,其中(a)纯化的aav颗粒基本上不含杂质,(b)药学上可接受的盐的浓度为约150mm氯化钠,(c)缓冲剂的浓度为约20mm,(d)冷冻保护剂为约5%(w/v)海藻糖,并且(e)非离子表面活性剂为约0.001%(w/v)泊洛沙姆188。
66、在一个方面,本文提供了一种包含用于制备和获得包含纯化的aav颗粒、药学上可接受的盐、缓冲剂、冷冻保护剂和非离子表面活性剂的药物组合物的手段的系统,其中(a)纯化的aav颗粒基本上不含杂质,(b)药学上可接受的盐的浓度为约200mm氯化钠,(c)缓冲剂的浓度为约20mm,(d)冷冻保护剂为约5%(w/v)海藻糖,并且(e)非离子表面活性剂为约0.001%(w/v)泊洛沙姆188。
67、在一个实施方案中,缓冲剂包括tris hcl。在一个实施方案中,缓冲剂包括l-组氨酸hcl。
68、在一个实施方案中,药物组合物的ph为约4.0至约9.0。在一个实施方案中,药物组合物的ph为约7.0至约8.0。在一个实施方案中,药物组合物的ph为约7.3至约7.7。在一个实施方案中,药物组合物的ph为约7.5。
69、在一个实施方案中,aav选自由aav1、aav2、aav3、aav4、aav5、aav6、aav7、aav8、aav9和aav10组成的组。在一个实施方案中,aav包括raav。
70、在一个实施方案中,纯化的aav颗粒的滴度为约1×1010个病毒基因组/毫升(vg/ml)或更大。在一个实施方案中,纯化的aav颗粒的滴度为约1×1011个病毒基因组/毫升(vg/ml)或更大。在一个实施方案中,纯化的aav颗粒的滴度为约1×1012个病毒基因组/毫升(vg/ml)或更大。在一个实施方案中,纯化的aav颗粒的滴度为约1×1013个病毒基因组/毫升(vg/ml)或更大。在一个实施方案中,纯化的aav颗粒的滴度为约1×1014个病毒基因组/毫升(vg/ml)或更大。在一个实施方案中,纯化的aav颗粒的滴度为约1×1015个病毒基因组/毫升(vg/ml)或更大。
71、在一个实施方案中,杂质包括工艺相关杂质、产物相关杂质或它们的组合。
72、在一个实施方案中,工艺相关杂质选自由残余宿主细胞组分、残余病毒生产组分、残余细胞培养组分、残余纯化组分或它们的组合组成的组。在一个实施方案中,残余宿主细胞组分包括宿主细胞蛋白、宿主细胞dna、宿主细胞rna或它们的组合。在一个实施方案中,宿主细胞dna包括病毒外染色质相关dna。在一个实施方案中,残余病毒生产组分包括质粒dna、辅助病毒或它们的组合。在一个实施方案中,残余细胞培养组分包括抗生素、补充剂、诱导剂、生长因子或它们的组合。在一个实施方案中,残余纯化组分包括缓冲剂、无机盐、酶、洗涤剂、培养基或它们的组合。
73、在一个实施方案中,产物相关杂质包括空衣壳、聚集的aav颗粒、降解的aav颗粒或它们的组合。
74、在一个实施方案中,纯化的aav颗粒包括完整或部分完整衣壳,并且产物相关杂质包括空衣壳。在一个实施方案中,纯化的aav颗粒包括完整衣壳,并且产物相关杂质包括空衣壳。在一个实施方案中,纯化的aav颗粒基本上由完整衣壳组成,并且产物相关杂质包括空衣壳。
75、在一个实施方案中,产物相关杂质包括聚集的aav颗粒、降解的aav颗粒或它们的组合。在一个实施方案中,纯化的aav颗粒包括空衣壳。在一个实施方案中,纯化的aav颗粒基本上由空衣壳组成。在一个实施方案中,产物相关杂质包括聚集的aav颗粒或它们的组合。
76、在一个实施方案中,药物组合物处于液体状态。在一个实施方案中,药物组合物处于固体或半固体状态。
77、在一个实施方案中,药物组合物维持或增强纯化的aav颗粒的稳定性。
78、在一个实施方案中,药物组合物减少或防止纯化的aav颗粒的聚集。
79、在一个实施方案中,药物组合物(a)维持或增强纯化的aav颗粒的稳定性;并且(b)减少或防止纯化的aav颗粒的聚集。
80、在一个实施方案中,在一个或多个冷冻/解冻循环后,纯化的aav颗粒的稳定性得以维持或增强。在一个实施方案中,在三个或更多个冷冻/解冻循环后,纯化的aav颗粒的稳定性得以维持或增强。
81、在一个实施方案中,在一个或多个冷冻/解冻循环后,aav颗粒的聚集小于5%。在一个实施方案中,在一个或多个冷冻/解冻循环后,aav颗粒的聚集小于2%。在一个实施方案中,在一个或多个冷冻/解冻循环后,aav颗粒的聚集小于1%。在一个实施方案中,在三个或更多个冷冻/解冻循环后,aav颗粒的聚集小于5%。在一个实施方案中,在三个或更多个冷冻/解冻循环后,aav颗粒的聚集小于2%。在一个实施方案中,在三个或更多个冷冻/解冻循环后,aav颗粒的聚集小于1%。
82、在一个实施方案中,aav颗粒的稳定性和/或聚集通过选自由动态光散射(dls)、分析超速离心(auc)、光学显微术、尺寸排阻色谱法(sec)、透射电子显微术和具有多角度静态光散射的场流分级(fff-mals)组成的组的测定来测量。
83、在一个实施方案中,纯化的aav颗粒通过包括以下步骤的方法获得:(a)使包含aav颗粒的上清液与包含核酸酶的组合物接触;以及(b)纯化颗粒。在一个实施方案中,核酸酶包括benzonase或和染色质-dna核酸酶。在一个实施方案中,染色质-dna核酸酶包括mnase。
技术实现思路
- 还没有人留言评论。精彩留言会获得点赞!