利用孤儿基序和CpG密度的组合来控制异源转基因的表达的制作方法
本发明涉及核酸序列,该核酸序列导致与其可操作地连接的异源转基因的受控表达。
背景技术:
1、将遗传物质(例如,异源核酸)递送至靶细胞以增加所希望的基因产物表达的基因疗法方法支持治疗目的。病毒已经进化到能够高效地将核酸递送到特定的细胞类型,同时避免受感染宿主的免疫监视(robbins等人,(1998)pharmacol.ther.[药物学与治疗学],80(1):35-47)。这些特性使病毒作为用于基因疗法的递送媒介物或载体具有吸引力。几种类型的病毒(包括逆转录病毒、腺病毒、腺相关病毒(aav)和单纯疱疹病毒)已在实验室中进行了修饰以用于基因疗法应用(lunstrom等人,(2018)diseases[疾病],6(2):42)。特别地,衍生自腺相关病毒(aav)的载体可以有效地递送遗传物质,因为(i)它们能够感染(转导)包括肌纤维和神经元在内的多种非分裂和分裂细胞类型;(ii)它们缺乏病毒结构基因,从而消除了天然宿主细胞对病毒感染的应答,例如干扰素介导的应答;(iii)野生型病毒从未与人类的任何病理相关;(iv)与能够整合到宿主细胞基因组中的野生型aav相比,复制缺陷型aav载体通常作为附加体持续存在,从而限制了插入诱变或癌基因激活的风险;并且(v)与其他载体系统相比,aav载体不触发显著的免疫应答,从而允许例如一种或多种治疗性异源核酸的长期表达(wold等人,(2013)curr.gene ther.[当前基因疗法],13(6):421-33;lee等人,(2017)genes dis.[基因与疾病],4(2):43–63)。
2、aav为细小病毒科(parvoviridae)家族的成员。aav基因组包含线性单链dna分子,该线性单链dna分子典型地含有约4.7千碱基(kb)和编码非结构性rep(复制)及结构性cap(衣壳)蛋白的两个主要开放阅读框。两个顺式作用反向末端重复(itr)序列与aav编码区侧接,这些反向末端重复序列的长度典型地为约145个核苷酸,并具有间杂的回文序列,这些回文序列可折叠成发夹结构,其在dna复制的起始期间充当引物。除他们在dna复制中的作用以外,已证实itr序列有助于病毒整合、自宿主基因组的拯救及病毒核酸衣壳化成为成熟病毒粒子(muzyczka等人,(1992)curr.top.micro.immunol.[微生物学和免疫学当前主题],158:97-129)。
3、虽然aav因其转导多种细胞类型并将异源核酸递送至多种靶组织类型的能力而令人满意,但是将异源核酸递送至不需要异源核酸表达的组织以及在需要的地方高表达转基因仍然是一个挑战。仔细校准所需组织中的基因表达可以提供治疗益处。含有cag启动子的aav载体已用于许多基因疗法的临床试验,例如用于cns疾病(hoequemiller等人,(2016)hum.gene ther.[人类基因疗法],27(7):478-96)。
4、仍然需要开发在特定组织中获得异源核酸高表达的方法。因此,需要改善治疗性蛋白(例如抗体或功能性结合片段、酶等)和核酸(例如用于crispr的shrna、sirna、grna等)的组织特异性表达。
5、更广泛地使用病毒载体进行基因递送的另一个障碍是载体的包装能力。例如,aav载体基因组典型地限于单链(ssaav)的约4.7kb和自互补(scaav)载体的2.4kb,这限制了可以递送的遗传有效载荷的大小(wu等人,(2010)mol.ther.[分子疗法],18(1):80-86)。由于遗传有效载载包括调节元件(例如启动子、终止信号等),这进一步限制了可被包装的异源核酸的大小。因此,需要提供长度缩短的调节元件,以允许插入编码更大蛋白质的异源核酸序列,例如,插入用于基因疗法的aav衍生载体中。
技术实现思路
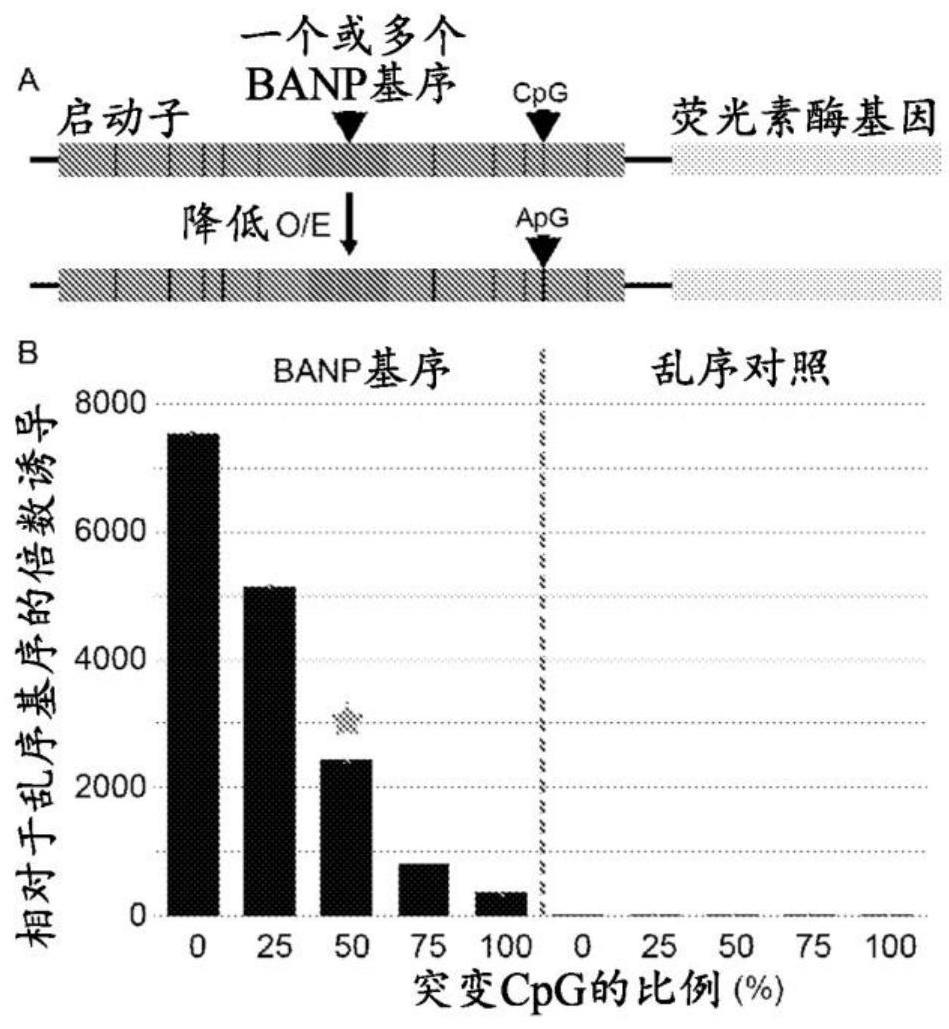
1、本发明人先前已经发现哺乳动物中迄今的孤儿调节基序当被蛋白质banp结合时充当强转录激活剂,也是cpg岛启动子的激活剂。当超过一个拷贝的基序存在于异源转基因前面时,这种强激活效协同增强。
2、经过进一步研究,本发明人发现孤儿调节基序附近cpg位点的数量影响该基序的活性。可利用这种效应调节与所述基序可操作地连接的基因的表达。例如,一个表达载体可以包含多于一个异源转基因,每个都受其各自的banp基序的控制,但这些基序中的每个周围都有不同的cpg密度。这将导致每个转基因的不同的、受控的表达,尽管它们在相同的载体上并且由相同的转录因子结合的相同基序控制。
3、本发明的另一个优点是,富含cpg的基序通常受细胞高度控制,并且如果构建体意外掺入宿主细胞的基因组,将导致转基因表达的关闭。
4、因此,本发明提供了分离的核酸分子,其包含超过220bp,选自seq id no:1、seqid no:2和seq id no:3的组的一个或多个拷贝的序列,和在所述选自seq id no:1、seq idno:2和seq id no:3的组的一个或多个拷贝的序列之前的n个碱基对(bp)和/或之后的n个bp中的大于0.6的cpg观察值与估计值比率(o/e比率),其中该cpg o/e比率通过以下确定:对选自seq id no:1、seq id no:2和seq id no:3的组的至少一个或多个拷贝的序列周围的n个bp长序列中的cpg二核苷酸的数量进行计数,并通过将cpg二核苷酸的计数数量乘以n并将结果除以该n个bp中存在的c数量和g数量的乘积来计算该o/e比率(n*cpg/(c*g)),其中n在50和1000之间并且是紧接在所述选自seq id no:1、seq id no:2和seq id no:3的组的一个或多个拷贝的序列之前或紧跟其后的序列的长度,以bp计。为了清楚起见,声明技术人员熟知c代表胞嘧啶核苷酸,g代表鸟苷核苷酸并且cpg(或cg)代表5'—c—磷酸—g—3',即胞嘧啶和鸟嘌呤仅被一个磷酸基团隔开(磷酸将dna中的任意两个核苷连接在一起)。
5、在一些实施例中,cpg存在于紧接选自seq id no:1、seq id no:2和seq id no:3的组的一个或多个拷贝的序列之前的50-1000bp中,并且异源转基因直接或不直接位于所述选自seq id no:1、seq id no:2和seq id no:3的组的一个或多个拷贝的序列之后。
6、在一些实施例中,cpg存在于紧接选自seq id no:1、seq id no:2和seq id no:3的组的一个或多个拷贝的序列之后的50-1000bp中。
7、在一些实施例中,cpg存在于紧接选自seq id no:1、seq id no:2和seq id no:3的组的一个或多个拷贝的序列之前的50-1000bp中且在该一个或多个拷贝的序列之后的50-1000bp中。
8、在一些实施例中,n为约50。在一些实施例中,n为约100。在一些实施例中,n为约150。在一些实施例中,n为约200。在一些实施例中,n为约250。在一些实施例中,n为约500。在一些实施例中,n为约800。在一些实施例中,n为约1000。
9、本发明的序列的核酸序列为:
10、seq id no:1bmycgcgrbv
11、seq id no:2ymycgcgrkv
12、seq id no:3tctcgcgaga
13、在一些实施例中,本发明的分离的核酸进一步包含编码蛋白质banp或其活性片段或变体的另一个序列,该序列可操作地连接至组成型启动子或诱导型启动子。
14、在一些实施例中,本发明的分离的核酸的异源转基因是嵌合抗原受体。
15、本发明还提供了载体,该载体包含本发明的分离的核酸。在一些实施例中,该载体是质粒、dna载体、rna载体、病毒载体、腺病毒载体、腺相关病毒载体、慢病毒载体、逆转录病毒载体、γ逆转录病毒载体或hsv载体。在一些实施例中,本发明的分离的核酸小于8kb。在一些实施例中,本发明的分离的核酸小于5kb。
16、本发明还提供了试剂盒或组合物,该试剂盒或组合物包含本发明的分离的核酸和第二分离的核酸分子,该第二分离的核酸分子包含编码蛋白质banp或其活性片段或变体的序列,该序列可操作地连接至组成型启动子或诱导型启动子。在这样的试剂盒中,本发明的分离的核酸可以在同一载体内或在不同载体内。
17、本发明还提供了本发明的分离的核酸、本发明的载体或本发明的试剂盒或本发明的组合物用于优选在细胞中瞬时体外、离体或体内表达异源转基因的用途。在一些实施例中,与在相同条件下与seq id no:1、seq id no:2或seq id no:3的单拷贝可操作地连接时的异源转基因的表达相比,该用途使异源转基因的表达增加大于二的倍数。在一些实施例中,异源转基因的表达通过报道基因活性、报道基因荧光、定量逆转录酶pcr或基因组学方法例如rna测序来测量。
18、本发明进一步提供了体外、离体或体内在细胞中产生异源转基因的方法,该方法为将本发明的任何分离的核酸或权利要求书中本发明的载体引入细胞,培养该细胞(或细胞群),并纯化重组表达的异源转基因。在一些实施例中,细胞是干细胞。
19、本发明还提供了分离的细胞,其包含本发明的分离的核酸。在该细胞或多个细胞中,包含选自seq id no:1、seq id no:2和/或seq id no:3的组的至少两个拷贝的序列的分离的核酸序列和异源转基因可以稳定地整合到所述细胞的基因组中。
- 还没有人留言评论。精彩留言会获得点赞!