去除术中回收血液中肿瘤细胞的离体方法与流程
本发明涉及一种使用三功能双特异性抗体去除回收血液中肿瘤细胞,以及减少由此产生的红细胞浓缩物中的残余抗体的方法。
背景技术:
1、自1980年代初艾滋病流行以来,人们对异体输血的替代方案的兴趣日益浓厚,特别是对择期手术。目前占美国和欧洲一些国家献血5%以上的一种替代方案是自体输血,其主要通过术前献血获得。除术前献血外,手术区域的术中血液回收(intraoperative bloodsalvage,ibs)(表a)是满足输血需求的重要选择。在上述ibs过程中,手术患者流失的血液被收集、清洗并使其可用于再回输给该患者。
2、简而言之,流入手术区域的血液从该部位吸入专门设计的容器。加入柠檬酸盐或肝素抗凝剂,离心和/或过滤内容物以去除白细胞和血块和碎片。使用的ibs设备可以从简单、廉价的装有抗凝剂的无菌瓶到昂贵、复杂、高速的细胞洗涤设备(例如medtronicsequestra 1000,cobe brat 2,medtronic autolog,haemonetics cell saver-和freseniusbentzien等人,anaesthesist 49:505,2000;serrick等人,j.extracorpor.technol.35(1):28,2003;carless等人,the cochrane review,in:the cochranelibrary,john wiley&sons,ltd.,issue 3pp.1-180,2010)。在美国,每年有近一百万例手术用到ibs方法,其已成为医院血液管理和保存计划不可或缺的一部分(www.bloodbook.com)。
3、由于总体输血率高,除了术前贫血的发生率增加外,术前献血还引发了其他严重的经济问题(carless等人,transfus.med.14:123,2004)。此外,在意大利,根据监管指南,异体输血不包括不需要的自体血液制品,由此必须丢弃大约30%的术前自体献血。在这方面,ibs和随后的自体输血通常是血液管理中安全和更具成本效益的措施。
4、表a:癌症手术术中血液回收基准
5、
6、
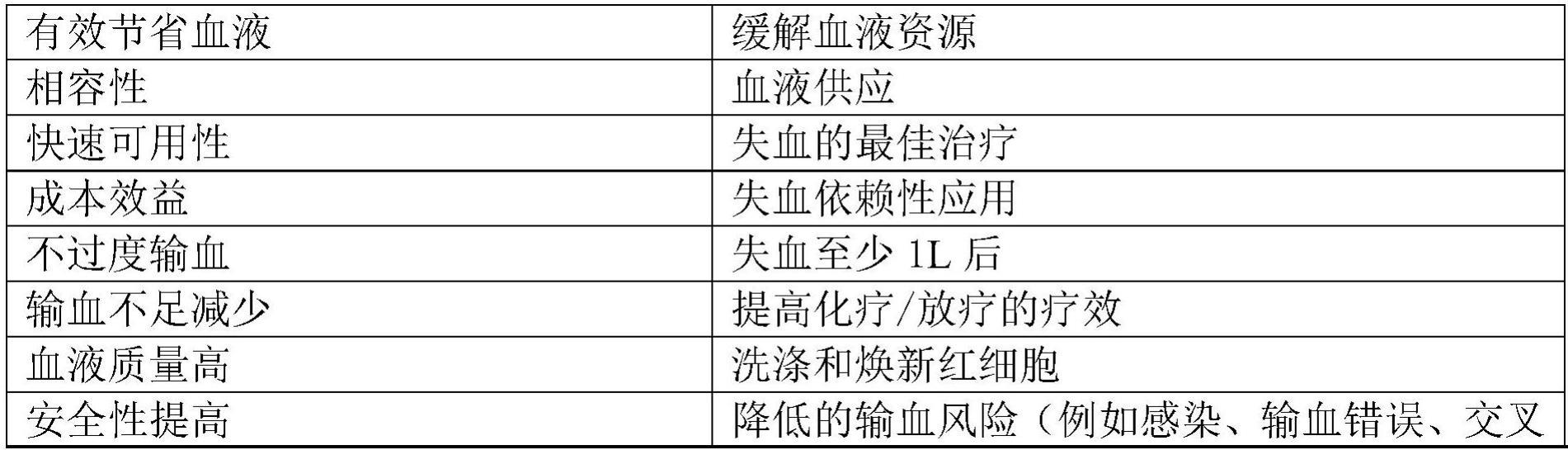
7、术中血液回收的优点
8、与输入异体红细胞相反,ibs被认为是一种安全有效的替代方案。重要的是,尽管有出色的病毒诊断,但hiv感染的传播风险为每493.000次异体输血1例,丙型肝炎病毒感染的传播风险为每103.000次异体输血1例,乙型肝炎病毒感染的传播风险为每63.000次异体输血1例(schreiber等人,n.engl.j.med.334:1685,1996)。从1996年到2001年进行的一项“输血的严重危害”的研究结果记录了这些异体输血事件的风险(dzik等人,transfusion43:1190,2003)。引人注目的是,与献血和输血过程中由于管理或人为失误而导致abo不相容血液的巨大风险相比,通过输入受污染的血传播传染病的风险似乎更小(sazama,transfusion 30:583,1990;dzik等人,transfusion 43:1190,2003)。超过70%的输血事件可归因于不正确的输血成分,其主要是由于管理失败和采样、处方和成分收集错误造成的(dzik等人,transfusion 43:1190,2003)。术前和术中自体红细胞输血本质上绕过了这些异体输血的固有风险。一般来说,自体血液回收技术具有优势,不需要输注晶体液或胶体来保持血容量(表a)。在大出血期间,术中可以回收多升血液,这远远超过其他自体技术。
9、患者对ibs的适用性
10、术中血液回收已经使用超过25年。它广泛用于心胸外科、血管和创伤外科以及肝移植。其应用的禁忌有细菌感染和肿瘤细胞可能流入手术区域,以及在手术部位使用微纤维胶原蛋白或其他异体材料。如今,由于献血短缺和对传播感染的恐惧,ibs的使用也在高失血癌症手术中引起了极大兴趣。报告发现与标准存活数据相比,局部复发或转移性疾病没有增加,因此不愿意在癌症手术中使用自体输血的外科医生已经减少(klimberg等人,arch.surg.212:1326,1986;perseghin等人,vox sang.72:221,1997)。如vanderlinde等人(bmj 324:772,2002)回顾的那样,与异体输血相比,用术前献血中收集的红细胞进行自体输血可以显著降低结直肠癌手术期间的感染和复发发生率(表b)。其中一些经过评审的临床试验甚至更为重要,因为由于细菌传播感染的固有风险,结直肠手术本身已被排除在ibs建议之外。
11、表b:自体与异体输血的随机试验的临床结果*
12、
13、
14、ns=不显著
15、na=不可用(即没有报道)
16、*表格摘自vanderlinde等人,bmj 324:772,2002。
17、然而,一项研究清楚地表明,可以在手术区域检测到肿瘤细胞,尽管它们对癌症复发的影响尚不清楚(hansen等人,arch.surg.130:387,1995)。例如,其比较了61位患者(进行了腹部、骨科、泌尿科、妇科或头颈部恶性肿瘤的癌症手术)的外周血和ibs中的肿瘤细胞数量。在上述61位患者中,在57位患者的肿瘤手术期间的血液中检测到肿瘤细胞。对这些肿瘤细胞的增殖能力、侵袭性和成瘤性进行鉴定,灵敏度为每500ml血液10个肿瘤细胞(hansen等人,arch.surg.130:387,1995)。有趣的是,流出血液中的肿瘤细胞数量与失血量无关,并且这些患者中只有26%可以在外周血中检测到循环肿瘤细胞。因此,据估计,流入手术区域的血液中的肿瘤细胞数量可能在10到107的范围内。这些结果也由dale等人,br.j.surg.75:581,1988和müller等人,anaesthesist 45:834,1996独立证实。
18、为了进一步解决ibs样品中残余的肿瘤细胞的风险的安全问题,需要额外的方法来有效清除污染的肿瘤细胞:
19、·一种方法是与cell saver-等自动ibs设备联合使用,以白细胞去除过滤器(例如pall rc400、rcez1t),rc xl-1)对样品进行额外过滤为代表(bantadini等人,transfusion 34.531,1994;yaprak等人,turk.j.pediatr.40:89,1998;gwak等人,livertransplant.11:331,2005)。安全输入通过ibs收集的红细胞不会损害临床结果,正如几项试验所评估的那样(edelman等人,urology 47:179,1996;perseghin等人,voxsang.72:221,1996;davis等人,bju international 91:474,2003)。
20、·在一不同的ibs方法中,基于有核癌细胞的放射敏感性的基本原理以及非有核红细胞的放射抗性,样品用50gy照射。
21、由于这种ibs/辐射方法需要复杂的物流,包括额外的人员需求、剂量问题和临床部门的合适且经过认证的辐照设备,因此后者的方法不利于广泛应用。相反,在ibs中去除白细胞的过滤方法是一种减少残余的肿瘤细胞的好方法,尽管该技术仍然存在残余的肿瘤细胞仍可通过过滤器的固有风险。
22、因此,为了进一步提高癌症手术中去除残余的肿瘤细胞的安全性,必须改进所有已知的重新输入获得的自体血液(例如,从肿瘤患者手术期间的伤口中获得)的方法,以提供可靠的回收血液中可能污染的肿瘤细胞的去除;所述改进应该能够在例如设备(如cellsaver-或等)或任何其他方法中轻松实施,以重新输入接受手术或手术期间的患者的血液。
23、wo-a-2013050445描述了一种从回收血液中去除肿瘤细胞的方法,该方法基于抗体介导的多细胞复合物的形成,即结合物(associate),其包括由抗体驱动的肿瘤相关抗原识别所识别的肿瘤细胞,任选地进一步通过免疫细胞(白细胞)如t细胞和fc受体阳性辅助细胞的识别,和/或进一步地,肿瘤细胞随后通过例如离心和/或过滤步骤去除所述结合物。也可以使用蛋白质支架的类抗体代替抗体或与抗体组合。然而,在这方面,存在处理过的血液中残余的抗体过量的风险,由此回输所述处理过的血液可能引起严重的副作用。
24、本发明要解决的问题
25、本发明的目的是提供一种从术中回收血液中去除肿瘤细胞的改进的方法,该方法允许在肿瘤高失血手术期间回输由细胞回收设备产生的自体红细胞浓缩物(erythrocyteconcentrate,ec),其中,优选地,显著降低副作用发生。在本发明中,揭示了将肿瘤细胞与免疫细胞物理结合的三功能双特异性抗体的应用,当其与离心步骤和随后的过滤步骤相结合时,将导致ec中肿瘤细胞和残余的抗体显著减少,因此所述ec可以回输至患者体内而不会引起严重的副作用。
26、发明详述和优选实施方案
27、以下讨论包含在描述本发明和说明其优选实施方案的目的中。
28、除非另有解释,本文中使用的所有技术和科学术语具有与本公开所属领域的普通技术人员通常理解相同的含义。除非上下文另有明确说明,单数术语“一(a,an)”和“所述(the)”包括复数指示代词。类似地,除非上下文另有明确说明,“或”一词意在包括“和”。尽管与本文所描述的方法和材料相似或等效的方法和材料可用于本公开的实施或试验,但合适的方法和材料描述如下。术语“包含(包括,comprises)”意指“包括(includes)”。本文提及的所有出版物、专利申请、专利和其他参考资料均通过引用整体并入本文。如有冲突,以本说明书(包括术语解释)为准。此外,材料、方法和示例仅供说明,而非为了限制。
29、本发明涉及:
30、(1)一种从术中回收血液中去除肿瘤细胞的离体(ex vivo)方法,其包括以下步骤:
31、(i)将可能含有免疫细胞和肿瘤细胞的术中回收血液收集到储液器中;
32、(ii)将储液器中步骤(i)所述术中回收血液与至少一种三功能抗体和/或支架蛋白接触,其中所述抗体或所述支架蛋白具有以下性质:
33、a)与t细胞结合;
34、b)与肿瘤细胞上的肿瘤相关抗原结合;
35、c)通过其fc部分与fc受体阳性细胞结合,
36、从而获得包含细胞聚集体的术中回收血液,其中所述细胞聚集体包含所述三功能双特异性抗体和/或所述支架蛋白;
37、(iii)通过离心从步骤(ii)获得的术中回收血液中分离红细胞浓缩物;
38、(iv)洗涤步骤(iii)中所述红细胞浓缩物;
39、(v)过滤步骤(iv)中所述红细胞浓缩物以去除所述聚集体的残留物和/或所述与细胞结合的三功能双特异性抗体和/或支架蛋白的残留物。
40、(2)优选地,在根据权利要求1所述的离体方法中,所述三功能抗体选自由双特异性、三特异性、四特异性和多特异性抗体组成的组,更优选为全igg双特异性抗体。
41、(3)优选地,在根据(1)或(2)所述的离体方法中,用于与步骤(ii)中所述术中回收血液接触的所述至少一种三功能抗体和/或所述支架蛋白的量为2.5μg或更多,更优选2.5μg或更多至5.0μg或更少。
42、(4)优选地,在根据(1)至(3)中任一项所述的离体方法中,步骤(i)中所述术中回收血液的体积为300ml或更多,优选在应用三功能双特异性抗体之前收集在储液器中的体积为400ml或更多。更优选地,所述术中回收血液收集在储液器中。
43、(5)优选地,根据(4)所述的离体方法,其还包括将步骤(i)中所述术中回收血液稀释至350ml至2800ml的体积的步骤,更优选为350ml至2000ml,其含有至少300ml-500ml未稀释的术中回收血液。
44、(6)优选地,在根据(1)至(5)中任一项所述的离体方法中,该方法还包括另外至少一轮的步骤(i)至(v),并且其中至少在第一轮中,用于与所述三功能抗体接触的术中回收血液的体积为400-1500ml。
45、(7)优选地,在根据(6)所述的离体方法中,术中回收血液是血液和稀释液的混合物。
46、(8)优选地,在根据(1)至(7)中任一项所述的离体方法中,在步骤(ii)中将所述至少一种三功能抗体和/或所述支架蛋白与所述术中回收血液接触10-180分钟的时间以获得含有细胞聚集体的术中回收血液,优选20-90分钟,更优选30-60分钟;任选地在19-25℃的温度下,优选在室温下。
47、(9)优选地,在根据(1)至(8)中任一项所述的离体方法中,所述细胞聚集体包括所述抗体、肿瘤细胞和免疫细胞,其中所述免疫细胞优选为t细胞和/或fcγ受体阳性细胞。
48、(10)优选地,在根据(1)至(9)中任一项所述的离体方法中,在步骤(v)中用过滤器过滤步骤(iv)中的红细胞浓缩物,其中所述过滤器优选为白细胞去除过滤器。
49、(11)优选地,在根据(1)至(10)中任一项所述的离体方法中,所述至少一种三功能抗体选自具有以下同种型组合的抗体组成的组:
50、大鼠-igg2b/小鼠-igg2a,
51、大鼠-igg2b/小鼠-igg2b,
52、大鼠-igg2b/人-igg1,
53、小鼠-[vh-ch1;vl-cl]-人-igg1/大鼠-[vh-ch1,vl-cl]-人-igg1-[铰链]-人-igg3*-[ch2-ch3]
54、[*=高加索同种异型g3m(b+g)=不与蛋白a结合]。
55、(12)优选地,在根据(1)至(11)中任一项所述的离体方法中,所述肿瘤相关抗原选自由:epcam、her2neu、egfr、cd30、cd20、cd22、muc1、具有糖基化模式改变的muc1*、psma、cd33、mcsp、cmet、epha2、内皮唾液酸蛋白、碳酐酶ix、igf-1r、fap-α、cd19、gd2、cea、fr、蛋白聚糖、g250、gc182、gt468、gt512组成的组,优选肿瘤相关抗原是epcam。
56、(13)优选地,在根据(1)至(12)中任一项所述的离体方法中,所述三功能抗体和/或所述支架蛋白通过t细胞表面抗原与t细胞结合,其中所述t细胞表面抗原选自cd2、cd3、cd4、cd8、cd28、cd40l和cd44组成的组,优选所述t细胞表面抗原为cd3。
57、(14)优选地,在根据(1)至(13)中任一项所述的离体方法中,所述至少一种三功能抗体和/或所述支架蛋白的fc部分包含i型、ii型和/或iii型fcγ受体的结合位点。
58、(15)优选地,在根据(1)至(13)中任一项所述的离体方法中,所述至少一种三功能抗体和/或所述支架蛋白能够通过单核细胞、巨噬细胞、树突状细胞、自然杀伤细胞和/或活化的中性粒细胞的i型、ii型和/或iii型fcγ受体与其结合。
59、(16)优选地,在根据(1)至(15)中任一项所述的离体方法中,所述肿瘤细胞来自上皮、血液或神经外胚层肿瘤。
60、结合表1-3和下述说明书和实施例描述了其它优选实施方案。本发明的进一步优选特征可以从权利要求中获得。
61、上述方法在体外(ex vivo)实施,即在人体外。术中血液回收(ibs)是本领域公知的,其也被描述为“自体血液回收”。手术期间流失的血液被回收并重新输入到手术期间流失血液的同一患者中。
62、此外,本发明涉及一种具有以下性质的三功能抗体在治疗肿瘤或癌症的方法中的应用:
63、a)与t细胞结合;
64、b)与肿瘤细胞上的肿瘤相关抗原结合;
65、c)通过其fc部分与fc受体阳性细胞结合,
66、所述方法包括(i)收集术中回收血液,其中可能含有免疫细胞和肿瘤细胞;
67、(ii)将步骤(i)中所述术中回收血液与所述三功能抗体接触,以获得含有细胞聚集体的术中回收血液,其中所述细胞聚集体包含所述三功能抗体;
68、(iii)通过离心,从步骤(ii)获得的术中回收血液中分离红细胞浓缩物,优选通过密度梯度离心;
69、(iv)洗涤步骤(iii)中所述红细胞浓缩物;
70、(v)过滤步骤(iv)中所述红细胞浓缩物以去除所述聚集体的残留物和/或与所述细胞结合的三功能抗体的残留物。
71、优选地,上述公开的三功能抗体选自由双特异性、三特异性、四特异性和多特异性抗体组成的组,更优选为双特异性抗体。
72、从术中回收血液中去除肿瘤细胞的方法包括本文所述的离体方法的步骤,并且在适当的情况下,关于离体方法所述内容相应地适用于本方法。
73、上述方法针对去除可能污染术中获得的回收血液的肿瘤细胞。所述血液优选从接受手术治疗并患有肿瘤和/或癌症或疑似携带可能被认为是致瘤细胞的患者中获得。
74、优选地,所述方法从外科医生从手术区域抽吸血液开始。优选地,收集步骤通过抽吸设备进行,并且在此步骤中也可以使用稀释液,例如瑞咯啶(sterofundin)。也可以使用其他稀释液,例如含肝素的0.9% nacl。然后将抽吸的血液与抗凝剂混合,以避免血液凝固。抽吸的血液可以收集在储液器中,直至有足够的血液进行处理。
75、关于“抗凝血剂”包括抗凝血剂的分类,例如抗血小板药物、溶解血栓和纤维蛋白溶解药物以及金属离子螯合剂,例如柠檬酸盐、柠檬酸盐葡萄糖(citrate dextrose,acd)、edta和草酸盐。在相关方面,抗凝血剂包括肝素和糖胺聚糖,例如低分子量肝素(如贝米肝素(bemiparin)、舍托肝素(certoparin)、达肝素(dalteparin)、依诺肝素(enoxaparin)、那曲肝素(nadroparin)、帕肝素(pamaparin)、瑞肝素(reviparin)和亭扎肝素(tinzaparin))以及类肝素(如达那肝素(danaparoid)、舒洛地特(sulodexide)、硫酸皮肤素(dermatansulfate));直接凝血酶(ii)抑制剂(如阿加曲班(argatroban)、比伐卢定(bivalirudin)、达比加群(dabigatran)、地西卢定(desirudin)、水蛭素(hirudin)、来匹卢定(lepirudin)、美拉加群(melagatran)和希美拉加群(ximelagatran));xa因子抑制剂(如蜱抗凝肽tickanticoagulant peptide)(如阿哌沙班(apixaban)、奥米沙班(otamixaban)、利伐沙班(rivaroxaban))和寡糖(如磺达肝癸钠(fondaparinux)和艾卓肝素(idraparinux));维生素k拮抗剂(如醋硝香豆素(acenocoumarol)、氯茚二酮(clorindione)、杀鼠醚(coumatetralyl),双香豆素(dicoumarol,dicumarol)、二苯茚酮(diphenadione)、双香豆素乙酸乙酯(ethyl biscoumacetate)、苯丙羟基香豆素(phenprocoumon)、苯茚二酮(phenindione)、喀氯香豆醇(tioclomarol)和华法林(warfarin))。
76、在本发明的一个实施方案中,如此收集的血液回收物可以对肿瘤细胞的存在进行测试,其中特别优选的肿瘤相关抗原的类型是通过本领域公知的方法确定的,例如通过标记抗体与肿瘤相关抗原的表位特异性反应,以确定所述抗体结合的肿瘤抗原类型以及应用于本发明的类型。
77、在本发明中,术语“肿瘤细胞”是指任何能够持续分裂并形成实体瘤或涌入血液的异常细胞。优选地,在本发明中,存在于术前回收血液中的肿瘤细胞可以来自上皮、血液或神经外胚层肿瘤。
78、本发明中包括的肿瘤的例子包括(但不限于)肉瘤和癌,其包括纤维肉瘤、粘液肉瘤、脂肪肉瘤、软骨肉瘤、成骨肉瘤和其它肉瘤、滑膜瘤、间皮瘤、尤文氏肿瘤、平滑肌肉瘤、横纹肌肉瘤、结肠癌、淋巴恶性肿瘤、胰腺癌、乳腺癌(包括基底乳腺癌、导管癌和小叶乳腺癌)、肺癌、卵巢癌、前列腺癌、肝细胞癌、鳞状细胞癌、基底细胞癌、腺癌、汗腺癌、甲状腺髓质癌、甲状腺乳头状癌、嗜铬细胞瘤皮脂腺癌(pheochromocytomas sebaceous glandcarcinoma)、乳头状癌(papillary carcinoma)、乳头状腺癌、髓样癌、支气管癌、肾细胞癌、肝癌、胆管癌、绒毛膜癌、肾母细胞瘤、宫颈癌、睾丸肿瘤、精原细胞瘤、膀胱癌和中枢神经系统肿瘤(如胶质瘤、星形细胞瘤、髓母细胞瘤、颅咽管瘤、室管膜瘤、松果体瘤、血管母细胞瘤、听神经瘤、少突胶质细胞瘤、脑膜瘤、黑色素瘤、神经母细胞瘤和视网膜母细胞瘤)。进一步的例子包括上皮肿瘤、血液肿瘤和神经外胚层肿瘤。
79、优选地,在本发明所述的离体方法中,所述肿瘤细胞来自上皮、血液或神经外胚层肿瘤。
80、在本发明中,“免疫细胞”包括t细胞和fc受体阳性细胞。在本发明中,“fc受体细胞”是指在细胞表面存在fc受体的细胞。优选地,“fc受体阳性细胞”是指单核细胞、巨噬细胞、树突状细胞、自然杀伤细胞、中性粒细胞和嗜酸性粒细胞中的一种或多种。
81、优选地,在步骤(i)中,可含有免疫细胞和肿瘤细胞的所述术中回收血液收集在储液器(reservoir)中。
82、然后将所述术中回收血液与抗体或适当的蛋白质支架接触,所述抗体或适当的蛋白质支架能够特异性结合到至少一个肿瘤细胞的至少一个肿瘤相关抗原的至少一个表位。
83、在本发明中,“红细胞浓缩物(erythrocyte concentrate)”是指浓缩的红细胞。
84、在本发明中,“细胞聚集体(cell aggregate)”是指相互粘附的细胞,并且这种表述可与“结合物(associate)”或“细胞结合物(cell associate)”互换。类似地,“结合(associating)”和“聚集(aggregating)”也是可以互换的。
85、作为进一步的要求,所述抗体必须能够在血液中形成所包含的至少所述抗体和所述肿瘤细胞的三维网络,以获得包含所述抗体和肿瘤细胞的聚集体或结合物。在本发明的进一步特别优选实施方案中,所述抗体还能够与多于一个的肿瘤细胞和/或免疫细胞结合,以便形成抗体、肿瘤细胞和任选的免疫细胞,进一步任选地额外肿瘤细胞的三维网络。由于多细胞复合物的形成导致的所述结合物的组成、结构和尺寸,这些结合物能够通过离心、过滤或其组合从所述ibs中除去。应当理解,过滤和离心是优选的方法,而为了有效地去除所述包含残余的肿瘤细胞的结合物,本领域技术人员可能认可其它方法。
86、因此,本发明优选侧重于机械去除通过将抗体与肿瘤细胞上的肿瘤相关抗原和免疫细胞结合和聚集而形成的结合物和聚集体,而不是通过抗体特异性相互作用和免疫效应破坏所述肿瘤细胞从而去除携带肿瘤相关抗原的肿瘤细胞。当以常规方式使用抗体作为免疫试剂以便通过与免疫细胞相互作用来破坏肿瘤细胞时,本发明优选地受益于抗体能够交联抗原的能力,这些抗原在本案中位于肿瘤细胞或其片段上。本发明的效果是通过抗体与所述肿瘤细胞的相互作用,特别是通过离心和过滤分离方法去除所述三维网络来实现的。
87、本方法还可以与本领域已知的其它方法联合使用,其中抗体或抗体样分子可以连接到磁性成分如磁珠或其它结构元件,其通过所述结构元件促进抗体复合物的去除,或者通过流式细胞术等细胞分选方法去除肿瘤细胞。只有通过肿瘤细胞和免疫细胞的交联,借助三功能抗体与肿瘤相关抗原的结合,t细胞上的cd3和/或fcγ受体阳性细胞才能通过ak的fc部分形成细胞结合物和聚集体。由于所述抗体与肿瘤细胞或其片段上的肿瘤相关抗原等抗原以及任选的免疫细胞和/或其他肿瘤细胞的三维网络形成,因此机械去除所述结合物成为可能。在这方面,在本发明中没有必要涉及其它结构组分如磁珠或荧光分子以促进所述去除,这使得本方法更加简单且更容易执行。
88、本发明在此描述和要求保护在本发明限制内的三功能双特异性抗体,并以三功能双特异性抗体抗cd3×抗epcam举例说明。所述抗cd3×抗epcam三功能双特异性抗体针对肿瘤相关抗原epcam,并且还结合cd3(t细胞表面抗原),通过其fc部分与fc受体阳性细胞结合。实施例中描述的具体实施方案应当理解为为本发明的可行性提供证据的示例性实施方案。在提供了通过卡妥索单抗(catumaxomab)从ibs中出色地去除了肿瘤细胞的证据之后,已经为目前要求保护的方法所基于的原理提供了概念证明。在提供了这一证据之后,本领域技术人员必然有可能将概念扩展到本发明所涵盖的其它肿瘤和其它抗体,这些肿瘤和抗体能够与所述肿瘤细胞和任选的所述免疫细胞相互作用,以便提供三维网络,即可以通过例如离心和/或过滤去除多细胞复合物。
89、本发明的抗体具体选自三功能抗体。优选地,本发明中的三功能抗体可以是双特异性、三特异性、四特异性和多特异性抗体。下面公开的三功能抗体是指三功能双特异性抗体。然而,如果三特异性、四特异性和多特异性抗体也表现出相同的性质或效果,则所述三功能抗体也可以指本文所用的三功能三特异性、四特异性和多特异性抗体。
90、通常,双特异性抗体被定义为能够优选地通过其可变区与两种不同类型的抗原结合的抗体;三特异性抗体的特征在于优选地通过其可变区与三种不同类型的抗原结合;四特异性抗体的特征在于优选地通过其可变区与四种不同类型的抗原结合,而多特异性抗体被定义为能够优选通过其可变区结合多种不同类型的抗原。作为一个具体的例子,三功能双特异性抗体抗cd3×抗epcam被定义为一方面与肿瘤相关抗原epcam结合,另一方面与t细胞表面抗原cd3结合,以及通过其fc部分与辅助细胞结合。
91、通常,上述双特异性、三特异性、四特异性和多特异性抗体可以是单价、二价、三价、四价或多价。具有单价结合性质的抗体被定义为能够与一种肿瘤相关抗原结合的抗体。二价单克隆抗体被定义为能够与两种肿瘤相关抗原或一种肿瘤相关抗原和一种免疫细胞相关抗原结合的抗体。三价单克隆抗体被定义为能够与三种不同的肿瘤相关抗原,或两种肿瘤相关抗原和一种免疫细胞相关抗原,或一种肿瘤相关抗原和两种免疫细胞相关抗原结合的抗体。四价单克隆抗体被定义为能够与四种不同的肿瘤相关抗原或两种不同的肿瘤相关抗原(每个具有两个相同的抗原结合臂),或两个/三个肿瘤相关抗原和一个免疫细胞相关抗原,或两个肿瘤相关抗原和两个免疫细胞相关抗原结合的抗体。多价单克隆抗体被定义为能够与一种或多种肿瘤相关抗原和/或一种或多种免疫细胞相关抗原结合的抗体。术语“与肿瘤相关抗原结合”定义为与肿瘤细胞上所述肿瘤相关抗原的表位结合。只有那些具有权利要求1所述的三功能双特异性形式的抗体才被本发明所涵盖。仅以参考目的描述所有其他抗体。
92、双功能或三功能抗体的一般描述如kontermann re(ed.),springer heidelbergdordrecht london new york,pp.1-28(2011)所述,具有双特异性或三特异性(具有二价,三价和四价的三功能形式)与一种肿瘤相关抗原和白细胞(即免疫系统细胞)的一种或多种表面抗原的结合特性对于本专利申请非常重要。
93、·具有二价抗原结合特征的双特异性抗体形式:
94、例如:scfv(如bite类)、db、scdb、dsdb、dart、dab2/vhh2、杵臼结构衍生物、seed-igg、异源fc-scfv、fab-scfv和crossmab。
95、·具有三价抗原结合特征的双(三)特异性抗体形式:
96、例如:三联体、dnl-f(ab)3、scfv2-ch1/cl、dab3、fab-scfv2和igg-scfab。
97、·具有四价抗原结合特征的双(三)特异性抗体形式:
98、例如:igg-scfv、scfv-igg、scfv-fc、f(ab’)2-scfv2、sdb-fc、scdb-ch3、db-fc、scfv2-h/l、dvd-ig、tandab、scfv-dhlx-scfv、dab2-igg、二合一mab、mab2、dab-igg和dab-fc-dab。
99、根据本发明使用的其他抗体在以下参考文献中描述:
100、müller d和re kontermann.in:bispecific antibodies.kontermann re(ed.),springer heidelberg dordrecht london new york,pp.83-100(2011)
101、scfv(bite)
102、baeuerle pa,zugmaier g和d rüttinger.in:bispecificantibodies.kontermann re(ed.),springer heidelberg dordrecht london new york,pp.273-288(2011)
103、dvd-ig
104、tarcsa e,fraunhofer w,ghayur t,salfeld j和j gu.in:bispecificantibodies.kontermann re(ed.),springer heidelberg dordrecht london new york,pp.171-186(2011)
105、dnl衍生物
106、chang c-h,rossi ea,sharkey rm,dm goldenberg.in:bispecificantibodies.kontermann re(ed.),springer heidelberg dordrecht london new york,pp.199-216(2011)
107、二合一抗体
108、koeing p和g fuh.in:bispecific antibodies.kontermann re(ed.),springerheidelberg dordrecht london new york,pp.187-198(2011)
109、crossmabs
110、schaefer et al.proc.natl.acad.sci.usa 108:11187(2011)
111、在本发明中,使用至少一种三功能抗体。优选地,可以联合两种或两种以上具有不同特异性的三功能抗体,以介导肿瘤细胞和免疫细胞的结合。
112、优选地,未稀释的步骤(i)中所述的术中回收血液的体积为300ml或更大,或400ml或更大。在这方面,“未稀释”是指所述术中回收血液不与任何其他液体混合。更优选地,未稀释的步骤(i)中所述的回收血液的体积为2550ml或更小、2000ml或更小、1500ml或更小、或1300ml或更小。进一步更优选地,未稀释的步骤(i)中所述的术中回收血液的体积为300ml至2550ml、350ml至2550ml、400ml至2550ml、300ml至2000ml、350ml至2000ml、400ml至2000ml、300ml至1500ml、350ml至1500ml、400ml至1500ml、300ml至1300ml、350ml至1300ml或400ml至1300ml。
113、优选地,步骤(ii)中的抗体仅在收集的术中最小血容量为350ml后施用,以允许抗体与免疫细胞和肿瘤细胞更好的相互作用和结合。
114、优选地,本发明中的方法包括进一步用稀释溶液稀释步骤(i)中所述术中回收血液的步骤,其中所述稀释溶液的体积为2500ml或更少、2000ml或更少、1500ml或更少、1000ml或更少、500ml或更少、400ml或更少、300ml或更少、200ml或更少或100ml或更少。
115、优选地,本发明的方法包括进一步将步骤(i)中所述术中回收血液稀释至体积为350ml至2800ml、350ml至2600ml、350ml至2400ml、350ml至2200ml、350ml至2000ml、400ml至2800ml、400ml至2600ml、400ml至2400ml、400ml至2200ml、400ml至2000ml、450ml至2800ml、450ml至2600ml、450ml至2400ml、450ml至2200ml、450ml至2000ml、500ml至2800ml、500ml至2600ml、500ml至2400ml、500ml至2200ml、500ml至2000ml、1000ml至2000ml、1000ml至2200ml、1000ml至2400ml、1000ml至2600ml、1200ml至2000ml、1200ml至2200ml、1200ml至2400ml、1200ml至2600ml、1400ml至2000ml、1400ml至2200ml、1400ml至2400ml或者1400ml至2600ml的步骤。
116、优选地,在步骤(ii)中使用本发明的所述三功能抗体的量为1.0μg或更多、1.5μg或更多、2.0μg或更多、2.5μg或更多、3.0μg或更多、3.5μg或更多、4.0μg或更多、或4.5μg或更多。更优选地,本发明中所述三功能双特异性抗体使用的量为2.5μg或更多。进一步更优选地,在步骤(ii)中使用本发明的三功能双特异性抗体的量为1.0μg至1.5μg、1.5μg至2.0μg、2.0μg至2.5μg、2.5μg至3.0μg、3.0μg至3.5μg、3.5μg至4.0μg或4.0μg至4.5μg。优选地,在步骤(ii)中使用的本发明所述三功能抗体的浓度为1ng/ml至7ng/ml,更优选2ng/ml至6ng/ml,进一步更优选3ng/ml至5ng/ml。
117、优选地,在步骤(ii)中使用的本发明所述的三功能抗体的量为5.0μg或更少。更优选地,在步骤(ii)中使用的本发明所述的三功能双特异性抗体的量为1.0μg或更多至5.0μg或更少、1.5μg或更多至5.0μg或更少、2.0μg或更多至5.0μg或更少、2.5μg或更多至5.0μg或更少、3.0μg或更多至5.0μg或更少、3.5μg或更多至5.0μg或更少、4.0μg或更多至5.0μg或更少、或4.5μg或更多至5.0μg或更少。进一步更优选地,在步骤(ii)中使用的本发明所述的三功能双特异性抗体的量为2.5μg或更多至5.0μg或更少。
118、优选地,在本发明中,步骤(i)至(v)重复至少一次,并且其中至少在第一轮中,用于与三功能双特异性抗体接触的所述术中回收血液的体积为300ml至1500ml、350ml至1500ml、400ml至1500ml、450ml至1500ml或500ml至1500ml。
119、更优选地,步骤(i)至(v)重复至少一次,并且其中至少在第一轮中,用于与三功能双特异性抗体接触的所述术中回收血液的体积为300ml至1500ml、350ml至1500ml、400ml至1500ml、450ml至1500ml或500ml至1500ml,并且其中所述术中回收血液是血液和稀释液的混合物。
120、本发明的三功能抗体可以通过选自由cd2、cd3、cd4、cd8、cd28、cd40l和cd44组成的组的t细胞表面抗原与t细胞结合。这意味着用于本发明的抗体优选包括抗原结合位(paratope),其能够识别并结合选自由cd2、cd3、cd4、cd8、cd28、cd40l和cd44组成的组的t细胞表面抗原的表位。这种特异性优选地促进t细胞的募集。
121、优选地,所述t细胞表面抗原为cd3。这意味着用于本发明的抗体还优选包括可识别并结合到cd3表位的抗原结合位。
122、卡妥索单抗是三功能抗体的一个例子,通过其2个特异性结合位点结合epcam阳性肿瘤细胞和cd3阳性t细胞。卡妥索单抗还通过结合其完整的片段可结晶(fc)区来募集i型、iia型和iii型fcγr阳性辅助细胞,从而形成三功能作用方式。在本发明的上下文中,卡妥索单抗的主要作用方式由物理聚集肿瘤细胞和淋巴细胞/辅助细胞,以及随后通过离心和过滤去除细胞聚集体。除了卡妥索单抗在用于本发明时的作用方式之外,已经公开了由双特异性三功能抗体诱导的肿瘤细胞破坏的多种机制。
123、zeidler等人[0],[0],[0]和riechelmann等人[0]阐述了biuii(卡妥索单抗的变体抗体)和卡妥索单抗在体外激活t细胞和辅助细胞,以及它们对肿瘤细胞杀伤的贡献。将这种三功能抗体与外周血单核细胞(pbmc)一起使用,显示了辅助细胞活化是抗肿瘤活性的重要因素。t细胞和辅助细胞的活化导致细胞因子(白细胞介素[il]-1β、il-2、il-6、il-12、tnf-ɑ、干扰素γ[ifn-γ]和趋化因子(c-c基序)配体18[ccl18])的产生。值得注意的是,riechelmann等人表明ifn-γ在5小时内达到峰值,而tnf-ɑ在24小时内达到峰值。他们还表明了树突状细胞和nk细胞上活化标志物上调。卡妥索单抗不与b淋巴细胞结合,但它通过直接吞噬作用刺激fcγr阳性辅助细胞来清除肿瘤细胞。
124、在本文中,特别是对于本发明,其与和andersson[0]的研究具有相关性,其表明在刺激后前4小时,促炎细胞因子il1β、tnf-ɑ、il-6、il-8、ifn-γ和il-12未分泌。这是常规途径[0]下,刺激后细胞因子从头合成所必需的时间。
125、[53]zeidler r,mayer a,gires o,et al.tnf-alpha contributes to theanti-tumor activity of a bispecific,trifunctional antibody.anticancerres.2001;21(5):3499-3503.
126、[54]zeidler r,mysliwietz j,csanady m,et al.the fc-region of a newclass of intact bi-specific antibody mediates activation of accessory cellsand nk cells and induces direct phagocytosis of tumor cells.br j cancer.2000;83(2):261-266.
127、[55]zeidler r,reisbach g,wollenberg b,et al.simultaneous activationof t-cells and accessory cells by a new class of intact bi-specific antibodyresults in efficient tumor cell killing.j immunol 1999;163(3):1246-1252.
128、[1]riechelmann h,wiesneth m,schauwecker p,et al.adoptive therapy ofhead and neck squamous cell carcinoma with antibody coated immune cells:apilot clinical trial.cancer immunol immunother.2007;56(9):1397-1406.
129、[1]abbas ak,lichtman ah.general properties of cytokines.in:cellularand molecular immunology.5th edition.philadephia,pennsylvania:saunders,imprint of elsevier;2003:section iv.
130、[3]e,andersson b.kinetics of cytokine release and expression oflymphocyte cell-surface activation markers after in vitro stimulation ofhuman peripheral blood mononuclear cells with streptococcus pneumoniae.scandj immunol.1999:49(3):237-243.
131、在一个优选的实施方案中,用于本发明的抗体是单克隆抗体。本文详细公开的三功能双特异性抗体尤其如此。
132、在本发明中,在术中血液体积较大(例如>1500ml)的情况下,必须开始新一轮本发明所述的方法。
133、因此,优选地,在收集1500ml术中血液并供应2.5μg或更多的抗体后,更优选2.5μg至5.0μg抗体,进一步更优选2.5μg抗体,在至少另外开始一轮步骤(i)至(v)之前,必须首先开始离心,其中优选2.5μg或更多的抗体,更优选2.5μg至5.0μg抗体,进一步更优选2.5μg抗体,在步骤(i)至(v)的后续轮次中与术中血液接触,优选体积为1500ml或更少。
134、优选地,在将抗体用在储液器中之前,必须在ibs储液器中收集最小体积300-400ml的术中血液,以避免抗体的局部过度浓缩,其优点是可以避免高的局部抗体浓度,并且可以显著抑制过量抗体水平残留到最终产物ec中。优选地,在开始离心之前,可以收集最小400ml的未稀释术中血液,以为抗体提供足够的淋巴细胞结合位点。优选地,在储液器中术中回收血液与稀释液混合达到最大体积1500ml的情况下,可以以之前2.5μg的第一抗体剂量开始ibs设备的第一轮离心,在进一步从手术区域收集术中血液的情况下,可以在储液器中另外添加2.5μg剂量的抗体。
135、优选地,如果从个体患者中可获得超过1500ml的术中血液,在满足标准(例如对于第一轮)的情况下,可以进行第二轮ibs。优选避免额外进行例如4轮或更多的轮次,以限制重新输入的残余的ab的量。优选地,2到3轮中,ec中积累的残余的抗体的总量不应超过70ng。
136、具有相对定义的三维结构的蛋白质通常称为蛋白质支架。这些蛋白质支架可用作设计人工工程抗体的试剂。这些支架通常包含一个或多个适合特定或随机序列变异的区域,并且常常进行上述序列的随机化以产生蛋白质文库,从中可以选择所需的抗体支架。这些支架在抗体设计领域特别有用。
137、这些抗体支架是非免疫球蛋白,其模仿单克隆抗体与例如肿瘤细胞和免疫细胞的结合活性的性质。支架通常包括形成所述抗体支架结合侧的环或结构域。这些抗体模拟物可用于设计能够与几乎任何感兴趣的化合物结合的蛋白质的目的。这种定向进化方法可产生对感兴趣的抗原具有高亲和力的抗体样分子。此外,这些支架可用于显示定义的暴露环(例如,先前随机化并根据抗原结合选择的环),以定向进化结合这种引入的环的分子。关于如何获得抗体样支架蛋白的方法在本领域是已知的。下面描述了一种获得抗体样支架蛋白的可能方法。
138、第一种筛选方法,其用于分离或鉴定感兴趣的随机化或突变的蛋白,其涉及:(a)将感兴趣的化合物与候选蛋白质接触,所述候选蛋白质是衍生的非抗体蛋白质,其包括具有免疫球蛋白样折叠的结构域,所述非抗体蛋白质衍生自具有突变的氨基酸序列的参考蛋白质,其中所述非抗体蛋白质以至少如1microm紧密的kd与化合物结合,不比与参考蛋白质结合紧密,其中所述接触是在允许化合物-蛋白质复合物形成的条件下进行的;(b)从复合物中获得与化合物结合的衍生蛋白质。
139、第二种筛选方法,其用于分离或鉴定与感兴趣的肿瘤相关蛋白结合的化合物。该方法从包括具有免疫球蛋白样折叠的结构域的、衍生自具有突变的氨基酸序列的参考蛋白质的非抗体蛋白质开始,其中非抗体蛋白质以至少如1μm紧密的kd与化合物结合,不比与参考蛋白质结合紧密。然后将该衍生蛋白质与候选化合物(肿瘤相关抗原或其表位)接触,其中接触在允许化合物-蛋白质复合物形成的条件下进行,并且从复合物中获得与衍生蛋白质结合的化合物。同样,这种通用技术可以用任何蛋白质进行。
140、获得与感兴趣的化合物(肿瘤相关抗原或其表位)结合的非抗体蛋白质的进一步方法描述如下。其中一种方法涉及:(a)提供包括免疫球蛋白样折叠的非抗体支架蛋白,其中支架蛋白与化合物并不以如1μm紧密的kd结合;(b)产生非抗体支架蛋白的突变衍生物,从而产生突变蛋白文库;(c)将文库与化合物接触;(d)从文库中选择至少一种与化合物结合的衍生蛋白质,其kd至少如1μm紧密;(e)任选地重复步骤(b)-(d),在重复步骤(b)中将非抗体支架蛋白替换为上一步(d)的产物。同样,这种通用技术可以用任何蛋白质进行。
141、如此产生的支架蛋白模拟上述和下述公开的抗体的功能,其可以用于代替基于免疫球蛋白的抗体或与之联合使用。在本发明中,所述三功能抗体可以用所述支架蛋白替换,只要两者在与t细胞结合、与肿瘤细胞上的肿瘤相关抗原结合以及通过其fc部分与fc受体阳性细胞结合方面表现出相同的功能,以获得含有细胞聚集体的术中回收血液。在本发明中,所述三功能抗体和所述支架蛋白可以单独应用或联合应用。
142、下面更详细地介绍了三功能双特异性和三特异性抗体。需要注意的是,本文还描述了三功能双特异性抗体和三特异性抗体在人体内的作用方式,以便提供这些单克隆抗体的完整定义。然而,所述三功能双特异性和三特异性抗体的这些内在性质在当前要求保护的发明中没有效果,因为抗体几乎从ibs中完全去除,至少达到不可检测或不相关的程度,使得它们在重新输入去除肿瘤细胞的红细胞浓缩物时不会在人体内提供任何相关的作用方式。具体地,本文所述述的方法在体外(in vitro)(人体外)进行,这可以通过上述卡妥索单抗通过其2个特异性结合位点与epcam阳性肿瘤细胞和cd3阳性t细胞结合并去除来说明,因此上述抗体不会发生任何内在生物活性。
143、用于本发明的抗体的特征优选地在于通过i、ii和iii型fcγ受体结合至fc受体阳性细胞的fc受体阳性细胞结合的附加作用。
144、优选地,本发明中使用的抗体在其fc部分包含i、ii和/或iii型fcγ受体的结合位点。
145、优选地,本发明中使用的抗体能够与作为fcγ受体阳性细胞的单核细胞、巨噬细胞、树突状细胞、自然杀伤细胞、中性粒细胞和/或嗜酸性粒细胞结合。
146、在本发明中,肿瘤相关抗原是指肿瘤细胞中产生的抗原物质,其在肿瘤细胞表面表达。
147、优选地,三功能抗体或支架蛋白结合的肿瘤相关抗原选自由:epcam、her2neu、egfr、cd30、cd20、cd22、muc1、具有糖基化模式改变的muc1*、psma、cd33、mcsp、cmet、epha2、内皮唾液酸蛋白、碳酐酶、igf-1r、fap-α、cd19、gd2、cea、fr、蛋白聚糖、g250、gc182、gt468和gt512组成的组。
148、更优选地,所述三功能抗体或支架蛋白结合的所述肿瘤相关抗原为epcam、her2/neu、muc1、egfr、epha2、gd2或cd20。
149、优选地,本发明的三功能抗体针对一种t细胞表面抗原和一种肿瘤相关抗原,其中t细胞表面抗原选自由cd2、cd3、cd4、cd8、cd28、cd40l和cd44组成的组,其可以与选自由epcam、her2neu、egfr、cd30、cd20、cd22、muc1、糖基化模式改变的muc1*、psma、cd33、mcsp、cmet、epha2、内皮唾液酸蛋白、碳酐酶、igf-1r、fap-α、cd19、gd2、cea、fr、蛋白聚糖、g250、gc182、gt468和gt512组成的组中任意肿瘤相关抗原联合。
150、优选地,本发明的三功能抗体针对一种t细胞表面抗原(即cd3)和一种肿瘤相关抗原(即epcam)。
151、优选地,所述抗体是异源三功能双特异性抗体,优选单克隆抗体,其选自以下一种或多种同种型组合:
152、·大鼠-igg2b/小鼠-igg2a,
153、·大鼠-igg2b/小鼠-igg2b,
154、·大鼠-igg2b/小鼠-igg3;
155、·大鼠-igg2b/人-igg1,
156、·大鼠-igg2b/人-igg2
157、·大鼠-igg2b/人-igg3[东方同种异型g3m(st)=结合蛋白a],
158、大鼠-igg2b/人-igg4;
159、·大鼠-igg2b/大鼠-igg2c;
160、·小鼠-igg2a/人-igg3[高加索同种异型g3m(b+g)=不结合蛋白a,以下表示为*]
161、·小鼠-igg2a/小鼠-[vh-ch1,vl-cl]-人-igg1-[铰链]-人-igg3*-[ch2-ch3]
162、·小鼠-igg2a/大鼠-[vh-ch1,vl-cl]-人-igg1-[铰链]-人-igg3*-[ch2-ch3]
163、·小鼠-igg2a/人-[vh-ch1,vl-cl]-人-igg1-[铰链]-人-igg3*-[ch2-ch3]
164、·小鼠-[vh-ch1,vl-cl]-人-igg1/大鼠-[vh-ch1,vl-cl]-人-igg1-[铰链]-人-igg3*-[ch2-ch3]
165、·小鼠-[vh-ch1,vl-cl]-人-igg4/大鼠-[vh-ch1,vl-cl]-人-igg4-[铰链]-人-igg4[ch2 n端区域]-人-igg3*[ch2 c端区域:>aa第251位]-人-igg3*[ch3]
166、·大鼠-igg2b/小鼠-[vh-ch1,vl-cl]-人-igg1-[铰链-ch2-ch3]
167、·大鼠-igg2b/小鼠-[vh-ch1,vl-cl]-人-igg2-[铰链-ch2-ch3]
168、·大鼠-igg2b/小鼠-[vh-ch1,vl-cl]-人-igg3-[铰链-ch2-ch3,东方同种异型]
169、·大鼠-igg2b/小鼠-[vh-ch1,vl-cl]-人-igg4-[铰链-ch2-ch3]
170、·人-igg1/人-[vh-ch1,vl-cl]-人-igg1-[铰链]-人-igg3*-[ch2-ch3]
171、·人-igg1/大鼠-[vh-ch1,vl-cl]-人-igg1-[铰链]-人-igg4[ch2 n端区域]-人-igg3*[ch2 c端区域:>aa第251位]-人-igg3*[ch3]
172、·人-igg1/小鼠-[vh-ch1,vl-cl]-人-igg1-[铰链]-人-igg4[ch2 n端区域]-人-igg3*[ch2 c端区域:>aa第251位]-人-igg3*[ch3]
173、·人-igg1/大鼠-[vh-ch1,vl-cl]-人-igg1-[铰链]-人-igg2[ch2 n端区域]-人-igg3*[ch2 c端区域:>aa第251位]-人-igg3*[ch3]
174、人-igg1/小鼠-[vh-ch1,vl-cl]-人-igg1-[铰链]-人-igg2[ch2 n端区域]-人-igg3*[ch2 c端区域:>aa第251位]-人-igg3*[ch3]
175、·人-igg1/大鼠-[vh-ch1,vl-cl]-人-igg1-[铰链]-人-igg3*-[ch2-ch3]
176、·人-igg1/小鼠-[vh-ch1,vl-cl]-人-igg1-[铰链]-人-igg3*-[ch2-ch3]
177、·人-igg2/人-[vh-ch1,vl-cl]-人-igg2-[铰链]-人-igg3*-[ch2-ch3]
178、·人-igg4/人-[vh-ch1,vl-cl]-人-igg4-[铰链]-人-igg3*-[ch2-ch3]
179、·人-igg4/人-[vh-ch1,vl-cl]-人-igg4-[铰链]-人-igg4[ch2 n端区域]-人-igg3*[ch2 c端区域:>aa第251位]-人-igg3*[ch3]
180、·小鼠-igg2b/大鼠-[vh-ch1,vl-cl]-人-igg1-[铰链]-人-igg3*-[ch2-ch3]
181、·小鼠-igg2b/人-[vh-ch1,vl-cl]-人-igg1-[铰链]-人-igg3*-[ch2-ch3]
182、·小鼠-igg2b/小鼠-[vh-ch1,vl-cl]-人-igg1-[铰链]-人-igg3*-[ch2-ch3]
183、在本发明一个特别优选的实施方案中,使用的具有单价结合特异性的三功能双特异性抗体具有以下性质:
184、a)与t细胞结合;
185、b)与肿瘤细胞上的肿瘤相关抗原结合;
186、c)通过其fc部分与fc受体阳性细胞结合;
187、所述三功能双特异性抗体还优选选自一组具有以下同种型组合的抗体:
188、大鼠-igg2b/小鼠-igg2a,
189、大鼠-igg2b/小鼠-igg2b,
190、大鼠-igg2b/小鼠-igg1,
191、小鼠-[vh-ch1;vl-cl]-人-igg1/大鼠-[vh-ch1,vl-cl]-人-igg1-[铰链]-人-igg3*-[ch2-ch3]
192、[*=高加索同种异型g3m(b+g)=不结合蛋白a]。
193、特别优选的是抗体,优选为针对epcam和cd3的三功能双特异性抗体和/或支架蛋白,其具有大鼠-igg2b/小鼠-igg2a同种型组合。所述三功能双特异性抗体的优选示例是抗cd3×抗epcam抗体。优选所述抗体是单克隆抗体。
194、优选地,本发明所述抗体是具有例如fv、fab、scfv或f(ab)2片段的单克隆、嵌合、重组、合成、半合成或化学修饰的完整抗体。
195、在本发明的方法中,也可以使用人源的抗体或衍生物或片段,或修饰后适合用于人类的抗体(所谓的“人源化抗体”)(参见例如shalaby等人,j.exp.med.175(1992),217;mocikat等人,transplantation 57(1994),405)。
196、上述不同类型的抗体和抗体片段的制备对于本领域技术人员来说是显而易见的。单克隆抗体的制备优选哺乳动物来源的,例如人、大鼠、小鼠、兔或山羊,可以使用常规方法进行,例如在和milstein(nature 256(1975),495),harlow和lane(antibodies,alaboratory manual(1988),cold spring harbor)或galfré(meth.enzymol.73(1981),3)所描述的。
197、还可以根据本领域技术人员常见技术,通过重组dna技术制备所述抗体(参见kurucz等人,j.immunol.154(1995),4576;hollinger等人,proc.natl.acad.sci.usa 90(1993),6444)。
198、具有两种不同特异性的抗体,即所谓的双特异性抗体的制备,例如可以使用重组dna技术进行,也可以通过所谓的杂交杂交瘤融合技术进行(参见例如milstein等人,nature 305(1983),537)。该技术包括融合杂交瘤细胞系,每个细胞系产生具有所需特异性之一的抗体,并鉴定和分离产生具有两种特异性的抗体的重组细胞系。
199、如果三功能双特异性或三特异性三功能抗体表现出本文描述的性质和作用,本发明所基于的问题可以通过在优选实施方案中使用它们来克服。通过三功能双特异性抗体具体描述了本发明。然而,应当了解,它还涵盖了以下表现出类似效果的三特异性抗体。尽管上述术语“抗体”或“支架蛋白”可以指三功能双特异性抗体,但应理解,它还可以涵盖以下表现出类似作用的三特异性抗体。
200、具有三种特异性的抗体,即所谓的三特异性抗体的制备,也适用于解决本发明的问题,例如可以通过偶联具有额外特异性的第三抗原结合位点来进行,例如以“单链可变片段”(scfv)的形式偶联到双特异性抗体的igg重链之一。此外,可以使用重组技术,例如基于载体的蛋白质合成或寡核苷酸合成方法。
201、类似地,可以通过将具有第三特异性的scfv替换双特异性抗体中一个特异性的重链的ch2-ch3区域来制备三特异性f(ab)2构建体,而具有其他特异性的重链的ch2-ch3区域可以通过例如将终止密码子(“铰链”5区域的末端)插入编码基因来去除,例如通过同源重组。
202、还可以制备三特异性scfv构建体,其中代表三种不同特异性的三个vh-vl区域串联排列。
203、完整的双特异性抗体由两个抗体半分子(每个具有h和l免疫球蛋白链)组成,每个半分子代表一种特异性,另外其像正常抗体一样具有执行公知效应器功能的fc部分。它们优选使用四源杂交瘤技术制备。这种制备方法在de-a-44 19 399中举例说明。为了完全公开,该文件全文通过引用并入本文,以及双特异性抗体的定义。应当理解,其它制备方法如果导向根据本发明所要求的根据上述定义的完整双特异性抗体,则也是有用的。
204、例如,可以使用新开发的制备方法生产足够量的完整双特异性抗体(lindhofer等人,j.immunology,155:219(1995))。针对乳腺癌细胞上两种不同肿瘤相关抗原(例如c-erb-b2,epcam,例如ga-733-2=c215)的两种双特异性抗体的组合将仅表达其中一种抗原的肿瘤细胞未鉴定的风险最小化。
205、根据本发明的方法,识别肿瘤细胞上肿瘤相关抗原的抗体或支架蛋白不结合、或不通过本领域可能已用作工具的磁性颗粒或磁珠等任何手段结合,以去除通过所述抗体与所述肿瘤细胞和任选的免疫细胞结合而形成的结合物。此外,现有技术描述了用例如荧光染料等显色物质标记肿瘤细胞或抗体,然后进行例如流式细胞术的细胞分选。与此相反,本发明的原理在于形成如上所述的三维网络(结合物),其尺寸足以被过滤器保留或被离心力分离,并通过过滤或离心或其组合等机械手段直接去除所述网络。通过与抗体相互作用形成的结合物的尺寸为可以通过过滤或离心去除的大小。用磁珠或类似工具结合抗体或肿瘤细胞作为间接辅助手段去除抗体和肿瘤细胞的结合物的实施方案也可以与本发明结合使用。此外,将肿瘤细胞与正常细胞分离的流式细胞术方法等分离方法也可以与本发明结合使用。
206、术语“结合物”、“多细胞复合物”和“聚集体”可互换使用,并且始终定义抗体、支架蛋白、肿瘤细胞和/或免疫细胞和/或另外的肿瘤细胞之间的三维网络,以形成可通过离心或过滤或其组合去除的交联肿瘤细胞。所述结合物具体由抗体、肿瘤细胞和免疫细胞组成,上述免疫细胞是t细胞和/或fc受体阳性细胞。
207、所述至少一种抗体与所述术中得到的回收血液接触一段时间,该时间足以交联肿瘤细胞和任选的免疫细胞和/或其它肿瘤细胞以获得结合物。优选地,所述术中回收血液中存在所述肿瘤细胞和所述免疫细胞。所述肿瘤细胞可以通过所述至少一种抗体或所述至少一种支架蛋白特异性识别。
208、实现所述交联所必需的时间可以由本领域技术人员用常规方法确定。本发明所用的时间优选为10至180分钟,以获得含有细胞聚集体的术中回收血液。在本发明中,接触周期优选在10至118分钟之间,更优选在20至90分钟之间,进一步更优选在30至60分钟之间。温度优选为室温,其范围可以是19℃至25℃,优选约21℃。
209、所述过滤优选为白细胞减少或去除过滤,其中含有的肿瘤细胞的聚集体或结合物在红细胞通过过滤器并被收集的同时全部或基本除去。过滤器可以选自孔径在20μm至40μm之间的筛网过滤器,其保留了通过本发明方法形成的结合物,以及例如纤维蛋白链和死细胞团块。尺寸约为8μm的红细胞可以通过过滤器。优选用微聚集体过滤器回输手术期间或手术后收集的流出的自体血。
210、包括分离方法的细胞回收设备在综述carless pa、henry da、moxey aj、o'connell d、brown t和fergusson da,cell salvage for minimizing perioperativeallogeneic blood transfusion,2010,the cochrane collaboration,john wiley&sons,ltd.中记载,其全文通过引用并入本文。
211、为了接收仅含有部分的红细胞的微聚集体血液过滤器的一个例子是pall sq 40s输血过滤器。
212、离心通常通过密度梯度离心步骤进行,然后用生理盐水洗涤一段时间,并且转速足以去除包含所述肿瘤细胞的结合物并将红细胞从所述肿瘤细胞结合物,以及任选地从白细胞中分离。
213、过滤通常进行足够长的时间以去除包含所述肿瘤细胞的结合物,并将红细胞从所述肿瘤细胞结合物,以及任选地从白细胞中分离。
214、在一个优选的实施方案中,所述红细胞浓缩物不含或基本上不含污染的肿瘤细胞,使用时不添加生理盐水。
215、可以使用进一步的过滤步骤来去除残余的结合物和/或白细胞。
216、由于潜在的过滤技术不同于经典的、微米级的包括堵塞问题的过滤方法,这种先进的肿瘤细胞去除策略似乎是可行的。
217、本发明的好处之一是,与用抗体破坏或通过用磁珠或细胞分选方法去除肿瘤细胞相比,本发明大大减少了所述去除肿瘤细胞所用的时间。
218、本发明的其它优点包括术中血液中产生的红细胞浓缩物中肿瘤细胞显著减少,并且在手术区域由于手术创伤产生的促炎细胞因子也显著减少。此外,残余的三功能抗体可以在准备回输的最终ec浓缩物中减少到非临界量。
219、根据优选的实施方案,然后将使用本发明方法获得的血液制品重新施用于起始血液样品获自的患者中,不会引起严重的副作用。
220、实施例
221、下面,描述用于实施本发明的一个示例性实例。具有本领域普通技术的人员采用该方法时必然获得所要求保护的好处。采用该实施例,可以在不偏离本发明的情况下进行各种修改。以下实施例仅用于说明上述公开,而不应被视为对本发明范围的限制。
222、catuvab与机械自体输血设备结合使用,机械自体输血装置是手术设备的一部分,并作为标准从ec中去除白细胞。医疗设备catuvab试剂盒由以下组件组成:含有溶于100μl缓冲液(无菌灌装)的10μg抗体(卡妥索单抗)的注射器,其带有套管,灭菌和无菌包装,欧洲统一(conformitéeuropéenne,ce)标志;含有5.7ml 0.9% nacl溶液的6r小瓶(无菌灌装);2个带100μl套管(21g x 11/2”,40mm)的2ml注射器,无菌包装,带有ce标志的两个无菌ldf,孔径40μm,带硅胶软管并标准化连接。研究性医疗设备catuvab的制造商是lindis bloodcare gmbh,neuendorfstr.20b,henningsdorf,germany。卡妥索单抗是一种生物工程化、完整、三功能双特异性抗epcam×抗cd3结合单克隆抗体,由小鼠免疫球蛋白g(igg)2a链和大鼠igg2b链组成[21,24,25]。
223、epcam在来源于上皮组织的鳞状细胞癌中强表达,可见于各种上皮来源的肿瘤(胃癌、卵巢癌、胰腺癌、结肠/直肠癌、非小细胞肺癌、前列腺癌、膀胱癌、食道癌、子宫内膜癌、epcam阳性肝癌或腹膜癌)[25-27]。过去,卡妥索单抗已被开发为腹膜内治疗表达epcam抗原的恶性腹水和上皮癌(例如膀胱癌、卵巢癌、胰腺癌、肺癌、结肠癌、乳腺癌、前列腺癌和胃癌)的靶向疗法。在上皮癌引起的恶性腹水的先导适应症治疗中,欧洲药品管理局(ema)于2009年批准了卡妥索单抗。出于商业原因,该产品于2017年下架。
224、卡妥索单抗在catuvab设备中的主要作用方式由肿瘤细胞和淋巴细胞/辅助细胞的物理聚集和随后的通过离心和过滤去除细胞聚集体组成,作为机械自体输血的一部分。抗体同时与患者术中血液中的淋巴细胞(通过抗体的cd3特异性区域)、肿瘤细胞和fcγr阳性辅助免疫细胞离体结合最终导致形成更大的细胞聚集体。
225、[21].ruf p,kluge m, m,burges aet al.pharmacokinetics,immunogenicity and bioactivity of the therapeutic antibody catumaxomabintraperitoneally administered to cancer patients.british journal of clinicalpharmacology 2007,69:6/617–625 2010.
226、[24].riesenberg r,buchner a,pohla h,lindhofer h.lysis of prostatecarcinoma cells by trifunctional bi-specific antibodies(alpha epcam x alphacd3).journal of histochemistry&cytochemistry 2001;49(7):911-917.
227、[25].schmitt m,schmitt a,reinhardt p,et al.opsonization with atrifunctional bispecific(acd3 x aepcam)antibody results in efficient lysis invitro and in vivo of epcam positive tumor cells by cytotoxic tlymphocytes.international journal of oncology 2004;25(4):841-848.
228、[26].spizzo g,fong d,wurm m,ensinger c,obrist p et al..epcamexpression in primary tumour tissues andmetastases:an immunohistochemicalanalysis.journal of clinical pathology 2011;64:41.
229、[27].keller l,werner s,pantel k.biology and clinical relevance ofepcam.cell stress.2019;3(6):165–180.
230、在体外预备研究中,研究了术中血液处理和最终产品的三个参数,以证明其安全性和有效性:
231、1)epcam阳性肿瘤细胞
232、2)促炎细胞因子和
233、3)残余的抗体卡妥索单抗。
234、手术期间积累的血液和清洗溶剂收集在含有骨碎片过滤器的储液器中(例如atr120储液器,fresenius kabi)。将收集在储液器中的血液和清洗溶剂混合物离心并使用ibs机器(c.a.t.s.+,fresenius kabi,at3 autotransfusionsset,fresenius kabi)洗涤,产生红细胞浓缩物(ec)。使用40μm的白细胞去除过滤器(ldf,rs1,haemonetics)(ldf样品3)过滤红细胞浓缩物(ec)。所有用于分析的样品均通过输出连接/出口提取并收集在无菌管中。收集的用于抗体分析的样品在1-2h(-20℃)内冷冻。样品立即被送到trion researchgmbh。离心用于细胞因子分析的血液样品,收集上清液(血浆),在1-2h(-20℃)内冷冻。样品立即置于干冰上被送到分析实验室。
235、首先稀释卡妥索单抗,并使用注射器通过储液器上的端口将一定量的稀释抗体(2.5μg或5μg抗体)输送到血液混合物中。抗体分布在术中血液中,大约30分钟内形成肿瘤和免疫细胞的聚集体。在ibs常十几个的洗涤和浓缩过程中,密度相对较低的细胞聚集体可以通过离心从总混合物中的红细胞中分离出来。第二个过滤步骤(catuvab的ldf过滤器)去除了任何剩余的细胞聚集体。
236、对肿瘤细胞的分析表明,在16个测试的患者样品中有10个,即63%的术中血液样品中存在肿瘤细胞,范围从69到约260.000。重要的是,在catuvab方法中产生的最终红细胞浓缩物中没有检测到残余的肿瘤细胞,即使用细胞回收设备(也称为机械处理的自体输血机(mat))包括应用三功能双特异性抗体通过与免疫细胞和肿瘤细胞交联来生成细胞聚集体并结合离心和过滤步骤以产生无肿瘤细胞的红细胞浓缩物。
237、为了覆盖catuvab方法的安全性方面,测量了促炎细胞因子il-6和il-8,这是ec回输后与潜在副作用最相关的两个指标。与储液器中未处理的术中回收血液相比,最终产物(ec)中il-6总量的平均值降低了28倍。对于il-8,甚至观察到平均值降低了52倍。最终ec产品中il-6和il-8总量的平均值分别为53和9ng,代表了非临界值,因为这些量将在患者体内稀释约2000-3000倍。这种解释是基于患者身体血容量平均在5-7升之间,含有约2-3升血浆来计算的。在这种情况下,即使是测量到的il-6的峰值264ng也不会通向临界值。因此,从本研究的数据来看,受促炎细胞因子影响的安全性方面不应该成为catuvab方法的问题。
238、第三个重要参数,特别是考虑到catuvab方法作为医疗设备的批准,是最终ec产品中残余的抗体的量。
239、在这里,在研究过程中引入了方法的两个变化(在结果部分描述),导致最终产品中的残余的抗体大幅减少。因此,在实施这些变化后,在最终ec产品中仅发现总抗体量在定量限(125pg/ml)和9ng之间。可以根据所有接受抗体的15名患者的测量值给出建议,其中最终产物中的峰值为69ng。因此,最终ec产品中70ng抗体的量可以是用于定义残余的抗体界限的值。
240、该研究的目的是利用catuvab从肿瘤手术期间回收的患者血液中去除肿瘤细胞,并在catuvab方法之前和期间以及最终产品红细胞浓缩物(ec)中评估肿瘤细胞、细胞因子和残余的卡妥索单抗抗体。
241、catuvab方法使用(i)双特异性三功能抗体卡妥索单抗交联epcam阳性肿瘤细胞与cd3阳性t细胞和fcγ受体阳性免疫细胞,(ii)在离心步骤中从所生成的ec中去除此类细胞聚集体,以及(iii)使用40μm白细胞去除过滤器(ldf)在最终过滤步骤中去除包含残余的肿瘤细胞的细胞聚集体。
242、由于该试点研究的探索性特征和患者数量少,仅进行了使用平均值的描述性统计。
243、1.材料
244、1.1.抗体
245、
246、1.2.术中血液
247、1.2.1 mat/储液器
248、手术期间回收的血液和清洗溶剂收集在含有骨碎片过滤器的储液器中(mat/储液器样品)。
249、1.2.2 ek_b(ec)
250、将收集在储液器中的血液和清洗溶剂混合物离心并使用细胞回收机(fresenius)洗涤,产生红细胞浓缩物(ec)(erythrozytenkonzentrat:ek_b样品)。
251、1.2.3 ldf
252、使用40μm白细胞去除过滤器(ldf,haemonetics)过滤红细胞浓缩物(ec或ek_b),使得红细胞浓缩物中几乎不再含有白细胞(ldf样品)。
253、所有用于分析的样品均通过输出连接/出口提取并收集在无菌管中。
254、2.方法
255、2.1法兰克福大学医院制备样品
256、所有样品都是在手术过程中收集的,用于肿瘤细胞检测的血液样本在手术后立即通过tnt在室温下运送,第二天早上9点之前到达trion research gmbh。收集的用于抗体分析的样品在1-2h(-20℃)内冷冻,并在干冰上送到trion research gmbh。离心用于细胞因子分析的血液样品,收集上清液(血浆),在1-2h(-20℃)内冷冻,并在干冰上送到trionresearch gmbh。
257、2.2 trion research gmbh实施的方法
258、在第一步中,通过ficoll密度离心分离来自mat、ek_b和ldf样品的外周血单核细胞(pbmc)和可能的肿瘤细胞。在第二步中,制备细胞涂片(cytospin)。根据以下sop处理血液样品并制备细胞涂片:
259、·ay-028.01“pbmc的分离”
260、·tr-as-0107-v01“细胞计数和细胞活力的测定”
261、·tr-sop-kf-004“用卡妥索单抗在临床研究中制备细胞涂片”
262、此外,通过elisa测量测定mat、ek_b和ldf样品中的抗体浓度,根据以下sop进行:
263、·ay-006.02卡妥索单抗-elisa
264、没有对样品进行脱脂,这被认为并不重要,因为样品没有脂肪。ek_b和ldf样品未离心(与mat样品相反),而是与样品稀释缓冲液以1:1混合并直接应用于包被elisa板。该方法获得了更准确的结果,如初步加标研究(spiking study)所示。在法兰克福研究方进行catuvab方法期间收集所有用于抗体测量的样品,在1-2小时内冷冻并储存在<-15℃,直到分批在干冰上运送到trion research。在那里,样品储存在<-15℃直至测量。
265、2.3由外部认证实验室进行的方法
266、外部认证实验室使用抗体ber-ep4分析细胞涂片中是否存在epcam阳性肿瘤细胞。
267、2.4 synlab mvz labor münchenzentrum gbr进行的方法
268、synlab mvz labor测量了mat、ek_b和ldf样品中的细胞因子谱。
269、3结果
270、2019年3月至2019年11月期间,德国法兰克福大学医院连续有16名接受腹部肿瘤切除术的癌症患者(平均66.8岁)参加了这项研究。仅选择已知为epcam阳性的肿瘤适应症,例如晚期结肠癌、胆管癌、食道癌、卵巢癌、胰腺癌、胆管癌、直肠癌和肺门周胆管细胞癌。临床研究方案于2018年12月由法兰克福大学医院伦理委员会批准(编号325/18),并获得了每位患者的知情同意。所有患者都知道该方法,并被告知流出的血液是为了研究目的而收集的,不会输回给他们。
271、在手术期间,将catuvab方法体外(extra-corporal)应用于15名患者的术中血液。一名患者(9号)采集的血液没有应用抗体(在储液器中没有检测到抗体,数据未显示),因此在统计计算中取出了该患者和相关样品。仅选择肿瘤适应症,根据文献已知为epcam阳性(见表1)。术中血液混合物(血液和稀释溶液)的体积范围为500ml至2800ml,手术期间添加的稀释溶液的体积为0至2500ml。用2.5μg卡妥索单抗处理的患者样品组的未稀释术中血液的体积在300至1300ml之间,以产生肿瘤细胞聚集体。对于用5μg处理的患者样品组,未稀释(和稀释)的术中血液体积范围为300ml(1400ml)至2550ml(2600ml)。
272、3.1术中血液中检测epcam阳性肿瘤细胞
273、通过使用肿瘤标志物epcam和细胞角蛋白进行免疫荧光染色,从而对epcam阳性肿瘤细胞进行检测和定量。密度梯度离心法使用ficoll-paque作为淋巴细胞和肿瘤细胞的分离培养基,这些淋巴细胞和肿瘤细胞在细胞涂片制剂离心后染色。使用抗体ber-ep4分析这些细胞涂片是否存在epcam阳性肿瘤细胞。通过免疫荧光显微镜和集成数字图像分析(applied imaging)对肿瘤细胞进行定量[28]。
274、[28].jager m,schoberth a,ruf p,hess j et al:immunomonitoring resultsof a phase ii/iii study of malignant ascites patients treated with thetrifunctional antibody catumaxomab(anti-epcam x anti-cd3).cancer research2012,72(1):24-32.
275、在不同的catuvab方法步骤(储液器和/或ec)中,16个患者血液样品中有10个(62.5%)检测到epcam阳性肿瘤细胞。epcam阳性肿瘤细胞的数量范围从ec样品(过滤前)中发现的69到mat-储液器中的263.076。重要的是,在ec最终产物中的最后一个纯化步骤(过滤)后未发现肿瘤细胞(表2)。肿瘤细胞的染色由外部认证实验室的团队进行,该实验室在检测源自癌的epcam阳性肿瘤细胞方面拥有丰富的经验。
276、3.2促炎细胞因子il-6和il-8的测量
277、众所周知,卡妥索单抗可能激活不同类型的免疫细胞,因此测量的目的是确定catuvab方法中促炎细胞因子可能的增加[29]。将样品送到synlab mvz实验室(德国慕尼黑),并通过使用磁性微球珠的公司的多重技术测定细胞因子。多重elisa基于独特的荧光信号(fluorescent signature)包被的微珠结合特定的细胞因子,随后通过激光技术进行测量。
278、[29].zeidler r,reisbach g,wollenberg b,et al.simultaneous activationof t-cells and accessory cells by a new class of intact bi-specific antibodyresults in efficient tumor cell killing.journal of immunology 1999;163(3):1246-1252.
279、在catuvab方法中,还取样测量促炎细胞因子以评估安全性参数。因此,在加入交联抗体卡妥索单抗之前在储液器中以及在过滤前后(最终产品)在ec中测量il-6和il-8。由于卡妥索单抗可以激活不同类型的免疫细胞,因此测量的目的是确定catuvab方法中促炎细胞因子潜在的增加。
280、如表1所示,术中血液中il-6(和粗体的il-8)值从低于定量水平(blq为4pg/ml;6pg/ml)到加入卡妥索单抗之前,储液器中的2633pg/ml;518pg/ml(平均值:662pg/ml;129pg/ml)。加入卡妥索单抗后,ec中的上述值的范围从49至1070pg/ml(平均值:339pg/ml;323pg/ml)(过滤前)。过滤后,ec中的上述值的范围为20;blq不高于2488pg/ml;139pg/ml(平均值:516pg/ml;46pg/ml)。在catuvab方法中,术中血液的体积从储液器中的2800ml(平均值:1461ml)减少到ec中的40ml(平均值:99ml),还计算了储液器和ec(过滤后)中的细胞因子总量,以评估(i)catuvab方法中细胞因子总量的减少和(ii)可能重新输入到患者的细胞因子量。收集在储液器中的术中血液中,细胞因子il-6;il-8的总量的范围从5.2ng,8.4ng到7372ng;901ng(平均值:1502ng;204ng)。在完成catuvab方法后,ec(最终产品)中il-6;il-8的值的范围从1ng;0.1ng至264ng;16ng(平均值:53ng;3.9ng)。与储液器中未处理的收集的术中血液相比,最终产品(ec)中il-6;il-8总量相比平均值减少了28;52倍。
281、3.3过滤后ec最终产品中残余的抗体(卡妥索单抗)的评估
282、卡妥索单抗浓度通过已建立的双位点elisa测量。简而言之,卡妥索单抗被抗大鼠igg轻链特异性抗体(la1b12,trion research,munich,germany)捕获。然后通过抗小鼠igg2a特异性生物素标记的检测抗体(bd pharmingen,san diego,ca)检测结合的卡妥索单抗。然后,加入链霉亲和素-b-半乳糖苷酶及其相应的底物氯酚红-β-d-吡喃半乳糖苷(roche diagnostics,mannheim,germany),并在570nm处测量比色反应。通过在标准曲线上插值计算卡妥索单抗浓度。测定的定量下限(lloq)确定为125pg ml-1;定量上限为4000pgml-1。所有样品在测量前均以1:2稀释为两份[21,28]。
283、[21].ruf p,kluge m, m,burges aet al..pharmacokinetics,immunogenicity and bioactivity of the therapeutic antibody catumaxomabintraperitoneally administered to cancer patients.british journal of clinicalpharmacology 2007,69:6/617–625 2010.
284、[28].jager m,schoberth a,ruf p,hess j et al:immunomonitoring resultsof a phase ii/iii study of malignant ascites patients treated with thetrifunctional antibody catumaxomab(anti-epcam x anti-cd3).cancer research2012,72(1):24-32.
285、医疗设备的一个重要先决条件是要回输给患者的最终产品中没有抗体或非常低的残余的抗体。因此,使用定量限为125pg/ml的非常灵敏的elisa测定法来测量残余的抗体。
286、在试点研究期间,研究了应用抗体的不同方法。因此,对于患者1-10,抗体应用方式没有明确定义,在某些情况下,在开始收集术中血液之前,抗体首先在储液器中应用。抗体测量表明,由于在储液器底部发生局部高浓度的抗体,因此这样的应用方案导致抗体分布不理想。结果,在catuvab方法结束时,最终ec产品中未结合的抗体积累并检测到相对较高的量。患者2和7的情况就是如此,在应用2.5μg抗体后,检测到相对较高的抗体浓度,分别为1.694pg/ml和1.026pg/ml(表3)。
287、到目前为止,为了改善这种情况,在患者11-16中,仅在储液器中收集了最小350ml的术中血液体积后,才将抗体应用于患者,以使抗体与免疫细胞和epcam阳性肿瘤细胞更好地相互作用和结合。实验设置的这种变化明显改善了这种情况,因为在患者11和16中,抗体浓度降至blq,在患者15中,应用2.5μg后抗体浓度降至160pg/ml。
288、另一个重要的发现是,在术中血液体积较大(>1500ml)的情况下,当向储液器添加额外的抗体(+2.5μg)时,最终产品中也会发现更高浓度的抗体。因此,在患者12和13中也检测到相对较高的抗体浓度,分别为888pg/ml和628pg/ml。
289、这些结果表明,将每个ibs周期的术中血液体积限制在1,500ml(如果术中血液总量为≥1,500ml,则可以开始第二个周期)。从患者14-16开始,在储液器中建立抗体应用的两种改进后,最终ec中发现的抗体总量范围从blq(≤125pg/ml)至9ng(表3)。
290、因此,决定在主要研究的方案上,在回收1500ml术中血液并供应2.5μg抗体后,必须首先开始离心,然后开始新的术中血液采集,并可以开始新的catuvab方法并供应新的抗体(2.5μg)。
291、这项研究的另一个重要目的是测量抗体的总量,这可能与最终ec一起应用回患者。
292、在这里,在抗体应用得到改善之前,患者1-10中检测到的抗体总量从blq到69ng(2.5μg应用组)不等。在储液器中建立改进的抗体应用后,最终ec中发现的抗体总量范围在2.5μg应用组中从blq至9ng,在5μg应用组中从blq至59ng(表3)。
293、4讨论
294、在上述实施例中,将15名肿瘤患者的术中血液用于含有三功能抗体的医疗设备方法中并结合离心和过滤步骤,对参数进行优化以满足以下标准:
295、1)从术中血液中产生的红细胞浓缩物中去除肿瘤细胞
296、2)通过手术减少由于手术创伤在手术区域产生的促炎细胞因子
297、3)将用于交联免疫细胞和肿瘤细胞的三功能抗体减少到准备回输的最终红细胞浓缩物(ec)中的非临界量。
298、为了优化,研究并定义了以下参数:
299、1)具有足够结合位点的最小量的淋巴细胞和单核细胞,用于所使用的具有特异性抗epcam、抗cd3和与fcγ受体阳性细胞结合的fc部分的三功能抗体。最小量的免疫细胞将允许对所使用的三功能抗体进行定量结合,这些抗体也可以与源于上皮的抗epcam结合臂肿瘤细胞交联以产生细胞聚集体(细胞复合物)。
300、2)因此,实验表明,2.5μg所述抗epcam×抗cd3三功能抗体的量可以与含有约300×10e6淋巴细胞和单核细胞的最小300ml未稀释的术中血液定量结合。未稀释的术中血液的最小量可以稀释至五倍(例如用单-瑞咯啶(solo-sterofundin)溶液)仍符合上述标准。结果,在最终ec产品中,确定残余的抗体低于不高于9ng的定量限(blq)。
301、3)通过三功能抗体将免疫细胞与肿瘤细胞交联,然后在mat细胞回收机内离心,产生免疫细胞和体积剧烈减少的红细胞浓缩物。与未处理的手术血液相比,随后对ec的过滤产生了最终ec产品,准备好以分别减少28倍和52倍的量的促炎细胞因子il-6和il-8进行回输。
302、在概念验证研究中,对ldf后ec中具有大量残余的抗体的患者的详细分析揭示了导致这一观察结果的情况,而在上述示例中必须避免这种情况。因此,在将抗体应用于储液器之前,必须在ibs储液器中回收最小体积(300-400ml)的术中血液,以避免局部抗体浓度过高。其次,在开始catuvab方法(开始离心以产生ec)之前,可以收集最小量的未稀释的术中血液(400ml),以为抗体提供足够的在淋巴细胞上的结合位点。在储液器中收集的术中回收血液混合物的最大体积达到1500ml(血液和稀释液)的情况下,可以以2.5μg的第一抗体剂量开始ibs设备的第一轮离心;在进一步从手术区域收集术中血液的情况下,可以将另外2.5μg剂量的卡妥索单抗添加到储液器中。
303、如果可自个体患者中获得超过1500ml的术中血液,则可以在满足标准(例如第一轮)时进行第二轮ibs。不允许额外的轮次(三轮或更多)来限制重新输入的残余的ab量。通常,ec中两轮期间积累的残余的抗体总量不应超过70ng。
304、第三个重要参数,特别是考虑到catuvab方法作为医疗设备的批准,是最终ec产品中残余的抗体的量。在这里,在研究期间引入了两个变化[(i)在添加抗体之前必须收集最少量的术中血液,(ii)如果收集了1500ml的术中血液,则必须开始该方法,对于更大的术中血液体积,必须启动第二轮该方法]在研究期间引入了该方法(在结果部分中描述),这导致最终产品中的残余的抗体大大减少。因此,在实施这些变化后,在最终ec产品中仅发现总抗体量在定量限(125pg/ml)和9ng之间的。
305、手术期间肿瘤细胞的扩散可能源于留在切除线处的肿瘤细胞、肿瘤意外破裂、腹膜腔内既往存在的肿瘤细胞或通过术中加压释放到血液中,但不太可能来自循环肿瘤细胞[30,31]。一些研究表明,在62%-90%的病例中,通常在自体回输袋的红细胞浓缩物中检测到肿瘤细胞,这些细胞表现出增殖能力、侵袭性和致瘤性[30,32,42]。hansen等人[30]认为,在手术区域鉴定的肿瘤细胞与在外周血中循环的肿瘤细胞不同,因为手术区域中肿瘤细胞的检测频率和数量都远高于手术结束时循环中的肿瘤细胞。研究还发现,在大多数情况下,ibs本身不足以去除肿瘤细胞[32]。
306、为了解决这一问题,已在脊柱癌患者和多种泌尿系统恶性肿瘤(包括前列腺癌、尿路上皮癌、肾癌和肝癌)中测试了白细胞去除过滤器(ldf)[33-36]。
307、kumar等人[37]表明,在11名受试对象中的8名中,使用ldf的ibs可以有效地清除脊柱肿瘤手术中回收血液中的肿瘤细胞。ldf诱捕肿瘤细胞的机制可能是机械筛分和非特异性生物粘附过程的组合[38]。然而,肿瘤细胞是否在临床环境中被完全过滤,ldf是否消除了肿瘤细胞转移的风险,仍然未知。因此,监管指南例如德国(querschnittsleitlinieder rztekammer 2020,www.baek.de)禁止回输从癌症手术中获得的术中血液的自体ec。
308、wu等人[39]进行了一项泛分析,以评估纯ibs与异体输血在恶性疾病手术中的肿瘤学安全性。据报道,无论效果成本比或肿瘤手术的疗效如何,结合ldf的ibs在肿瘤复发率方面与同种异体血相当。其他出版物例如linder等人(european urology 63(2013)第839-845页)报道了同种异体输血的患者比不输血的患者表现出更高的肿瘤复发率(见第843页)。然而,已发表的数据表明,ldf过滤肿瘤细胞的能力是有限的。因此,当肿瘤细胞数量过高(≥2×103)时,过滤器将无法完全去除肿瘤细胞,因此肿瘤远端扩散的风险仍然存在[38,40,41]。
309、作为替代方案,还提出了在回输之前对血液进行辐照。血液辐照可确保肿瘤细胞数量减少10-12个对数,这被认为足以清除所有肿瘤细胞[42]。然而,spyratou等人(journal of medical physics,2019年4月至6月,第44卷,第2期,第113-117页)表明,辐照在细胞以及膜细胞骨架的机械性能中表现出负面作用,从而对红细胞的功能产生负面影响。除此之外,辐照还会破坏恶性细胞的dna,降低其繁殖能力。辐照治疗需要特殊的大型放射设备以及严格的辐射防护管理。世界上大多数医疗机构都没有这样的条件,辐照治疗通常无法在手术室完成,这合理地限制了其广泛的临床实施。
310、基于单克隆抗epcam抗体卡妥索单抗的选择性,发明了一种有效且易于实施的方法,用于从肿瘤手术期间收集的血液中去除具有转移潜力的epcam阳性肿瘤细胞[43,44]。walcher等人(frontiers in immunology,2020年8月,第11卷,第1280条)还描述了epcam已被评估作为治疗性生物标志物以及癌症干细胞的标志物,并且在结直肠癌和乳腺癌中已经进行了具有不同抗体形式靶向epcam。epcam在>90%范围内的广谱上皮实体癌类型(例如卵巢癌、胃癌、结肠癌、胰腺癌、膀胱癌、前列腺癌、子宫内膜癌和非小细胞肺癌)中表达[26,27],并且由于其高亲和力和细胞结合潜力,卡妥索单抗即使在非常低的epcam表达水平下也能结合[22],使catuvab适用于广泛的实体癌手术。
311、在这里,我们必须讨论epcam阴性肿瘤细胞的作用,它可能会逃脱catuvab方法。在本文中,必须考虑三个条件。首先,只应考虑在>90%的病例中表达epcam的癌症适应症。其次,由于离心和过滤步骤与三功能抗体的结合和交联能力(过滤器特征)无关,epcam阴性肿瘤细胞也将减少高达90%。第三,一些出版物已经表明,与epcam阴性肿瘤细胞相比,epcam阳性癌细胞的转移潜力更高[43,44]。综上所述,使用catuvab时残余的epcam阴性肿瘤细胞潜在污染的风险/收益比似乎是可以接受的,但需要进一步的临床评估。
312、这项试点研究表明,在采血过程中轻松实施catuvab方法是可行的。即使在术中血液中的高肿瘤细胞水平(例如>2.6×105)下,也可以在最后的ldf过滤步骤后清除这些细胞。il-6和il-8量可以分别以平均28倍和52倍显著降低,表明该方法的细胞因子洗脱效果。鉴于受试者体内大约2,000至3,000倍的稀释度,最终产品中il-6和il-8总量的平均值被认为不是关键的。这种解释是基于患者身体血容量在平均5-7升之间的范围,含有约2-3升血浆计算的。在这种情况下,即使是测得的il-6峰值为264ng也不会通向临界值。因此,关于促炎细胞因子的安全性方面不应该成为catuvab方法的问题。
313、在16种最终ec产品中的8种中检测到残余的卡妥索单抗抗体,其量减少(平均为37ng),考虑到小鼠的ld50>5.0mg/kg,这被认为不是关键的[45],在食蟹猴中在不高于300μg/kg下没有毒性迹象[46],临床试验中证实7μg的mtd静脉应用[47]超过了ec中的残余的药物数量级以及一般临床经验[28]。
314、5.结论
315、由于自体输血设备本身不足以去除肿瘤细胞[30,31],并且应用ldf等其他措施虽然显著降低了重新引入肿瘤细胞的风险,但在回收的血液中存在高肿瘤负荷的情况下失败[38],因此仍然存在污染物残留的风险。尽管患者数量很少,但这项离体研究的结果表明了epcam阳性肿瘤细胞的完全去除,而该结果需要在临床研究中验证。
316、[22].andree kc,barradas amc,nguyen at.capture of tumore cells onanti-epcam-functionalized poly(acrylic acid)-coated surfaces.acs appliedmaterials and interfaces2016:8(23):14349-14356.
317、[26].spizzo g,fong d,wurm m,ensinger c,obrist p et al..epcamexpression in primary tumour tissues andmetastases:an immunohistochemicalanalysis.journal of clinical pathology 2011;64:41.
318、[27].keller l,werner s,pantel k.biology and clinical relevance ofepcam.cell stress.2019;3(6):165–180.
319、[30].hansen e,futamura n,nakanishi h,hirose h,et al.the effect ofstorage on the survival of cancer cells in blood and efficient elimination ofcontaminating cancer cells by a leukocyte depletion filter.the americanjournal of surgery 2005;71:585.
320、[31].dale rf,kipling rm,smith mf,et al.separation of malignant cellsduring autotransfusion.british journal of surgery 1988;75:581.10.
321、[32].hansen e,wolff n,knuechel r,et al.tumor cells in blood shed fromthe surgical field.archives of surgery 1995;130:387.
322、[33].ciepluch b,wilson-robles h,levine g,et al.removal ofhemangiosarcoma cells from canine blood with a cell salvage system andleukocyte reduction filter.veterinary surgery2018;47(2):293-30.
323、[34].kumar n,zaw as,koo bl,nandi s et al.intraoperative cell salvagein metastatic spine tumour surgery reduces potential for reinfusion of viablecancer cells.european spine journal 2016;25:4008–4015.
324、[35].ferroni mf,correa af,timothy d,lyon td,benjamin j,davies bj,ostmc.the use of intraoperative cell salvage in urologic oncology.reviewsin.urology 2017;19(2):89-96.
325、[36].pinto am,chedid mf,capra rp,prediger c et al.intraoperative cellsalvage with autologous transfusion in liver transplantation.world journal ofgastrointestinal surgery 2019;27;11(1):11-18.doi:10.4240/wjgs.v11.i1.11.
326、[37].kumar n,ahmed q,lee vk,et al.can there be a place forintraoperative salvaged blood in spine tumor surgery?annals of surgeryoncology 2014;21(7):2436-2443.
327、[38].gwak ms,lee kw,kim sy,et al.can a leukocyte depletion filter(ldf)reduce the risk of reintroduction of hepatocellular carcinoma cells?liver transplantation 2005;11:331.
328、[39].wu w,zhang w,zhang w,et al.survival analysis of intraoperativeblood salvage for patients with malignancy disease:aprisma-compliantsystematic review and meta-analysis.medicine(baltimore)2019;98(27):e16040.
329、[40].hansen e.failed evidence of tumour cell removal from salvagedblood after leucocyte depletion.transfusion medicine 2006;16(3):213-216.
330、[41].liang tb,li dl,liang l,li jj,bai xl,yu w et al.intraoperativeblood salvage during liver transplantation in patients with hepatocellularcarcinoma:efficiency of leukocyte depletion filters in the removal of tumorcells.transplantation 2008;85:863–869.
331、[42].zhang fj,yang jt,tang lh,wang wn,sun k,ming y et al.effect of x-ray irradiation on hepatocarcinoma cells and erythrocytes in salvagedblood.scientific reports 2020;|7:7995|doi:10.1038/s41598-017-08405-z.
332、[43].de wit s,van dalum g,lenferink atm,et al.the detection of epcam+and epcam-circulating tumor cells.scientific reports 2015;5:122-7.
333、[44].liu x,li j,cadilha l,markota a et al.,epithelial-type systemicbreast carcinoma cells with a restricted mesenchymal transition are a majorsource of metastasis.science advances 2019,5:eaav4275.
334、[45].schwaiger fw.acute intravenous toxicity study of removab(anti-epcam x anti-cd3)in the mouse(report nr 075.002.315),aurigon life science2003.
335、[46].leuschner j.removab-dose escalation study with 6single dosesafter intravenous2-hour infusion in the cynolmolgus monkey(report nr.14348/01)lpt laboratory of pharmacology and toxicology 2,2001.
336、[47].mau-sorensen m,dittrich c,dienstmann r et al.a phase i trial ofintravenous catumaxomab:a bispecific monoclonal antibody targeting epcam andthe t cell coreceptor cd3.cancer chemotherapy and pharmacology 2015;75(5):1065-1073.
337、6.缩写
338、ab:抗体
339、blq:低于定量限
340、cca:胆管癌
341、ec:红细胞浓缩物
342、epcam:上皮细胞粘附分子
343、esoph.:食道癌
344、ibs:术中血液样本
345、il:白细胞介素
346、ldf:白细胞去除过滤器
347、nd:储液器中未检测到抗体
348、ovar.:卵巢癌;
349、pancr.:胰腺癌;
350、pccc:肺门周胆管细胞癌
351、vol.:体积
352、表1
353、
354、表2
355、
356、表3
357、
技术实现思路
- 还没有人留言评论。精彩留言会获得点赞!