染色质占据和RNA的单细胞分析测序的制作方法
在一方面,提供用于在同一细胞中同时分析全基因组染色质蛋白结合或组蛋白修饰标记和rna表达的方法和组合物。
背景技术:
1、基因表达表现出显著的细胞异质性,其可受到多种因素的影响,包括染色质修饰的不同方面(corces,m.r.等人(2016)lineage-specific and single-cell chromatinaccessibility charts human hematopoiesis and leukemia evolution.nat genet48,1193-1203,doi:10.1038/ng.3646;cheung,p.等人(2018)single-cell chromatinmodification profiling reveals increased epigenetic variations withaging.cell173,1385-1397e1314,doi:10.1016/j.cell.2018.03.079)。在过去的几年里,已经开发了几种以单细胞分辨率测量染色质状态不同方面的测定。其中包括基于液滴的单细胞chip-seq15、基于tn5的染色质可及性测定(atac-seq)(buenrostro,j.d.等人(2015)single-cell chromatin accessibility reveals principles of regulatoryvariation.nature 523,486-490,doi:10.1038/nature14590.cusanovich,d.a.等人(2015)multiplex single cell profiling of chromatin accessibility bycombinatorial cellular indexing.science348,910-914,doi:10.1126/science.aab1601)、dnase i超敏性测定(dnase-seq)(jin,w.等人(2015)genome-widedetection of dnase i hypersensitive sites in single cells and ffpe tissuesamples.nature528,142-146,doi:10.1038/nature15740)、基于mnase的核小体定位和染色质可及性测定(scmnase-seq)(lai,b.等人(2018)principles of nucleosomeorganization revealed by single-cell micrococcal nucleasesequencing.nature562,281-285,doi:10.1038/s41586-018-0567-3)、基于免疫切割的组蛋白修饰测定(cut&run,scchic-seq)(ku,w.l.等人single-cell chromatinimmunocleavage sequencing(scchic-seq)to profile histone modification.natmethods16,323-325,doi:10.1038/s41592-019-0361-7(2019).skene,p.j.和henikoff,s.an efficient targeted nuclease strategy for high-resolution mapping of dnabinding sites.elife6,doi:10.7554/elife.21856(2017).hainer,s.j.,boskovic,a.,mccannell,k.n.,rando,o.j.和fazzio,t.g.(2019)profiling of pluripotency factorsin single cells and early embryos.cell177,1319-1329e1311,doi:10.1016/j.cell.2019.03.014)、抗体引导的tn5染色质标记测定(act-seq,cut&tag,cobatch)(carter,b.等人mapping histone modifications in low cell number and singlecells using antibody-guided chromatin tagmentation(act-seq).naturecommunications10,1-5(2019).wang,q.等人cobatch for high-throughput single-cellepigenomic profiling.mol cell76,206-216e207,doi:10.1016/j.molcel.2019.07.015(2019).kaya-okur,h.s.等人(2019)cut&tag for efficient epigenomic profiling ofsmall samples and single cells.nat commun10,1930,doi:10.1038/s41467-019-09982-5)和nome-seq测定(pott,s.(2017)simultaneous measurement of chromatinaccessibility,dna methylation,and nucleosome phasing in single cells.elife6,doi:10.7554/elife.23203)。这些测定测量染色质状态的一个或多个方面并提供关于染色质中细胞异质性的数据,但并不在同一单细胞中直接同时测量rna和染色质或转录因子结合两者。
技术实现思路
1、在一方面,我们现在提供用于在同一单细胞中直接同时测量rna和染色质或转录因子结合两者的新组合物和方法。
2、更特别地,在一个优选方面,提供用于诊断或预测疾病的方法,该方法包括:
3、1)从样品中分离和培养感兴趣的细胞;
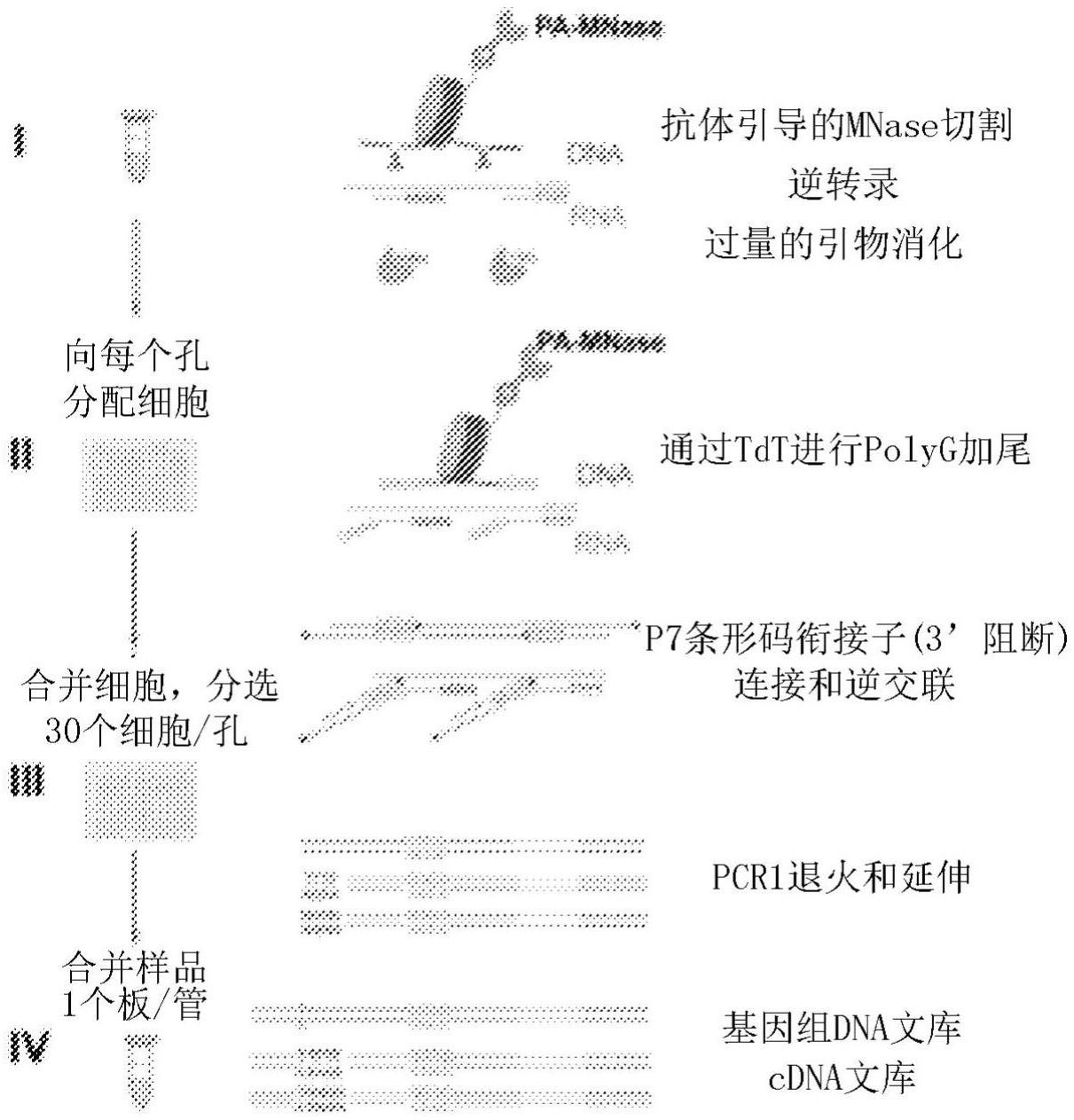
4、2)进行染色质切割并使细胞进行逆转录;
5、3)在存在寡核苷酸衔接子的情况下,使细胞进行末端脱氧核苷酸转移酶(tdt)介导的寡核苷酸至cdna和染色质切割的末端两者;或者,使细胞进行末端修复,将脱氧腺苷添加至dna末端,然后将条形码化的衔接子与dna t/a连接并将衔接子与cdna末端引物辅助连接;
6、4)合并来自每个反应孔的细胞并将合并的细胞分选或稀释到新孔中,然后进行一个或多个扩增步骤;和
7、5)使分选的细胞进行文库构建和测序;从而在单细胞中同时分析染色质占据和rna。在优选的方面,此类方法可用于在单细胞中同时分析染色质占据和rna。适当地,在该方法中,在染色质切割之前用固定剂交联细胞。
8、在另一方面,提供用于诊断或预测疾病的方法,该方法包括:
9、1)使细胞进行核酸酶介导的染色质切割;
10、2)通过用多核苷酸激酶和外切核酸酶处理修复核酸片段的5’和3’端;
11、3)使核酸片段逆转录;
12、4)使细胞与条形码衔接子接触;
13、5)用末端脱氧核苷酸转移酶(tdt)和条形码衔接子连接使细胞进行polyg加尾,产生基因组文库并对细胞进行分选。在优选的方面,此类方法可用于在单细胞中同时分析染色质占据和rna,
14、适当地,在使细胞与条形码衔接子接触之前,用外切核酸酶消化过量的引物。
15、此类方法特别地有用于在受试者中诊断癌症,并且可包括根据本方法处理受试者的生物样品。
16、另外,本方法有用于鉴定诊断或治疗癌症的生物标志物,并且可包括根据如本文公开的方法处理受试者的生物样品,并且之后基于鉴定的生物标志物向受试者施用癌症治疗剂。
17、本方法还有用于确定实体瘤样品的细胞异质性以治疗癌症,任何所述方法可包括根据如本文公开的方法处理受试者的肿瘤样品;确定肿瘤样品的细胞异质性,并用一种或肿瘤特异性治疗剂和/或化学治疗剂治疗受试者。优选地,确定肿瘤的细胞异质性可准确地诊断肿瘤的分期和性质。
18、仍然进一步地,本方法还有用于评估细胞,任何所述方法可包括本方法的细胞,从而评估细胞。细胞可包括例如肿瘤细胞、干细胞、修饰细胞、感染细胞、car-t细胞、car-nk细胞、转化细胞、细胞系或其组合。可评估细胞的表观遗传变异、转录组变异、基因表达、蛋白表达、生物标志物或其组合等。
19、提供用于诊断或预测疾病的另外方法,其包括鉴定和分析单个细胞中的组蛋白修饰,该方法适当地包括:
20、1)用交联固定剂交联细胞;
21、2)使固定细胞与染色质特异性引导核酸酶接触以切割染色质;
22、3)通过多核苷酸激酶修复核酸酶切割的末端并添加5'-磷酸用于多聚核苷酸加尾和连接;和
23、4)用条形码衔接子对核酸酶切割位点进行条形码化并合并细胞;
24、5)拆分细胞并用逆交联缓冲液温育细胞;
25、6)捕获条形码化的细胞dna片段并通过第一扩增测定对条形码化的dna片段进行索引标记以产生dna文库;
26、7)合并和纯化dna文库并对纯化的dna文库进行poly a加尾;
27、8)将加尾的poly a与衔接子连接并纯化连接的dna;
28、9)进行第二扩增测定、分离、纯化和测序扩增的片段;从而鉴定和分析单个细胞中的组蛋白修饰。
29、在某些方面,将来自第一扩增测定的扩增的dna片段映射到人参考基因组(ucschg18)。在某些方面,基于每个条形码将来自第一扩增测定的映射的dna片段分成单个集合。
30、在某些方面,以上方法可用于在受试者中确定细胞异质性和细胞分化,并且包括从受试者获得样品并根据以上方法测定样品。在某些方面,受试者可患有遗传性病症、疾病、神经系统疾病或病症、癌症、自身免疫性疾病或其组合。
31、在另一方面,提供用于检测和鉴定单个细胞中的核酸酶超敏位点的方法,并且可包括:
32、a)用固定剂交联细胞;
33、b)裂解细胞并用核酸酶消化细胞dna;
34、c)将细胞核等分并将染色质dna与第一条形码衔接子连接;
35、d)合并细胞核,然后稀释并重新分配到单独的板孔中;
36、e)使dna进行逆交联,经由扩增测定引入与第一条形码衔接子互补的第二条形码;
37、f)合并扩增的dna,将dna与第二条形码衔接子连接;
38、g)扩增dna并引入第三条形码衔接子;和
39、h)合并和测序扩增的dna;其中,
40、i)具有相同条形码组合的序列源于单细胞;从而检测和鉴定单个细胞中的核酸酶超敏位点。
41、在此类方法中,核酸酶可适当地包括:内切核酸酶、外切核酸酶、dnase、mnase或其组合。优选的条形码衔接子可包括与以下具有50%序列同一性的核苷酸序列:acactgacgacatggttctacannnnnnnnagatcggaagagcacacgtctgaactccagtcac(seq id no:2)、tgtagaaccatgtcgtcagtgtcccccccc/3ddc(seq id no:3)、gatcggaagagcgtcgtgtagggaaagagtg(seq id no:4)或tctttccctacacgacgctcttccgatct(seq id no:5)。
42、在仍然另一方面,提供用于确定在发育、遗传状况或疾病状态期间发生的细胞异质性和细胞分化的方法,该方法适当地包括:
43、1)使固定细胞与染色质特异性引导核酸酶接触以切割染色质;
44、2)修复核酸酶切割的末端并通过末端脱氧核苷酸转移酶(tdt)用dg多聚尾标记dna末端;
45、3)通过t4连接酶连接寡核苷酸dc衔接子;
46、4)合并细胞并对细胞进行分选;
47、5)扩增和用第一条形码对dna进行条形码化;
48、6)合并细胞并用第二条形码对dna进行条形码化;
49、7)分离、纯化和测序扩增的片段;从而,
50、8)鉴定和分析单个细胞中的组蛋白修饰;从而确定细胞异质性和细胞分化。
51、在仍然另一方面,提供用于检测和鉴定单个细胞中的dnase i核酸酶超敏位点的方法,其包括:
52、1)裂解细胞并用dnase i消化细胞dna;
53、2)将染色质dna与第一条形码衔接子连接;
54、3)合并细胞核,然后稀释并重新分配到单独的板孔中;
55、4)使dna进行逆交联,经由扩增测定引入与第一条形码衔接子互补的第二条形码;
56、5)合并扩增的dna,将dna与第二条形码衔接子连接;
57、6)扩增dna并引入第三条形码衔接子;和,
58、7)合并和测序扩增的dna,其中具有相同条形码组合的扩增的dna序列源于单细胞;从而检测和鉴定单个细胞中的核酸酶超敏位点。在某些实施方案中,第一条形码衔接子可通过末端脱氧核苷酸转移酶(tdt)和t4连接酶与染色质dna连接。
59、定义
60、除非另外定义,否则本文使用的所有技术和科学术语具有与本发明所属领域的技术人员通常理解的相同的含义。尽管在测试本发明的实践中可使用与本文所述的那些类似或等效的任何方法和材料,但本文描述了优选的材料和方法。在描述和要求保护本发明时,将使用以下术语。还应当理解,本文使用的术语仅用于描述特定实施方案的目的,而并不旨在限制。
61、冠词“一个/种(a)”和“一个/种(an)”在本文中用于指一个或多于一个(即至少一个)冠词的语法对象。举例来说,“一个要素”意指一个要素或多于一个要素。因此,例如,“一个细胞”的陈述包括多个相同类型的细胞。此外,在详细描述和/或权利要求中使用术语“包括(including)”、“包括(includes)”、“具有(having)”、“具有(has)”、“具有(with)”或其变体的情况下,此类术语旨在以类似于术语“包含(comprising)”的方式包括。
62、术语“约”或“大约”意指在如由本领域普通技术人员确定的特定值的可接受误差范围内,这将部分地取决于如何测量或确定该值,即测量系统的局限性。例如,根据本领域的实践,“约”可意指在1个或多于1个标准偏差内。备选地,“约”可意指给定值或范围的至多20%、至多10%、至多5%或至多1%的范围。备选地,特别是关于生物系统或过程,该术语可意指在一个值的5倍以内,以及2倍以内的数量级内。在申请和权利要求中描述了特定值的情况下,除非另外规定,否则应假设术语“约”意指在特定值的可接受误差范围内。
63、术语“扩增(amplify)”、“扩增(amplification)”、“扩增反应”或“扩增(amplifying)”是指用于扩大目标核酸拷贝的任何体外过程。扩增有时是指目标核酸的“指数”增加。然而,“扩增”也可以指目标核酸数量的线性增加,但不同于一次性单引物延伸步骤。在一些实施方案中,可进行有限的扩增反应,也称为预扩增。预扩增为其中由于进行少量循环(例如10个循环)而发生有限量扩增的方法。预扩增可允许一些扩增,但在指数期之前停止扩增,并且典型地产生期望的核苷酸序列的约500份拷贝。预扩增的使用可限制与某些扩增反应中耗尽的反应物相关的不准确性,并且还可减少由于目标的核苷酸序列或物种丰度所致的扩增偏倚。在一些实施方案中,可进行一次性引物延伸作为线性或指数扩增的前奏。
64、在以上描述和权利要求中,诸如“……中的至少一种”或者“……中的一种或多种”之类的短语可出现在要素或特征的结合列表之后。术语“和/或”也可能出现于两种或更多种要素或特征的列表中。除非其中使用该短语的上下文另外隐含或明确地矛盾,否则这种短语旨在意指任何单独列出的要素或特征,或者与任何其他列举的要素或特征组合的任何列举的要素或特征。例如,短语“a和b中的至少一种”、“a和b中的一种或多种”以及“a和/或b”各自旨在意指“单独的a、单独的b或a和b一起”。类似的解释也旨在针对包括三种或更多种项目的列表。例如,短语“a、b和c中的至少一种”;“a、b和c中的一种或多种”;以及“a、b和/或c”各自旨在意指“单独的a、单独的b、单独的c、a和b一起、a和c一起、b和c一起或a和b和c一起”。另外,以上和权利要求中使用的术语“基于”旨在意指“至少部分地基于”,使得未列举的特征或要素也是允许的。
65、如本文使用的涉及项目、组合物、装置、方法、过程、系统等的定义或描述的要素的术语“包含(comprising)”、“包含(comprise)”或“包含(comprised)”及其变体,意指为包括性或开放式的,其允许另外的要素,从而指示定义或描述的项目、组合物、装置、方法、过程、系统等包括那些指定的要素——或者,视情况而定,其等价物——并且可包括其他要素并且仍然落在所定义的项目、组合物、装置、方法、过程、系统等的范围/定义内。
66、如本文使用的术语“疾病”是指困扰哺乳动物(比如人)的任何疾病或状况,包括例如癌症、免疫失调、感染、神经系统状况和遗传病症。
67、本说明书和权利要求中的术语“样品”以其最广泛的意义使用,并且可通过非限制性实例的方式,包括样本或培养物(例如微生物培养物)、生物以及非生物样本。生物样品可包括动物来源的材料,包括流体(例如血液、唾液、尿液、淋巴液等)、固体(例如粪便)或组织(例如口腔的、器官特异性的、皮肤等),以及液体和固体食品和饲料产品和成分,比如乳制品、蔬菜、肉类和肉类副产品及废物。生物样品可从例如人、任何家养动物或野生动物、植物、细菌或其他微生物等获得。这些实例不应解释为限制适用于本公开的样品类型。本领域的技术人员将意识到并理解检测特定目标序列所需的特定样品类型(pawliszyn,j.,sampling and sample preparation for field and laboratory,(2002).venkateshiyengar.g.,等人,element analysis of biological samples:principles andpractices(1998).drielak.s.,hot zone forensics:chemical,biological.andradiological evidence collection(2004);以及nielsen.d.m.,practical handbook ofenvironmental site characterization and ground-water monitoring(2005))。
68、如本文所述的细胞“亚群”是指特定细胞类型的细胞的特定子集,其可与该细胞类型的其他细胞区分或可唯一地鉴定并与该细胞类型的其他细胞区分开来。细胞亚群可以在表型上表征,并且优选地通过本文体现的方法表征。如本文所述的细胞(亚)群可由特征为特定细胞状态的特定细胞类型的细胞的(亚)群构成。
69、本文提供的范围理解为该范围内所有值的简写。例如,1-50的范围理解为包括来自1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49或50的任何数字、数字的组合或子范围。浓度、量、细胞计数、百分比和其他数值在本文中可以范围形式呈现。应当理解的是,使用这种范围形式仅是为了方便和简洁,并且应当灵活地解释为不仅包括作为范围的限值而明确地列举的值,而且包括包含在该范围内的所有单个数值或子范围,如同每个数值和子范围均明确地列举一样。
70、本文提供的任何组合物或方法可与本文提供的任何其他组合物和方法中的一种或多种组合。
71、本文引用的所有出版物、公开的专利文件和专利申请特此通过引用并入,如同每个单个出版物、公开的专利文件或专利申请具体且单独地指示为通过引用并入一样。
- 还没有人留言评论。精彩留言会获得点赞!