D-阿洛酮糖3-差向异构酶固定化酶的制备方法及其应用
d-阿洛酮糖3-差向异构酶固定化酶的制备方法及其应用
技术领域:
1.本发明属于酶工程技术领域,具体涉及一种d-阿洛酮糖-3-差向异构酶固定化酶的制备方法,及其在转化d-阿洛酮糖方面的应用。
背景技术:
2.d-阿洛酮糖是稀有糖家族的重要成员,是一种新型的低能量甜味剂。因具有较高的甜度和较低的能量,d-阿洛酮糖被认为是一种理想的甜味剂和蔗糖的有效替代品,可用于开发低热量食品饮料。同时,d-阿洛酮糖可以发生美拉德反应,有助于提升食品品质,可以完美发挥传统的糖的作用。
3.生物合成法生产d-阿洛酮糖,是利用微生物所产特异性的酶,专一性的催化底物合成d-阿洛酮糖。d-阿洛酮糖-3-差向异构酶(d-allulose-3-epimerase,dae)可以催化多种酮糖c3位的差向异构,是生产稀有糖的良好催化剂,以d-果糖为底物生产附加产值高的d-阿洛酮糖。随着d-阿洛酮糖的市场需求量的日益增加,高效的生物催化剂的开发对其工业应用至关重要。然而,d-阿洛酮糖3-异构酶催化果糖转化为阿洛酮糖过程中,由于酶无法重复利用,使得该工艺成本较高,且水溶性的酶不易从反应系统中分离出来,不利于控制和自动化生产。酶的固定化技术可以增加酶稳定性的同时使酶可以反复多次使用,但是传统的酶固定化方式容易导致酶多个位点和载体结合,破坏酶的天然构象或者出现位阻效应而阻碍底物进入到酶的活性位点,致使固定化酶活性大幅度下降。
技术实现要素:
4.鉴于以上问题,本发明的目的在于提供一种d-阿洛酮糖3-差向异构酶固定化酶的方法,包括用于固定化酶制备的蛋白质,使得制备的固定化酶能够在保持较高酶活性的同时维持良好的稳定性,实现批次循环使用。
5.本发明技术方案具体如下:
6.本发明提供一种利用相互作用多肽对spytag/spycatcher,或snooptag/snoopcatcher制备d-阿洛酮糖-3-差向异构酶固定化酶的方法,包括如下步骤:
7.1)向磷酸钠缓冲液中加入spycatcher或snoopcatcher,之后加入适量环氧树脂,25℃恒温振荡反应12h,反应产物用pbs缓冲液洗涤数次;
8.2)将洗涤后的反应产物加入甘氨酸缓冲液中,25℃恒温振荡反应12~24h,反应产物用超纯水清洗数次;
9.3)将清洗后的反应产物加入磷酸钠缓冲液中,之后加入可与所述spycatcher专一结合的多肽spytag或可与所述snoopcatcher专一结合的多肽snooptag,25℃恒温搅拌反应3~12h,获得d-阿洛酮糖-3-差向异构酶固定化酶;
10.其中,多肽对spycatcher/spytag的核苷酸序列分别如seq id no:1和seq id no:2所示;多肽对snoopcatcher/snooptag的核苷酸序列分别如seq id no:3和seq id no:4所示。
11.进一步地,步骤1)中,所述spycatcher或snoopcatcher与所述环氧树脂的加量比例按质量比为:每20~35mg蛋白对应加入1g环氧树脂;步骤3)中,所述清洗后的反应产物与所述spytag或snooptag的加量比例按摩尔比为1:1。
12.进一步地,步骤1)中,所述环氧树脂经过如下预处理:将环氧树脂置于磷酸钾缓冲液中,25℃恒温下150rpm振荡1h,振荡处理重复2~3次,最后用超纯水清洗环氧树脂;用于对所述环氧树脂进行预处理的磷酸钾缓冲液由0.1mol/l的k2hpo4和0.1mol/l的kh2po4按体积比15~16:1混合配制而成。
13.进一步地,步骤2)中甘氨酸缓冲液的浓度为3mol/l,ph为7.4;步骤1)和步骤3)中的所述磷酸钠缓冲液的浓度为2mol/l,ph为6.4~7.4;步骤1)中用于洗涤反应产物的pbs缓冲液的ph为7.4。
14.在此基础上,本发明提供一种利用d-阿洛酮糖-3-差向异构酶固定化酶制备d-阿洛酮糖的方法,具体步骤如下:
15.1)将固定化酶加入到含有d-果糖的反应体系中,于50~60℃反应1.5~2.5h;反应体系中的d-果糖浓度为100~500g/l;反应体系中固定化酶的催化剂用量为:每20~25g d-果糖对应加入0.01g固定化酶;
16.2)反应完成后,用ph7.4的pbs缓冲液洗涤固定化酶,之后将固定化酶置于ph7.4的pbs缓冲液中,4℃保存备用。
17.进一步地,步骤1)中,所述含有d-果糖的反应体系为水果自发酵液,其d-果糖的浓度为100g/l。
18.本发明提供的可相互作用的多肽spytag/spycatcher,以及snooptag/snoopcatcher,较之常规的tag-catcher蛋白组装体系可以在体外特异性地自组装形成更稳定的共价键,充分满足固定化酶的结合程度和活性位点要求,利用该特性制备获得的d-阿洛酮糖-3-差向异构酶固定化酶同时保持了酶活高和稳定性高的特点,重复多次使用后酶活无明显衰减。同时,利用本发明提供的多肽对进行d-阿洛酮糖-3-差向异构酶固定化酶的制备,过程中无需使用戊二醛(交联)及其它有毒害的化学试剂,同时也不涉及昂贵的试剂和复杂的设备,整个制备过程无毒害且成本低廉。
附图说明:
19.图1为spycatcher核苷酸序列的扩增产物电泳结果,图中泳道1中的条带对应spycatcher的dna分子,泳道m为marker条带。
20.图2为spytag核苷酸序列的扩增产物电泳结果,图中泳道1、2中的条带对应spytag的dna分子,泳道m为marker条带。
21.图3为snoopcatcher核苷酸序列的扩增产物电泳结果,图中泳道1中的条带对应snoopcatcher的dna分子,泳道m为marker条带。
22.图4为snooptag核苷酸序列的扩增产物电泳结果,图中泳道1~3中的条带对应snooptag的dna分子,泳道m为marker条带。
23.图5为d-阿洛酮糖3-差向异构酶固定化酶以果糖溶液为底物进行的15个批次催化反应中的酶相对活性变化趋势。
24.图6为d-阿洛酮糖3-差向异构酶固定化酶以水果自发酵液为底物进行的10个批次
催化反应中的酶相对活性变化趋势。
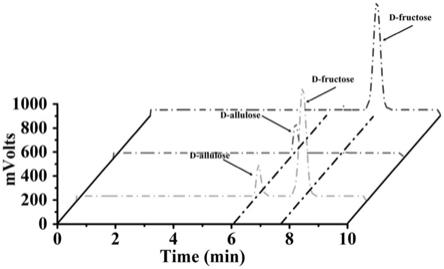
25.图7为d-阿洛酮糖的高效液相色谱检测结果。
26.以下通过具体的实施方案叙述本发明方法。除非特别说明,本发明所用的技术手段均为本领域技术人员所公知的方法。另外,实施方案应理解为说明性的,而非限制本发明的范围,本发明的实质和范围仅由权利要求书所限定。对于本领域技术人员而言,在不背离本发明实质和范围的前提下,对这些实施方案中的物料成分和用量进行的各种改动也属于本发明的保护范围。
27.实施例1
28.1)spycatcher多肽的制备:
29.a.克隆来源于酿脓链球菌streptococcus pyogenes的spycatcher酶基因(genbank:afd50637.1),进一步通过密码子优化后得到编码spycatcher多肽的核苷酸序列,如seq id no.1所示。以该核苷酸序列为模板设计引物并进行pcr扩增反应,其上游引物spycatcher nde i和下游引物spycatcher ecor i的核苷酸序列分别如seq id no.5和seq id no.6所示。pcr反应体系如表1所示:
30.表1以spycatcher多肽的核苷酸序列为模板的pcr反应体系
[0031][0032]
pcr反应条件及过程具体如下:
[0033][0034]
反应结束后,取2μl扩增产物进行琼脂糖凝胶(0.8%)电泳,结果如图1所示。纯化回收约420bp处的pcr产物(目的基因产物)进行测序,测序结果如seq id no.1所示。dna的纯化回收采用omega公司的小量dna纯化回收试剂盒,按照试剂盒操作说明进行纯化回收。
[0035]
b.采用nde i和ecor i两种限制性内切酶对纯化回收的目的基因产物和pet-28a载体进行双酶切,将酶切后的目的基因产物和载体进行连接。
[0036]
目的基因产物的酶切反应体系如表2所示:
[0037]
表2目的基因产物的酶切反应体系
[0038][0039][0040]
pet-28a载体的酶切反应体系如表3所示:
[0041]
表3pet-28a载体的酶切反应体系
[0042][0043]
以上两个酶切反应体系于37℃反应2h,琼脂糖凝胶电泳鉴定酶切产物。酶切产物的纯化回收采用omega公司的胶回收纯化试剂盒,参照试剂盒说明书进行酶切产物的纯化回收。
[0044]
c.将酶切后的目的基因产物与载体进行连接,通过琼脂糖电泳确定酶切后的目的基因产物与载体的相对浓度,调整两者的倍数使载体与目的基因产物在连接反应体系中的摩尔比为1:1~2:1。连接反应体系如表4所示:
[0045]
表4酶切后的目的基因产物与载体的连接体系
[0046][0047]
连接体系于16℃反应6h或过夜,得到连接产物。
[0048]
d.将连接产物转化大肠杆菌jm109,转化后的宿主菌通过抗生素平板进行筛选,对筛选获得的阳性克隆进行测序验证,验证无误的阳性克隆即为表达spycatcher的工程菌株。具体操作为:将连接产物加入到大肠杆菌jm109感受态细胞中,混匀后冰浴30min,42℃热击90s,立即冰浴5min,再加入lb复苏液,于37℃、220r/min振荡复苏培养40~60min,之后4000r/min离心5min;离心得到的菌体用lb培养基悬浮,混合涂布于含有卡那霉素的lb平板上,待菌液充分吸收后,37℃倒置培养12~16h,直至出现单菌落;挑取单菌落进行测序验证,验证无误的阳性转化子即为表达spycatcher的工程菌株。
[0049]
e.将工程菌株于适宜条件下培养至对数期后进行诱导表达,具体操作为:按1%的接种量将工程菌株接种于lb培养基中,于37℃、220rpm振荡发酵培养2.5~3h,当od值达到0.6-0.8后,加入终浓度为0.1mm的iptg,16℃、120rpm诱导表达16~18h。
[0050]
f.离心收集表达后的菌体,将菌体进行细胞破碎处理,之后通过亲和层析制备获
得spycatcher多肽。具体操作包括如下步骤:
[0051]
首先,于4℃,8000rpm离心收集表达后的菌体,用lysis buffer(20mm tirs-hcl、20mm咪唑、500mm nacl,ph7.4)悬浮菌体细胞,混匀后加入200μl溶菌酶、0.3μl 0.1%的tritonx-100以及240μl pmsf,混匀后倒入烧杯中冰浴20min;
[0052]
其次,冰浴后的细胞悬液用超声波细胞破碎仪进行破碎处理,处理时间为20min(超声2.5s,间隔3.0s);
[0053]
最后,将细胞破碎液于4℃、12000r/min离心30min,将上清液加载到经lysis buffer平衡后的镍树脂亲和层析柱(ni-nta superflow)结合1h,使混合的样品流经纯化柱,用wash buffer(20mm tirs-hcl、20mm咪唑、500mm nacl,ph7.4)洗去杂质蛋白,再用elution buffer(20mm tirs-hcl、500mm咪唑、500mm nacl,ph7.4)溶出目的蛋白,然后用ph7.4的pbs将elution buffer透析去除,得到置换后的spycatcher多肽。
[0054]
蛋白浓度由bca蛋白浓度测定试剂盒测定(北京索莱宝,货号:pc0020)。
[0055]
2)snoopcatcher多肽的制备:
[0056]
克隆来源于肺炎链球菌streptococcus pneumoniae的snoopcatcher酶基因(genbank:amd39965.1),进一步通过密码子优化后得到编码snoopcatcher多肽的核苷酸序列,如seq id no.3所示。以该核苷酸序列为模板设计引物并进行pcr扩增反应,其上游引物snoopcatcher nde i和下游引物snoopcatcher ecor i的核苷酸序列分别如seq id no.7和seq id no.8所示。后续的pcr扩增(扩增产物的琼脂糖凝胶电泳结果如图2所示)、扩增产物的纯化回收、产物与载体的酶切、连接、工程菌株的构建、表达直至亲和层析收集snoopcatcher多肽的一系列制备步骤完全参照spycatcher多肽的制备过程。
[0057]
实施例2
[0058]
1)spytag多肽的制备:
[0059]
以d-阿洛酮糖-3-差向异构酶基因(genbank:baw27657.1)为模板,同时参照源于酿脓链球菌streptococcus pyogenes的spytag序列(genbank:wp-_129284416.1)设计引物进行pcr扩增反应,其上游引物spytag nde i和下游引物spytag ecor i的核苷酸序列分别如seq id no.9和seq id no.10所示。pcr反应体系如表5所示:
[0060]
表5以两种核苷酸序列组合为模板的pcr反应体系
[0061][0062]
pcr反应条件及过程具体如下:
[0063]
[0064][0065]
反应结束后,取2μl扩增产物进行琼脂糖凝胶(0.8%)电泳,结果如图3所示(建议增加凝胶电泳图谱,非常重要),纯化回收约1000bp处的pcr产物(目的基因产物)进行测序,测序结果如seq id no.2所示。
[0066]
后续目的基因产物与载体的酶切、连接、工程菌株的构建、表达直至亲和层析收集spytag多肽的一系列制备步骤参照spycatcher多肽的制备过程。
[0067]
2)snooptag多肽的制备:
[0068]
以d-阿洛酮糖-3-差向异构酶基因为模板,同时参照源于肺炎链球菌streptococcus pneumoniae的snooptag序列(genbank:amk38054.1)设计引物进行pcr扩增反应,其上游引物snooptag nde i和下游引物snooptag ecor i的核苷酸序列分别如seq id no.11和seq id no.12所示。pcr反应体系的其余组分及反应条件与spytag多肽制备中的pcr相同。
[0069]
反应结束后,取2μl扩增产物进行琼脂糖凝胶(0.8%)电泳,结果如图4所示,纯化回收约1000bp处的pcr产物(目的基因产物)进行测序,测序结果如seq id no.4所示。
[0070]
后续目的基因产物与载体的酶切、连接、工程菌株的构建、表达直至亲和层析收集snooptag多肽的一系列制备步骤参照spytag多肽的制备过程。
[0071]
实施例3
[0072]
d-阿洛酮糖-3-差向异构酶固定化酶的制备:
[0073]
1)向2mol/l,ph6.4的磷酸钠缓冲液中逐滴加入spycatcher或snoopcatcher,所述spycatcher或snoopcatcher是以纯酶液(酶浓度为5~8mg/ml)的形式加入到反应体系中,滴加过程中对反应容器辅以振荡,之后加入适量环氧树脂,25℃恒温振荡反应12h,反应产物用ph7.4的pbs缓冲液洗涤数次;
[0074]
其中环氧树脂经过如下预处理:将环氧树脂e103(购自天津南开和成科技有限公司)置于磷酸钾缓冲液中,25℃恒温下150rpm振荡1h,振荡处理重复3次,最后用超纯水清洗环氧树脂2次;用于对环氧树脂进行预处理的磷酸钾缓冲液是由0.1mol/l的k2hpo4和0.1mol/l的kh2po4按体积比15~16:1混合配制而成;
[0075]
所述spycatcher或snoopcatcher与所述环氧树脂的加量比例按质量比为:每25mg蛋白对应加入1g环氧树脂。
[0076]
2)将步骤1)获得的反应产物加入3mol/l,ph7.4甘氨酸缓冲液中,25℃恒温振荡反应24h,反应产物用超纯水清洗数次。
[0077]
3)将清洗后的反应产物加入2mol/l,ph7.4的磷酸钠缓冲液中,之后逐滴加入spytag或snooptag,控制滴加量,使体系中反应产物与所述spytag或snooptag的摩尔比为1:1;所述spytag或snooptag是以酶浓度为5~8mg/ml的纯酶液形式加入到反应体系中,滴加完成后于25℃恒温搅拌反应12h,获得d-阿洛酮糖-3-差向异构酶固定化酶。
[0078]
实施例4
[0079]
利用实施例3获得的d-阿洛酮糖-3-差向异构酶固定化酶催化果糖溶液中的d-果糖转化,催化反应的具体步骤如下:
[0080]
1)配制浓度为500g/l的果糖溶液,将固定化酶加入果糖溶液中,于50℃反应1.5h;反应体系中固定化酶的催化剂加量为:每25g d-果糖对应加入0.01g固定化酶。
[0081]
2)反应完成后,用ph7.4的pbs缓冲液洗涤固定化酶,之后将固定化酶置于ph7.4的pbs缓冲液中,4℃保存,以备下一批次反应使用。
[0082]
后续批次的反应均可通过重复上述步骤完成。本实施例总共进行了15批次的催化反应,前10个批次的固定化酶相对活性始终保持在60%以上(图5所示),酶活性稳定,无明显衰减。
[0083]
实施例5
[0084]
利用实施例3获得的d-阿洛酮糖-3-差向异构酶固定化酶催化水果酵素中的d-果糖转化。作为底物的酵素是以木瓜、葡萄、梨经自发酵获得,发酵液的初始ph值为3~5,其果糖含量约为100g/l。
[0085]
催化反应的具体步骤如下:
[0086]
1)向发酵液中加入固定化酶,于60℃反应2.5h;反应体系中固定化酶的加量为:按每200ml发酵液中加入0.01g固定化酶。
[0087]
2)反应完成后,用ph7.4的pbs缓冲液洗涤固定化酶,之后将固定化酶置于ph7.4的pbs缓冲液中,4℃保存,以备下一批次反应使用。
[0088]
后续批次的反应均可通过重复上述步骤完成。本实施例同样进行了15批次的催化反应,前10个批次的固定化酶相对活性始终保持在50%以上(图6所示),酶活性稳定,无明显衰减。
[0089]
实施例6
[0090]
d-阿洛酮糖产物的hplc鉴定:
[0091]
将实施例5催化反应完成后的反应液稀释至合适浓度后加入到液相小瓶中进行定量分析,测定条件如下:
[0092]
色谱仪:agilent1260;
[0093]
检测器:蒸发光散射检测器(alltech chrom,elsd6000)
[0094]
进样:agilent自动进样器;进样量20μl;
[0095]
色谱柱:prevail carbohydrate es column-w(5μm,4.6
×
250mm,agela technologies,china);柱温40℃;
[0096]
流动相:75%乙腈;流速1ml/min。
[0097]
结果如图7所示,获得d-阿洛酮糖产物且产物和底物d-果糖在柱子中被很好地保留和分离。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1